서 론
당뇨병은 일반적으로 제 1형 당뇨병과 제 2형 당뇨병으 로 분류된다. 제 1형 당뇨병은 인슐린 의존형 당뇨병으로 인슐린을 생산하지 못하는 것이 원인이 되어 발생하고, 제 2형 당뇨병은 인슐린이 상대적으로 부족하거나 인슐린 저 항성이 커서 인슐린이 제 기능을 하지 못하여 발생하게 된다(1,2). 2013년 대한민국 사망원인통계에 따르면 당뇨병 에 의한 사망률이 인구 10만명 당 21명으로 사망원인의 5위를 차지하고 있으며 전 국민의 약 10%가 당뇨병 환자로 보고되고 있다(3). 2030년이 되면 당뇨병은 모든 연령층에 서 전 세계 인구의 약 4.4%인 3억 6천명 정도 증가할 것으로 추정된다(4). 현재 사용되는 대부분의 경구용 당뇨병 치료 제는 설폰요소제, 알파-글루코시데이즈 억제제, 메트포민 등으로 혈당 조절에만 초점이 맞춰져 있을 뿐만 아니라 저혈당, 간독성, 체중증가 젖산증 등을 유발하기 때문에 이러한 부작용을 최소화하고 당뇨병을 치료할 수 있는 혈당 강하소재의 개발이 필요하다(5).
버섯은 탄수화물, 단백질, 지질, 무기질, 비타민 등이 풍 부하고 베타글루칸을 포함한 생리활성 물질이 다량 함유되 어 있어 오랫동안 식용 및 약용 소재로 이용되고 있다(6,7). 식용 및 약용 버섯은 항암(8), 콜레스테롤 저하(9), 혈당 강하(10), 감염 예방 효과(11) 등의 효능이 보고되어 다양한 기능성 소재로 활용되고 있다.
최근 대부분의 버섯 종균은 액체배지에서 함유된 영양성 분을 이용한 생물전환을 통해서 다양한 생리활성물질을 포함하는 균사체 배양이 가능하게 되었다(12). 또한 버섯 균사체를 포함한 액체 배양물은 배지의 영양성분 조성과 배양조건에 따른 항암(13) 및 항산화(14) 등의 활성을 가지 는 다양한 대사산물을 얻을 수 있다(15). 액체배양은 작은 공간에서 단기간 대량 생산이 가능하여 경제적이며 자실체 로부터 유용성분을 생산하는 것보다 더 효율적인 생산방법 이라 할 수 있다(16).
Ceriporia lacaerata는 구멍장이버섯목(Polyporales) 유색 고약버섯과(Phanerochaetaceae)의 버섯으로 목재의 셀룰로 오스, 헤미셀룰로오스, 리그닌 등을 분해하는 백색 부후균 이다(17). 백색 부후균에는 일반적으로 잘 알려진 표고버섯 (Lentinus edodes), 새송이버섯(Pleurotus eryngii), 영지버섯 (Ganoderma lucidum) 등이 있으며 이러한 버섯들은 식품과 의약품 소재로 많이 활용되고 있다(18-21). C. lacerata에 관한 연구로는C. lacerata P2 균사체의 크리스탈 바이올렛 제거(22), dimethyl phthalate의 생분해(23)에 관한 연구가 보고 되었고 최근 C, lacerata 액체 배양 균사체 추출물의 제1형 당뇨병 쥐에서의 항당뇨 효과에 관한 연구가 보고되 었다(24). 하지만C. lacerata 균사체 배양물의 제2형 당뇨에 서의 효과와 그 기전에 관한 연구는 아직 보고되지 않았다. 이에 본 연구에서는C. lacerata 균사체 배양물의 혈당 강하 활성을 평가하기 위하여C. lacerata 균사체 배양물을 농축 건조하여 인슐린종 세포주인 INS-1 세포에 노출시켜 세포 사멸 억제 효과를 평가하고, 3T3-L1 세포에서 GLUT4 발현 을 측정하였으며 정상 마우스와 유전적으로 당뇨병을 가지 고 있는 마우스에서 혈당, 인슐린, C-peptide, 장기 무게 등 을 비교 분석하였다.
재료 및 방법
본 실험에 사용한 균주는 ㈜월드바이오텍(World Biotech Co., LTD., Sangju, Korea)에서 보유한C. lacerata 균사체로, potato dextrose agar(PDA, Difco. Co., Maryland, USA) 배지 에 접종하여 25°C에서 9일 동안 배양하여 사용하였다. RPMI-1640 medium, Dulbeco’s modified Eagle’s medium (DMEM), fetal bovine serum(FBS), bovine calf serum(BCS), bovine serum albumin(BSA), penicillin/streptomycin은 WelGENE 사(WELGENE Inc., Daegu, Korea)로부터 구입 하여 사용하였고, High Capacity cDNA Reverse Transcription Kit는 Bioneer 사(Bioneer, Inc., CA, USA)로부터 구입하여 사용하였으며 그 외의 시약과 덱사메타손(Dex), 3-isobutyl- 1-methylxanthine(IBMX)은 Sigma 사(St. Luis, MO, USA)에 서 구입하여 사용하였다.
PDA 배지에서 배양된C. lacerata 종균을 지름 20 mm로 절개하여 potato dextrose broth(PDB, Difco Co., Maryland, USA) 배양액 50 mL에 넣어 homogenizer(10,000×g, 3분)로 균질화한 후 4 L 액체 배지에 접종하였다. C. lacerata 균사 체를 액체 배양하기 위한 배지의 조성으로 glucose 20 g/L, peptone 2 g/L, yeast extract 2 g/L, K2HPO4 1 g/L, KH2PO4 0.5 g/L, MgSO4 0.5 g/L를 혼합하여 5 L jar fermentor (Fermentec Co., Ltd., Cheongwon, Korea)에서 pH 5, 온도 25°C, 회전 속도 300×g으로 9일 동안 배양하였다. 9일 동안 배양한C. lacerata 균사체 배양물을 농축 건조(CL01)하였 을 때 기능성과 관련하여 현재 후보물질로 고려중인 세포외 다당체(exopolysaccharide) 함량이 건조 중량 대비 4.21± 0.32%(w/w) 수준이었다. 건조중량을 기준으로 각 실험군의 용량에 맞게 혈당 강하 활성을 평가하였다.
Rat 췌장 베타세포주인 INS-1 세포를 10% FBS, 100 U/mL penicillin, 100 μg/mL streptomycin, 50 μM 2-mercaptoethanol 이 첨가된 RPMI-1640 배지에서 37°C, 5% CO2 조건의 세포 배양기에서 배양하였다. 세포 수 산정 실험을 위해 INS-1 세포를 24-well plate에 1×105 cells/500 μL/well로 분주한 다음 18시간 배양 후 이들 세포에 덱사메타손(100 nM) 단 독, 덱사메타손(100 nM)+CL01(50 μg/mL), 덱사메타손(100 nM)+CL01(100 μg/mL)을 24시간 처리하였다. 세포를 phosphate buffered saline(PBS)로 세척 후 0.25% trypsin EDTA를 첨가하여 plate에서 세포를 탈착시켜 회수 한 다음 1,000 rpm, 3분간 원심분리 하였다. 다음 상층액을 제거 후 남은 세포 pellet에 500 μL의 PBS를 넣어 세포현탁액을 만들었다. 10 μL의 세포현탁액에 10 μL의 trypan blue day를 혼합하여 이 중 10 μL 혼합액을 hemocytometer에 위치한 다음 현미경으로 세포를 계수하였다. 이때 각 실험 군은 triplicate 상태로 3 회 실시하였다.
INS-1 세포(1.0×106 cells/4 mL cell culture plate)에 덱사메 타손(100 nM), CL01(50 μg/mL), 덱사메타손(100 nM)+ CL01(50 μg/mL)을 24시간 처리하였다. 세포를 PBS로 세척 후 0.25% trypsin EDTA를 첨가하여 plate에서 세포를 탈착 시켜 회수 한 다음 1,000 rpm, 3분간 원심분리시켰다. 이후 상층액을 버린 다음 세포 pellet에 buffer[5 mM Tris-Cl(pH 7.4), 20 mM EDTA, 0.5% Triton X-100]를 가해 얼음 위에서 30분간 용해시켰다. 용해된 시료를 회수 후 13,000 rpm, 20분간, 4°C에서 원심 분리한 다음 상층액을 취했다. 상층액 에 동일한 양의 phenol-chloroform-isoamyl alcohol 혼합물 (25 : 24 : 1)을 첨가하여 실온에서 13,000 rpm, 10분간 원심 분리하여 상층액을 취하였다. 다시 상층액에 동일한 양의 chloroform-isoamyl alcohol(24 : 1) 혼합액을 넣고 실온에서 13,000 rpm, 10분간 원심 분리하여 상층액을 취하였다. 이 후 상층액에 1/10 용량의 3 M sodium acetate와 2 배 용량의 100% 알코올을 넣고 -70°C에서 1 시간 정치하였다. 이후 13,000 rpm, 20 분간, 4°C에서 원심 분리하여 상층액은 버리 고 pellet을 건조 후 Tris-EDTA buffer와 RNase를 넣어 30분 간, 37°C에서 반응시켰다. 이후 DNA 시료를 1.8% agarose gel에서 전기 영동한 다음 DNA를 ethidium bromide(0.1 μ g/mL)로 염색하여 UV 조명에서 촬영하였다.
마우스 지방세포 3T3-L1 세포주는 American type culture collection(ATCC, Manasas, VA, USA)에서 구입하여 사용 하였다, 세포는 10% BCS, 1% P/S을 포함한 DMEM 배지에 서 37°C, 5% CO2 조건의 세포 배양기에서 배양시킨 후 배양액에 분화유도 배양액(0.5 mM IBMX, 1 μM Dex, 10 μg/mL 인슐린/10% FBS)으로 바꾸어 2일간 배양하였다. 2 일 후 5 μg/mL 인슐린/10% FBS를 포함한 DMEM 배지로 교환하여 배양하며 이틀에 한 번씩 배양액을 교환하였다. 8~10일 배양하여 지방세포의 표현형이 90%이상 발현된 후 실험을 수행하였다. 인슐린 저항성을 유도하기 위하여 세포를 36시간 동안 10% FBS를 포함한 low-glucose DMEM(5.5 mM glucose) 배지에서 배양한 후 대조군은 1% FBS, 1% BSA를 첨가하고 인슐린을 넣지 않은 low-glucose DMEM(5.5 mM glucose) 배지에서 3시간 동안 배양하였고, 실험군은 대조군과 같은 조건에서 CL01을 농도별(0, 10, 100, 1000 μg/mL)로 3시간 동안 처리하고, 인슐린 100 nM를 첨가하여 30분 동안 배양하였다. 총 RNA는 Trizol system(Molecular research center, Inc., OH, USA)으로 분리 하여 nanodrop 1000(Thermo Fisher Scientific Inc.)(260 nm/280 nm)로 RNA의 순도를 측정하였고, 총 RNA 시료 2 μg을 High Capacity cDNA Reverse Transcription Kit를 사용하여 42°C에서 1시간, 99°C에서 5분 동안 반응시켜 cDNA를 합성하였다. GLUT 4 mRNA 발현량을 측정하기 위하여 합성된 cDNA로 RT-PCR을 실시하였다. 5 ‘ - C T G T A A C T T C A T T G T C G G C A T G G - 3 ’ , 5 ’ - A G G C A G C T G A G A T C T G G T C A A A C - 3 ’ primer(GLUT4)와 100 μM SYBR® premix ExTaq (Takara Biotechnology Co., Ltd., Tokyo, Japan)를 첨가하여 형광 유 전자 증폭기(Thermal Cycler Dice Real Time System, Takara Biotechnology Co., Ltd., Tokyo, Japan)로 PCR을 수행하였다.
실험동물은 7주령의 수컷 ICR(KOATECH, Pyeongtaek, Korea)를 구입하여 5일간 순화시킨 뒤 실험에 사용하였다. 동물은 온도 23±2°C, 상대습도 50±15% 및 12시간 명암주기 로 조절되는 환경에서 사육하였다. 실험동물은 케이지 당 3마리 이하로 배치하여 사육하였으며, 실험기간 동안 사료 는 Certified irradiated global 18% protein rodent diet(2918C, Harlan Laboratories Inc., USA)를 자유 급이하였고, 음수는 여과된 살균정제수를 자유롭게 섭취시켰다. 각 실험군당 10마리씩 절식 혈당을 측정하여 각 군의 평균 혈당이 균등 하게 무작위 배치하였다. 실험군은 정상대조군(멸균주사 용수(Daihan Pharm Co., Ltd., Seoul, Korea))(N1), 음성대조 군(N2), CL01 250 mg/kg 섭취군(N3), CL01 500 mg/kg 섭취 군(N4), CL01 1000 mg/kg 섭취군(N5), 양성대조군(메트포 민(Diabex Tab. 1000 mg, Daewoong Co., Ltd., Seongnam, Korea) 400 mg/kg)(N6)으로 구성하였다. CL01 섭취군은 CL01을 각 농도 별로 멸균주사용수(Daihan Pharm Co., Ltd., Seoul, Korea)에 녹여 경구 섭취용 존데와 주사기를 이용하 여 10 mL/kg를 경구 투여하였고, 음성대조군과 양성대조군 은 각각 동일한 용량의 멸균주사용수와 멸균주사용수에 녹인 메트포민을 경구 투여하였다. 동물실험은 경기바이오 센터 동물실험윤리위원회(Institutional Animal Care and Use Committee, IACUC)(2013-01-0009)의 승인 하에 수행 하였다.
정상 동물을 4시간 절식시킨 후 체중 및 혈당을 측정하여 0분으로 하고, 각 실험군 별로 CL01 및 멸균주사용수를 경구 투여하였다. 60분 후에 정상대조군을 제외한 실험군 에 glucose 2 g/10 mL/kg로 경구 투여한 후 각각 30, 60, 90, 120, 240분 후에 미정맥에서 혈액을 채취하여 glucometer (G-Doctor, AllMedicus Co., Ltd., Anyang, Korea)로 혈당을 측정하였다.
실험동물은 6주령의 수컷 normal mouse(C57BLKS/J-m/m) 와 db/db mouse(C57BLKS/J-db/db)(Japan SLC Inc., Shizuoka, Japan)를 구입하여 7일간 순화시킨 뒤 실험에 사 용하였다. 케이지당 1마리씩 배치하여 온도 23±2°C, 상대습 도 60±5% 및 12시간 명암주기로 조절되는 환경에서 사육 하였다. 실험기간 동안 사료는 LabDiet 5L79(PMI Nutrition International LLC, St. Louis, MO, USA)를 자유 급이하였고, 음수는 여과된 살균정제수를 자유롭게 섭취시켰다. 각 실 험군당 실험동물을 6마리씩 무작위 배치하였다. 실험군은 정상대조군(normal mouse)(G1), 음성대조군(db/db mouse)(G2), 양성대조군(메트포민 300 mg/kg)(G3), CL01 300 mg/kg 섭 취군(G4)으로 구성하였다. CL01 섭취군과 양성대조군은 각각 멸균증류수에 녹인 CL01과 메트포민을 매일 일정한 시간에 6주간 경구 투여하였고, 정상대조군과 음성대조군 은 각각 동일한 용량의 멸균증류수를 동일한 기간 동안 경구 투여하였다. 격일로 사료 섭취량, 물 섭취량을 측정하 였고, 주 1회 체중 및 혈당을 측정하였다. 혈당은 미정맥에 서 혈액을 채취하여 glucometer(ACCU-CHEK Sensor, Roche Diagnostics GmbH, Basel, Switzerland)로 측정하였다. 모든 동물실험은 계명대학교 Committee for Laboratory Animal Care and Use(KM-2012-10)의 승인 하에 수행하였다.
시험 6주 후 실험동물을 12시간 절식시킨 후 혈당을 측정 하여 0분으로 하고, glucose 1 g/10 mL/kg로 경구 투여한 후 각각 30, 60, 90, 120, 180분 후에 미정맥에서 혈액을 채취하여 혈당을 측정하였다.
실험 종료 후, 실험동물을 12시간 절식시키고 ether로 마취하여 개복한 후 심장에서 혈액을 채취한다. 채취한 혈 액을 원심분리(3,000×g, 10 min)하여 혈청을 제거하고 추후 의 분석을 위해 –70°C에서 보관하였다. 혈장 내 혈당은 autoanalyzer Konelab 20XT kit(Thermo Fisher Scientific, Bremen, Germany)를 이용하여 측정하고, 인슐린, C-peptide 의 농도는 mouse ELISA assay kit(Shibayagi, Co., Ltd., Gunma, Japan)를 이용하여 측정하였다. 희생 즉시 모든 동 물의 간, 신장, 비장, 신장지방, 복부지방을 분리 적출하여 생리식염수로 세척한 후 거즈로 수분을 제거하였고 각각의 무게를 측정하여 체중 당 장기무게로 나타내었다.
결과 및 고찰
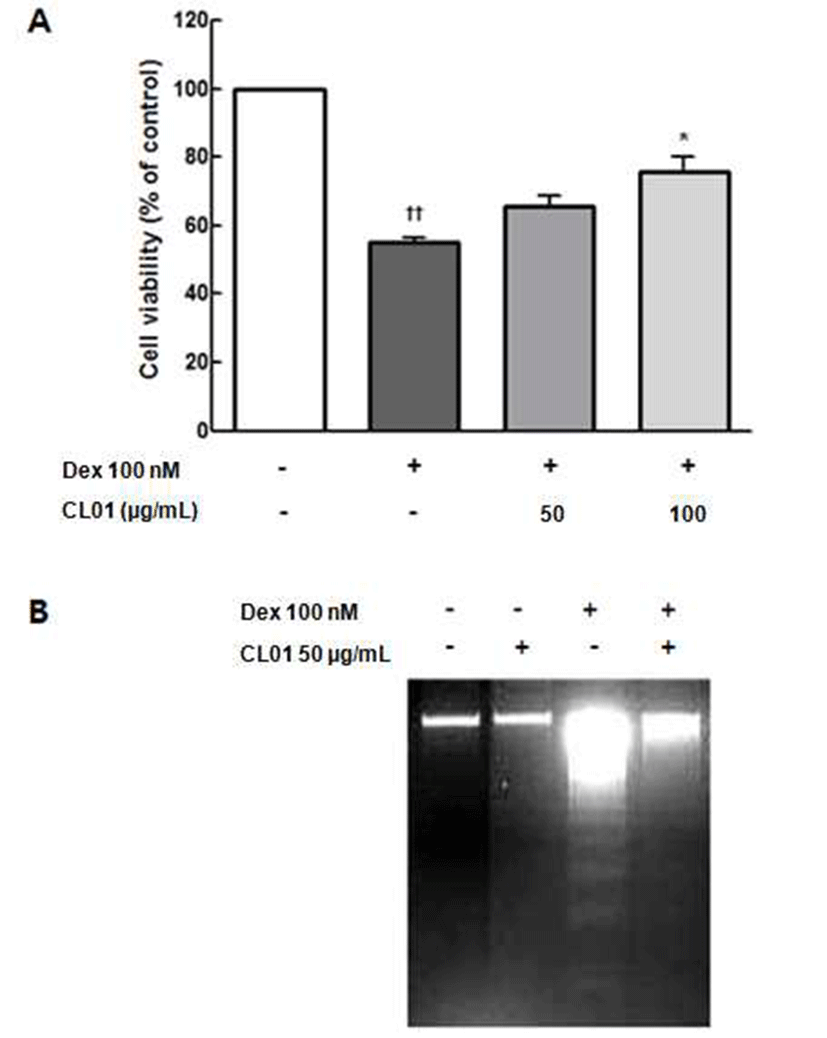
인슐린 분비 세포의 세포 사멸을 유도하여 당뇨병을 유 발시키는 약물로 알려진 덱사메타손(25)와 CL01을 처리하 여 세포 생존율을 확인한 결과는 Fig. 1A와 같다. 시료를 첨가하지 않은 그룹을 100%로 보았을 때 덱사메타손을 처리한 그룹에서 세포 생존율이 약 45% 감소하였고, 덱사 메타손을 처리한 그룹에 비해 덱사메타손과 함께 CL01 50 μg/mL을 처리한 그룹은 세포 생존율이 약 10% 증가하였고 CL01을 100 μg/mL 처리한 그룹은 약 20%가 증가하여 유의 적인 차이를 보였다(p<0.05). DNA 분절화는 세포 사멸의 중요한 생화학적, 형태학적 특징의 하나이다(26,27). 이에 CL01이 덱사메타손 유도 세포사에 대한 억제 효과를 알아 보고자 DNA 분절화 실험을 실시하였다(Fig. 1B), 시약을 첨가하지 않은 대조군(lane1)과 비교하여 덱사메타손을 처 리한 군(lane3)에서 DNA 분절화 현상이 있어났으나, 덱사 메타손과 CL01을 함께 처리한 군(lane4)에서는 DNA 분절 화 현상이 보이지 않았다. 이 연구 결과는 CL01이 INS-1 세포의 DNA 분절화를 억제하여 덱사메타손에 의한 세포 사를 차단하는 INS-1 세포 보호 효과를 가지고 있음을 제시 한다.
덱사메타손 등에 의한 베타세포사멸유도 기전은 거시적 으로는 소포체의 과잉 활성화와 그로인한 인슐린 과잉 합성 및 산화 스트레스 발생으로 인해 베타세포의 사멸로 이어지 는 것으로 최근 밝혀진 바 있으며(28) 이와 관련해서 유관 연구 결과 등을 종합할 때 베타세포 사멸방지 신호전달 과정에 관여하는 단백질(PI3K-Akt)의 활성화를 통해 세포 사멸 방지가 될 것으로 예측하고 있다(29).
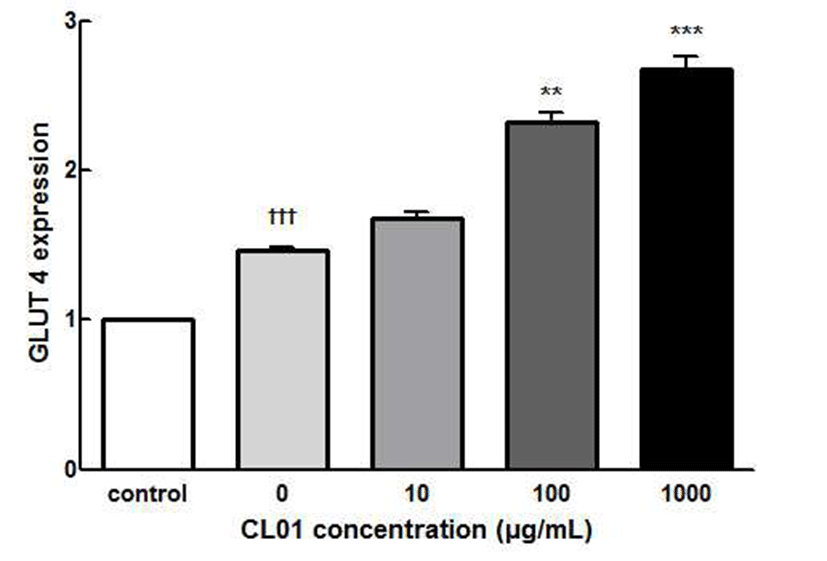
본 시험의 동물모델이 제2형 당뇨동물모델임을 감안하 면 제2형 당뇨의 주요 원인인 인슐린저항성과 관련한 주요 지표인 당수송체 GLUT4의 발현 정도는 중요한 의미를 가 지므로 CL01 처리에 따른 당수송체 GLUT4의 발현 변화를 3T3-L1 지방세포에서 확인하는 in vitro 시험을 통해 in vivo 시험과의 연관성을 설명하고자 하였다. CL01이 3T3-L1 세 포에서 GLUT4 유전자 변화에 미치는 영향을 측정한 결과 는 Fig. 2에 나타냈다. GLUT4의 mRNA 발현을 확인한 결 과, CL01 처리 농도에 의존적으로 유전자 발현이 증가하였 으며 CL01을 1000 μg/mL 처리하였을 때, 처리하지 않을 때에 비하여 약 186% 증가하였다. GLUT4는 혈중 포도당을 인슐린 신호에 의해 세포 내로 유입시키는 역할을 하며 이러한 GLUT4의 발현이 증가하면 혈중 당 유입량이 증가 되어 혈당이 저하될 수 있다(30). 이 실험 결과 CL01이 GLUT4의 유전자 발현을 증가시켜 혈당은 낮추는 역할을 하는 것으로 사료된다.
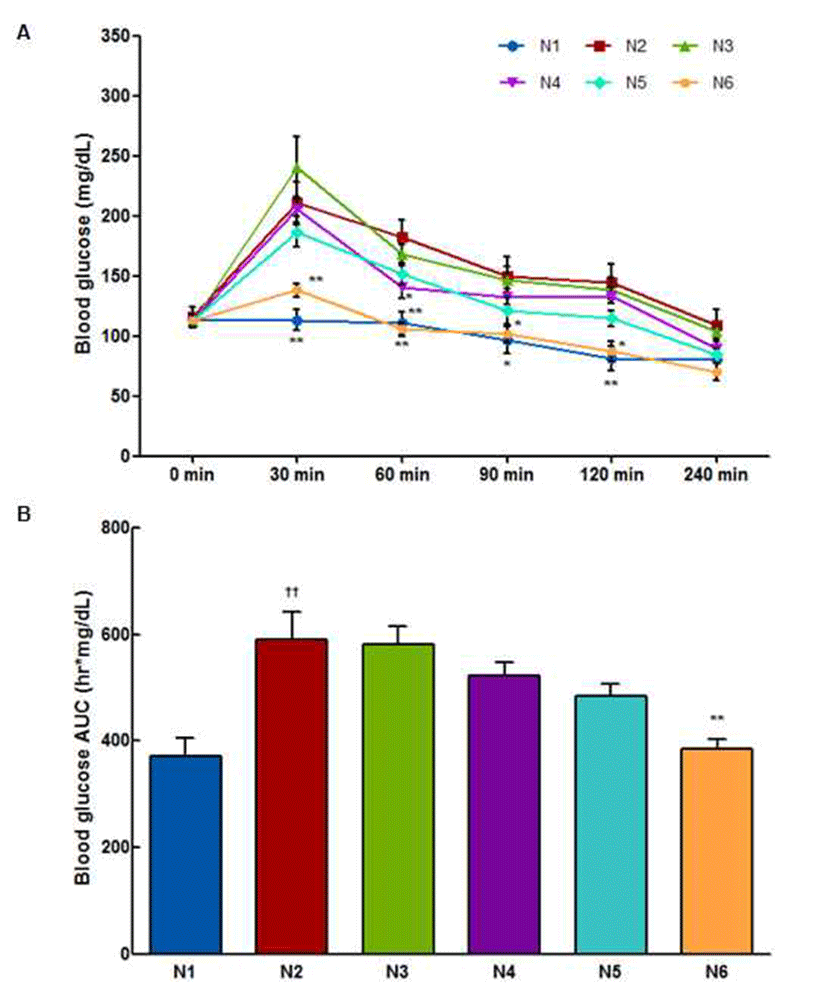
정상동물에서 경구 당 부하 시험에 따른 혈당의 변화는 Fig. 3에 나타냈다. Glucose를 섭취한 모든 군(N2~N6)에서 섭취 30분 후 혈당이 상승하였고, 시간이 지남에 따라 혈당 이 감소하는 양상을 보였다. 음성대조군은 정상대조군에 비해 30, 60, 90, 120분에 유의적인 혈당 증가를 보였다 (p<0.05, 0.01). CL01 250 mg/kg 섭취군에서는 음성대조군 과 유의적 차이를 나타내지 않았고, CL01 500 mg/kg 섭취군 에서 60분에 유의적으로 혈당이 감소하였다(p<0.05). CL01 1000 mg/kg 섭취군에서는 glucose 섭취 후 혈당을 측정하는 모든 시간에 음성대조군과 비교하여 약 10~20% 혈당 감소 경향을 보였고, 시험 종료 시 음성대조군 (80.3±29.1 mg/dL)과 유사한 수준(84.8±15.1 mg/dL)으로 혈 당이 감소되었다. 시험 종료 후 CL01을 섭취한 모든 군에서 음성대조군에 비해 혈당이 낮아졌으며, 부검하여 장기를 관찰한 결과 육안적 이상이 관찰되지 않았다(data not shown). 본 실험은 정상동물에서의 유효농도 설정 용도로 진행된 것으로 정상동물에서 혈당강하효과 실험 시 1,000 mg/kg까지 독성이 없었으나, 500 mg/kg에서도 경구내당능 이 개선되는 효과가 나타나 제 2형 당뇨병 동물에서의 실험 농도는 300 mg/kg 이하로 설정하여 실험하였다.
각 실험군의 체중은 Table 1에 나타냈다. 체중 측정 결과, 모든 실험군에서 유의적인 변화가 관찰되지 않았으며 실험 기간 내내 체중이 증가하는 경향을 보였고 CL01 섭취군에 서 음성대조군보다 체중이 약 7%정도 적게 측정되었다. 사료 및 물 섭취량 측정 결과(Table 2, Table 3)를 보면 정상 대조군에 비하여 음성대조군 및 CL01 섭취군에서의 사료 및 물 섭취량이 많았으나 음성대조군과 CL01 섭취군을 비 교하였을 때 CL01 섭취군에서 사료 섭취량이 약 15%, 물 섭취량이 약 9%정도 감소한 것을 알 수 있다. 이것을 통해 CL01이 당뇨의 일반 증상인 비만, 다식, 다음 등을 개선할 수 있을 것으로 사료된다(31).
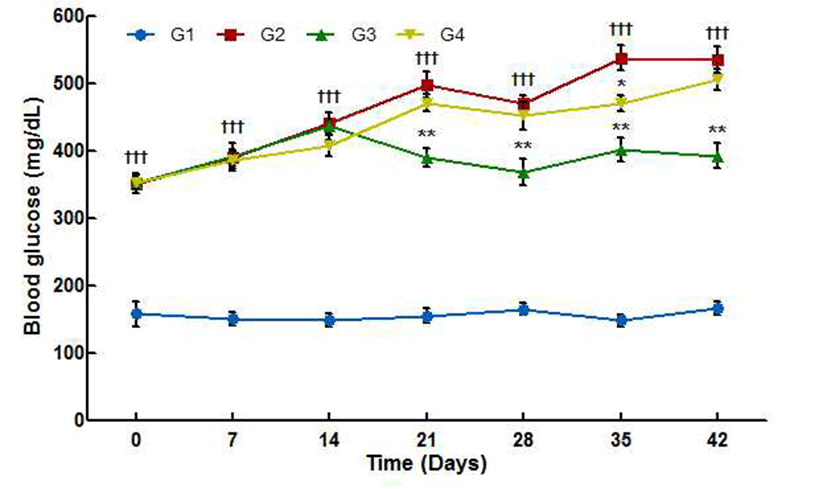
실험 기간 동안의 혈당 변화는 Fig. 4에 나타냈다. 실험 초기 db/db 마우스를 이용한 그룹의 혈당은 350 mg/dL 전후 로 비슷한 수준을 나타냈으나 음성대조군은 정상대조군과 유의적인 차이(p<0.001)를 보이며 실험 기간 동안 지속적으 로 증가하였고 종료 시점에는 약 535 mg/dL로 측정되었다. 양성대조군은 실험 2주까지는 음성대조군과 유사하게 혈 당이 증가하였으나 3주부터는 음성대조군과 유의적인 차 이(p<0.01)로 혈당이 감소하여 실험 종료 시점에 혈당이 약 390 mg/dL로 실험 초기 혈당과 유사하게 측정되었다. CL01 섭취군은 2주까지는 양성대조군보다 혈당 증가폭이 작지만 3주부터 혈당이 증가하였으며 실험 5주 후 음성대 조군과 유의적 차이(p<0.05)를 보이는 약 470 mg/dL를 나타 내었고 6주 후 혈당이 약 506 mg/dL를 나타냈다.
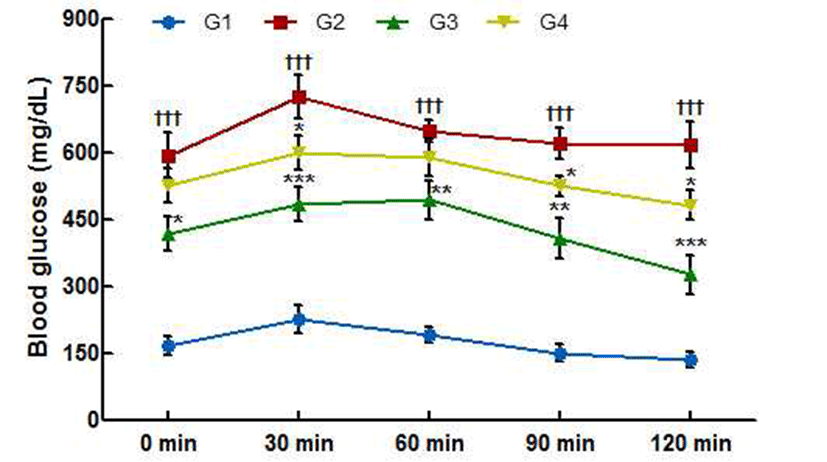
제 2형 당뇨병 동물에서 실험 물질 섭취 6주 후 경구 당 부하 시험에 따른 혈당의 변화는 Fig. 5에 나타냈다. 모든 그룹에서 포도당 섭취 30분 후 혈당이 증가였고, 60분 이후 혈당이 점차적으로 감소하였다. 포도당 섭취 30, 90, 120분 후 CL01 섭취군에서 음성대조군과 유의적 차이 (p<0.05)를 보였고 120분 후에 CL01 섭취군에서 음성대조 군에 비해 혈당이 약 15%정도 감소한 것을 알 수 있었다.
이 실험을 통해 CL01이 혈당을 낮춰주며 내당능을 증가시 킨다는 것을 알 수 있는데 이는 당뇨 합병증을 치료하고 있는 환자가 혈당을 정상 혈당에 가깝게 유지하는 것이 중요하다는 연구결과(32,33)에 따라 당뇨 합병증을 완화하 는데 긍정적인 효과를 보일 것으로 사료된다.
실험 물질 섭취 6주 후 동물을 희생하여 혈장 내 혈당, 인슐린, C-peptide 농도를 측정하였다(Table 4). 혈장 내 혈 당 측정 결과, 음성대조군에서의 혈당이 약 855 mg/dL로 증가하였고, 반면에 CL01 섭취군에서는 약 664 mg/dL로 음성대조군과 유의적 차이를 보였다(p<0.01). 혈장 내 인슐 린 농도와 C-peptide 농도의 측정 결과, 음성대조군에서 혈 장 내 인슐린 농도가 정상대조군과 비교하여 유의적인 수치 (p<0.001)로 증가하였고 CL01 섭취군에서는 음성대조군과 비교하여 약 36% 증가한 13.73±0.95 ng/L였다. 혈장 내 C-peptide 농도는 양성대조군과 CL01 섭취군에서는 음성 대조군에 비하여 증가하였으나 CL01 섭취군에서 양성대조 군에 비해 약 18%정도 낮은 140.45±14.01 pg/dL의 농도를 나타냈다. 혈장 내 인슐린과 C-peptide 농도는 인슐린 분비 의 지표임과 동시에 인슐린과 C-peptide는 proinsulin의 구 성 요소이기도 하다. proinsulin이 분해되는 경우 인슐린은 혈중 안정성이 낮은 반면 C-peptide는 혈중 안정성이 높아 장시간에 걸친 인슐린 분비능을 확인하는 지표로 활용가능 하다(34). 제 2형 당뇨병 환자의 90% 이상에서 인슐린 저항 성이 생겨 고인슐린혈증이 유발된다(35). Kim 등(36)의 연 구에 따르면 당내성 장애, 당뇨병, 고혈압, 비만 등의 인슐린 저항성 증후군 유병률이 인슐린의 농도가 증가할수록 증가 하며 인슐린 농도가 낮은 경우보다 대사 이상이 생길 경우 가 증가함을 알 수 있다. 본 연구에서는 CL01 섭취 후 혈중 인슐린 농도가 증가하여 인슐린 저항성을 개선하는 것은 아니며, 혈당이 감소하는 것은 인슐린 분비를 촉진하기 때 문으로 추측할 수 있다.
혈액학적 지표 분석을 위한 채혈 후 개복하여 간, 신장, 비장, 신장지방, 복부지방의 무게를 측정하여 Table 5에 나타냈으며 장기를 관찰한 결과 육안적 이상 소견이 관찰되 지 않았다(data not shown). 음성대조군은 측정한 간, 신장, 신장지방, 복부지방의 무게가 정상대조군과 비교하여 유의 적으로 증가하였고(p<0.01, 0.001) 비장의 무게는 유의적 차이가 없었다. CL01 섭취군에서 간과 신장의 무게가 유의 적이지는 않으나 음성대조군과 비교하여 감소하였고 복부 지방의 무게는 증가하였다. 반면 신장 지방의 무게는 음성 대조군과 비교하여 약 45% 감소하였다(p<0.05). Kunar 등 (37)에 의하면 db/db 마우스 16~20주령에 신장 지방이 유의 적으로 증가한다고 알려져 있다. 또한 본 연구에 사용된 db/db 마우스는 제 2형 당뇨병 모델일 뿐 아니라 렙틴에 대한 저항성이 발생하여 식욕 조절이 어려워 결과적으로 비만을 초래한다고 알려져 있다(38). 이 연구를 통하여 CL01의 섭취가 제 2형 당뇨병으로 인한 신장 지방의 축적 을 억제할 수 있을 것으로 사료된다.
요 약
세리포리아 락세라타 균사체 배양물(CL01)의 혈당 강하 효과를 확인하기 위해 in-vitro 및 in-vivo 시험을 수행하였 다. CL01이 INS-1 세포에서 덱사메타손에 의한 세포 사멸 방지 효과를 나타냈으며 3T3-L1 세포에서는 당수송체인 GLUT4의 발현을 증가시켰다. 제 2형 당뇨 마우스를 4 그룹 (normal control (G1), negative control (G2), positive control (G3), CL01 250 mg/kg (G4))으로 나누어 6주간 매일 CL01 을 투여한 후 혈중 지표를 확인한 결과, CL01 섭취군은 체중, 사료 및 물 섭취량에서 음성대조군 대비 유의적인 차이를 보이지 않았다. 투여 5주 후 CL01 섭취군의 혈당이 음성대조군 대비 유의적인 감소를 보였으며 6주 경과 시 혈중 인슐린은 36% 증가하였고 혈중 C-peptide 농도는 18% 감소하였다. 경구 당 부하 시험 결과 CL01 섭취군의 혈당이 음성대조군 대비 15% 감소하였다. 이상의 결과를 통해 CL01이 베타 세포를 증식시켜 인슐린 분비를 촉진하고 혈 당을 낮추는 효과가 있음을 알 수 있다.










