서 론
포도주는 2011년 현재 세계 79개국에서 연간 약 2,600만 톤이 생산되어 약 1,900억 달러의 시장을 형성하고 있으며 세계 포도 생산량의 약 66.0%가 포도주로 가공되고 있다 (1,2). IWSR(International Wine & Spirit Research) 2010의 보고에 따르면 2008년 세계적으로 약 310억병의 포도주가 소비되었으며 향후 소비량이 증가할 뿐 아니라 고급 포도주 의 소비 증가로 인하여 판매액은 더욱 크게 증가할 것으로 예상하고 있다(3). 우리나라의 포도주 수입액은 2008년 현 재 약 1,700억원에 달하고 있으며 향후 계속 증가할 것으로 전망되고 있으나 복분자주를 포함한 국산 과실주 시장의 규모는 2012년 현재 출고가 기준으로 연간 약 870억원으로 서 전체 주류시장의 약 1.16%를 차지하고 있을 뿐이다(3,4). 국산 포도주에 대한 소비자의 선호분석 결과에 따르면 전체 응답자의 오직 21.7%가 국산 포도주를 선호하였으며 44.4%가 수입 포도주를 선호한다고 응답한 바 있다(5).
일반적으로 포도주의 품질은 원료 포도의 품질, 포도주 효모 및 양조기술 등에 의해 영향을 받는다. 특히 원료 포도 의 품질은 포도주의 주질에 매우 큰 영향을 미치게 되어 세계적으로 유명한 포도주들은 유럽종(Vitis vinifera) 포도 에 속하는 양조용 포도 품종인 까베르네쇼비뇽, 메를로, 피노누아, 샤르도네 등을 원료로 제조되고 있다(1). 그러나 우리나라의 포도주는 대부분이 주 품종인Vitis labruscana 에 속하는 캠벨얼리 포도를 사용하여 제조되고 있으며 캠벨 얼리 포도는 생과용으로 적합한 품종으로서 우리나라 전체 포도 재배면적의 69.9%인 7,902.5 ha에서 재배되고 있다 (6,7). 또한 포도는 발효성 당의 함량이 풍부하여 토착형 효모에 의한 자연발효로 쉽게 포도주로 발효되기도 하지만 배양효모를 접종하여 발효를 유도하는 것이 포도주의 품질 에 좋은 영향을 미치기 때문에 포도주 선진국들은 우수한 포도주 효모를 개발하여왔다(8,9). 특히 포도주의 발효에 주로 관여하는 효모는 Saccharomyces cerevisiae로서 이 효 모는 당을 분해하여 알코올을 생산할 뿐 아니라 다양한 향미물질을 만들어 냄으로서 포도주의 품질에 결정적인 영향을 미치게 된다(10-13). 현재 유럽을 중심으로 제조하 고자 하는 포도주의 타입에 따라 또는 원료 포도의 품종에 따라 포도주의 향과 맛에 적합한 효모들이 개량되었으며 S. cerevisiae Fermivin, EC-1118, OC2, W-3 등 약 150주 이상의 우량 포도주 효모 균주가 산업화되어 시판되고 있다 (8,9). 따라서 국산 포도주의 품질을 개선하기 위하여 우리 나라 기후와 토양에 알맞은 양조용 포도 품종을 개량하는 한편 그 품종에 알맞은 포도주 효모의 개발 등 다양한 연구 가 필요하나 현재까지 체계적이고 조직적인 연구가 진행되 지 못하였다.
본 연구진은 국산 포도의 발효에 적합한 포도주 효모를 개발하기 위한 일환으로 국산 포도의 자연발효 중 효모의 변화 등을 조사하고 미생물의 천이현상이 일어나는 단계의 발효액으로부터 토착형S. cerevisiae S13과 D8 효모를 분리 한 바 있다. 이 두 균주는 모두 아황산 및 고농도의 당에 대해 저항성을 가지고 있으며 캠벨얼리 포도주에 있어서 S13은 향과 색, D8은 색에 있어서 대조균주인 W-3보다 우수한 결과를 나타내었다(14). 본 연구에서는 이들 토착형 효모를 스타터로 이용하여 우리나라 포도 품종 중 가장 포도주 양조적성이 우수한 것으로 알려진(15) Muscat Bailey A(MBA) 포도를 발효하면서 발효 특성을 조사하는 한편 포도주의 주질 특성을 조사하였다.
재료 및 방법
포도주 발효에 사용한 원료 포도는 2012년 9월에 경북 영천에서 수확한 MBA 포도 상품을 구입하여 -20°C에서 냉동 보관하면서 사용하였다. 본 실험에 사용한 균주로는 경북대학교 식품공학부 미생물공학실에 보관중인 S. cerevisiae S13, D8 및 W-3를 사용하였다(14). 대조균으로 사용한 W-3 균주는 시판 산업용 포도주 효모 중 무가당 포도주의 제조에 적합한 것으로 알려져 있다(15). 효모의 배양을 위하여 YPD 배지(2.0% glucose, 1.0% yeast extract, 2.0% bactopeptone)(Difco, Detroit, MI, USA)를 사용하여 30°C에서 정지기까지 진탕배양 하였다. 효모 균주는 YPD 배지에서 48시간 배양하여 얻은 배양액과 30%(w/v) 글리 세롤 용액을 1:1로 혼합하여 –70°C에 보관하면서 사용하 였다.
제경 및 파쇄한 MBA 포도 5 kg을 10 L 발효 용기에 첨가한 다음 설탕을 가하여 당도를 24 °Brix로 조정하였다. 여기에 포도주 발효에 유해한 미생물의 오염과 생육을 방지 하기 위하여 potassium metabisulfite의 최종농도가 200 mg/L이 되도록 첨가한 후 총 담금액 용량에 대하여 5%(v/v) 용량의 YPD 배지에서 배양하여 얻은 효모 균체를 접종하 여 알코올 발효를 수행하였다. 발효실의 온도를 20°C로 유 지하여 발효를 진행시키면서 이산화탄소의 발생이 현저히 줄고 알코올 농도가 최대치에 도달하여 더 이상 알코올 농도가 증가하지 않을 때 발효를 종료하였다. 발효가 끝난 발효액은 원심분리기(Supra 22K, Hanil Science Industrial Co., Incheon, Korea)를 사용하여 10,000×g로 10분간 원심분 리한 후 침전물을 제거하고 포도주를 제조하였다.
포도주의 가용성 고형분의 농도는 포도주 발효액을 원심 분리(10,000×g, 10 min)하여 얻은 상징액을 당도계(RA250, ATAGO, Tokyo, Japan)를 사용하여 측정하였다. 알코올의 증류는 상징액 100 mL와 증류수 20 mL로 용기를 세척하여 첨가한 것을 증류하여 80 mL의 증류액을 얻었다. 여기에 증류수를 첨가하여 100 mL로 정용한 액의 알코올 농도를 주정계로 측정한 후 Gay Lussac 표를 이용해 15°C로 온도 보정하여 환산하였다(16,17). 환원당 함량의 측정은 DNS(dinitrosalicylic acid) 법(18)에 따라 측정하였다. 즉 시 료 1.0 mL에 DNS 시약 3.0 mL를 첨가하여 95°C에서 5분간 반응시킨 다음 증류수를 21 mL를 첨가한 후 분광광도계 (UV-1601, Shimazdu Co., Kyoto, Japan)를 사용하여 550 nm에서 흡광도를 측정하고 포도당 표준곡선으로부터 환원 당 함량을 환산하였다. 총산은 AOAC 방법(16,17)에 따라 포도주의 술덧을 여과하여 얻은 여액을 0.1 N NaOH로 적정 하여 주석산으로 환산하였으며 pH는 pH meter(340, Mettler Toledo Co., Schwerzenbach, Germany)를 이용하여 측정하 였다.
포도주의 유기산 함량을 분석하기 위하여 발효액을 메탄 올과 증류수로 활성화 시킨 Sep-pack C18 cartridge와 0.45 µm membrane을 통과시킨 후 HPLC(600E, Waters, Milford, MA, USA)와 RI detector(410, Waters)를 사용하여 분석하였 다. 유기산 column은 Shodex RSpak KC-811(ϕ 8.0×300 mm)(Showa Denko America Inc., New York, NY, USA)를 사용하였고 column 온도는 40°C로 설정하였으며 mobile phase로는 0.1 N phosphoric acid를 사용하여 1.0 mL/min의 flow rate로 분석하였다(18,19). 각 피크의 동정은 표준품의 retention time과 비교하였고 함량은 피크의 면적으로 계산 하였다.
아세트알데히드, 메탄올 및 고급 알코올의 정량은 GC(Model 6890N, Agilent Technologies Inc., Santa Clara, CA, USA)와 FID 검출기(Agilent Technologies Inc.)를 사용 하여 분석하였다(19). Column으로는 HP-FFAP(ϕ 0.25 mm×30 m)(Agilent Technologies Inc.)를 사용하였고 column 온도는 60°C(4 min), 210°C(6°C/min), 210°C(2 min)으로 설정 하였다. Injector 온도는 190°C, carrier gas는 H2를 사용하였 으며 split ratio는 100:1, flow rate는 30 mL/min이었으며 detector 온도는 200°C이었다. 각 피크의 동정은 표준품의 retention time과 비교하였고 함량은 피크의 면적으로 계산 하였다.
색도는 colorimeter(CM-3600d, Konica Minolta, Osaka, Japan)를 이용하여 측정하고 L(명도), a(적색도), b(황색도) 값으로 나타내었다.
관능검사를 위하여 경북대학교 대학원 식품공학과 학생 중 본 실험에 관심 있는 학생 20명을 관능요원 으로 선정하 여 포도주의 관능적 요소를 잘 인지하도록 반복 훈련시킨 후 검사방법과 평가 특성을 설명하였다. 효모 균주를 달리 한 포도주는 알코올 발효 후 원심분리하여 얻은 포도주를 16시간 냉장 보관한 후 제공하였다. 기호도의 평가항목은 색(color), 맛(taste), 향(flavor) 및 전반적인 기호(overall preference)에 대하여 5단계 기호도 척도법으로 실시하였다 (20). 이때 관능평점은 5, 대단히 좋다(very good); 4, 약간 좋다(good); 3, 보통이다(fair); 2, 약간 나쁘다(poor); 1, 아주 나쁘다(very poor)로 하였다.
모든 데이터는 SAS 통계처리(SAS Inc., Cary, NC, USA) 를 이용한 분산분석(ANOVA)과 Duncan의 다중 비교 분석 법으로 유의성을 검증하였다(21).
결과 및 고찰
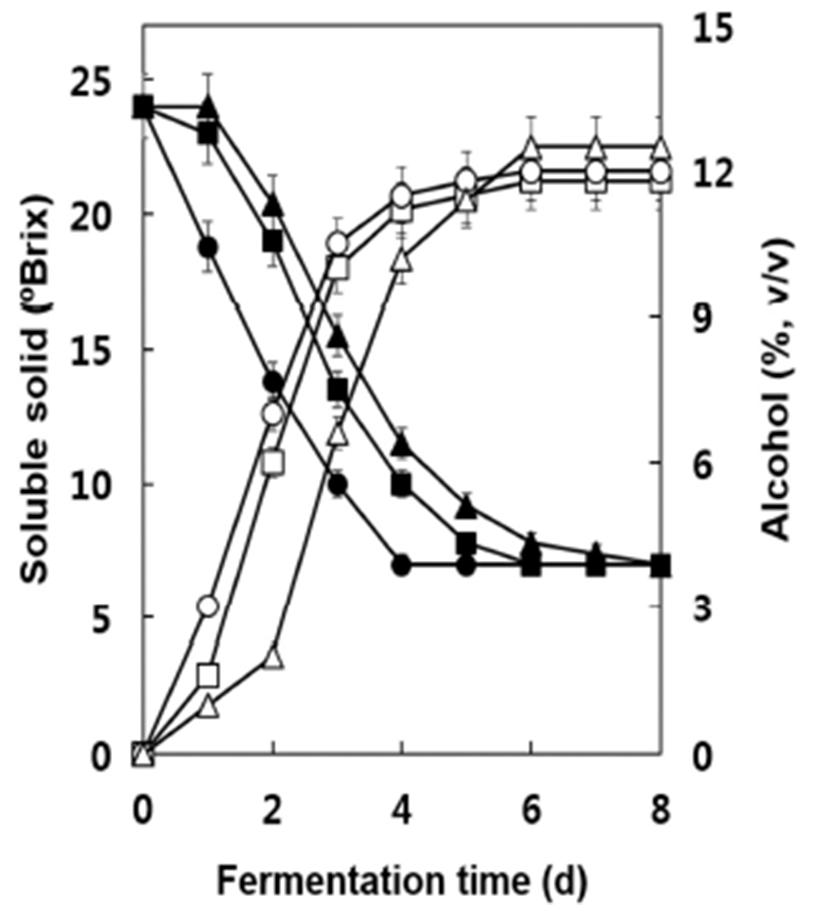
토착형 효모S. cerevisiae S13과 D8에 의한 MBA 포도주 발효과정 중의 알코올 함량과 가용성 고형분의 변화를 조사 한 결과는 Fig. 1과 같다. 대조균주로 사용한 W-3의 경우 발효 1일 후부터 3일까지 가용성 고형분의 함량이 떨어지 면서 알코올의 생성이 급격히 증가하여 발효 6일 후에 최대 알코올 농도를 나타내었다. 균주 S13과 D8의 경우에는 이 에 비하여 가용성 고형분의 함량과 알코올의 생성이 다소 지연되었으나 발효 6일 후에는 알코올의 농도가 S13은 W-3 와 유사한 수준에 D8은 다소 높은 수준에 도달하였다. 발효 종료 후 잔존 가용성 고형분 함량은 약 7.0~7.1°Brix이었으 며 최종 알코올 농도는 D8의 경우 12.4%로서 W-3의 12.0% 보다도 다소 높게 나타났으나 S13의 경우 11.8%로서 거의 유사한 수준을 나타내었다. 발효 종료 후의 잔존 환원당 함량은 0.07~0.10%로서 세 균주 모두 발효가 잘 이루어졌 으며(data not shown) D8 포도주의 경우 가용성 고형분에 대한 알코올 생성비는 알코올 부피를 기준으로 약 52.1%로 서 이론적 최대 수치인 59.0%에 근접한 양의 알코올을 생산 하였음을 알 수 있었다(14). 본 연구에서 사용한 S13과 D8 균주는 캠벨얼리 포도주 발효에서 모두 대조균주인 W-3보 다도 다소 높은 알코올 생성력을 보인 바 있다(14). 본 연구 에서 사용한 토착형 효모 균주 D8가 W-3보다도 다소 높은 알코올 함량을 나타낸 것은 이 균주가 우리나라에서 재배하 고 있는 포도로부터 분리된 것으로서(22) MBA 포도주의 제조에 잘 적응하여 대조균주 W-3보다 다소 높은 알코올을 생산한 것으로 추정된다.
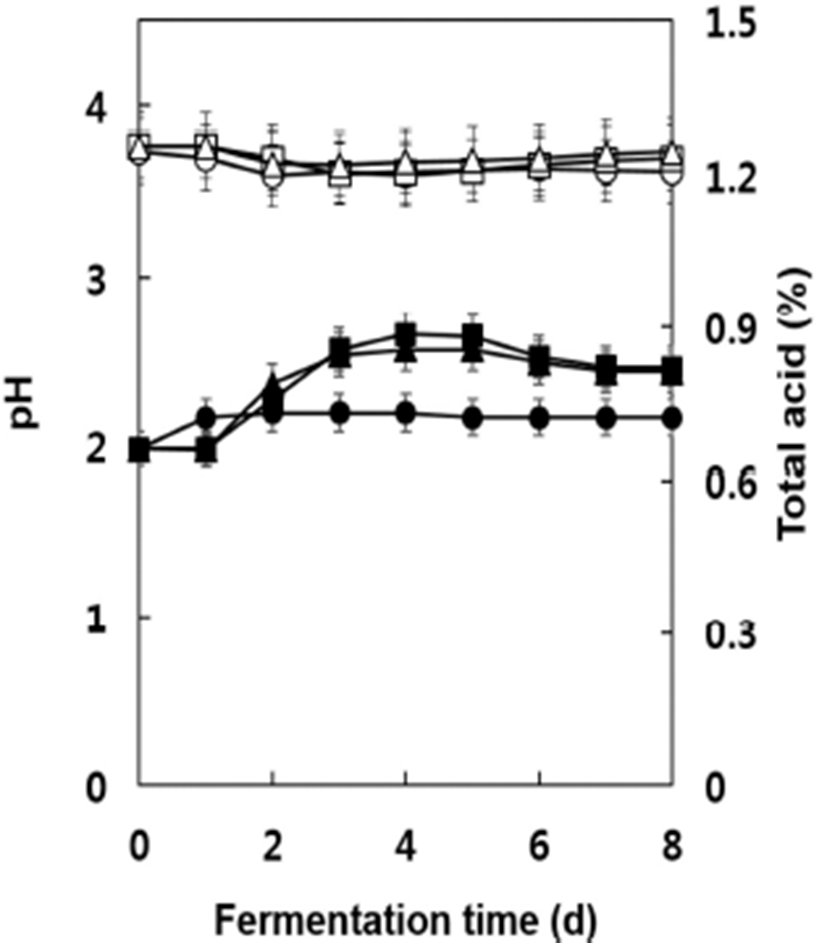
발효 중 pH와 총산 함량의 변화를 조사한 결과는 Fig. 2와 같다. 발효 전 머스트의 pH는 약 3.76으로서 캠벨얼리 보다는 다소 높았으며(14) 세 균주 모두 초기발효 중 다소 감소하였다가 발효가 진행되면서 다시 pH가 증가하는 현 상을 나타내었다. 발효기간 중 세 균주 간에 큰 차이는 없었 으나 균주 D8, S13, W-3의 순으로 pH가 다소 높게 유지되었 으며 발효 종료시점인 8일 후에는 W-3 포도주가 3.62, S13 포도주가 3.70, D8 포도주는 3.74를 나타내었다. 발효 전 모든 시험구에서 머스트의 총산 함량은 0.66%로서 캠벨얼 리의 경우보다 다소 높은 수준을 나타내었으나(14) 일반적 인 포도의 총산 함량보다 낮게 나타났다(23,24). 발효 중 총산의 함량은 대조균주 W-3의 경우 발효 1일 후까지 증가 하여 다른 균주들에 비해 다소 높았으나 그 이후부터 발효 종료 시까지 거의 일정한 수준을 나타내어 다른 균주들에 비하여 낮은 값을 유지하였다. 균주 S13과 D8은 발효 4일까 지 다소 느리게 증가하여 4일~5일 후 최고점인 0.85~0.88% 의 높은 수준을 나타내었으나 이후부터 다소 감소하여 발효 가 종료된 8일후에는 S13 포도주가 0.82%, D8 포도주가 0.80%로서 대조균주 W-3의 0.72%보다 총산의 함량이 다소 높게 나타났다. Lamikanra(25)에 의하면 포도에 0.58% 함유 되어 있던 총산이 발효 중 0.90%까지 증가하였다가 발효 후기에 다시 0.75%까지 감소하였다고 보고한 바 있다. 이러 한 산도의 변화는 발효 중 malic acid와 tartaric acid의 함량이 감소하며 succinic acid 및 lactic acid의 함량이 증가하면서 복잡한 작용에 의해 일어나는 현상으로 알려져 있다(26). 또한 포도주 발효 중 스타터로 첨가한 포도주 효모의 종류 에 따라서 또한 비교적 최근 포도 속에 존재하던 토착형 효모가 초기발효에 관여하는 것으로 알려져 원료 포도의 미생물 분포와 이들의 아황산 내성 및 알코올 내성 등에 따라서 발효 중 유기산의 함량과 조성의 변화는 다양한 양상을 나타내게 된다(27). 일반적으로 포도주의 pH는 3.3~3.6 정도, 총산 함량은 0.55~0.85%가 바람직한데 적포 도주는 다소 낮은 범위의 총산을 유지하는 것으로 알려져 있으며(1) 본 연구에서 제조한 포도주의 경우에도 이와 잘 일치하였다.
실험에 사용한 포도로 제조한 포도즙의 유기산 함량과 발효가 끝난 후 포도주에서 나타난 유기산의 조성 및 각 유기산의 함량을 조사한 결과는 Table 1과 같다. Malic acid 의 함량은 D8 포도주가 189.1 mg/L로서 가장 높았으며 S13 포도주는 131.0 mg/L로서 D8 포도주는 W-3 포도주의 182.2 mg/L와 유사한 수준을 나타내었으나 S13 포도주는 W-3 포도주의 약 71.9% 수준으로 매우 낮게 나타났다. 포도즙의 경우 5,007 mg/L으로 매우 높았으나 발효에 의해 malic acid 가 상당량이 분해되었으며 특히 S13 균주는 그 분해력이 높은 것으로 생각되었다. 그러나 캠벨얼리 발효 중 S13 균주에 의한 malic acid의 분해력이 D8보다는 높고 W-3보 다는 낮게 나타났다. Tartaric acid의 함량은 D8, S13, W-3 포도주의 순으로 높게 나타나 캠벨얼리 발효의 경우와 매우 유사하게 나타났으나 citric acid의 함량 역시 D8, S13, W-3 포도주의 순으로 높아 캠벨얼리 발효의 경우와 상이한 현상 을 보여 원료 포도의 특성에 따라서도 유기산의 분해력이 다르게 나타남을 알 수 있었다(14). Lactic acid의 함량은 S13 포도주가 1,825 mg/L, D8 포도주가 1,117 mg/L로서 W-3 포도주의 302 mg/L에 비하여 각각 6.1배, 3.7배의 높은 수준을 나타내었다. 포도주에 검출되는 유기산으로는 tartaric acid, malic acid 및 citric acid가 있으며 포도주의 신맛은 주로 tartaric acid와 malic acid에 의해 결정되는데 신맛의 정도는 malic acid > tartaric acid > citric acid > lactic acid의 순으로 강하다(28). 일반적으로 캠벨얼리 포도주에 는 약 2,400 mg/L의 malic acid와 약 3,000 mg/L의 tartaric acid와 약 500 mg/L의 lactic acid가 함유되어 있는 것으로 알려져 있다(29). 본 연구의 결과 토착형 효모 S13 포도주와 D8 포도주의 malic acid와 tartaric acid의 함량이 일반적인 국산 포도주에 비하여 매우 낮게 나타났다. 포도주의 lactic acid 함량은 발효 또는 숙성 중 증가하기도 하지만 citric acid는 주로 포도 원료로부터 유래하며 포도주의 종류에 따라 500~1,000 mg/L의 농도로 존재한다(26). 일반적으로 발효 중 와인효모에 의해 상당량의 citric acid가 분해되기도 하며 원료 포도 유래의 어떤 미생물들이 citric acid를 생성 하기도 한다. Citric acid를 생산하는 균주들로는Aspergillus sp.에 속하는 8종의 곰팡이, Candida sp.에 속하는 5종의 효모와 일부 세균 등 다양한 미생물들이 알려져 있다(30). 우리나라 포도 품종에 따른 효모의 분포 조사 결과 캠벨얼 리 포도에서는 거의 검출되지 않는 Candida sp.가 MBA 포도에서는 약 16.7%의 빈도로 검출된 바 있다(31). 본 연구 에서 사용한S. cerevisiae S13과 D8 균주는 대조균주인 W-3 보다 다소 발효가 지연되는 현상을 보여(Fig. 1) 이 시기에 citric acid를 생산하는 미생물들이 증식하였을 가능성이 있 으나 이에 대하여는 좀 더 연구해야할 과제이다.
토착형 효모 균주 S13과 D8로 발효하여 제조한 MBA 포도주의 아세트알데히드, 메탄올 및 고급알코올의 함량을 조사한 결과는 Table 2와 같다. 아세트알데히드 함량은 D8 포도주가 12.3 mg/L, S13 포도주가 15.2 mg/L으로서 W-3 포도주의 31.7 mg/L보다 매우 낮게 나타났다. 아세트알데 히드는 간 독성, 발암성 등 사람의 건강에 나쁜 영향을 미치 는 물질로서 식품공전에서는 700 mg/L 기준치를 정하여 관리하고 있는데(32) 본 연구의 경우 토착형 효모로 제조한 MBA 포도주에서는 이 기준치의 1.8~2.2%의 수준을 나타 내었으며 대조균주로 사용한 W-3 포도주보다 매우 낮게 나타났다. 메탄올의 함량은 S13 포도주는 98.6 mg/L, D8 포도주는 112.0 mg/L로서 W-3 포도주의 192.8 mg/L의 각각 51.1%, 58.1%로서 매우 낮게 나타났다. 메탄올은 과량을 섭취할 경우 시신경을 마비시키거나 심하면 생명에 치명적 으로 작용할 수 있는 물질로서 국제적으로 소비자 건강에 문제가 없다고 생각되는 메탄올 허용치는 Cabaroglu에 의 해 백포도주 150 mg/L, 적포도주 300 mg/mL 이하로 보고된 바 있다(33). 일반적으로 포도주의 메탄올 함량은 이보다 낮게 나타나지만 특정 경우에는 이보다 높은 농도를 가진 포도주가 보고되기도 한다(34,35). 우리나라 식품공전에서 는 1,000 mg/L으로 기준치를 정하여 관리하고 있어(32) 본 연구에서 제조한 MBA 포도주는 이 기준치의 약 9.9%, 11.2%의 수준을 나타내었다.
포도주 제조 중 생성되는 고급 알코올은 그 양에 따라 포도주 품질에 큰 영향을 미치는 것으로 알려져 있으며 포도주에서 검출되는 주요 고급 알코올로는 이소아밀알코 올, 이소부탄올 및 프로판올 등이 있다(36). 이들 각각의 성분은 매우 독특한 냄새와 휘발성으로 인하여 포도주와 같이 알코올 농도가 낮은 알코올성 음료에는 flavor나 body 에 결정적인 영향을 미치는 중요한 구성성분으로서 유기산 과 다양한 ester를 형성하여 와인의 숙성된 향에 기여하기도 하지만 과량으로 존재할 경우 숙취의 원인이 되는 물질로 알려져 있다(2). 이소아밀알코올의 함량은 D8 및 S13 포도 주가 각각 527.3 mg/L, 583.8 mg/L로서 모두 W-3 포도주의 810.2 mg/L에 비하여 매우 낮게, 이소부탄올의 함량은 D8 및 S13 포도주가 각각 59.5 mg/L, 85.8 mg/L로서 모두 W-3 포도주의 175.1 mg/L에 비하여 매우 낮게 나타났다. 또한 프로판올의 함량 역시 D8 및 S13 포도주가 각각 41.5 mg/L, 40.7 mg/L로서 모두 W-3 포도주의 69.9 mg/L에 비하여 매우 낮게 나타났다. 이 두 균주에 의한 캠벨얼리 포도주의 경우에는 이소부탄올의 함량이 W-3 포도주보다 다소 낮게 나타났으나 이소아밀알코올 및 프로판올의 함량은 W-3로 발효한 캠벨얼리 포도주와 유사하게 나타나 본 연구에서는 상이한 결과를 나타내었다(14).
토착형 효모 균주 S13과 D8로 발효하여 제조한 MBA 포도주의 색도를 조사한 결과는 Table 3과 같다. L 값은 S13 포도주가 26.34, D8 포도주가 26.71로서 W-3 포도주의 27.19보다 다소 낮게, a 값은 S13 포도주가 44.71, D8 포도주 가 43.79로서 W-3 포도주의 46.73보다 다소 낮게 나타났으 며 b 값은 S13 포도주가 11.43, D8 포도주가 9.35로서 W-3 포도주의 16.34보다 매우 낮게 나타났다. 일반적으로 Vitis vinefera에 속하는 유럽계 포도로 제조한 시판 적포도주 색도에 관한 연구에 의하면 L 값은 55~75, a 값은 20~40, b 값은 10~28의 범위를 나타낸다고 보고된 바 있다(37). 본 연구에서 제조한 MBA 포도주는 유럽계 포도로 제조한 적포도주의 L 값에 비하여 매우 낮은 수치를 나타내었으나 우리나라 캠벨얼리 포도주의 L 값인 약 29.1과 유사하였으 며 발효 직후의 캠벨얼리 적포도주는 L 값이 외국의 포도주 에 비하여 낮지만 오크통 숙성 중에 48.1로 증가한 예가 있어(38) 숙성에 의한 색도의 변화에 관하여는 좀 더 연구해 야할 과제이다. 포도주를 평가할 때 중요한 항목 중의 하나 인 색도는 품질을 평가해 주는 요소이기도 하지만 양조과정 중 색도의 변화는 발효과정 혹은 숙성정도를 예측할 수 있는 지표가 되기도 한다. 적포도주에서는 적색색소가 침 강, 퇴색, 갈변이 되며 갈변은 주로 polyphenol성 물질의 산화로 일어나기 때문에 이러한 결과를 토대로 하여 다양한 형태의 적포도주들이 발전되어 왔다(39). 본 연구에서 얻은 적포도주의 색도는 기존 외국의 적포도주와는 상이한 독특 한 적포도주의 개발 가능성을 시사하고 있다.
| Strain | Hunter’s color value | ||
|---|---|---|---|
| L | a | b | |
| S. cerevisiae W-3 | 27.19±1.42a | 46.73±2.57a | 16.34±1.53a |
| S. cerevisiae S13 | 26.34±1.12a | 44.71±2.21a | 11.43±1.32b |
| S. cerevisiae D8 | 26.71±1.32a | 43.79±1.68a | 9.35±1.41b |
토착형 효모로 제조한 MBA 포도주 시료의 색, 향, 맛, 전반적인 기호도에 대한 관능검사 결과는 Table 4와 같다. 토착형 효모 균주 S13으로 제조한 MBA 포도주의 경우 색에서 대조균주인 W-3으로 제조한 포도주보다 우수한 점 수를 얻었으나 유의적인 차이는 없었으며 D8로 제조한 포 도주의 경우 W-3 포도주와 유사한 수준의 점수를 얻었다. 그러나 향, 맛, 전반적인 기호도에 있어서는 S13 및 D8 균주로 발효한 MBA 포도주의 경우 W-3 균주로 제조한 포도주보다 다소 낮거나 유사한 수준의 점수를 얻었다. Kim 등(14)에 의하면 S13 및 D8 균주로 발효한 캠벨얼리 포도주의 경우 색, 향, 맛, 전반적인 기호도 모든 항목에서 대조균주인 W-3로 발효한 캠벨얼리 포도주에 비하여 우수 한 점수를 얻었다. 특히 캠벨얼리 포도주 색의 경우 D8 포도주가 3.66으로서 W-3 포도주의 3.08보다 매우 높은 결과를 얻었으며 S13 포도주는 3.25로서 다소 높은 점수를 얻은 바 있다. S13 균주는 포도주 색의 조절뿐만 아니라 MBA 포도주에 있어서 D8 균주와 더불어 아세트알데히드, 메탄올 및 고급알코올의 생성이 매우 약하기 때문에(Table 2) 이 균주와 포도주 효모와의 혼합발효는 국산 포도주의 품질 개선에 도움이 될 것으로 사료된다. 서로 특성이 다른 두 균주를 사용한 혼합발효를 통한 국산 포도주의 품질 개선에 관하여는 이미 몇몇 연구보고가 있다. Malic acid 분해효모Issatchenkia orientalis와 포도주 효모의 혼합발효 에 의해서는 우리나라 캠벨얼리 포도주의 신맛 조절에 효과 가 있음이 보고된 바 있으며(40) 우리나라 포도에 다량으로 존재하는 non-Saccharomyces 효모인 Hanseniaspora uvarum과의 혼합발효를 통하여 캠벨얼리 포도주의 향미 개선에 관한 연구들이 있다(27).
요 약
우리나라 캠벨얼리 포도주의 발효 중 효모 천이단계에서 분리된 당 내성 토착형 효모 균주 S. cerevisiae S13과 D8 균주로 MBA 포도주를 발효하여 그 특성을 산업용 포도주 효모 W-3 균주와 비교하였다. 토착형 효모 두 균주의 경우 발효초기 가용성 고형분의 감소 및 알코올 생성이 다소 지연되었으나 발효 종료 후 D8 포도주는 12.4%, S13 포도주 는 11.8%로서 대조균주 W-3 포도주의 12.0%와 알코올 함 량이 유사하거나 다소 높았다. Malic acid의 함량의 경우 D8 포도주는 W-3 포도주와 유사한 수준을 나타내었으나 S13 포도주는 W-3 포도주의 약 71.9% 수준으로 매우 낮았 다. 아세트알데히드, 메탄올, 프로판올, 이소프로판올, 이 소아밀알코올 등의 함량 역시 D8 포도주와 S13 포도주 모두가 W-3 포도주보다 매우 낮게 나타났다. 특히 메탄올 의 함량은 S13 포도주가 98.6 mg/L, D8 포도주가 112.0 mg/L로서 W-3 포도주의 192.8 mg/L에 비하여 각각 51.1%, 58.1%의 낮은 수준을 나타내었다. 또한 색도를 나타내는 L, a, b 값은 S13, D8 포도주 모두에서 W-3포도주보다 낮게 나타났으며 관능평가 결과 색에 있어서 S13 포도주가 W-3 포도주보다 다소 높은 점수를 얻었으나 통계적으로 유의적 인 차이는 보이지 않았다.










