서 론
최근에는 많은 천연소재의 생리활성물질의 연구가 활발 히 진행되고 있는 상황이다(1,2). 또한 이러한 연구는 건강 식품의 항산화 활성과 현대인들이 많은 관심을 가지고 있는 피부노화에 대한 anti-aging 등의 다양한 기능에 초점이 맞 추어져있다. 따라서 기존의 천연물보다 좋은 기능성과 안 전성이 요구되는 새로운 천연소재의 개발이 절실히 요구되 는 실정이다(3).
노간주나무(Juniperus rigida)는 노가지나무, needle juniper로도 불리며 측백나무과에 속하는 늘푸른 큰키나무 로 한국, 중국, 시베리아 전역에 분포되어 있다. 한국에서는 석회암지대에서 자라며, 추위에 강하고 해풍을 잘 견디는 특징이 있어 해안가에서 방풍림으로 이용되고 있다(4). 노 간주나무의 열매는 두송실이라고 하는데 거풍제습과 이뇨 작용이 있어 관절염에 외용약으로 쓰거나, 부조, 통풍, 요로 생식기 질환에 사용한다(5). 노간주나무의 열매는 정유성 분으로 α-pinene, myrene, careen, limonene, p-cymene 등이 함유되어 있다. 또한 다른 측백나무과 식물들의 잎은 보통 hinokiflavone 외에 amentoflavone과 podocarpusflavone을 함유하는 특징이 있다(6,7).
당뇨병은 진행되는 동안 베타세포의 기능 손상에 의해 체내 free radical의 농도와 산화적 스트레스가 증가되며, 항산화 효소의 활성을 감소시켜 합병증으로 인한 사망의 주요한 원인으로 작용한다(8). α-Glucosidase는 식이 중에 함유된 탄수화물의 소화과정 마지막 단계를 촉매하여 포도 당으로 전환시키는 효소로서, α-glucosidase 저해제는 탄수 화물의 소화와 흡수를 지연시켜 식후 혈당증가를 완화시킨 다. α-glucosidase 저해제는 고인슐린 혈증이나 저혈당을 유발하지 않고, 인슐린 분비를 촉진시키며 소장에서 글루 카곤 분비를 억제하는 glucagon-like peptide-1의 분비를 촉 진한다(9). 현재 acarbose와 voglibose 등의 glucosidase 저해 제가 시판되고 있으나, 이들 약제를 장기간 복용한 경우 일부 환자에 있어서 복부팽만감, 구토, 설사 등 부작용을 나타낼 수 있어 그 사용이 제한될 수 있다(10).
따라서 본 연구에서는 노간주나무 추출물의 다양한 항산 화 작용과 항당뇨 효과를 통하여 천연항산화제 및 항당뇨의 기능성 식품 및 약품 소재로서의 활용에 있어 기초자료로 사용하고자 본 실험을 수행하였다.
재료 및 방법
본 실험에 사용된 노간주나무(Juniperus rigida Sieb.)는 충북 괴산에서 2012년 봄에 생산 된 건채를 구입하여 추출 시료로 사용하였다. 시료의 추출은 열수 및 에탄올 추출을 하였다. 시료의 에탄올 추출물은 70% 에탄올 10배의 양을 가하여 실온에서 24시간 침지하여 상등액과 침전물을 분리 하여 동일한 방법으로 3회 반복 추출하였고, 열수 추출물은 증류수 10배의 양을 가하여 80℃에서 3시간 가량 환류냉각 추출해 실온에서 24시간 침지하여 상등액과 침전물을 분리 하여 동일한 방법으로 3회 반복 추출하였다. 각 시료 추출물 은 여과지(Whatman No.2)를 이용하여 여과한 후 EYELA evaporator(SB-1100, Tokyo, Japan)로 감압 농축하여 용매를 완전히 제거한 후 동결 건조하여 -20℃에 보관하면서 본 실험의 시료로 사용하였다.
폴리페놀 정량은 Folin-Denis 방법(11)에 준하여 정량하 였다. 즉, 500배 희석한 시료 용액 50 μL에 folin-ciocalteu’s phenol reagent 시약 50 μL을 첨가하여 실온에서 3분간 반응 시킨 후, 포화용액 0.7 M Na2CO3 용액 50 μL을 첨가하여 혼합한 후 1시간 실온에서 방치하고, 700 nm에서 흡광도를 측정한 후 표준물질인 tannic acid로 미리 작성한 표준곡선 의 흡광도 값과 비교하여 폴리페놀 함량(mg/g)을 산출하 였다.
총 플라보노이드 함량은 Zhuang 등의 방법(12)을 변형하 여 측정하였다. 즉, 추출물 100 μL에 2% AlCl3 ethanol solution 100 μL을 혼합하여 실온에서 1시간 방치한 후 microplate reader를 이용하여 420 nm에서 흡광도를 측정하 였다. 표준물질로는 quercetin을 사용하였으며, 표준물질의 검량선과 비교하여 총 플라보노이드 함량(mg/g)을 구하였다.
ABTS radical cation decolorization의 측정은 Pellegrini 등의 방법(13)의 의해 측정하였다. 즉, 7mM ABTS 5mL와 140mM K2S208 88 μL를 섞어 어두운 곳에 14∼16시간 방치 시킨 후, 이를 absolute ethanol과 약 1 : 88 비율로 섞어 734 nm에서 대조군의 흡광도 값이 0.7 ± 0.002가 되도록 조절 한 ABTS solution을 사용하였다. 시료용액 50 μL와 ABTS solution 1mL을 혼합하여 30초간 진탕한 후 2.5분간 반응시 키고 734 nm에서 흡광도를 측정하여 아래의 식에 의해 라 디칼 소거활성을 계산하였다.
FRAP assay는 Benzie와 Strain법(14)을 96well plate에 맞 게 수정하여 실시하였다. 반응액은 30 mM acetate buffer (pH 3.6) 10 mM의 TPTZ의 FeCl3·6H2O를 10:1:1의 비율로 실험 직전에 만들어 사용하였다. 반응액 150 mL와 시료 20 mL를 혼합하여 8분간 실온에서 반응시킨 후 593 nm에 서 흡광도를 측정하였다. 표준물질로는 FeSO4·7H2O를 사 용하였다.
ACE 저해효과 측정은 Cushman 등의 방법(15)에 의하여 행하였다. 즉, 반응구는 0.3 M NaCl을 함유하는 0.1 M potassium phosphate buffer (pH 8.3)에 기질로 2.5 mM hippuryl-histidyl- leucine 용액 0.15 mL를 혼합하였으며, 대 조구는 추출액 대신 동일 buffer 0.1 mL를 첨가하여 37℃에 서 30분간 반응시키고 1 N HCl 0.35 mL 첨가로 반응을 중지시킨 뒤 3 mL의 ethyl acetate를 첨가하였다. Ethyl acetate 층만을 취한 다음 용매를 증류시킨 잔사에 2 mL의 증류수를 첨가하여 효소에 의해 기질로부터 분리되어 추출 된 hippuric acid를 280 nm에서 흡광도를 측정한 후 표준곡 선에서 양을 환산하여 아래의 식에 의해 저해율을 계산하 였다.
PF는 Andarwulan와 Shetty의 방법(16)으로 측정하였다. 10 mg의 β-carotene/50 mL chloroform 용액 1 mL를 evaporator용 수기에 넣고 40℃ water bath에서 chloroform을 증류시킨 후, 20 μL linoleic acid, 184 μL tween 40과 50 mL H2O2를 가하여 emulsion을 만들고, 5 mL emulsion을 시료용액 100 uL에 혼합하여 잘 섞어준 뒤 50℃에서 30분간 반응시켜 냉각시킨 다음, 470 nm에서 흡광도를 측정하였 고, PF는 반응구의 흡광도/대조구의 비로 나타내었다.
본 실험에 TBARS는 Burge와 Aust의 방법(17)에 따라 측정하였다. 1% linoleic acid와 1% tween-40으로 emulsion 을 만들고 emulsion 0.8 mL와 시료 0.2 mL를 섞은 후 50℃ water bath에서 10시간 반응시켰다. 반응 후 반응액 1mL에 TBA reagent 2mL를 가하고 15분간 중탕한 다음 10분간 냉각시킨 후 15분간 1,000 rpm으로 원심분리 하였다. 원심 분리 한 액을 실온에서 10분간 방치 한 후 상등액을 532 nm서 흡광도를 측정하였으며, TBARS 값은 1mL 반응혼합 물에 대해서 생성된 1,1,3,3-tetraethoxy propane (TEP)의 함 량을 환산하여 [1-(반응구의 생성량/대조구의 생성량)] × 100 으로 항산화 활성을 나타내었다.
세포를 α-glucosidase 저해활성을 측정하기 위하여 Tibbot 등의 방법(18)에 따라 반응 혼합액은 50 mM sodium succinate buffer (pH 4.2)에 p-nitrophenol-α-D-glucopyranoside (PNPG)를 용해시켜 1 mg/mL의 농도로 기질을 만들었다. 기질 1 mL와 효소(Sigma, 37℃, pH 6.8, 1,000 unit/mL) 0.1 mL를 혼합하고 대조구에는 증류수 0.1 mL, 반응구에는 시 료 0.1 mL을 넣어 37℃에서 30분간 반응시킨 후 1N-NaOH 0.1 mL를 첨가하여 발색시켰다. 이때 생성된 p-nitrophenol (PNP)은 400 nm에서 spectro-photometer를 이용하여 측정 하였으며, 그 양은 표준물질 p-nitrophenol로 부터 작성한 표 준곡선으로부터 구하여 다음의 식으로 저해율을 구하였다.
α-amylase 저해활성 측정은 agar diffusion 방법(19)을 이 용하여 측정하였다. Plate는 5 g의 agar와 5 g의 soluble starch를 500mL 증류수에 녹인 후 121℃, 15분간 감압 살균 하고 15mL씩 분주하여 제조하였고, 대조군의 경우 0.8 μL 의 증류수 0.2 μL의 효소(Sigma, 20℃, pH 6.9, 1,000 unit/mL)를 섞고 반응군은 증류수 대신 추출물을 효소와 섞어 plate에 놓인 disc paper 위에 각각 분주하고 37℃에서 3일간 배양한 후 I2/KI (5 mMI2 in 3%KI) 5 mL를 가하여 15분간 발색 후 다음의 식으로 효소 저해율을 구하였다.
결과 및 고찰
식물체 내의 페놀성 화합물은 2차 대사산물로서 항산화, 항균 등 다양한 생리활성을 나타내며, 특히 항산화 활성은 페놀성 화합물이 작용하는 것으로 보고되고 있고(20), 이와 같이 페놀성 화합물 함량과 항산화 활성간의 상호작용에 대한 많은 연구들에서 알 수 있듯이 식물체가 지니고 있는 페놀성 화합물의 함량을 조사함으로서 항산화 활성을 탐색 하는 일차적인 자료가 될 수 있을 것으로 생각된다(20). Tannic acid를 기준물질로 하여 표준곡선을 그린 후 노간주 나무 추출물에 존재하는 총 폴리페놀 함량 측정 결과를 Table 1에 나타내었다. 노간주나무 열수추출물에서 71.3 mg/g의 함량을 나타내었으며 에탄올추출물에서 116.0 mg/g로 Yoo 등(21)이 보고한 솔잎 수용성 추출물의 함량인 16.1mg/g, Moon 등(22)이 보고한 녹차10.9 mg/g, 인지 6.7 mg/g의 추출물로 노간주 추출물이 많은 폴리페놀이 함유되 어 있음을 확인할 수 있었다.
| Sample | Extract | Total phenolics (mg/g) | Total flavonoids (mg/g) |
|---|---|---|---|
| Juniperus rigida S. | EtOH | 116.0 ± 0.14 | 76.4 ±2.16 |
| Water | 71.3 ±2.03 | 17.7 ±2.03 |
페놀성 물질은 phenolic hydroxyl기를 가지며 단백질 및 거대 분자들과 쉽게 결합하며, 항산화 활성과 같은 다양한 생리활성을 가지고 있다. 또한 플라보노이드는 유리 라디 칼 분해 능력을 가져서 항산화제로 작용할 수 있다. 이와 같이 천연 항산화제로 작용할 수 있는 폴리페놀 화합물이나 플라보노이드는 식물에 존재하는 phytochemical로서 여러 가지 식물에 다량 함유되어 있는 것으로 보고되었다(23). 노간주나무 추출물에 함유된 플라보노이드 화합물을 quercetin을 표준물질로 측정한 결과 Table 1에 나타내었다. 노간주나무 열수추출물에서 17.7 mg/g 에탄올추출물에서 76.4 mg/g로 Yin 등(24)이 보고한 대황 24.47 mg/g, 석류 43.27 mg/g, 은행 0.97 mg/g, 천마 14.57 mg/g 에탄올 추출물 보다 노간주 에탄올 추출물에 많은 플라보노이드가 함유되 어 있음을 확인할 수 있었다.
ABTS 라디칼 소거능 측정은 potassium persulfate와 반응 하여 녹색의 ABTS radical을 형성하고, 생성된 양이온 (ABTS+˙)은 항산화성을 가진 물질에 의해 제거되어 radical 특유의 색인 청록색에서 연한 녹색으로 탈색되는 것을 측정 하는 방법이다(25). DPPH radical 소거활성 실험과 동일한 원리로, ABTS 시약은 합성된 radical이나 물과 유기용매 모두에 용해되므로 극성 시료뿐만 아니라 비극성 시료의 항산화 활성 측정에 모두 사용 가능하다(26). 이러한 원리를 이용하여 ABTS를 측정한 결과 500 μg/mL에서 에탄올추출 물은 79.3%의 활성을 보였으며, 열수추출물은 76.4%의 활 성을 나타내었다(Fig. 1). 이는 Cho 등(27)과 Kim 등(28)이 까막살, 참보라색 우무 에탄올 추출물과 송이즙 1.0 mg/mL 농도에서 ABTS radical 소거능이 13.6 %, 16.2 %, 7 %를 보인 결과와 비교하여 볼 때 노간주 추출물의 ABTS radical 소거능이 높음을 알 수 있었다.
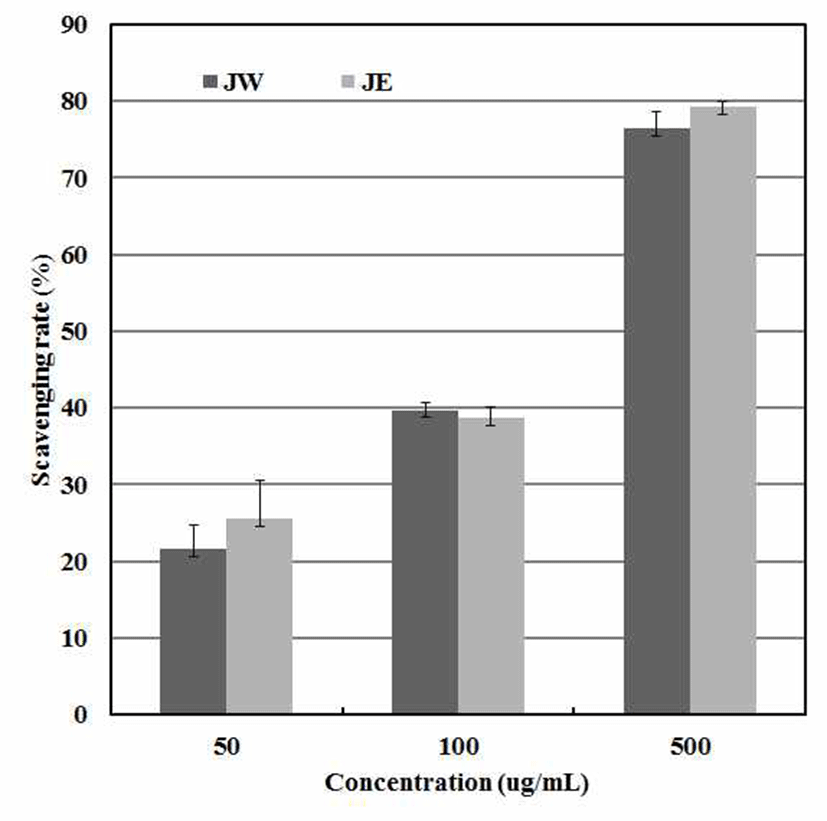
 JW : J. rigida Sieb. extracted with water,
JW : J. rigida Sieb. extracted with water,  JE : J. rigida Sieb. extracted with ethanol. Results are means ± S.D. of triplicate data.
JE : J. rigida Sieb. extracted with ethanol. Results are means ± S.D. of triplicate data.
환원력은 항산화 능력과 관련이 있는 중요한 인자로서 FRAP에 의한 환원력 측정은 산성 pH에서 환원제에 의해 ferric tripyridyltriazine (Fe3+-TPTZ) 복합체가 ferrous tripyridyltriazine (Fe2+-TPTZ)으로 환원되는 원리를 이용한 것으로, 항산화제와 같이 환원력을 가진 물질은 Fe3+ -ferricyanide 복학체를 Fe2+형태로 환원시켜 청색을 띠게 한다(15). 노간주나무 추출물에 존재하는 FRAP값을 측정 한 결과 열수추출물에서 1.83 mM의 함량을 나타내었으며, 에탄올 추출물에서 1.77 mM로 Jang 등(29)이 보고한 엉겅 퀴 추출물의 0.58 mM을 보인 결과와 비교할 때 노간주 에탄올추출물이 FRAP의 함량이 높음을 확인할 수 있었다 (Table 2).
| Extract | Total FRAP value (Fe2+Mm/mg) |
|---|---|
| Water | 1.83 ± 0.06 |
| EtOH | 1.77 ± 0.04 |
ACE는 renin에 의해 생성된 angiotensin I의 C-말단부터 가수분해하여 angiotensin Ⅱ로 전환시키는 효소로 angiotensin Ⅱ는 강력한 혈관수축 작용으로 혈압을 상승시켜 고혈압의 주된 원인이 되며 이러한 ACE 활성의 저해요소로는 메밀 에 많이 포함된 rutin과 저분자 peptide, 그리고 녹차에 함유 되어있는 catechin 등 polyphenol 성분이 대표적이다(23). 이러한 ACE의 작용을 억제하기 위하여 노간주나무 추출물 의 저해효과를 측정한 결과 500 μg/mL 농도에서 열수추출 물은 75.39%, 에탄올추출물은 71.25% 저해활성을 나타내 었다(Fig. 2). 이는 Xu 등(30)이 보고한 ethyl acetate 분획물 이 2 mg/mL와 1 mg/mL 의농도에서 62.03%, 46.97% 나타난 것과 비교하여 노간주 추출물의 효능이 높음을 알 수 있었다.
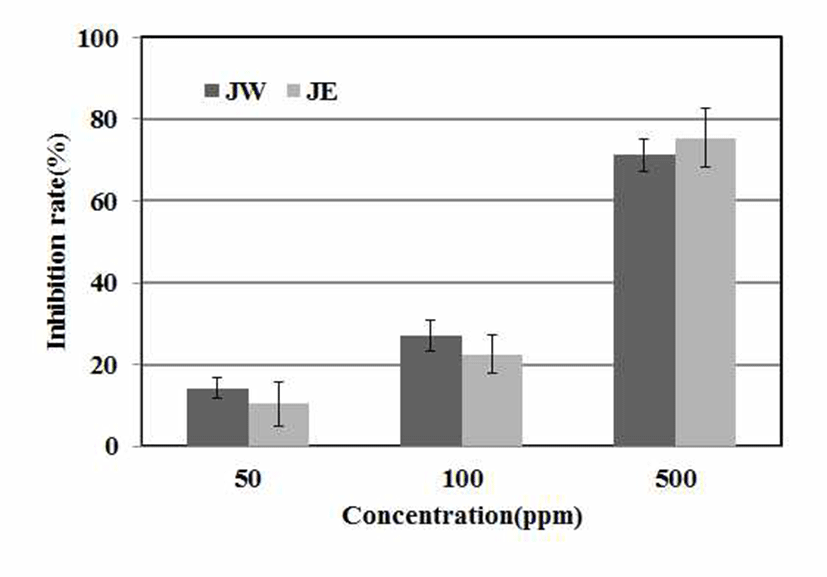
 JW: J. rigida Sieb. extracted with water,
JW: J. rigida Sieb. extracted with water,  JE: J. rigida Sieb. extracted with ethanol. Result are means ± SD of triplicate data.
JE: J. rigida Sieb. extracted with ethanol. Result are means ± SD of triplicate data.
지질 산화과정에서 생성되는 peroxy radical과 반응하여 불활성물질(inactive products)을 형성하고 그로 인해 free radical에 의한 연쇄 반응을 중단시킨다는 β-carotene은 주 로 lipoprotein과 같은 지방친화성 구조의 내부에 존재하면 서 singlet oxygen을 효과적으로 억제하는 것으로 알려져 있다(16). 노간주나무 추출물의 지용성 물질에 대한 항산화 력을 측정하기 위해 PF를 측정하였다. PF를 측정한 결과 열수추출물에서는 1.4 PF, 에탄올 추출물에서는 2.1 PF로 우수한 항산화력이 있는 것으로 확인되었다(Fig. 3). 이는 Jo 등(31)의 연구에서 열수 추출물에서 2.0 PF값과 에탄올 추출물에서 1.2 PF값을 나타낸 것과 비교하여 노간주 추출 물의 항산화력이 우수한 것으로 확인되었다.
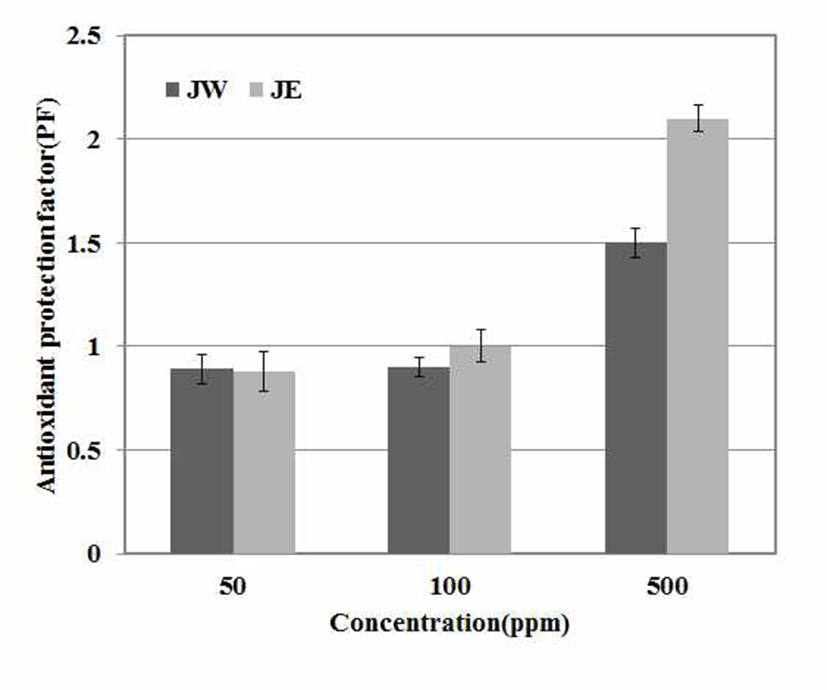
 JW: J. rigida Sieb. extracted with water,
JW: J. rigida Sieb. extracted with water,  JE: J. rigida Sieb. extracted with ethanol. Result are means ± SD of triplicate data.
JE: J. rigida Sieb. extracted with ethanol. Result are means ± SD of triplicate data.
지방산패도를 나타내는 TBARS값은 TBA시약과 반응하 여 붉은색을 띄는 malondialdehyde (MA)의 생성량을 나타 낸 것이다(17). 불포화 지방산이 자동산화 하는 과정 중 지방산화의 2차 산물인 MA가 생성된다. 이에 노간주 추출 물의 MA생성 억제활성을 알아본 결과 500 μg/mL 함량에서 열수추출물은 55.78%, 에탄올추출물은 71.48%의 항산화 효과를 나타내었으며, 이러한 결과로 볼 때 추출물의 첨가 농도가 높아질수록 농도 의존적으로 항산화 효과도 증가함 을 알 수 있었다(Fig. 4). 생체 내에서 세포막에 존재하는 인지질 및 당지질과 혈관에 존재하는 지질은 산소와 결합하 여 과산화류, keton류 등을 생성하여 DNA를 손상시켜 암을 유발하기도 하며, 세포의 노화를 일으키는 것으로 알려져 있는데(32), 노간주 추출물이 지방 자동 산화 과정 중 생성 되는 2차 대사산물의 생성을 억제하는 것으로 확인되어 항산화 소재로 활용가능 할 것으로 보인다.
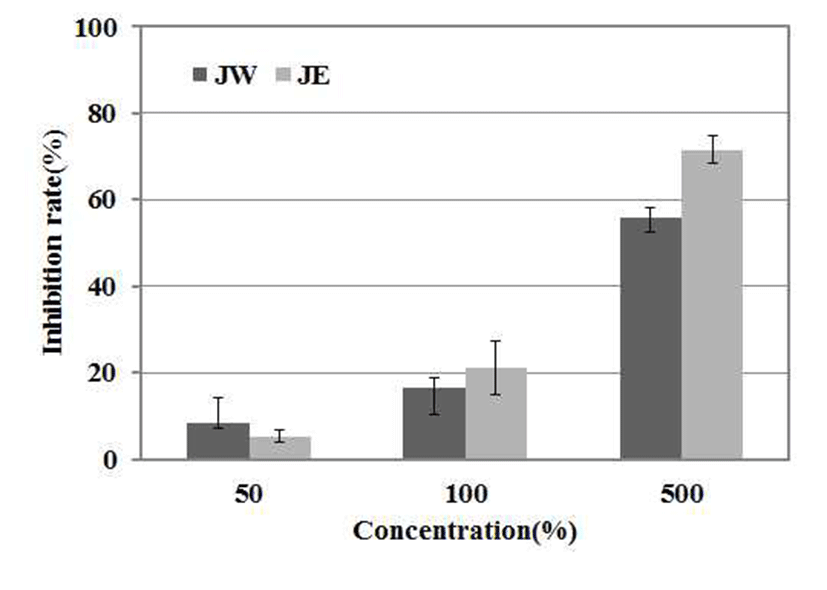
 JW: J. rigida Sieb. extracted with water,
JW: J. rigida Sieb. extracted with water,  JE: J. rigida Sieb. extracted with ethanol. Result are means ± SD of triplicate data.
JE: J. rigida Sieb. extracted with ethanol. Result are means ± SD of triplicate data.
α-glucosidase는 brush-border membrane에 존재하는 소화 효소로 이당류나 다당류를 단당류로 가수분해하는 역할을 한다. α-glucosidase 저해제는 탄수화물 식이 후 혈당 상승을 억제할 수 있는데 이는 활성물질이 α-glucosidase에 경쟁적 으로 결합하여 효소 활성을 억제함으로서 장내에서 당질의 소화와 흡수를 지연시켜 급격한 혈당의 상승과 불필요한 인슐린의 분비를 억제하기 때문이다(33). 본 실험에서는 500 μg/mL 농도에서 열수추출물은 48.39% 에탄올 추출물 의 경우 78.14 %로 Yin 등(34)이 보고한 6년근 황기에탄올 추출물의 500 μg/mL의 농도에서 24.59 %의 효능을 나타낸 것과 비교하여 높은 저해율을 보여 기능성 소재로 활용할 수 있을 것으로 기대된다(Fig. 5).
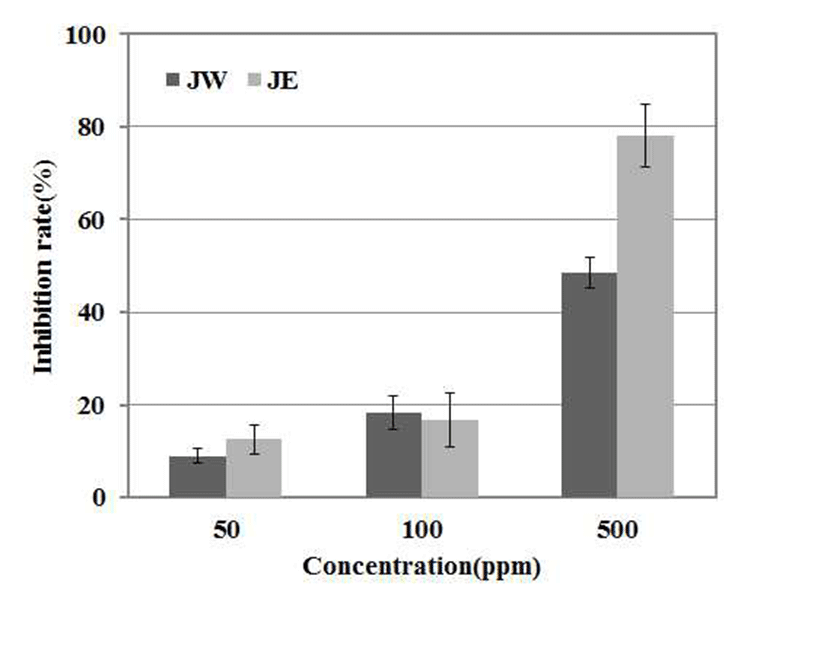
 JW: J. rigida Sieb. extracted with water,
JW: J. rigida Sieb. extracted with water,  JE: J. rigida Sieb. extracted with ethanol. Result are means ± SD of triplicate data.
JE: J. rigida Sieb. extracted with ethanol. Result are means ± SD of triplicate data.
α-amylase는 탄수화물의 α-D-(1,4)-glucan 결합을 분해하 는 효소이고, α-glucosidase 소장 상피세포의 brush-border membrane에 존재하는 효소로서 소장에서 음식물 중의 전 분을 포도당과 같은 단당으로 분해하여 흡수시킨다(33). 따라서 소장의 α-amylase와 α-glucosidase를 저해함으로서 포도당의 흡수를 지연시킬 수 있어 α-amylase와 α -glucosidase의 저해활성은 혈당수치 상승억제의 지표로서 사용된다(35). 노간주나무 추출물의 α-amylase 저해활성을 검토한 결과 500 μg/mL 농도에서 열수추출물은 87.59%, 에탄올추출물은 98% 저해 활성을 보였다(Fig. 6). 이는 Xu 등(30)이 보고한 500 μg/mL의 농도에서 14.62 %와 비교하 여 높은 저해율을 보여 기능성 소재로 활용 가능성을 제시 한다.
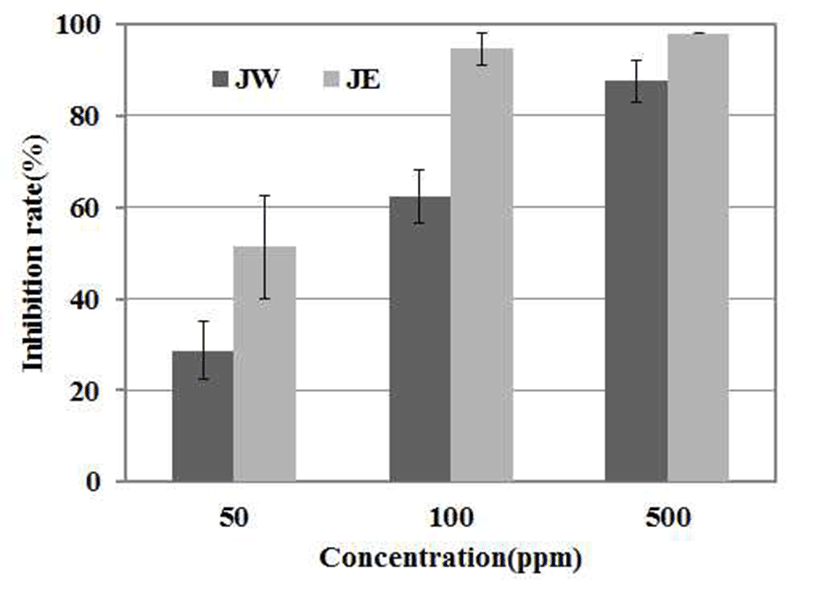
 JW: J. rigida Sieb. extracted with water,
JW: J. rigida Sieb. extracted with water,  JE: J. rigida Sieb. extracted with ethanol. Result are means ± SD of triplicate data.
JE: J. rigida Sieb. extracted with ethanol. Result are means ± SD of triplicate data.
요 약
본 연구에서는 노간주나무 추출물의 항산화 및 α -amylase와 α-glucosidase을 조사하여 항산화소재로 이용하 고자 실험하였다. 노간주나무 추출물의 항산화효과를 살펴 보기 위하여 총 폴리페놀 함량을 측정한 결과 열수추출물은 71.3mg/g, 에탄올추출물은 116.0 mg/g 함량을 포함하고 있 었으며, 플라보노이드 함량은 열수추출물은 17.7 mg/g, 에 탄올추출물은 76.4 mg/g 함량을 포함하고 있었다. ABTS 라디칼 소거능을 측정한 결과 500 μg/mL 농도에서 열수추 출물은 76.4%, 에탄올 추출물은 79.3% 라디칼 소거능을 나타내었다. FRAP 값을 측정한 결과 열수추출물에서 1.83 mM를 에탄올추출물에서 1.77 mM로 열수추출물에서 더 높은 효과를 나타내었다. ACE 활성억제효과는 500 μg/mL 농도에서 열수추출물 75.39%, 에탄올 추출물 71.25%로 저 해율을 나타내었다. 노간주나무 추출물의 antioxidant protection factor를 측정한 결과 열수추출물의 경우는 1.5 PF, 에탄올추출물의 경우는 2.1 PF를 나타내었다. TBARS 저해율은 500 μg/mL 농도에서 열수추출물과 에탄올추출물 각각 55.78%와 71.48%을 나타내었다. α-glucosidase와 α -amylase 저해효과를 측정한 결과 500 μg/mL 농도에서 각 각 70%와 90% 이상의 저해효과를 나타내어 항산화 및 항당 뇨 예방물질 소재로의 활용이 가능할 것으로 판단된다.










