서 론
연꽃(Nelumbo nucifera Gaertner)은 수련과의 여러살이해 수상 식물로서 East indian lotus 및 Chinese water lily라고 불리며, 연꽃의 잎을 연잎 또는 하엽이라 하고, 연꽃의 수술 을 연수, 연꽃씨앗을 연자육(Nelumbinis Semen), 연꽃뿌리 를 연근(lotus root, Nelumbinis Rhizoma), 연꽃의 꽃봉우리 를 연화(lotus flower)라고 한다(1). 식품원재료 데이터베이 스에 의하면, 연잎, 연근, 연화는 식품원료로 사용이 가능하 며 특히 연화를 이용하여 전통적인 가양주 방식에 의해 제조된 연화주는 17세기부터 제조된 것으로 알려져 있다 (1,2).
연꽃에 대한 연구로는 연꽃추출물이 6가 크롬으로 유도 된 세포독성에 대한 보호효과(3), 연꽃수술추출물이 과산 화수소로 손상된 배양 인체피부흑색종세포에 대한 항산화 효과 및 멜라닌화 방어효과(2), 활성산소종인 glucose oxidase로 손상된 배양 C6 Glioma 세포에 미치는 항산화효 과(4), tyrosinase 활성억제 및 멜라닌 생성억제의 의한 미백 효과(1), UVB 자외선 조사에 의한 각질형성세포의 보호 및 피부 노화방지(5) 등 주로 항산화활성에 연관된 연구가 주로 보고되었다. 이들 항산화활성은 연꽃에 함유되어 있 는 quercetin, luteolin, isoquercitrin, luteolin glucoside, kaepferol-3-diglucoside등의 bioactive compounds에 의한 것 으로 알려져 있다(6-8). 또한, 연꽃 및 연근은 오래전부터 강심, 수렴, 지사, 불면증 등의 치료에 처방되었을 정도로 건강식품으로 오랫동안 이용되어 왔다(1,5).
하지만, 연화 및 연화주에 대한 식품학적인 관점에서의 연구는 매우 미흡하여 연화 및 연화주의 일반성분, 아미노 산, 무기질, 비타민, 지방산 등에 대한 영양성분 분석과 라디 칼 소거능을 기초로 한in vitro 항산화 활성, 이들에 함유된 항산화성분에 대한 연구는 거의 전무한 실정이다.
따라서, 본 연구에서는 연화 및 전통주 방식으로 제조된 연화주에 대하여 영양성분 분석을 실시하고, 연화를 80%에 탄올 및 열수로 각각 추출한 후, 이들 추출물에 대한 항산화 성분(총 페놀 및 총 플라보노이드 함량), in vitro 항산화활성 (DPPH radical scavenging, ABTS radical scavenging, FRAP activity, reducing power, oxygen radical absorbance capacity) 을 평가하여 식품학적 기초자료를 제공하고자 한다.
재료 및 방법
본 연구에 사용된 연화는 국내산 경북 칠곡(Chilgok, Korea)에서 2013년도에 수확한 것을 사용하였다. 일반성 분, 아미노산, 유리당, 지방산, 무기질, 유기산 등의 식품학 적 성분분석에는 연화 원물을 세척한 후 사용하였고, 항산 화활성의 평가는 연화를 동결건조 한 후, 조분쇄하여 연화 분말에 약 10배의 80% 에탄올 및 증류수를 각각 첨가하고 80∼100℃ 수욕 상에서 3시간동안 환류냉각하면서 3회 반 복 추출하였다. 각각의 조추출물은 4℃에서 방냉한 후, Whatman No. 3 여과지로 여과하고 10,000×g로 원심분리하 여 50℃에서 감압농축 한 후 동결건조 하여 연화 80% 에탄 올 추출물 및 연화 열수 추출물을 제조하였다(9). 추출물의 수율은 원료 대비 고형분의 양으로 계산하였다. 한편, 연화 주는 전통주 제조방법(10)에 따라 6-7월에 수확한 연화(총 량 대비 5%)에 누룩, 찹쌀:백미(6.7:3.3)를 첨가한 후 100일 간 저온숙성 시킨 것으로 밑술을 담근 지 3일 후 효모와 효소균을 생성시키고 다시 3일 후 1차 덧술을 담근 후 찹쌀: 백미 고두밥을 쪄서 술에 넣어 2차 덧술을 담그는 ‘3양주’ 주조법으로 제조하였다. 전통방식으로 제조한 연화주는 약 16%의 알코올을 함유한다.
AOAC법(11)에 따라 수분은 105℃ 상압건조법, 조지방 은 soxhlet 추출법, 조단백은 semi micro kjeldahl법, 조회분 은 550℃ 회화법으로 정량하였다. 탄수화물은 100에서 조 지방, 조단백, 조회분을 뺀 값으로 하였다.
아미노산 함량 분석은 AccQ․Tag 방법(12)을 이용하여 분석하였다. 시료 약 0.2 g을 정확히 취하여 50 mL 앰플에 넣고 6 N HCl 15 mL를 가한 다음 N2로 치환하여 신속하게 밀봉하였다. 이를 110℃ 오븐에서 24시간 가수분해 시킨 뒤 방냉하여 50 mL 정용플라스크에 옮기고 탈이온수로 정용한 후 0.2 μm membrane 필터로 여과하였다. AccQ․ Fluor Reagent Kit를 사용하여 유도체화 시켜 구성 아미노산 을 분석하였다. 즉, 여과된 유리 아미노산 시료 10 μL를 시험관(Φ 6×50 mm) 밑바닥에 취하고 여기에 AccQ․Fluor Reagent Kit의 1용액 70 μL를 넣어 혼합하였다. 여기에 미리 55℃에서 반응시킨 2A 용액 20 μL를 넣어 재혼합하였고, 이를 실온에서 1분간 방치한 후 55℃에서 10분간 유도체화 시킨 다음 HPLC로 유리 아미노산을 측정하였다. 분석에 사용한 아미노산 표준물질은 amino acid standard H(Pierce Co., Rockford, IL, USA)이고, 칼럼은 AccQ Tag column(3.9 x 150 mm, Waters, Milford, MA, USA), 검출기는 fluorescence(Ex=250 nm, Em=395 nm, JASCO, Tokyo, Japan)이고 분석온도는 37℃이었다.
시료 5 g에 80% 에탄올 145 mL을 넣고 90℃ 항온수조에 서 2시간 동안 환류 추출한 후 10,000×g에서 10분 동안 원심분리하여 얻은 상등액을 적당히 농축시켜, 0.25 μm membrane 필터로 여과한 후 HPLC로 분석하였다(13). 유리 당 표준시료는 fructose, sucrose, glucose 및 maltose(Sigma Co., St. Louis, MO, USA)를 사용하였고, 칼럼은 carbohydrate analysis column(300 x 3.9 mm, Waters), 검출기 는 RI, 시료주입은 10 μL이었다.
지방산 분석은 gas chromatography를 이용하여 측정하였 다. 우선, 지방질은 soxhlet 추출법(11)으로 추출하고 AOAC 법(14)에 따라 50 mL의 둥근플라스크에 지방질 200 mg을 취하여 0.5 N NaOH/MeOH를 넣고 환류냉각기를 부착한 다음 지방구가 없어질 때까지 가열된 모래상자에서 5-10분 간 가수분해 시켰다. 10% BF3/MeOH 5 mL을 환류냉각기 위로 천천히 넣어 2분간 모래상자에 방치하여 반응시켰다. 다시 5 mL 헥산을 환류냉각기 위로 넣어 1분간 반응시키고 냉각관에서 분리하여 반응플라스크에 포화식염수 15 mL 을 넣고 마개를 막은 상태에서 5초간 가볍게 흔들어 준 후 포화 식염수를 추가로 넣어 헥산층이 플라스크 목까지 올라오도록 하였다. 헥산층을 뽑아 무수황산나트륨이 들어 있는 파스퇴르 피펫을 통과시켜 탈수시키고 탈수된 시험액 을 gas chromatography에 주입하여 분석하였다. 사용한 칼 럼은 HP-INNOWax(30 m × 0.25 mm × 0.25 μm film thickness, Hewlett-Packard, Wilmington, DE, USA) 검출기 는 불꽃이온화 검출기, 주입기 온도는 220℃, 검출기 온도는 275℃, 오븐의 온도는 50℃/3min-10℃/min-250℃/5min, 운 반기체는 헬륨이었다.
무기질 분석은 유도결합 프라즈마 원자방출 분광법을 이용하여 측정하였다. 무기질의 전처리 방법은 건식법(15) 으로 하였다. 즉, 시료 약 2 g을 도가니에 넣고 전열기에서 예비 가열시킨 후 550℃ 전기 회화로에서 6시간 회화한 다음 방냉 하였다. 여기에 탈이온수 10방울을 가하고 묽은 질산(1:1 HNO3) 4 mL를 넣은 다음 다시 전열기(120℃)에서 수분을 제거시키고 550℃ 전기 회화로에서 1시간 회화․방 냉하였다. 여기에 묽은염산(1:1 HCl) 10 mL를 첨가한 다음 이를 50 mL 정용플라스크로 옮겨 탈이온수로 정용, 여과하 여 유도결합 프라즈마 원자방출 분광법(ICP-AES, Inductively Coupled Plasma Atomic Emission Spectrophotometer, Jobin Yvon JY138 Ultrace, Longjumeau, France)으로 분석하였다. 각 원소의 표준용액은 0, 1, 10 ppm의 3수준의 농도로 조제 하여 표준검량곡선을 작성하였으며 이때, ICP-AES의 작동 조건은 power: 1.0 KW for aqueous, nebulizer pressure: 3.5 bar for meingard type c, aerosol flow rate: 0.3 L/min, shealth gas flow: 0.3 L/min, cooling gas: 12 L/min 이었다. 각 무기질 의 검출 파장은 Ca: 393.366, Mg: 279.553, Mn: 257.610, Se: 196.060, Na: 588.995, K: 766.491, Fe: 238.204, P: 213.618, Cu: 324.754 및 Zn: 213.856 nm이었다.
유리당 분석은 Park 등(16)에 방법을 변형하여 시료 1 g을 취하여 cap이 달린 삼각플라스크에 넣고 증류수 15 mL를 가하여 80°C 항온수조에서 4시간 동안 가열한 다음 3,000 rpm에서 20분간 원심분리한 후에 상등액을 0.45 μm membrane filter로 여과한 후 HPLC로 분석하였다. Column 은 ROA-Organic acid(300×7.8 mm, 8 μm)를 사용하였으며, 이동상은 0.005 N H2SO4로 하여 0.5 mL/min로 분석하였다. 이때 oven temp.는 30°C이었고, UV-VIS detector 210 nm에 서 분석하였다.
총 페놀 함량은 Folin-Ciocalteu's phenol reagent가 시료의 페놀성 화합물에 의해 몰리브덴 청색으로 환원되는 원리로 측정하였다(17). 각 시료 1 mL에 10% folin-ciocalteu's phenol regent 1 mL 및 2% Na2CO3 용액을 1 mL을 첨가하여 혼합한 후 상온에서 1시간 동안 방치하였다. 그리고 상등액 을 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 750 nm에서 흡광도를 측정하였다. 표준 물질은 gallic acid를 이용하였으며 표준 검량 곡선 (y=16.785x-0.0343, R2=0.9971)으로부터 총 페놀 함량을 계 산하였다.
총 플라보노이드 함량은 Moreno 등(18)의 방법을 변형하 여 비색 정량하였다. 각 시료 0.5 mL에 95% 에탄올 1.5 mL, 10% aluminum nitrate 0.1 mL, 1 M potassium acetate 0.1 mL 그리고 증류수 2.8 mL를 첨가하여 혼합한 후 상온에 서 30분간 정치하여 반응시킨 다음 microplate reader로 415 nm에서 흡광도를 측정하였다. 플라보노이드 함량은 quercetin을 이용하여 작성한 표준 검량 곡선(y=3.0534x -0.0005, R2=0.9998)으로부터 함량을 구하였다.
DPPH 라디칼 소거능 측정은 Stagos 등(19)의 방법을 변 형하여 측정하였다. 시료 0.2 mL에 에탄올로 용해한 0.4 mM DPPH 용액 0.8 mL을 첨가하여 혼합한 후 상온에서 10분간 반응하였다. 그리고 microplate reader를 사용하여 490 nm에서 흡광도 값을 측정한 후 다음 식을 이용하여 결과 값을 나타내었다.
ABTS radical 소거능은 Custódio 등(20)의 방법을 변형하 여 측정하였다. 7 mM ABTS와 2.45 mM potassium persulphate를 혼합한 후, 암소에서 16시간 방치하여 양이온 ABTS+을 형성시켰다. 다음 734 nm에서 흡광도의 값이 1.7 이하가 되도록 보정하여 ABTS 용액을 제조하였다. 농도별 로 희석된 시료를 10 μL씩 1.5 mL tube에 취하고 ABTS 용액 1 mL을 첨가하여 30분 동안 반응시킨 다음, microplate reader를 이용하여 734 nm에서 흡광도를 측정하였다. ABTS radical 소거능은 다음 식에 의하여 값을 백분율로 나타내었다.
FRAP은 Biglari 등(21)의 방법을 변형하여 측정하였다. 0.3 M sodium acetate buffer(pH 3.6), 10 mM TPTZ 및 20 mM FeCl3ㆍ6H2O를 제조하여 실험직전에 10:1:1의 비율로 혼합하여 FRAP용액을 제조하였다. 다음 FRAP용액 1.5 mL 에 시료 50 μL, 증류수 150 μL를 첨가한 후 37℃에서 4분간 반응시킨 후, microplate reader를 이용하여 593 nm에서 흡 광도를 측정하였다.
Reducing power는 Jayaprakasha 등(22)의 방법을 변형하 여 측정하였다. 시료 0.5 mL에 0.2 M phosphate buffer(pH 6.6) 및 1% potassium ferricyanide를 각각 2.5 mL씩 첨가하 여 혼합한 후 50℃에서 20분간 반응시켰다. 다음 10% TCA 용액 2.5 mL을 첨가하여 1,790×g에서 10분간 원심분리 후 상등액 2.5 mL을 취하여 증류수 2.5 mL과 ferric chloride 0.5 mL을 첨가하여 혼합한 후 microplate reader를 사용하여 700 nm에서 흡광도를 측정하였다.
본 실험에서 시료, 표준물질의 농도별 희석 및 시약의 제조는 75 mM phosphate buffer(pH 7.4)를 이용하였다. Black well plate에 시료 25 μL, 40 nM fluorescein 150 μL를 첨가하고 측정 직전에 144 mM AAPH 25 μL를 첨가한 다음 fluorescence microplate reader(Spectramax GEMINI EM, Molecular Devices, Sunnyvale, CA, USA)를 이용하여 485 nm에서 전자여기 후 530 nm에서 방출되는 조건으로 37℃ 에서 90분간 3분마다 fluorescence의 감소율을 측정하였다. 결과 값은 시료 첨가구와 무 첨가구의 area under curve(AUC)값을 나타낸 후 Trolox를 이용하여 작성한 검량 선(y=1.6079x+0.917, R2=0.9912)에 대입하여 나타내었다 (23).
결과 및 고찰
연화 및 연화주의 일반성분을 분석한 결과(Table 1), 연화 및 연화주의 수분함량은 각각 85.90 및 92.87%이었다. 조회 분 함량은 각각 1.04 및 0.15%, 조단백질 함량은 1.91 및 1.70%, 조지방 함량은 0.30 및 0.11%, 탄수화물 함량은 10.85 및 5.17%이었다. 연화 및 연화주의 아미노산 조성은 Table 2와 같이, 연화의 총 아미노산 함량은 2,167.7 mg/kg 이었고 필수 아미노산은 성인기준으로 histidin을 제외한 valine, leucine, isoleucine, threonine, phenylalanine, lysine, methionine 및 tryptophane의 함량이 484.9 mg/kg으로 전체 아미노산 함량의 약 22.4%를 차지하였다. 연화주의 경우, 총 아미노산 함량은 6,315.2 mg/kg이었고, 필수 아미노산 함량은 1,714.1 mg/kg으로 전체 아미노산 함량의 약 27.1% 로 나타났다. 한편, 아미노산 중에서 glutamine이 연화 및 연화주 각각 603.6 mg/kg, 1,410.1 mg/kg으로 가장 많이 함유되어 있었다. 연화는 asparagine, serine 순으로 함량이 높았으며 arginine 및 glycine 등은 미량 함유된 것으로 나타 났다. 반면, 연화주는 glutanime 다음으로 arginine, leucine 순으로 높은 함량을 보였으며 cystine은 비교적 낮은 함량을 보였다.
| Moisture (%) | Crude ash (%) | Crude protein (%) | Crude fat (%) | Carbohydrate4) (%) | |
|---|---|---|---|---|---|
| LF1) | 85.90±0.253) | 1.04±0.04* | 1.91±0.02* | 0.30±0.01* | 10.85 |
| LF wine2) | 92.87±0.32* | 0.15±0.02 | 1.70±0.01 | 0.11±0.01 | 5.17 |
연화 및 연화주에 함유된 fructose, glucose, sucrose, lactose, maltose 및 sucrose의 유리당 함량을 분석한 결과는 Table 3과 같이, 연화에는 fructose가 0.14 g/100 g 함유되어 있었고 glucose는 0.09 g/100 g 함유되어 있었으며 lactose, maltose 및 sucrose는 검출되지 않았다. 반면, 연화주에는 glucose 1.85 g/100 g이 함유되어 있었으며 fructose, lactose, maltose 및 sucrose는 검출되지 않았다. Table 4는 연화 및 연화주의 지방산 조성으로 연화는 palmitic acid(C16:0)가 약 38.63%로 가장 높았고, linoleic acid(C18:2n6c) 및 eicosenoic acid(C20:1)도 각각 약 26.96%, 21.11%를 차지하 였다. 반면, 연화주의 지방산 함량은 oleic acid(C18:1n9c)가 약 76.24%의 비율로 가장 많이 함유되어 있었으며 linoleic acid(C18:2n6c)도 13.50%의 비율로 전체 지방산 중에서 불 포화지방산의 함량이 약 89.74%로 매우 높았다.
| LF1) (g/100g) | LF wine2) (g/100g) | |
|---|---|---|
| Fructose | 0.14±0.013) | ND4) |
| Glucose | 0.09±0.01 | 1.85±0.01 |
| Lactose | ND | ND |
| Maltose | ND | ND |
| Sucrose | ND | ND |
무기질 함량(Table 5)은 연화에서 K이 390.91 mg/100 g으 로 가장 많이 함유되어 있었고, Ca(131.27 mg/100 g), Mg(47.56 mg/100 g) 순으로 나타났다. 연화주에는 K이 27.40 g/100 g으로 가장 많이 함유되어 있었고 Na(17.12 g/100 g), Mg(8.85 g/100 g) 순으로 나타났다. 연꽃의 부위별 무기질 함량을 조사한 Im(24)의 연구에서 연꽃의 주요 무기 질 함량은 Ca, K, Na, Mg, Fe 순의 나타나 연화와는 다른 경향을 보였다. 한편, 연화 및 연화주의 유기산 함량 및 조성을 분석한 결과는 Table 6과 같이 연화는 citric acid(2,222.22 mg/kg)가 가장 많이 함유되어 있었으며 그 다음 malic acid, oxalic acid, lactic acid 순으로 나타났다. 반면 연화주는 lactic acid(5,427.90 mg/kg)가 가장 많이 함유 되어 있었으며 citric acid, acetic acid 순으로 나타났다.
연화 에탄올 추출물(lotus flower ethanol extract, LFE), 연화 열수 추출물(lotus flower water extract, LFW) 및 연화 주 동결건조물(freeze dried lotus flower wine, FLF wine)의 총 페놀 함량과 총 플라보노이드 함량을 분석한 결과 Table 7과 같이 연화 에탄올 추출물 및 열수추출물의 총 페놀 함량 및 총 플라보노이드 함량이 연화주 동결건조물에 비해 높은 것으로 나타났다. 연꽃의 부위별 추출물의 총 페놀 및 총 플라보노이드 함량을 연구한 Lee 등(25)의 결과에 따르면 연꽃 70% 에탄올 추출물에는 약 182.7 mg/g의 총 페놀화합물 및 32.3 mg/g의 총 플라보노이드 함량이 존재한 다고 보고하여 본 연구에서의 연화 에탄올추출물의 총 페놀 (약 76 mg GAE/g) 및 총 플라보노이드(20 mg QE/g)와는 다소 차이를 보였다. 이는 Im 등(26)의 연구에서 백련 4종류 (가람, 초의, 백화건련, 승달)의 열수 및 에탄올 추출물을 이용하여 효능을 비교한 결과, 가람 열수추출물에서 144.2 μg/mL-1로 가장 높은 총 페놀 함량을 나타내었고 다음으로 초의(90.6 μg/mL-1), 백화건련(56.4 μg/mL-1) 및 승달(39.8 μg/mL-1)순으로 나타난 것과 유사한 것으로 연꽃 및 연화 품종 간의 차이로 판단되어진다.
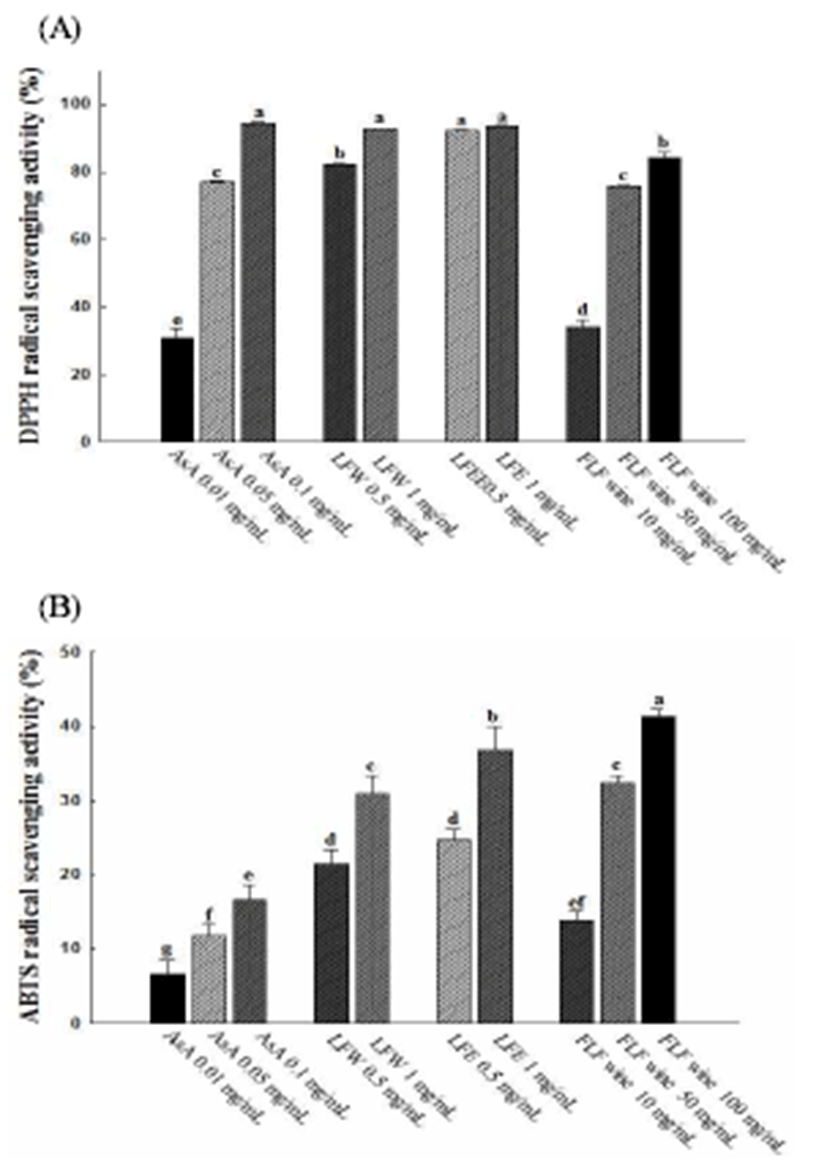
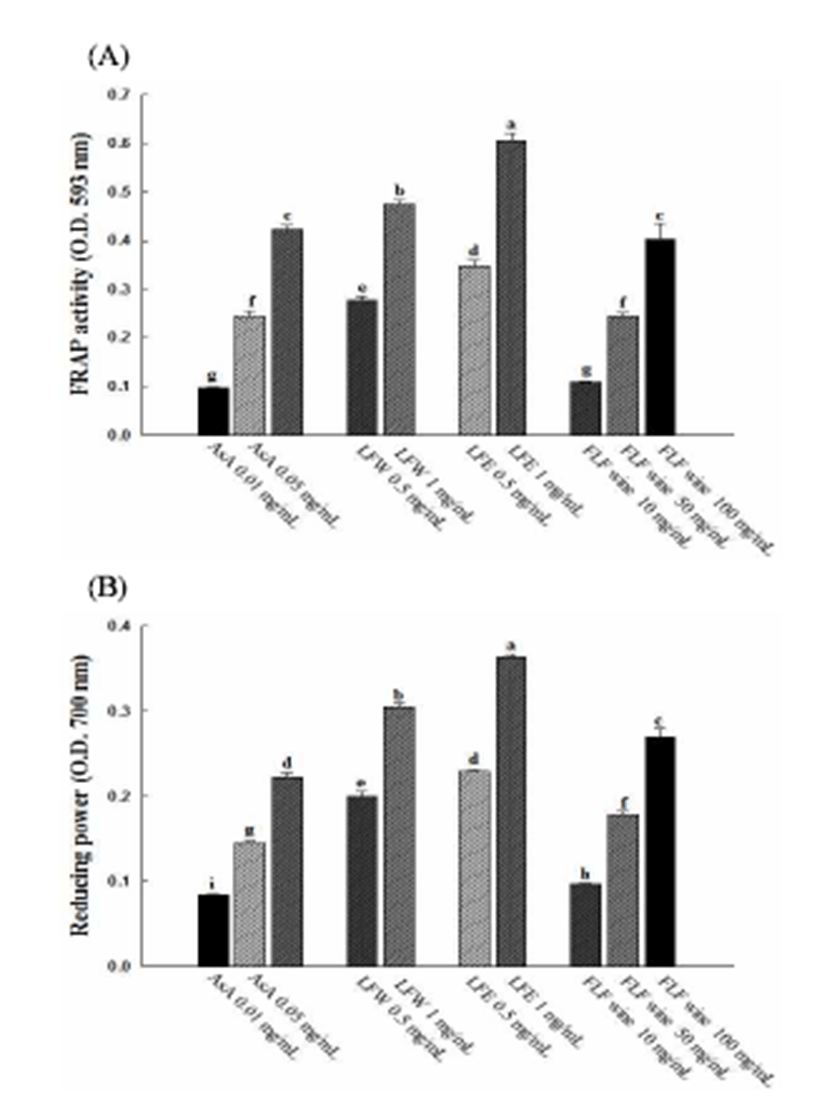
연화 에탄올 추출물, 연화 열수 추출물 및 연화주 동결건 조물에 대한 항산화 활성은 다양한in vitro 항산화활성 평가 모델(DPPH radical scavenging, ABTS radical scavenging, FRAP activity, reducing power, oxygen radical absorbance capacity)에서 실시하였다. Fig. 1은 연화 에탄올 추출물, 연화 열수 추출물 및 연화주 동결건조물의 DPPH radical 및 ABTS radical 소거능을 평가한 결과로서 연화 에탄올 추출물 및 열수 추출물에서 연화주 동결건조물에 비해 높은 활성을 나타내었다. 이는 Jeong 등(27)의 연구에서 총 페놀 함량이 높았던 블루베리 추출물에서 라즈베리 추출물보다 높은 항산화능을 나타낸 것과 유사한 결과로 페놀성 화합물 에 존재하는 hydroxyl group(-OH)에 의한 전자공여능에 기 인한 것으로 판단되어진다. 또한, FRAP activity 및 reducing power의 경우에도 Fig. 2에서와 같이, 연화 에탄올 추출물 및 열수 추출물에서 연화주 동결건조물에 비해 높은 항산화 활성을 보여 DPPH radical 및 ABTS radical 소거능의 결과 와 같은 양상을 나타내었다. 한편, radical chain reaction의 주요단계인 수소 전자 전달과 연관하여 항산화성분의 free radical 소거능을 나타내는 ORAC value는 hydrophobic 성분 과 hydrophilic 성분에 모두 반응하기 때문에 전자전달이론 과 관련된 항산화활성을 보다 수치화 하여 나타낸 것으로 연화 추출물 및 연화주 동결건조물의 측정 결과는 Table 8과 같다. ORAC value는 연화 에탄올 추출 및 열수 추출물 에서 각각 272.9±7.6 및 275.3±2.6 mM TE/g을 나타낸 반면, 연화주 동결건조물에서는 11.5±0.4 mM TE/g의 ORAC value를 나타냈다. Feeney(28)는 성인 일일 ORAC 권장량을 약 3,000 - 5,000 ORAC 지수로 제시한바 연화 및 연화주의 섭취는 체내 산화적 스트레스 저감에 도움을 줄 것으로 판단되었다. 연잎 및 연꽃의 항산화활성은 주로 quercetin, roemerin, liriodenune, leucocyanidin 등과 같은 페놀성 화합 물에 기인한 것으로 알려져 있지만(5), 연화에 대한 페놀성 화합물의 분석 자료는 아직 보고된 바 없어 향후 연화 추출 물에 함유된 bioactive compound의 함량 분석 및 in vivo 모델을 이용한 효능평가가 선행되어야 할 것으로 사료된다.
| Sample | Mean±SD | RSD(%) | |
|---|---|---|---|
| ORAC values (mM TE1)/g) | LFW2) | 275.3±2.6a | 0.9 |
| LFE3) | 272.9±7.6a | 2.8 | |
| FLF wine4) | 11.5±0.4b | 3.6 |
요 약
본 연구는 연화 및 연화주에 대한 식품학적 기초자료를 제공하고자 연화 및 연화주의 영양성분, 항산화성분 및 다 양한 모델에서의 항산화활성을 평가하였다. 연화 및 연화 주의 수분함량은 각각 85.90 및 92.87%이었고, 조회분 함량 은 1.04 및 0.15%, 조단백질 함량은 1.91 및 1.70%, 조지방 함량은 0.30 및 0.11%, 탄수화물 함량은 10.85 및 5.17%이었 다. 연화 및 연화주의 총 아미노산 함량은 각각 2,168 및 6,341 mg/kg 이었고 필수 아미노산은 각각 485 및 2,246 mg/kg으로 전체 아미노산 함량의 약 26.0 및 35.4%이었다. 연화에는 fructose가 0.14 g/100 g 함유되어 있었고 연화주에 는 glucose 1.85 g/100 g이 함유되어 있었으며 지방산 조성은 연화의 경우, palmitic acid(C16:0)가 약 38.63%로 가장 높았 고, 연화주의 경우 oleic acid(C18:1n9c)가 약 76.24%의 비율 로 가장 높았다. 무기질 함량은 연화(390 mg/100 g) 및 연화 주(27.40 g/100 g)에서 모두 K이 가장 높았다. 유기산 함량 은 연화에서 citric acid(2,222 mg/kg)가 가장 많았고, 연화주 는 lactic acid(5,427.90 mg/kg)가 가장 많았다. 한편, 연화 에탄올 추출물 및 열수 추출물의 항산화활성은 연화주 동결 건조물에 비해 높았으며 이는 총 페놀 함량의 결과와 유사 한 경향을 나타냈다. ORAC value는 연화 에탄올 추출 및 열수 추출물에서 각각 272.9±7.6 및 275.3±2.6 mM TE/g을 나타낸 반면, 연화주 동결건조물에서는 11.5±0.4 mM TE/g 로 나타났다. 이상의 연구 결과로부터 연화 추출물은 다양 한 항산화 평가모델에서 항산화 활성을 나타내었으며 전통 방식에 의해 제조된 연화주의 항산화 활성은 연화에 함유된 일부 항산화 성분의 침출에 기인된 것으로 사료되며, 연화 추출물 및 연화주는 체내 산화적 스트레스 저감에 일부 도움을 줄 것으로 판단되었다.










