서 론
뜰보리수(Elaeagnus multiflora)는보리수나무과(Elaeagnaceae), 보리수나무속(Elaeagnus)에 속하며, 국내에서는 주로 관상 용 또는 과수로 재배되거나 야생에 분포하고 있다. 뜰보리 수의 열매는 점핵과이며, 긴 타원형으로 길이가 1.5 cm이고 6~7월 붉은색으로 숙성되고 맛은 다소 떫은맛과 단맛을 가지고 있어 식용이 가능하다. 한방에서는 이 열매를 ‘목반 하’라고 하는데, 그 효능으로는 오장을 보호하고 번열, 소갈 을 없앨 뿐만 아니라 설사와 출혈을 멎게 하고 소화불량, 골수염, 부종, 생리불순 등에 약효가 있다고 알려져 있다 (1,2). 이러한 뜰보리수는 척박한 토질에서 잘 자라며, 농약 이나 화학비료를 주지 않고 특별한 관리도 하지 않아도 잘 성장하며, 무농약, 유기농 과실로 비할 수 있는 과수로 기대되나 현재에는 관상수로 재배할 뿐 과실수로서 재배는 거의 없는 실정이다. 또한 뜰보리수는 한국과 일본 등지에 서만 재배되고 있어 WTO와 FTA에 대응할 수 있는 과수로 서 영양성분과 기능성 물질에 대한 연구와 가공식품 개발과 더불어 육종이 된다면 농산물의 부가가치와 농가소득을 증대할 수 있는 대처 작물로 각광을 받을 것으로 기대된다 (3).
뜰보리수 열매는 영양 가치가 매우 높고 당분은 약 13~ 14%로 주로 포도당과 과당이며, 감에 함유되어 있는 gallic acid, catechin, epicatechin, epigallocatechin, catehin gallate,epicatechin gallate 및 epigallocatechin gallate 등과 같은 polyphenol성 화합물이 다량 함유되어 있어 항산화, 항염증, 항암 및 α-glucosidase 저해 활성이 보고되고 있다(2,4-11). 따라서 고품질의 기능성 식품의 원료로서 활용이 기대되고 있으며 뜰보리수 열매 추출물과 현미식초를 이용한 혼합음 료 제조에 관한 연구만이 보고되고 있다(1,3). 또한 열처리 과정은 물질적인 특징이나 향뿐만 아니라 화학적 구성 등에 많은 변화를 준다. 한편 일부 연구자들에 의해 열처리할 경우 다양한 이화학적 변화에 의해 생리활성물질이 증가한 다는 연구 결과가 발표되면서 이와 관련된 연구가 활발히 진행되고 있다(12).
국내 주류 시장은 큰 변화를 겪고 있으며, 그 중에서 2012 년 와인의 소비는 2000년보다 2.5배 증가한 3.8±107 L를 소비하였다(13).
본 연구는 식품학적 가치가 높으며, 여러 가지 약리성분 을 함유하고 있는 것으로 알려진 뜰보리수 열매를 이용한 가공식품을 개발하기 위한 연구의 일환으로 열처리에 따른 뜰보리수 열매 과즙과 과실주의 특성 및 항산활 활성을 평가하여 보고하는 바이다.
재료 및 방법
본 연구에 사용한 뜰보리수 열매는 2012년 7월에 수확한 것을 경상남도 고성군 소재 영농조합법인 마리오자임에서 제공받아 사용하였다. 뜰보리수 열매 과즙 제조는 Joo 등 (13)의 방법에 준하여 수행하였다. 즉, 뜰보리수 열매를 흐 르는 물에 3회 세척하고 물기를 제거한 후 믹서기(HJ-7000, Hanil, Daejeon, Korea)를 사용하여 갈아서 파쇄한 후 10 L의 플라스틱 용기에 넣은 후 -40℃로 급속 냉동하였다. 이를 40℃에서 급속 해동시켜 펄프와 콜로이드 상태의 액만 을 치즈 크로스로 여과하여 뜰보리수 열매 과즙을 얻었다. 과즙은 -40℃에서 동결 보관하면서 필요에 따라 해동하여 사용하였다.
본 실험에 사용한 미생물 배양용 배지는 Difco사 제품 (Detroit, MI, USA)을 사용하였다. 10개 표준 phenolic acids(gallic acid, p-hydroxylbenzoic acid, protocatechuic acid, vanillic acid, t-cinnamic acid, p-coumaric acid, caffeic acid, ferulic acid, tannic acid 및 salicylic acid)와 7개 표준 flavonols 화합물(catechin, epicatechin, epigallocatechin, catechin gallate, epicatechin gallate, epigallocatechin gallate 및 rutin)는 Sigma Chemical Co.(St. Louis, MO, USA)에서 구입하였다. 10개의 표준 유기산 화합물인 oxalic acid, tartaric acid, malic acid, ascorbic acid, acetic acid, malic acid, citric acid, succinic acid, fumaric acid 및 glutaric acid와 3개 의 표준 유리당 화합물인 fructose, glucose 및 sucrose 역시 Sigma Chemical Co.에서 구입하였다. 한편, High performance liquid chromatography(HPLC)-grade H2O, methanol, acetonitrile 및 glacial acetic acid는 Fisher Scientific(Fairlawn, NJ, USA) 에서 구입하였고 Folin-Cicalteu’s phenol reagent, 2,2- diphenyl-1-picrylhydrazyl(DPPH), 2,2'-Azino-bis(3-ethylbenzothiazoline- 6-sulfonic acid) diammonium salt(ABTS), 2,4,6-tri(2-pyridyl- 1,3,5-triazine)(TPTZ) 및 기타 분석 시약 은 Sigma Chemical Co.에서 구입하였다.
냉장고에서 계대배양 보존한 효모 균주(Saccharomyces cerevisiase CS02)를 50 mL YPD(yeast extract 5.0 g/L, bacto peptone 5.0 g/L 및 dextrose 20 g/L) 액체배지에 효모를 접종 한 후 30℃의 진탕 배양기에서 160 rpm으로 48 hr 종 배양하 여 알코올 발효를 위한 주모로 사용하였다(13). 5 L 발효조 에 설탕으로 24 °Brix로 조정한 3 L 뜰보리수 과즙에 (NH4)HPO4를 0.5% 첨가한 후 뜰보리수 과즙에 존재하는 미생물 살균과 항산화 활성 등의 증가 목적으로 80℃에서 30 min, 100℃에서 30 min 및 120℃에서 30 min간 열처리한 후 종 배양한 주모를 5.0%(v/v) 접종하여 25℃에서 9일간 발효시켰다.
뜰보리수 과즙 및 발효액을 원심분리기(Hanil micro-12, Daejeon, Korea)로 원심분리한 후 상등액을 취하여 굴절당 도계(N-1α, Atago CO., Tokyo, Japan)를 이용하여 가용성고 형물을 측정하였다. 환원당은 Miller(14)의 dinitrosalicylic acid(DNS)법을 사용하여 분석하였다. 과즙 및 발효액을 원 심분리기로 원심분리한 후 상등액을 당 농도가 1.0 g/L 이하 가 되게 희석한 후 여기에 DNS 시약을 1 mL 첨가하여 100℃의 끓는 물에서 10 min 동안 발색시킨 후 냉각하여 분광광도계(Spectronic 2D, Thermo Co., Califonia, CL, USA)를 사용하여 570 nm에서 흡광도를 측정하여 검량선 과 비교하였다. 검량선 작성을 위한 표준물질로는 포도당 을 사용하였다.
pH는 pH meter(MP 220 pH meter, London, UK)를 사용하 여 측정하였다. 알코올 측정은 증류법으로 발효 중에 있는 시료 100 mL에 물 100 mL를 가하여 희석시킨 후 증류시켜 80 mL을 회수한 후 증류수 20 mL를 넣어 100 mL로 표선을 맞춘 다음 알코올계(MT-380, Atago Co., Tokyo, Japan)로 측정하였다.
뜰보리수 과즙 발효 중의 생균수 측정은 발효액을 멸균 증류수로 10단 희석법으로 적당히 희석하고 용융 PCA (plate count agar)와 혼합하는 speared plate method로 접종한 다음 30℃에서 72 hr 동안 배양하여 형성된 효모 집락을 계수하여 생균수를 측정하였다.
유리당과 유기산의 분석은 Joo 등(13)의 방법에 준하여 HPLC(Agilent 1200 series, Agilent Co., Forest Hill, Vic, Australia)를 이용하여 분석하였다. 유리당 분석은 과즙 혹 은 발효액을 원심분리한 후 deionized water(DW)로 적당히 희석한 시료를 sep-pak NH2 칼럼(Waters Co., Milford, MA, USA)과0.45 μm-membrane filter(Dismic®-25CS, Toyoroshikaisha, Ltd., Tokyo, Japan)를 순차적으로 통과시켜 전 처리하였다. 유리당 분석 칼럼(Polyamine II, 4.6±150 mm, 5 μm, YMC Co., Kyoto, Japan)에 전 처리한 시료 20 μL을 주입하고 55℃에서 이동상 용매(acetonitrile:water=75:25(v/v))를 1.0 mL/min 속도로 이동시키면서 reflective index(RI, Agilent 1200 series, Agilent Co.) 검출기 상에서 유리당을 검출하였 다.
유기산 분석은 과즙 혹은 발효액을 원심분리한 후 상등 액을 0.45 μm-membrane filter(Toyoroshikaisha, Ltd.)를 통과 시켜 입자를 제거하였다. 유기산 분석 칼럼(TSKgel ODS-100V, 4.6±250 mm, 5 μm, Tosoh Corp., Tokyo, Japan) 에 전 처리한 시료 20 μL을 주입하고 30℃에서 이동상 용매 (0.1% phosphoric acid)를 1.0 mL/min 속도로 이동시키면서 UV 검출기(Agilent 1200 series, Agilent Co.)의 210 nm에서 측정하였다.
수용성 phenolics 함량은 Folin-Denis법(15)로 측정하였 다. 과즙 및 발효액을 원심분리한 후 100배 희석하고 0.5 mL을 시험관에 분주하고 25% Na2CO3 용액 0.5 mL을 첨가 하여 3분간 정치시켰다. 다시 2N Folin-Ciocalteu phenol 시 약 0.25 mL 첨가하여 혼합한 다음 상온에서 1 hr 동안 정치 시켜 발색시켰다. 발색된 청색을 분광광도계(Spectronic 2D)를 이용하여 750 nm에서 흡광도를 측정하였다. 이때 총 phenolics 함량은 gallic acid를 이용하여 작성한 표준곡선 으로부터 함량을 구하였다.
수용성 flavonoids 함량은 Dvais법(16)으로 측정하였다. 과즙 및 발효액을 원심분리 한 후 10배 희석하고 0.1 mL를 시험관에 분주하고 diethylene glycol 2 mL, 1 N NaOH 0.02 mL를 가한 다음 37℃에서 1 hr 동안 방치하여 발색시킨 후 분광광도계를 이용하여 420 nm에서 흡광도를 측정하였 다. 이때 총 flavonoids 함량은 rutin을 이용하여 작성한 표준 곡선으로부터 함량을 구하였다.
Flavanols 및 phenolic acids의 분석은 Lee 등(11)의 방법에 준하여 HPLC(Agilent 1200 series, Agilent Co.)를 이용하여 분석하였다. Flavanols 및 phenolic acids 분석은 유기산 분석 을 위해 전처리한 시료를 사용하였다.
Flavanols 분석 칼럼(TSKgel ODS-100Z, 4.6±250 mm, 5 μm, Tosoh Co.)에 전처리한 시료 20 μL을 주입하고 40℃에 서 60~100%까지 A 용매 gradient로 10 mM KH2PO4(pH 2.5)(이동상 용매 A)와 100% 메탄올(이동상 용매 B)을 이용 하여 1.0 mL/min의 이동시키면서 30 min간 수행하였다. UV 검출기(Agilent 1200 series, Agilent Co.)의 270 nm에서 측정하였다.
Phenolic acid 분석 칼럼(XTerraTM RP C8, 4.6±250 mm, 5 μm, Waters Co.)에 전처리한 시료 20 μL을 주입하고 30℃ 에서 0~100%까지 B 용매 gradient로 0.5% acetic acid(이동 상 용매 A)와 100% 메탄올(이동상 용매 B)을 이용하여 1.0 mL/min의이동시키면서60 min간수행하였다. UV 검출기 (Agilent 1200 series, Agilent Co.)의 280 nm에서 측정하였다.
Blois(17)의 방법을 약간 변형하여 전자 소거능을 측정하 였다. 1.5±10−4 M DPPH 용액 0.8 mL과 원심분리 한 과즙액 혹은 발효액을 50배로 희석한 후(20 μL/mL) 0.2 mL을 가하 고 10 sec vortex하고 실온에서 30분 방치한 후 분광광도계 를 이용하여 525 nm에서 흡광도를 측정하였다. 음성 대조 구 실험은 시료 대신에 증류수를 0.2 mL를 취하여 실험하였 다. 전자 소거능은 실험구와 음성 대조구의 흡광도 를 구하 여 백분율(%)로 표시하였다.
7 mM ABTs 용액과 2.45 mM potassium persulfate (K2S2O8)을 1:1로 섞고, 실온의 어두운 곳에서 12~16 hr 보관하여 ABTS 라디칼을 생성시켰다. ABTS은 732 nm에 서 흡광도가 0.7±0.02가 되도록 메탄올로 희석하여 사용하 였다. 메탄올로 희석된 ABTS 용액(Abs 0.7±0.02) 0.9 mL과 원심분리 한 과즙 혹은 발효액을 100배 희석한 시료(10 μL/mL) 0.1 mL를 섞고, 정확히 3분 후 분광광도계를 이용하 여 732 nm에서 흡광도를 측정하였다. 음성 대조구 실험은 시료 대신에 증류수를 0.1 mL를 취하여 실험하였다. ABTS 라디칼 소거활성은 실험구와 음성 대조구의 흡광도를 구하 여 백분율(%)로 표시하였다(13).
FRAP 분석은 Cho와 Joo(12)의 방법에 준하여 과즙 및 발효액의 항산화력을 측정하였다. 300 mM sodium acetate buffer(pH 3.6)와 40 mM HCl로 용해시킨 10 mM TPTZ 용액 그리고 20 mM FeCl3 용액을 사용하였다. 미리 제조된 sodium acetate buffer, TPTZ 용액 및 FeCl3 용액을 10:1:1(v/v/v)의 비율로 혼합하여 37℃에서 15 min간 반응시 켜 FRAP 시약을 준비하였다. FRAP 시약 1.5 mL를 50배(20 μL/mL) 희석된 과즙 혹은 발효액 0.05 mL에 혼합하여 섞고, 37℃에서 15 min간 반응시키고 분광광도계를 사용하여 593 nm에서 흡광도를 측정하였다. 음성 대조구 실험은 시료 대신에 3차 증류수를 0.05 mL를 취하여 실험하였으며, FRAP 활성은 흡광도 값으로 표시하였다.
결과 및 고찰
뜰보리수 과실주의 열처리 조건별로 제조된 발효 전・후 이화학적 특징은 Table 1과 같았다. 열처리 조건별 발효 전 pH는 각각 pH 3.17[100℃에서 30 min(100℃)] 열처리 및 3.18[비열처리(대조구), 80℃에서 30 min 열처리(80℃) 및 120℃에서 30 min 열처리(120℃)]에서 발효 후 pH는 각각 3.32(100℃ 및 120℃), 3.33(80℃) 및 3.34(대조구)로 약간 증가하였고 °Brix는 발효 전 24.0°에서 발효 9일째 7.8(대조구 및 100℃), 8.0(100℃) 및 9.0°(120℃)로 감소하였 다. 한편 환원당은 열처리 온도가 증가할수록 환원당 함량 은 증가하여 발효 전 각각 145.66(대조구), 168.33(80℃), 234.42(100℃) 및 294.13 g/L(120℃)에서 발효 후 각각 2.99, 29.84, 29.99 및 31.05 g/L로 감소하였다. 생균수는 열처리구 보다 대조구가 약간 높은 생균수를 나타내었고 발효 전 7.11(대조구), 6.76(80℃), 6.73(100℃) 및 6.65 cfu/mL(120℃) 에서 발효 후 약간 증가하여 각각 7.26, 8.61, 8.72 및 8.73 cfu/mL 있었다.
1) All data are presented as the mean SD of triplicate determinations. Means with different lowercase letters (a, b, c, d, and e) indicate significant differences of fermentation times by Tukey s multiple range test (p<0.05).
2) )NFJEM, nonfermented juice of Elaeagnus multiflora, Elaeagnus multiflora juices were contained 0.5% (w/v) of (NH)4HPO4 and 24 °Brix of sugar.
일반적으로 과실주 발효 시 pH, 가용성고형물 및 환원당 은 감소하고 효모 생균수가 증가함에 따라 알코올 함량 역시 증가하는 것이 과실주 발효의 전형적인 양상으로 알려 져 있다(13,18). 그러나 본 연구에서는 가용성 고형분 및 환원당 감소와 생균수 및 알코올 함량 증가는 과실주 발효 의 전형적인 양상 있었으나, 발효 초기(뜰보리수 과즙) pH 가 너무 낮아 발효 후 약간 증가하는 경향을 보였다. 한편 Jin 등(19)은 발효주의 발효가 진행되면서 유기산과 알코올 이 상호 반응하여 ester와 같은 향 형성에 이용되어 pH가 증가된 것으로 보고하였고 So 등(20)은 단백질 분해로 인한 아미노산과 peptide의 완충작용에 의해 pH가 증가한 것으 로 추정하였다.
열처리 조건별 발효 전 총 유리당 함량은 거의 동일하였 으나, 열처리 온도가 상승할수록 환원당인 fructose와 glucose 함량은 증가하고 비환원당인 sucrose는 감소하였고 발효 후 sucrose는 모두 검출되지 않았다. 특히 대조구의 경우 발효 전 fructose, glucose 및 sucrose는 각각 45.66, 68.41 및 123.32 g/L 있었으나, 120℃에서 30 min간 열처리 한 경우 fructose, glucose 및 sucrose는 각각 91.78, 136.84 및 10.24 g/L 있었고 발효 후에는 유사한 함량을 나타내었 다. 이는 뜰보리수 과즙의 산 조건에서 열처리가 됨에 따라 sucrose가 산가수분해되어 fructose와 glucose로 분해되어 증가된 것으로 판단되었고 발효 후에 유사한 것은 효모의 당 소비에 기인한 것으로 추정되었다. 곶감주(21), 복분자 주(22), 단감 와인(18), 오디 와인(23) 및 대봉감 연시 와인 (13)의 발효 과정 중 효모의 당 이용성이 sucrose, glucose 및 fructose 순인 것으로 보고하여 본 연구결과에서 소량의 fructose와 glucose가 남은 것은 효모의 당 이용성에 기인한 것으로 판단되었다.
열처리 조건별 발효 전 총 유기산 함량은 열처리 온도가 증가할수록 감소하였고 acetic acid는 검출되지 않았으나, 발효 후에는 검출되었고 citric acid, lactic acid, malic acid, oxalic acid, succinic acid 및 tartaric acid 함량이 증가하여 총 유기산 함량도 증가하는 경향을 나타내었다. 특히 대조 구의 경우 발효 전 ascorbic acid, citric acid, fumaric acid, lactic acid, malic acid, oxalic acid, succinic acid 및 tartaric acid는 각각 2.48, 0.39, 0.03, 6.42, 1.44, 0.58, 0.12 및 1.78 g/L 있었나, 120℃에서 30 min간 열처리한 경우 각각 1.67, 0.69, 0.05, 6.01, 0.74, 0.12, 0.77 및 1.54 g/L 있었다. 한편 발효 후 대조구 및 120℃에서 30 min간 열처리에서 acetic acid가 각각 0.82 및 0.78 g/L 검출되었고 이외에 citric acid, lactic acid, malic acid, oxalic acid, succinic acid 및 tartaric acid는 증가하여 각각 0.62(대조구) 및 1.10(120℃), 7.78 및 7.32, 5.12 및 2.59, 1.51 및 0.32, 0.34 및 2.16과 3.38 및 3.08 g/L 있었다. 또한 citric acid는 약 1.6배, lactic acid는 약 1.2배, malic acid는 3.6배, oxalic acid는 2.6배, succinic acid는 2.8배 및 tartaric acid는 약 2.0배 정도 많이 검출되었 다. 이는 효모의 발효 과정에서 tricarboxylic acid cycle (TCA) 회로의 대사 중간체 축적에 기인한 것으로 추정되어 진다. 단감 와인(18)과 오디 와인(23)의 연구결과에서도 malic acid는 2배와 3.7배 증가하였다고 보고하였다. Joo 등(13)은 대봉감 연시 와인의 경우 발효 초기보다 발효 종기 malic acid는 약 3.6배, succinic acid 3배, oxalic acid는 약 2.7배 및 citric acid는 1.5배 정도 증가하였다고 보고하여 본 연구와 유사한 결과를 보였다. 과실주 제조 시 citric acid와 malic acid는 맛에 중요한 성분으로 citric acid는 과실 주의 향에 신선함을 증가시키고 malic acid는 과실주의 신맛 을 부드럽게 만들어 준다. 본 연구 결과 열처리 온도가 상승 함에 따라 뜰보리수 과실주의 citric acid 함량은 높았으나, malic acid 함량은 낮았다. 이는 열처리에 의한 malic acid 생성에 관여하는 젖산균의 사멸에 의한 것으로 추정되어 앞으로 malic acid를 강화를 통한 감산 연구가 더 이루어져 야 할 것으로 판단되었다.
뜰보리수 과즙과 과실주의 항산화 활성은 3 가지의 다른 방법인 DPPH 라디칼 소거활성, ABTS 라디칼 소거활성 및 FRAP 분석을 통하여 평가하였는데 열처리 온도가 상승 함에 따라 항산화 활성은 증가하였고 발효 후에는 감소하는 경향을 보였다(Fig. 2).
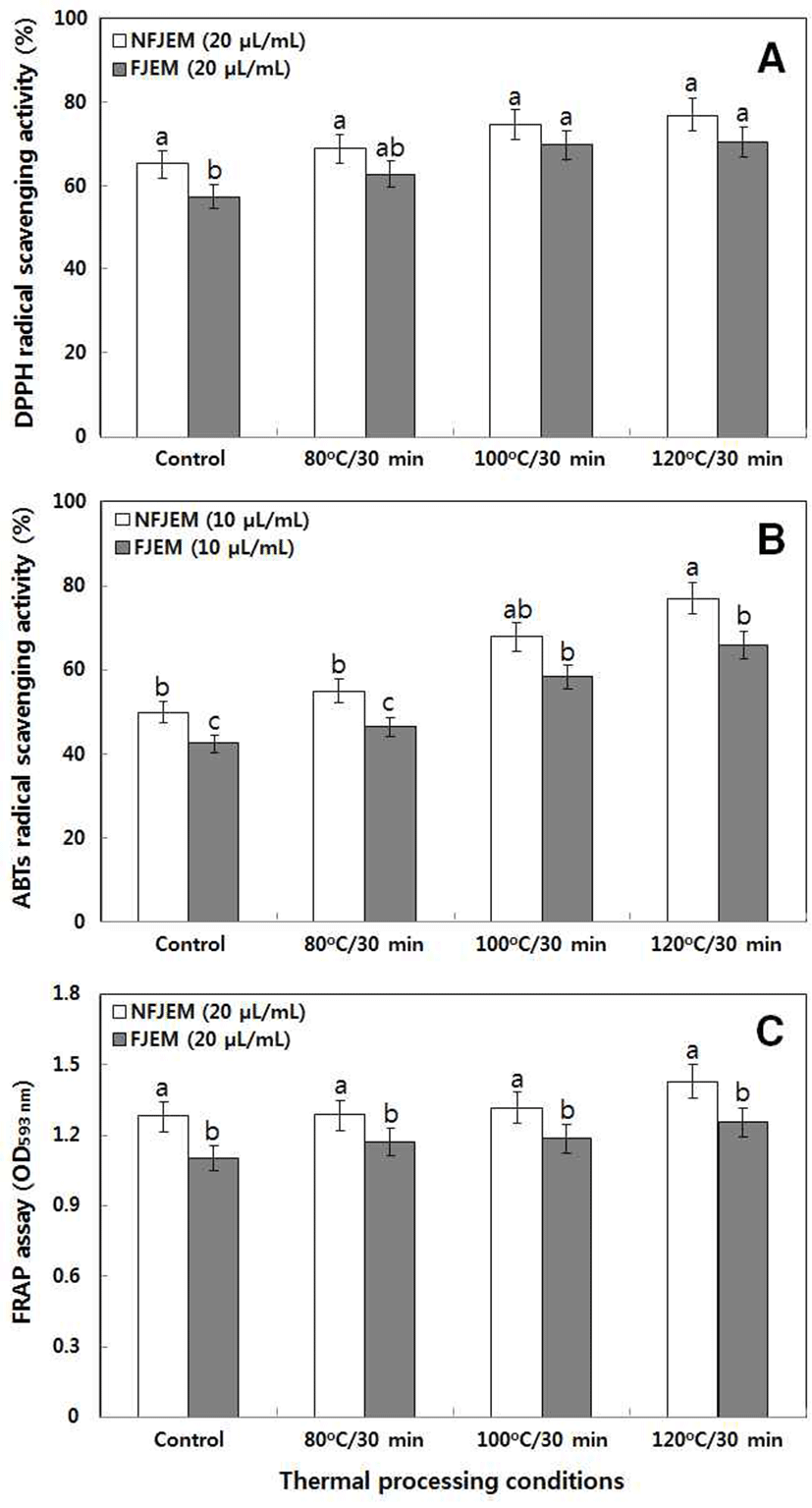
열처리 조건별 발효 전 DPPH 라디칼 소거활성은 각각 65.22(대조구), 68.81(80℃), 74.65(100℃) 및 76.87%(120℃) 에서 발효 후 57.33, 62.77, 69.69 및 70.47%로 감소하였고 ABTS 라디칼 소거활성 역시 발효 전 49.93, 54.87, 67.95 및 76.96%에서 발효 후 42.47, 46.46, 58.27 및 65.95%로 감소하였으며, FRAP 활성은 각각 1.280, 1.284, 1.315 및 1.428에서 1.101, 1.171, 1.185 및 1.254로 감소하였다.
이전에 많은 연구자들에 의해서 다양한 식용 작물들에 대한 열처리 시 원료보다 항산화 활성이 증가한다고 보고하 였다. Kim 등(24)은 5가지 과채류(멜론, 사과, 토마토, 참외 및 수박)의 열처리 후 항산화 활성이 증가하였다고 보고하 였다. 한편 최근 Kim 등(25), Choi 등(26) 및 Cho와 Joo(12) 는 검정콩, 여주 및 자색고구마의 열처리 후 항산화 효과가 증가한다고 보고하였으며, 특히 열처리 온도가 높을수록 온도에 비례하여 항산화 활성이 증가함을 보고하여 본 연구 결과와 일치하였다.
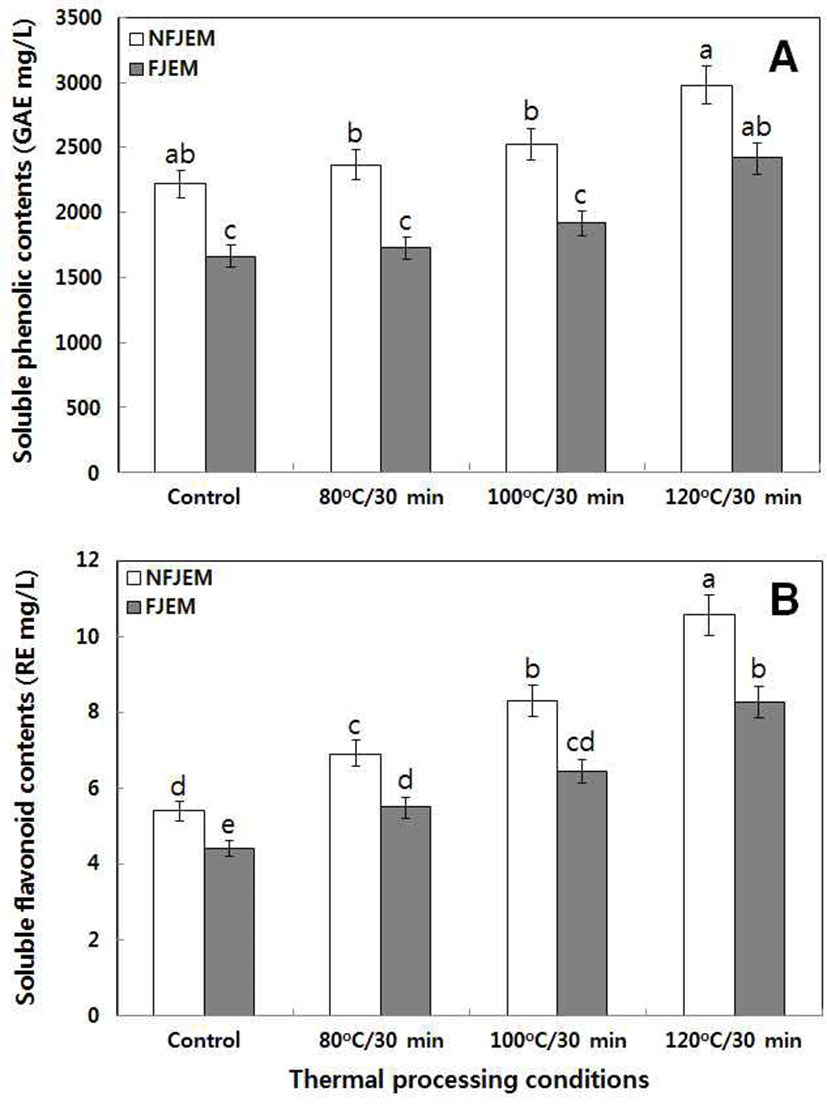
뜰보리수 과실주의 열처리 조건별로 제조된 발효 전・후 수용성 phenolics 및 flavonoids 함량은 Fig. 1과 같았으며, flavonols 및 phenolic acids 함량은 Table 2과 같았다.
1) All data are presented as the mean SD of triplicate determinations. Means with different lowercase letters (a, b, c, d, and e) indicate significant differences of fermentation times by Tukey s multiple range test (p<0.05).
2) )NFJEM, nonfermented juice of Elaeagnus multiflora, Elaeagnus multiflora juices were contained 0.5% (w/v) of (NH)4HPO4 and 24 °Brix of sugar.
열처리 조건별 수용성 phenolics 및 flavonoids 함량은 열처리 온도가 상승함에 따라 함량은 증가하였고 발효 후에 는 감소하였다(Fig. 1). 수용성 phenolics 함량은 발효 전 각각 2214.51(대조구), 2362.68(80℃), 2521.59(100℃) 및 2981.34 GAE mg/L(120℃)에서 1660.13, 1726.31, 1915.72 및 2415.72 GAE mg/L로 감소하였다(Fig. 1A). 또한 수용성 flavonoids 함량 역시 발효 전 각각 5.40(대조구), 6.91(80℃), 8.29(100℃) 및 10.56(120℃) RE mg/L에서 4.40, 5.49, 6.45 및 8.23 REmg/L로 감소하였다(Fig. 1B).
총 flavonols 및 총 phenolic acids 함량 역시 열처리 온도가 상승함에 따라 함량은 증가하였고 발효 후에는 감소하였다 (Table 2). 열처리 온도가 상승함에 따라 6 종의 flavonols 중 3 종의 catechin, epicatechin 및 epigallocatechin는 증가하 였으며, 10 종의 phenolic acids 중 4 종의 gallic acid, p-hydroxylbenzoic acid, protocatechuic acid, salicylic acid 및 vanillic acid는 증가하였으며, 열처리가 되지 않은 대조 구에서는 검출이 되지 않은 ferulic acid가 검출되었다. 한편 발효 후에는 6 종의 flavonols 및 10 종의 phenolic acids 모두 발효 전(과즙)보다는 함량이 감소하였다. 특히 120℃ 에서 30 min 열처리 후 발효시킨 과실주의 경우 catechin, catechin gallate, epicatechin, epigallocatechin, epigallocatechin gallate, epigallocatechin, epigallocatechin gallate, caffeic acid, t-cinnamic acid, p-coumaric acid, ferulic acid, gallic acid, p-hydroxylbenzoic acid, protocatechuic acid, salicylic acid 및 vanillic acid 함량이 가장 높아 각각 99.45, 20.11, 264.55, 17.26, 82.19, 8.81, 1.46, 0.74, 4.03, 5.02, 6.44, 5.92, 10.22, 60.53 및 10.11 mg/L 있었다.
식물체를 열처리할 경우 식물체의 세포막과 세포벽은 붕괴되고 ester 결합으로서 이루어진 결합형 polyphenol성 화합물이 유리형으로 전환된다(12). 뜰보리수 과즙의 총 phenolics 및 flavonoids의 함량 증가는 열처리에 따른 유리 형 phenolics 혹은 flavonoids 함량의 증가에 의한 것으로 추측되며, 이로 인해 항산화 활성 역시 증가한 것으로 판단 되었다. Hwang 등(27)은 배즙의 열처리 조건에 따른 총 polyphenols와 flavonoids 함량 변화를 살펴본 결과 대조구 의 경우 각각 0.23 mg/g 및 1.50 μg/g 이였으며, 열처리 온도 가 높고 시간이 길수록 증가하는 경향을 보였고 총 polyphenols 함량은 150℃에서 1 시간 처리구에서 3.42 mg/g, 총 flavonoids 함량은 150℃에서 4 시간 처리구에서 561.49 μg/g으로 보고하였다. 한편 Kim 등(24)은 5가지 과채 류즙(멜론, 사과, 토마토, 참외 및 수박)의 총 polyphenols와 flavonoids 함량 변화는 열처리 온도가 증가함에 따라 증가 한다고 보고하여 본 연구 결과와 일치하였다. 한편 Lee 등 (11)은 뜰보리수 열매의 주요 화합물로 catechin 유도체 6종 과 gallic acid 등의 7종 phenolic acid를 보고하였으며, 이들 함량이 가장 높은 75% 주정 추출물에서 항산화 활성이 가장 높다고 보고하였다. 특히 catechin 유도체와 gallic acid 는 식품에서 라디칼 소거활성 뛰어난 것으로 알려져 있다 (28,29). 일반적으로 과실주 발효 시 phenolics가 감소하는 것은 phenolics의 산화 분해에 의한 것으로 본 연구의 발효 후 phenolics 혹은 flavonoids 등의 감소는 이들 산화 분해에 의한 것으로 판단되었고 이들의 감소에 따라 발효 후 항산 화 활성이 감소한 것으로 추측되었다. Joo 등(13)은 대봉감 연시 과실주의 경우 catechin gallate과 epicatechin gallate의 함량은 과즙보다 과실주에서 감소한 반면에 gallic acid는 이에 상응하여 증가한다고 보고하였으나, 본 연구에서는 모두 감소하는 경향을 보였는데 이는 과실주 제조 원료의 차이와 발효 과정 중 생성되는 산 생성 정도나 미생물 유래 esterase 등의 효소 활성 차이에 기인한 것으로 추정되었다.
본 연구에서는 뜰보리수 과즙의 열처리 후 과실주를 제 조하고 이화학적 특성, 수용성 phenolics와 flavonoids 함량, flavonols 및 phenolic acids 함량 및 항산화 활성을 조사하였 다. 발효 후 가용성고형물 및 환원당은 감소하였고 효모 생균수와 알코올 함량이 증가하였으며, 유리당은 fructose 와 glucose가 소량 검출되었고 lactic acid 등의 유기산 함량 은 증가하였다. 한편 열처리 후 총 phenolics 및 flavonoids 함량, flavaonols 및 phenolic acids 함량이 현저히 증가하였 고 이에 상응하여 항산화 활성 역시 증가하였으나, 발효 후 이들 함량이 감소함에 따라 항산화 활성 역시 감소하였 다. 따라서 본 연구 결과로부터 뜰보리수 과즙을 이용한 기능성 과실주 제조 가능할 것으로 판단되었다.
요 약
뜰보리수 열매의 이용성 증대를 위하여 뜰보리수 과즙에 열처리 후 과실주를 제조하고 그 특성을 조사하였다. 뜰보 리수 과즙을 발효하였을 때 9일 경과 시 pH는 3.32~3.33, 가용성고형물은 7.8~9.0 °Brix, 환원당은 29.84~31.05 g/L, 생균수는 7.26~8.73 CFU/mL, 알코올은 11.0% 있었다. 열 처리된 과즙이 열처리되지 않은 과즙보다 항산화 활성이 높았으며, 이에 상응하여 수용성 phenolics와 flavonoids 함 량도 높았다. 한편 120℃에서 30 min 열처리 후 발효시킨 과실주의 유리당은 fructose(0.42 g/L) 및 glucose(0.09 g/L) 가 소량 검출되었으며, 주요 유기산은 lactic acid(7.32 g/L), malic acid(2.59 g/L), succinic acid(2.16 g/L) 및 oxalic acid (3.08 g/L) 있었고 주요 flavonols와 phenolic acids 화합물은 catechin(99.45 mg/L), epicatechin(264.55 mg/L), epigallocatechin (82.19 mg/L), gallic acid(6.44 mg/L) 및 salicylic acid(60.53 mg/L)가 검출되었다. 부가적으로 DPPH 라디칼 소거활성, ABTS 라디칼 소거활성 및 FRAP 활성은 각각 70.47%, 65.93% 및 1.254% 이였다. 이 결과로부터 뜰보리수 과즙의 열처리에 따른 새로운 형태의 과실주를 개발할 수 있을 것으로 추측된다.










