ARTICLE
Aspergillus oryzae 발효 청미래덩굴잎 분말차의 관능적 품질 및 항산화능과 xanthine oxidase 및 aldehyde oxidase 저해활성
이상일1, 이예경2, 김순동2, 양승환2, 서주원2,*
Sensory quality, antioxidant, and inhibitory activities of XO and AO of Smilax china leaf tea fermented by Aspergillus oryzae
Sang-Il Lee1, Ye-Kyung Lee2, Soon-Dong Kim2, Seung Hwan Yang2, Joo-Won Suh2,*
Author Information & Copyright ▼
1Department of Food, Nutrition and Cookery, Keimyung College, Daegu 704-703, Korea
2Division of Bioscience and Bioinformatics, College of Natural Science, Myongji University, Yongin 449-728, Korea
*Corresponding author. E-mail:
jwsuh@mju.ac.kr; Phone: 82-31-330-6190, Fax: 82-31-336-0870
© The Korean Society of Food Preservation. . This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Jul 24, 2013; Revised: Dec 13, 2013; Accepted: Dec 18, 2013
Abstract
This study was conducted in order to investigate the optimal fermentation periods of the Smilax china L. leaves as a fermented tea via Aspergillus oryzae for 0 (non-fermented), and 10, 20, and 30 days (NF, F10, F20, F30). It was also observed for its quality characteristics. In the color and spectrum (400~700nm) of 1% tea water extract, NF was light yellow, whereas fermented tea (F10~F30) was light red color, and the F10 among F10~F30 has the clearest color and spectrum. Furthermore, acceptabilities of aroma and brightness were insignificantly different between NF and F10~30, while the mouth feel and overall acceptabilities were insignificantly distinct among all of the fermented teas. Therefore, these results suggest that the appropriate fermentation period for tea fermentation is 10 days. On the other hand, the total polyphenol and flavonoid content in the NF was the highest among all of the fermented teas. In the antioxidant parameters, EDA (electron donating ability), FRAP (ferric reducing antioxidant power), and LPOIA (lipid peroxidation inhibitory activity) in the NF were the highest among all fermented teas. Meanwhile, the XOI (xanthine oxidase inhibitory activity) was low, as well as insignificantly different from NF and F10~F30, whereas the AOI (aldehyde oxidase inhibitory activity) was markedly higher (38.09~41.70%) by the hot water tea extract (with or without fermentation), particularly the AOI that has increased via fermentation. In conclusion, the overall antioxidant activity tended to be reduced by fermentation; however, the EDA, FRAP and LPOIA in the fermented tea for 10 days was higher than the activities during 20~30 days of fermentation. There was a similar result in the color and acceptability of fermented tea for 10 days, which was remarkably better than those of 20-30 days. Therefore, fermented tea from the leaves of Smilax china L. could be expected to be used as a functional tea without the loss of inhibitory activity of both the XO and AO via fermentation.
Keywords: Smilax china L.; fermentation; Aspergillus oryzae; xanthine oxidase; aldehyde oxidase.
서 론
경제개발에 따른 산업화로 인하여 수질을 포함한 환경오 염과 식생활의 서구화 및 운동부족, 대사의 불균형, 각종 스트레스의 증가 등으로 다양한 생활습관병이 크게 증가하 고 있다(1). 이 같은 상태에서는 체내에서 활성산소종(ROS: reactive oxygen spices) 생성계 효소인 XO(xanthine oxidase) 와 AO(aldehyde oxidase) 활성이 증가된다(2). 또, 과잉으로 생성된 ROS는 생체막을 구성하는 불포화지방산의 과산화 를 촉진하여 조직손상을 초래할 뿐만 아니라 단백질의 불활 성화, 세포의 노화, 동맥경화, 당뇨, 뇌졸중 및 암과 같은 질병을 유발케 한다(2). 그러나 생체는 ROS의 공격을 방어 할 수 있는 ascorbic acid, glutathione, tocopherol 등과 같은 비단백성 항산화 물질과 superoxide dismutase, catalase, glutathione peroxidase, glutathione S-transferase 등과 같은 항산화계 효소들이 존재하여 ROS로 인한 독성을 경감시키 며, 각종 질병의 예방과 노화를 지연시키는 것으로 알려져 있어(3,4), 이러한 항산화 시스템을 강화시킬 수 있는 새로 운 생리활성물질의 끊임없는 개발이 요구되고 있다.
청미래덩굴(Smilax china L.)은 우리나라 산야에 널리 분 포하는 활엽덩굴성 관목으로 뿌리에는 triterpenoid saponins, flavones, stilbenes 및 organic acids 등이 함유되어 있으며(5), 한의학에서는 통풍치료(6,7)와 해독(5). 항염, 항암 및 항산 화(7,8) 등의 효과가 있는 것으로 알려져 있다. 청미래덩굴 의 잎은 예로부터 망개떡 제조에 사용해 왔으나 이에 대한 연구는 항균 및 항산화능 등 단편적인 연구(6,9)가 있을 뿐이며 다른 기능적 특성에 관한 연구는 없는 실정이다. 통풍은 관절염의 원인이 되는 대사성질환의 일종으로 뇨산 (uric acid)의 과잉생성 또는 배설저하로 유발된 고뇨산 혈증 으로 인하여 관절부위에 뇨산의 결정체가 축적되어 발생하 는 염증으로 통증을 일으키는 질환이다(10). 또한 뇨산은 purine의 최종 대사산물로 xanthine oxidoreductase(XOR)에 의하여 xanthine으로부터 생성된다. XOR은 xanthine dehydrogenase(XD)와 xanthine oxidase(XO)로 구분되며 정 상생리상태에서는 XD로 작용하나 병리적인 상태에서는 XO로 작용 한다(11). 한편, AO는 XO와 분자량이 유사하고 FAD, molybdenum 및 철-유황과 같은 보결분자단을 가지고 있으며 생체 내 작용에 있어서 상호 밀접한 관련이 있으나 기질의 특이성에는 차이가 있는 것으로 보고되고 있다(12). AO는 간, 폐 및 신장 등의 세포질에 다량으로 존재하는 효소(13)로 항암제(methotrexate)와 항바이러스제 (famciclovir)와 같은 약물을 포함한 aldehyde 및 질소함유 heterocyclic 화합물의 산화에 관여하며(12,14), 전자공여체 의 존재 하에서는 sulfoxides, N-oxides, nitrosamines, hydroxamic acids, azo 염료, oximes, epoxides, 방향족 nitro 화합물 및 1,2-benzisoxazole 유도체와 같은 다양한 화합물 을 환원시킴으로서 이들 약물에 대한 해독(15,16)과 다중약 물의 저항성을 극복하는데도 관여한다(17). 또한 AO는 체 내에서 내외인성 기질들의 산화 과정 중에 superoxide와 같은 ROS를 생성(18)하는 것으로 알려져 있으며, 알코올성 간 손상을 유도(19) 할 뿐만 아니라 고지방 식이에 의한 지방간의 생성에도 관여한다는 보고(20,21) 등을 고려해 볼 때 ROS와 관련된 질병의 발생에도 XO와 더불어 상당한 영향을 미칠 것으로 생각된다. 최근 AO의 mRNA는 visceral adipose tissue에서 subcutaneous adipose tissue에 비해 높게 발현되며(21), vitamin A의 aldehyde로부터 adipocyte의 분 화(22) 뿐만 아니라 간의 섬유화를 억제(23) 하는 retinoic acid를 생성하는 것으로 알려져 있어, AO는 비만의 조절과 간 손상의 예방 및 항암제 개발에 대한 표적효소 (24,25)로 관심이 집중되고 있다. 즉, AO는 체내 독성물질의 해독에 관여하나 환자들이 복용중인 다양한 약물에 대하여는 그 효과를 감소시킬 수 있으며 특히, 음주로 인한 간 손상과 복부비만을 유도하는데 관여할 뿐만 아니라 ROS 생성을 촉진하는데 관여함을 시사한다.
본 연구는 청미래덩굴의 뿌리인 토복령이 통풍을 완화하 고 해독작용을 한다는 많은 보고들이 있음에도 잎에 대하여 는 이와 관련된 연구가 없다는 점을 고려하여 청미래덩굴잎 열수추출액이 통풍과 해독, 알코올성 간질환 유도와 비만 등에 관여하는 XO 및 AO의 활성에 미치는 영향을 조사하 였다. 또한 세계적으로 비발효차에 비하여 발효차의 기호 도가 높고 그 이용률이 현저하게 높음(26)을 고려하여 청미 래덩굴잎의 기호성 증진을 위하여 우리나라의 전통메주 발효에 이용되는 Aspergillus oryzae로 발효시킨 후, 적정 발효기간의 설정과 발효에 따른 열수추출액의 주요 항산화 지표항목들의 변화를 조사하였다.
재료 및 방법
실험재료 및 균주
실험에 사용한 청미래덩굴(Smilax china L.)잎은 2012년 7월10일에 경기도 용인시의 야산에서 채취한 후 40℃의 열풍건조기에서 충분히 건조시킨 후 food mixer (HNF-1710, Hanil Electric Co., Ltd., Seoul, Korea)를 사용하 여 40 mesh 입도로 분쇄하였으며, polyethylene film으로 밀봉하여 4℃에서 보관하면서 시료로 사용하였다.
발효용 균주는 한국식품연구원에서 분양받은Aspergillus oryzae KFRI 995를 malt extract(BactoTM, Becton, Dickinson and Co., Sparks, MD, USA)를 사용하여 25℃에서 7일간 진탕배양하여 108cells/mL로 균수를 조정하여 종균으로 사 용하였다.
발효차 제조방법
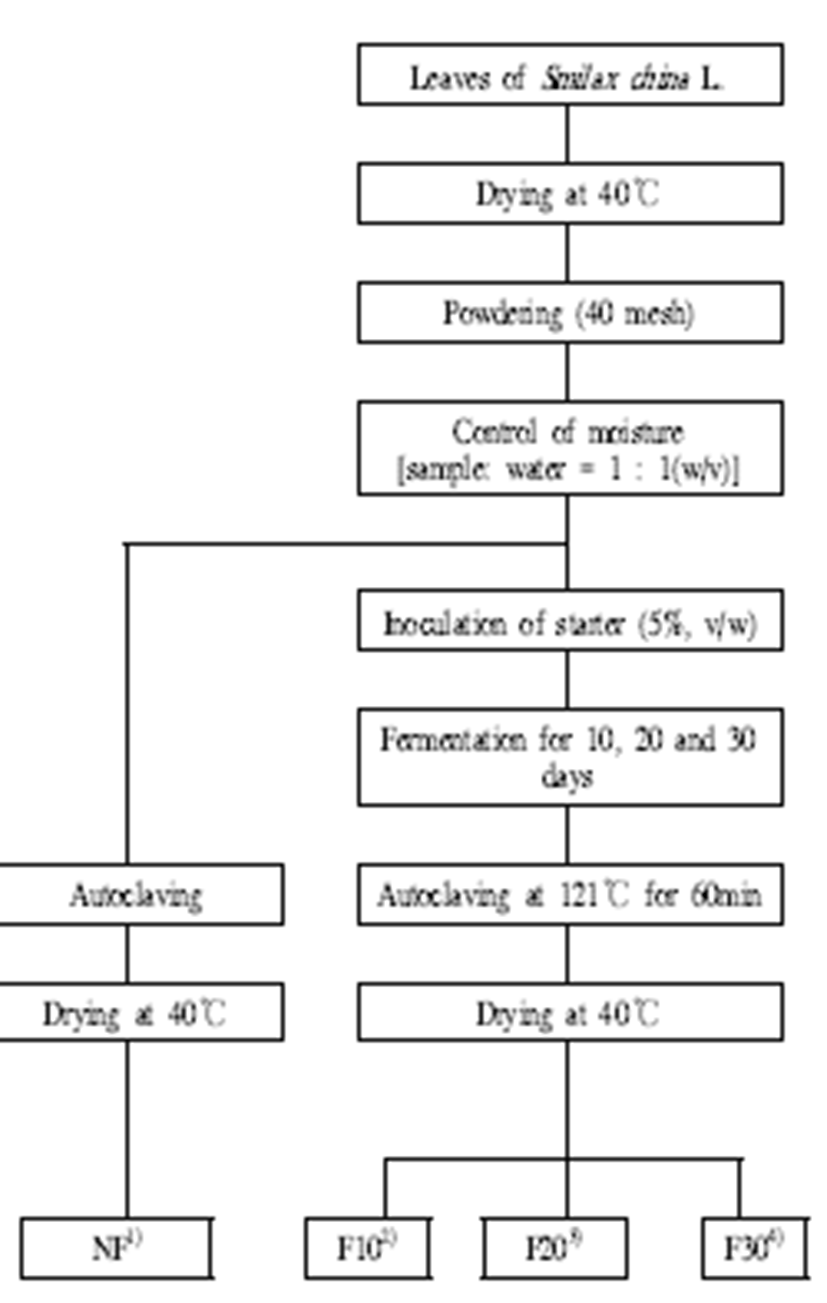
청미래덩굴잎 발효차의 제조는 Fig. 1에서와 같이 제조 하였다. 즉, 4℃에서 보존중인 분말 청미래덩굴잎 1 kg에 malt extract에서 배양한 종균 100 mL를 증류수 900 mL과 혼합한 액을 골고루 섞어 25℃에서 10, 20 및 30일간 발효시 켰다. 발효가 완료된 후는 polypropylene bag에 담아 121℃ 에서 60분간 가압멸균 하였으며, 이어서 40℃에서 건조시 켜 청미래덩굴 증차를 제조하였다.
Fig. 1.
Preparation and fermentation procedures of Smilax china L. leaf teas.
1)NF : non-fermented, 2)F10 : fermented for 10 days, 3)F20 : fermented for 20 days, 4)F30 : fermented for 30 days.
Download Original Figure
관능검사
열수추출은 tea extractor(Damian Tea Co., Anyang, Korea)를 이용하여 90℃의 열수(수돗물)에 청미래덩굴잎 발효차를 1%(w/v) 농도로 하여 5분간 우려내어 50℃의 보 온 통에 보관하면서 시료로 사용하였다. 관능요원은 차를 연구 교육하는 (사)우리차문화연합회의 40~60세의 여성 회원 25명으로 주 1회 4시간씩 4주간 관능항목에 대한 강도 와 기호도에 대한 훈련을 행하였으며, 5주째에 4종의 시료 에 대하여 향(aroma), 맛(taste), 색상 (color), 밝기 (brightness) 및 입에 닿는 감각(mouth feel)에 대한 기호도와 및 종합적인 기호도(overall acceptability)를 5점 측도법(27) 으로 아주 나쁘다(1점), 나쁘다(2점), 보통이다(3점), 좋다(4 점), 아주 좋다(5점)로 평가하였다.
우린 차의 색상
색상은 관능검사용의 1% 열수추출액을 시료로 하여 colorimeter(CR-200, Minolta Co., Osaka, Japan)로 밝기를 나타내는 L*값(lightness), 적색도를 나타내는 a*값(redness) 및 황색도를 나타내는 b*값(yellowness) 및 H°값(hue angle) 을 측정하였다. 이때 사용한 표준백판의 L*, a* 및 b*값은 각각 94.5, 0.3132, 0.3203이었다. 또, spectrophotograms은 동일 시료를 사용하여 recording spectrophometer(Cary Winuv, Varian, Seoul, Korea)를 사용하여 400~700 nm에서 의 흡광도를 측정하였다.
총 polyphenol 및 총 flavonoid 함량
1% 열수추출액을 시료로 사용하여 polyphenol(TP) 함량 은 Minussi 등(28)의 방법에 따라 열수추출액 100 μL에 2% sodium carbonate 2 mL와 50% Folin-Ciacalteu reagent 100 μL를 가한 후 720 nm에서 흡광도를 측정하였으며, gallic acid(Sigma-Aldrich Co., St. Louis, MO, USA)의 표준검량선 에 의하여 함량을 산출하였다. 총 flavonoid(TF) 함량은 Meda 등(29)의 방법에 따라 열수추출액 1 mL에 2% aluminum chloride 1 mL와 50% 에탄올 1 mL를 혼합하여 실온에서 10분간 반응시킨 다음 415 nm에서 흡광도를 측정 하였으며, 표준품 quercetin(Sigma-Aldrich Co.)의 표준검량 선에 의하여 함량을 산출하였다.
전자공여능
전자공여능(electron donating ability: EDA)은 Blois(30) 의 방법에 따라 시료 1% 열수추출액 0.2 mL에 0.4 mM DPPH(1,1-diphenyl-2-picryl-hydrazyl) 용액 0.8 mL를 가하 여 10분간 방치한 다음 525 nm에서 흡광도를 측정하였으며 전자공여능(%) = [1 - (시료흡광도/대조구 흡광도)] × 100의 계산식에 의하여 활성도를 산출하였다.
철 환원력
철 환원력(ferric reducing antioxidant power: FRAP)은 Benzie와 Strain(31)의 방법에 따라 시료의 1% 열수추출액 0.05 mL에 증류수 0.05 mL을 가하여 혼합한 후 0.3 M sodium acetate buffer(pH 3.60)와 10 mM 2,4,6-tris (2-pyridyl)-s-triazine을 함유하는 40 mM HCl 용액 및 20 mM FeCl3 용액(10:1:1, v/v)의 혼합용액 1.9 mL를 가하여 37℃에서 30분간 반응시킨 후 593 nm에서 흡광도를 측정하 였다. 대조구는 추출액 대신에 증류수를 사용하였으며 활 성도는 건조시료 g당 Fe3+이 Fe2+로 환원된 량을 μmole로 나타내었다.
지질과산화 저해능
지질과산화 저해능(lipid peroxidation inhibitory activity: LPOIA)은 Banerjee 등(32)의 방법을 일부 변형하여 신선한 계란 노른자 10%(w/v)를 함유하는 50 mM Na-phosphate buffer(pH 7.4)로 균질화한 액 0.25 mL에 1% 열수추출액과 증류수를 각각 0.20 mL 및 0.55 mL을 가하였다. 여기에 70 mM FeSO4 용액 0.05 mL을 가하여 37℃에서 30분간 반응시킨 후 pH를 3.5로 조정한 20% acetic acid 1.5 mL와 0.8% thiobabituric acid를 함유하는 sodium dodecyl sulfate 1.5 mL 및 20% trichloroacetic acid 0.05 mL를 가하고 95℃에 서 1시간동안 가열한 다음 냉각하였다. 여기에 n-butanol 5 mL을 가하여 3,000×g로 10분간 원심분리하여 얻은 상층 액의 흡광도를 532 nm에서 측정하였으며, 저해율(%)= [1-(test blank의 OD/blank의 OD)]×100의 계산식에 의하여 지질과산화 저해활성을 측정하였다.
Xanthine oxidase 및 aldehyde oxidase의 저해활성
청미래덩굴잎 시료는 비발효(NF), 10일 발효차(F10), 20 일 발효차(F20) 및 30일 발효차(F30)의 건조 분말화한 시료 의 1% 열수추출액을 사용하였다. 효소원은 Rajagopalan 등 (33)의 방법에 따라 토끼의 간 조직으로부터 xanthin oxidase(XO) 및 aldehyde oxidase(AO)를 추출, ammonium sulfate 분획, 투석 및 원심분리를 행하여 부분 정제한 후 -70℃에서 보관하면서 공시하였다. XO 활성도는 Stirpe와 Della Corte(34)의 방법에 따라 기질 xanthine을 uric acid로 의 전환정도를 대조구에 대한 %로 나타내었으며, AO 활성 도는 Rajagopalan 등(33)의 방법에 따라 기질 NMN (N1-methyl nicotinamide)으로부터 산화된 pyridone을 300 nm에서 흡광도를 측정한 다음 시료대신에 증류수를 첨가 한 대조구에 대한 %로 나타내었다.
통계처리
분석은 3회 반복으로 실험하여 평균치와 표준편차로 나 타내었고, 관능검사는 관능요원 25명의 평균값과 표준편차 로 나타내었다. 유의성 검증은 SPSS version 12(SPSS Inc., Chicago, IL, USA) software package program을 이용하여 Duncan's multiple range test를 행하였다.
결과 및 고찰
청미래덩굴잎 발효차 열수추출액의 색상과 spectrum상의 특성
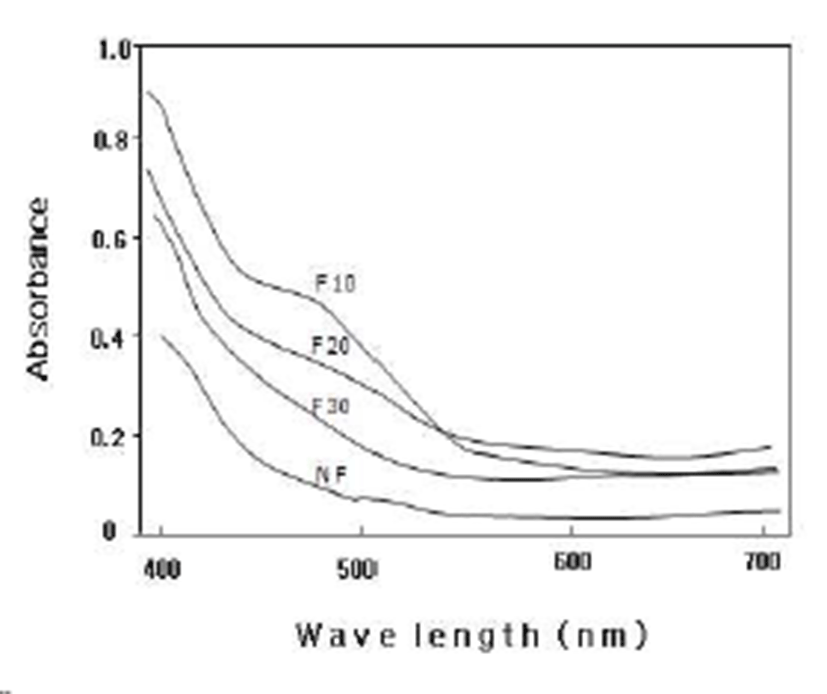
A. oryzae에 의한 청미래덩굴잎 발효차의 발효기간에 따 른 1% 열수추출액의 색상과 spectrum(400~700nm)의 변화 를 조사한 결과는 Table 1 및 Fig. 2와 같다. 밝기를 나타내는 L*값은 10~30일간 발효시킨 F10, F20 및 F30에서는 32.7 8~35.72로 발효시키지 않은 NF의 51.09보다 현저하게 낮 았으나 적색도를 나타내는 a*값은 이와 반대로 NF의 경우 는 9.15이었으나 F10, F20 및 F30에서는 19.34~19.67로 유의적으로 높았다. 또, 황색도를 나타내는 b*값은 a*값과 반대의 현상을 나타내었으며 L*, a* 및 b*값 모두 발효차와 비발효차 간에는 유의적인 차이를 보였으나 발효기간에 따른 뚜렷한 차이는 없었다. 이러한 현상은 hue angle(H°)의 값에서 보여주듯이 NF는 68.72로 연한 황색을 띠나 F10, F20 및 F30에서는 36.02~37.06으로 맑은 적색으로 상호간 의 뚜렷한 차이를 보이지 않음에 따라 10일간의 발효로 청미래덩굴잎에 존재하는 무색에서 연한 황색을 띠는 polyphenols 성분의 대부분이 발효에 의하여 산화되는 것으 로 생각된다.
Table 1.
Hunter's color values of 1% hot water extracts of Smilax china L. leaf teas dur ing fermentation by A. oryzae
| Plots1) |
Hunter's color values |
| L* |
a* |
b* |
H° |
| NF |
51.09±3.25a |
9.15±0.74b |
16.44±1.66a |
68.72±4.37a |
| F10 |
35.72±2.45b |
19.67±1.89a |
11.29±1.57b |
37.45±2.40b |
| F20 |
34.51±1.09b |
19.32±1.23a |
11.31±0.98b |
37.08±1.95b |
| F30 |
31.72±1.24b |
19.34±1.44a |
11.30±0.72b |
37.02±1.67b |
Download Excel Table
Fig. 2.
Spectrophotograms of fermented Smilax china L. leaves tea 1% water extracts at different fermentation per iods by A. oryzae.
NF : non- fermented, F10 : fermented for 10 days, F20 : fermented for 20 days, F30 : fermented for 30 days.
Download Original Figure
한편, 1% 열수추출액의 가시부에서의 흡광도를 조사한 결과 F10의 경우는 특히 400~550 nm 파장범위에서 NF나 F20 및 F30에 비하여 높은 흡광도를 나타내었다. 이러한 현상은 발효에 따라 475~489 nm에서 흡광하는 새로운 물 질이 생성됨을 암시하고 있으나 발효기간이 10일 이상이 되면 이러한 물질들이 점차 감소하거나 소실되는 것이라 사료된다.
열수추출액의 관능적 특성
A. oryzae에 의한 청미래덩굴잎 발효차의 발효기간에 따 른 1% 열수추출액에 대한 기호도를 조사한 결과는 Table 2와 같다. 향에 대한 기호도는 비발효 및 발효차 모두에서 보통∼보통이하로 상호 유의적인 차이를 보이지 않았다. 맛에 대한 기호도는 10∼30일간 발효시킨 F10, F20, F30 상호간에는 유의적인 차이를 보이지 않았으나 발효시킨 경우가 발효시키지 않은 NF에 비하여는 양호한 것으로 나 타났다. 이러한 현상은 발효시키지 않은 청미래덩굴잎은 비교적 강한 신맛과 떫은맛을 띠는데 비하여 발효시킨 경우는 이러한 맛이 없거나 감소되며 이들 맛에 덮여 있던 감미가 비교적 뚜렷하게 나타난 때문이라 사료된다. 차의 밝기에 대한 기호도는 NF와 F10~F30과의 유의적인 차이 가 없었다. NF의 경우는 연한 황색을 띠는 반면 F10~F30은 맑은 적색을 띠어 발효에 의하여 밝기에 대한 기호도가 낮아질 것으로 예측된 바와는 다른 결과를 나타내었다. 이 러한 현상은 발효에 의하여 청미래덩굴잎에 존재하는 청색 을 띠는 chlorophyll이 소실되면서 F10∼F30의 열수추출액 은 맑고 깨끗해 보이는 색상으로 변화된 때문으로 생각된 다. 입에 닿은 감각과 종합적인 기호도도 발효시킨 경우가 발효시키지 않은 경우에 비하여 유의적으로 높은 값을 나타 내었으나 F10, F20 및 F30 상호간의 차이는 없어 관능적인 평가에 의한 적정 발효기간은 10일이 적당한 것으로 사료 된다. 향(aroma), 맛(taste), 밝기(brightness) 및 입에 닿는 감각(mouth feel)에 대한 기호도는 특히 발효차의 주요 품질 평가 항목으로 알려져 있다(35,36). 생엽에 존재하는 엽록 소가 발효에 의하여 분해되어 소실되지 않으면 이들이 어두 운 색상을 띠게 되어 밝기에 대한 기호도를 떨어트리게 된다. 또한, 차 발효의 중요한 목적은 차의 주요 성분인 catechin을 비롯한 polyphenol 성분을 polyphenol oxidase에 의하여 산화, 중합시킴으로서 새로운 기능성 성분인 teaflavins 또는 tearubigins과 같은 적색계의 아름다운 색상 을 생성케 함과 동시에 부드러운 맛과 소화성을 향상시키는 데 있다(26,37). 일반적으로 식물체의 발효는 항산화작용이 있는 polyphenol의 함량을 감소시키는 반면 hydrogen peroxide와 같은 산화작용이 높은 물질을 감소시키는 효과 가 있다(37). 또한 단백질 등과 결합하여 소화성을 감소시킴 과 동시에 떫은맛을 띠는 tannin 성분을 감소시킴으로서 기호도를 높이며, 발효 중에 수용성의 새로운 flavonoid성분 을 생성하는 효과가 있으며 세계적으로 차 생산량의 80%가 발효차로 소비되고 있다(26).
Table 2.
Sensory quality of fermented Smilax china L. leaves tea 1% water extracts at different fermentation periods by A. oryzae
| Plots1) |
Aroma |
Taste |
Brightness |
Mouth feel |
Overall acceptability |
| NF |
2.75±0.40NS,2) |
2.15±0.22c,3) |
3.16±0.35NS |
2.19±0.27c |
2.37±0.29b |
| F10 |
2.84±0.41 |
3.65±0.32a |
3.04±0.28 |
3.45±0.34a |
3.90±0.30a |
| F20 |
2.52±0.34 |
3.59±0.28a |
2.94±0.31 |
3.38±0.28a |
3.78±0.23a |
| F30 |
2.41±0.30 |
3.13±0.27a |
2.90±0.34 |
3.27±0.29a |
3.65±0.21a |
Download Excel Table
TP 및 TF 함량
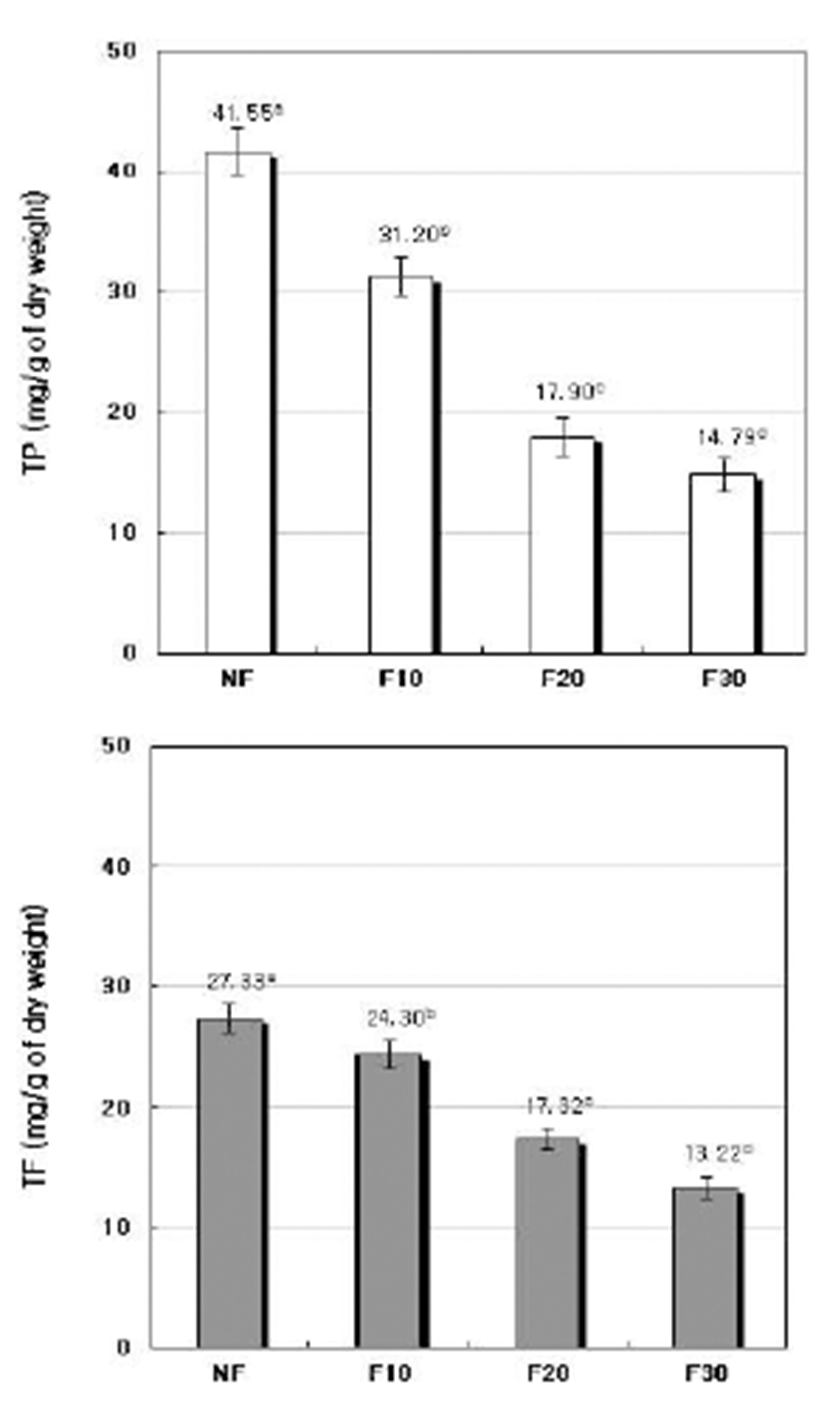
A. oryzae에 의한 발효기간에 따른 청미래덩굴잎 발효차 열수추출액의 total polyphenol(TP) 함량과 total flavonoid (TF)의 함량을 조사한 결과는 Fig. 3과 같다. 열수추출액으 로부터 환산한 차 건물 g당의 TP 함량은 NF에서 41.55 mg이었으나 발효기간이 길어짐에 따라 거의 비례적으로 감소하였으며 그 감소율은 발효 10일째는 24.91%, 20일째 는 56.92%, 30일째는 64.41%를 나타내었다. TF의 함량도 TP의 경우와 같이 NF에서 27.33 mg을 나타내었으나 발효 기간이 길어짐에 점차적으로 감소하여 F10에서는 24.30 mg, F20에서는 17.32 mg, F30에서는 13.22 mg으로 감소하 였다. 그러나 TP의 감소율이 TF의 감소율에 비하여 커서 F20과 F30에서의 TF/TP 비율(%)은 각각 97.76% 및 89.38% 로 flavonoid가 polyphenol의 대부분을 차지하였다. 이러한 현상은 청미래덩굴잎에 존재하는 polyphenol 성분 중 비 flavonoid 성분들이 발효에 의한 감소율이 큼을 나타낸다. 발효에 의한 polyphenol성분의 감소는 발효도, 발효기간 및 발효방법에 따라 차이를 보이는 것으로 알려져 있으며 차의 발효시에는 비수용성 polyphenol 성분들이 수용성의 flavonoid로 전환한다는 보고도 있다(37).
Fig. 3.
Content of total polyphenol (TP), total flavonoid (TF) of fermented Smilax china L. leaves tea water extracts at different fermentation periods by A. oryzae.
NF : non-fermented, F10 : fermented for 10 days, F20 : fermented for 20 days, F30 : fermented for 30 days. Values are mean±standard deviation of triplicate determination, different letters on the bars (a~d) indicate significant differences (p<0.05).
Download Original Figure
전통 메주발효균인 A. oryzae를 포함한 Aspergillus속 미 생물은 amylase, protease와 같은 효소를 강력하게 분비할 뿐만 아니라 pectinase와 같은 식물체 세포벽성분의 분해에 관여하는 효소를 분비함으로서 발효를 통하여 세포벽과 강하게 결합하여 용출되기 어려운 기능성 성분들을 차로서 이용 시에 쉽게 가용화 할 수 있도록 하는 효과가 있다(38). 또한 식물체에 널리 분포하는 덟은 맛의 원인이 되는 gallotannins을 비롯한 gallic acid esters의 depside결합과 ester결합의 가수분해에 관여하는 tannase를 분비함으로서 polypheol의 함량과 떫은맛을 감소시키는 효과가 있다(39).
식물체에 존재하는 polyphenol 성분은 항산화 작용을 비 롯한 다양한 생리활성을 나타내며(40), 그 함량에 비례하여 항산화력이 높아지는 것으로 보고되고 있다(41). 그러나 한편으로는 polyphenol 성분의 함량이 높을수록 활성산소 를 생성하는 과산화수소의 함량이 높다는 보고가 있으며 (42), 또한 이들 성분들은 소화작용을 억제하고 떫은맛을 띰으로서 기호도 떨어트리며 세계적으로도 발효차의 선호 도가 높은 것으로 알려져 있다(37).
EDA 및 FRAP
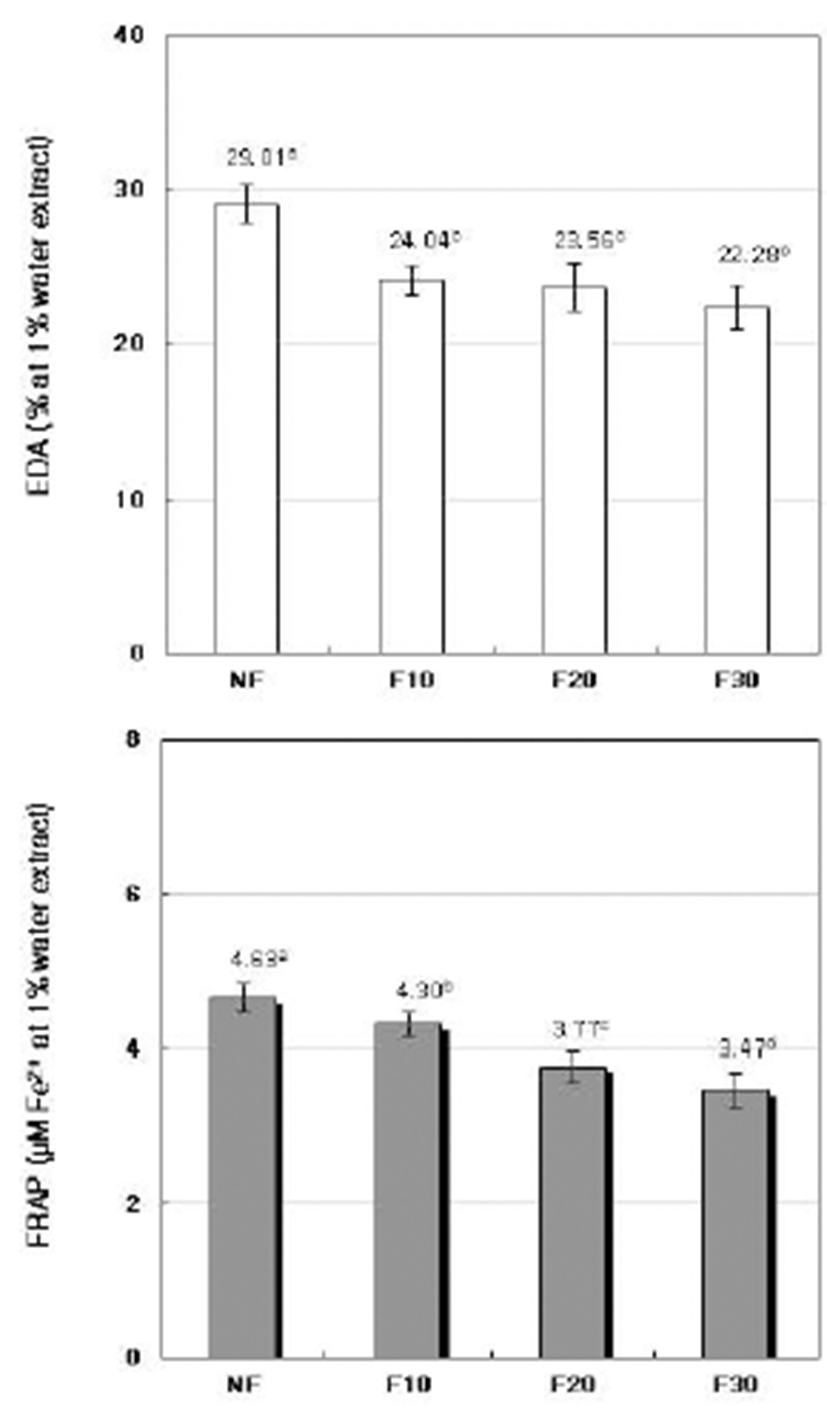
A. oryzae에 의한 발효기간에 따른 청미래덩굴잎 발효차 1% 열수추출액의 전자공여능(EDA) 및 철환원력(FRAP)을 측정한 결과는 Fig. 4와 같다. EDA는 체내에서 생성되는 ROS에 전자를 공여함으로서 산화를 막는 작용을 하며(43), 환원력은 산화물을 원래의 상태로 환원시키는 힘으로 모두 항산화를 나타내는 중요한 지표로 활용되며(6), EDA가 높 을수록 FRAP도 높아지는 것으로 알려져 있다(44).
Fig. 4.
EDA and FRAP of fermented Smilax china L. leaves tea 1% water extracts at different fermentation per iods by A. oryzae.
NF : non-fermented, F10 : fermented for 10 days, F20 : fermented for 20 days, F30 : fermented for 30 days. Values are mean±standard deviation of triplicate determination, different letters on the bars (a~c) indicate significant differences (p<0.05).
Download Original Figure
실험결과, EDA는 비 발효차(NF)에는 29.01%이었으나 발효 10일째(F10)의 EDA 감소율은 17.14%였으며, 발효 20일째(F20)와 30일째(F30)의 감소율은 각각 18.79% 및 23.20%를 나타내었고 F10, F20, F30상호간의 유의차는 없 었다. 그러나 FRAP는 NF 4.63 μM Fe2+, F10 4.30 μM Fe2+, F20 3.77 μM Fe2+, F30 3.47 μM Fe2+로 그 감소율은 발효 10일째 7.13%, 20일째 18.58%, 30일째는 25.06%로 20일까 지는 기간에 따라 유의적인 감소를 나타내었으나 30일째는 발효 20일째와의 유의차가 없었다. Ko와 Yang(45)은 청미 래덩굴잎 열수추출농축물(1 mg/mL)의 EDA는 33.6%라 보 고하였으나 본 실험의 1% 열수추출액(10 mg/mL)의 EDA 는 29.01%로 이러한 차이는 청미래덩굴잎의 채취시기와 채취 장소 및 처리방법에 기인되어 나타난 결과로 생각한 다. 그리고 EDA를 포함한 항산화능은 polyphenol의 함량이 높을수록 높은 것으로 알려져 있으나(46), 본 실험에서는 발효기간에 따라 polyphenol의 함량이 발효 10일째는 24.91%, 20일째는 56.92%, 30일째는 64.41%로 감소함에도 불구하고 EDA와 FRAP의 감소율은 polyphenol의 감소율에 는 미지지 않을 정도로 그 감소율이 비교적 낮았다. 따라서 이러한 현상은 발효에 따라 항산화능을 지니는 새로운 물질 이 생성됨을 나타낸다. 차의 발효에서도 catechin과 같은 항산화성 물질이 감소하는 대신에 새로운 항산화 물질인 theaflavins나 thearubigins가 생성되는 것으로 보고되고 있 다(37).
과산화지질의 생성 저해활성
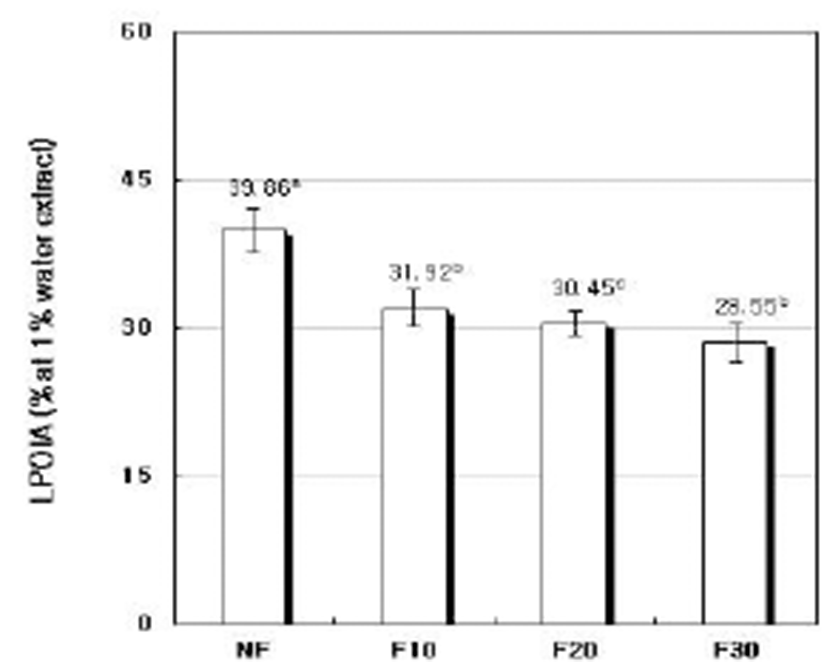
A. oryzae에 의한 발효기간에 따른 청미래덩굴잎 발효차 1% 열수추출액의 과산화지질 생성억제능(LPOIA)을 측정 한 결과는 Fig. 5와 같다. NF의 LPOIA는 39.86%이었으나 F10의 경우는 31.92%로 NF에 비하여 7.94%가 감소하였고 F20 및 F30의 경우는 NF에 비하여 각각 9.41% 및 11.31%가 감소하였다. LPOIA는 생체막에 존재하는 불포화지방산이 산화, 분해되어 독성을 나타내는 aldehyde, ketone 및 lactone 과 같은 물질의 생성(47)을 차단하는 힘으로 발효에 의하여 도 잔존 활성이 비교적 높게 유지되어 산화적 스트레스로 인한 세포조직의 손상을 경감시킬 수 있는 기능성 차로서의 활용성이 기대된다.
Fig. 5.
Lipid peroxidation inhibitory activity (LPOIA) of fermented Smilax china L. leaf tea 1% water extracts at different fermentation per iods by A. oryzae.
NF : non-fermented, F10 : fermented for 10 days, F20 : fermented for 20 days, F30 : fermented for 30 days. Values are mean±standard deviation of triplicate determination, different letters on the bars (a~c) indicate significant differences (p<0.05).
Download Original Figure
열수추출액이 XO 및 AO 저해활성에 미치는 영향
XO와 AO는 동식물계에 널리 분포하며 종에 따라 특성 적 차이를 나타내는 것으로 알려져 있다(48). XO와 AO는 기질특이성에서는 약간의 차이를 보이지만 생화학적으로 는 대단히 유사한 특성을 가지는 효소(49)로 pyrimidine, purine, pteridine 유도체와 같은 N-heterocyclic 화합물(50) 이나 친유성 방향족화합물의 산화에 관여 한다(51). 또한 azo 염료(52), 항암제(53)와 항고혈압제(54)의 환원에 관여 함으로서 때로는 생체내에서 이들 약물의 효과를 감소시키 기도 하지만 치료 후 체내에 잔존하는 약성을 해독시키는 작용도 있다. AO는 XO가 결핍된 경우에 allopurinol과 pyrazinamide 등의 대사에 관여 하며(55), 두 효소 모두 분자 상 산소를 전자수용체로 이용하여 superoxide와 hydrogen peroxide 등과 같은 ROS 생성계 효소이다(18). 특히, AO는 ethanol(19), thioacetamide 및 chloroform에 의한 간 손상(56) 을 촉진하고 지방세포(adipocyte)의 분화와 지질의 저장 및 지방세포내의 단백질(adiponectin) 분비에 관여함으로서 비 만과 관련이 있는 것으로 보고되고 있다(21). 또한, 고지방 식이 및 알코올성 지방간 생성에 관여(19) 할 뿐만 아니라 항비만 adipokine인 adipionectin에 의해 AO의 활성이 저하 된다는 보고도 있다(23). 일반적으로 식물체 함유된 flavonoid는 AO의 활성을 억제하며 그 억제도는 flavonoid 의 glycoside에 비하여 aglycone에서 현저하다(57).
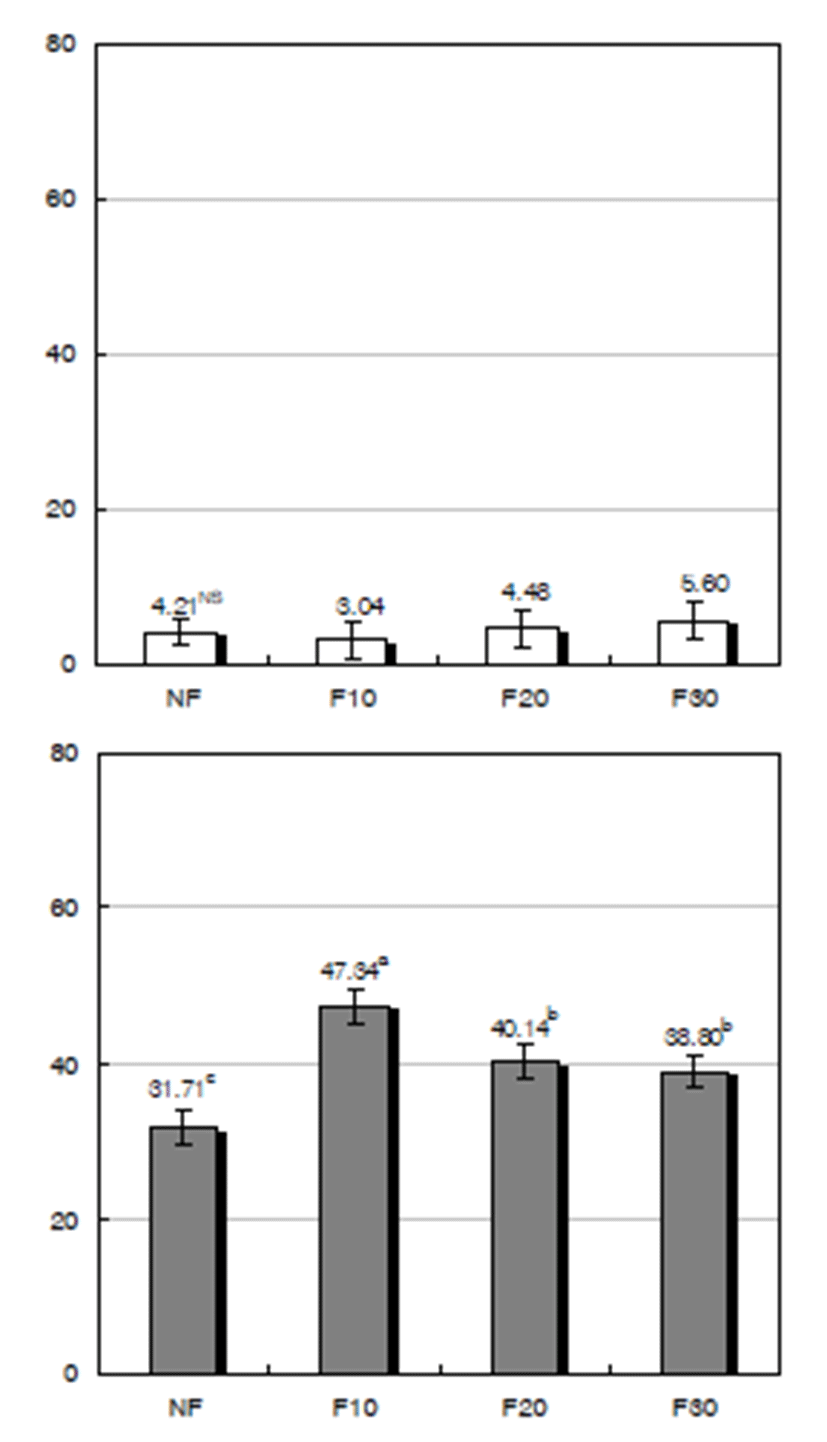
청미래덩굴잎 비발효차(NF) 및 발효차(F10, F20 및 F30) 1% 열수추출물이 토끼 간 조직으로부터 추출하여 부분 정제한 xanthine oxidase(XO) 및 aldehyde oxidase(AO)의 저해활성에 미치는 영향을 조사한 결과는 Fig. 6과 같다. NF 및 F10~30의 1% 열수추출액은 XO의 저해활성에는 3.04∼5.16%로 뚜렷한 영향을 미치지 않았다. 그러나 AO의 저해활성은 여타 항산화 지표들에서와는 달리 비 발효차인 NF(31.71%)에서 보다 발효차(38.80∼47.34%)에서 전반적 으로 높은 경향을 보였으며, 발효 10일째인 F10에서의 저해 활성은 47.34%로 NF에 비하여 49.29%가 높았다. 이러한 결과는 청미래덩굴 뿌리인 토복령 추출물이 XO의 활성을 억제함으로서 통풍과 관련이 있는 뇨산의 생성을 억제한다 는 보고(10)와 차이를 보였으나 1% 열수추출액에서 비 발 효(NF) 및 발효(F10)에서 각각 31.71% 및 47.34%의 비교적 높은 저해활성을 나타냄으로서 이와 관련되는 기능적인 효과가 기대된다.
Fig. 6.
Effects of fermented Smilax china L. leaves tea 1% water extracts at different fermentation per iods by A. oryzae on the activities of XO and AO extracted and partial purified rabbit liver.
CON : activity % of reaction mixture without sample, NF : non-fermented, F10 : fermented for 10 days, F20 : fermented for 20 days, F30 : fermented for 30 days. Values are mean±standard deviation of triplicate determination, different letters on the bars (a~c) indicate significant differences (p<0.05).
Download Original Figure
열수추출액이 부분정제 AO의 kinetic에 미치는 영향
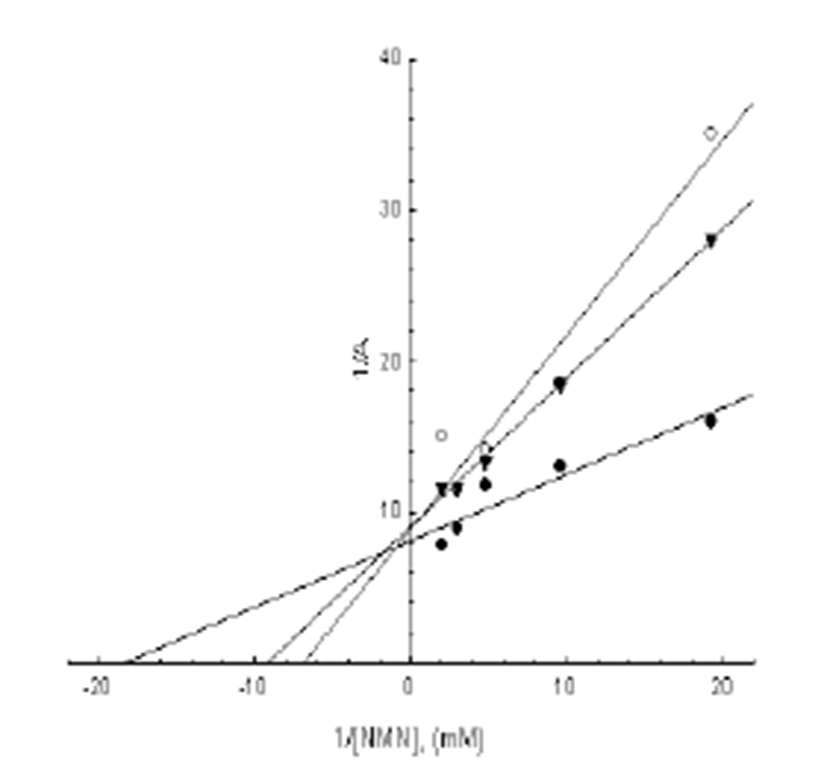
청미래덩굴잎과 그 발효차에 의한 AO의 활성저해 현상 이 어떠한 작용에 의해 나타나는지를 조사할 목적으로 비 발효차(NF)와 발효차(F10)의 열수추출물(tea 300 μg/mL) 을 각각 첨가한 다음 기질인 NMN의 농도를 변화시켜가면 서 AO의 활성을 측정하여 LB plot 하였다(Fig. 7). 청미래덩 굴잎의 성분에 의한 AO의 활성 억제 현상은 Vmax치에는 별다른 차이가 없었으나 Km 값에는 대조구(control), 비발 효(NF) 및 발효차(F10) 열수추출물을 첨가한 경우 각각 54.27, 144.16 및 109.21 μM로 대조구에 비하여 NF 및 F10에 서 현저하게 증가하고 있어, 청미래덩굴잎 성분에 의한 AO 의 활성억제는 효소에 대한 기질인 NMN과의 경쟁적 저해 현상을 나타내었다.
Fig. 7.
Typical Lineweaver -Burk plots for inhibitory activity of NF and F10 water extract (1%) on the oxidation of NMN catalyzed by rabbit liver aldehyde oxidase.
The enzyme assays were performed as described in Materials and Methods. The data represent the average of 3 experiments. Closed circle; control, Open circle; Fermented Smilax china L. Leaves Tea, Closed triangle; non-fermented Smilax china L. Leaf Tea.
Download Original Figure
이상의 결과, 발효에 의하여 항산화 활성과 관련이 있는 TP, TF, EDA, FRAP, LPOIA이 다소 감소하는 경향을 보이 지만 한편으로는 열수로 추출한 1% 농도의 차 음료로써 음주로 인한 간 손상유도와 이로 인한 복부비만 등에 관여 하는 AO의 저해활성을 높임으로서 마시는 기능성 차로서 의 활용이 기대된다.
요 약
A. oryzae로 발효한 청미래덩굴(Smilax china L.)잎 발효 차의 적정 발효기간을 확립하고자 비 발효(NF) 및 10, 20 및 30일간 발효(F10, F20, F30)시킨 차 1% 열수추출물(1 tea bag 기준)의 색상, 관능검사 및 total polyphenol(TP), total flavonoid(TF), 전자공여능(EDA), 철환원력(FRAP), 과 산화물 생성 억제능(LPOIA)을 조사하였다. 또, 체내 활성 산소(ROS) 생성계 효소인 동시에 요통과 음주로 인한 간 손상유도 및 이로 인한 복부비만에 직간접적으로 관여하는 xanthine oxidase(XO) 및 aldehyde oxidae(AO)의 저해활성 에 미치는 영향을 조사하였다. 색상과 spectrum(400~ 700nm)의 변화를 조사한 결과, NF는 연한 황색을 띠는 반면 F10∼F30에서는 엷은 적색을 띠었으며 F10의 색상이 가장 선명하였다. 향(aroma)과 밝기(brightness)에 대한 기호도는 비발효차와 발효차간의 유의차를 보이지 않았으나 맛 (taste)과 입에 닿는 감각(mouth feel) 및 종합적인 기호도 (overall acceptability)는 F10, F20 및 F30 간의 뚜렷한 차이 를 보이지 않아 발효 10일이 이상적인 발효기간이라 사료 된다. TP 함량은 NF에서 41.55 mg/g(dry basis)이었으나 발 효에 따라 거의 비례적으로 감소하였으며 그 감소율은 발효 10일째 24.91%, 20일째 56.92%, 30일째 64.41%를 나타내었 다. TF의 함량은 NF에서 27.33 mg을 나타내었으나 발효에 점차적으로 감소하여 F10 24.30 mg/g, F20 17.32 mg/g, F30 13.22 mg/g으로 감소하였다. 그러나 TP의 감소율이 TF의 경우에 비하여 커서 TF/TP 비율(%)은 발효에 따라 증가하 는 경향을 나타내었다. EDA는 NF에서는 29.01%이었으나 F10에서는 NF에 비하여 17.14%가 감소하였으며, F20 및 F30에서는 각각 18.79% 및 23.20%가 감소하였다. FRAP(μ M Fe2+)는 NF 4.63, F10 4.30, F20 및 F30에서는 각각 3.77 및 3.47로 발효에 따라 감소하는 경향을 보였다. LPOIA는 NF에서는 39.86%이었으나 F10의 경우는 31.92%로 NF에 비하여 19.92%가 감소하였고 F20 및 F30는 NF에 비하여 각각 23.61% 및 28.38%가 감소하였다. NF 및 F10∼30의 1% 열수추출액이 생유 및 토끼 간 조직으로부터 부분정제 한 XO와 AO의 활성에 미치는 영향을 조사한 결과, XO활성 에는 비발효, 발효 모두에서 뚜렷한 영향을 미치지 않았다. 그러나 AO의 활성은 비발효, 발효 관계없이 38.09∼41.70% 범위로 억제하였으며, 이러한 억제는 경쟁적 저해현상에 기인되어 나타난 것으로 생각된다.
감사의 글
본 연구는 농촌진흥청, 차세대바이오 그린 21사업의 연 구비(No. PJ009521)로 수행된 과제로 연구비 지원당국에 깊은 감사를 드립니다.
REFERENCES
Carr MC. The emergence of the metabolic syndrome with menopause. J Clin Endocrinol Metab. 2003; 88:2404-2411


Halliwell B. Reactive oxygen species and the central nervous system. J Neurochem. 2006; 59:1609-1623.

Jeon SM, Bok SH, Jang MK, Lee MK, Nam KT, Park YB, Rhee SJ, Choi MS. Antioxidative activity of naringin and lovastatin in high cholesterol-fed rabbits. Life Sci. 2001; 69:2855-2866


Moon SH, Lee MK, Chae KS. Inhibitory effects of the solvent fractions from persimmon leaves on xanthine oxidase activity. Korean J Food Nutr. 2001; 4:120-125.

Cheng DS, Hua XL. Today’s research of
Smilax china. J Chin Med Mater. 2006; 29:90-93.

Song HS, Park YH, Jung SH, Kim DP, Jung YH, Lee MK, Moon KY. Antioxidant activity of extracts from
Smilax china root. J Korean Soc Food Sci Nutr. 2006; 35(9):1133-1138.

Shu XS, Gao ZH, Yang XL. Anti-inflammatory and anti-nociceptive activities of
Smilax china L. aqueous extract. J Ethnopharmacol. 2006; 103:327-332


Li YL, Gan GP, Zhang HZ, Wu HZ, Li CL, Huang YP, Liu YW, Liu JW. A flavonoid glycoside isolated from
Smilax china L. rhizome in vitro anticancer effects on human cancer cell lines. J Ethnopharmacol. 2007; 113:115-124


Choi HY. Antimicrobial effect of ethanol extract of
Smilax china leaf. Korean J Sanitation. 2004; 19:22-30.

Chena L, Yina H, Lanb Z, Maa S, Zhanga C, Yanga Z, Li P, Linc B. Anti- hyperuricemic and nephroprotective effects of
Smilax china L. J Ethnopharmacol. 2011; 135:399-405.

Ham YK, and Kim SW. Protective effects of plant extract on the hepatocytes of rat treated with carbon tetrachloride. J Korean Soc Food Sci Nutr. 2004; 33:1246-1251.

Beedham C. Molybdenum hydroxylases: biological distribution and substrate- inhibitor specificity. Prog Med Chem. 1987; 24:85-121.

Al-Salmy HS. Individual variation in hepatic aldehyde oxidase activity. IUBMB Life. 2001; 51:249-253


Kitamura S, Nakatani K, Sugihara K, Ohta S. Strain differences of the ability to hydroxylate methotrexate in rats. Comp Biochem Physiol. 1999; 122C:331-336


Hirao Y, Kitamura S, Tatsumi K. Epoxide reductase activity of mammalian liver cytosols and aldehyde oxidase. Carcinogenesis. 1994; 15:739-743


Sugihara K, Kitamura S, Tatsumi K. Involvement of mammalian liver cytosols and aldehyde oxidase in reductive metabolism of zonisamide. Drug Metab Dispos. 1996; 24:199-202.

McCrystal M, Evans B, Harvey V, Thompson P, Porter D, Baguley B. Phase 1 study of the cytotoxic agent N-w2-(dimethylamino)ethylxacridine-4-carboxamide. Cancer Chemother Pharmacol. 1999; 44:39-44.

Kundu TK, Hille R, Velayutham M, Zweier JL. Characterization of superoxide production from aldehyde oxidase: an important source of oxidants in biological tissues. Arch Biochem Biophys. 2007; 460:113-121


Shaw S, Jayatilleke E. The role of aldehyde oxidase in ethanol-induced hepatic lipid peroxidation in the rat. Biochem J. 1990; 268:579-583


Conklin D, Prough R, Bhatanagar A. Aldehyde metabolism in the cardiovascular system. Mol Biosyst. 2007; 3:136-150.

Weigert J, Neumeier M, Bauer S, Mages W, Schnitzbauer AA, Obed A, Grooschl B, Hartmann A, Schäaffler A, Aslanidis C, Schoolmerich J, Buechler C. Small-interference RNA-mediated knock-down of aldehyde oxidase 1 in 3T3-L1 cells impairs adipogenesis and adiponectin release. FEBS Lett. 2008; 582:2965-2972


Mercader J, Ribot J, Murano I, Felipe F, Cinti S, Bonet ML, Palou A. Remodeling of white adipose tissue after retinoic acid administration in mice. Endocrinol. 2006; 147:5325-5332


Neumeier M, Weigert J, Schäaffler A, Weiss TS, Schmidl C, Büuttner R, Bollheimer C, Aslanidis C, Schöolmerich J, Buechler C. Aldehyde oxidase 1 is highly abundant in hepatic steatosis and is downregulated by adiponectin and fenofibric acid in hepatocytes
in vitro. Biochem Biophys Res Commun. 2006; 350:731-735


Pryde DC, Dalvie D, Hu Q, Jones P, Obach RS, Tran TD. Aldehyde oxidase: an enzyme of emerging importance in drug discovery. J Med Chem. 2010; 53:8441-8460


Garattini E, Terao M. Increasing recognition of the importance of aldehyde oxidase in drug development and discovery. Drug Metab Rev. 2011; 43:374-386


Halder B, Pramanick S, Mukhopadhyay S, Giri AK. Anticlastogenic effects of black tea polyphenols theaflavins and thearubigins in human lymphocytes
in vitro. Toxicol In Vitro. 2006; 20:608-613


Herbert A, Jeol LS. Sensory evaluation practices. 1993; 2nd ed New York, USA: Academic Press. p. 68-94.

Minussi RC, Rossi M, Bologna L, Cordi L, Rotilio D, Pastore GM, Duran N. Phenolic compounds and total antioxidant potential of commercial wines. Food Chem. 2003; 82:409-416


Meda A, Lamien CE, Romito M, Millogo J, Nacoulma OG. Determination of the total phenolic, flavonoid and proline contents in burkina fasan honey, as well as their radical scavenging activity. Food Chem. 2005; 91:571-577


Blois MS. Antioxidant determination by the use of a stable free radical. Nature. 1958; 181:1199-1200


Benzie IF, Strain JJ. The ferric reducing ability of plasma(FRAP) as a measure of antioxidant power: the FRAP assay. Anal Biochem. 1996; 239:70-76


Banerjee A, Dasgupta N, De B.
In vitro study of antioxidant activity of
Syzygium cumini fruit. Food Chem. 2005; 90:727-733.

Rajagopalan KV, Fridovich I, Handler P. Hepatic aldehyde oxidase: I. Purification and properties. J Biol Chem. 1962; 237:922-928.

Stirpe F, Della Corte E. The regulation of rat liver xanthine oxidase. Conversion in vitro of the enzyme activity from dehydrogenase (type D) to oxidase (type O). J Biol Chem. 1969; 244:3855-3863.

Chen YS, Liu BL, Chang YN. Effects of bacterial strains on sensory quality of Pu-erh tea in an improved pile-fermentation process. J Biosci Bioehg. 2010; 109:557-563.

Owuor PO, Obanda M, Nyirenda HE, Mphangwe NIK, Wright LP, Apostolides Z. The relationship between some chemical parameters and sensory evaluations for plain black tea (
Camellia sinensis) produced in Kenya and comparison with similar teas from Malawi and South Africa. Food Chem. 2006; 97:644-653.

Lee YK, Lee SI, Kim JS, Yang SH, Lee IA, Kim SD, Suh JW. Antioxidant activity of green tea fermented with
Monascus pilosus. J Appl Biol Chem. 2012; 55:19-25


Angayarkanni J, Palaniswamy M, Murugesan S, Swaminathan K. Improvement of tea leaves fermentation with
Aspergillus spp. pectinase. J Biosci Bioeng. 2002; 94:299-303


Zhong X, Peng L, Zheng S, Sun Z, Ren Y, Dong M, Xu A. Secretion, purification, and characterization of a recombinant
Aspergillus oryzae tannase in Pichia pastoris. Protein Expr Purif. 2004; 36:165-169


Osawa T. In: Uritani I, Garcia VV, Mendoza EM, editors. Novel natural antioxidant for utilization in food and biological system. Postharvest Biochemistry of Plant Food Material in the Tropics. 1994; Tokyo, Japan: Japan Scientific Societies Press. p. 241-251.

Angioloni A, Collar C. Buckwheat the source of antioxidant activity in functional foods. J Sci Food Agric. 2011; 91:1283-1292.

Arakawa H, Maeda M, Okubo S, Shimamura T. Role of hydrogen peroxide in bactericidal action of catechin. Biol Pharm Bull. 2004; 27:277-281


Choi CH, Song ES, Kim SJ, Kang MH. Antioxidative activities of
Castanea crenata Flos. methanol extracts. Korean J Food Sci Technol. 2003; 35:1216-1220.

Kang YH, Park YK, Oh SR, Moon KD. Studies on the physiological functionality of pine needle and mugwort extracts. Korean J Food Sci Technol. 1995; 27:978-984.

Ko MS, Yang JB. Antioxidant and antimicrobial activities of
Smilax china leaf extracts. Korean J Food Preserv. 2011; 18:764-772


Torel J, Gillard J, Gillard P. Antioxidant activity of flavonoids and reactivity with peroxy radical. Phytochem. 1986; 25:383-385


Hur SJ, Ye BW, Lee JL, Ha YL, Park GB, Joo ST. Effect of conjugated linoleic acid on color and lipid oxidation of beef patties during cold storage. Meat Sci. 2004; 66:771-775


Yasuhara A, Akiba-Goto M, Fujishiro I, Uchida H, Uwajima T, Aisaka K. Production of aldehyde oxidases by microorganisms and their enzymatic properties. J Biosci Bioeng. 2002; 94:124-129


Yamaguchi Y, Matsumura T, Ichida K, Okamoto K, Nishino T. Human xanthine oxidase changes its substrate specificity to aldehyde oxidase type upon mutation of amino acid residues in the active site: roles of active site residues in binding and activation of purine substrate. J Biochem. 2007; 141:513-524


Garattini E, Fratelli M, Terao M. The mammalian aldehyde oxidase gene family. Human Genomics. 2009; 4:119-130.

Krenitsky TA. Aldehyde oxidase and xanthine oxidase-functional and evolutionary relationships. Biochem Pharmacol. 1978; 27:2763-2764


Stoddart AM, Levine WG. Azoreductase activity by purified rabbit liver aldehyde oxidase. Biochem Pharmacol. 1992; 43:2227-2235


Itoh K. Individual and strain differences of aldehyde oxidase in the rat. Yakugaku Zasshi. 2009; 129:1487-1493.

Dambrova M, Uhle´n S, Welch CJ, Wikberg JES. Identification of an N-hydroxyguanidine reducing activity of xanthine oxidase. Eur J Biochem. 1998; 257:178-184


Moriwaki Y, Yamamoto T, Nasako Y, Takahashi S, Suda M, Hiroishi K, Hada T, Higashino K. In vitro oxidation of pyrazinamide and allopurinol by rat liver aldehyde oxidase. Biochem Pharmacol. 1993; 46:975-981


Ali S, Pawa S, Naime M, Prasad R, Ahmad T, Farooqui H, Zafar H. Role of mammalian cytosolic molybdenum Fe-S flavin hydroxylases in hepatic injury. Life Sci. 2008; 82:780-788


Rashidi MR, Nazemiyeh H. Inhibitory effects of flavonoids on molybdenum hydroxylases activity. Expert Opin Drug Metab Toxicol. 2010; 6:133-152