1. 서론
신체 내의 방어 작용인 염증 반응은 미생물 감염, 화학적 자극 등 유해한 외부 물질과 병리학적 자극에 의해 발생한다(Kalaiselvan과 Rasool, 2016). 염증 원인이 제거되지 않고 염증 매개체들에 과도하게 노출될 경우, 시간이 지나면서 세포 손상, 조직 괴사, 심지어 암과 같은 만성질환으로 이어질 수 있다(Lee 등, 2012). 면역 방어 세포인 대식세포는 염증 과정에서 가장 핵심적인 역할을 한다. 특히, 대표적인 염증 자극 물질로는 lipopolysaccharide (LPS)가 알려져 있으며, 이는 대식세포와 같은 다양한 면역 세포를 활성화시킨다(Sun 등, 2021). 자극받은 면역 세포들은 nuclear transcription factor E2 related factor 2/heme oxygenase-1, mitogen-activated protein kinases 및 nuclear factor-kappa B와 같은 염증 신호 전달 경로를 활성화시켜 inducible nitric oxide synthase (iNOS), cyclooxygenase-2 (COX-2)와 같은 염증 유발 효소뿐만 아니라 interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α), nitric oxide (NO) 및 prostaglandin E2 (PGE2) 등의 염증 인자를 생성한다(Ci 등, 2010; Peng 등, 2015). 염증 유발 효소인 iNOS는 건강한 신체에서의 정상적인 조건이 아닌 LPS와 같은 자극물질에 의해 유도되어 발현이 일어난다. 이러한 iNOS는 다량의 NO를 발생시킴으로써 생체 내에서 건강한 세포와 조직을 손상시켜 염증을 악화시킨다고 알려져 있다(Forstermann과 Sessa, 2012; Sakai 등, 2006). 또한, PGE2 생성과 연관이 있는 COX-2는 signaling cascade 촉발, 촉매적 활성 증가 등으로 인해 급성적인 발현이 유도되어 PGE2를 다량으로 생성한다(Hong 등, 2021). 다량으로 생성된 PGE2는 혈관 신생 유도 및 세포 사멸 억제 작용으로 인해 종양 성장에 기여하며, 통각 수용체를 감작시켜 신체를 염증 상태로 만드는 원인이라고 알려져 있다(Kang, 2012; Kim 등, 2007). 이러한 염증 매개체 유전자들의 발현으로 인한 염증성 매개 인자들의 생성을 조절하는 것을 핵심 타겟으로 하여 항염증제 개발이 활발히 진행되고 있다(Park 등, 2012).
알로에는 북아프리카, 중동 아시아, 남부 지중해 등의 덥고 건조한 지역에서 많이 분포되어 있으며, 약 500개의 종류가 존재한다. 이 중 알로에 아보레센스(Aloe arboresences), 알로에 베라(Aloe vera), 알로에 사포나리아(Aloe saponaria), 알로에 페록스(Aloe ferox)가 대표적이다. 알로에의 효능으로는 변비 개선 및 예방, 항산화, 항암, 항진균, 항고지혈증, 항당뇨병 등이 보고된다(Kim 등, 2022; Sanchez 등, 2020). 또한, acemannan 다당체와 anthraquinones류인 aloesin, aloin, aloenin, aloeemodin 등이 함유되어 있으며, 이 외에도 비타민, 아미노산, 토코페롤, 지방산, 미네랄 등의 성분들이 함유된 것으로 알려져 있다(Derouiche 등, 2023; Ro 등, 2020). 알로에의 주요 성분 중 하나인 acemannan은 알로에의 acetylated mannose에서 주성분인 다당체를 분리한 성분으로, 의료 및 산업 분야에서 많은 약리학적, 생물학적으로 다양한 연구가 진행되었다(Gonzalez-Delgado 등, 2023). 이는 구강 질환, 심혈관 질환, 종양 질환, 대사 질환 등의 효능뿐만 아니라, 대식세포에서 전염증성 사이토카인 분비에 대한 면역 조절 효과를 가진 것으로 알려져 있다(Darzi 등, 2021; Tavakoli 등, 2023).
Aloesin은 알로에 식물에서 유래된 천연 폴리페놀 성분으로 신체에 강력한 항산화 작용을 하며, 화상 치유, 면역 조절, 항균뿐만 아니라 멜라닌 생성에 직접적인 영향을 미치는 것으로 나타났다. 또한, 색소 침착 억제 효과와 mitogen-activated protein kinase (MAPK) pathway에 대한 저해 효과로 인한 항염증 활성을 나타내어 다양한 생물학적 효능을 가진 것으로 알려져 있다(Dini와 Laneri, 2021; Saeedi 등, 2021; Tornero-Martinez 등, 2022). 이로 인해 acemannan과 aloesin은 각각 다양한 효능을 가지고 있으며, 두 성분의 공통 효능으로는 신체 내에서 항염증 활성을 갖고 있는 것을 알 수 있다. 하지만 aloesin은 비용이 높은 단점을 갖고 있어(Jeon 등, 2022), aloesin에 비해 비용이 저렴한 acemannan을 혼합하게 되면 경제적인 장점을 높일 수 있다.
본 연구에서는 알로에의 주요 성분인 acemannan과 aloesin의 각각의 효능과 혼합 비율에 따른 항염증 활성을 규명하여 최적의 비율을 탐색하고, 기능성 소재로써 활용 가능성을 검증하고자 한다.
2. 재료 및 방법
본 실험에 사용된 물질인 acemannan과 aloesin은 ㈜네이처텍(Jincheon-gun, Chungcheongbuk-do, Korea)에서 공급받아 실험을 진행하였다. Acemannan은 알로에 베라(Aloe vera) 잎의 외피를 제거한 후 셀룰로오스 효소 처리하여 여과한 상등액을 활성탄 여과 및 농축 건조시켜 제조하였다. Aloesin은 알로에 페록스(Aloe ferox) 잎을 열수 추출 후 냉각 침지하여 얻어진 침전물을 columm chromatography를 통하여 고순도의 aloesin을 제조하였다. 시료는 단일물질인 acemannan과 aloesin, acemannan과 aloesin을 1:1 (AA-1), 1:2 (AA-2), 1:3 (AA-3), 2:1 (AA-4), 3:1 (AA-5)의 비율로 혼합한 시료 5종을 사용하여 실험을 진행하였다.
세포 배양은 fetal bovine serum (FBS), dulbecco modified eagle medium (DMEM), 100 U/mL penicillin/streptomycin을 Thermo Scientific Hyclone (Waltham, MA, USA)에서 구입하여 사용하였다. 세포 독성을 측정하기 위해 사용된 3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide (MTT)와 dimethyl sulfoxide (DMSO)는 Sigma Chemical Co. (St. Louis, MO, USA)에서 구입하였다. 이후 세포 실험에 사용된 LPS, Griess reagent 등은 Sigma Chemical Co.에서 구입하였으며, PGE2 생성량과 전염증성 사이토카인인 TNF-α 및 IL-6 생성량 측정을 위해 enzyme-linked immunosorbent assay (ELISA) kit를 이용하였고, 이는 R&D Systems, Inc. (Minneapolis, MN, USA)에서 구입하여 사용하였다. 염증 매개 물질의 단백질 발현을 확인하기 위해 iNOS 및 anti-rabbit IgG, HRP-linked antibody은 Cell signaling (Danvers, MA, USA)을 사용하였고 β-actin, COX-2 및 anti-mouse (m-IgGκ BP-HRP)는 Santa cruz biotechnology, Inc. (Dallas, Texas, USA)에서 구입하였다. 단백질 발현을 위한 시약인 immobilon western chemiluminescent HRP substrate는 Merck millipore (Burlington, MA, USA)에서 구입하여 enhanced chemiluminescence (ECL)로 사용하였다.
실험에 사용한 기기는 pH meter (STARA2110, Thermo Scientific), CO2 incubator (MCO-18AC, Pantasonic Healthcare Co., Kadomashi, Osaka, Japan), micro refrigerated centrifuge (Smart R17, Hanil Scientific Inc., Gimpo, Gyeonggi-do, Korea), microplate reader (SPECTROstar Nano, BMG LABTECH, Allmendgrun, Ortenberg, Germany), chemidoc imaging system (BIO-RAD, Hercules, CA, USA) 등을 사용하였다.
본 실험에 사용된 대식세포는 한국세포주은행(KCLB40071)에서 분양받아 사용하였으며, DMEM 배지에 FBS는 10%, 100 U/mL penicillin/streptomycin은 1%의 비율로 조제하여 세포 배양 시 배지로 사용하였다. 배양 조건은 5% CO2 incubator에서 37℃로 설정하였으며, 계대배양은 18시간 이상 배양한 후 진행하였다.
대식세포인 RAW 264.7 세포에 대한 세포 독성을 확인하기 위해 Carmichael 등의 방법(Carmichael 등, 1987)을 이용하여 실험을 진행하였다. 세포를 일정하게 배양하기 위해 cell counting 후 96 well plate에 1×104 cells/well을 분주하여 배양하였다. 이후 acemannan, aloesin 및 각 비율대로 제조한 시료들을 5, 10, 50, 100, 500, 1,000 μg/mL의 농도로 첨가하였다. 시료가 첨가된 배양액과 함께 24시간 동안 배양한 후, 2.5 mg/mL의 농도인 MTT 시약을 각 well에 40 μL씩 첨가하여 3시간 30분 배양하였다. 이후 상등액을 모두 제거하고, DMSO 100 μL씩 첨가하여 shaking을 10분간 진행한 뒤 microplate reader를 이용해 540 nm로 흡광도를 설정하여 측정하였다.
NO 생성 저해 활성은 RAW 264.7 세포를 이용하여 Green 등의 방법(Green 등, 1982)을 통해 실험을 진행하였다. 6 well plate에 RAW 264.7 세포를 3×105 cells/well의 농도로 분주하여 24시간 동안 배양한 후 각 well이 10 μg/mL의 LPS 농도를 가지도록 배양액 내에 처리하였다. LPS 처리 2시간 후 희석된 시료들을 100 μg/mL 농도로 처리하여 18시간 배양한 뒤 96 well plate에 배양액 100 μL와 griess 시약 100 μL를 혼합하여 10분간 반응시킨다. 그 후, microplate reader를 이용해 흡광도 540 nm에서 측정을 진행하였다.
RAW 264.7 세포를 3×105 cells/well로 6 well plate에 분주하고 24시간 동안 배양하여 세포를 안정화시켰다. 24시간 후 각 well에 LPS를 10 μg/mL의 농도가 되도록 처리하여 2시간 동안 반응시켰다. 염증 유도를 시킨 후 각 시료를 첨가하여 18시간 동안 배양하였으며, 배양이 완료된 배양액 800 μL를 침전물을 제거하기 위해 16,305 ×g에서 5분간 원심분리를 진행하였다. 원심분리 후 상층액 500 μL를 수거하여 PGE2의 함량을 측정하였다. 이는 ELISA kit를 이용하여 제조사에서 제공한 방법에 따라 실험을 진행하였다. PGE2 함량 측정은 microplate reader를 이용하여 450 nm의 흡광도에서 측정하였다.
염증 매개 cytokine인 TNF-α, IL-6의 생성량을 측정하기 위해 대식세포인 RAW 264.7 세포를 이용하여 실험을 진행하였다. 6 well plate에 세포를 3×105 cells/well로 분주하여 24시간 동안 배양하였다. 이후, 세포에 자극제인 LPS를 10 μg/mL의 농도로 처리하여 2시간 동안 반응시킨 후 각 시료를 농도별로 첨가하였다. 18시간 후, 배양액을 수거하여 5분간 16,305 ×g로 원심분리를 진행한 상등액을 실험에 사용하였다. TNF-α와 IL-6의 생성량은 각각의 ELISA kit를 이용하여 제조사에서 제공한 방법에 따라 실험을 진행하였다. TNF-α와 IL-6 함량 측정은 microplate reader를 이용하여 450 nm의 흡광도에서 측정하였다.
염증 매개 인자인 iNOS, COX-2 단백질 발현을 확인하기 위해 LPS로 RAW 264.7 세포의 염증을 유도하여 western blot을 진행하였다. 먼저, 100 mm cell culture dish에 RAW 264.7 세포(1×106 cells/well)를 분주하여 24시간 동안 안정화시켰다. 안정화된 세포를 확인한 뒤 자극제인 LPS를 10 μg/mL 농도로 각 well에 처리하여 2시간 동안 반응시켜 염증을 유도하였다. 2시간 후 각 시료들을 독성이 없는 구간인 10, 50, 100 μg/mL 농도로 처리하여 16시간 동안 배양하였다. 배양이 완료된 세포의 배양액을 제거하여 PBS로 2회 세척하고 lysis buffer (RIPA buffer와 protease & phosphatase single-use inhibitor cocktail 100X를 혼합한 용액)를 이용하여 세포를 용해시켰다. 용해된 세포는 20분간 원심분리(4℃, 16,305 ×g)하여 상층액을 수거하였다. 수거된 상층액은 BCA protein assay kit로 정량을 진행하였으며, 이후 10%의 acrylamide gel로 전기영동하여 단백질을 분리하였다. 분리된 단백질을 membrane (polyvinylidene fluoride)에 transfer한 뒤 skim milk를 tris-buffered saline & tween 20 (TBST)로 용해하여 5% skim milk를 제조하였으며, 이를 이용해 1시간 동안 blocking하였다. 이후 1차 항체를 3% skim milk에 희석하여 4℃에서 overnight을 진행하여 반응한 다음 TBST로 10분간 3회 membrane 세척을 진행하였다. 세척 한 membrane에 2차 항체를 첨가하여 1시간 30분 동안 반응시킨 후 제거하여 TBST로 10분간 3회 세척을 진행하였다. 그다음 ECL용액으로 membrane의 단백질을 반응시켜 chemidoc imaging system으로 결과를 확인하였다.
3. 결과 및 고찰
담황색의 기질인 MTT는 세포 내 미토콘드리아에서 호흡연쇄 효소로 인한 환원 반응이 일어나 formazan을 형성한다. 암적색인 formazan은 죽은 세포에서는 생성이 일어나지 않고, 살아있는 세포 내에서만 생성이 일어나며, 550 nm 근처에서 최대의 흡광도가 발생한다(Yoo와 Lee, 2020).
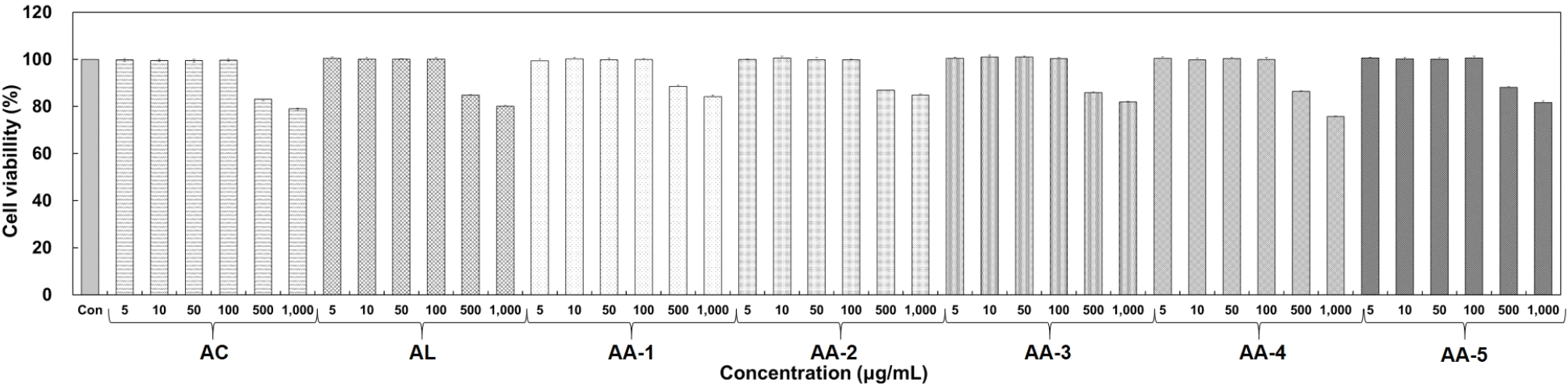
대식세포인 RAW 264.7 세포에서의 acemannan, aloesin 및 혼합 시료인 AA-1, AA-2, AA-3, AA-4, AA-5의 세포 생존율을 MTT assay를 이용하여 확인하였다(Fig. 1). Acemannan, aloesin 및 AA-1-5는 5-1,000 μg/mL의 농도로 처리하여 실험하였으며, 그 결과, 100 μg/mL 농도에서 모든 시료는 90% 이상의 세포 생존율을 나타내었다. 따라서 이후 항염증 활성 관련 세포 실험은 세포 생존율이 90% 이상인 100 μg/mL 농도로 설정하여 실험을 진행하였다.
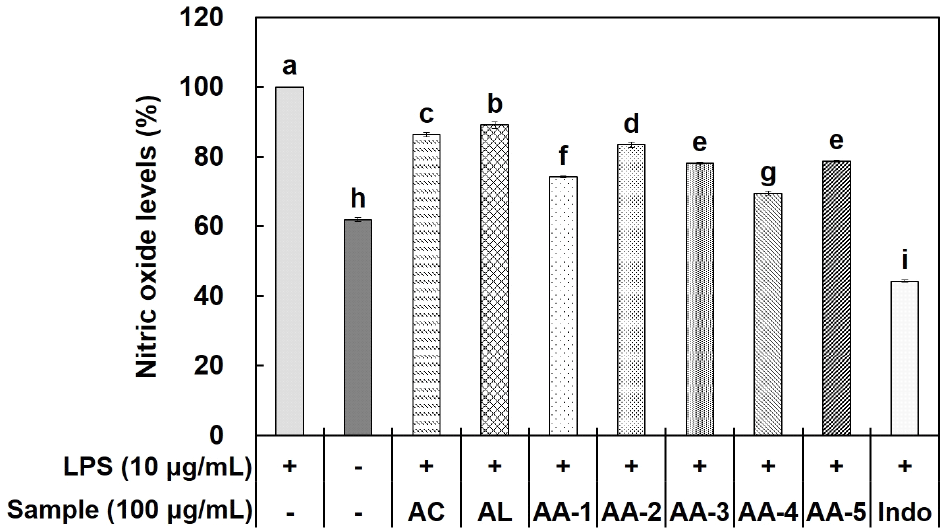
염증 반응은 선천성 면역 반응으로 생체 방어 기작 중 가장 먼저 발생하는 면역 반응이라고 알려져 있어, 면역과 염증은 서로 밀접한 관계를 가지고 있는 것을 알 수 있다. 결과적으로 선천성 면역 반응 중 가장 대표적인 물질 중 하나인 NO는 혈액 응고, 혈압 조절, 암세포 관련 면역 반응 등 다양한 기능을 가지고 있지만, 과도하게 생성될 경우 세포 손상으로 인한 다양한 질환들의 원인으로 작용한다고 알려져 있다(Lee와 Ji, 2023).
Acemannan, aloesin 및 혼합 시료인 AA-1, AA-2, AA-3, AA-4, AA-5의 NO 생성 저해 활성을 확인하고자 LPS로 유도된 RAW 264.7 세포를 이용하였다. 먼저, LPS 단독 처리군과 무처리군에 대한 차이를 확인하였으며, 각 시료의 NO 생성 저해 활성 측정 결과, 100 μg/mL 농도에서 acemannan과 aloesin은 각각 13.68%, 10.95%의 저해 효과가 나타났으며, AA-1은 25.89%, AA-2는 16.61%, AA-3는 21.85%, AA-4는 30.51%, AA-5는 21.33%의 저해 효과를 확인하였다(Fig. 2). 이는 acemannan과 aloesin을 혼합하였을 때 NO 생성 저해 효과가 더 높게 나타나는 것을 확인하여 단독으로 사용하기보다 혼합하였을 때 상승효과가 있는 것을 확인하였다. 이후 최적의 혼합비율을 찾기 위해 PGE2, TNF-α 및 IL-6 생성량 실험을 추가적으로 진행하였다.
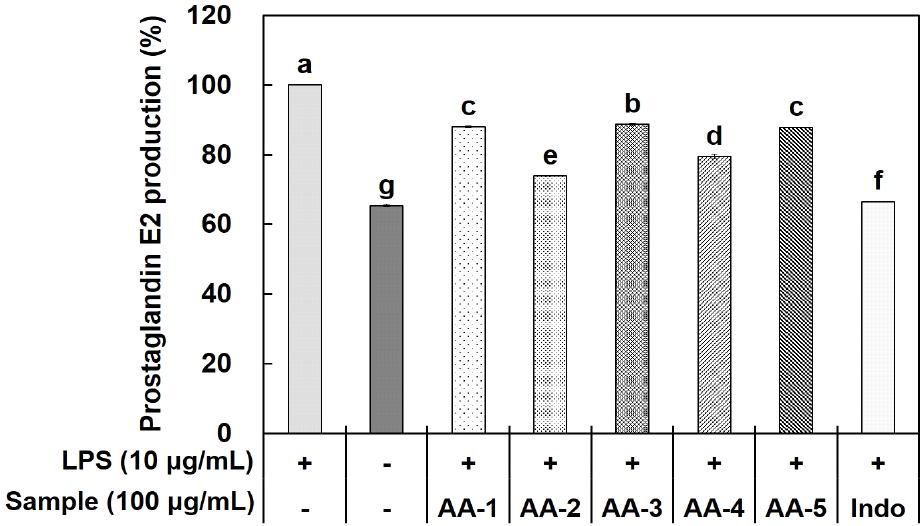
염증 반응을 유도하는 중요 인자 중 PGE2는 국소적으로 활성화되며, arachidonic acid에 의해 COX가 작용하여 합성되어지는 물질이다. 이는 angiogenesis 촉진으로 인한 암 발생과 통증, 부종 및 홍반 등의 염증반응에 동반되는 질환들을 유발한다(Jeong 등, 2012; Sun 등, 2020).
RAW 264.7 세포에 LPS 처리를 통해 증가된 PGE2 생성량을 acemannan과 aloesin을 혼합한 시료인 AA-1, AA-2, AA-3, AA-4, AA-5 처리 후 억제 효능을 확인하였다(Fig. 3). PGE2 생성 저해 활성 측정 결과, 100 μg/mL 농도에서 AA-1은 11.97%, AA-2는 26.11%, AA-3는 11.34%, AA-4는 20.53%, AA-5는 12.21% 저해 효과가 나타나는 것을 확인하였다.
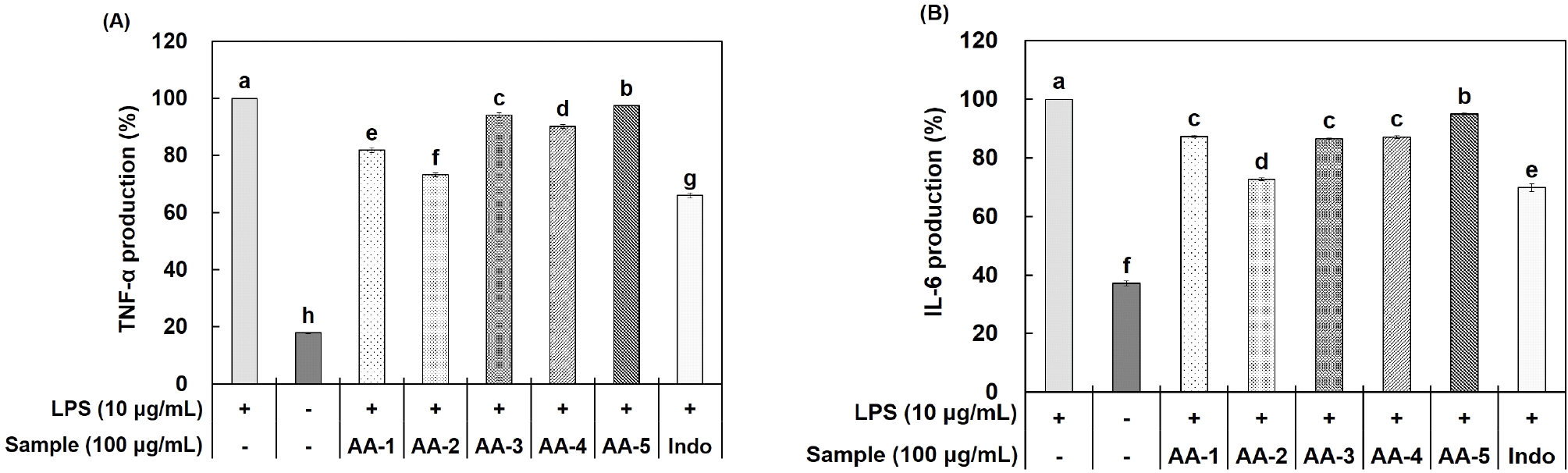
Pro-inflammatory cytokines으로 알려진 TNF-α, IL-6, IL-1β 등은 염증 조절 인자로서 염증 반응에 관여한다고 알려져 있다. TNF-α, IL-6, IL-1β는 면역계를 자극하여 만성 염증 유발 cytokine으로서 종양 형성 등에 관여한다고 알려져 있으며, 이러한 cytokine이 과다하게 생성될 경우 패혈성 쇼크 및 염증성 질환 등을 유발한다(Kim, 2017; Park 등, 2018).
Acemannan과 aloesin을 혼합한 시료인 AA-1, AA-2, AA-3, AA-4, AA-5에 대한 TNF-α 및 IL-6의 생성량 저해 활성을 측정하였다. 그 결과, Fig. 4에 나타난 바와 같이, TNF-α 생성량은 100 μg/mL 농도에서 AA-1은 18.13%, AA-2는 26.77%, AA-3는 5.97%, AA-4는 9.79%, AA-5는 2.58%의 저해 효과를 보이는 것을 확인하였다. IL-6 생성량은 100 μg/mL 농도에서 AA-1은 12.66%, AA-2는 27.33%, AA-3는 13.42%, AA-4는 12.84%, AA-5는 5.05%의 저해 효과를 나타내었다.
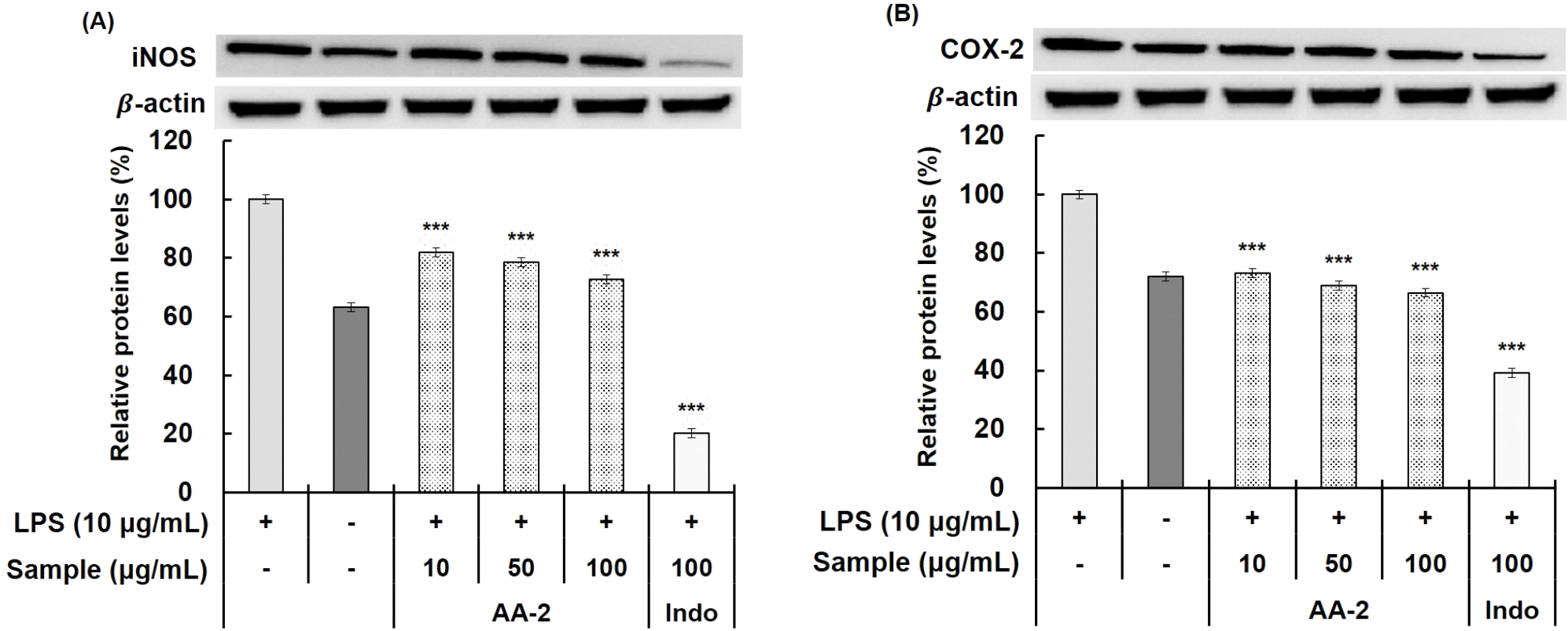
TNF-α와 IL-6와 같은 pro-inflammatory cytokine은 과발현이 일어나게 되었을 때, 염증 관련 유전자인 iNOS와 COX-2의 생성을 유도하여 NO와 PGE2 등의 염증 매개체를 생성한다(Kim 등, 2021). 하지만 NO 생성 저해 활성에서 AA-2가 AA-4에 비해 낮은 저해 활성을 보였지만, 염증 발생에 관여하는 PGE2, TNF-α 및 IL-6의 저해 활성에서 더 높은 활성을 나타내어, 본 연구에서는 AA-2를 선택하여 iNOS 및 COX-2의 단백질 발현량에 대한 실험을 진행하였다. 추후 다른 혼합 비율에 대한 항염증 활성도 추가적인 연구를 진행하여 항염증 활성 메커니즘을 확립하고자 한다.
염증 반응에 관여하는 효소인 iNOS와 COX-2는 염증 반응에서 NO와 PGE2의 생성을 조절하는 데 관여한다. 대표적으로 염증 자극에 의해 유도되는 단백질인 iNOS는 과도한 NO 생성과 염증 매개체의 생합성을 촉진하여 조직 손상, 신경 손상 및 유전자 변이 등이 일어나 염증을 심화시킨다고 알려져 있다. 또한, 염증 반응 부위에서 발현되는 COX-2는 apoptosis 억제 및 세포 증식을 촉진하여 암뿐만 아니라, 다양한 염증성, 퇴행성 질환을 발생시키는 데 중요한 역할을 한다. 이러한 염증 반응으로 인해 발생한 iNOS 및 COX-2의 발현을 조절하는 것은 항염증 반응에 관여한다는 것을 알 수 있다(Lee 등, 2010; Lee 등, 2017; Namkoong 등, 2015).
Acemannan과 aloesin을 혼합한 시료 중 PGE2 생성 저해 활성, TNF-α 및 IL-6의 생성량 저해 활성이 가장 우수한 AA-2의 iNOS, COX-2 단백질 발현량에 미치는 영향을 확인하였다(Fig. 5). AA-2는 10, 50, 100 μg/mL의 농도로 처리하였으며, 최종 농도인 100 μg/mL 농도에서 AA-2에 의한 iNOS 및 COX-2의 단백질 발현 저해 효과는 각각 25.01%, 27.27%가 나타나는 것을 확인하였다. 본 연구를 통해 acemannan과 aloesin이 혼합된 추출물은 염증 발생에 관여하는 NO, PGE2, pro-inflammatory cytokine의 생성량을 저해하는 활성을 통해 항염증 소재로써 활용 가능성이 있음을 확인하였다. 이러한 결과를 토대로 추가적인 염증 기전 검증 및 in vivo 연구 등을 통해 기능성 소재로 활용할 수 있을 것으로 기대된다.
4. 요약
현재 항염증 활성에 대한 효능이 검증된 acemannan과 aloesin을 다양한 비율로 혼합하여 비율에 따른 항염증 효능을 확인하고자 본 연구를 진행하였다. 항염증 활성은 NO, PGE2, TNF-α 및 IL-6 생성량 및 염증 관련 단백질인 iNOS, COX-2의 발현량에 대한 효능을 검증하였다. Acemannan과 aloesin 각각의 NO 생성 저해 활성 결과와 혼합 시료인 AA-1, AA-2, AA-3, AA-4, AA-5의 NO 생성 저해 활성 결과를 비교하였을 때, 혼합 시료가 더 우수한 NO 생성 저해 활성을 나타내는 것을 확인하였다. 이후 최적의 배합 비율을 찾기 위해 PGE2, TNF-α 및 IL-6 생성량에 대해 측정하였다. 그 결과, 시료 5종 모두 최종 농도인 100 μg/mL 농도에서 LPS 단독 처리군 대비 저해 효과가 나타났으며, 이 중 AA-2의 저해 효과가 가장 높은 것을 확인하여 western blot을 통한 염증 관련 단백질 발현량은 AA-2를 이용하여 실험을 진행하였다. 염증 관련 단백질인 iNOS 및 COX-2의 발현량을 측정 결과, AA-2는 농도 의존적으로 감소하였으며, 최종 농도인 100 μg/mL 농도에서 LPS 단독 처리군 대비 각각 25% 이상의 억제 효과가 나타나는 것을 확인하였다. 이러한 결과들을 토대로 acemannan과 aloesin을 다양한 비율로 배합하였을 때, 항염증 활성을 가진 것을 확인하였으며, 이 중 acemannan과 aloesin이 1:2의 비율로 혼합되었을 때 가장 높은 항염증 활성을 나타내었다. 결론적으로 acemannan과 aloesin을 혼합한 시료는 다양한 기능성 소재로써 활용이 가능하며, 이후 항염증 활성 실험들의 기초자료로도 활용이 가능한 것을 확인하였다.










