Article
쌀의 품종에 따른 미강 추출물의 이화학적 품질특성 및 항산화 활성모니터링
구율리1,
김주현1,
조준현2,
서우덕3,
홍주헌1,
윤광섭1
,4
,*

Physicochemical characteristics and antioxidant activities of rice bran extracts according to extraction solvent and cultivar
Yul Ri Gu1,
Ju Hyeon Kim1,
Jun-Hyeon Cho2,
Woo-Duck Seo3,
Joo-Heon Hong1,
Kwang-Sup Youn1
,4
,*

Author Information & Copyright ▼
1Department of Food Science and Technology, Catholic University of Daegu, Gyeongsan 38430Korea
2Department of Southern Area Crop Science, NICS, RDA, Miryang 50424Korea
3Crop Foundation Division, NICS, Wanju 55365
4Institute of Food Science and Technology, Catholic University of Daegu, Gyeongsan 38430Korea
Copyright © The Korean Society of Food Preservation. . This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Sep 13, 2018; Revised: Oct 01, 2018; Accepted: Oct 01, 2018
Abstract
Rice bran is widely used in various types of food supplement as oil, functional materials. In this study, we compared the physicochemical characteristics and antioxidant activities of rice bran extracts according to extraction solvent (water, 80% ethanol, and 80% methanol) and cultivar (Bukkyeong 2012-2, Han-ahreum, and Jasmin 85) to develop a useful food processing materials. The moisture content of rice bran powder was 8.19-9.00% depend on cultivars. Its color variables ranged as follows: L value, 50.06-55.18; a value, 2.35-2.97; and b value 11.65-13.88. The total polyphenol and total flavonoid content of 80% ethanol extract of Bukkyeong rice bran (E-BRB) extract were 6.75 and 5.18 g/100 g, respectively, which were higher than those of other extracts. Whereas, the total protein content of hot-water extract of Bukkyeong rice bran (H-BRB) was the highest, with 18.46 g/100 g. The DPPH and ABTS radical scavenging activities of E-BRB extract at 10 mg/mL concentration were 95.94% and 96.47%, respectively. The ferric-reducing antioxidant power and reducing power of E-BRB extract at 10 mg/mL concentration were 1.39 mM and 1.97, respectively. These results suggest that 80% ethanol extract of Bukkyeong rice bran can be used as a physiologically active substance for functional materials and functional food in food industry.
Keywords: rice bran, cultivar; physicochemical characteristics; antioxidant activities
서론
체내의 에너지 대사 과정에서 산소의 대부분은 산화적 인산화를 통해 정상적으로 환원되지만 그 중 일부는 인체에 유해한 활성산소나 유리기를 형성하여 인체에 장애를 일으키는 것으로 알려져 있다(1). 활성 산소는 노화와 이로 인한 많은 질환의 중요 원인으로 보고되어 있으며, 산화적 스트레스는 지질 과산화를 유도하고 단백질, 세포막 및 DNA 등을 손상시켜 세포의 노화와 변형을 유도함으로써 다양한 질병을 유발하게 된다(2). 이에 경제성장과 생활수준 향상에 따른 천연물 유래 기능성식품 소재에 대한 관심이 증가하고 있으며(3), 활성산소를 제거 할 수 있는 항산화 능력이 우수하고 안전성과 효과가 뛰어난 천연소재의 탐색이 활발히 진행되고 있다(4,5). 특히 천연물 소재의 항산화제 및 질병 치료제들이 각광받고 있고 건강한 먹거리에 대한 관심이 높아지면서 세계 2대 작물이자 우리나라의 중요한 식량자원인 쌀의 부산물인 미강에 대한 다양한 생리활성들이 보고되고 있다(6-8).
영양에 관해서 우수한 재료로 알려진 미강(rice bran)은 현미에서 정백미로 도정하는 과정에서 생기는 과피, 종피, 호분층 등의 분쇄혼합물로, 미강의 구성성분은 단백질 12-16%, 지방 16-22% 및 섬유소 8-12% 등이다. 미강의 풍부한 식이섬유는 혈중 콜레스테롤을 낮추며 또한 장내 비피더스균을 증가시켜 장내 세균의 발란스를 유지시켜 주는 기능을 가지고 있다(9). 그뿐만 아니라 미강은 vitamin B군, vitamin E, Ca, P, Mg, Fe와 같은 미네랄과 phytic acid, γ-oryzanol, α-tocopherol와 같은 항산화 물질이 다량 함유되어 천연 항산화제로 비만방지, 간장과 신장의 기능 개선(10), 염증 반응 억제 활성(11), 혈압상승 억제 작용(12) 및 혈중 콜레스테롤 저하(13) 등 다양한 생리활성을 나타내고 있어 인간의 건강 유지와 질병 예방을 위해 이들 성분을 활용하고자 하는 연구가 진행되고 있다(14,15). 또한 식생활의 다양화와 고급화로 인한 쌀 소비량 감소로 과잉 생산의 문제, 식품의 기호성 증진을 위해 과거보다 더욱 정교해지는 곡류의 도정 과정으로 인해 미강의 발생량은 계속 증가될 것으로 예측되고 있어 미강을 이용한 식품소재로서의 연구 개발이 지속적으로 이루어지고 있다(16,17). 하지만 우수한 영양과 기능적 가치를 함유하고 있음에도 불구하고 미강은 식품의 식미를 떨어뜨리고 저장성이 매우 낮아 연간 40만 톤의 미강 생산량 중 약 20-30% 정도만이 미강유 추출의 원료로 쓰이고 나머지는 사료나 유기질 비료로 이용되고 있어 효과적인 활용에는 어려움을 겪고 있는 실정이다(6,18). 반면 국외에서는 미강의 영양학적, 기능적 특성을 고려한 식품 개발을 꾸준히 하여 고섬유질 빵, 머핀, 쿠키, 크래커 등 구운 제품에 많이 활용하고 있다(19).
따라서 본 연구에서는 쌀 가공 부산물인 미강의 추출용매 및 품종별 품질특성과 항산화 활성을 조사하여, 기능성 소재 및 생리활성 자원으로서 다양한 활용방안을 제시하고자 하였다.
재료 및 방법
실험재료
본 연구에 사용한 미강의 품종은 3종(Bukkyeong 2012-2(북경), Jasmin 85(자스민) 및 한아름)으로 2017년 수확하여 정미기(LH-5000M, Hwangso Co., Daegu, Korea)로 10분도로 정미한 후 얻어진 미강을 국립식량과학원으로부터 제공받아 사용하였다. 미강은 분쇄기(RT-04, Hanli Co., Sejong, Korea)로 분쇄하여 60 mesh 표준망체(Chung Gye Sang Cong Sa, Seoul, Korea)를 통과한 분말을 -20℃ 이하 암소에서 보관하면서 추출용 시료로 사용하였다.
수분함량 및 색도 측정
미강 분말의 수분함량은 시료 0.5 g을 petridish에 담아 적외선 수분측정기(MB-45, Mositure analyzer, INC., Ohaus, NJ, USA)를 이용하여 105℃에서 분말의 수분함량이 항량에 도달할 때까지 건조하여 측정하였다. 색도는 표준색도 Y=86.6, x=0.3160, y=0.3214로 보정된 chromameter(CR-400, Minolta Co., Osaka, Japan)를 이용하여 측정하였으며, L 값(brightness), a 값(redness-greenness), b 값(yellowness-blueness)을 3회 반복 측정하여 평균치로 나타내었다.
미강 추출물 제조
미강 분말 10 g에 10배의 용매(증류수, 80% 에탄올 및 80% 메탄올)를 가한 다음 환류냉각추출기(CA-1112, Eyela Co., Tokyo, Japan)로 각각 100℃ 및 80℃에서 4시간 추출하였다. 추출 후, 불순물을 제거하기 위하여 여과지(No.2, Whatman International Ltd., Leicestershire, UK)를 이용하여 여과하였다. 여과된 용액은 감압농축기(Model N-1N, Eyela Co., Tokyo, Japan)로 농축한 다음, 동결건조기(Free Zone 2.5, Labconco Co., Kansas, MO, USA)로 건조하여 -70℃ 이하의 암소에 보관하면서 분석용 시료로 사용하였다.
추출수율 측정
추출용매에 따른 추출물의 수율은 동결건조(Free Zone 2.5, Labconco Co.)한 다음 건물 중량을 구하였고 시료 조제에 사용한 원료 건물량에 대한 백분율로 나타내었다.
총 폴리페놀 함량 측정
총 폴리페놀 함량은 Folin-Denis법(20)에 따라 시료 1 mL에 1 N Folin Ciocalteu reagent 1 mL를 첨가하고 충분히 혼합한 다음 20% Na2CO3 1 mL를 첨가하여 실온의 암소에서 30분간 반응시킨 후 분광광도계(Ultrospec 2100pro, Biochrom Ltd., Cambridge, UK)를 이용하여 725 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 tannic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하여 작성한 표준곡선으로부터 계산하였다.
총 플라보노이드 함량 측정
총 플라보노이드 함량은 Jia 등(21)의 방법을 응용하여 측정하였다. 시료 1 mL에 5% NaNO2 150 μL를 혼합하여 실온에서 6분간 반응 시킨 후 10% AlCl3 300 μL와 혼합하여 다시 실온에서 5분간 반응 시킨 후 1 N NaOH 1 mL와 혼합한 다음 분광광도계(Ultrospec 2100pro, Biochrom Ltd.)를 이용하여 510 nm에서 흡광도를 측정하였다. 총 플라보노이드함량은 rutin(Sigma-Aldrich Co.)을 사용하여 작성한 표준곡선으로부터 계산하였다.
총 단백질 함량 측정
총 단백질 함량은 Lowry 등(22)의 방법으로 측정하였다. 실험 전, A(Na2CO3 5 g을 0.5 N NaOH 50 mL 용해), B(CuSO4·5 H2O 0.2 g을 증류수 20 mL 용해) 및 C(potassium tartarate 0.4 g을 증류수 20 mL 용해)를 각각 제조한 다음 이를 혼합하여 D(A: 30 mL, B: 1.5 mL 및 C: 1.5 mL)를 제조하였다. 그 후, E(2 N Folin-Ciocalteu 4.5 mL를 증류수 45 mL 용해)를 제조하여 준비하였다. 시료 1 mL에 D 1 mL 첨가 후, 15분간 실온에서 방치한 다음, E 3 mL 첨가하여 다시 45분간 실온에서 방치하고 분광광도계(Ultrospec 2100pro, Biochrom Ltd.)를 이용하여 540 nm에서 흡광도를 측정하였다. 총 단백질 함량은 bovine serum albumin(BSA, Sigma-Aldrich Co.)을 표준곡선으로 이용하여 계산하였다.
DPPH radical 소거활성 측정
DPPH radical 소거활성은 1,1-diphenyl-2-pycrylhydrazyl (DPPH)의 환원력을 이용하여 측정하였다(23). 즉, DPPH reagent는 DPPH 12 mg을 absolute ethanol 100 mL에 용해한 후 증류수 100 mL 첨가하여 흡광도를 517 nm에서 약 1.6으로 조정하여 제조하였다. 시료 0.5 mL에 DPPH reagent 5 mL를 혼합하여 실온에서 15분간 반응시킨 후 분광광도계(Ultrospec 2100pro, Biochrom Ltd.)로 흡광도를 측정하고 아래와 같이 계산하였다.
ABTS radical 소거활성 측정
2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS) radical 소거활성(24)은 7.4 mM ABTS(Sigma-Aldrich Co.)와 2.45 mM potassium persulfate를 최종 농도로 혼합하여 실온인 암소에서 24시간 동안 방치하여 ABTS+을 형성시킨 후 732 nm에서 흡광도 값이 0.70±0.02가 되게 phosphate buffer saline(PBS, pH 7.4)으로 희석하였다. 희석된 용액 180 μL에 시료 20 μL를 혼합하여 정확히 1분간 반응시킨 다음 분광광도계(Ultraspec 2100pro, Biochrom Ltd.)를 이용하여 732 nm에서 흡광도를 측정하였다. ABTS radical 소거활성은 추출물의 첨가 전과 후의 차이를 아래와 같이 백분율로 나타내었다.
Ferric reducing antioxidant power(FRAP) 측정
FRAP는 Benzie와 Strain의 방법(25)에 따라 다음과 같이 측정하였다. FRAP reagent는 25 mL acetate buffer(300 mM, pH 3.6)를 37℃에서 가온한 후, 40 mM HCl에 용해한 10 mM 2,4,6-tris(2-pyridyl)-s-triazine(TPTZ, Sigma-Aldrich Co.) 2.5 mL와 20 mM ferric chloride(FeCl3) 2.5 mL를 첨가하여 제조하였다. 시료 30 μL에 제조된 FRAP reagent 900 μL와 증류수 90 μL를 넣은 후 37℃에서 10분간 반응시킨 후 분광광도계(Ultraspec 2100pro, Biochrom Ltd.)를 이용하여 510 nm에서 흡광도를 측정하였다. FRAP는 FeSO4·7H2O (Sigma-Aldrich Co.)을 정량하여 작성한 표준곡선으로부터 계산하였다.
환원력 측정
환원력은 Oyaizu(26)의 방법에 따라 다음과 같이 측정하였다. 시료 1 mL에 0.2 M phosphate buffer(pH 6.6) 2.5 mL와 1% potassium ferricyanide(Duksan pure chemicals Co., Ltd., Ansan, Korea) 용액 2.5 mL를 가한 후 50℃에서 30분간 반응시켰다. 반응 후 10% trichloroacetic acid(Duksan pure chemicals Co.) 용액 2.5 mL를 가하여 원심분리한 후, 상등액 2.5 mL에 증류수 2.5 mL와 0.1% ferric chloride(Duksan pure chemicals Co.) 용액 0.5 mL를 혼합한 다음 분광광도계(Ultraspec 2100pro, Biochrom Ltd.)를 이용하여 700 nm에서 흡광도를 측정하였다.
통계처리
모든 실험결과는 IBM SPSS Statistics(19.0, IBM Corp., Armonk, NY, USA)를 이용한 분산분석(ANOVA)을 실시하였고 각 측정 평균값의 유의성(p<0.05)은 Duncan's multiple range test를 실시하여 검정하였다.
결과 및 고찰
수분함량 및 색도
미강 3종(Bukkyeong 2012-2(북경), Jasmin 85(자스민) 및 한아름) 분말의 수분함량 및 색도는 Table 1과 같다. 수분함량은 북경, 한아름 및 자스민 미강 분말에서 각각 8.30%, 9.00% 및 8.19%로 한아름 미강 분말에서 가장 높게 나타났다.
Table 1. .
The moisture contents and color values of rice bran
| Sample1) |
Moisture contents
(%) |
Color values |
| L |
a |
b |
| BRB |
8.30±0.02b2) |
55.18±0.05a |
2.97±0.02a |
13.88±0.02a |
| HRB |
9.00±0.06a |
53.31±0.02b |
2.35±0.03c |
12.43±0.02b |
| JRB |
8.19±0.04c |
50.06±0.05c |
2.52±0.03b |
11.65±0.03c |
Download Excel Table
색도는 L 값, a 값 및 b 값이 각각 50.06-55.18, 2.35-2.97 및 11.65-13.88로, 북경 미강 분말에서 L 값, a 값 및 b 값이 모두 높게 나타났으나, 미강 품종에 따른 색도차이는 크게 나타나지 않았다. Shin 등(27)의 볶은 미강을 첨가한 식빵의 품질특성에서 볶음 미강의 첨가량이 증가할수록 L 값은 감소하고 a 값 및 b 값이 증가한다고 보고하였으며, Lee 등(28)의 도정률에 따른 향미벼의 이화학적 품질특성에서 도정률이 증가할수록 L 값이 증가하고 a 및 b 값이 감소한다고 보고하여, 향후 미강 분말을 첨가한 제품은 첨가량에 따라 색도에 영향을 줄 것으로 판단된다.
수율, 총 폴리페놀, 총 플라보노이드 및 총 단백질 함량
추출용매 및 품종에 따른 미강 추출물의 수율, 총 폴리페놀, 총 플라보노이드 및 총 단백질 함량은 Table 2와 같다. 수율은 4.67-9.60%로, 다른 추출물에 비해 한아름 추출물에서 높은 추출수율을 나타내었으며, 모든 시료에서 80% 에탄올 및 80% 메탄올 추출물보다 열수 추출물의 추출수율이 높게 나타났다. Jeon 등(29)의 미강 에탄올 추출물의 수율은 4.50%로 나타나 본 연구 결과와 유사하였으나 Jung 등(30)의 미강 추출물의 수율은 에틸아세테이트 추출물은 2.6%, 알칼리 분해 후 에틸에세테이트 추출물은 3%, 80% 메탄올 추출물은 1.35%로 나타나 본 연구에서의 북경, 자스민 및 한아름미의 미강 추출물의 수율이 높은 것으로 나타났다.
Table 2. .
The yield, total polyphenol, total flavonoid, and total protein contents of rice bran extracts prepared by different extraction solvents and cultivar
| Sample1) |
Yield (DB2), %) |
Total polyphenol (TA3), g/100 g) |
Total flavonoid (Rutin, g/100 g) |
Total protein (BSA, g/100 g) |
| H-BRB |
8.97±0.07b4) |
3.74±0.05d |
4.70±0.39bc |
18.46±0.12a |
| E-BRB |
4.80±0.01g |
6.75±0.16a |
5.11±0.05a |
13.82±0.09d |
| M-BRB |
4.67±0.03g |
5.04±0.12c |
4.95±0.19ab |
15.41±0.13b |
| H-HRB |
9.60±0.02a |
3.09±0.06e |
4.08±0.09e |
15.60±0.23b |
| E-HRB |
6.77±0.13d |
6.20±0.07b |
5.18±0.07a |
12.90±0.06ef |
| M-HRB |
6.78±0.06d |
5.17±0.03c |
4.21±0.08de |
13.23±0.34e |
| H-JRB |
8.70±0.05c |
2.08±0.07f |
4.42±0.02cd |
14.52±0.17c |
| E-JRB |
5.37±0.11e |
5.26±0.18c |
5.08±0.25a |
12.57±0.51f |
| M-JRB |
5.13±0.03f |
5.12±0.08c |
4.56±0.11c |
13.76±0.26d |
Download Excel Table
총 폴리페놀 및 총 플라보노이드 함량은 각각 2.08-6.75 g/100 g 및 4.08-5.18 g/100 g 으로 대체로 북경 추출물에서 높게 나타났으며, 모든 시료에서 열수 추출물보다 80% 에탄올 및 80% 메탄올 추출물에서 높은 함량을 나타내는 경향이었다. Jung 등(30)의 미강 페놀산 농축물의 특성 및 항산화 활성에서 에틸아세테이트, 80% 메탄올 및 알칼리 분해 추출법으로 시료를 제조하여 총 폴리페놀함량을 측정한 결과, 22.64-744.57 mg/100 g으로 본 연구의 추출물이 더 높은 함량을 나타내었으며, 곡류에 함유되어 있는 페놀 화합물들은 우수한 항산화력을 가진다고 알려져 있어(31) 폴리페놀 함량이 높은 시료에서 우수한 항산화 활성을 나타낼 것으로 판단된다.
또한 총 단백질 함량은 12.57-18.46 g/100 g으로, 북경 추출물에서 높게 나타났으며, 모든 시료에서 80% 에탄올 및 80% 메탄올 추출물보다 열수 추출물에서 높은 함량을 나타내었다. Kim 등(32)의 품종 및 도정도별 보릿가루의 이화학적 특성에서 도정도별 조단백질 함량은 도정도가 감소함에 따라 함량이 증가하는 경향을 나타내었다. 이는 미강 내 단백질 함량이 12-15% 정도 차지하고 있으며, 곡류의 단백질 등 여러 가지 영양성분과 섬유질이 배유 중심으로부터 바깥부분으로 증가하기 때문이라 판단된다(33,34).
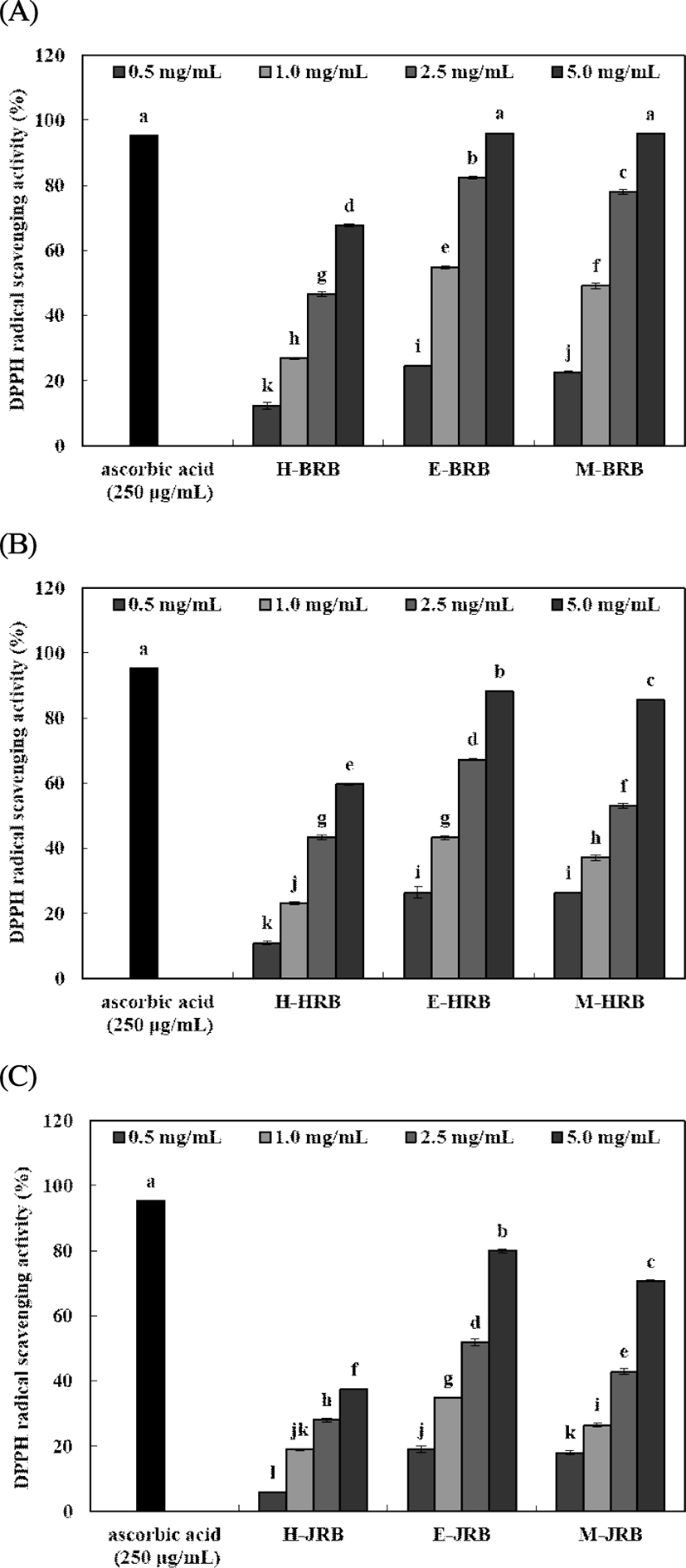
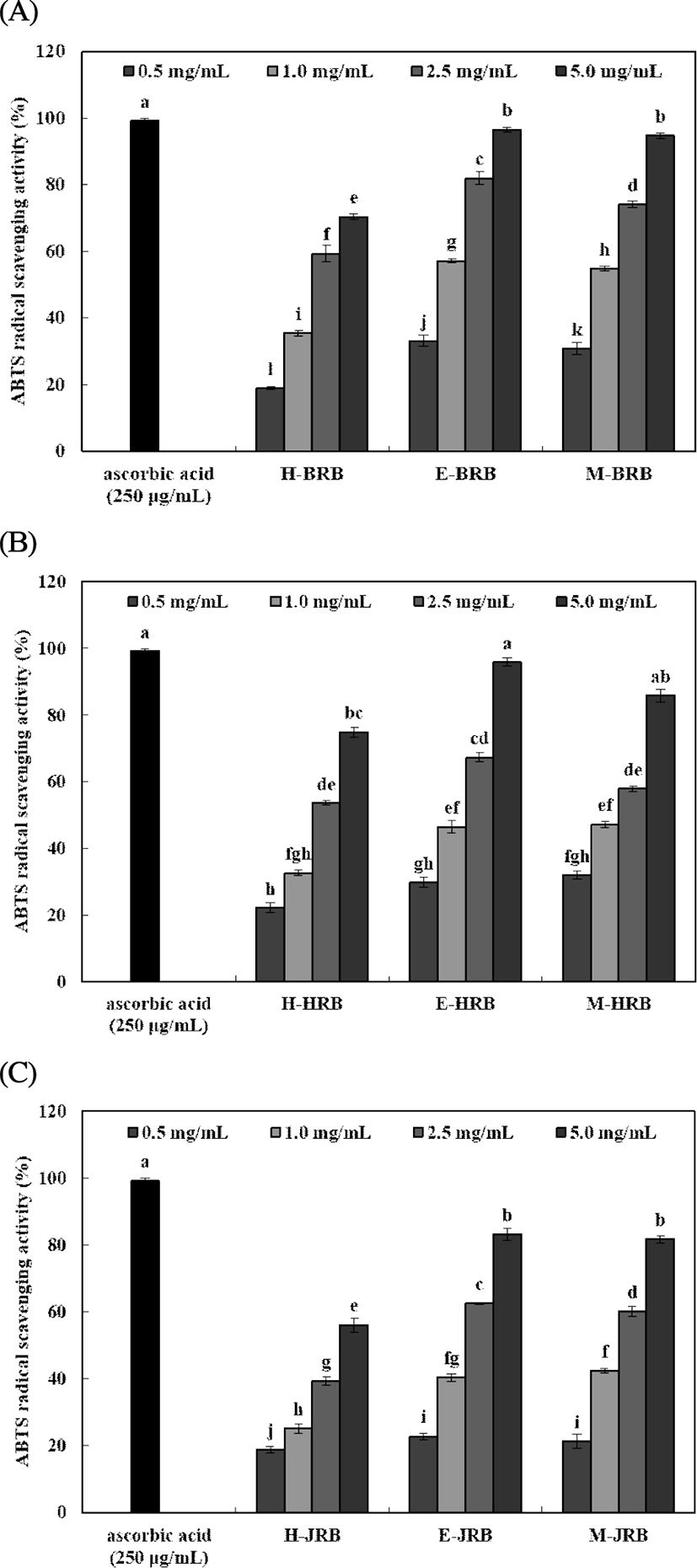
DPPH 및 ABTS radical 소거활성
추출용매 및 품종에 따른 미강 추출물의 DPPH 및 ABTS radical 소거활성은 Fig. 1 및 Fig. 2와 같다. DPPH radical 소거활성은 0.5-5.0 mg/mL 농도로 실험한 결과, 북경 추출물에서 12.44-95.94%, 한아름 추출물에서 10.90-88.08% 및 자스민 추출물에서 5.80-79.98%으로 나타났다. 5.0 mg/mL 농도에서 북경, 한아름 및 자스민 추출물 순으로 높은 DPPH radical 소거활성을 나타내었으며, 80% 에탄올 추출물에서 가장 높은 함량을 나타내었다. Oh 등(16)은 홍진주, 흑광 및 여러 품종의 미강 70% 에탄올 추출물 1 mg/mL 농도에서 DPPH radical 소거활성은 90%, 82.89% 및 9.91-34.58%로 가장 높게 나타났는데, 이는 본 연구에서 다른 추출용매보다 80% 에탄올 추출물에서 radical 소거활성이 높게 나타난 경향과 유사하게 나타났다. 또한 Lee 등(2)의 미강추출물의 항산화 활성 연구에서는 물과 에탄올 추출에 따른 연구에서는 물 추출물이 67.12% 및 71.15%로 나타났으며, 에탄올 추출물은 89.43% 및 92.38%로 나타나 에탄올 추출물의 radical 소거활성이 높아 본 연구와 유사하였다. Jeon 등(29)의 미강 에탄올 추출물의 연구에서는 125 μg/mL, 250 μg/mL에서 각각 70%, 90%의 소거능을 보여 높은 항산화력을 나타내었다.
Fig. 1. .
DPPH radical scavenging activity of rice bran extracts prepared by different extraction solvents and cultivar.
A, Bukkyeong 2012-2 rice bran extracts; B, Han-ahreum rice bran extracts; C, Jasmin 85 rice bran extracts. Means±SD (n=3) with different letters (a-l) above bars are significantly different by Duncan's multiple range test (p<0.05).
Download Original Figure
Fig. 2. .
ABTS radical scavenging activity of rice bran extracts prepared by different extraction solvents and cultivar.
A, Bukkyeong 2012-2 rice bran extracts; B, Han-ahreum rice bran extracts; C, Jasmin 85 rice bran extracts. Means±SD (n=3) with different letters (a-l) above bars are significantly different by Duncan's multiple range test (p<0.05).
Download Original Figure
ABTS radical 소거활성은 0.5-5.0 mg/mL 농도로 실험한 결과, 북경 추출물에서 18.91-96.47%, 한아름 추출물에서 22.21-95.91% 및 자스민 추출물에서 18.77-83.09%으로 나타났다. Jung 등(30)의 미강 페놀산 농축물의 연구의 경우, 알칼리 분해 후 에틸에세테이트 추출물의 ABTS radical 소거활성은 10 μg/mL 농도에서 98%의 활성을 나타내어높은 항산화성을 나타내었다. 또한 ABTS radical 소거활성은 DPPH radical 소거활성과 유사하게 5.0 mg/mL 농도에서 북경, 한아름 및 자스민 추출물 순으로 높은 radical 소거활성이 나타났다. Chun 등(35)은 도정분획별 쌀의 항산화 활성을 조사한 결과 쌀의 도정률이 감소할수록 항산화 활성이 증가한다고 보고하여 미강에는 항산화 물질이 함유되어 있는 것으로 판단된다. 또한 Park 등(8)의 미강 추출물의 항산능 연구에서는 DPPH radical 소거활성은 용매를 메탄올로 쓰기 때문에 수용성 용액을 용매로 사용하는 ABTS radical 소거활성보다 높게 나타날 경우 폴리페놀류와 같은 지용성 성분이 많은 것으로 해석할 수 있으며, 반대의 경우 항산화 활성이 지용성 물질보다 수용성 고분자 물질에 많이 존재하는 것으로 예측하였다. 본 실험의 경우는 ABTS 라디칼에 대한 항산화능이 상대적으로 높아 수용성 항산화물질이 더 많이 존재함을 추측할 수 있었다.
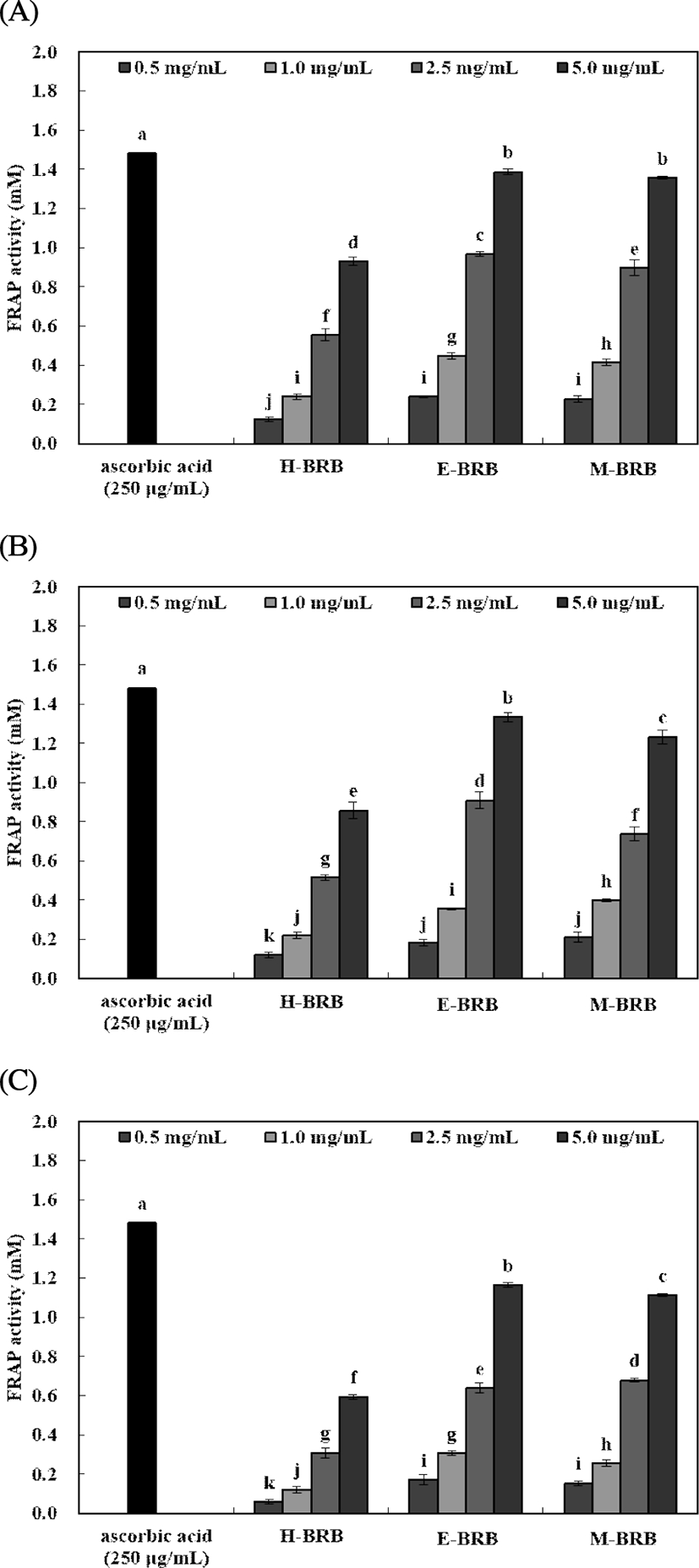
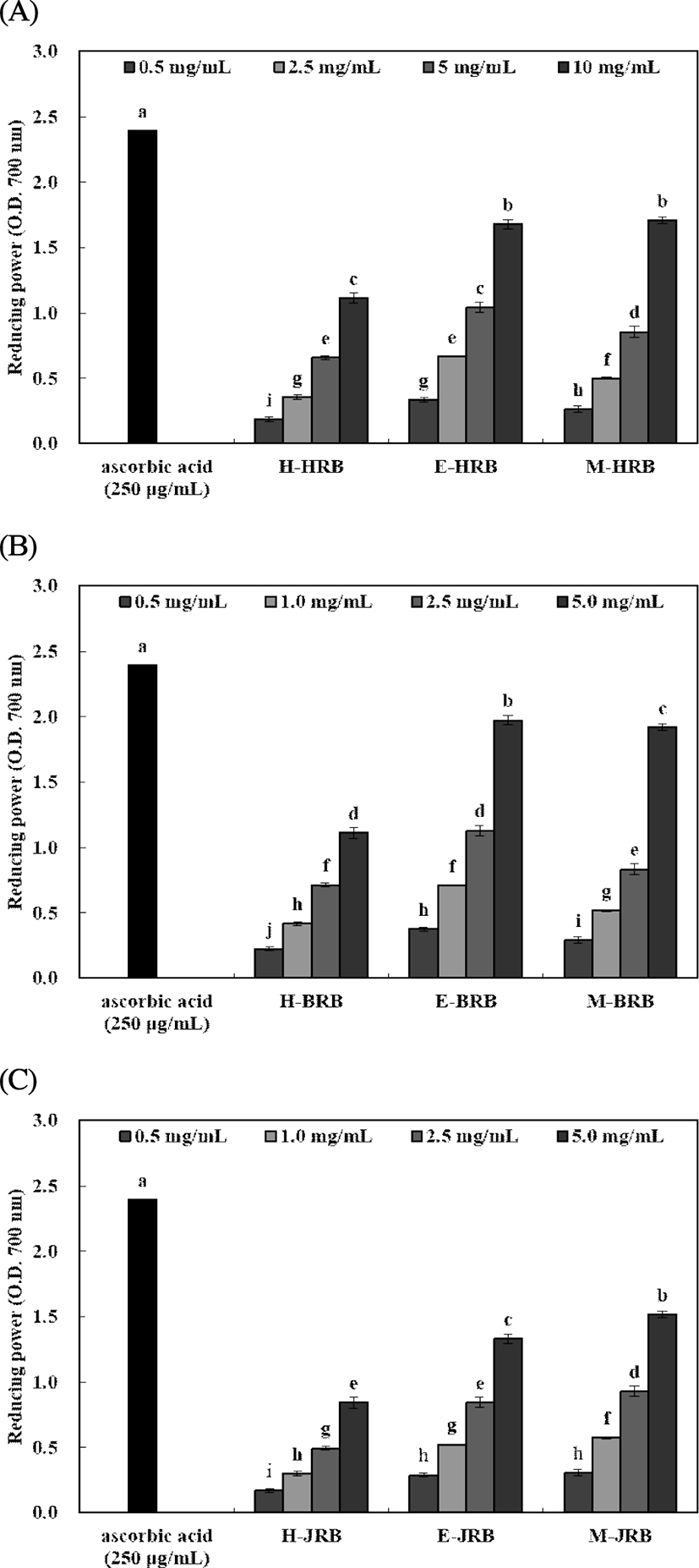
FRAP 활성 및 환원력
추출용매 및 품종에 따른 미강 추출물의 FRAP 활성 및 환원력은 Fig. 3 및 Fig. 4와 같다. FRAP 활성은 0.5-5.0 mg/mL 농도로 실험한 결과, 북경 추출물에서 0.12-1.39 mM, 한아름 추출물에서 0.12-1.33 mM 및 자스민 추출물에서 0.06-1.17 mM로 나타났다. FRAP 활성은 5.0 mg/mL 농도에서 북경 및 한아름 추출물은 유사한 활성을 나타내었으며, 자스민 추출물에서 낮은 활성을 나타내었다. Sim 등(36)의 연구에서 모든 혼합물 내 미강 함유량이 증가함에 따라 FRAP 활성 또한 유의적으로 증가하는 경향을 나타내었으며, Lee 등(6)이 보고한 미강의 항산화 활성에 대한 연구 결과와 유사한 것을 확인하였다.
Fig. 3. .
FRAP(ferric reducing antioxidant power) activity of rice bran extracts prepared by different extraction solvents and cultivar.
A, Bukkyeong 2012-2 rice bran extracts; B, Han-ahreum rice bran extracts; C, Jasmin 85 rice bran extracts. Means±SD (n=3) with different letters (a-k) above bars are significantly different by Duncan's multiple range test (p<0.05).
Download Original Figure
Fig. 4. .
Reducing power of rice bran extracts prepared by different extraction solvents and cultivar.
A, Bukkyeong 2012-2 rice bran extracts; B, Han-ahreum rice bran extracts; C, Jasmin 85 rice bran extracts. Means±SD (n=3) with different letters (a-j) above bars are significantly different by Duncan's multiple range test (p<0.05).
Download Original Figure
환원력은 0.5-5.0 mg/mL 농도로 실험한 결과, 북경 추출물에서 0.23-1.97, 한아름 추출물에서 0.19-1.71 및 자스민 추출물에서 0.17-1.52로 나타났다. 5.0 mg/mL 농도에서 북경, 한아름 및 자스민 추출물 순으로 높은 환원력을 나타냈으며, 80% 에탄올 및 80% 메탄올에서 유사하게 나타났다. Oh 등(16)의 벼 품종별에 따른 항산화 효과 연구에서는 환원력을 측정하였을 때 미강 추출물의 경우 1 mg/mL 농도에서는 0.03-0.35로 나타나 본 연구 결과와 유사하였다. 또한 추출용매 및 품종에 따른 미강 추출물의 항산화 활성을 확인한 결과는 Chung 등(37)이 보고한 흑미 유래 페놀 화합물의 항산화 활성에서 높은 폴리페놀 함량을 나타내는 분획물은 항산화 활성 또한 우수함을 확인한 연구결과와 유사하게 나타났으며, 이는 80% 에탄올에 의해 추출된 폴리페놀 및 플라보노이드 성분이 주요 항산화 물질일 것으로 추정되며 좀 더 구체적인 성분 분석 등의 연구 진행이 필요하다.
요 약
본 연구에서는 미강을 다양한 가공식품소재로 활용하기 위해 추출용매와 북경, 한아름 및 자스민 3품종에 따른 미강 추출물의 품질특성 및 항산화 활성을 확인하였다. 미강 3종 분말의 이화학적 특성에서 수분함량은 8.19-9.00%로 모두 유사하게 나타났으며, 색도 또한 L 값(50.06-55.18), a 값(2.35-2.97) 및 b 값(11.65-13.88)이 미강 품종에 따른 차이는 크게 나타나지 않았다. 미강 추출물의 수율은 4.67-9.60%로 나타났으며, 총 폴리페놀, 총 플라보노이드 및 총 단백질 함량은 각각 2.08-6.75 g/100 g, 4.08-5.18 g/100 g 및 12.57-18.46 g/100 g으로 나타났으며, 모두 북경 추출물에서 높게 나타났으나, 총 폴리페놀 및 총 플라보노이드 함량은 80% 에탄올 추출물에서, 총 단백질 함량은 열수 추출물에서 높게 나타났다. 항산화 활성을 확인하기 위해 진행한 DPPH, ABTS radical 소거활성, FRAP 활성 및 환원력은 0.5-5.0 mg/mL 농도로 진행하였으며, 모두 총 폴리페놀 및 총 플라보노이드 함량이 높게 나타난 북경, 한아름 및 자스민 추출물 순으로 높은 항산화 활성을 나타내었다. 이러한 결과는 북경 80% 에탄올 추출물에 항산화 물질이 많이 함유되어 있는 것으로 판단되며, 미강을 이용한 기능성 소재 및 생리활성 자원으로서의 활용 가능성을 확인하였다.
Acknowledgements
본 연구는 농촌진흥청 어젠다사업(과제번호: PJ011647032018)의 연구비 지원에 의해 연구되었으며, 이에 감사드립니다.
References
CrossCE, HalliwellB, BorishET, PryorWA, AmesBN, SaulRL, MccordJM, HarmanD. 1987; Oxygen radical and human disease. Ann Intern Med. 107:526-545.

LeeJH, ParkJS. 2015; Antioxidant activities of rice bran extracts for wellness convergence. J of digital convergence. 13:401-406


MoonJS, ChoiSS, LeeSY, YimDS. 2015; Antioxidant activities and anti-inflammatory effects of rice bran and wheat bran extracts. Korean J Pharmacogn. 46:140-147.

BaeSM, KimJH, ChoCW, JeongTJ, HaJU, LeeSC. 2001; Effect of microwave treatment on the antioxidant activity of rice processed by-products. J Korean Soc Food Sci Nutr. 30:1026-1032.

HalliwellB. 1996; Antioxidants in human health and disease. Annu Rev Nutr. 16:33-50


LeeJH, OhSK, KimDJ, YoonMR, ChunAR, ChoiIS, LeeJS, KimYG. 2013; Comparison of antioxidant activities by different extraction temperatures of some commercially available cultivars of rice bran in Korea. Korean J Food Nutr. 26:1-7


WooKM, LeeYS, KimYH. 2005; Antioxidant effects of tocotrienol in rice bran. Korean J Crop Sci. 50:4-7.

ParkTS, LeeSY, KimHJ, KimKT, KimYJ, JeongIH, DoWN, LeeHJ. 2009; Extracts of adlay, barley and rice bran have antioxidant activity and modulate fatty acid metabolism in adipocytes. Korean J Food Nutr. 22:456-462.

Chae GY, Kwon RH, Jang MW, Kim MJ, Ha BJ (2011) Whitening and antioxidative effect of rice bran fermented by Bacillus subtilis. J Soc Cosmet Sci Korea, 37, 153-159
ChaeGY, KwonRH, JangMW, KimMJ, HaBJ. 2011; Whitening and antioxidative effect of rice bran fermented by
Bacillus subtilis. J Soc Cosmet Sci Korea. 37:153-159.

BaeSM, KimJH, ChoCW, JeongTJ, YookHS, ByunMW, LeeSC. 2002; Effect of γ-irradiation on the antioxidant activity of rice hull, rice bran and bran. J Korean Soc Food Sci Nutr. 31:246-250.

ChoiSP, KangMY, NamSH. 2004; Inhibitory activity of the extracts from the pigmented rice brans on inflammatory reactions. J Korean Soc Appl Biol Chem. 47:222-227.

Lee KY, Kim JH, Son JR, Lee JS (2001) Detection and extraction condition of physiological compounds from bran of Heugjinju rice (Oryza sativa L.). Korean J Postharvest Sci Technol, 8, 296-301
LeeKY, KimJH, SonJR, LeeJS. 2001; Detection and extraction condition of physiological compounds from bran of
Heugjinju rice (
Oryza sativa L.). Korean J Postharvest Sci Technol. 8:296-301.

HaTY, HanS, KimSR, KimIH, LeeHY, KimHK. 2005; Bioactive components in rice bran oil improve lipid profiles in rats fed a high-cholesterol diet. Nutr Res. 25:597-606


ScalbertA, ManachC, MorandC, RemesyC. 2005; Dietary polyphenols and the prevention of diseases. Crit Rev Food Sci Nutr. 45:287-306.

GrafE, EatonJW. 1990; Antioxidant functions of phytic acid. Free Radical Biol Med. 8:61-69


OhSK, KimDJ, ChunAR, YoonMR, KimKJ, LeeJS, HongHC, KimYK. 2010; Antioxidant compounds and antioxidant activities of ethanol extracts from milling by-products of rice cultivars. J Korean Soc Food Sci Nutr. 39:624-630


HongSG. 2005; Development of immunostimulation materials from rice bran. Food Industry and Nutrition. 10:42-47.

KimYS, HaTY, LeeSH, LeeHY. 1997; Properties of dietary fiber extract from rice bran and application in bread-making. Korean J Food Sci Technol. 29:502-508.

JangKH, KwakEJ, KangWW. 2010; Effect of rice bran powder on the quality characteristics of cookie. Korean J Food Preserv. 17:631-636.

SingletonVL, RossiJA. 1965; Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. Am J Enol Vitic. 16:144-158.

JiaZ, TangM, WuJ. 1999; The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals. Food Chem. 64:555-559.

LowryOH, RosebroughNJ, FarrAL, RandallRJ. 1951; Protein measurement with the folin phenol reagent. J Biol Chem. 193:265-275.

BloisMS. 1958; Antioxidant determinations by the use of a stable free radical. Nature. 181:1199-1200


ReR, PellegriniN, ProteggenteA, PannalaA, YangM, Rice-EvansC. 1999; Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med. 26:1231-1237


BenzieIF, StrainJJ. 1996; The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power” the FRAP assay. Anal Biochem. 239:70-76


OyaizuM. 1986; Studies on products of browning reaction: antioxidative activities of products of browning reaction prepared from glucosamine. Jpn J Nutr. 44:307-315


ShinHK, LeeJH, LeeSK. 2017; Characteristics of white pan bread with roasted rice bran. Korean J Food Sci Technol. 49:401-407.

LeeDH, ParkHM, ChoJH, SeoWD, HongJH, YounKS. 2018; Physicochemical properties of aromatic rice prepared using different milling recoveries and roasting procedures. Korean J Food Preserv. 25:289-295


JeonSB, JeonJA, JeongBG. 2010; Anti-oxidative activities and tyrosinase inhibition ability of rice bran ethanol extract. J Korean Soc Cosmet. 16:602-606.

JungEH, HwangIK, HaTY. 2010; Properties and antioxidative activities of phenolic acid concentrates of rice bran. Korean J Food Sci Technol. 42:593-597.

KongSH, ChoiYM, LeeSM, LeeJS. 2008; Antioxidant compounds and antioxidant activities of the methanolic extracts from milling fractions of black rice. J Korean Soc Food Sci Nutr. 37:815-819


KimEH, LeeYJ, LeeSH, JangGY, KimMY, YoonNR, LeeMJ, LeeJS, JeongHS. 2015; Physicochemical characteristics of barley powder produced from different cultivars and with different degress of milling. Korean J Food Sci Technol. 47:639-644


ParradoJ, MiramontesE, JoverM, GutierrezJF, Collantesde Teran L, BauristaJ. 2006; Preparation of a rice bran enzymatic extract with potential use as functional food. Food Chem. 98:742-748


ParkSH, KimK, KimSK, ParkYK. 1989; Proximate composition and mineral content of naked barley differing in pearling degrees. J Korean Soc Food Sci Nutr. 18:328-332.

ChunHS, YouJE, KimIH, ChoJS. 1999; Comparative antimutagenic and antioxidative activities of rice with different milling fractions. Korean J Food Sci Technol. 31:1371-1377.

Sim WS, Choi SI, Jung TD, Cho BY, Choi SH, Xionggao H, Lee JH, Seo YR, Kim HB, Lim KT, Lee OH (2018) β-Glucan content and antioxidant activity of mixed extract from sarcodon aspratus and rice bran. J Food Hyg Saf, 33, 200-206
SimWS, ChoiSI, JungTD, ChoBY, ChoiSH, XionggaoH, LeeJH, SeoYR, KimHB, LimKT, LeeOH. 2018; β-Glucan content and antioxidant activity of mixed extract from
sarcodon aspratus and rice bran. J Food Hyg Saf. 33:200-206.

ChungYA, LeeJK. 2003; Antioxidative properties of phenolic compounds extracted from black rice. J Korean Soc Food Sci Nutr. 32:948-951.