1. 서론
현대사회는 의학 및 과학기술의 발전으로 인간의 기대수명이 상당히 증가하였으나, 나이가 들면서 발생하는 노화는 뇌에 영향을 미치는 대사와 면역 및 인지기능을 저해하여 신경퇴행성 질환의 발병을 유발하는 것으로 알려져 있다(Flanagan 등, 2018). 알츠하이머병, 파킨슨병, 헌팅턴병 등을 포함하는 신경퇴행성 질환은 신경세포 기능 부전, 인지 및 시냅스 기능 장애와 돌이킬 수 없는 신경세포의 손실을 유발하는데, 현재 많은 연구에서 조절되지 않은 활성 산소종(reactive oxygen species, ROS)의 생성에 의한 산화 스트레스를 신경퇴행성 질환의 주요 발병 기전으로 간주하고 있다(Plascencia-Villa와 Perry, 2023; Teleanu 등, 2022). 인체 내 대사 과정의 부산물로 발생하는 ROS에는 초산화물 음이온 라디칼(O2•−), 하이드록실 라디칼(•OH), 과산화수소(H2O2) 및 산화질소(nitricoxide, NO) 등이 있으며, 이들의 과도한 생성은 체내 항산화 시스템을 무너뜨려 산화 스트레스를 유발하여 DNA 손상, 신경 염증, 세포 사멸을 포함한 신경세포 손상을 유발한다(Olufunmilayo 등, 2023). 특히 신경세포에서 산화 스트레스는 신경 염증, 신경세포 파괴, 시냅스 손실, 미토콘드리아 기능 장애 등을 유발하여 신경 퇴화를 촉진한다고 밝혀졌다(Teleanu 등, 2022).
뇌는 산소 소모량이 많고 다중불포화지방산 및 산화 환원 금속 전이 이온의 함량이 수치가 높아 ROS에 쉽게 노출되고, 다른 조직에 비해 항산화 물질이 적게 존재하여 산화적 손상에 특히 취약하다(Misrani 등, 2021). 과도한 ROS의 생성에 의한 산화 스트레스의 축적은 단백질, 탄수화물 및 핵산을 포함하는 세포 구성 요소들의 변성을 일으켜 세포 기능을 손상시키고, 신경세포를 구성하는 다량의 지질과 반응하여 지질 과산화를 활성화시켜 세포와 세포막의 구조적 손상을 유발함으로써 신경퇴행성 질환의 발병을 촉진한다(Olufunmilayo 등, 2023). 뇌세포에서 산화 스트레스는 Toll like receptor-4(TLR-4)를 활성화시켜 myeloid differentiation primary response 88(MyD88)에 의해 개시되는 염증 경로를 통해 주요 염증 조절자인 nuclear factor-κB(NF-κB)의 핵 내 이동을 초래하여 tumor necrosis factor-α(TNF-α) 및 interleukin-1β(IL-1β)와 같은 염증성 사이토카인 및 inducible nitric oxide synthase(iNOS), cyclooxygenase-2 (COX-2)와 같은 유도성 효소의 발현을 증가시켜 신경세포 사멸을 유발한다(Anwar, 2022; Chae, 2005). 또한 신경 변성 중 생성되는 산화 스트레스는 아세틸콜린 분해효소(acetylcholinesterase, AChE)의 활성을 증가시킴으로써 인지와 신호 전달에 중요한 신경전달물질인 아세틸콜린(acetylcholine, ACh)의 생성을 억제하여 콜린성계의 불균형을 초래하며, 시냅스 발달 및 가소성에 중요한 역할을 하는 synaptophysin(SYP), postsynaptic density protein-95(PSD-95)의 발현 수준을 감소시켜 시냅스 기능 장애를 유발한다(Go 등, 2023).
따라서 산화 스트레스를 조절하여 신경퇴행성 질환을 예방하기 위해 폴리페놀과 같은 식이 항산화제의 섭취 필요성이 대두되고 있으며, 식물 소재로부터 유래하여 안정성이 검증된 천연 항산화제를 발굴하기 위한 연구가 활발히 진행되고 있다(Feng 등, 2023; Kim 등, 2024).
노각나무(Stewartia pseudocamellia Maxim.)는 차나무과(Theaceae)에 속하는 낙엽수로 전 세계적으로는 중국, 일본, 한국 등에 분포하고 있으며, 우리나라에서는 주로 지리산 권역에 자생하고 있다(Lee 등, 2023). 예로부터 노각나무는 전통 의학에서 타박상, 근육 이완, 사지마비 등의 다양한 통증을 치료하는 민간요법으로 사용되었다(Lee 등, 2023). 현재까지 진행된 연구에 따르면, 노각나무의 가지와 잎에는 dihydrochalcone, hyperin, lignin, gallic acid, quercetin, spinasterol glycoside, rutin 등의 생리활성 물질이 존재하며, 이러한 물질들은 항산화, 항염증, 피부 미백, 산화질소 생성 억제 등의 효능을 가지는 것으로 보고되었다(Lee 등, 2023; Roh 등, 2015). 또한 노각나무에 함유된 rutin은 마우스 해마 세포에서 산화 스트레스로 인한 세포 생존력 감소 및 ROS 생성을 유의적으로 억제하였으며, iNOS, COX-2와 같은 염증성 단백질의 발현 정도를 감소시킴으로써 세포 보호 효과를 나타냈다(Song 등, 2015). 하지만 이러한 다양한 생리활성 물질을 지닌 노각나무 에탄올 추출물을 이용한 뇌신경 세포 보호 효과 및 그에 관한 기전 연구는 미흡한 실정이다. 따라서 본 연구에서는 노각나무 잎의 H2O2로 유도된 신경독성에 대한 보호 효과 및 뇌신경 세포에서의 염증 반응, 콜린성 기능 장애 및 시냅스 독성의 개선 효과를 평가하고, 주요 생리활성 물질을 분석함으로써 퇴행성 뇌 질환을 예방 및 개선할 수 있는 건강 기능성식품의 소재로서의 활용 가능성을 평가하고자 연구를 수행하였다.
2. 재료 및 방법
본 실험에 사용된 시약 중 folin & ciocalteu’s phenol reagent, Na2CO3, gallic acid, diethylene glycol, NaOH, rutin, sodium phosphate, 2,2’-azino-bis(3-ethyl benzothiazoline-6-sulfonic acid) (ABTS), 1,1-diphenyl 2-picrylhydrazyl(DPPH), trichloroacetic acid(TCA), 2-thiobarbituric acid(TBA), ascorbic acid, acetylthiocholine iodide(ATCI), 5,5’-Dithiobis(2-nitrobenzoic acid) (DTNB), tacrine, 2,5-diphenyltetra-zoliumbromide(MTT), 2’,7’-dichlorodihydrofluoresceindiacetate(DCF-DA), corticosterone, Dulbecco’s modified eagle medium(DMEM), minimum essential medium(MEM), fetal bovine serum(FBS), penicillin, streptomycin, H2O2는 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입하였다. 1차 항체 TLR4(sc-52962), MyD88(sc-74532), p-NF-κB(sc-136548), AChE(sc-373901), SYP(sc-17750), PSD-95 (sc-32290) 및 β-actin(sc-69879)는 Santa Cruz Biotechnology (Santa Cruz, CA, USA)에서 구입하였고, iNOS(18985-1-AP)와 choline acetyltransferase(ChAT)(20747-1-AP)는 Proteintech(Wuhan, China)에서, COX-2(ab15191)는 Abcam(Cambridge, UK) 구입하였다. Mouse 2차 항체(AP124P)는 Merck(Darmstadt, Germany)에서 구입하였고, rabbit 2차 항체(7074S)는 Cell Signaling Technology(Danvers, MA, USA)에서 구입하였다. 그 외 사용된 용매 및 시약은 모두 1급 이상의 등급을 사용하였다.
본 실험에 사용된 노각나무 잎은 강원도 홍천군에서 재배되어 판매하는 것을 2024년 2월에 구입한 후, 분쇄하여 사용하였다. 분쇄된 시료 20 g에 20% 에탄올 1 L를 첨가하여 40°C에서 2시간 동안 환류 냉각장치를 이용하여 추출하였고, 추출물은 No. 2 filter paper(Whatman PLC, Kent, UK)로 여과하였다. 이후 회전진공농축기(N-N series, Eyela Co., Tokyo, Japan)를 사용하여 농축하였고, 이를 동결건조한 후 -20°C에서 보관하며 실험에 사용하였다.
노각나무 잎 20% 에탄올 추출물의 총페놀성 화합물 함량을 측정하기 위해 시료 1 mL에 folin & ciocalteu’s phenol reagent 1 mL와 3차 증류수 9 mL를 혼합하여 상온에서 5분간 반응시켰다. 이후 반응물에 7% Na2CO3 10 mL를 첨가한 후 3차 증류수를 사용하여 25 mL로 정용한 뒤 상온에서 2시간 동안 반응시켰다. 이후 분광광도계(UV-1800, Shimadzu, Kyoto, Japan)를 이용하여 760 nm에서 흡광도를 측정하였다, 측정된 흡광도는 gallic acid를 사용하여 시료와 동일한 방법으로 작성된 표준곡선을 통해 총페놀성 화합물 함량을 계산하였다.
노각나무 잎 20% 에탄올 추출물의 총 플라보노이드 함량을 측정하기 위해 시료 1 mL에 diethylene glycol 10 mL과 1 N NaOH 1 mL를 혼합하여 30°C에서 1시간 동안 반응시킨 후 420 nm에서 흡광도(UV-1800, Shimadzu)를 측정하였다. 측정된 흡광도는 rutin을 사용하여 시료와 동일한 방법으로 작성된 표준곡선을 통해 총 플라보노이드 함량을 계산하였다.
노각나무 잎 20% 에탄올 추출물의 ABTS 라디칼 소거 활성을 측정하기 위해 150 mM NaCl을 포함한 100 mM sodium phosphate buffer(pH 7.4)에 2.45 mM ABTS 시약을 혼합하여 68°C 항온수조에서 30분 동안 가열하였다. 이후 상온에서 10분 동안 냉각시킨 뒤 0.45 μm filter를 이용해 여과하여 4°C에서 24시간 동안 보관 후 사용하였다. 제조한 ABTS 원액이 734 nm에서 흡광도가 0.70±0.02가 되도록 증류수로 희석하여 실험에 사용하였으며, 시료 20 μL와 흡광도가 맞춰진 ABTS 시약 980 μL를 혼합하여 37°C에서 10분간 반응시킨 후 734 nm에서 흡광도(UV-1800, Shimadzu)를 측정하였다.
노각나무 잎 20% 에탄올 추출물의 DPPH 라디칼 소거 활성을 측정하기 위해 80% 메탄올을 이용하여 0.1 mM DPPH를 용해시킨 후 514 nm에서 흡광도가 1.00±0.02가 되도록 희석하여 실험에 사용하였다. 시료 50 μL와 흡광도가 맞춰진 DPPH 시약 1.45 mL를 혼합하여 암실에서 30분간 반응시킨 후 517 nm에서 흡광도(UV-1800, Shimadzu)를 측정하였다.
노각나무 잎 20% 에탄올 추출물의 지질과산화물 생성 억제 활성을 측정하기 위해 4주령의 수컷 Institute of Cancer Research (ICR) 마우스를 Samtako(Osan, Korea)로부터 구입하여, 항온(22±2°C), 항습(50-55%) 조건을 유지하며 12시간 주기로 낮과 밤을 교대시키는 환경에서 1주일간 사육하였다. 사육된 마우스의 뇌 조직을 적출한 후, 조직 무게의 10배에 달하는 20 mM Tris HCl buffer(pH 7.4)를 첨가하여 균질화하였다. 이를 12,000 ×g, 4°C, 15분 조건으로 원심분리하여 얻어진 상등액을 실험에 사용하였다. 시료 0.2 mL, 뇌 조직 상등액 0.1 mL, 10 μM FeSO4 0.1 mL, 0.1 mM ascorbic acid 0.1 mL를 혼합하여 37°C에서 1시간 동안 반응시켰다. 이후, 30% TCA 0.1 mL와 1% TBA 0.3 mL를 첨가하여 80°C 항온수조에서 20분간 가열한 후 원심분리를 통해 얻은 상등액을 취하여 532 nm에서 흡광도(UV-1800, Shimadzu)를 측정하였다. 본 동물실험은 경상국립대학교 동물윤리 심의위원회 승인을 거쳐서 진행되었다(경상국립대학교 동물실험 승인번호: GNU-220429-M0042, 승인일: 2022.04.29.).
노각나무 잎 20% 에탄올 추출물의 α-glucosidase 억제 활성을 측정하기 위해 시료 50 μL를 0.1 M sodium phosphate buffer (pH 6.9)와 0.5 unit/mL α-glucosidase 효소액 50 μL를 혼합하여 37°C에서 10분 동안 배양하였다. 이후 기질인 3 mM 4-nitrophenyl-α-D-glucopyranoside를 가하여 37°C에서 5분 동안 반응시킨 후, 흡광도를 마이크로플레이트 리더기(Epoch 2, Bio-Tek Instruments, Inc., Winooski, VT, USA)를 사용하여 405 nm 파장에서 측정하였다.
노각나무 잎 20% 에탄올 추출물의 AChE 억제 활성을 측정하기 위해 ATCI를 기질로 사용하고 DTNB를 발색 시약으로 사용하여 실험을 수행하였다. 시료 40 μL, AChE(0.1 U/mL) 20 μL 및 PBS를 혼합하여 37°C에서 15분 동안 방치시켰다. 이후 ATCI(15 mM) 20 μL와 DTNB(5 mM) 30 μL를 첨가하여 37°C에서 10분 동안 배양한 후, 흡광도를 마이크로플레이트 리더기(Epoch 2, Bio-Tek Instruments, Inc.)를 사용하여 405 nm 파장에서 측정하였다.
노각나무 잎 20% 에탄올 추출물의 뇌신경 세포 보호 효과를 측정하기 위해 HT22 세포와 MC-IXC 세포를 사용하였다. HT22 세포는 마우스의 뇌 해마 조직에서 유래된 것으로 뇌신경 세포의 특성을 나타내며, 경상국립대학교 수의과대학 조직학 실험실에서 분양받아 사용하였다. HT22 세포는 10% FBS, 50 units/mL penicillin 및 100 μg/mL streptomycin이 함유된 DMEM 배지를 사용하여 37°C, 5% CO2 조건에서 배양되었다.
MC-IXC 세포는 인간의 뇌 조직에서 유래된 뇌신경 세포로 American Type Culture Collection(Manasas, VA, USA)로부터 구매하여 사용하였다. MC-IXC 세포는 10% FBS, 50 units/mL penicillin 및 100 μg/mL streptomycin이 함유된 MEM 배지를 사용하여 37°C, 5% CO2 조건에서 배양되었다.
뇌신경 세포의 세포 생존율을 측정하기 위해 MTT 분석법을 이용하였다. HT22 세포와 MC-IXC 세포를 96-well plate에 1×104 cells/well 농도로 분주하여 24시간 동안 배양하였다. H2O2 처리에 대한 뇌신경 세포의 생존율을 확인하기 위해 시료 및 양성대조군(vitamin C)을 처리하여 24시간 동안 배양하고, 200 μM H2O2를 처리하여 3시간 동안 배양하였다. 이후 MTT 시약을 처리하여 3시간 동안 반응시킨 후 DMSO를 처리하여 반응을 종결시켰다. 흡광도는 마이크로플레이트 리더기(Epoch 2, Bio-Tek Instruments, Inc.)를 이용하여 570 nm(determination wavelength)와 655 nm(reference wavelength)에서 측정하였다.
뇌신경 세포 내에서 생성된 산화적 스트레스를 측정하기 위해 DCF-DA 분석법을 이용하였다. HT22 세포와 MC-IXC 세포를 black 96-well plate에 1×104 cells/well 농도로 분주하여 24시간 동안 배양하였다. H2O2 처리에 대한 산화적 스트레스 수준을 확인하기 위해 시료 및 양성대조군(vitamin C)을 처리하여 24시간 동안 배양하고, 200 μM H2O2를 처리하여 3시간 동안 배양하였다. 이후 DCF-DA 시약을 처리하여 50분 동안 반응시킨 후 fluorometer(Infinite F200, TECAN, Mannedorf, Switzerland)을 이용하여 485 nm(excitation wavelength) 및 535 nm(emission wavelength)에서 형광 광도를 측정하였다.
단백질 발현량을 측정하기 위해 HT22 세포를 6-well pate에 2×105 cells/well 농도로 분주하여 배양하고, 시료와 H2O2를 각각 처리하여 배양한 후 단백질을 추출하기 위해 1% protease inhibitor가 첨가된 lysis buffer(ProtinEx™ Animal cell/tissue, GeneAll Biotechnology, Seoul, Korea)를 각 well 당 100 μL씩 분주한 뒤 얼음에서 10분간 반응시켰다. 이후 13,000 ×g, 10분, 4°C 조건에서 원심분리한 상등액으로 bradford protein assay를 이용하여 단백질을 정량한 다음 sample buffer(4X)와 혼합한 후 -20°C 보관하여 실험에 사용하였다. 샘플을 95°C에서 5분간 반응시킨 후 sodium dodecyl sulfate polyacryl-amide gel electrophoresis(SDS-PAGE)를 통해 단백질을 크기별로 분리하였다. 이후 polyvinylidene fluoride(PVDF) membrane으로 이동시킨 뒤, 단백질의 비특이적인 결합을 막기 위해 5% skim milk를 이용하여 1시간 동안 blocking 한 후 세척하였다. 이후 membrane을 1:1,000으로 희석한 1차 항체와 4°C에서 overnight 동안 반응시킨 다음 0.1%(v/v) Tween 20이 포함된 tris-buffered saline 용액으로 3회 세척 후, 1:5,000으로 희석된 2차 항체와 1시간 동안 반응시켰다. 마지막으로 항체와 반응시킨 membrane을 enhanced chemiluminescence(ECL, TransLab, Daejeon, Korea)을 이용하여 발색시켜 iBright CL1000 imaging system(Thermo Fisher, Waltham, MA, USA)을 통해 단백질 발현량을 측정하였다.
시료 내의 주요 생리활성 물질은 고성능 액체크로마토그래피(high performance liquid chromatography, Ultimate 3000 series, Dionex, Sunnyvale, CA, USA)를 이용하여 분석하였다. Column은 YMC-Triart C18(250×4.6 mm, 5 μm, YMC Korea, Seongnam, Korea)을 사용하였으며, 시료는 50% MeOH로 용해하여 0.45 μm filter로 여과한 뒤 20 μL 주입하였다. 이동상은 0.1% formic aicd가 함유된 증류수(A)와 0.1% formic aicd가 함유된 acetonitrile(B)로 구성되었으며, 용매 조성은 0-30% (0-15 min), 30-60%(15-30 min), 60-100%(30-40 min)로 설정하여 총 40분간 분석하였다. 유속은 1 mL/min, 검출기로는 diode array detector(DAD)를 이용하였으며, 260 nm의 UV 파장을 측정하였다. 이후 260 nm에서 검출된 peak는 동일한 방법으로 분석된 표준물질(rutin)의 UV spectrum과 비교하여 유사도를 판단하였으며, 검출된 생리활성 물질의 정량분석을 위해 표준물질을 6개의 농도로 단계 희석한 후 시료와 동일한 방법으로 분석한 뒤 나타난 표준물질의 크로마토그램 peak 면적에 대한 검량곡선을 작성하였다. 검량곡선에 시료의 크로마토그램 peak 면적을 대입하여, 시료에 존재하는 표준물질의 함량을 계산하였다.
3. 결과 및 고찰
노각나무 잎 20% 에탄올 추출물의 총페놀성 화합물 및 플라보노이드 함량을 측정한 결과는 Table 1과 같으며. 총페놀성 화합물의 함량은 243.89 mg of GAE/g이고 총 플라보노이드 함량은 81.21 mg of RE/g을 나타내었다.
| TPC1) | TFC2) | ABTS3) | DPPH4) | |
|---|---|---|---|---|
| ESP | 243.89±0.98 | 81.21±3.02 | 236.10±1.21 | 281.65±1.98 |
| Vitamin C5) | - | - | 114.79±0.53 | 122.48±1.14 |
노각나무 잎 20% 에탄올 추출물의 라디칼 소거 활성 능력을 측정하기 위해 ABTS 및 DPPH를 이용하여 측정하였다(Table 1). ABTS 및 DPPH 라디칼 소거 활성의 IC50은 236.10 μg/mL, 281.65 μg/mL으로 나타났으며 양성대조군인 vitamin C의 IC50은 각각 114.79 μg/mL, 122.48 μg/mL으로 나타났다. 노각나무 잎 20% 에탄올 추출물은 양성대조군인 vitamin C에 비해 낮은 활성을 보였으나 시료가 천연 소재 추출물임을 고려하였을 때, 비교적 높은 라디칼 소거 활성을 나타낸 것으로 판단된다. 또한 Yang 등(2022)의 연구에서 수행된 노각나무와 같이 차나무과에 속하는 동백나무의 에탄올 추출물의 ABTS 및 DPPH 라디칼 소거 활성의 IC50(319.97 μg/mL; 324.10 μg/mL)보다 노각나무 잎 20% 에탄올 추출물의 라디칼 소거 활성이 우수함을 확인하였다. 산화적 스트레스의 정도를 나타낼 수 있는 지질과산화물 생성 억제 활성을 측정한 결과, 노각나무 잎 20% 에탄올 추출물의 IC50은 30.97 μg/mL, 양성대조군으로 사용된 catechin의 IC50은 22.06 μg/mL로 나타났다(Fig. 1). 특히, 노각나무 잎 20% 에탄올 추출물의 100 μg/mL 농도에서의 지질과산화물 생성 억제 활성은 84.89%로 나타났으며, 이는 동일 농도에서의 양성대조군인 catechin(85.73%)과 유사한 지질과산화물 생성 억제 활성을 나타내었다. 이러한 결과는 노각나무 잎 20% 에탄올 추출물이 catechin과 유사한 수준의 강력한 지질과산화물 억제 활성을 나타냄으로써 천연 항산화 소재로 활용될 가능성을 시사한다.
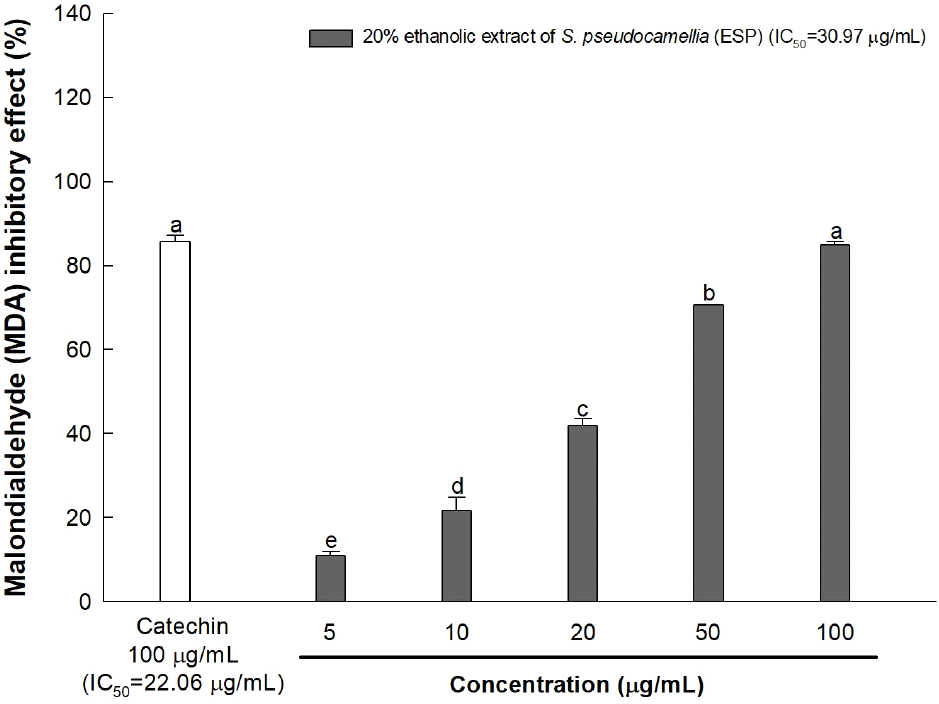
페놀산, 플라보노이드 등을 포함하는 폴리페놀은 식물의 2차 대사산물로써 과일, 채소 등에서 널리 발견되며, 방향족 고리에 하나 이상의 hydroxyl기를 가지고 있어 효율적으로 자유 라디칼 및 ROS를 제거하여 항산화 및 항염증 활성을 나타내는 것으로 알려져 있다(Rudrapal 등, 2022). Lee 등(2018)에 따르면 노각나무에는 dihydrochalcone, flavonoid, lignan 등의 생리활성 화합물들이 풍부하여 자유 라디칼의 생성을 억제하여 항산화 및 항염증에 효과가 있는 것으로 보고되었다. 또한 Kim 등(2021)에 따르면 노각나무 잎 에탄올 추출물의 ABTS 및 DPPH 라디칼 소거 활성을 측정하였을 때 우수한 라디칼 소거 활성을 나타낸다고 보고되었다. 따라서 본 연구에서도 노각나무 잎 20% 에탄올 추출물의 항산화 활성을 확인하였으며 이러한 항산화 활성은 노각나무 잎에 함유되어 있는 다양한 총페놀성 화합물 및 플라보노이드 화합물에서 기인한 것으로 판단된다.
뇌 조직은 타 조직에 비해 산소 요구량이 높고 불포화 지방산이 다량 존재하여 상대적으로 낮은 항산화 체계를 가지고 있으며, 펜톤 반응을 통해 ROS 형성을 촉진할 수 있는 Fe2+ 및 Cu2+와 같은 금속이온이 대량 존재한다(Feng 등, 2023). 이와 같이 생성된 다량의 ROS는 뇌의 불포화지방산과 반응하여 지질 과산화가 일어나 지질과산화물인 malondialdehyde(MDA)의 생성을 야기하고, 과도하게 축적된 MDA는 세포막과 효소 활성 등의 변성을 유발한다고 알려져 세포의 산화 스트레스 지표로 사용되고 있다(Kim 등, 2024). Li 등(2024)에 따르면 노각나무에 함유된 rutin은 MDA, ROS의 생성을 감소시키고, 카탈레이스(catalase, CAT), 초과산화물 불균등화효소(superoxide dismutase, SOD), 글루타티온(glutathione, GSH)와 같은 항산화 효소의 수치를 증가시킴으로써 산화 스트레스로 유발된 신경 손상을 완화할 수 있다고 보고되었다. 따라서 노각나무 잎 20% 에탄올 추출물은 폴리페놀 화합물에 의한 우수한 라디칼 소거 활성을 통해 ROS의 수준을 감소시킴으로써 세포막에서의 지질과산화 산물인 MDA의 생성을 억제하고, 더 나아가 뇌신경 세포에 대한 산화 스트레스를 효과적으로 감소시킴으로써 세포 보호 효과에 기여할 수 있을 것으로 판단된다.
노각나무 잎 20% 에탄올 추출물의 α-glucosidase 억제 활성은 농도가 낮아짐에 따라 억제 활성이 감소하는 경향을 나타냈으며, 노각나무 잎 20% 에탄올 추출물의 IC50은 12.34 μg/mL로 양성대조군으로 사용된 acabose(IC50=154.36 μg/mL)와 비교하였을 때 상당히 우수한 억제 활성을 보여주었다(Fig. 2A). 노각나무 잎 20% 에탄올 추출물의 AChE 억제 활성을 측정한 결과, 노각나무 잎 20% 에탄올 추출물 IC50은 233.63 μg/mL로 나타났고, 양성대조군으로 사용된 tacrine의 IC50은 0.045 μg/mL로 나타났으며, 노각나무 잎 20% 에탄올 추출물의 농도가 증가함에 따라 AChE 억제 활성이 증가하는 농도 의존적인 결과를 보였다(Fig. 2B). 노각나무 잎 20% 에탄올 추출물은 양성대조군인 tacrine에 비해 낮은 AChE 억제 활성을 보였으나 500 μg/mL 농도에서 76.42%의 AChE 억제 활성을 나타내었고, 이는 rutin을 주요 생리활성 물질로 함유한 황칠나무 잎 에탄올 추출물의 1,000 μg/mL 농도에서의 AChE 억제 활성(48.69%)보다 우수한 결과를 나타냈다(Kim 등, 2016). 또한, 노각나무 잎 20% 에탄올 추출물의 농도 의존적인 억제 효과는 기존 약물 대비 부작용이 적고 안정성이 높은 천연 소재로서의 활용 가능성이 있다고 판단된다.
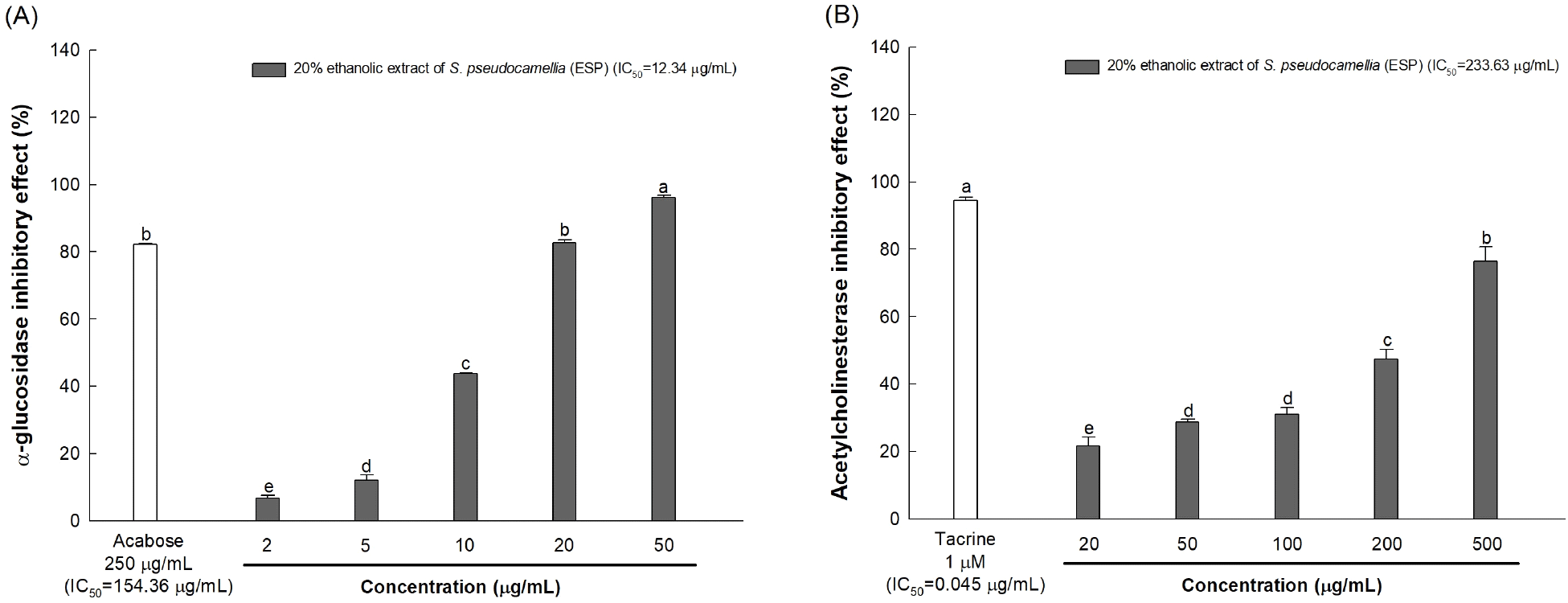
α-Glucosidase는 장 점막 세포 존재하며 신체의 탄수화물 대사에 참여하고 α-1,4 글리코시드 및 α-1,6 글리코시드 결합을 분해하는 효소로 탄수화물 섭취 시 포도당과 같은 단당류로 분해하여 장에서 흡수되도록 하는데, 이의 수준을 억제함으로써 식후 혈당을 조절하여 당뇨병의 발병을 예방할 수 있다고 보고되었다(Gong 등, 2020). 하지만 포도당 농도가 조절되지 않아 발생하는 고혈당증은 만성질병으로 신경세포 독성을 유발하는 산화적 손상을 일으키는 최종 당화 산물을 생성하며 산화 스트레스 및 염증을 증가시켜 인지 장애를 초래하는 신경세포 손상을 유발할 수 있다(Naguib 등, 2020). 또한, 지속적인 고혈당증으로 인한 ROS의 생산 증가는 뇌에 산화 스트레스를 유발하여 ACh와 같은 주요 신경전달물질의 생성을 감소시키고 AChE의 활성을 증가시킨다(Chen 등, 2022). 이로 인한 신경전달물질 수치의 불균형은 신경 전달에 문제를 일으켜 인지기능 장애 및 신경퇴행성 질환의 발생을 유발할 수 있는 것으로 알려져 있다(Rajagopalan 등, 2023). Saidi 등(2022)의 연구에 따르면 노각나무 잎의 주요 활성 화합물인 rutin은 탄수화물의 흡수 및 포도당 생성을 감소시키고 효소의 활성 부위에 결합함으로써 α-glucosidase의 활성을 효과적으로 억제할 수 있으며, 우수한 AChE 억제 활성을 통해 시냅스 ACh의 수준을 회복시켜 신경퇴행성 질환을 예방할 수 있다고 보고되었다. 따라서 위와 같은 결과들을 보았을 때, 노각나무 잎 20% 에탄올 추출물의 뛰어난 α-glucosidase 및 AChE 억제 활성은 rutin과 같은 페놀 화합물에 기인한 것으로 판단되며, 이는 고혈당으로 유도되는 산화 스트레스로 인해 발생하는 신경 전달의 장애를 개선하여 인지 능력 개선 및 신경 퇴행성 질환에 예방효과를 나타낼 수 있는 천연 소재로서의 가능성이 있는 것으로 사료된다.
본 실험에서는 산화 스트레스로 인한 노각나무 잎 20% 에탄올 추출물의 뇌신경 세포 보호 효과를 확인하기 위해 HT22와 MC-IXC 세포에 H2O2를 처리하여 산화 스트레스를 유도하였다. 뇌신경 세포에서의 세포 생존율은 살아있는 세포의 미토콘드리아가 생성한 탈수소효소가 tetrazolium 염과 반응하여 불용성인 보라색의 formazan을 형성하는 원리인 MTT 분석법을 이용하였다(Zhang 등, 2023). H2O2만 처리한 HT22, MC-IXC 세포의 생존율은 정상 대조군(100.00%) 대비 각각 40.54%, 72.41%로 감소하였으며, 노각나무 잎 20% 에탄올 추출물 100 μg/mL를 처리한 세포의 생존율은 각각 88.01%, 83.13%로 나타나 노각나무 잎 20% 에탄올 추출물이 뇌신경 세포에서 H2O2에 의해 저하된 세포의 생존율을 유의적으로 증가시키는 것을 확인할 수 있었다(Fig. 3A와 3B). H2O2 처리 후 두 세포주 간의 생존율 차이가 나타나는데, 이는 두 세포주가 H2O2로 유도된 산화 스트레스에 대해 상이한 반응성을 보이기 때문이다. HT22 세포는 마우스 해마 조직에서 유래된 뇌신경 세포로 H2O2와 같은 산화 스트레스 유도 물질에 민감한 특성을 가지고 있는 반면, 인간 신경모세포종에서 유래된 MC-IXC 세포는 암세포의 특성상 효소적 및 비효소적 항산화제를 통한 항산화 시스템이 활성화되어 산화 스트레스 환경에 대한 내성이 상대적으로 높다(Aboelella 등, 2021; Kushairi 등, 2020). 따라서 HT22와 MC-IXC 세포에서 관찰된 H2O2 처리 후 세포 생존율 개선 효과의 차이는 두 세포주 간의 산화 스트레스에 대한 반응성 차이에서 기인한 것으로 판단된다.
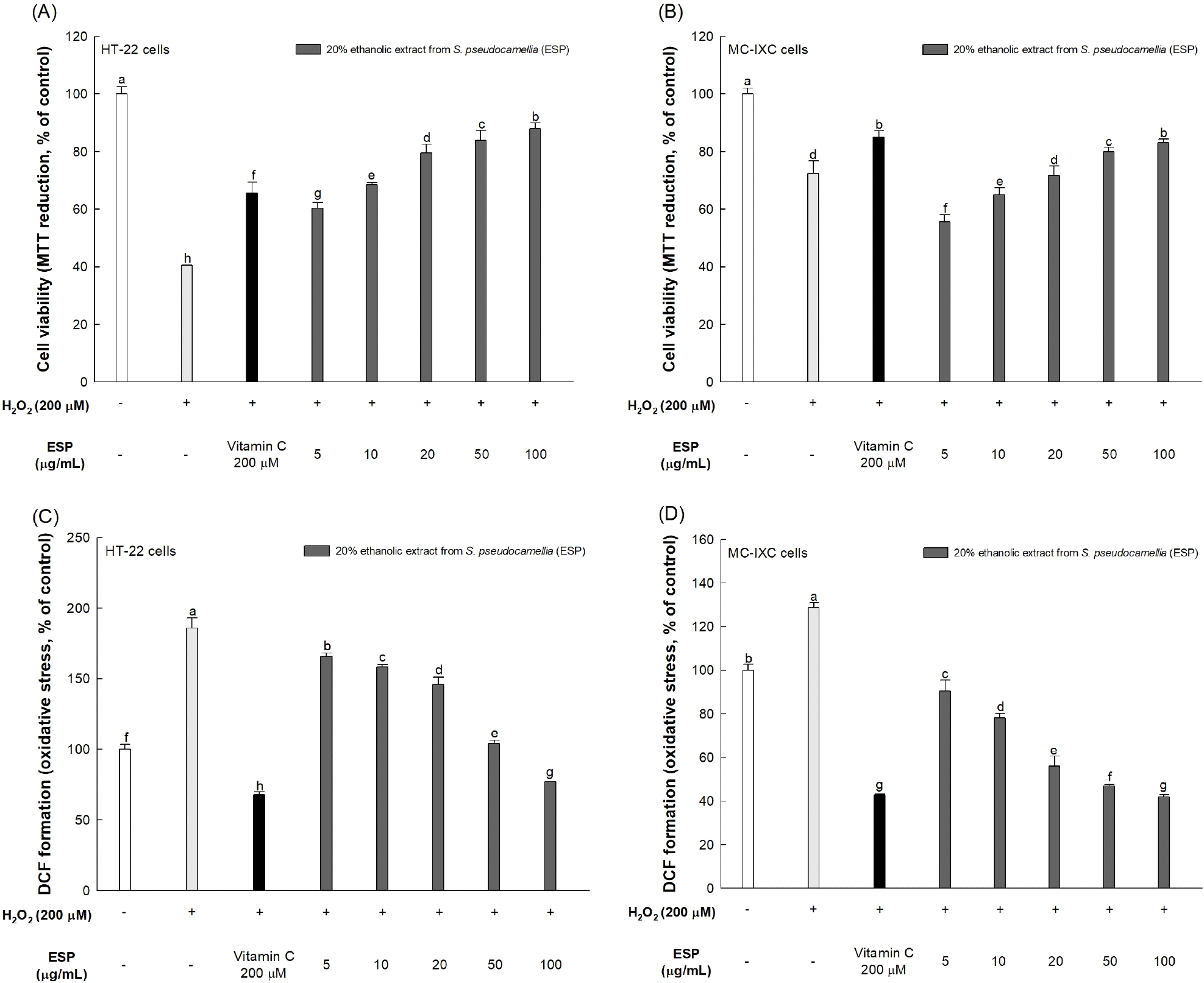
세포 내의 ROS 생성 수준을 측정하기 위해 막투과성 형광 염료인 H2DCF-DA가 세포 내의 효소에 의해 비형광성 DCFH로 가수분해되고, 이는 산화 스트레스 하에서 ROS와 반응하여 형광성이 강한 DCF로 산화되는 점을 이용한 DCF-DA 분석법을 사용하여 측정하였다(Engelbrecht 등, 2024). H2O2만 처리한 HT22, MC-IXC 세포의 ROS 함량은 정상 대조군(100.00%) 대비 각각 185.62%, 128.86%로 증가하였으며, 노각나무 잎 20% 에탄올 추출물 100 μg/mL를 처리한 세포의 ROS 함량은 각각 77.01%, 41.95%로 나타나 노각나무 잎 20% 에탄올 추출물이 뇌신경 세포에서 H2O2에 의해 생성된 ROS를 억제하는 데 효과가 있음을 확인하였다(Fig. 3C와 3D).
여러 세포 구성 요소에서 내인성으로 생산되는 ROS의 일종인 H2O2는 지질, 단백질 및 DNA 등을 표적으로 삼아 산화 스트레스를 유발하며, 뇌에 존재하는 Fe2+와의 펜톤 반응을 통해 세포 손상을 유발하는 •OH 라디칼 생성에 크게 기여하는 것으로 나타났다(Kumar 등, 2023). 뇌의 신경세포는 다량의 불포화지방산이 존재하고 다른 조직에 비해 항산화 체계의 수준이 낮아 산화 스트레스에 민감하며, ROS로 인한 산화 스트레스는 뉴런과 신경다발에 영향을 미침으로써 신경세포의 손상 및 사멸을 유발하여 알츠하이머병과 같은 퇴행성 뇌신경질환을 유발한다(Cui 등, 2020). 노각나무에 함유된 quercetin, hyperin과 같은 화합물은 지질다당류(lipopolysaccharide, LPS)로 처리한 RAW 264.7 세포에서 강력한 NO 억제 활성과 iNOS, COX-2와 같은 염증성 단백질 수치를 현저히 감소시킴으로써 강력한 항염증 효과를 통해 세포를 보호하였다(Lee 등, 2018). Islam 등(2022)에 의하면 노각나무 잎에 함유된 rutin은 뇌신경 세포에서 b-cell lymphoma 2(Bcl-2), Bcl-2–associated X protein (BAX) 등과 같은 세포 사멸 인자와 NF-κB와 같은 염증 인자의 발현을 조절하며, 세포 내의 ROS 함량을 조절하고 세포 내 항산화 효소의 활동을 유지시킴으로써 H2O2로 인한 세포 사멸로부터 세포를 보호하였다. 또한, rutin은 GSH의 수준을 조절하고 지질과산화물을 포함한 과산화물의 분해를 촉진하며 SOD, 글루타티온과산화효소(glutathione peroxidase, GPx) 등의 항산화 관련 효소의 활성을 증가시킴으로써 산화 스트레스를 크게 감소시키는 효과가 있다고 보고되었다(Chen 등, 2020). 이러한 결과들을 고려하였을 때 노각나무 잎에 함유된 rutin을 포함한 페놀성 화합물이 뇌신경 세포 내의 ROS를 감소시키고 세포 사멸을 억제함으로써 뇌신경 세포를 보호할 수 있을 것으로 판단된다.
H2O2로 유도되는 스트레스로 인한 염증에 대한 노각나무 잎 20% 에탄올 추출물의 항염증 개선 기작을 확인하고자 H2O2를 처리한 HT22 세포에서 단백질 발현량을 측정하였다(Fig. 4). H2O2를 처리한 그룹에서는 정상 대조군(100.00%) 대비 TLR4 (158.70%), MyD88(158.51%), p-NF-κB(154.58%), iNOS (178.68%), COX-2(184.47%)의 발현량이 증가하였다. 반면, H2O2와 노각나무 잎 20% 에탄올 추출물 100 μg/mL를 함께 처리한 그룹에서는 정상 대조군(100.00%) 대비 TLR4(92.96%), MyD88(121.07%), p-NF-κB(92.55%), iNOS(142.20%), COX-2 (93.21%)의 발현량이 유의적으로 감소한 것을 확인함으로써 노각나무 잎 20% 에탄올 추출물의 항염증 효과를 확인하였다.
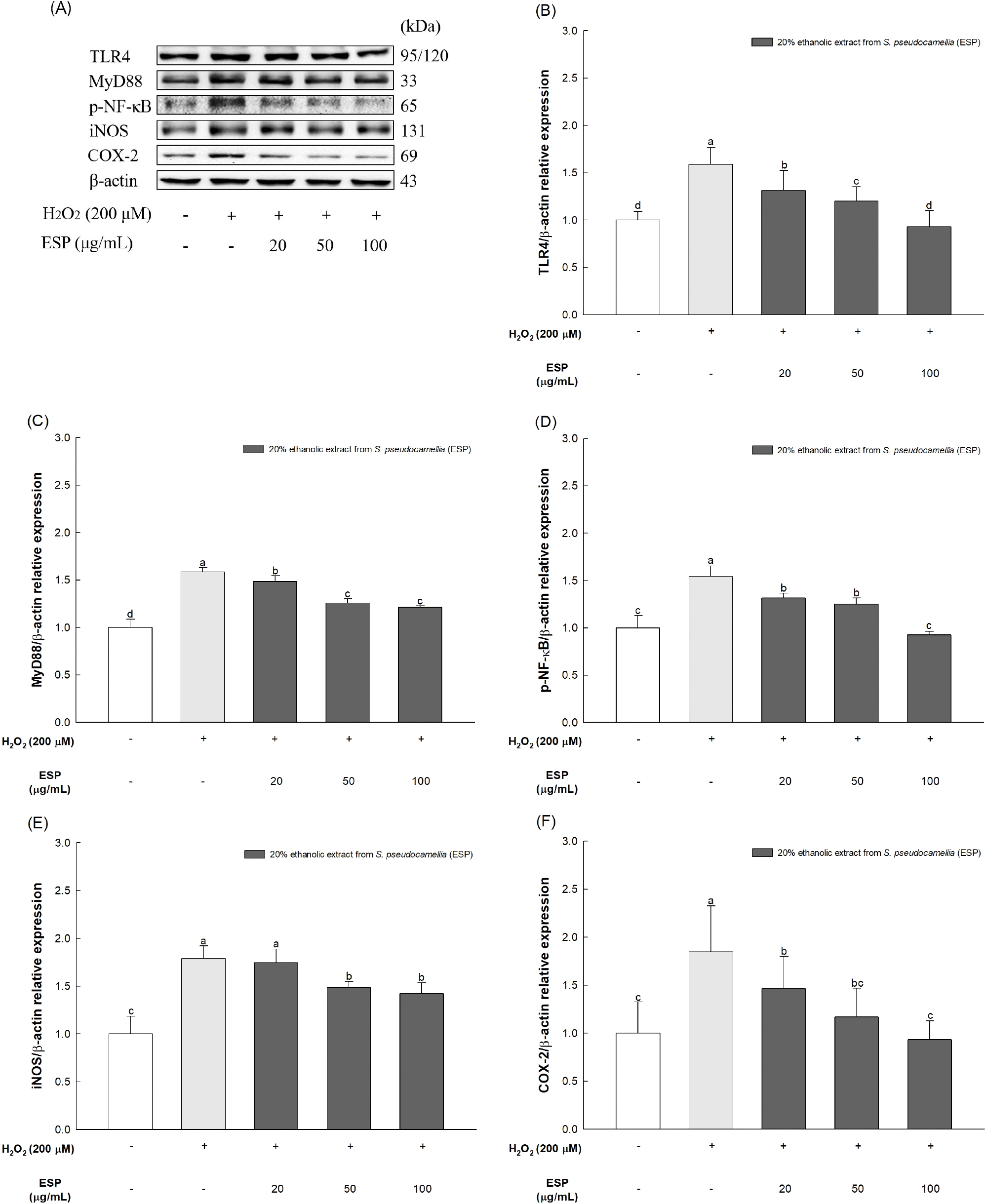
H2O2로 인해 발생하는 산화 스트레스는 세포 내 ROS의 농도를 증가시켜 염증성 사이토카인의 방출 및 세포 사멸을 초래할 수 있으며, 이는 TLR4를 활성화함으로써 염증 반응을 유발한다(Li 등, 2018). Li 등(2018)에 따르면, TLR은 면역에서 핵심적인 역할을 하는 세포막 관통 단백질로써, 산화 스트레스에 대한 반응으로 TLR4 신호 전달 경로가 활성화되면 세포질 어댑터 단백질인 MyD88과 결합하여 NF-κB와 같은 하위 분자를 활성화한다고 보고되었다. NF-κB는 활성화를 억제하는 inhibitor κB(IκB) 단백질과 결합하여 세포질 내에서 비활성 상태로 존재하나, TLR 등에 의해 세포가 자극되면 IκB로부터 분리가 되면서 핵막을 통과하여 핵 내로 들어가 TNF-α, interleukin-6 (IL-6)와 같은 염증성 사이토카인 및 iNOS, COX-2와 같은 유도효소 등을 활성화함으로써 염증을 유발한다(Chae, 2005). 이와 같이 산화 스트레스에 의한 염증성 사이토카인의 분비는 신경 염증을 유도하여 알츠하이머병과 같은 퇴행성 뇌신경질환의 발병 위험을 증가시킬 수 있다(Go 등, 2023). 따라서 신경 염증을 조절하는 것은 퇴행성 뇌신경질환의 발병 및 진행을 예방하는데 중요한 인자로 여겨진다. 본 논문에서는 H2O2 유도 신경 염증에 관한 노각나무 잎 20% 에탄올 추출물의 보호 효과를 조사하였으며, 노각나무 잎 20% 에탄올 추출물의 투여는 TLR4/MyD88/NF-κB 신호 전달 경로의 활성화를 억제함으로써 신경 염증성 단백질의 발현 수준을 감소시켰다. 이전 연구에 따르면 노각나무 추출물은 LPS로 유도된 RAW 264.7 세포에서 IκB-α, NF-κB, TNF-α, IL-6, IL-1β와 같은 염증성 단백질의 발현 수준을 억제시킴으로써 항염증 활성을 나타냈다(Lee 등, 2012). 또한, 노각나무에 함유된 rutin은 뇌신경 세포에서의 TNF-α 및 NF-κB의 수준을 하향 조절함으로써 신경염증 반응을 완화하였으며(Sun 등, 2021), 노각나무에 함유된 α-spinasterol은 미세아교세포 및 해마 세포에서 heme oxygenase-1(HO-1)의 상향 조절 및 TNF-α, IL-1β 등과 같은 염증성 사이토카인의 발현을 억제함으로써 신경 손상을 예방할 수 있는 것으로 나타났다(Majeed 등, 2022). 따라서 rutin을 포함한 다양한 생리활성 화합물이 함유되어 있는 노각나무 잎 20% 에탄올 추출물은 H2O2로 유도되는 산화 스트레스에 의한 신경 염증을 억제함으로써 뇌신경 세포를 보호하여 인지기능 향상에 기여할 수 있을 것으로 판단된다.
H2O2로 유도되는 스트레스로 인한 콜린성 기능 장애 및 시냅스 독성에 대한 노각나무 잎 20% 에탄올 추출물의 개선 효과를 확인하고자 H2O2를 처리한 HT22 세포에서 단백질 발현량을 측정하였다(Fig. 5). H2O2를 처리한 그룹에서 ACh를 생성하는 효소인 ChAT의 발현량은 정상 대조군(100.00%) 대비 ChAT(51.83%)로 감소하였고, ACh를 분해하는 효소인 AChE의 발현량은 정상 대조군(100.00%) 대비 AChE(182.03%)로 증가하였다. H2O2로 유발된 시냅스 독성에 미치는 개선 효과를 확인하기 위해 측정한 SYP의 발현량(49.39%)은 정상 대조군(100.00%)에 비해 감소하였고, PSD-95의 발현량(48.58%)도 정상 대조군(100.00%)에 비해 감소하였다. 반면, H2O2와 노각나무 잎 20% 에탄올 추출물 100 μg/mL를 함께 처리한 그룹은 정상 대조군(100.00%) 대비 ChAT(87.51%), AChE(100.53%), SYP(82.74%), PSD-95(73.25%)의 발현량이 유의적으로 조절함으로써 콜린성 및 시냅스 독성에 대한 보호 효과가 있을 것으로 판단된다.
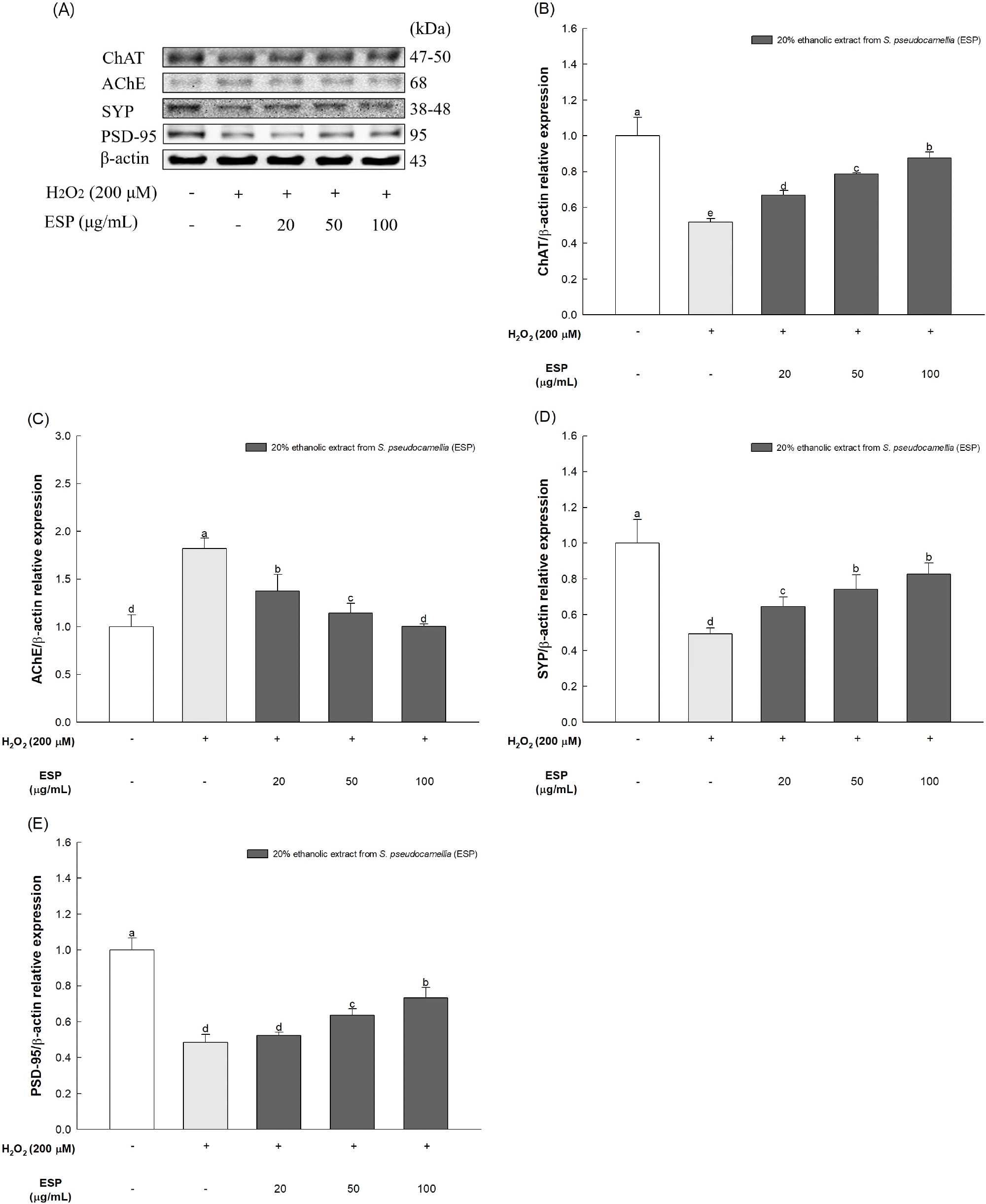
산화 스트레스는 알츠하이머병의 주요 병리적 특징 중 하나로 ROS의 생성을 촉진하여 미세아교세포 및 성상세포 구조와 기능을 손상시키며, 뇌막에 존재하는 다량의 불포화지방산과 반응하며 지질 과산화를 증가시켜 지질 과산화물 생성에 의한 산화적 손상 및 막 변화를 유발하여 시냅스 막을 변화시켜 신경세포 사멸을 초래한다(Go 등, 2023). Tsai 등(2022)에 따르면 H2O2로 인해 발생하는 산화 스트레스는 ACh의 합성을 담당하여 시냅스에서의 신경 신호 전달을 매개하는 ChAT의 활성을 억제하고, ACh의 분해를 촉진하는 AChE의 활성을 증가시킴으로써 ACh의 수치를 감소시켜 시냅스 전달 및 가소성 상실에 영향을 미친다고 보고되었다. 또한, 이러한 산화 스트레스는 각각 시냅스 전과 시냅스 후 영역에 위치하여 시냅스 기능 및 발달과 기억 형성에 중요한 역할을 하는 SYP, PSD-95와 같은 시냅스 단백질의 발현을 감소시킴으로써 시냅스 기능 장애를 유발한다(Tsai 등, 2022). 노각나무의 주요 생리활성 물질인 rutin은 blood-brain-barrier(BBB)를 쉽게 통과하는 성질을 가지고 있어 신경 손상, 기억 상실 및 인지 장애로부터 신경을 보호하고, 뇌에서의 ChAT의 수치를 증가시키고 AChE의 수치를 감소시킴으로써 콜린성 신경 전달 결핍을 조절할 수 있다(Abdel-Aleem과 Khaleel, 2018). 또한 Sun 등(2021)에 따르면 rutin은 신경세포에서의 SYP와 PSD-95의 수준을 회복시켜 시냅스 손실을 방지한다고 보고되었다. 콜린성 체계의 불균형 및 시냅스 기능 장애는 알츠하이머병의 주요 병리학적 특징으로 알려져 있으므로, 콜린계 및 시냅스 단백질을 보호하는 것은 뇌신경 세포 보호 효과를 통해 학습 및 기억 능력을 향상시키고, 퇴행성 뇌신경질환의 진행을 늦추며 인지기능 및 기억능력을 개선할 수 있을 것으로 사료된다. 이와 같은 결과를 바탕으로 볼 때, 노각나무 잎 20% 에탄올 추출물은 H2O2로 유도된 콜린계 불균형을 효과적으로 완화시키고, 시냅스 단백질을 발현 수준을 조절함으로써 시냅스 기능 장애를 개선하여 신경퇴행성 질환에서 나타나는 인지기능 장애를 개선하는데 유의미한 효과를 나타낼 수 있을 것으로 생각된다.
항산화 및 H2O2로 유도된 산화 스트레스에 대한 뇌신경 세포 보호 효과를 나타내는 노각나무 잎 20% 에탄올 추출물의 생리활성 물질을 분석하기 위해 고성능 액체크로마토그래피(high performance liquid chromatography, HPLC)를 진행하였다. HPLC 분석 결과 260 nm에서 머무름 시간 17.337분에 나타난 peak이 노각나무 잎 20% 에탄올 추출물의 주요 생리활성 물질로 확인되었으며, 표준물질인 rutin을 시료와 동일한 방법으로 분석하여 머무름 시간과 UV-Vis spectrum을 비교한 결과 999.56의 상동성을 나타내었다(Fig. 6A). 노각나무 잎 20% 에탄올 추출물에 함유된 rutin을 정량 분석한 결과, 21.40±0.09 μg/mg of dried weight의 함량을 나타내었다(Fig. 6B).
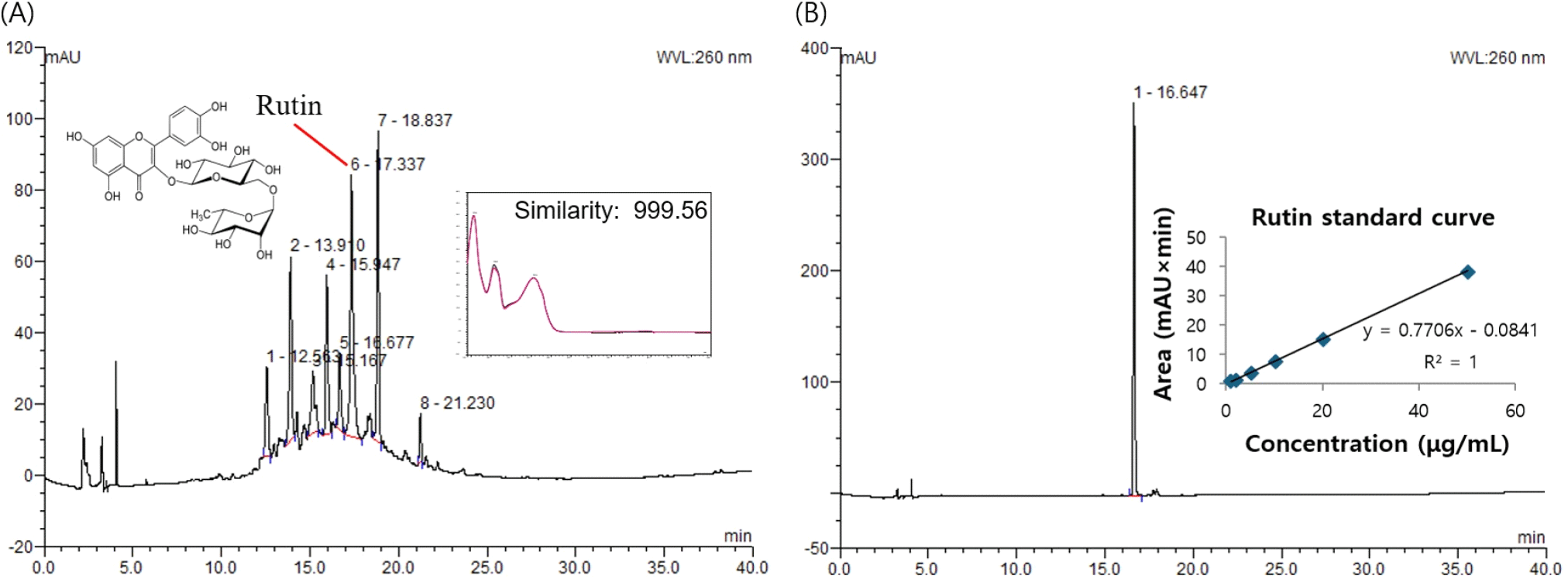
플라보노이드는 다양한 페놀 구조를 가진 천연 물질 그룹으로 과일, 채소, 꽃 등에서 발견되는데, 가장 흔한 천연 플라보노이드인 rutin은 quercetin과 이당류 분자인 rutinose로 구성되어 있으며(Wang 등, 2020), 산화 스트레스 매개 질병 및 지질 과산화에 대해 다양한 보호 효과를 나타내고 여러 설치류 실험 모델에서 항산화, 항염증, 항세포 사멸 및 신경 보호 활동을 포함한 약리학적 및 생물학적 효과를 나타내는 것으로 보고되었다(Çelik 등, 2020). Kim 등(2016)에 따르면 rutin은 우수한 라디칼 소거 활성 및 지질과산화 생성 억제 활성을 가지며, ROS의 생성을 저해하여 신경세포 보호 효과를 나타낸다고 보고되었다. 또한 rutin은 염증성 사이토카인의 생성을 억제하고 마우스 뇌에서 시냅스 손실을 구제함으로써, 알츠하이머병, 파킨슨병을 포함한 다양한 신경퇴행성 질환에 유익한 효과를 발휘하는 것으로 알려져 있다(Sun 등, 2021).
이러한 결과들을 고려할 때, 항산화 활성 및 H2O2로 유도된 뇌신경 세포 독성에 대한 보호 효과는 노각나무 잎 20% 에탄올 추출물에 함유된 rutin 등의 플라보노이드 화합물 등에서 기인한 것으로 판단되며, 이는 인지기능 개선에 도움을 줄 수 있는 천연 소재로서의 활용 가능성이 있다고 사료된다. 하지만 HPLC 분석에서 확인되지 않은 다양한 생리활성 물질의 명확하게 분석하기 위해 UPLC-QTOF-MSE와 같은 추가적인 연구가 필요할 것으로 생각된다.
4. 요약
본 연구는 노각나무의 항산화 활성 및 H2O2로 인한 산화 스트레스로부터 뇌신경 세포 보호 효과를 확인하고 주요 생리활성 물질을 분석하고자 하였다. 노각나무 잎 20% 에탄올 추출물은 우수한 in vitro 항산화 활성과 α-glucosidase 및 AChE 억제 활성을 나타냈으며, HT22 세포와 MC-IXC 세포에서 H2O2로 유도된 산화 스트레스에 대한 세포 생존율을 증가시키고 산화 스트레스의 생성을 억제함으로써 뇌신경 세포 보호 효과를 나타내었다. 또한, 노각나무 잎 20% 에탄올 추출물은 TLR4, MyD88, p-NF-κB, iNOS 및 COX-2와 같은 염증성 단백질의 발현 수준을 감소시키고, ChAT, AChE, SYP 및 PSD-95와 같은 콜린성 및 시냅스 가소성 관련 단백질의 발현 수준을 유의적으로 조절함으로써 H2O2로 유도되는 신경 염증 반응 및 콜린계 불균형을 완화 효과를 확인하였다. 마지막으로 HPLC 분석 결과 노각나무 잎 20% 에탄올 추출물의 주요 생리활성 물질은 rutin으로 확인되었다. 따라서 본 연구 결과를 통해 노각나무 잎 20% 에탄올 추출물의 항산화 활성 및 뇌신경 세포 보호 효과는 rutin을 포함한 다양한 페놀성 화합물에서 기인한 것으로 판단되며, 인지기능 및 기억능력 개선에 도움을 줄 수 있는 건강기능식품의 소재로서의 활용 가능성이 기대된다.
