서 론
예전에는 질병의 치료나 예방을 위해 화학제품을 이용하여 여러 기능성 식품을 개발하여 사용해왔으나, 최근 바이오산업의 급성장과 건강에 관한 관심이 증대됨에 따라 독성과 부작용이 적은 약용식물과 같은 천연물을 섭취하고자 하는 수요가 늘고 있다(Dhama 등, 2015). 이에 따라 약용식물을 이용한 건강 기능성 식품의 시장이 커지고 있는 추세이며, 다양한 연구가 진행되고 있다(Lee, 2013).
한국의 약용소재는 전통요법에서 비롯되어 그 효능이 이미 밝혀진 경우가 많으며, 다양한 생리활성을 나타낸다고 알려져 있다(Kim 등, 2016). 이러한 약용소재의 효능 및 생리활성에 관한 다양한 연구가 진행 중이며, 이를 활용하여 산업화에 이용하고 있다(Kim, 2015). 하지만 건강 기능성 식품을 만들기 위해서는 효능을 나타내는 활성 성분과 관련된 연구가 우선으로 진행되는 것이 중요하며, 앞으로도 이에 관련된 연구가 진행되어야 할 필요성이 있다(Jang 등, 2016).
산수유(Cornus officinalis)는 층층나무과에 속하는 낙엽활엽소교목으로 가을에 붉은 열매를 수확하고, 종자를 제거한 산수유 열매를 약용소재로 사용하고 있다(Park 등, 2012). 산수유의 주요 성분은 morroniside(Du 등, 2008), loganin(Jang 등, 2016), ursolic acid(Yu 등, 2006)와 같은 terpenoid와 anthocyanin(Park 등, 2017), gallic acid(Wang 등, 2003) 등이 있다. 그중에서 특히 morroniside와 loganin은 대한민국 약전에서 산수유의 지표성분으로 설정되어 있으며, 두 주요 성분 함량의 합이 1.2% 이상으로 규정하고 있다(MFDS, 2019). 또한, 산수유 열매의 복합추출물은 식약처에서 개별인정형 건강기능식품으로 인정되었으며, 이에 따라 산수유가 건강 기능성 소재로서 활용할 수 있는 천연소재라고 할 수 있다.
산수유 열매(Corni fructus)와 같은 약용소재로부터 활성 성분을 분리하기 위해서는 추출, 분획하는 과정을 거치거나(Choi 등, 2011), 생리활성물질의 흡착 및 분리에 주로 사용하는 다공성 합성 흡착제를 이용한다(Choi 등, 2011). 이러한 다공성 합성 흡착제의 종류에는 chromatorex, sephadex, Diaion HP 20 등이 있으며(Noriko 등, 2007), 그 중 Diaion HP 20은 styrene과 divinyl benzene이 공중합체로 이루어져 있는 고 다공성 합성 흡착제이다(Basso 등, 2013). 산수유 열매에는 morroniside와 loganin과 같은 배당체가 존재하기 때문에 흡착제를 사용하여 분리하여야 비교적 분리가 잘 이루어진다고 알려져 있다(Liang 등, 2013).
산수유의 선행연구로는 채취시기에 따른 이화학적 특성(Kim 등, 2019), 적정추출조건(Kang 등, 2018), 영양성분 분석(Kim 등, 2003)과 효능과 관련된 항산화성(Tural과 Koca, 2008), 항염증(Kim과 Son, 2016), 항당뇨(Kim, 2005) 등 다양한 연구가 진행되었으나, 산수유의 활성 성분에 관한 연구는 미비한 실정이다.
따라서 본 연구에서는 건강 기능성 식품 소재화를 목적으로 산수유 열매를 90% 에탄올로 추출하고, 추출물을 용매분획하고 Diaion HP 20 gel chromatography로 활성 물질을 분리하여 항산화능을 조사하고 HPLC로 분석하였다.
재료 및 방법
산수유 열매(Corni fructus)는 경북대학교 교내에서 2018년의 산수유 꽃의 만개일인 3월 21일로부터 274일 경과된 12월 19일에 채취하여 정선 및 수세하고 제핵하였다. 자연건조 후 분쇄하여 시료로 사용하였다.
본 실험에서는 gallic acid, (±)-catechin, trolox, 2,2’-azinobis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS), potassium chloride, 2,2-diphenyl-1-picrylhydrazyl(DPPH), 2,4,6-tris(2pyridyl)-1,3,5-triazine(TPTZ), sodium acetate, ferric chloride는 Sigma Chemical Co.(St. Louis. Mo, USA)를 사용하였다. 추출 및 용매 분획 용매인 ethanol, n-hexane, ethyl acetate, n-butanol은 Duksan Co.(Seoul, Korea)을 사용하였다. 항산화 활성과 항산화 함량을 분석하기 위해 UV/visible spectrometer(UV-1601, Shimadzu Co., Kyoto, Japan), microplate reader(Multiskan GO, Thermo Scientific, Waltham, MA, USA)를 사용하였다.
산수유 분말과 90% ethanol를 1 : 20(w/v) 비율로 실온에서 3시간 추출하여 이를 여과지(Whatman No.2)에 여과하여 산수유 조추출물을 얻어 농축하였다. 이를 10% ethanol에 현탁하여 n-hexane, ethyl acetate, n-butanol의 순으로 용매 분획 및 농축하여 n-hexane, ethyl acetate, n-butanol, water 획분을 얻었다.
우수한 항산화능을 나타낸 ethyl acetate 획분을 Diaion HP 20 gel을 충진한 column(23×500 mm)으로 Diaion HP 20 gel column chromatography를 실시하였다. Diaion HP 20 gel을 20% ethanol로 column에 slurry packing하였고, 80 mg/mL 농도의 ethyl acetate 획분 2 mL를 gel에 흡착시켰다. 이동상 용매로 ethanol의 농도(20%, 40%, 60%, 80%)를 순차적으로 2.5 mL/min의 유속으로 용출하였고, 각각의 획분을 얻어 감압농축 후 실험에 사용하였다.
DPPH 라디칼 소거 활성은 Blois(1958)의 방법을 변형하여 측정하였다. 시료 20 μL와 200 μM DPPH 시액 180 μL를 혼합하여 30분간 암실에서 방치시킨 후 517 nm에서 분석하였다. DPPH 라디칼 소거 활성은 gallic acid를 사용하여 검량선의 회귀식을 이용해 mM GAE로 나타내었다.
ABTS 라디칼 소거 활성은 Re 등(1999)의 방법을 이용하여 측정하였다. ABTS solution은 7.4 mM 2,2’-azono-bis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS)와 2.45 mM potassium persurfate를 1 : 1(v/v)로 혼합한 후 24시간 동안 암실에서 반응시켰다. 그 후 ABTS solution을 734 nm에서 흡광도가 1.0이 되도록 ethanol로 희석하였다. 96 well plate에 sample 20 μL에 희석한 ABTS solution 180 μL를 넣고 5분간 암실에서 방치한 후 734 nm에서 흡광도를 측정하였다. Trolox를 사용하여 검량선의 회귀식을 이용해 mM TE로 나타내었다.
FRAP 활성은 Benzie과 Strain(1996)의 방법을 이용하여 측정하였다. Acetate buffer(300 mM, pH 3.6), 10 mM 2,4,6tris(2-pyridyl)-1,3,5-triazine(TPTZ) in 40 mM hydroxy acid, 20 mM ferric chloride solution을 10 : 1 : 1로 혼합하여 cocktail solution을 제조하였다. Sample 25 μL에 cocktail solution 175 μL를 넣고 30분간 암실에서 방치한 후, 590 nm에서 흡광도를 측정하였다. Trolox를 사용하여 검량선의 회귀식을 이용해 mM TE로 나타내었다.
총페놀성 화합물 함량은 Prussian blue assay(Graham, 1992) 방법을 변형하여 측정하였다. 96-well plate에 distilled water 75 μL, sample 20 μL, 0.02 M ferric chloride in 0.1 M hydrogen chloride 25 μL, 0.016 M potassium ferricyanide 25 μL를 순차적으로 혼합하여 진탕 한 후 실온에서 15분간 방치하고, stabilizer(distilled water : 1% gum arabic : 85% phosphoric acid = 3 : 1 : 1, v/v/v) 125 μL를 첨가한 후 700 nm에서 microplate reader(Multiskan GO, Thermo Scientific, MA, USA)로 흡광도를 측정하였다. 총페놀성화합물 함량은 gallic acid를 이용하여 검량선의 회귀식을 이용해 GAE mg/100 mL로 나타내었다.
총플라보노이드 함량은 Jia 등(1999)의 방법을 이용하여 측정하였다. Sample 70 μL에 50% ethanol 430 μL, 5% sodium nitrate 50 μL를 넣고 30분간 실온에서 반응시켰다. 그 후 10% aluminium nitrate nonhydrate 50 μL를 넣고 혼합한 후 5분간 실온에서 반응시키고, 1 N sodium hydroxide 500 μL를 넣고 혼합하여 510 nm에서 UV-visible spectrometer(UV-1601, Shimadzu, Kyoto, Japan)를 사용하여 흡광도를 측정하였다. 총플라보노이드 함량은 (±)-catechin을 이용하여 검량선의 회귀식을 이용해 CE mg/100 mL로 나타내었다.
총안토시아닌 함량은 Lee 등(2005)의 방법을 변형하여 측정하였으며, 조추출물, 용매 획분을 5 mg/mL의 농도로 실험에 사용하였다. Sample 0.5 mL에 0.025 M potassium chloride buffer(pH 1.0) 0.5 mL와 0.4 M sodium acetate buffer(pH 4.5) 0.5 mL를 각각 가하여 반응시켰다. 그 후 530 nm와 700 nm에서 흡광도를 측정하였으며, 아래 식에 대입하여 계산하였다.
A = (A530nm–A700nm)pH1.0–(A530nm–A700nm)pH4.5
MW(molecularweight) = 449.2 g/mol
D: dilution factor
ε: molar absorption coeffcient(26,900)
HPLC 분석은 Kim 등(2009)의 방법을 이용하여 2 mg/mL 농도의 조추출물, 용매 획분을 0.45 μm syringe filter에 여과하여 실험에 사용하였다. HPLC(1260 Infinity Quaternary LC System, Agilent Technologies, Palo Alto, CA, USA)에 Develosil ODS-HG-5 column(4.6×150 mm, 5.6 μm, Nomura Chemical Co., Ltd, Seto, Japan)를 사용하여 240nm에서 분석하였다. 분석 조건으로는 column temperature 20°C, injection volume 10 μL, mobile phase는 acetonitrile : methanol : 0.1% acetic acid in water(10 : 5 : 85, v/v/v), flow rate는 0.5 mL/min로 분석하였다. 표준품은 morronisiede, loganin을 사용하였고, 시료와 retention time을 비교하여 검량선의 회귀식을 이용해 함량(mg/100 g)을 산출하였다.
UPLC-MS는 UPLC-MS(Waters UPLC system, Waters Xevo TQ-S Smicro, Milford, USA)에 UPLC BEH ODS (2.1×50 mm ID, 1.7 μm, Waters)를 사용하여 ESI모드에서 분석하였다. 분석조건으로 mobile phase는 acetonitrile : methanol : 0.1% acetic acid in water(10 : 5 : 85, v/v/v), injection volume 3 μL, flow rate는 0.2 mL/min을 이용하여 positive와 negative ion mode에서 분석하였다.
결과 및 고찰
산수유 열매의 에탄올 추출물 및 용매 획분의 항산화능은 Table 1에 나타내었다. 용매 획분의 DPPH 라디칼 소거 활성은 ethyl acetate 획분 다음으로 n-hexane 획분, n-butanol 획분, water 획분 순으로 활성이 낮아졌으며(p<0.05), ABTS 소거 활성은 ethyl acetate 획분에서 가장 높은 활성을 나타냈다(p<0.05). FRAP 활성은 0.31–18.86 mM TE의 범위를 보였으며, ethyl acetate 획분에서 가장 높았다(p<0.05). 항산화 활성은 모두 ethyl acetate 획분에서 가장 높았으며, 이는 페놀성 화합물의 영향으로 높게 나타난 것으로 사료된다. 또한, 산수유 열매의 80% methanol 추출물을 용매 분획하였을 때 ethyl acetate 획분에서 가장 높은 항산화 활성(DPPH 및 ABTS 라디칼 소거 활성)을 나타냈다고 보고된 바 있다(Kim과 Son, 2016).
용매 획분의 총페놀성 화합물 함량은 2.53–145.84 GAE mg/100 mL의 범위를 나타냈으며, ethyl acetate 획분, n-hexane 획분, n-butanol 획분, water 획분 순으로 낮아졌다(p<0.05). Ethyl acetate는 산수유 열매의 페놀성 화합물을 가장 효과적으로 추출할 수 있다고 알려져 있다(Stankovic 등, 2014). 총플라보노이드는 0.48–85.67 CE mg/100 mL의 범위를 나타냈으며, n-hexane 획분에서 가장 높았다(p<0.05). 총안토시아닌 함량은 0.01–0.97 mg/100 mL의 범위를 나타냈으며, n-butanol에서 가장 높게 나타났다(p<0.05). n-Hexane은 비극성 성분을 제거하기 위하여 주로 사용되며(Han 등, 2013), n-butanol은 안토시아닌 성분을 효율적으로 추출할 수 있다고 보고된 바 있다(Ko 등, 2017).
산수유 열매 용매 획분의 항산화능을 종합적으로 고려하였을 때 ethyl acetate 획분의 활성이 가장 높았으며, 이 획분을 이용하여 Diaion HP 20 gel column chromatography를 실시하였고, 각각의 획분의 항산화능을 Table 2에 나타내었다. 40% ethanol 획분에서 DPPH 라디칼 소거 활성, ABTS 라디칼 소거 활성, FRAP 활성은 각각 0.00–10.22 mM GAE, 0.41–37.29 mM TE, 0.31–27.32 mM TE의 범위를 나타냈다. DPPH 라디칼 소거 활성은 80% ethanol 획분에서 활성이 전혀 없는 것으로 나타났으며, ethyl acetate 획분이 10.22 mM GAE로 가장 높은 활성을 나타냈다(p<0.05). ABTS 라디칼 소거 활성과 FRAP 활성은 40% ethanol 획분에서 각각 37. 29 mM TE, 27.32 mM TE로 가장 높았으며, DPPH 라디칼 소거 활성과 같은 경향을 보였다(p<0.05). 복분자 딸기를 Diaion HP-20으로 활성 성분을 분리하였을 때 DPPH 라디칼 소거 활성 및 ABTS 라디칼 소거 활성이 가장 높았다고 보고된 바 있다(Choi 등, 2011).
Diaion HP 20 gel을 이용하여 얻은 획분의 총페놀성 화합물 함량, 총플라보노이드 함량, 총안토시아닌 함량은 각각 5.31–580.84 GAE mg/100 mL, 4.22–166.24 CE mg/100 mL, 0.01–0.74 mg/100 mL의 범위를 나타냈다. 총페놀성 화합물 함량은 40% ethanol 획분에서 가장 높았으며, 60%, 20%, 80% ethanol 획분 순으로 낮아졌다(p<0.05). 또한, ethyl acetate 획분보다 약 3.98배 증가하여 가장 높은 함량을 나타냈다(p<0.05). 총플라보노이드 함량 및 총안토시아닌 함량도 40% ethanol 획분에서 가장 높았다(p<0.05).
활성 성분을 HPLC로 분석하고, 표준물질을 농도별로 함량을 계산해 검량선의 회귀식을 얻었다. Retention time은 10.16분에 morroniside, 20.95분에 loganin이 검출되었으며(Fig. 1), 활성 성분의 함량은 Table 3에 나타내었다. 산수유의 에탄올 추출물에서 morroniside와 loganin이 각각 136.36 μg/mL, 53.29 μg/mL로 나타났다. 항산화능이 가장 높은 ethyl acetate 획분에서는 morroniside와 loganin이 각각 36.02 μg/mL, 149.72 μg/mL로 나타났다(p<0.05). 용매분획을 하였을 때, morrniside는 n-butanol 획분, loganin은 ethyl acetate 획분에서 증가하는 것으로 분석되었다.
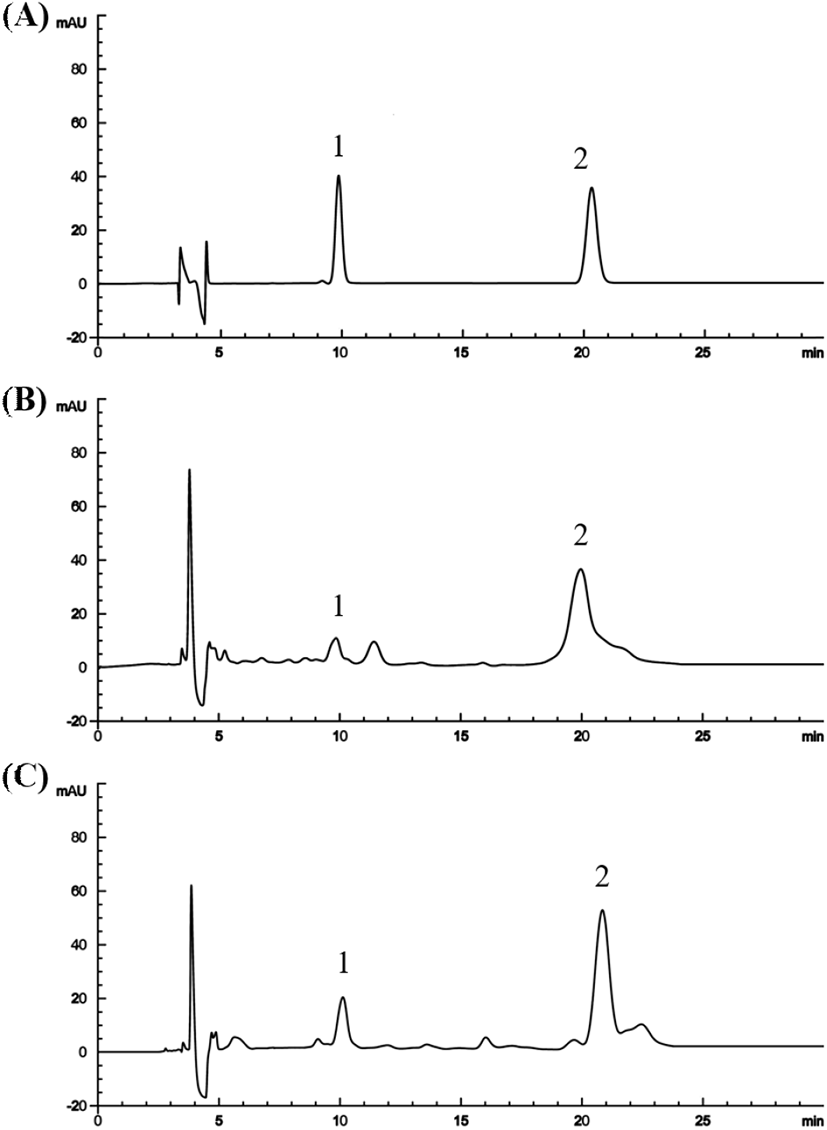
20% ethanol 획분에서는 morroniside와 loganin이 각각 20.07 μg/mL, 16.66 μg/mL, 40% ethanol 획분에서는 80.05 μg/mL, 151.74 μg/mL로 나타났다. 40% ethanol 획분에서 morroniside와 loganin의 함량이 가장 높았으며(p<0.05), 가장 우수한 항산화능을 나타낸 결과와도 같은 경향을 나타내었다. 산수유 열매의 morroniside나 loganin과 같은 iridoid glycoside 물질은 Diaion HP 20을 이용할 때 분리가 잘 된다고 보고된 바 있다(Wang 등, 2018). 본 결과에서도 ew40% ethanol 획분에서 loganin이 가장 높은 함량을 나타내었으며, 산수유 열매의 항산화능을 나타내는 주요 활성 성분으로 사료된다.
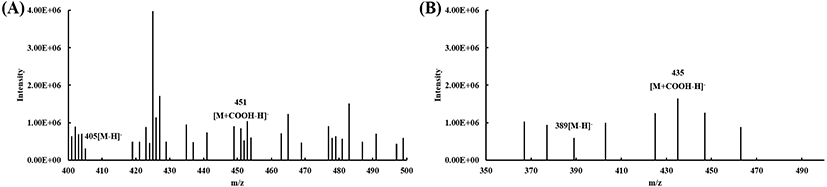
40% ethanol 획분의 HPLC로 분석한 산수유의 활성 성분인 morroniside 및 loganin을 UPLC-MS로 표준품과 비교하여 분자량을 확인하였다(Fig. 2). Negative 조건에서 morronisde와 loganin 각각 405[M-H]−와 451[M+COOHH]−, 389[M-H]−와 435[M+COOH-H]−로 나타났으며, 이는 각각 분자량의 parent ion이라고 보고된 바 있다(Cao 등, 2011).