ARTICLE
약주 제조를 위한 저온 적응성 효모의 특성
서동준1, 여수환1, 문지영1, 정우진2, 조용식1, 백성열1,*
Characteristics of yeast with low temperature adaptation for Yakju brewed
Dong-Jun Seo1, Soo-Hwan Yeo1, Ji-Young Mun1, Woo-Jin Jung2, Yong Sik Cho1, Seong Yeol Baek1,*
1농촌진흥청 국립농업과학원 농식품자원부 발효식품과
2전남대학교 농업생명대학 친환경농업센터, 농식품생명화학부
1Fermented Food Division, Department of Agro-food Resource, NAAS, RDA, Wanju 55365, Korea
2Division of Applied Bioscience and Biotechnology, Institute of Environmentally-Friendly Agriculture, Chonnam National University, Gwangju 61186, Korea
*Corresponding author.
dunkbis@korea.kr Phone:82-63-238-3609, Fax:82-63-238-3843
© The Korean Society of Food Preservation . This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Feb 2, 2015; Revised: Apr 10, 2015; Accepted: Apr 10, 2015
Abstract
The objectives of this study were to isolate and characterize low temperature adaptation yeast and to obtain suitable yeasts strains for manufacturing Yakju. In this study, we isolated 482 wild yeasts from fermented foods. Out of these, 5 yeast strains were selected based on increased growth at low temperature (15°C) and high β-glucosidase activity. To screen the aromatic level of isolates, media containing cerulenin and 5,5,5-trifluor-DL-leucine (TFL) were used. Y297 strain demonstrated tolerance against TFL and produced more than 13% alcohol. Y297 strain was identified a Saccharomyces cerevisiae based on the 26S rDNA gene sequences. Maximum cell growth was observed after 19 hr and 38 hr of incubation at 25°C and 15°C, respectively. The exponential phase was followed by a lengthy stationary phase, at 15°C, when the cells remained high viable. Y297 strain demonstrated tolerance against alcohol (10%), glucose (60%) and salt(NaCl, 8%). β-glucosidase and esterase activity in Y297 were higher than those of controls at 15°C. Overall, these results indicated that using wild yeast strain, isolated from fermented food, affects the chemical characteristics of the brewed Yakju.
Keywords: low temperature; Saccharomyces cerevisiae; Yakju; aromatic compounds
서 론
우리나라의 술은 보통 백미 형태를 주재료로 하여 술을 만드는데 찹쌀이나 멥쌀에 누룩을 발효제로 사용하여 당화 와 발효가 동시에 진행되는 병행복발효주이다. 위와 같은 방법으로 발효시킨 술밑을 맑게 여과한 것을 약주라고 하였 다. 약주를 생산하는 과정에서 효모는 알코올을 생성하는 발효과정에서뿐만 아니라 다양한 대사산물과 휘발성 향미 성분을 생산하는 등의 약주의 품질을 형성하는 중요한 역할을 한다(1-3). 온도는 술의 품질을 좌우하는 휘발성 향 미 성분을 생산하는데 있어서 중요 인자이다. 와인 생산의 경우 저온발효(10~15℃)는 primary aroma의 손실을 방지할 수 있고 secondary aroma(ethyl과 acetate esters등)의 합성을 증가시키는 것으로 알려져 있다(4-6). 또한 10~12℃의 온도 에서의 발효는 ester의 생산을 75%이상 증가시킨다는 실험 결과도 알려져 있다(7). Saccharomyces cerevisiae의 경우, 단백질 전사, 세포막의 유동성, 효소 활성과 같은 세포경로 와 특성도 저온의 영향을 받는 것으로 보고되고 있다(8,9). 그러나 저온은 균 생장 정도를 저하되거나 이상발효를 일으 키기는 등의 좋지 못한 영향을 주기도 한다. 그렇기 때문에 저온적응성을 가지는 효모를 이용하여 발효를 할 수 있다면 좀 더 좋은 품질의 약주를 생산할 수 있을 것이다.
유기산과 알코올이 결합하여 만들어지는 ester는 다양한 음식의 풍미 성분으로 알려져 있으며 발효주에서는 향기 성분의 주요 지표로서 사용되어진다. 와인의 경우, ester의 생산은 Esterase(EC3.1.1.1)에 의한 가수분해 반응과 alcohol acetyltransferase(EC2.3.1.84)를 포함한 합성반응의 상호작 용에 의해 이루어진다(10,11). Saccharomyces spp. 경우 ATF1, Lg-ATF1, ATF2, EHT1, EEB1, IAH1등의 ester의 합성 과 가수분해에 관련된 유전자를 여러연구를 통해 보고되고 있다(12-15). 그 중 ethyl caproate도 역시 전구체인 ethanol이 나 caproic acid등과 alcohol acetyltransferase나 esterase등과 같은 효소의 유무에 따라 달라진다(16). 이러한 ethyl caproate의 생산은 지방산 생합성 효소가 촉진하는 것으로 알려져 있고 지방산 생합성 효소는 cerulenin에 의해 저해되 기 때문에 cerulenin 저항성 균주를 찾는다면 ethyl caproate 생산 균주를 찾는데 유용하게 이용할 수 있다고 보고되고 있다(1,17). Isoamyl acetate 또한 과일 향과 달콤한 향을 내는 주요 성분으로 L-leucine이 과잉 생산되는 균주는 에스 테르와 고급 알코올류의 생산이 증가하여 isoamyl acetate 역시 증가되는 것으로 보고되고 있다. 이러한 균주는 L-leucine의 유사물질인 5,5,5-trifluor-DL-leucine(TFL)을 이용하여 저항성 균주를 선발하는 방법이 보고되고 있다 (1,18).
본 연구에서는 발효식품에서 분리한 효모를 이용하여 저온적응성을 가지는 균주에 대한 특성연구를 통해 약주의 품질을 향상하고 효모 종균의 다양성을 확보하는 것을 목적 으로 한다.
재료 및 방법
효모균주
본 실험에서 사용한 효모는 전국에서 수집한 메주, 누룩 등의 발효식품 50여종으로 분리한 482균주들을 사용하였 다. 비교균주로 시판효모인 Fermivin(S. cerevisiae, Gist Brocades, Denmark)와 La parisienne(S. cerevisiae, DB ingredients, UK) 사용하였다. 실험에 사용된 효모는 yeast extract 1%, peptone 2%, dextrose 2%(Difico, Becton Dickinson and company, spark, USA) 액체배지에 배양 후, glycerol를 20% 첨가하여 -80℃에서 보관하여 실험에 사용 하였다.
배지 및 배양조건
효모는 YPD 한천배지(Difico, Becton Dickinson and company, spark, USA)에 도말하여 2일간 배양한 후 순수 분리하였다. 저온에서 생육이 우수한 효모를 선발하기 위 해 shaking incubator에서 2일간 15℃에서 배양한 후 spectrophotometer(SYNERGmx, D.I Biotec Ltd., Seoul., Korea)에서 600 nm로 흡광도를 측정하여 생육이 우수한 균주를 선발하였다. 선발된 균주는 온도(15℃, 25℃)에 따른 생장 정도와 에탄올 내성(0~20%) 및 glucose(0~60%)를 사 용한 내당성과 sodium chloride(0~10%)에 의한 내염성을 Bioscreen C(OY Growth Curves Ab Ltd., Finland)을 사용하 여 600 nm에서 확인하였다. 또한 cerulenin(Sigma-Aldrich Co., St Louis, USA)과 5,5,5,-trifluor-DL-leucine(TFL,Sigma- Aldrich Co., St Louis, USA)에 대한 저항성은 yeast nitrogen base(YNB, Difco, detroit, Mi, USA)에 2% glucose 및 2% agar 조성의 한천배지에 cerulenin(25 μM)과 TFL(1 mM)을 첨가하여 제조한 후 효모를 접종하여 15℃에서 48시간 배양 한 후 집락 생성 여부에 따라 내성을 평가하였다(17,18). 황화수소 생성능을 알아보기 위해 Biggy 한천배지(Difico, Becton Dickinson and company, spark, USA)에서 15℃, 48시 간 배양 한 다음, colony의 색깔 진하기에 따라 황화수소 생성능을 평가하였다(19).
효모의 동정
분리 효모를 동정하기 위해 26S rDNA 유전자의 D1/D2 부위 염기서열을 분석하였다. 프라이머로 NL1(5’-GCATATCAATAAGCGGAGGAAAAG- 3’) 및 NL4(5’-GGTCCGTGTTTCAAGACGG- 3’)를 사용하여 26S rRNA D1/D2 부 위 단편을 증폭 후, ㈜ZENOTECH사에 의뢰하여 염기서열 을 분석하였다. 염기서열은 National Center for Biotechnology Information(NCBI)의 BLAST를 사용하여 유전자의 상동성 을 비교하였으며 염기서열은 DNASTAR pro software (Seqman Pro, Ver 9., Lasergene)를 사용하였고 효모의 계통 분석도(phylogenetic tree) 작성은 MEGA 6.0의 Kimura2- parameter method를 이용하여 작성하였다.
효모의 효소활성
효모의 효소활성을 확인하기 위해 yeast protein extraction buffer kit(GE healthcare, St Louis, USA)를 사용하여 단백질 을 추출하였다. β-glucosidase(EC 3.,2.1.21.)의 활성은 Grover 등(20)의 방법을 적용하여 실험하였다. 10 mM의 기질 ρ-nitrophenyl-β-D-glucopyranoside(Sigma-Aldrich Co., St Louis, USA)을 100 μL 넣고 100 mM citrate phosphate buffer(pH 4.0)을 890 μL 넣은 후, 효모추출액을 넣은 후 45℃에서 반응시킨 후 0.5 M sodium carbonate(Sigma- Aldrich Co., St Louis, USA)로 반응을 멈춘 후 원심 분리한 상등액을 spectrophotometer에서 흡광도 405 nm로 활성을 확인하였다. esterase(EC 3.1.1.6)의 활성은 Frank 등(21)의 방법을 변형하여 실험하였다. 효모 추출액(32 μL)에 4.5 M ρ-nitrophenyl acetate(Sigma-Aldrich Co., St Louis, USA) 가 포함된 0.1 M tris-HCl buffer(pH 7.0)을 넣고 35℃에서 반응시켜 효소활성을 확인하였다. 또한 5 M ρ-nitrophenyl- β-butyric acid(Sigma-Aldrich Co., St Louis, USA)를 기질로 하여 0.5 M sodium phosphate buffer(pH 7.0)에서 40℃에서 반응 후 405 nm에서 활성을 확인하였다. 모든 효모는 YPD(25% glucose)배지에서 5일간 120 rpm을 배양하였고 분당 생성되는 1 μmol의 ρ-nitrophenol을 1 unit으로 정의하 여 실험하였다.
에탄올 발효능 분석
효모의 에탄올 생성량은 25% glucose가 포함된 YPD 액 체배지에서 분리한 효모를 접종한 후 15℃에서 120 rpm으 로 5일간 배양한 후 원심 분리한 상등액 100 mL를 증류하여 회수한 후 주정계를 사용하여 측정하였다(22).
효모의 형태적 분석
분리효모를 한천배지에 도말하여 2일간 25℃에서 한 후 순수 분리된 균주를 Karnovsky’s 고정액을 처리한 후 50~100% alcohol을 이용하여 탈수시킨다. 탈수된 샘플을 CO2 가스를 이용하여 건조한 후 gold coating작업 후 전자주 사현미경(scanning electron microscopy, SEM; H-2460N, Hitachi, Tokyo, Japan)을 이용하여 5,000~10,000배 배율을 사용하여 균 형태를 확인하였다.
통계처리
실험결과의 통계처리는 SAS program(9.1, SAS Institute Inc., Cary, NC, USA)을 이용하여 평균(mean)과 표준편차 (SD)로 표시하였다. 통계분석은 분산분석(ANOVA)을 사 용하였고 Tukey's Studentized Range test로 유의성을 검증 하였다.
결과 및 고찰
저온 적응성 효모의 분리
메주와 누룩 등의 발효식품에서 분리한 482균주를 이용 하여 저온(15℃)에서 YPD 액체배지에 2일간 배양한 후 생 장정도를 spectrophotometer로 확인하였다. Table 1은 분리 한 균들 중에서 저온 생장 정도가 우수한 5균주와 시판효모 2종에 대해 알코올 생산능과 향기관련 효소 및 저항성을 확인한 결과이다. 저온에서의 생장은 시판효모인 control 1(Con1)과 비슷한 생장정도를 보이며 control 2(Con2)에 비 해서는 우수하다는 것을 확인할 수 있었다. Chiva 등(5)의 보고에 의하면 Saccharomyces spp.의 경우 저온에서 높은 생장률을 보이는 균주는CSF1, HSP104, TIR2 유전자가 과 발현되는 현상이 보고되고 있다. 저온적응성 균주 분리 시 위와 같은 유전자의 발현 특성을 확인할 수 있다면 좀 더 빠르고 쉽게 균주를 분리할 수 있을 것이다. 알코올 생산능 은 Y605 균주가 14.8%로 가장 높은 농도를 보였으며 Con1 과 Y205, Y297, Y624는 비슷한 농도가 관찰되었고 Con2와 Y389는 8~9%로 가장 낮은 알코올 생산능을 보였다. Baek 등(1)의 논문에서 25℃, 48시간 배양 시S. cerevisiae의 알코 올 생성능은 7.3~9.5%의 생성능을 보였고 non-S. cerevisiae 의 알코올 생성능은 2,2~4.7%로 나타났다. 온도와 배양시 간의 차이는 있지만 대체적으로S. cerevisiae의 알코올 생성 능이 non-S. cerevisiae에 비교하여 2배 가까이 높은 것으로 조사되었다. 하지만 시판효모인 Con2의 경우, 이 균주가 S. cerevisiae인 것을 감안하면 Con2가 알코올 생성능과 저 온적응성에서도 낮은 결과가 나타났다. 이 결과를 통해 Con2는 저온에서 생육성장 뿐만 아니라 발효능이 감소되 어지는 것으로 생각된다. β-Glucosidase의 경우, 전반적으 로 모든 효모에서 높은 활성을 보였다. 이 효소는 비휘발성 향기성분을 생산하는데 있어 중요한 역할을 한다고 알려져 있는데S. cerevisiae의 경우 pH4 그리고 40~50℃에서 높은 활성을 보인다고 보고되었다(23). 또한 non-S. cerevisiae에 서도 Candida stellata, Candida hellenica, Kloeckera apiculata 균주들에서 β-glucosidase의 활성이 있음을 확인 할 수 있다(24). Y389 균주는 ceruleni과 TFL에 대한 저항성 을 모두 확인 할 수 있었고 Y297, Y605 균주는 TFL에 대한 저항성을 관찰할 수 있었다. 이취에 관련된 황화수소 생산 능은 Y389 균주가 가장 높은 것으로 나타났다. Table1의 결과를 토대로 Y389의 경우 저온적응성과 향기인자의 활 성이 강했지만 알코올 생성능이 낮고 이취가 강하기 때문에 약주 생산에 적합하지 않는 것으로 판단된다. Y297 균주는 알코올 생성능이 높고 황화수소 생산도 거의 보이지 않으며 향기인자의 활성 또한 확인되어 Y297 균주의 특성을 우선 적으로 조사하였다.
Table 1.
Screening wild type yeasts from fermented foods that are adapted to low temperature (15℃) and tolerant against aromatic compounds
|
Strains |
Cell growth1) (O.D600, 15℃) |
Ethanol contents2) (%) |
β-Glucosidase3) |
Cerulenin4) |
TFL4) |
H2S production5) |
|
Con1 |
1.256±0.031a
|
13.7±0.7b
|
++ |
- |
- |
+ |
|
Con2 |
0.958±0.033b
|
9.1±0.7c
|
++ |
- |
- |
+ |
|
Y205 |
1.172±0.063a
|
13.5±0.3b
|
+++ |
- |
- |
+ |
|
Y297 |
1.183±0.070a
|
13.1±0.6b
|
+++ |
- |
+ |
- |
|
Y389 |
1.189±0.034a
|
8.1±0.1c
|
+++ |
+ |
+ |
+++ |
|
Y605 |
1.252±0.010a
|
14.8±0.2a
|
+++ |
- |
+ |
+ |
|
Y624 |
1.194±0.050a
|
13.4±0.8b
|
+++ |
- |
- |
- |
Download Excel Table
선발효모의 동정 및 형태적 분석
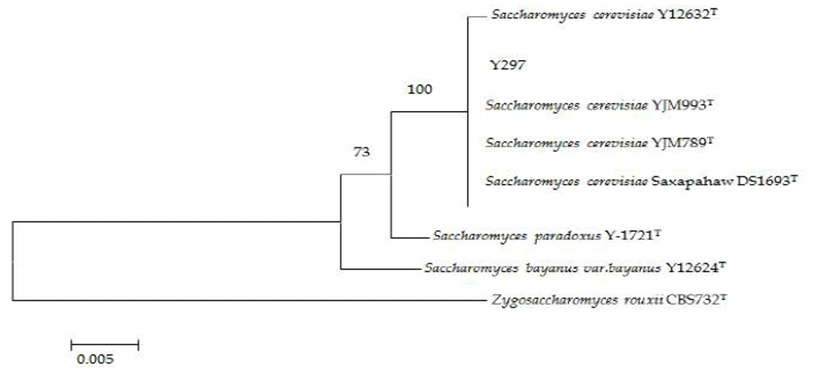
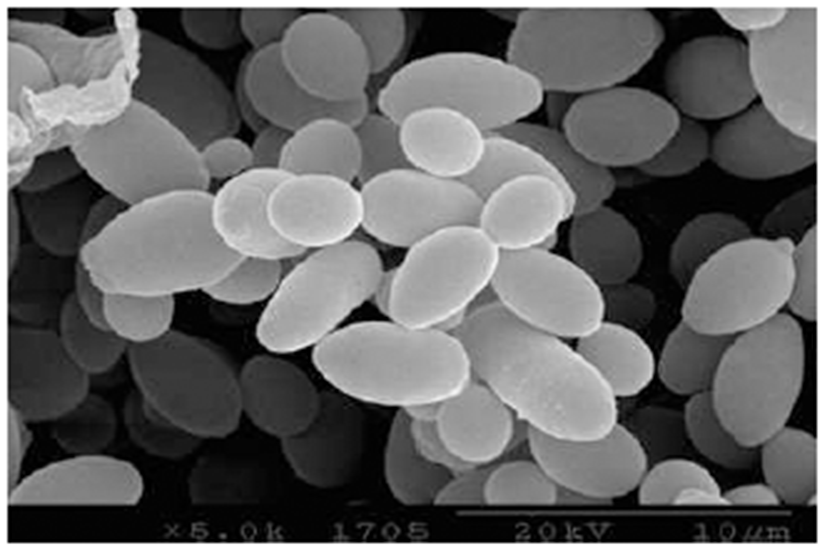
Fig. 1은 선발된 효모 균주의 26S rRNA 유전자의 D1/D2 부위 염기서열 분석 결과를 나타내었다. Y297 균주는 Saccharomyces cerevisiae로 동정되어졌으며 Fig. 2는 출아 중인 S. cerevisiae Y297 균주의 형태를 SEM을 이용하여 확인한 결과이다.
Fig. 1.
Phylogenetic relationship between Saccharomyces cerevisiae strain Y297 and other previously reported strains based on their 26S rDNA sequences. Evolutionary distances were calculated according to the Kimura2-parameter method.
Download Original Figure
Fig. 2.
Scanning electron microscope micrograph of budding yeast cells, Saccharomyces cerevisiae.
Download Original Figure
선발효모의 내성
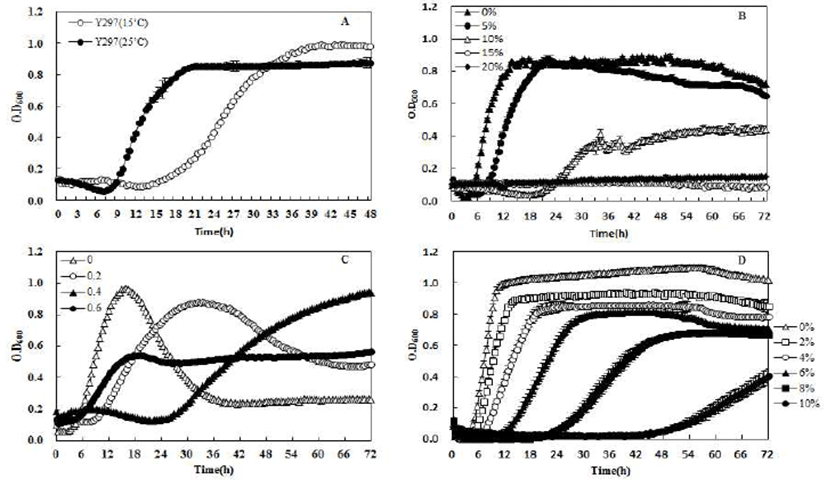
Fig. 3은 선발된 Y297균주에 대등(5)의 실험에서도 시판 효모인S. cerevisiae QA23 역시 25℃에 비해 장기간 정지상 으로 상하여 여러 환경조건에서 Bioscreen C를 이용하여 48~72시간까지의 균 성장정도를 조사한 결과이다. Fig. 3A 는 온도에 따른 균 성장도를 확인한 결과로써 25℃에서 19시간이 경과했을 때 정지상으로 접어들어 38시간에 정지 상으로 접어드는 15℃에서보다 빠른 생장 속도를 보였다. 그렇지만 저온 정지상에서 세포질량의 값은 15℃에서 보다 높은 흡광도를 확인할 수 있다. Chiva 등(5)의 실험에서도 시판효모인 S. cerevisiae QA23 역시 25℃에 비해 장기간 stationary phase상태를 유지하고 높은 발효능을 보였다. 그 에 반해 25℃에서는 24시간 만에 정지상에 도달했지만 짧은 시간에 성장곡선이 급격히 감소하는 곳으로 보고되었다. 알코올 내성(Fig. 1B)의 경우 Y297 균주는 10% 알코올 함량 에서도 0.4이상의 흡광도를 보여준다. S. cerevisiae K-701 균주를 높은 알코올 농도에 노출 후 생존율을 확인한 실험 에서 급격하게 균 생존율이 떨어지는 것을 확인할 수 있었 다(25). 내당성에 관한 실험인 Fig. 3C의 경우는 glucose 60%에서 0.5정도의 흡광도를 나타내며 내염성 실험인 Fig. 3D에서는 NaCl 8%에서 흡광도 0.7를 유지한다. Wu 등(26)의 내염성 실험에서 염 감수성 효모인 S. cerevisiae AXT3은 25 mM의 NaCl에서 급격히 균수가 감소하는 것을 확인할 수 있었다. 위 결과를 통해 Y297이 저온적응성을 가지고 있으며 여러 환경 조건에 대한 내성을 가지는 것을 확인할 수 있었다.
Fig. 3.
Changes in yeast cell growth under different fermentation conditions. A: Temperature (15℃ and 25℃), B: Alcohol tolerance (0~20%), C: Glucose tolerance (0~60%), D: Salt tolerance (NaCl, 0~10%).
Download Original Figure
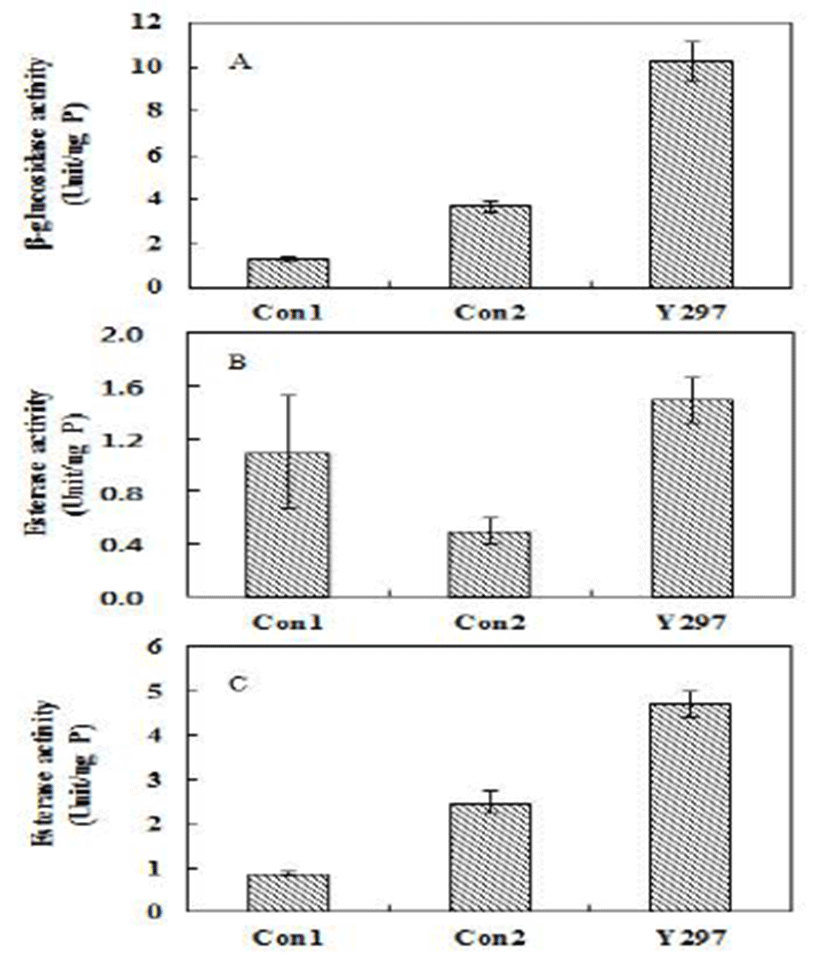
선발효모의 효소활성
저온(15℃)에서 배양한 효모의 세포질 단백질을 추출하 여 향기성분과 관련된 효소인 β-glucosidase와 esterase의 활성을 확인했다(Fig. 4). Y297의 β-glucosidase의 활성(Fig. 4A)은 시판효모들보다 2.5배 높은 활성을 확인할 수 있었 다. Hernández 등(23)의 실험에서 ρ-nitrophenyl-β-Dglucopyranoside을 기질로 하여 활성을 측정한 결과, 균 생 장 속도와 비례하여 활성이 높아지는 것을 확인할 수 있었 고 배양 후 10시간 이후에 활성이 점점 감소되어진다고 보고하고 있다. 또한 상등액보다 균체를 이용한 활성 실험 에서 좀 더 높은 활성이 관찰되었다. ρ-nitrophenyl acetate를 기질로 하여 실험한 esterase의 활성(Fig. 4B)은 Con2에 비해 높은 활성을 보였고 ρ-nitrophenyl-β-butyric acid를 기질로 하여 실험 Fig. 4C 또한 시판효모들보다 높은 esterase 활성 을 보였다. 위의 결과를 통해 발효식품에서 선발된 Y297 균주는 대조구에 비해 향기성분 관련된 효소의 높은 활성을 관찰할 수 있었다. 이러한 점은 약주제조에 있어서 유용한 종균자원 될 수 있는 가능성이 있을 것으로 판단된다.
Fig. 4.
β-glucosidase and esterase activity in the cytoplasm fractions of yeasts based on the release of ρ-nitrophenol from ρ-nitrophenyl- β-D-glucopyranoside (A), ρ-nitrophenyl acetate (B) and ρ -nitrophenyl-β-butyric acid (C).
Download Original Figure
요 약
발효식품에서 분리한 효모 482균주의 저온적응성 및 알 코올 생성능을 확인하고 β-glucosidase와 cerulenin, TFL저 항성을 실험하여 저온적응성이 우수하고 향기성분 활성이 좋은 Y297 균주를 선발하였다. 26s rRNA 염기서열을 분석 한 결과, Y297은 Saccharomyces cerevisiae로 동정되었다. 선발된 균주는 15℃에서는 25℃에 비해 정지상으로에 도달 하는 시간은 오래 걸리지만 보다 많은 균수를 유지하였다. YPD 액체배지에 알코올 농도 10%와 glucose 60% 그리고 NaCl 8%가 포함된 배지에서 내성을 확인할 수 있었다. YPD(glucose 25%)배지에서 배양한 효모의 세포질 단백질 을 추출하여 β-glucosidase와 esterase의 활성을 측정한 결과 시판효모보다 우수한 활성을 나타냈다. 이러한 결과를 통 해 선발된 Y297는 약주제조에 적합한 종균효모로써의 가 능성을 확인할 수 있었다.
Acknowledgment
This work was carried out with the support of ‘Cooperative Research Program for Agriculture Science & Technology Development (Project No. PJ00999001)’ Rural Development Administration, Republic of Korea.
REFERENCES
Baek SY, Lee YJ, Kim JH, Yeo SH. Isolation and characterization of wild yeasts for improving liquor flavors style and quality. Microbiol Biotechnol Lett. 2015; 43 p. 1-9.

Lee SR. Korean Fermentation Foods. 1986; Eeha women’s university pressSeoul, Korea p. 224-294.

Shin KR, Kim BC, Wang JY. Characterization of Yakju prepared with yeasts from fruits. J Korean Soc Food Sci Nutr. 1999; 28 p. 794-800.

Beltran G, Rozes N, Mas A, GuillamOn JM. Effect of low-temperature fermentation on yeast nitrogen metabolism. World J Microbiol Biotechnol. 2007; 23 p. 809-815


Chiva R, Lopez-malo M, Salvado Z, Mas A, GuillamOn JM. Analysis of low temperature-induced gene (LTIG) in wine yeast during alcoholic fermentation. FEMS Yeast Res. 2012; p. 831-843


Torija MJ, Rozes N, poblet M, GuillamOn JM, Mas A. Effects of fermentation temperature on the strain population of
Saccharomyces cerevisiae. Int J Food Microbiol. 2003; 80 p. 47-53


Engan S, Aubert O. Relations between fermentation temperature and the formation of some favour components. In 16th European brewery convention congress. 1977; AmsterdamNetherlands p. 591-607.

Schade B, Jansen G, Whiteway M, Entian KD, Thomas DY. Clod adaption in budding yeast. Mol Biol Cell. 2004; 15 p. 5492-5502.

Aguilera J, Randez-Gil F, Prieto JA. Cold response in
Saccharomyces cerevisiae : new functions for old mechanisms. FEMS Microbiol Rev. 2007; 31 p. 327-341


Lilly M, Lambrechts MG, Pretorius IS. Effect of increased yeast alcohol acetyltransferase activity on flavor profiles of wine and distillates. Appl Environ Microbiol. 2000; 66 p. 744-753


Mason AB, Dufour JP. Alcohol acetyltransferase and the significance of ester synthesis in yeast. Yeast. 2000; 16 p. 1287-1298


Cauet G, Degryse E, Ledoux C, Spagnol R, Achstetter T. Pregnenolone esterification in
Sacchromyces cerevisiae. A potential detoxification mechanism. Eur J Microchem. 1999; 261 p. 317-324


Fujii T, Nagasawa N, Iwamatsu A, Bogaki T, Tamai Y, Hamachi M. Molecular cloning, sequence analysis, and expression of the yeast alcohol acetyltransferase gene. Appl Environ Microbiol. 1994; 60 p. 2786-2792.

Fukuda K, Kiyokawa Y, Yanagiuchi T, Wakai Y, Kitamoto K, Inoue Y. Purification and characterization of isoamyl acetate-hydrolyzing esterase encoded by the IAH1 gene of
Saccharomyces cerevisiae from a recombinant
Escherichia coli. Appl Microbiol Biothchnol. 2000; 53 p. 596-600


Saerens SMG, Verstrepen KJ, Van laere SDM, Voet ARD, Van Dijck P, Delvaux FR. The
Saccharomyces cerevisiae EHT1 and
EEB1 genes encode novel enzymes with medium-chain fatty acid ethyl ester synthesis and hydrolysis capacity. J Biologic Chem. 2006; 281 p. 4446-4456


Verstrepen KJ, Van Laere SDM, Vanderhaegen BMP, Derdelinckx G, Dufour JP, Pretorius IS. Expression levels of the yeast alcohol acetyltransferase genes
ATF1, Lg-ATF, and
ATF2 control the formation of a broad range of volatile esters. Appl Environ Microbiol. 2003; 69 p. 5228-5237


Ichikawa E, Hosokawa N, Hata Y, Abe Y, Suginami K, Imayasu S. Breeding of sake yeast with improved ethyl caproate productivity. Agric Biol Chem. 1991; 55 p. 2153-2154


Bussry H, Umbarger HE. Biosynthesis of branched chain amino acids in yeast a trifluoroleucine-sesistant mutant with altered regulation of leucine uptake. J Bacteriol. 1970; 103 p. 286-294.

Comitini F, Gobbi M, Domizio P, Romani C, Lencioni L, Mannazzu I, Ciani M. Selected non-
Saccharomyces cerevisiae wine yeasts in controlled multistarter fermentations with
Saccharomyces cerevisiae. Food Microbiol. 2011; 28 p. 873-882.

Grover AK, Macmurche DD, Cushley RJ. Studies on almond emulsion ß-D-glucosidase I Isolation and characterization of a bifunctional isozyme. Biochem Biophys Acta. 1977; 482 p. 98-108


Frank B, BjOrn D, Sabrina R, Christian Z, Helmut S, Manfred JS. Cell surface expression of bacterial esterase A by
Saccharomyces cerevisiae and its enhancement by constitutive activation of the cellular unfolded protein response. Appl Environ Microbiol. 2006; 72 p. 7140-7147


Jung HK, Park CD, Park HH, Lee GD, Lee IS, Hong JH. Manufacturing and characteristic of Korea traditional liquor,
Hahyangju prepared by
Saccharomyces cerevisiae HA3 isolated from traditional Nuruk. Korean J Food Sci Technol. 2006; 38 p. 659-667.

Hernández LF, Espinosa JC, Fernández-González M, Briones A. ß-Glucosidase activity in a
Saccharomyces cerevisiae wine strain. Int J Food Microbiol. 2003; 80 p. 171-176.

Strauss MLA, Jolly NP, Lambrechts MG, van Rensburg P. Screening for the production of extracellular hydrolytic enzymes by non-
Saccharomyces cerevisiae wine yeasts. Food Microbiol. 2001; 28 p. 873-882.

Yamaoka C, Kurita O, Kubo T. Improved ethanol tolerance of
Sacchromyces cerevisiae in mixed cultures with
Kluyveromyces lactis on high-sugar fermentation. Microbiol Res. 2014; 169 p. 907-914


Wu G, Wang G, Ji J, Li Y, Gao H, Wu J, Guan W. A chimeric vacuolar Na+/H+ antiporter gene evolved by DNA family shuffling confers increased salt tolerance in yeast. J Biotechnol. 2015; 203 p. 1-8