1. 서론
축산 부산물은 가축 도축과 가공 과정에서 정육 외에 부수적으로 생산되는 식용 가능 부위로, 간, 심장, 위장, 비장, 창자, 콩팥 등의 조직과 머리, 다리, 꼬리, 뼈, 혈액 등이 포함된다(Ahn 등, 2019). 소 부산물은 예로부터 식문화 속에서 사료, 의약용 원료 등 다양한 방식으로 활용되었으나, 여전히 일부 부위는 소비가 저조하고 상대적으로 경제적 가치가 낮다(Jeon, 2013). 예컨대, 축산물품질평가원에 따르면 신장, 심장, 허파 등 특수 부위의 구매 비율은 전체의 1.6%에 불과하며, 심장과 같은 부위는 곱창(소장)이나 대창(대장)에 비해 단가가 낮은 것으로 나타났다(KAPE, 2024). 이러한 현실은 축산 부산물의 영양학적 가치와 기능적 특성에 대한 과학적 연구의 필요성을 시사하며, 나아가 부산물의 고부가가치화를 위한 활용 방안 마련이 요구됨을 뒷받침한다.
특히, 신장, 심장, 허파와 같은 각 조직은 각기 다른 생리적 기능과 대사 특성을 지니며, 이로 인해 조직별로 고유한 지방산 및 인지질 조성을 나타낸다(Du 등, 2022). 신장은 노폐물 여과와 전해질 조절을 담당하는 조직으로, 기능 유지를 위해 세포막의 안정성이 높아야 하므로(Chew와 Lennon, 2018; Tian과 Liang, 2021), 막 안정성에 기여하는 포화지방산의 비율이 중요한 역할을 한다(Catalá, 2015). 또한, 세포막의 유동성과 수송 기능 유지를 위해 불포화지방산의 높은 비율이 함께 요구된다(Bianchetti 등, 2021). 심장은 높은 에너지 수요와 지속적인 수축으로 인해(Kolwicz 등, 2013), β-산화 과정에서 불포화지방산을 선호하므로, 이러한 지방산들이 높은 비율로 축적될 수 있다(Van Der Lee 등, 2000). 한편, 허파는 외부 환경과의 접촉이 잦아 산화 스트레스에 취약하므로, 세포막의 안정성과 유동성이 균형을 이루는 지질의 조성이 요구된다(Al-Saiedy 등, 2018; Kageyama 등, 2024). 이러한 조직 간 생리적 기능 및 요구의 차이는 지방산 합성과 축적 양상에 반영되어 각 조직이 고유한 지방산 조성 프로필을 형성하며, 소 부산물의 영양학적 가치와 활용 가능성 파악에 중요한 단서가 될 것으로 보인다.
인지질은 세포막의 주요 구성 성분으로서, 세포막의 유동성, 곡률 형성, 단백질 기능 등 막의 물리 ․ 화학적 특성 전반에 영향을 미치며(Fuentes 등, 2021), 그 지방산 조성은 조직별 생합성 경로와 효소 활성 등에 따라 달라진다(Choi 등, 2018). 따라서, 인지질은 각 조직의 지질학적 특성을 규명하는 데 있어 중요하며, 이 중 phosphatidylcholine(PC)과 phosphatidylethanolamine(PE)은 다양한 조직에서 가장 풍부하게 존재하는 인지질로(Van Der Veen 등, 2017), 이들의 지방산 조성은 각 조직이 기능성 소재로 활용될 때 영양학적 가치에 중요한 영향을 미칠 수 있다.
그럼에도 불구하고, 소 부산물의 조직별 지방산 조성, 주요 인지질 구성 및 인지질 내 지방산 조성에 대한 연구는 국내외에서 여전히 제한적이므로, 이들의 기능성 소재로서의 가능성을 평가할 수 있는 기초자료가 여전히 부족하다. 특히 기존 연구는 주로 생체 조직이나 원료 상태를 대상으로 한 분석에 국한되어 있으며, 실제 섭취와 유사한 조리 조건, 즉 삶은 상태에서 소 부산물(신장, 심장, 허파)의 지질 조성을 비교한 연구는 드문 실정이다. 이에 본 연구에서는 소 부산물의 영양학적 가치와 활용 가능성을 재조명하고자, 소 부산물(신장, 심장, 허파)을 대상으로 식품으로 흔히 이용되는 삶은 상태를 기준으로 하여 부위별 지방산 조성을 정량 분석하고, 차이를 규명하였다. 아울러, Phosphorus-31 nuclear magnetic resonance(31P-NMR) 분석을 활용하여 주요 인지질(PC, PE)의 함량을 파악하고, thin layer chromatography(TLC)를 통한 각 인지질의 분리 및 gas chromatography(GC) 분석을 통해 이들 인지질 내 지방산 조성을 규명함으로써, 조직별 지질 특성을 종합적으로 평가하고자 하였다. 본 연구 결과는 소 부산물의 과학적 가치 규명은 물론, 부산물의 고부가가치화를 위한 기초자료로 활용될 수 있을 것으로 기대된다.
2. 재료 및 방법
본 연구에서 시료로 사용된 소 부산물(신장, 심장, 허파)은 농촌진흥청에서 제공받았다. 각 시료의 제조회사는 신장은 폴더독, 심장은 천안축산물유통센터, 허파는 꿀맛컴퍼니였다. 지방산 및 인지질 추출을 위한 diethyl ether(DE), petroleum ether, ethanol, chloroform, methanol은 normal-grade를 사용하였다. 지방산 정량을 위한 internal standard(IS, C11:0 triundecanoin)은 Nu-Chek Prep(Elysian, MN, USA), FAME 표준물질은 Supelco (37 Component FAME Mix)에서 구매하였다. 31P-NMR을 이용한 인지질 정성 및 정량에 사용된 triphenylphosphate(TPP≥99%), chloroform-d(CDCl3), ethylenediaminetetraacetic acid (EDTA)는 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구매하였다.
각 시료는 세 번 반복하여 조리되었으며, 조리 전후 무게는 다음과 같다. 신장은 조리 전 496.67±4.16 g에서 조리 후 257.00± 18.58 g으로, 심장은 734.67±59.14 g에서 574.00±55.24 g으로, 허파는 1,265.33±250.13 g에서 1,219.00±246.01 g으로 세 시료 모두 조리 후 무게의 감량이 확인되었다.
소 부산물(신장, 심장, 허파)은 다음과 같은 방법으로 농촌진흥청 국립식량과학원 식품자원개발부 식생활영양과에서 배송되었으며, 분석 전까지 −50°C에서 보관하였다.
조리 전 시료는 흐르는 물로 세척하여 표면의 불순물을 제거하였다. 이후, 증류수 6 L를 사용하여 핫플레이트(ERA-B352E, SK Magic Co., Ltd., Seoul, Korea)의 불세기 9에서 가열하였으며, 신장과 허파의 경우 25분, 심장은 30분 동안 가열하였다. 가열 처리 후 체를 이용하여 잔여 수분을 제거하였고, 균질화를 위해 시료를 약 1.5 cm 이하로 세절한 뒤 마쇄기(Blixer 6, Robot Coupe, Jackson, MS, USA)로 1,500 rpm에서 분쇄하였다. 분쇄된 시료는 질소 충진 후 −70°C에서 보관되었으며, 이후 냉동 상태로 배송되었다.
지방산 조성 분석을 위해 산분해법을 수행하였다. 이를 위해 균질화된 시료 1 g을 50 mL vial에 취하고, 항산화제로서 50 mg/mL 농도의 pyrogallol 용액 2 mL 및 내부 표준물질(internal standard solution, C11:0 triundecanoin, 5 mg/mL in iso-octane) 1 mL를 첨가하였다. 산 분해를 위해 8.3 M HCl 10 mL를 가한 후, vortex 혼합을 수행하였고, 80°C로 설정된 shaking water bath에서 200 rpm으로 1시간 동안 반응을 진행하였다. 반응 종료 후, 찬물로 급속 냉각하였다. 추출 과정에서는 DE 15 mL를 첨가한 후 1분간 vortex 처리하고, 원심분리하여 상층 유기층을 분리하였다. 이후, anhydrous sodium sulfate column을 통과시켜 잔여 수분과 이물질을 제거하였다. 이 과정을 PE 15 mL를 사용하여 반복 수행하였다. 최종적으로 회수된 상층 용매를 질소 가스로 완전히 제거한 후, 남은 지방을 정량하여 조지방 함량(wt%)을 계산하였다.
추출된 조지방의 지방산 조성을 분석하기 위해 GC(Hewlett-Packard 7890 series, Avondale, PA, USA)를 활용하였다. 분석에 앞서 methylation을 실시하였으며, Table 1과 같이 시료에서 추출된 조지방 양에 따라 용매의 양을 설정하였다. 시료에서 추출한 조지방에 0.5 N NaOH in methanol 용액을 첨가하고 혼합한 뒤, 85°C water bath에서 10분간 가열하였다. 이후 시료를 충분히 냉각한 후, 14% BF3 in methanol 용액을 첨가하여 다시 85°C에서 10분간 가열하고, 냉각하였다. 이후, Table 1에 따라 iso-octane과 포화 NaCl 용액 1 mL를 첨가하여 강하게 혼합한 후, 원심분리(2,500 rpm, 3분)하였다. 상층액은 anhydrous sodium sulfate column을 이용해 수분을 제거하고, 이를 통해 얻은 FAME을 GC에 주입하여 각 시료의 지방산 조성을 분석하였다. GC column은 SPTM-2560(100 m×0.25 mm, I.d., 0.2 μm film thickness, Supelco Inc., Bellefonte, PA, USA)이었으며, column oven 온도는 100°C에서 시작하여 4분간 유지한 후 3°C/min의 속도로 증가시켜 최종 240°C까지 도달한 후 17분간 유지하였다. Carrier gas는 He을 1.0 mL/min 유속으로 사용하였으며, injector와 detector 온도는 각각 225°C와 285°C로 설정하였다. 각 시료는 1 μL를 주입하여 분석하였으며, split ratio는 200:1로 설정하여 분석을 진행하였다. GC-FID 상에서의 분석은 각 지방산의 메틸에스테르에 관한 결과이므로 flame ionization detector(FID) 전환계수(FID conversion factor, Ri)를 이용하여 지방산 함량으로 환산하였다. 모든 분석은 세 반복씩 실시하여 평균값과 표준편차를 이용해 데이터로 산출하였다.
| Extracted crude fat (mg) | 0.5 N NaOH in methanol (mL) | 14% BF3 in methanol (mL) | Iso-octane (mL) |
|---|---|---|---|
| < 100 | 1.5 | 2 | 2 |
| 100-200 | 2 | 3 | 3 |
| > 200 | 3 | 5 | 5 |
Detector에서 분석된 데이터는 FAME에 대한 결과이므로, 이를 원래의 지방산 함량으로 전환하기 위해 각 지방산의 response factor(Ri)를 다음과 같이 계산하였다.
PSi는 FAME 표준물질에서 특정 지방산의 peak area를, PsC11:0은 FAME 표준물질 중 C11:0의 peak area를 의미한다. 또한, WC11:0은 FAME 표준물질에서 C11:0의 무게(mg), Wi는 각 지방산의 무게(mg)이다.
Response factor를 이용하여 각 시료에서의 지방산 함량을 아래 식을 통해 계산하였으며, 최종적으로 mg/100 g으로 표기하였다.
Pti는 시료의 각 지방산 peak area, WtC11:0은 시료에 첨가된 internal standard(C11:0)의 무게(g), PtC11:0은 시료 내 internal standard(C11:0)의 peak area를 의미한다. WFAMEi는 지방산 I의 메틸 에스테르로서의 양(mg), fFAi는 지방산 전환계수, Wspl은 시료의 양(mg)이다.
소 부산물(신장, 심장, 허파)에서 조지방을 추출하기 위해 Folch 추출법을 이용하였다. 시료 1 g에 증류수 6 mL와 Folch solvent(chloroform:methanol = 2:1, v/v) 24 mL를 첨가하였다. 2분간 vortex 혼합한 후 3,000 rpm으로 10분간 원심분리하여 상층액과 하층액을 분리하였으며, glass pipette을 사용하여 하층액을 anhydrous sodium sulfate column을 통해 여과하였다. 이후 남은 상층액에 chloroform 12 mL와 methanol 2 mL를 추가하고, 앞선 조건과 동일하게 vortex 혼합, 원심분리하여 하층액을 분리하였다. 모인 하층액을 nitrogen gas로 농축하여 얻은 시료를 바탕으로 조지방 함량을 구하였다.
Folch 추출법으로 얻은 조지방을 이용하여 Bruker Avance III-600 spectrometer(Bruker BioSpin, Billerica, MA)에 의해 인지질을 정량하였다. 장비에 장착된 자석은 Bruker Magnet (Bruker BioSpin, Billerica, MA)이며, 사용된 주파수는 242 MHz이다. 31P-NMR 분석 조건은 다음과 같다. Probe temperature 25 °C; excitation pulse 30°; the number of data points 64 K; relaxation delay 2 s; pulse width 11.05 μs; acquisition time 0.34 s; and number of scans 256.
인지질 분석을 위한 시료 준비를 위해 TPP solution 0.7 mL (1 mg/ mL in chloroform), 0.35 mL methanol, 0.35 mL EDTA-Na+ solution(pH 7.6)을 추출된 지방에 첨가하고, 2분간 교반한 후, 3000 rpm에서 10분간 원심분리하였다. 분리된 하층액은 glass pipette을 이용하여 anhydrous sodium sulfate column을 통해 여과하고, 이후 NMR tube에 옮겨 담았다. 정량 분석은 Hatzakis의 연구에서 사용된 공식을 일부 수정하여 값을 계산하였다(Hatzakis 등, 2008). 여기서 I(PL)은 인지질에 해당하는 피크 면적, A는 내부 표준물(internal standard, IS)로 첨가된 TPP의 μmol, I(TPP)는 첨가된 TPP에 해당하는 피크 면적, m은 분석에 사용된 시료의 질량이다.
3. 결과 및 고찰
소 부산물(신장, 심장, 허파)로부터 추출된 조지방의 각 지방산 조성과 이들의 총포화지방산, 불포화지방산, 트랜스지방산, 조지방 함량을 비교 분석하였다(Table 2). 각 조직에서 공통적으로 palmitic acid(C16:0), oleic acid(C18:1n-9), stearic acid (C18:0)가 주요 지방산으로 나타났으나, 이들 지방산의 상대적 함량 순서는 조직별로 상이하게 나타났다. 신장에서는 포화지방산인 palmitic acid의 함량이 2,514.70 mg/100 g으로 전체 지방산 중 가장 높았고, oleic acid가 2,500.56 mg/100 g, stearic acid가 2,034.51 mg/100 g 순으로 나타났다. 심장과 허파에서는 단일불포화지방산인 oleic acid가 각각 2,050.79 mg/100 g과 1,451.38 mg/100 g으로 가장 높게 나타났으나, 심장에서는 stearic acid(1,564.20 mg/100 g)와 palmitic acid(1,340.98 mg/100 g) 순으로, 허파에서는 palmitic acid(1,076.15 mg/100 g)와 stearic acid(745.53 mg/100 g) 순으로 그 뒤를 이었다.
Means with different superscripts (a-c) in the same row are significantly different at p<0.05 by Duncan’s multiple range test.
Total saturated fatty acids (mg/100 g) = C10:0 (mg/100 g) + C12:0 (mg/100 g) + C14:0 (mg/100 g) + C15:0 (mg/100 g) + C16:0 (mg/100 g) + C17:0 (mg/100 g) + C18:0 (mg/100 g) + C20:0 (mg/100 g) + C21:0 (mg/100 g) + C22:0 (mg/100 g) + C23:0 (mg/100 g) + C24:0 (mg/100 g).
Total unsaturated fatty acids (mg/100 g) = C14:1 (mg/100 g) + C16:1 (mg/100 g) + C18:1 (mg/100 g) + C18:2 (mg/100 g) + C18:3 (mg/100 g) + C20:1 (mg/100 g) + C20:2 (mg/100 g) + C20:3 (mg/100 g) + C20:4 (mg/100 g) + C20:5 (mg/100 g) + C22:1 (mg/100 g) + C24:1 (mg/100 g) + C22:6 (mg/100 g).
한편, 신장은 다른 부위에 비해 특이적인 지방산들이 검출되었는데, 심장과 허파에서는 검출되지 않은 cis-11,14,17-eicosatrienoic acid(C20:3n-3)와 docosahexaenoic acid(DHA, C22:6n-3)는 신장에서 각각 3.84 mg/100 g과 3.52 mg/100 g 검출되었다. 이 중 DHA는 α-linolenic acid(C18:3n-3)로부터 Δ6-desaturase 및 elongase 경로를 통해 생성되는 n-3 계열 다가불포화지방산이며(Takić 등, 2024), cis-11,14,17-eicosatrienoic acid 역시 n-3 지방산이므로, 이와 유사한 경로에서 유래했을 가능성이 있을 것으로 사료된다. 이는 신장의 대사 특성으로 인해 해당 지방산들이 신장에서 일시적으로 축적되었거나 대사 중간체 형태로 존재할 가능성을 시사한다. 또한, 스핑고지질의 구성 요소로 작용하며, 신경계의 안정성과 신호 전달에 필수적인 지방산(Mei 등, 2023; Song 등, 2022)으로 알려진 nervonic acid(C24:1n-9)는 각각 신장 23.52 mg/100 g, 허파 11.85 mg/100 g, 심장 3.96 mg/100 g으로 신장에서 유의적으로 높은 함량이 나타났다(p<0.05).
반면, heneicosanoic acid(C21:0)는 신장에서는 검출되지 않았으나, 심장(17.91 mg/100 g)과 허파(8.23 mg/100 g)에서 소량 검출되었다. 일반적으로 pentadecanoic acid(C15:0), heptadecanoic acid(C17:0) 등의 홀수 지방산은 반추위 미생물의 발효 과정에서 합성되어 육류와 유제품의 지방에 미량 축적되는 것으로 알려져 있다(Pfeuffer과 Jaudszus, 2016). Heneicosanoic acid 역시 이러한 과정에 의해 심장 및 허파 부근의 지방 조직에 축적된 것으로 보이며, 신장은 다른 두 조직에 비해 상대적으로 노폐물 여과 및 대사조절 기능이 활발하므로 해당 지방산이 β-산화를 통해 빠르게 분해 및 제거되어 검출되지 않은 것으로 보인다(Gao와 Chen, 2022).
각 조직에서 총지방산의 구성을 보면, 총포화지방산, 불포화지방산, 트랜스지방산 함량 모두 신장, 심장, 허파 순으로 높게 나타났는데, 신장의 총포화지방산 함량은 5,180.78 mg/100 g으로, 심장(3,163.34 mg/100 g)과 허파(2,033.11 mg/100 g)에 비해 높았으며, 총불포화지방산 함량도 신장 4,379.71 mg/100 g, 심장 3,400.51 mg/100 g, 허파 1,977.98 mg/100 g으로 나타났다. 절대적인 함량과는 달리, 불포화지방산/포화지방산 비율은 신장이 0.85로 가장 낮았으며, 허파는 0.97, 심장은 1.07로, 심장이 다른 조직에 비해 상대적으로 불포화지방산 비율이 높은 것으로 나타났다. 이는 신장이 기능 유지에 필요한 세포막 안정성을 확보하기 위해 포화지방산 비율을 높게 유지한다는 기존 보고와 부합하며(Catalá, 2015), 심장의 경우 지속적인 수축 운동과 높은 에너지 수요로 인해 에너지 생성 과정에서 불포화지방산을 우선적으로 활용하는 특성으로 인해, 조직 내 불포화지방산 축적 비율이 높아진 것으로 판단된다(De Tomasi 등, 2018). 또한, 허파는 외부 환경과 직접 접촉하여 산화적 스트레스에 노출되기 쉬우므로, 세포막의 안정성과 유동성을 모두 확보하기 위해 포화지방산과 불포화지방산이 균형 있게 분포하는 것으로 해석된다(Khoury 등, 2022).
총트랜스지방산 함량의 경우에도, 신장이 108.29 mg/100 g으로 심장(49.80 mg/100 g)과 허파(22.43 mg/100 g)에 비해 유의적으로 높았다(p<0.05). 특히, 신장의 트랜스지방산 비율은 전체 지방산의 1.12%를 차지하여 심장(0.75%)과 허파(0.56%)보다 높았는데, 이는 트랜스지방산이 반추위 미생물에 의해 생합성된 후 지방 조직에 축적되는 특성과 관련이 있을 것으로 사료된다(Petri 등, 2018; Xu 등, 2023). 또한, 신장은 주변부에 지방 조직이 상대적으로 많이 분포하고 있어(Cho 등, 2023), 이러한 반추 유래 트랜스지방산이 더 높은 비율로 포함된 것으로 보인다.
각 부위별 조지방 함량은 신장 9,668.78 mg/100 g, 심장 6,613.65 mg/100 g, 허파 4,033.52 mg/100 g 순으로 나타났으며, 이러한 부위 간 조지방 함량 차이는 해당 조직의 구성과 기능 차이에 기인한다. 신장은 주변에 지방 조직이 풍부하므로 조지방 함량이 높게 나타난 반면, 심장은 주로 근육조직(Emam과 Abugherin, 2019), 허파는 공기주머니와 수분으로 이루어져 있어 상대적으로 무게당 조지방 함량이 낮은 것으로 보인다(Haut 등, 2023).
삶은 소 부산물(신장, 심장, 허파)에서 추출된 주요 인지질인 PC와 PE의 함량(mg/100 g)과 조성비(w/w%)를 분석하기 위해31P-NMR을 활용하였다. 신장의 PC는 −0.82 ppm, PE는 −0.07 ppm, 심장은 PC −0.78 ppm, PE −0.05 ppm, 허파는 PC −0.79 ppm, PE −0.03 ppm에서 나타나(Fig 1), 각각의 peak를 통해 인지질을 정량하였다.
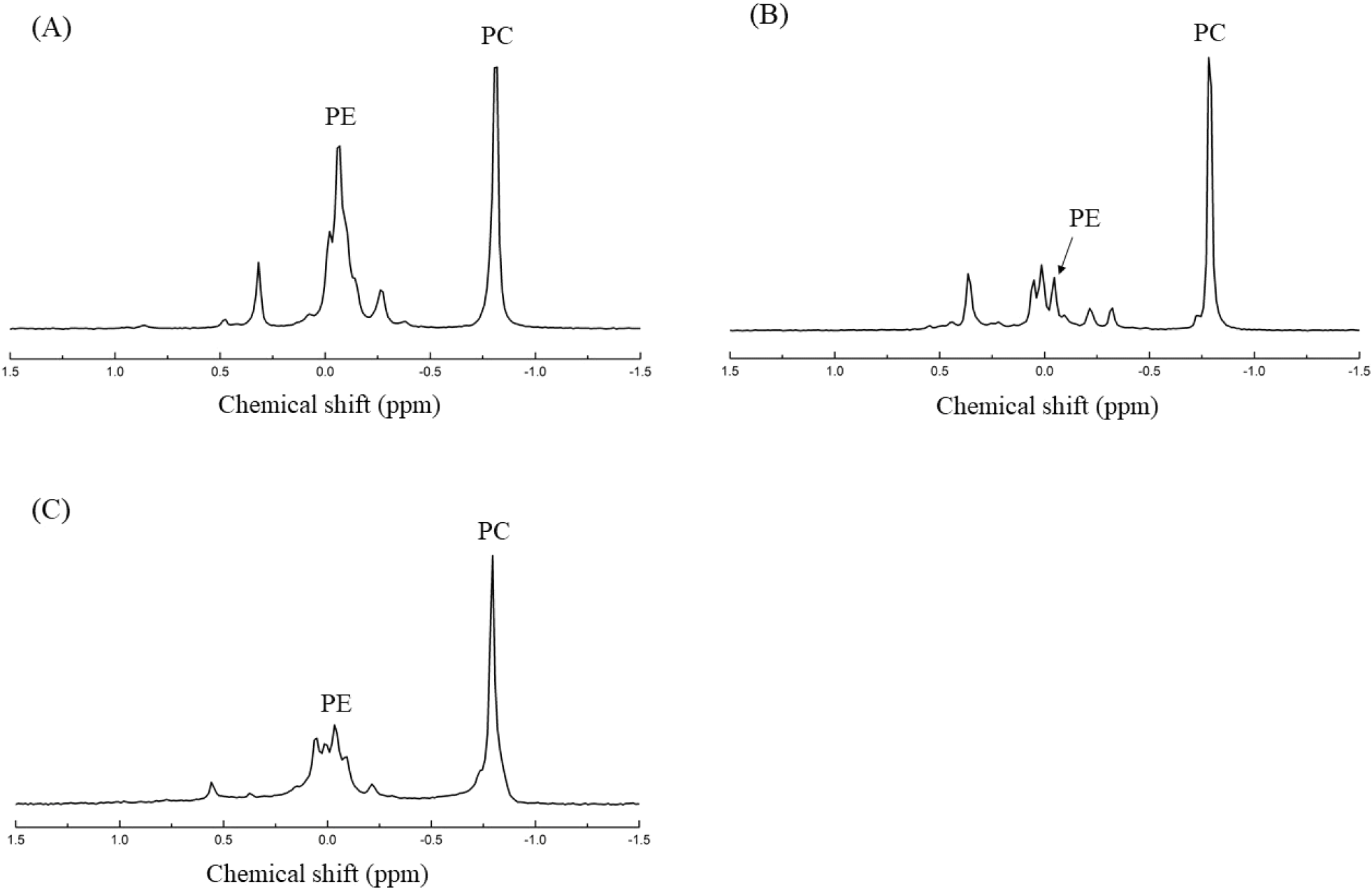
PC와 PE의 함량과 조성비를 비교한 결과(Table 3), PC 함량은 신장에서 1,379.45 mg/100 g으로 가장 높았고, 심장(1,207.30 mg/100 g), 허파(1,152.75 mg/100 g) 순으로 나타났다. PE 역시 신장에서 1,035.28 mg/100 g으로 가장 높았으며, 허파(430.17 mg/100 g)와 심장(295.99 mg/100 g) 순으로 나타나, 신장은 허파와 심장에 대비하여 약 3배 가까이 높은 수치를 보였다. 또한, 인지질 내에서 각각의 조성이 차지하는 비율(%)을 살펴보면, PC 조성비는 허파(21.03%), 심장(14.50%), 신장(10.70%) 순으로 나타났으며, PE의 조성은 신장(8.03%), 허파(7.84%), 심장(3.56%) 순이었다.
PC는 세포막의 기초 구조를 형성하고 막의 안정성을 유지하는 데 주요하게 작용하는 인지질로(Kanno 등, 2007), 안정적인 이중층 구조 형성에 기여하는 반면, PE는 비교적 작은 극성 머리기와 곡률 형성 능력으로 인해 세포 내 막 융합, 세포 분열 등 역동적인 과정에서 주로 기능한다(Calzada 등, 2016). 이러한 기능적 차이로 인해 조직별로 PC와 PE의 조성이 다르게 나타나며, 이는 각 조직의 생리적 요구와 밀접하게 연관되어있는 것으로 사료된다.
허파는 다른 조직에 비해 PC 비율이 유의적으로 높았는데(p<0.05), 이는 폐포 내 표면장력을 안정화하기 위한, 폐포 표면활성제(pulmonary surfactant)의 주된 구성 성분이 dipalmitoylphosphatidylcholine(DPPC)이기 때문으로 생각된다(Bernhard 등, 2001; Veldhuizen 등, 2000). 반면, 심장의 경우 PE의 절대 함량과 조성비가 가장 낮게 나타났는데, 이는 심장 조직의 대사적 특성이 인지질 조성에 반영된 것으로 판단된다. 심장은 지속적인 수축과 이완을 반복하며 혈액을 순환시키는 장기로서(Liu 등, 2025) 세포막의 안정성이 기능 유지에 중요한 역할을 한다(Houang 등, 2019). 반면, PE는 막의 곡률 형성에 기여하는 인지질로, 세포막의 구조적 변형이나 역동적 재배열이 활발한 조직에서 주로 관찰되기 때문에(Basu 등, 2018), 막의 구조적 안정성이 요구되는 심장 조직에서는 생합성 및 축적이 제한적이므로 그 수준이 낮게 유지되는 것으로 보인다.
한편, 세 조직 간 인지질 조성 차이는 단순한 생리적 요구 외에도, 인지질 생합성 경로 조절의 차이에서 비롯될 수 있다. PC는 de novo Kennedy 경로에서 choline kinase를 통해 choline으로부터 직접 합성되며, PE는 CDP-DAG 경로에서 생성된 후, phosphatidylethanolamine N-methyltransferase(PEMT) 경로를 통해 삼중 메틸화되어 PC로 전환될 수 있다(Tams 등, 2019). 이 과정은 PEMT1 및 PEMT2에 의해 촉매되며, 이들 효소의 발현 수준은 조직별로 다르거나, 유전적 요인에 의해 조절될 수 있는 것으로 알려져 있다(Sun 등, 2023). 특히, 신장에서는 PC와 PE의 함량이 유사하게 나타났는데, 이는 phosphatidylserine (PS)의 생합성과 이로부터 탈탄산 반응을 통해 PE를 생성하는 CDP-DAG 경로(Dong 등, 2023)가 다른 조직에 비해 신장에서 더 활성화되어 있기 때문으로 보인다(Jiao 등, 2019). 이 경로는 미토콘드리아 내막에서 주로 수행되며, 신장은 세뇨관 상피 세포를 포함하여 미토콘드리아가 밀도가 높은 조직이므로(Doke와 Susztak, 2022), CDP-DAG 경로의 활성이 조직 내 PE 축적에 기여했을 가능성이 있다. 반면, PE를 PC로 전환하는 PEMT 경로는 신장에서 관련 효소의 발현 수준이 낮아(Watanabe 등, 2014) CDP-DAG 경로에 의한 PE 생합성은 촉진되는 반면, PEMT 경로를 통한 PC 전환은 제한적이다. 따라서, 다른 조직과 달리 신장에서 PC와 PE가 유사한 수준으로 유지되는 것으로 보인다.
소 부산물(신장, 심장, 허파)의 인지질에 결합된 지방산 조성을 비교하기 위해, 각 조직에서 추출한 조지방으로부터 PC와 PE를 분리하여 지방산 조성을 분석하였다.
PC의 지방산 조성을 분석한 결과(Table 4), 세 조직 모두에서 palmitic acid, oleic acid, linoleic acid가 주요 지방산으로 나타났다. 신장 PC의 경우 palmitic acid가 31.88%로 가장 높은 비율을 보였으며, 그 뒤를 이어 linoleic acid(20.77%), oleic acid(14.83%), stearic acid(8.89%)가 나타나, 포화지방산이 43%, 불포화지방산이 57%를 차지하였다. 신장은 수분과 전해질의 선택적 이동을 담당하므로 세포막의 물리적 안정성이 중요하다(Hąc-Wydro 등, 2009). 따라서 세포막에 조밀하게 배열되는 포화지방산이 결합된 PC(Catalá, 2015)는 막의 장벽 기능을 강화하여 신장의 세포막 보호 및 여과 기능을 지원하는 데 유용할 것으로 판단된다(Ali와 Szabó, 2023). 또한, 불포화지방산은 막의 유동성을 높여 세포막의 선택적 투과성을 조절하는 데 중요한 역할을 하며(Bianchetti 등, 2021), 이 중 단일불포화지방산은 지질 이중층 스트레스와 세포 손상을 완화하여 신장 상피세포의 안정성을 보존할 수 있다(Pérez-Martí 등, 2022).
심장 PC는 다른 두 조직의 PC에서 palmitic acid가 가장 높은 비율을 보인 것과는 달리, linoleic acid가 34.24%로 가장 높아 다가불포화지방산의 비중이 42.91%를 차지하여, 신장 37.13%, 허파 15.69%에 비해 유의적으로 높았다(p<0.05). 또한, 심장의 불포화지방산/포화지방산 비율은 1.69로, 신장의 1.33, 허파의 0.70보다 높게 나타났다. 이러한 조성은 심근의 높은 대사율과 에너지 요구량에 대응하여 막 유동성을 유지하고 생체막의 기능적 조절을 용이하게 하기 위한 것으로 보인다(Yang 등, 2011). 심장은 빠르고 반복적인 수축 활동을 위해 막전위 조절과 이온 수송이 정밀하게 이루어져야 하므로 막의 유동성이 높아야 하며, 이에 따라, 심장의 PC 조성에서 다가불포화지방산의 비중이 높게 나타난다고 보고된다(Bohannon 등, 2020).
Means with different superscripts (a-c) in the same row are significantly different at p<0.05 by Duncan’s multiple range test.
Total saturated fatty acid (mg/100 g) = C14:0 (mg/100 g) + C15:0 (mg/100 g) + C16:0 (mg/100 g) + C17:0 (mg/100 g)+ C18:0 (mg/100 g) + C20:0 (mg/100 g) + C21:0 (mg/100 g).
Total unsaturated fatty acid (mg/100 g) = C16:1 (mg/100 g) + C18:1 (mg/100 g) + C18:2 (mg/100 g) + C18:3 (mg/100 g) + C20:1 (mg/100 g) + C20:2 (mg/100 g) + C20:3 (mg/100 g) + C20:4 (mg/100 g) + C20:5 (mg/100 g).
허파 PC에서는 palmitic acid 비율이 43.12%로, 세 조직 중 가장 높게 나타났다. 이는 폐포 표면활성제의 주요 성분이 palmitic acid가 결합된 DPPC이기 때문이며(Ding 등, 2001), 이와 같이 포화지방산 비율이 높은 PC 조성은 기체 교환 과정이 반복적으로 이루어지는 허파의 막 응집력을 증가시켜 표면장력 조절에 기여하는 것으로 알려진다(Ma와 Allen, 2007).
한편, 각 조직의 PE 지방산 조성을 분석한 결과, 세 조직 모두에서 arachidonic acid(C20:4n-6)의 비율이 신장 35.85%, 심장 28.88%, 허파 31.47%로 나타나, PC 지방산의 12.05%, 4.28%, 6.14%와 비교했을 때 상대적으로 비율이 높았다. PE는 에탄올아민기를 지닌 인지질로, 머리 부분의 부피가 작고 극성이 커 주로 세포막의 내엽에 분포하며 막의 곡률과 패킹 밀집도 조절에 중요한 역할을 한다(Patel과 Witt, 2017). 세 조직의 PE에 arachidonic acid의 비율이 높게 나타난 것은 arachidonic acid가 prostaglandin, thromboxane, leukotriene 등 다양한 eicosanoid의 전구체로 작용하며(Calder, 2015), 신호 전달 및 대사 조절에 중요한 역할을 수행하기 때문으로 해석된다(Turolo 등, 2021). 이에 따라, 신장, 심장, 허파와 같이 대사 활성이 높은 조직에서는 이러한 생리 활성 지질이 지속적으로 생성되므로(Jenkins 등, 2009; Wang 등, 2019), 이에 필요한 arachidonic acid가 세포막 인지질 형태로 높은 수준으로 유지되는 것으로 여겨진다.
특히, 신장 PE는 arachidonic acid가 35.85%로, 다른 두 조직에 비해 유의적으로 높게 나타났다(p<0.05). Arachidonic acid는 4개의 이중결합을 지닌 오메가-6 계열 지방산으로, 이와 같은 다가불포화지방산은 세포막의 유동성과 곡률 조절에 기여하며 막 내 단백질의 구조적 안정성을 향상시키는 것으로 알려져 있다(Danielli 등, 2023). 이러한 특성은 여과 및 재흡수가 반복적으로 이루어져 세포막의 형태적 변형이 빈번히 일어나는 신장 조직에서 특히 중요할 것으로 예상된다. 또한, arachidonic acid는 신장 조직에서 eicosanoid인 prostaglandin PGE2의 전구체로 작용하여 혈류 조절 및 사구체 여과율 증가 등 신장의 생리 기능 유지에 관여하므로(Dołęgowska 등, 2006), 신장 PE에 높은 비율로 존재하는 arachidonic acid는 구조적 안정성과 더불어 대사 조절 측면에서도 중요한 생리적 의미를 가진다. 아울러 신장 PE에서 검출된 eicosapentaenoic acid(EPA, C20:5n-3)는 비록 함량이 0.35%로 낮지만, 항염증 효과 및 세포막 유동성 조절에 기여하여 추가적인 생리활성을 부여할 수 있을 것으로 보인다(Calder, 2017; Nelson 등, 2021).
한편, 심장 PE에서는 stearic acid가 35.33%로 가장 높은 비율을 차지하였고, 그 다음으로 arachidonic acid(28.88%)와 linoleic acid(22.36%)가 높은 비율로 나타났다. 이는 심장 조직에서 포화지방산의 비중이 다른 조직에 비해 상대적으로 높아 주요 인지질 구성 요소로 포함되어 있음을 시사한다. 이러한 지방산 조성은 심장 세포막의 구조적 안정성과 유동성 사이의 균형을 유지하기 위한 결과로 해석되며(Levental 등, 2020), 이를 바탕으로 향후 심장 세포막의 기능적 유지를 도모하거나 심장 관련 질환 예방을 위한 지질 기반 기능성 소재 개발에 활용할 수 있을 것으로 기대된다(Jackson 등, 2024).
허파 PE에서는 oleic acid(31.47%)와 arachidonic acid(31.47%)가 가장 높게 나타났으며, 불포화지방산/포화지방산의 비율이 3.52로, 신장의 2.72와 심장의 1.63에 비해 높았다. 높은 불포화지방산 비율은 지속적인 산소 교환이 이루어지고 외부 자극에 노출되는 허파 조직에서 세포막의 유동성과 유연성을 확보하기 위한 구조적 적응으로 해석된다. 다가불포화지방산의 다중 이중결합은 막의 유동성을 높이고 인지질 간 패킹 밀도를 완화하여 막의 두께와 질서도를 감소시키는 것으로 알려져 있으며(Baccouch 등, 2023), 이와 같은 특성은 가스 교환 과정에서 반복적으로 일어나는 막 신장과 수축 시 안정적인 변형을 가능하게 한다. 이러한 결과로부터, 허파 PE의 높은 불포화지방산 비율은 폐포막의 계면 안정성과 막 기능의 항상성 유지에 기여하여, 호흡기의 가스 교환 효율과 점막 보호 기능에 중요한 역할을 할 것으로 판단된다.
결과적으로, 소 부산물(신장, 심장, 허파) 유래 인지질은 각 조직의 특성을 반영한 인지질 및 인지질 결합 지방산 조성이 나타났다. 이러한 차이는 조직별 인지질이 각 조직의 생리적 역할을 뒷받침했기 때문으로 보이며, 이들은 서로 다른 적용 가능성을 지니므로 맞춤형 건강 기능성 소재를 개발할 수 있는 잠재성을 가지고 있음을 알 수 있다. 신장에서는 포화 및 불포화지방산이 균형을 이룬 인지질 조성이 세포막의 안정성과 여과 기능 유지에 기여하며(Ali와 Szabó, 2023), eicosanoid 전구체로 작용하는 arachidonic acid 함량이 높아 대사 조절 및 항염 작용 측면에서 유용한 소재로 활용될 수 있다(Calder, 2017; Dołęgowska 등, 2006). 심장의 경우, 다가불포화지방산이 막 유동성을 높이고(Yang 등, 2011), 장쇄 포화지방산이 안정성을 보완하여 심근 기능 유지 및 심혈관 질병 예방에 적합한 소재로 개발될 수 있다(Jackson 등, 2024). 한편, 허파에서는 포화지방산이 풍부한 PC와 불포화지방산 비율이 높은 PE가 공존하여 막 응집력과 계면 안정성을 동시에 확보하고(Baccouch 등, 2023; Ma와 Allen, 2007), 이는 가스 교환이 빈번한 허파 조직의 특성을 반영하여 호흡기 점막 보호 및 건강 증진을 위한 기능성 소재로 활용할 수 있음을 시사한다.
4. 요약
본 연구는 소 부산물(신장, 심장, 허파)을 대상으로 지방산 조성 및 주요 인지질(PC, PE)의 함량과 조성을 분석하여, 조직별 지질 특성과 활용 가능성을 평가하였다. 지방산 조성 분석 결과, 신장은 palmitic acid(2,514.70 mg/100 g)를 중심으로 포화지방산 함량이 높았으며, 심장과 허파는 각각 oleic acid가 2,050.79 mg/100 g, 1,451.38 mg/100 g으로 가장 높게 나타났다. 특히 신장에서는 다른 조직에서 검출되지 않은 DHA, cis-11,14,17-eicosatrienoic acid 등의 지방산이 검출되었으며, nervonic acid 또한 23.52 mg/100 g으로 심장(3.96 mg/100 g)과 허파(11.85 mg/100 g)보다 유의적으로 높게 나타났다(p<0.05). 31P-NMR 분석 결과, PC와 PE가 신장에서 각각 1,379.45 mg/100 g과 1,035.28 mg/100 g으로 가장 높게 나타났으며, 허파는 전체 인지질 중 PC 비율이 21.03%로 가장 높았다. 인지질에 결합된 지방산 조성을 분석한 결과, 심장 PC는 linoleic acid가 34.24%, 신장 PC와 허파 PC는 palmitic acid가 각각 31.88%와 43.12%로 가장 높은 비율을 나타냈으며, PE에서는 세 조직 모두 arachidonic acid가 28.88-35.85%를 차지하여 가장 높게 나타났다. 심장 PC의 경우 불포화지방산/포화지방산 비율이 1.69로 신장(1.33)과 허파(0.70)에 비해 가장 높게 나타났다. 본 연구는 소 부산물의 과학적 가치를 재조명하고, 기능성 소재로의 고부가가치 활용 방안을 모색하는 기초 자료로 활용될 수 있을 것으로 생각된다.
