1. 서론
폴리페놀의 일종인 탄닌(tannin)은 가수분해성 탄닌(hydrolysable tannin)과 중합탄닌(condensed tannin 또는 polymeric tannin)으로 구분되며, 중합 탄닌을 구성하는 단량체(monomer)는 catechin, epicatechin 그리고 epicatechingallate를 포함하여 flavan-3-ol 형태로 모두 8종이 존재하고, 상호 동종(homo polymers) 혹은 이종(hetero polymers) 결합을 이루고 있다(Sarneckis 등, 2006; Schofield 등, 2001). 탄닌 중합체의 크기를 중합도(degree of polymerization, DP)로 나타내는데 monomer는 DP 1, oligomer는 DP 2-10, polymer는 DP 10 이상으로 이루어져 있다(Liwei 등, 2001). 탄닌은 이러한 고분자 중합체의 화학 구조적 특징으로 인해 생물학적으로 항산화, 항균 및 활성산소 제거 등 유익한 기능을 나타내지만, 채소나 과일 및 가공식품에서는 떫은맛과 쓴맛을 유발하고 탁도와 색 변화를 일으키는 등 품질에 영향을 미치기도 한다(Gacon 등, 1996; Haslam, 1974; Haslam, 1980; Kallithrata 등, 1997; Santos-Buelga와 Scalbert, 2000). 식물체나 과일 내 탄닌은 부위에 따라 구조적 유형이나 특징이 매우 다르다. 예를 들어 식물의 잎이나 과육에는 flavan-3-ol monomer 형태로 존재하며 과
일의 껍질이나 종자에는 oligomer나 polymer 형태의 중합체가 많이 존재한다(Czochanska 등, 1980; Foo와 Porter, 1980). 포도 과피와 종자에는 주로 catechin과 epicatechin으로 결합된 중합체가 큰 비중을 차지하며, 그 외 epicatechin gallate와 epigallocatechin gallate 등이 일부 결합되어 있기도 하다(Prieur 등, 1994). 이러한 탄닌 중합체는 생식용 포도 섭취 시 떫은맛을 유발하며, 특히 와인 제조 시 혼합되는 종자와 과피로 인해 와인의 떫은맛과 탁도 및 색에 영향 주는 것으로 알려져 있다. 포도의 떫은맛은 flavan-3-ol에 결합된 −OH가 구강 내 특정 단백질과 결합하여 침전되면서 느껴지기 때문에 −OH 수와 물질의 구조는 떫은맛과 관련이 깊으며, 일반적으로 탄닌 중합도가 클수록 떫은맛은 강하게 느껴진다고 알려져 있다(Arnold와 Noble, 1978). 최근 생식용 포도 소비가 증가하면서 무핵이며 과피까지 섭취 가능한 대립종 포도에 대한 소비자 선호도가 높아지는 추세에 있다. 따라서 포도 껍질에서 떫은맛을 유발하는 탄닌 중합체에 대한 품종별 함량 분석을 통해 포도 재배 연구에 활용하는 것이 중요하다. 탄닌 중합체 분석은 흡광도 측정이나 크로마토그래피를 이용하여 분획을 만들어 분리한 후 분석하는 등 매우 복잡하고 다양하게 이루어진다(Bae 등, 1994; Boukharta 등, 1988; Oh와 Hoff, 1979; Sun 등, 1998). 다른 한편으로는 중합체 자체를 분석하는 방법이 존재하지 않기 때문에 중합체를 추출한 후 phloroglucinol이나 benzyl mercaptan (toluene thiol)을 이용하여 산 분해를 하고 여기서 파생된 flavan-3-ol을 HPLC나 LC-MS로 정량 분석하는 방법이 널리 쓰인다(Kants와 Singleton, 1990; Mulkay 등, 1981; Rigaud 등, 1993; Wilson, 1981). 포도 떫은맛과 관련한 탄닌 분석은 주로 과피내 중합 탄닌을 대상으로 하는데, 탄닌 추출을 위해 일반적으로 껍질을 건조 후 분쇄하여 아세톤과 물 혼합용매로 일정시간 교반 추출하는 과정을 거친다. 그러나 이러한 추출방식은 과피내 모든 중합탄닌이 용출되기까지 긴 시간이 필요하며, 특히 포도 품종별 과피의 형태학적 차이로 인해 모든 시료에 일률적인 추출 시간을 적용할 때 추출 수율에 편차가 발생할 수도 있다. 반면 포도 섭취 시 느껴지는 떫은맛은 구강 내에서 몇 번의 짧은 저작으로 발생하기 때문에 긴 시간 유기용매 처리 후 얻어지는 탄닌은 그 자체로 떫은맛을 띄지만, 구강 내에서 순간 느끼는 떫은맛에 직접 영향을 주지는 않는다. 본 연구에서는 포도 품종별 혹은 부위별 탄닌 함량 차이나 편차를 구하는 정량적 분석 보다는, 떫은맛에 직접 영향을 주는 탄닌의 정성적 분석을 위한 좀 더 효과적인 추출방법의 차이를 시연하기 위하여 포도 과피는 기존 용매추출 방식으로 처리하고, 포도 과립과 과육은 용매 추출이 아닌 분쇄 후 용매 세정 방식으로 구분하여 HPLC-UV/DAD를 이용하여 탄닌 패턴을 분석하였다.
2. 재료 및 방법
본 연구에서는 성숙 포도 시료와 성장기 포도 시료 등 다양한 시료 군들에 적용할 목적으로 숙기에 수확한 칠레산 수입포도(일반 마트 구매)중 청색과 적색계열 포도 각 1종 그리고 Black sapphire(BS)와 생육 발달 과정 중에 있는 포도로서 경상북도 상주 포도 농가에서 재배 중인 rosetta 품종 중 과립 발달 후 각각 6, 8, 10주 경과한 포도와 충청남도 논산 포도 농가에서 5주 경과한 동일한 품종을 분석하였다. 총 8종의 탄닌 단량체 표준물질 중 취득이 불가능한 gallocatechin gallate (GCG)를 제외한 catechin(C), epicatechin(EC), gallocatechin (GC), epigallocatechin(EGC), epigallocatechin gallate(EGCG), epicatechin gallate(ECG) 및 catechin gallate(CG)는 모두 Sigma Aldrich(St. Louis, MO, USA)에서 구매하였다. 탄닌 단량체 두 분자가 연결된 dimer중 포도에서 주로 검출되는 procyanidin B1과 B2는 PhytoLab(GmbH Co., KG, Vestenbergs-greuth, Germany) 제품을 사용하였고 HPLC 분석과 시료 추출에 사용한 물, 메탄올, 아세토니트릴 및 아세톤(HPLC grade) 등은 모두 Sigma Aldrich(St. Louis, MO, USA)에서 구매하였다. 포도 시료 중 탄닌과 안토시아닌 분리와 정제를 위하여 HW-40F (Toyo Pearl, TOSOH Bioscience Japan) 레진을 사용하였다. 시료 전 처리 과정 중 포도 분쇄는 ONIONS/VEGETABLES CHOPPER(Rui’an Zhuodu Trading Co., Ltd, China)를 사용하였다. 시료 농축을 위하여 EYELA 감압농축기(Condenser N 1000, Water Bath SB 1000, Circulator CCA 110, TOKYO RIKAKI-KAI Co., Ltd, Japan)를 사용하였다.
HPLC 분석에 사용한 탄닌 표준물질은 단량체 7종과 dimer procyanidin B1 및 B2이며, 모두 100 ppm을 기준으로 칭량하고 메탄올과 인산 완충 용액(인산/H2O, 1/1,000, v/v)를 40/60(v/v) 비율로 혼합한 용매에 용해 후 냉장 보관 후 사용하였다. 정량분석을 위한 calibration에 사용한 표준시약 농도는 1-100 ppm 구간에서 5단계 농도로 희석하여 사용하였다.
포도 과피 내 탄닌 추출은 과피 시료 약 2-3 g을 취하여 30 mL 아세톤/물 혼합 용매(70/30, v/v)를 넣고 두 시간 교반 추출한 후 필터 종이에 거르고 감압농축기로 농축하였다(과피 추출법). 과피 추출법과 달리 구강 내에서 느껴지는 떫은맛을 유발하는 탄닌의 분석은 두 가지 시료의 비교를 위하여 과립과, 과피가 제거된 과육 3-5개(10-20 g)를 종자만 제거한 후 과립과 과육 원형 그대로 다지기를 사용하여 구강 내에서 5-10회 저작 후 와 유사한 성상이 되도록 10회 내외 다져서 분쇄하였다(과립분쇄법). 분쇄된 과립 시료 또한 약 30 mL 아세톤/물 혼합 용매를 넣고 10회 정도 흔들어 섞어준 후 필터 종이에 거르고 감압 농축기를 이용하여 농축 하였다.
농축된 시료는 에탄올 완충 용액(에탄올/H2O/TFA, 11/9/0.001, v/v/v) 2 mL에 용해한 후 다음과 같이 정제하였다. HW-40F 레진 약 2 mL를 오픈컬럼(0.5×10 cm)에 충진한 후 컬럼 컨디셔닝을 위하여 에탄올 완충 용액 1 mL를 용출시켰다. 시료 1 mL를 가한 후 용매를 완전히 용출시키고 H2O 1 mL를 가하여 당과 유기산류 등 수용성 물질을 제거하였다. 안토시아닌 분리를 위하여 에탄올 완충 용액 1 mL씩 2회 용출시켰다. 남아있는 탄닌 분획을 분리하기 위하여 아세톤 완충 용액(아세톤/H2O, 60/40, v/v)를 1 mL씩 3회 가하여 분리한 후 아세톤 완충 용액에 용해된 탄닌 분획은 감압농축기로 건조 후 메탄올/인산 완충 용액에 용해하여 HPLC 분석에 사용하였다.
실험에 사용한 HPLC는 G7111A 1260 Dual Pump, G7129A 1260 Vialsampler 그리고 G7115A 1260 DAD WR Detector가 개별 모듈로 결합된 Agilent 1260 Infinity II(Agilent Technologie, Inc., CA, USA) 모델이며, 탄닌 분리를 위하여 4.6×250 mm ZORBAX SB-C18(Agilent Technologie, Inc., CA, USA) 컬럼을 사용하였다. 메탄올/인산 완충 용액에 용해된 시료를 각각 10 mL씩 HPLC에 injection 하였으며, 탄닌 단량체 분리에 사용한 이동상 용매는 인산을 물에 용해(0.1%, v/v)하여 극성용매(A)를 제조하고, 비극성 용매(B)는 인산을 아세토니트릴에 용해(0.1%, v/v)하여 gradient로 사용하였다. 이동상 용매 이동 속도는 1 mL/min이며 컬럼온도 35°C와 UV 275 nm에서 총 용출시간 42분에 걸쳐 분석하였다. 시간에 따른 gradient는 0-5분에서 이동상 용매 A와 B의 비율을 90/10, 5-10분에서 87/13, 10-15분에서 86/14, 15-20분에서 78/22, 20-25분에서 78/22, 25-26분에서 0/100, 26-36분에서 0/100, 36-37분에서 90/10 그리고 37-42분에서 90/10으로 정하여 분석하였다.
결과는 평균과 표준편차(SD)로 표현되었으며, 모든 분석은 GraphPad Prism 7(GraphPad Software 9.4.1 version for Windows, San Diego, CA, USA)을 사용하여 수행하였다. 포도의 berry, skin 그리고 flesh에서 차이를 검정하기 위해 일원분산분석(one-way ANOVA)을 실시하였다. 사후검정은 Duncan의 다중범위검정(Duncan’s multiple range test)을 사용하였고, 통계의 유의성은 p<0.05 수준에서 검증하였다. 동일 행에서 위첨자 문자가 서로 다른 경우(a-c), 해당 값들은 동일 품종 내 부위 간에 통계적으로 유의한 차이가 있음을 의미한다. 두 부위(berry vs skin)만 비교한 경우에는 Wilcoxon 부호순위 검정(n=3)을 실시하였다.
3. 결과 및 고찰
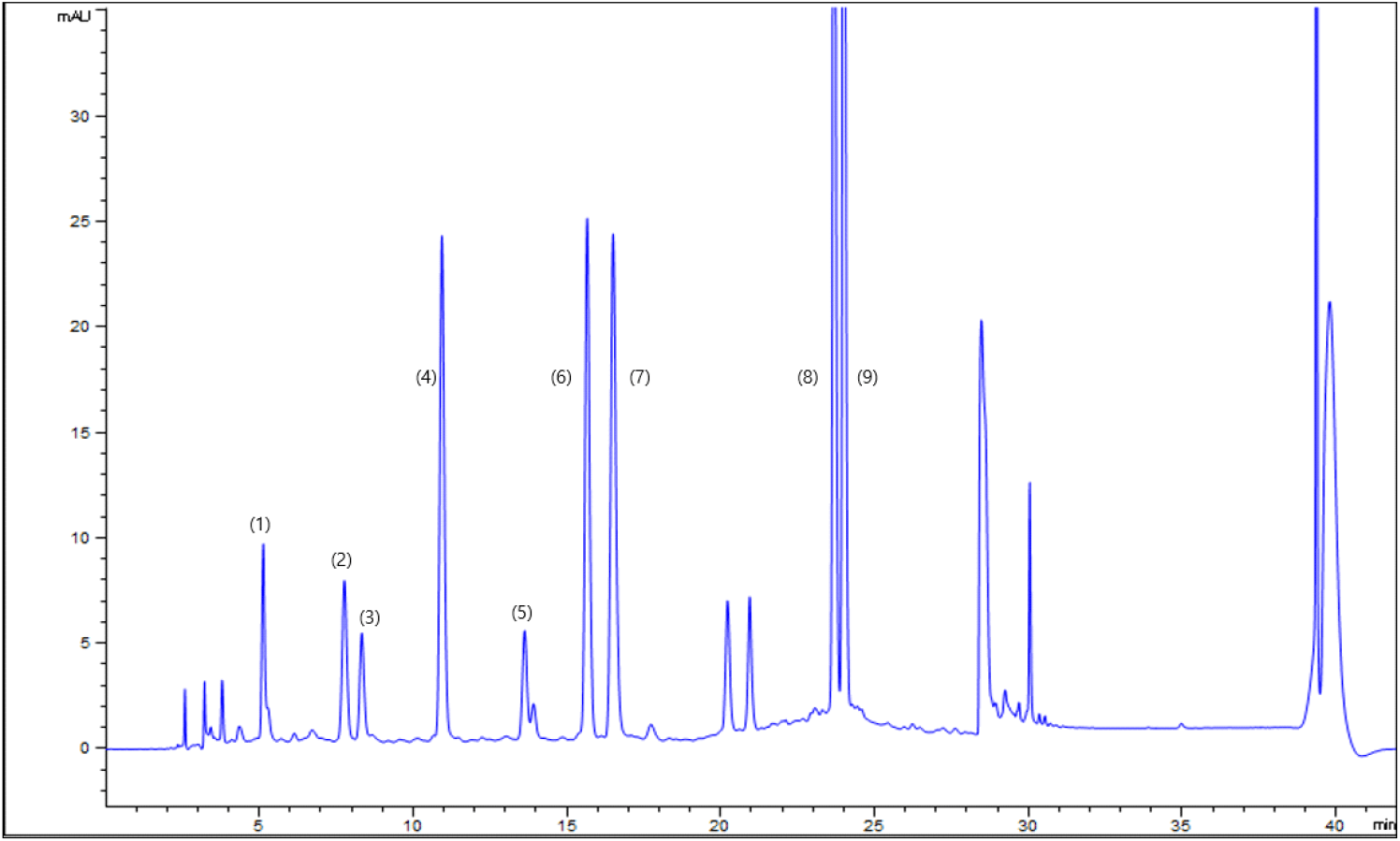
HPLC로 분석한 시료의 탄닌 정량분석을 위하여 단량체 7종과 dimer 2종의 표준용액으로 각각 1, 5, 10, 30, 100 ppm 등 5단계로 구분하여 분석하였다(Table 1). 표준용액 30 ppm에 대한 크로마토그램을 Fig. 1에 나타내었다. 탄닌 단량체의 경우 catechin과 epicatechin에 비해 gallo-구조의 gallocatechin과 epigallocatechin이 먼저 용출되었다. Catechin의 경우 epicatechin에 비해 일찍 용출되었으며, epicatechin과 catechin 각각 한 분자씩 결합한 dimer procyanidin B1 역시 catechin과 epicatechin에 앞서 용출 되었다. 그러나 gallo-구조의 단량체보다 gallic acid가 epicatechin과 catechin에 결합된 epicatechin gallate와 catechin gallate는 모든 단량체와 비교하여 가장 늦게 용출되었다. 따라서 본 실험에서는 gallo-구조가 우선 용출되고, 동일한 gallo-구조라 하더라도 gallic acid가 결합된-gallate 구조의 단량체가 더 늦게 용출되는 것을 알 수 있었다.
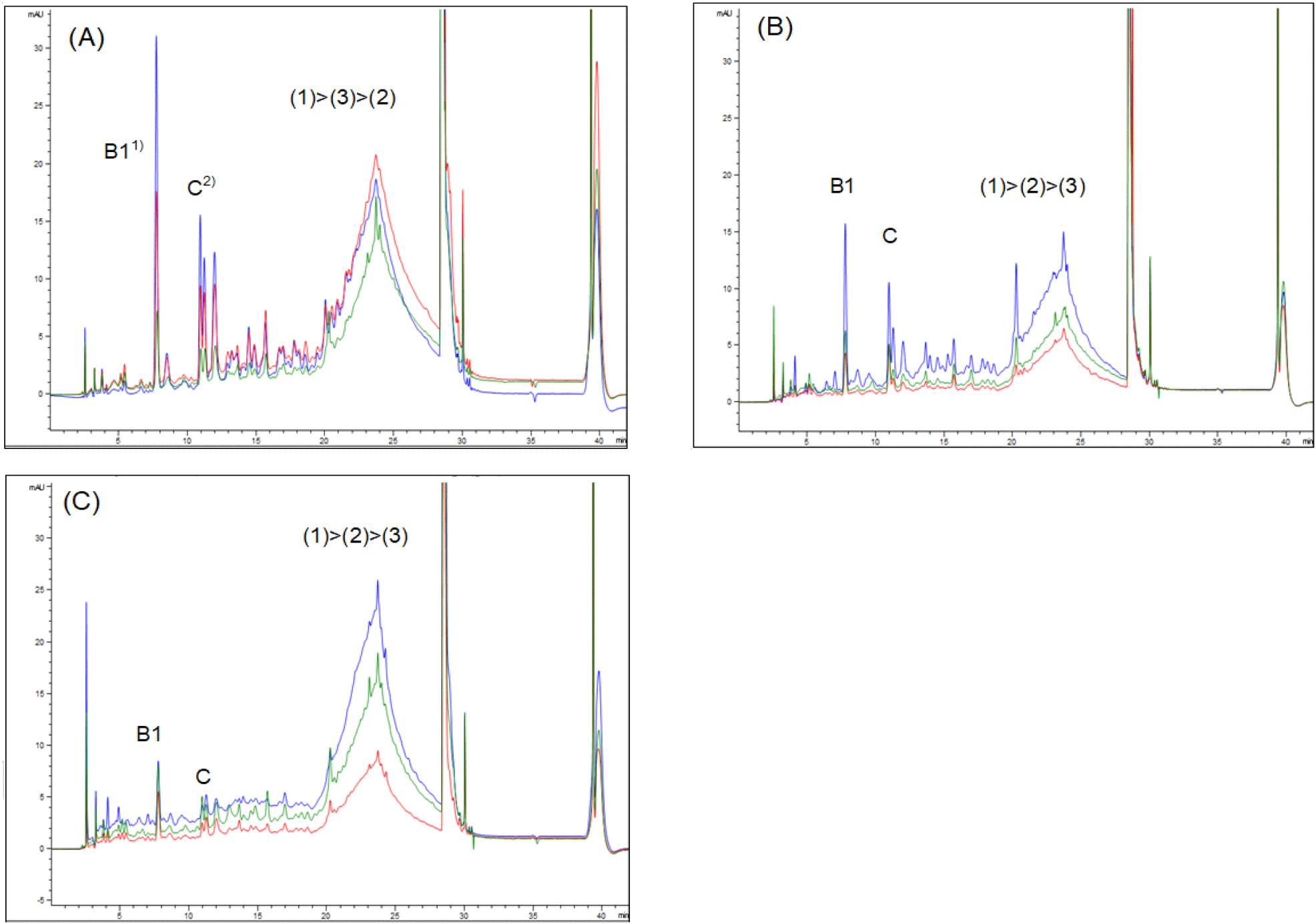
포도 시료를 과립, 과육 그리고 과피로 분리하여 탄닌 농도를 측정하였을 때 모든 시료에서 dimer procyanidin B1과 catechin이 검출되었다(Fig. 2). 일부 시료에서는 미량의 epicatechin이 정량 가능 범위 이하에서 분리되었으며 본 실험 결과에는 반영하지 않았다. 과립 시료에 있어서 dimer procyanidin B1의 경우 청색 포도에서 0.73 μmol/g으로 BS와 적색 포도(0.11/0.18 μmol/g)에 비해 가장 높게 나타났다. 과피 시료에서도 과립에서와 마찬가지로 procyanidin B1은 청색 포도(2.71 μmol/g)에서 가장 높게 나타났다. Catechin의 경우 procyanidin B1과 마찬가지로 과피와 과립 모두에서 청색 포도가 가장 높은 농도를 보였으며, 역시 과립보다 과피에서 현저하게 높게 나타났다. 과립과 과육 시료는 분쇄 후 용매로 저어주는 정도의 추출만으로 procyanidin B1과 catechin이 검출되었고, 과육보다 과립에서 높게 나타났는데, 이는 과육에 비해 과립에 과피 일부가 포함된 것에 기인한 것으로 추정되며 결국 두 개의 탄닌이 포도 떫은맛에 영향을 주는 것을 알 수 있었다. 두 시간 교반 추출한 과피의 경우 동일하게 procyanidin B1과 catechin만이 검출되었으나 농도에서 큰 차이를 보였다(Table 2). 이는 과피 추출의 경우 과립 분쇄법에 비해 더 많이 소요된 추출 시간에 따른 결과이며(Keren 등, 2014; Spigno 등, 2007) 포도 과피 내 탄닌은 주로 단량체가 연결된 중합체 형태로 존재(Sarneckis 등, 2006; Schofield 등, 2001)하기 때문에 교반 추출 과정에서 과립분쇄법에 비해 중합체로부터 단량체의 분리가 더욱 진행된 것으로 보인다. 따라서 포도 섭취 시 느껴지는 떫은맛에 영향을 주는 탄닌은 과립 분쇄만으로 검출이 가능했으며 장시간에 걸친 과피 추출에서 얻은 결과에 비해 오히려 생식포도 섭취 시 떫은맛을 구별하는 척도로 활용하기에 더 간단한 방법이라 할 수 있다. 또한 교반 추출만으로 과피 내 탄닌 중합체로부터 단량체의 분리는 제한적(Keren 등, 2014; Spigno 등, 2007)이기 때문에 중합 탄닌을 구성하는 단량체 패턴 분석을 위하여 추가적으로 산분해 과정을 거쳐 해리되는 단량체를 분석(Kants와 Singleton, 1990; Mulkay 등, 1981; Rigaud 등, 1993; Wilson, 1981)해야 하는 비교적 복잡한 과정이 요구된다. 따라서 포도 떫은맛에 영향을 주는 탄닌의 분석은 과립 자체를 간단히 처리하여 분석하는 것이 더 효과적이라 할 수 있다.
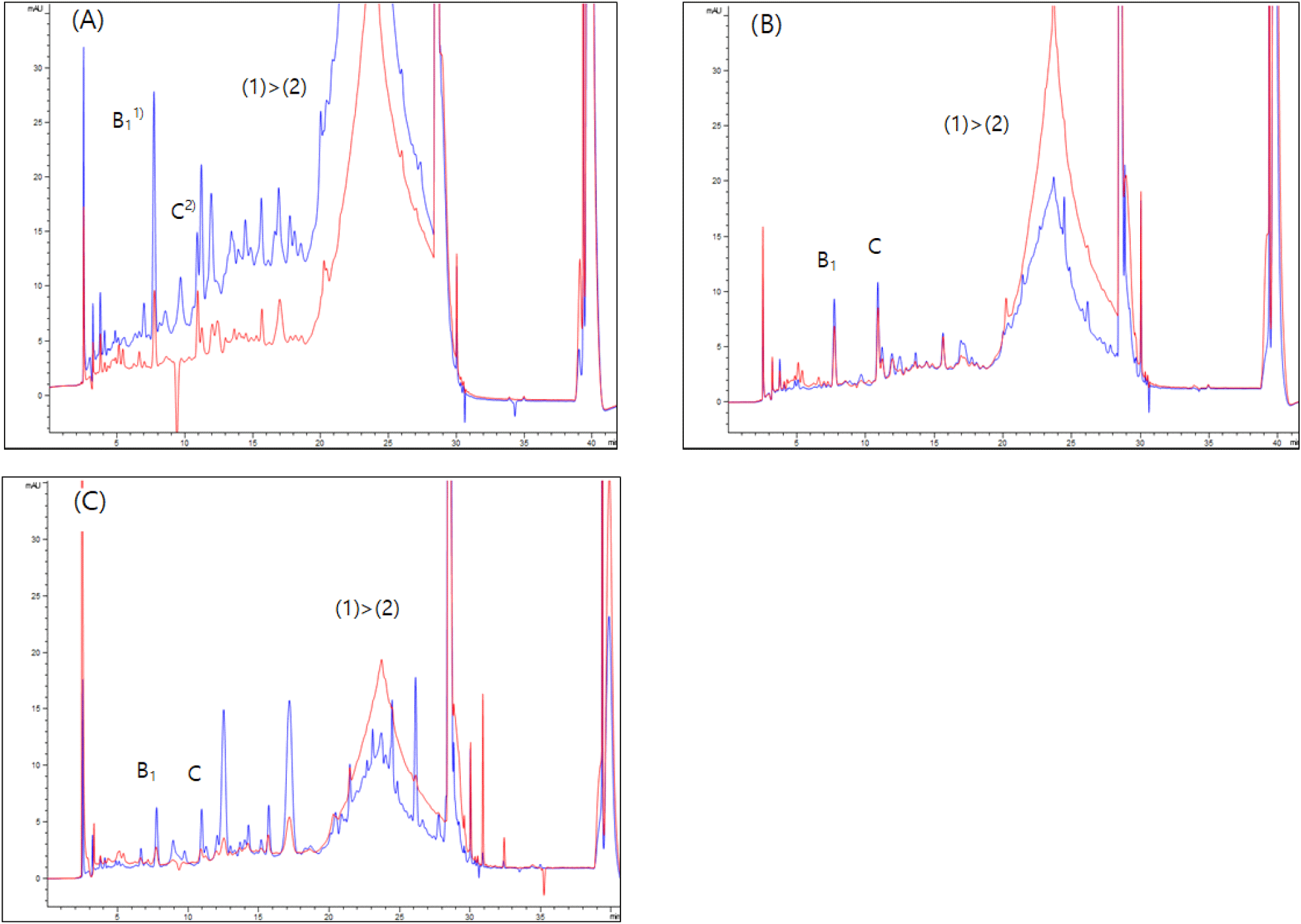
논산과 상주지역 농가에서 재배되는 포도 rosetta 품종 중 5-10주 성장한 포도 과립과 과피를 대상으로 탄닌 농도를 비교 분석하였다(Fig. 3). 성장단계의 포도 품종에서도 수확 포도와 마찬가지로 모든 과립 시료에서 탄닌 농도가 과피에 비해 낮게 검출되었으며, 농도의 차이 또한 수확 포도에 비해 매우 컸다(Table 3). 탄닌 농도는 포도의 개화 이후부터 서서히 증가하다가 변색기를 지나 수확기에 이르면서 현저히 감소하는 경향을 보인다(Nel, 2018). 그러나 논산지역 rosetta 품종의 경우 6-10주까지 성장하면서 과립 내 procyanidin B1 농도는 0.05-0.12 mmol/g으로 일정하게 매우 낮은 농도를 유지한 반면, 과피에서는 0.79-5.85 μmol/g으로 매우 크게 증가하였다. 상주지역 rosetta 품종은 과립에서 0.14 μmol/g 그리고 과피에서 9.99 μmol/g으로 모든 시료 중 가장 높은 결과를 나타냈다. Catechin 함량 역시 상주 rosetta에서 41.89 μmol/g으로 가장 높았으며, 논산 rosetta의 경우 10주 경과한 시료에서 13.68 μmol/g으로 논산의 동일한 품종에 비해 낮게 나타났다. 탄닌 단량체가 과립과 과피에서 큰 농도 차이를 보이는 것은 서로 상이한 추출 방법에 기인한 것으로 보이며, 과피 추출 시간을 높이면 농도 또한 더욱 크게 증가할 것으로 추정된다(Spigno, 2007). 따라서 포도 과피를 일정시간 이상으로 추출하게 되면 탄닌 농도가 계속 변하기 때문에 수확 포도에서와 마찬가지로 성장단계에 있는 포도에서도 과피 탄닌만으로 포도의 떫은맛을 평가하기에 적합하지 않은 것으로 나타났다.
포도 과피 탄닌 중합체는 대부분(60-70%) catechin과 epicatechin의 연결로 이루어져 있고(Souquet 등, 1996), procyanidin B1은 epicatechin과 catechin이 각각 한 분자씩 결합되어 있기 때문에 일반적으로 catechin 농도는 procyanidin B1에 비해 높게 나타난다. 따라서 catechin과 procyanidin의 비율(C/B1)도 1보다 큰 경우가 대부분이다. 본 실험에서는 BS를 제외한 모든 시료에서 C/B1 비율은 1.02-2.85 구간으로 나타났으며, BS 시료에서는 0.53-1.14 구간으로 1보다 낮게 나타났다(Table 1, 2). Catechin과 epicatechin은 분자량은 동일하나 특정 탄소에 결합된 OH 분자의 결합 각도가 차이를 보이는 epimer 관계에 놓여있다. 따라서 C/B1의 농도 비율은 중합 탄닌 전체의 결합력에 영향을 미치게 되며, 이는 포도 과피의 두께, 인장강도 그리고 절단력 등과 같이 과피의 형태학적 특징을 결정하는 주요 인자가 될 것으로 추정된다.
탄닌과 포도 떫은맛의 관계에 대한 기존 연구는 주로 포도 과피 추출물을 산분해 한 후 DP를 측정하여 시료간의 상대적 비교를 하는 방식으로 이루어졌다. 그러나 본 연구에서 제시한 바와같이 과피 분석보다는 과립 자체를 분쇄하여 탄닌을 분석하는 방식이 생식 포도의 구강내 저작 후 느껴지는 탄닌 분석에 더 적합한 것을 알수 있었고, 또한 procyanidin B1과 catechin이 포도 과립의 주요 중합탄닌인 것을 알 수 있었다. 그러나 떫은맛의 척도를 개별 탄닌의 종류와 농도로 나타내기 위해서는 떫은맛의 정도를 객관적인 관능 평가와 연계하여 표준화하고 이에 적합한 탄닌 마커를 발굴하는 방식의 추가적인 연구가 필요하다. 또한 이러한 탄닌 단량체의 발현이 과피내 탄닌 중합체로부터 포도 생육과정과 수확 후 일정기간 보존과 숙성을 거치며 발생 할 가능성도 내포되어 있기 때문에 과피 polymer를 산분해 후 얻어진 DP 결과와 연계된 연구도 필요하다.
4. 요약
포도 떫은맛에 영향을 주는 중합 탄닌의 정성/정량적 연구를 위하여 수확 포도와 생육 발달 과정에 있는 포도를 대상으로 시료 부위별로 추출 방법을 달리 한 후 그 차이를 HPLC를 이용하여 분석하였다. 탄닌 표준물질 단량체 7종과 dimer procyani-din B1과 B2 등 모두 9종의 탄닌을 retention time 42분에 걸쳐 명확히 분리하였다. 포도 시료를 과립과 과육 그리고 과피로 각각 분리하여 과립과 과육은 간단히 분쇄 후 아세톤 용매로 섞어주고 과피는 두 시간 교반 추출하는 방법으로 나누어 비교 분석하였다. 과립, 과육 및 과피 모두에서 catechin과 procyanidin B1이 유일하게 검출되었으며, 부위와 추출 방법에 따라 매우 큰 농도의 차이를 보였다. 과피 내 중합 탄닌 농도는 오랜 추출 시간으로 인해 과립과 과육에 비해 매우 높게 나타났으며, 오히려 떫은맛을 구분함에 있어 변별력에 큰 차이를 보여주지 못하는 것으로 보여진다. 반면 과립 분쇄법의 경우 구강 내 저작과 유사한 성상으로 분쇄하여 측정함으로써 구강 내에서 느껴지는 포도 떫은맛을 유발하는 탄닌 분석에 더 효과적인 전처리 방법으로 확인되었다. 또한, 검출된 catechin과 procyanidin B1의 비율(C/B1)을 측정하여 과피 내 중합 탄닌의 구성을 예측하는 데 활용할 수 있을 것으로 생각된다.
