1. 서론
2050년에는 전 세계 인구가 90억 명 돌파로 예측되는 가운데 유엔 식량농업기구는 식품 생산량이 70% 더 증가해야 할 것으로 추산했고, 세계 경제 발전에 따라 식품 소비 양상이 달라지고 있어 단백질에 대한 수요가 30-95%까지 증가할 것으로 예측하였다(FAO, 1991; Kim, 2018). 더불어 최근 세계 식품 시장에서 식물성 단백질이 푸드테크(Food+Technology)의 대표적인 분야로서 전 세계적으로 지속 가능한 식품의 대안으로 주목받고 있어 2020년부터 2030년까지 연평균 약 18% 이상의 성장이 예측되고(Kang과 Kim, 2023), 향후 10년 이내에 식물성 대체식품이 기존 동물성 식품 시장의 10%를 차지할 것으로 추정하고 있다(Gouseti 등, 2023).
특히, 귀리(Avena sativa L.)는 벼과(Gramineae)에 속하는 곡류로 쌀과 밀에 비해 소비는 적지만 단백질과 지질이 풍부하고 균형 잡힌 필수아미노산의 함유로 식품학적으로 가치가 높아 오래전부터 오트밀 형태의 식품으로 섭취되었다(Aman과 Graham, 1987; Jeong 등, 2014). 국가식품성분데이터에 의하면 귀리의 단백질 함량은 11.14 g/100 g, 필수아미노산은 4,736 g/100 g으로 대두(36.21 g/100 g, 14,627 g/100 g) 대비 31%의 단백질, 32%의 필수아미노산을 함유하고 있으며, 다른 곡물과 비교 시 단백질 함량이 높은 곡물이다(MFDS, 2025). 또한, 동물의 성장에 관여하며 성장 및 뼈의 분화, 칼슘 흡수 보조 역할을 하는 lysine은 다른 곡류에서는 단백질 함량이 높으면 그 함량이 떨어지는 경향을 보이나 귀리의 경우 lysine 함량은 총단백질 함량과 관계없이 일정하다고 한다(Jeong 등, 2014; RDA, 2016). 이처럼 귀리 단백질의 아미노산은 18개로 구성되어 있고 균형 잡힌 필수아미노산을 함유하고 있기 때문에 채식을 위주로 하는 사람들을 위한 단백질 공급원으로 그 가치가 높다(Jeong 등, 2014).
하지만 아직까지 산업적으로 귀리 단백질의 추출 기술은 부족한 실정이다. 귀리의 단백질 추출에 사용되는 방법의 하나인 알칼리 추출법은 알칼리 조건에서 단백질을 용출시킨 후 용출된 단백질을 산성 조건의 pH에서 침전시켜 획득하는 방법이다(Cluskey, 1973; Hohner와 Hyldon, 1977; Ma, 1983). 이러한 알칼리 추출법은 효소 처리법 및 다른 물리적(고압, 초음파 등), 화학적(변성 등), 생물학적(발효 등) 방법에 비하여 추출 수율이 낮지만, 방법이 간단하고 추출 비용이 저렴하여 시간과 비용적인 면에서 경제적인 장점을 가지고 있어 귀리의 단백질 추출의 주된 방법으로 이용되고 있다(Jeong 등, 2014; Tang 등, 2013).
이러한 알칼리 추출 연구는 알칼리 추출 시 단백질 추출 수율에 직접적인 영향을 미치는 추출 용액의 알칼리 농도와 침전 pH 적정 조건이 연구자에 따라 결과가 다르며, 수율 개선을 위한 연구도 매우 제한적으로 수행되었다(Cluskey 등, 1973; Ma, 1983a; Ma, 1983b, Ma 등, 1990). 또한 다수 연구에서 용출된 단백질을 침전시키기 위해 단백질의 등전점 조정에 일반적으로 합성 화합물인 염산(HCl)을 이용하는 경우가 대부분으로 실제 산업 현장에서 이용이 어려운 방법으로 연구되었다. 하지만 최근에는 천연 식품과 친환경적 공정에 대한 선호가 증가하면서 단백질 생산 시 염산 대신 구연산, 말산, 젖산, 초산과 같은 유기산과 레몬주스나 감귤류를 이용하는 연구가 대두 단백, 오카라 단백, 완두 단백의 식물성 단백질과 어류와 같은 동물성 단백질 추출 연구에도 활용되었다는 것을 알 수 있다(Cai 등, 2020; Chamba 등, 2013; Farjami 등, 2024).
이에 따라 천연 산성화제로 귀리 단백질의 등전점보다 낮은 pH를 가지면서 우리나라에서 생산량이 많은 감률류 착즙액을 적용하여 친환경적 단백질 추출 공정에 대한 기초 자료를 확보하는 것도 필요하다고 판단된다. 특히 우리나라 남해안 지역에서 많이 생산되고 있는 감귤류에는 감귤, 한라봉, 황금향, 유자 등이 있으나 이들 작목의 착즙액 pH는 감귤 3.6, 한라봉 4.1, 황금향 3.9, 유자 2.7로 유자가 가장 적합할 것으로 판단되었다(Lee 등, 2013).
따라서, 본 연구는 귀리 단백질 추출 시 유자 착즙액과 다수 선행 연구에서 사용된 구연산을 천연 산성화제로 활용하여 최적 알칼리 pH와 등전점 침전 pH 조건, 추출 수율을 높이기 위한 여러 가지 조건을 확인하고자 하였고, 최종적으로 식품산업 현장에 적용할 수 있는 알칼리 추출 공정 확립을 위한 기초 자료 확보에 그 목적이 있다.
2. 재료 및 방법
본 연구에 사용된 쌀귀리는 전라남도 강진에서 2024년에 재배된 조양 품종이며, 유자는 고흥에서 2023년에 재배된 것으로 착즙액을 사용하였다. 귀리 원곡은 동결건조(PVTFD50R, IlShinBioBase Co., Ltd., Dongducheon, Korea) 하였고, 처리에 사용된 귀리는 수돗물로 3회 세척하고 50°C에서 열풍 건조한 후 핀 밀로 분쇄하였으며, 수침 처리한 귀리는 원곡과 물을 1:10(w/v) 비율로 8시간 동안 수침한 후 50°C에서 15시간 동안 열풍 건조한 후 핀 밀로 분쇄하였다. 모든 귀리 시료는 −20°C에서 보관하면서 분석용 시료로 사용하였다.
본 연구에 사용된 시약은 caustic soda(Youngjin, Bucheon, Korea), citric acid anhydrous[RZBC(JUXIAN) Co., Ltd., China], trisodium citrate[RZBC(JUXIAN) Co., Ltd., China], sodium chloride(Sigma-Aldrich Inc., Co., St. Louis, MO, USA), sulfuric acid(Daejung chemicals & metals Co., Ltd., Siheung, Korea), amino acid standard Mixture(Prod#20088, Thermo Fisher Scientific Inc., Waltham, MA, USA), cystine (Merck & Co., Inc., Rahway, NJ, USA), L-Tryptophane (Sigma-Aldrich Inc., Co., St. Louis, MO, USA)이었다.
쌀귀리의 효소 처리는 전분 분해효소, 단백질 분해효소와 세포벽 분해효소에 대하여 3가지 방법으로 각 효소를 순차적으로 처리하였다. 즉, Enzyme Ⅰ 처리는 전분 분해효소인 α-amylase (BAN 480L, Novozymes A/S, Lyngby, Denmark) 0.1%와 당화효소인 Glucoamylase(Amylase AG 300L, Novozymes A/S, Lyngby, Denmark) 0.1%, Enzyme Ⅱ 처리는 Enzyme Ⅰ 처리에 세포벽 분해효소인 복합 섬유질 분해효소(Viscozyme® L, Novozymes A/S, Lyngby, Denmark) 0.1%를 추가 처리하였고, Enzyme Ⅲ 처리는 Enzyme Ⅱ 처리에 단백질 분해효소인 Protease(Alcalase 2.4 LFG, Novozymes A/S, Lyngby, Denmark) 0.1%를 추가 처리하여 사용하였다. 전분 분해효소는 시료 온도를 60-70°C, 세포벽 분해효소와 단백질 분해효소는 시료 온도를 50-55°C로 맞춘 후 효소를 투입하였다. 모든 효소 처리는 투입 후 120 rpm에서 1시간 동안 교반하였다.
쌀귀리 단백질의 추출은 용출 pH에 따른 단백질 추출 정도를 비교하기 위해 pH 11-13의 알칼리 조건에서 용출시켰다. 즉, 귀리 5 g에 40 mL 증류수를 넣고 가성소다와 구연산으로 pH를 조정한 후 50 mL로 정용하였다. 이를 30°C 항온수조(JSSB-30T, JS Reserch Inc., Gongju, Korea)에서 200 rpm으로 2시간 동안 교반 후 4°C, 10,000 rpm에서 20분 동안 원심분리(Combi R515, Hanil Scientific Inc., Gimpo, Korea)한 다음 상등액을 취하였다.
pH 11-13 조건에서 추출된 쌀귀리 단백질은 등전점 pH에 따라 단백질 침전 정도가 달라진다. 따라서 용출 단백질을 유자 착즙액(pH 2.7)과 구연산으로 pH 3-7로 조절하여 2시간 동안 침전시킨 후 4°C, 10,000 rpm에서 20분 동안 원심분리 한 다음 침전 단백질을 얻었다. 얻어진 침전 단백질은 중량 대비 2배(w/v)의 증류수를 가한 후 200 rpm으로 5분 동안 교반하고 4°C, 10,000 rpm에서 10분 동안 원심분리하는 과정을 3회 반복하여 세척하였다. 세척된 침전 단백질에 10 mL의 증류수를 가한 후 200 rpm으로 5분 동안 교반하고 1% 구연산과 5% 구연산삼나트륨을 이용하여 pH 7로 중화시킨 후 동결 건조하여 단백질 분말을 얻었다. 단백질 분말은 −20°C에서 보관하면서 분석용 시료로 사용하였다.
용출 단백질과 침전 단백질의 단백질 함량은 Bicinchoninic acid(BCA)법을 이용한 Takara BCA Protein Assay Kit(Cat.# T9300A, Takara Bio Inc., Kusatsu, Japan)로 분석하였다. 시료 20 μL에 BCA 시약(Bicinchoninic acid solution : copper(Ⅱ) sulfate pentahydrate 4% solution = 100 : 1, v/v) 200 μL를 혼합하여 37°C 항온수조에서 30분간 반응시킨 후 마이크로플레이트 리더(PowerWave XS2, BioTek, Winooski, Vermont, USA)를 통해 562 nm에서 흡광도를 측정하였다. 단백질 함량은 0.9% NaCl을 이용해 2 mg/mL 농도로 맞춘 bovine serum albumin (BSA)을 표준품으로 작성한 검량곡선을 이용하여 산출하였다.
조단백질 함량은 식품공전 2.1.3.1 총질소 및 조단백질 분석법(MFDS, 2025)에 따라 분석하였다. 침전 단백질을 동결건조 한 시료를 켈달(Kjeldahl) 분해법으로 분석한 후 질소 계수 5.83을 곱하여 분말 수분함량에 대해 보정한 값을 구하였다.
추출 수율은 귀리 원물 시료량과 조단백질 함량의 곱에 대한 최종 동결건조 분말 무게와 조단백질 함량의 곱으로 계산하였다.
시료의 구성아미노산 정량용 시험용액은 식품공전 2.1.3.3 아미노산 분석법(MFDS, 2025)에 따라 제조하였다. 16종의 아미노산과 트립토판은 아미노산 전용 분석기(L-8900&LA-8080, Hitachi High-Tech Science Corporation, Tokyo, Japan)를 통해 Ion exchange resin(60 mm×4.6 mm Na type) 컬럼(온도 57°C, 135°C)과 이동상(구연산리튬완충액, 닌히드린 반응액)을 이용하여 주입량 10 μL, 유속 0.4 mL/min, uv-vis 검출기 파장은 15종 및 트립토판 570 nm, 프롤린 440 nm의 조건으로 정량하였다. 시스틴은 HPLC(1260 infinity Ⅱ, Agilent Technologies, Waldbronn, Germany)를 이용해서 유도체를 만든 후 분석하였다. 분석은 Capcellpak UG120 C18(25 mm×4.6 mm, 5 μm) 컬럼(온도 40°C)과 이동상 (A) 40 mM NaH2PO4 (pH 7.8)과 (B) ACN : MeOH : DW = 45 : 45 : 10(v/v/v)를 이용하여 유속 1.5 mL/min, PDA 검출기 338 nm 조건으로 하였다. 아미노산 표준용액의 검량곡선을 통해 아미노산 함량을 계산하였다.
본 연구의 분석 결과는 모두 3회 반복 측정한 것으로 XLSTAT-Base program(Ver. Perpetual, Addinsoft Inc., Seattle, WA, USA)을 이용하여 통계 처리를 수행하였다. 2개 처리구의 비교는 Levene 검정을 통해 등분산성을 확인 후 p<0.05, 0.001, 0.0001의 유의수준에서 독립표본 t-test로 유의성을 검정하였고, 3개 이상 처리구의 비교는 일원분산분석(one-way analysis of variance) 후 p<0.05 수준에서 Duncan’s multiple range test로 각 실험군의 평균치 간의 유의성을 검정하였다.
3. 결과 및 고찰
가성소다를 이용해 귀리의 단백질을 추출하고 구연산으로 단백질을 침전시킬 때 귀리 원곡의 수침 여부와 식물성 단백질 침전 시 유자의 활용이 단백질 함량과 추출 수율에 어떤 영향을 주는지 확인하였다(Table 1). 물에 수침한 귀리 원곡의 알칼리 추출 침전액의 단백질 함량은 2.08 mg/mL, 조단백질 함량은 3.18%, 단백질 추출 수율은 21.17%를 나타냈고, 수침하지 않은 귀리 추출 침전액의 단백질 함량은 2.32 mg/mL, 조단백질 함량은 3.53%, 단백질 추출 수율은 26.69%를 나타냈다. 두 평균값을 독립표본 t-검정한 결과, 조단백질 함량과 단백질 추출 수율은 p<0.05 수준에서 수침하지 않은 귀리가 유의적으로 높았다. Albarracín 등(2013) 연구에서 현미의 젖산을 이용한 수침 시 단백질 소화율과 무기질 투과성은 개선되었으나 피틴산 손실량이 87-91%, 철 50% 이상, 아연 64% 이상, 단백질 45% 손실되었다고 보고한 결과를 토대로 귀리를 수침하지 않아야 단백질 손실이 적을 것으로 사료된다.
Raw oats, freeze-dried powder sample; Soaked oats, hot-air–dried powder sample after water immersion and protein precipitation by CA+yuzu juice → pH 13 alkaline extraction and pH 3 precipitation; Unsoaked oats, hot-air–dried powder sample and protein precipitation by CA+yuzu juice → pH 13 alkaline extraction and pH 3 precipitation; Citric acid (CA) and CA+yuzu juice, using unsoaked oats → pH 13 alkaline extraction and pH 3 precipitation.
또한, 알칼리 추출한 상등액에 산을 가해 단백질 침전 시 구연산과 구연산+유자 착즙액을 비교한 결과, 구연산을 이용한 단백질 침전액의 단백질 함량은 1.67 mg/mL, 조단백질 함량은 2.97%, 단백질 추출 수율은 21.17%를 나타냈고, 구연산+유자 착즙액을 이용한 단백질 침전액의 단백질 함량은 2.32 mg/mL, 조단백질 함량은 3.53%, 단백질 추출 수율은 26.69%를 나타냈다. 즉, 귀리에서 단백질 추출 후 구연산 단독으로 침전시키는 것보다 유자 착즙액을 이용하는 것이 침전액의 단백질 함량은 p<0.0001, 조단백질 함량은 p<0.001, 단백질 추출 수율은 p<0.05 수준에서 유의적으로 더 높일 수 있음을 알 수 있었다. Chamba 등(2013) 연구에서 대두단백 추출 시 비름 알칼리 추출과 레몬 추출물(pH<2.5) 등전정침전 시 단백질 함량 91.21%, 수율 43.62%로 합성 화학물질(NaOH와 HCl)을 이용한 대두단백과 유사하였다고 하며, Cai 등(2020) 연구에서 염산, 구연산, 말산을 사용하여 오카라 단백질 침전 시 말산과 구연산으로 침전된 단백질에서 7S 글로불린 단백질이 더 뚜렷하게 확인되었다고 한다. 이는 유기산, 레몬 추출물이나 유자 착즙액은 염산과 같은 강산에 비해 단백질 변성에 낮은 반응 보여주는 것으로 구연산과 더불어 유자 착즙액 이용 시 등전침전을 더 효율적으로 하여 단백질 함량을 높일 수 있을 것으로 사료된다.
귀리의 단백질 추출에 적정 알칼리 조건과 등전점 조건을 확인하기 위해 추출 pH 11-13, 침전 pH 3-7에 따른 단백질 특성을 확인하였다(Table 2). 알칼리 추출 pH에 따른 귀리추출액의 단백질 함량이 pH 11은 12.77 mg/mL, pH 12는 11.76 mg/mL, pH 13은 11.12 mg/mL를 나타내어 알칼리성이 높을수록 단백질 추출 함량은 낮아지는 것으로 나타났다. 반면, 알칼리 추출 pH가 증가할수록 등전점 침전물의 단백질 함량, 조단백질 함량은 증가했으며 등전점 pH 역시 그 수치가 증가할수록 단백질 함량과 조단백질 함량도 증가해 pH 13 알칼리 추출 후 pH 7 침전 시 단백질 함량이 가장 높은 것으로 나타났다. 이러한 결과는 쌀귀리를 반응표면분석법을 이용해 NaOH 알칼리 농도별 추출에 대한 침전 pH에 따른 수율이 알칼리 농도가 증가할수록 그리고 침전 pH 5 부근에서 수율이 증가하는 경향을 보인 Jeong 등(2014)의 연구와 유사했다. 이는 고농도의 알칼리 조건에서 단백질 수소결합의 붕괴로 인한 수소 원자의 해리가 증가하게 되고 이러한 작용으로 인해 단백질의 표면 전하량이 증가하여 용해도가 증가하기 때문으로 사료된다(Shen 등, 2008). 하지만 추출 수율의 경우 pH 11 추출 시 pH 5, 6, pH 12 추출 시 pH 4, 5, pH 13 추출 시 pH 4, 5, 6에서 가장 높은 값을 나타냈고, 그중 pH 11 추출 후 pH 5, 6 침전에서 54.12%, 54.36%, pH 12 추출 후 pH 4, 5 침전에서 55.34%, 54.90%로 가장 높은 수율을 보였으며, 이 4가지 추출 수율은 모두 유의적으로 차이가 없었다(p=0.989). 이는 귀리 단백질의 주요 구성 단백질 중 globulin, prolamin, glutelin의 등전점이 pH 4-6의 범위로(Ma, 1983a) 알칼리 조건에서 용출된 단백질이 pH 4-6 부근에서 등전점 침전으로 높은 추출 수율을 보인 것으로 판단된다. 이러한 결과는 침전 pH에 따른 추출 수율의 변화 중 침전 pH 4.9에서 최대 수율 81.80%로 관찰되었다고 하는 Jeong 등(2014)의 연구와 5°C 이하에서 pH 4.6으로 알칼리 추출물을 처리하였을 때 귀리 단백질의 최대 수율을 얻을 수 있다는 Hohner와 Hyldon (1977)의 연구 결과와 유사하였다.
최종적으로 추출 수율이 가장 높았던 조건의 조단백질 함량을 비교해 보면, pH 11에서 추출 후 pH 6 침전은 17.72%, pH 12에서 추출 후 pH 5 침전은 17.35%이며, 서로 유의적으로 차이가 있었다(p=0.015). 따라서, 구연산과 유자 착즙액을 이용한 귀리 단백질의 최적 등전점은 pH 6 정도로 판단되었고, 귀리를 pH 11에서 알칼리 추출 후 pH 6 등전점 침전 시 조단백질 함량과 추출 수율이 가장 높을 것으로 사료된다.
일반적으로 효소는 단백질과 다른 기질과의 결합을 분리하거나 식물성 단백질을 둘러싼 세포벽의 파괴 등을 통해 단백질 추출 효율을 높이는 데 도움을 준다(Gouseti 등, 2023). 즉, 전분 분해효소는 전분을 당으로 분해하여 전분과 단백질의 혼합 매트릭스를 풀어주며, 섬유질 분해효소는 고온, 고압, 알칼리 조건 같은 강한 물리 ․ 화학적 처리 없이도 식물 세포벽을 분해하여 단백질 추출 효율을 향상시킬 수 있고, 단백질 분해효소는 큰 단백질을 가수분해하여 용해성을 증가시키고 회수율을 개선하는 역할을 한다(Gouseti 등, 2023). 따라서 귀리 단백질 추출의 수율을 높이기 위해 원곡을 효소 종류별 처리에 따른 추출 단백질의 단백질 특성을 확인하였다(Figs. 1-3).

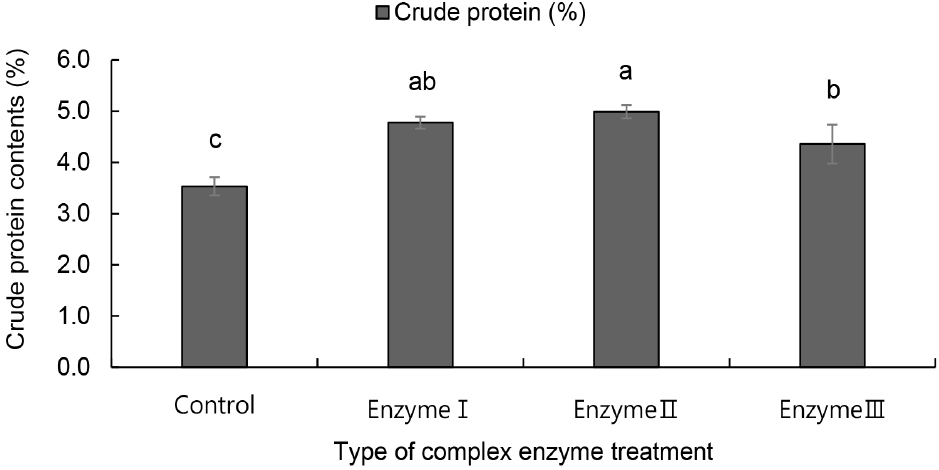
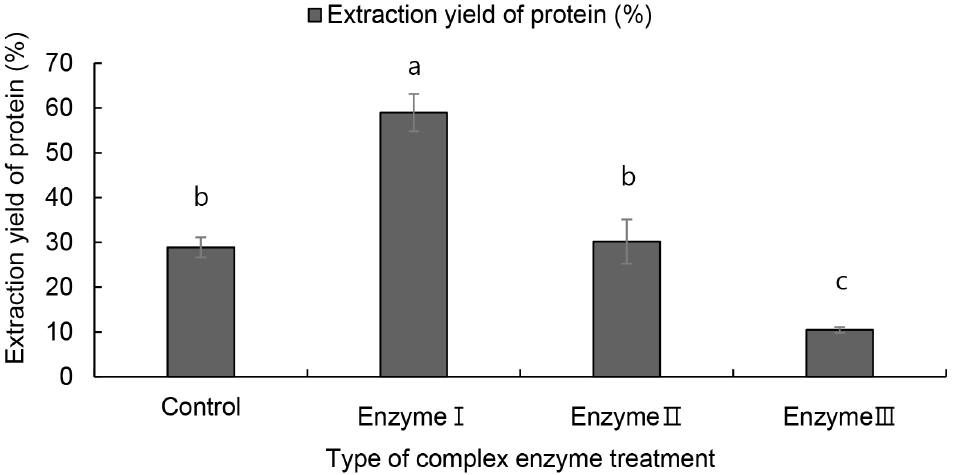
알칼리 추출액과 침전물의 단백질 함량은 모든 효소 처리에서 무처리(control) 대비 높았으며, 특히 전분 당화 ․ 분해효소와 복합 섬유질 분해효소를 이용한 enzyme Ⅱ 처리에서 가장 높은 것으로 나타났다. 즉 귀리 원곡의 효소 처리는 귀리 알칼리 추출 시 단백질을 더 효과적으로 추출할 수 있음을 보여주는 결과였다. 이는 탈지 대두박에 cellulase, xylanase, pectinase, 완두에 papain, 병아리콩에 arabinofuranosidase, cellulase, xylanase 혼합, 렌틸콩에 Viscozyme®를 이용한 연구에서 섬유질 분해효소를 활용했다는 연구 결과와 유사하였다(Gouseti 등, 2023). 또한, 단백질 분해효소 이용 처리(enzyme Ⅲ)는 추출액과 침전액의 단백질 함량이 유사한 값을 보였으며 이는 단백질 분해효소는 단백질을 더 작은 폴리펩티드 또는 단일 아미노산으로 분해하기 때문으로 판단된다. 조단백질 함량 역시 무처리에서 가장 낮은 값을 나타냈으며 enzymeⅠ 처리와 enzyme Ⅱ 처리에서 가장 높은 함량을 보였고 두 처리 간 유의적 차이는 없었다. 추출 수율은 enzyme Ⅰ 처리에서 가장 높은 값을 나타냈고, 단백질 분해효소를 이용한 enzyme Ⅲ 처리에서 가장 낮은 값을 나타냈다. 또한 enzyme Ⅰ 처리는 추출 수율이 가장 높았으나 enzyme Ⅱ 처리가 추출 건물량 대비 enzyme Ⅰ 처리보다 단백질 순도가 더 우수하다는 것을 알 수 있었다.
따라서 최종적으로 귀리의 단백질은 전분 당화 ․ 분해효소와 복합 섬유질 분해효소를 처리한 후 알칼리 추출하는 것이 추출 수율과 순도 높은 단백질 함량을 더 높일 수 있을 것으로 판단된다.
귀리 원곡의 침지 여부와 효소 종류별 처리, 알칼리 추출 pH 조건과 등전점 침전 pH 조건에 따른 추출 단백질의 구성아미노산 함량을 확인하였다(Tables 3-5). 귀리의 구성아미노산은 총 18종이었으며, 시료로 사용한 귀리 원곡의 총아미노산 함량은 101.16 mg/g, 필수아미노산 함량은 39.67 mg/g으로 국가식품성분표에 제시된 귀리 조양 품종의 총아미노산 함량 105.39 mg/g, 필수아미노산 함량 44.91 mg/g과 유사한 값을 나타냈다(RDA, 2016).
원곡 침지 여부에 따른 구성아미노산 중 대부분의 단백질에 함유된 alanine, 식물성 단백질에 다량 함유된 glutamic acid, 혈당 상승 저하에 관여하며 필수아미노산인 leucine, 근육 증가 및 체지방 감소 기능을 갖는 arginine 성분에서 침지한 원곡이 무침지 원곡 대비 유의적으로 높았고 나머지 성분은 원곡 침지에 따른 차이는 없었다. 또한, 추출 단백질의 총아미노산 함량이 원곡을 침지한 귀리는 19.65 mg/g, 침지하지 않은 귀리는 17.96 mg/g이었고, 필수아미노산 함량은 원곡을 침지한 귀리는 9.06 mg/g, 침지하지 않은 귀리는 8.55 mg/g이었으며 모두 서로 유의적인 차이가 없었다(p=0.061, p=0.219). 따라서, 일부 구성아미노산 성분이 침지한 시료에서 유의적으로 높았으나 총아미노산 함량, 필수아미노산 함량은 유의적인 차이가 없어 조단백질 함량과 단백질 추출 수율이 높았던 무침지 조건이 적합할 것으로 판단되었다.
귀리를 pH 13의 알칼리 조건에서 추출 후 등전점 침전 pH 조건에 따른 구성아미노산은 각 성분, 총아미노산, 필수아미노산이 pH 6 > pH 4 > pH 5 > pH 7 > pH 3 순서에 따라 유의적으로 높은 함량을 나타냈다. 특히 pH 6 침전 단백질은 원곡보다 높은 총아미노산 함량(112.82 mg/g)을 나타냈고, lysine, cysteine, tryptophan을 제외한 나머지 성분은 모두 원곡보다 높은 함량을 나타냈다. 또한 알칼리 추출 pH 조건에 따른 구성아미노산은 pH 11 > pH 12 > pH 13 순서에 따라 유의적으로 높은 함량을 나타냈고, 모두 원곡보다 높은 총아미노산 함량을 나타냈다. 즉, 추출 단백질의 아미노산 함량이 원곡보다 높은 함량을 나타낸다는 것은 동량의 귀리 원곡과 추출 단백질 사용 시 추출 단백질에서 더 효과적으로 아미노산을 섭취할 수 있다고 할 수 있다.
특히, 필수아미노산 함량 76.69 mg/g, 총아미노산 함량 203.7 mg/g를 나타낸 pH 11 알칼리 추출 후 pH 6 등전점 침전 단백질은 앞서 언급한 내용과 같이 단백질 추출 수율도 가장 높았다. 따라서 최종적으로 귀리의 식물성 단백질 추출 시 pH 11 알칼리 추출 후 pH 6 등전점 침전이 가장 적합할 것으로 판단되었다.
또한, 단백질 추출 수율 증대를 위한 효소 처리 여부에 따른 구성아미노산은 enzyme Ⅲ 처리에서 각 성분과 총아미노산, 필수아미노산 함량이 유의적으로 가장 높았고 enzyme Ⅰ과 Ⅱ는 tyrosine, valine, aspartic acid 성분을 제외한 나머지 성분과 총아미노산, 필수아미노산은 서로 유의적으로 차이가 없었다. enzyme Ⅲ를 처리한 귀리 단백질의 총아미노산 함량은 62.84 mg/g로 원곡의 62%, 필수아미노산은 23.05 mg/g로 원곡의 58% 정도로 높은 함량을 나타냈다. 또한, 원곡 대비 50% 이상 함량을 갖는 성분은 13종이었으며 그중 필수아미노산은 lysine, leucine, methionine, valine, threonine, phenylalanine 6종이었고, 특히 tyrosine 성분은 원곡의 97%로 그 함량이 유사했다. 따라서, 귀리 단백질 추출 시 enzyme Ⅲ 처리는 enzyme Ⅰ과 Ⅱ 대비 단백질 추출 수율이 낮아 추출 수율을 높이기 위한 목적을 달성할 수 없으나 구성아미노산 함량은 높일 수 있어 아미노산스코어(AAS) 측면에서 식물성 단백질로서 enzyme Ⅰ과 Ⅱ 대비 우수할 것으로 판단되었다(Table 6).
건강기능식품 영양성분 원료로써 단백질 제품 요건 중 하나인 아미노산스코어(AAS)는 건강기능식품의 기준 및 규격에서 최종 제품은 아미노산스코어가 85 이상 되어야 한다고 제시하고 있다. 하지만, 이를 맞추기 위해 최종제품에 아미노산스코어가 85 미만인 아미노산을 첨가할 수도 있다고 제시되어 있다(MFDS, 2021). 본 연구에서도 귀리 단백질 최적 추출을 위한 제조 공정별 아미노산스코어를 산출하였다(Table 6). 각 제조공정에서 필수아미노산 성분의 아미노산스코어는 85 미만이었고 tryptophan 성분의 아미노산스코어는 0으로 나타났다. 하지만, 이를 불완전 단백질이라고 단정할 수 없고 단독으로는 단백질 영양가가 낮으나, 다른 아미노산스코어를 보완할 수 있는 단백질과 보완적 섭취 시 단백질로써 활용할 수 있을 것으로 사료된다.
4. 요약
본 연구는 귀리 단백질 추출을 위한 알칼리 추출에서 유자 착즙액을 활용할 때 추출 수율과 단백질 함량을 높일 수 있는 최적 알칼리 pH, 침전 pH, 효소 처리 조건을 확인하고자 하였다. 먼저, 귀리 원곡은 수침하지 않은 귀리가 조단백질 함량은 3.53%, 단백질 추출 수율은 26.69%로 수침한 원곡보다 단백질 손실이 적었으며, 유기산(구연산)만 이용하여 단백질을 침전하는 것보다 유자 착즙액을 활용 시 조단백질 함량과 추출 수율을 더 높일 수 있었다. 귀리 단백질을 알칼리 추출 시 pH 11에서 수행 후 유기산과 유자 착즙액을 활용하여 pH 6 등전점 침전 조건에서 조단백질 함량은 17.72%, 추출 수율은 54.36%, 총아미노산 함량도 203.7 mg/g로 가장 높은 값을 나타냈다. 또한, 알칼리 추출 시 추출 효율을 높이기 위해 전분 분해 ․ 당화 효소, 섬유질 분해효소, 단백질 분해효소의 3가지 효소에 대해 복합 처리 효과를 확인하였고, 그 결과 효소 무처리구 대비 추출 수율이 높았으며 특히 전분 분해 ․ 당화 효소와 복합 섬유질 효소를 처리한 enzyme Ⅱ 처리에서 추출 건물량 대비 순도 높은 단백질 함량이 높았다. 효소 처리의 경우, 조단백질 함량과 추출 수율은 낮고 구성아미노산 함량은 높은 enzyme Ⅲ 처리구는 아미노산스코어(AAS) 측면에서 식물성 단백질로써 enzyme Ⅰ과 Ⅱ 대비 우수할 것으로 판단되었다. 따라서, 최종적으로 귀리의 단백질 추출을 위해 유자 착즙액을 활용한 알칼리 추출은 전분 분해 ․ 당화 효소 처리 후 pH 11에서 단백질 추출 후 pH 6 등전점 침전하는 것이 가장 최적 조건이라 판단된다. 이러한 연구 결과는 유자 착즙액을 활용한 알칼리 추출이 식품 산업에 적용하기에 적합하며, 귀리 단백질 생산에 효과적인 접근 방식이라는 것을 시사하고 있다.
