1. 서론
김(Pyropia spp.)은 홍조식물문, 김파래목, 김속에 속하는 홍조류로, 미역과 다시마와 더불어 우리나라에서 널리 소비되고 있다. 최근 김은 해외에서 기호적으로 우수성을 인정받아 수출이 점진적으로 증가하고 있다(KATI, 2023). 우리나라에서는 11월부터 익년 3월까지, 주로 겨울철에 서남해안 지역에서 주로 김이 양식되고 있다. 우리나라에서 양식하고 있는 김의 품종은 참김(P. tenera), 방사무늬김(P. yezoensis), 모무늬돌김(P. seriata), 그리고 잇바디돌김(P. dentata) 등이 있다(Kang 등, 2018). 이 중 방사무늬김은 우리나라와 일본에서 주로 생산되어 김밥용 김이나 조미김으로 가장 널리 소비되고 있다(Cho 등, 2009; Lee 등, 2012; Park 등, 2001; Sivakumar 등, 2021). 최근 우리나라에서는 방사무늬김에 비해 식감이 우수한 잇바디돌김에 대한 소비가 점차 증가하고 있는 추세이다.
김에는 다당류와 단백질이 풍부하고, 그 외에도 무기질, 비타민, carotenoid류, mycosporine-like amino acid류(MAAs), 그리고 고도불포화지방산 등 다양한 유용성분을 함유하고 있다(Cao 등, 2016). 특히, 김에는 betaine, taurine, aspartic acid, 그리고 glutamic acid 등의 유리아미노산을 다량 함유하고 있다고 보고된 바 있다(Kim 등, 2021). 이들 아미노산은 김의 풍미 형성뿐만 아니라 품질과도 밀접한 관련이 있어, 김의 품질 특성을 결정하는 중요한 성분으로 알려져 있다(Ishihara 등, 2008). MAAs는 항산화 활성, 자외선 차단을 통한 피부보호 효과, 그리고 지방세포 분화 억제 효과가 우수하다고 보고되고 있으며, 이 중 porphyra-334와 shinorine은 김의 다량 성분으로 확인된 바 있다(Ying 등, 2019). 김은 항암(Kwon 등, 2006), 동맥경화 예방(Inoue 등, 2009), 항고혈압(Qu 등, 2010), 심혈관질환 예방(Tsuge 등, 2004), 항산화(Hwang 등, 2014), 항염증(Yanagido 등, 2018), 알츠하이머병 예방(Liu 등, 2019), 항당뇨(Kitano 등, 2012), 그리고 골질환 예방(Ueno 등, 2017) 등 다양한 건강 기능성에 대한 다수의 논문들이 보고되고 있다.
김은 건강 기능성 및 기호성이 우수한 식품으로 인식되면서 동남아시아뿐만 아니라 유럽, 미국 등에서 그 수요가 꾸준히 증가하고 있는 추세이다. 이러한 김의 기호성 및 건강 기능성은 김에 함유되어 있는 다양한 성분들에 기인한다. 김의 품질 특성은 품종, 채취시기, 그리고 생산지역 등에 따라 다양하게 나타나며, 이와 관련된 연구들이 다수 보고되고 있다(Baek 등 2019; Cho 등, 2021; Jung 등, 2016; Kang 등, 2018; Kim 등, 2014; Kim 등, 2021; Shin 등, 2013). 또한 제품가공 및 저장 중의 품질 변화(Jo 등, 1995; Son 등, 2014) 및 조미김의 품질 특성(Jeon 등, 2008; Kim 등, 2023; Seo 등 2007)에 대한 연구도 보고되고 있다.
최근 대사체 분석 기술은 식품의 품질 향상, 원산지 판별, 품종 간 성분학적 차이 분석 및 가공 과정 중의 대사체 변화 등 다양한 분야에서 활용되고 있다(Shang 등, 2025). 특히 liquid chromatography mass spectrometry(LC-MS)는 식품소재 내 저분자 대사체 동정, 식별 및 정량에 널리 이용되고 있다(Wishart, 2008). 일부 김 품종(P. dioica 및 P. haitanensis)을 대상으로 포자의 생육시기에 따른 대사체 변화에 대한 연구는 보고된 바 있다(da Costa 등, 2018; Wang 등, 2015). 그러나, 우리나라와 일본에서 생산되고 있는 마른김 간 성분학적 특성을 이해하기 위한 LC-MS 대사체 연구는 이루어진 바가 없다.
본 연구에서는 우리나라와 일본에서 널리 생산되고 있는 방사무늬김을 원료로 하여 제조된 국내산 및 일본산 마른김을 대상으로 ultra-high performance liquid chromatography quadrupole time-of-flight mass spectrometry(UPLC-QTOF-MS)를 이용한 비휘발성 대사체 분석을 실시하였다. 또한, 마른김의 주요 저분자 화합물인 유리아미노산, MAAs의 함량 분석을 통해 국내산 및 일본산 마른김의 성분학적 특성을 이해하고자 하였다.
2. 재료 및 방법
본 실험에 사용한 국내산 9종 및 일본산 9종 마른김은 2020년 12월부터 2021년 4월에 채취한 방사무늬김을 이용하여 제조된 것으로, 목포수산식품지원센터로(Mokpo, Korea)부터 제공받았다. 즉, 국내산 마른김의 경우 전라남도 고흥(K-1, 2020년 12월; K-2, 2021년 1월; K-3, 2021년 2월; K-4, 2021년 3월; K-5, 2021년 4월), 진도(K-6, 2021년 1월; K-7, 2021년 2월), 완도(K-8, 2020년 12월; K-9, 2021년 3월)에서, 그리고 일본산 마른김의 경우 아리아케(J-1과 J-2, 2020년 12월; J-3-J-5, 2021년 1월; J-6-J-8, 2021년 2월: J-9, 2021년 3월)에서 생산되었다. 마른김 시료는 분쇄기(SFM-555SP, Shinil, Cheonan, Korea)로 분쇄한 후 사용 전까지 –25°C에서 냉동 보관하였다. 분석에 사용한 모든 이동상 용매는 Optima® LC/MS grade(Fisher Chemical, Loughborough, UK)를 사용하였다.
유리아미노산 분석은 Cho 등(2021)의 방법에 따라 실시하였다. 마른김 분말 0.5 g에 70% ethanol 50 mL를 가하고, 환류냉각장치(SEB-6, SciLab, Seoul, Korea)에 연결하여 100°C에서 1시간 동안 가열 ․ 환류한 후 흡입여과(No. 3, Advantec)하였다. 얻어진 여액은 약 2 mL가 되도록 감압농축하고, 이 농축액과 증류수로 세척한 세척액을 분액여두에 옮겼다. 탈지를 행하기 위해 diethyl ether 20 mL를 가하여 잘 혼합하고 하층액을 농축수기로 옮겨 감압 ․ 농축하였다. 농축액은 lithium citrate 완충액(pH 2.2) 25 mL로 정용하여 0.2 μm membrane filter로 여과한 후, 얻어진 여액을 cation separation column(LCA K07/Li, 4.6×150 mm, 7 μm, Sykam)이 장착된 아미노산 자동 분석기(S430, SYKAM, Eresing, Germany)를 이용하여 분석하였다. Buffer 용액(pH 2.90-7.95)의 유속은 0.45 mL/min, reagent의 유속은 0.25 mL/min로 하였으며, fluorescence detector (Exitation=440 nm, Emission=570 nm)로 검출하였다. 분석된 각 아미노산은 표준물질의 retention time과 비교하여 정성 분석하였으며, 피크 면적을 기준으로 외부표준법을 이용하여 정량 분석하였다.
마른김 분말 100 mg에 50% methanol 20 mL를 가한 다음 상온에서 24시간 동안 추출하였다. 마른김 추출물을 4°C에서 10분 동안 3,264 ×g로 원심분리하고 상층액 1 mL를 0.2 μm Syringe filter로 여과한 후 얻어진 여액을 LC-MS 대사체 분석에 사용하였다. LC-MS 분석은 UPLC(ACQUITY UPLC™ system, Waters Co., Milford, MA, USA)와 QTOF-MS(Xevo G2-XS QTOF-MS, Waters Co.)를 이용하였다. UPLC 조건의 경우, column은 ACQUITY UPLC HSS T3(1.8 μm, 2.1 × 50 mm, Waters Co.)를 사용하였다. 이동상 용매는 0.1% formic acid가 함유된 3차 증류수(A)와 acetonitrile(B)를 사용하였으며, 용출조건은 초기 0-2 min 0% B, 2-5 min 30% B, 5-7 min 60% B, 7-11 min 70% B, 11-13 min 100% B로 하는 gradient 방법으로 용출하였다. Column 온도는 40°C로, 유속은 0.35 mL/min으로 하였다. MS 조건의 경우 ionization mode는 positive electrospray ionization, capillary voltage는 2.5 kV, scan range는 m/z 40-1,000, cone voltage는 40 V, cone gas flow는 50 L/h, desolvation gas flow는 600 L/h, desolvation temperature는 200°C, ion source temperature는 130°C로 하였다. 각 마른김 시료에 대한 LC-MS 분석은 3회 반복 측정하였으며, 국내산 마른김 9종과 일본산 마른김 9종 추출물을 동일량으로 혼합한 quality control(QC)은 10회 반복하여 실시되었다. UPLC-QTOF-MS에서 검출된 화합물은 MassLynx 4.2 (Waters Co.)를 사용하여 정확한 분자량 및 원소 조성을 확인하였다. 화합물은 Massbank(https://massbank.eu/MassBank/), Lipid Maps (https://www.lipidmaps.org/), 그리고 참고문헌에 제시된 mass spectra를 비교하여 동정하였다. 다변량 통계분석은 각 화합물들의 분석 결과를 기반으로 Metaboanalyst 6.0 (https://www.metaboanalyst.ca/MetaboAnalyst/)을 이용하였다. 데이터 정규화를 위해 transformation은 square root transformation을 적용하였으며, scaling은 pareto scaling 하였다. 데이터를 시각화하고 마른김 간 차이를 나타내는 화합물을 동정하기 위해 통계분석은 principal component analysis(PCA) 및 orthogonal partial least squares-discriminant analysis(OPLS-DA) 순으로 진행하였으며, variable importance in the projection(VIP) 분석을 통해 국내산 및 일본산 마른김 간 차이를 나타내는 score가 1.3 이상인 유의성(p<0.001) 있는 변수를 추출하였다. 선별된 대사체들의 정규화된 함량(normalized concentration)은 box plot으로 시각화하였다.
마른김의 MAAs는 Chen 등(2013)이 제시한 방법을 약간 변형하여 추출하였다. 즉, 마른김 100 mg에 증류수 20 mL를 가하여 실온에서 24시간 동안 추출한 후 4,000 rpm에서 5분간 원심분리한 다음, 상층액 1 mL를 0.2 μm Syringe filter로 여과하여 분석용액을 제조하였다. 마른김의 MAAs 함량은 UPLC-QTOF-MS 기반 multiple-reaction monitoring(MRM)을 사용하여 측정하였다. LC-MS 분석은 이동상 용매 용출조건 및 MRM 등의 일부 조건을 제외하고, 2.3절에서 설명한 LC-MS 기반 대사체 프로파일링과 동일한 방법으로 실시하였다. 이동상 용매의 용출 조건은 초기 0-2 min 0% B, 2-5 min 5% B, 5-10 min 70% B로 하였다. Shinorine과 porphyra-334는 본 연구팀이 선행연구에서 분리한 것을 표준물질로 이용하였다(Choi 등, 2022). Shinorine과 porphyra-334는 각각 m/z 333.10 → 186.10, m/z 347.10 → 200.10의 precursor ion과 product ion을 사용하였으며, collision energy는 각각 25 eV와 30 eV로 설정하였다(Geraldes 등, 2020). MAAs는 LC-MS MRM chromatogram에서 검출된 표준물질의 retention time과 mass spectrum 비교를 통해 동정하였다. 또한 0-12.5 ng의 농도로 작성된 shinorine(420.96x + 5.93, R2=1)과 porphyra-334(788.30x + 11.47, R2=0.9999)의 표준곡선을 이용하여 정량하였다.
3. 결과 및 고찰
아미노산은 영양학적 의미 외에도 김의 풍미를 결정하는 중요한 요소이다. 특히, 김은 유리아미노산 함량이 높으므로, 국내산 및 일본산 마른김의 유리아미노산 종류와 함량 비교를 통해 그 성분학적 특성을 이해함이 유용하다고 판단되었다. 따라서 본 연구에서는 국내산 및 일본산 마른김을 대상으로 유리아미노산 함량을 분석하였다. 국내산 마른김의 총유리아미노산 함량은 3,692.51-5,709.58 mg/100 g으로 일본산 마른김(3,914.89-4,920.77 mg/100 g)과 유의적인 차이는 나타나지 않았다(Fig. 1A). 김의 총아미노산 함량은 계절, 생육장소, 해황 등 생육환경에 따라 다르다고 보고된 바 있다(Noda, 1993). 본 연구 결과에서도 동일한 원산지 내 마른김 간에는 채취시기에 따라 총유리아미노산 차이가 나타났으나, 채취시기와 관계없이 원산지 간 비교하였을 때는 의미있는 차이를 보이지 않았다. 마른김의 개별 아미노산 함량을 비교한 결과(Fig. 1B), taurine, threonine, asparagine, 그리고 phenylalanine 등을 제외한 대부분의 아미노산에서 유의한 차이(p<0.05)가 확인되었다. 주요 유리아미노산은 alanine(731.74-1,719.43 mg/100 g), taurine(1,009.28-1,593.04 mg/100 g), glutamic acid(497.87-1,635.66 mg/100 g) 그리고 aspartic acid(35.58-316.14 mg/100 g)로 확인되었으며, 이들 4종 아미노산은 총유리아미노산의 약 83.3-86.7%를 차지하였다. 개별 유리아미노산에 있어서도 원산지나 채취시기에 따라 차이를 보였으며, alanine, taurine, glutamic acid, aspartic acid는 상대적으로 높은 함량을 나타내었다(Table S1과 S2). 이는 alanine, taurine, glutamic acid, aspartic acid가 김의 주요 유리아미노산으로 보고된 이전 연구 결과들(Cho 등, 2021; Lee 등, 2012; Park 등, 2001)과 일치하였다.
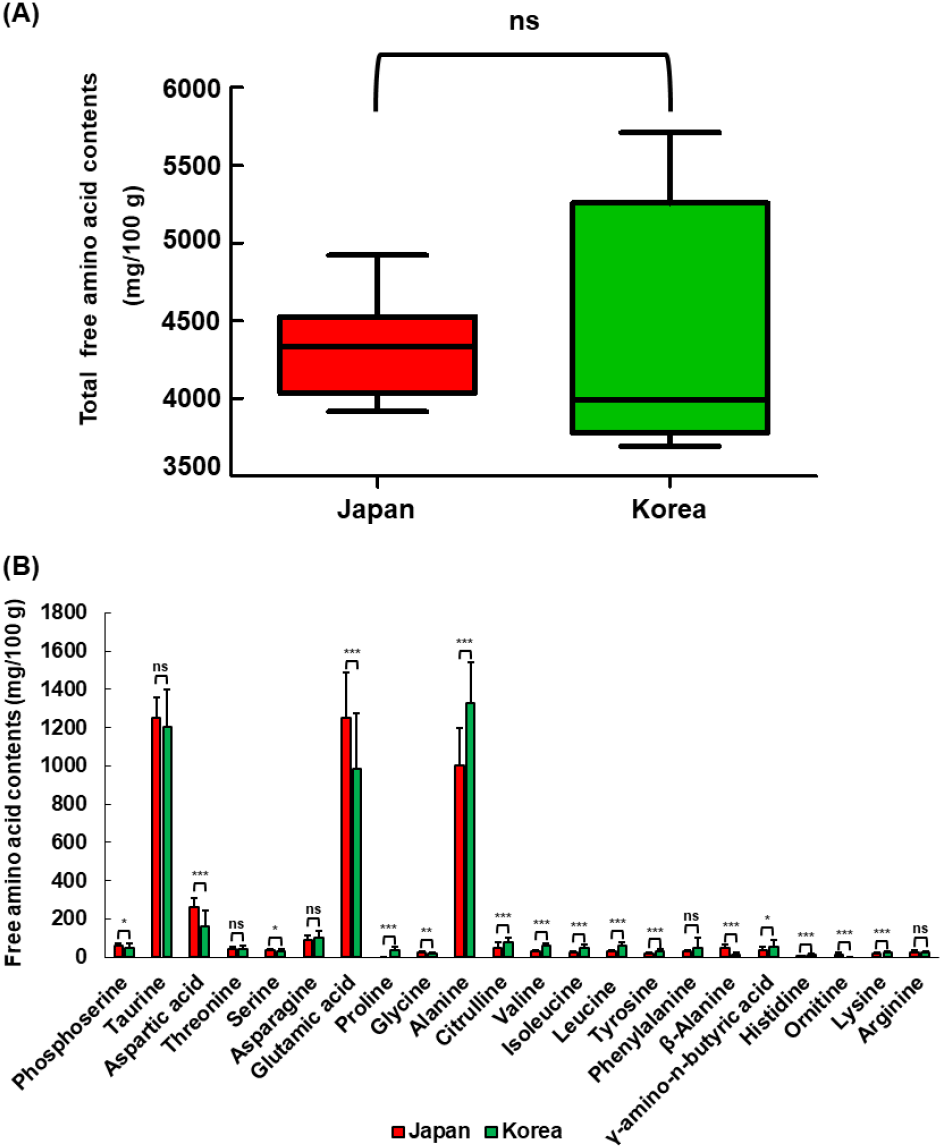
유리아미노산은 핵산 관련 화합물, 펩티드, 유기산, 유리당 및 카보닐 화합물과 함께 식품의 풍미를 형성하는 주요 물질로 알려져 있으며(Brand와 Bryant, 1994), 김에 다량 함유된 alanine, glutamic acid, aspartic acid의 함량 차이는 마른김의 맛에 영향을 미칠 수 있다. 맛에 관여하는 주요 유리아미노산을 비교한 결과, alanine은 국내산 마른김(1,043.44-1,719.43 mg/100 g)에서 일본산 마른김(731.74-1,373.14 mg/100 g)에 비해 유의적으로 더 높은 함량을 나타냈다. 반면, 일본산 마른김에서 glutamic acid(913.63-1,635.66 mg/100 g)와 aspartic acid(180.14-316.14 mg/100 g)의 함량은 국내산 마른김의 glutamic acid(497.87-1,433.94 mg/100 g)와 aspartic acid(35.58-290.99 mg/100 g)에 비해 유의적으로 더 높았다. 또한, 맛에 관련된 다수의 유리아미노산 조성에서도 원산지에 따른 유의적인 차이가 관찰되었으나, 그 함량 차이는 크지 않았다. 이러한 결과는 마른김의 총유리아미노산 함량은 원산지 간 차이를 보이지 않았으나, 개별 아미노산의 함량 차이를 나타내는 것으로 보아 원산지에 따라 김의 품질 특성에 영향을 미칠 것으로 시사되었다.
UPLC-QTOF-MS를 이용하여 국내산 마른김 9종과 일본산 마른김 9종의 대사체를 분석한 결과(Fig. 2), 4종의 아미노산(No. 1, 3, 4, 6), 6종의 MAAs(No. 10, 14, 19, 20, 22, 26), 9종의 핵산(No. 11, 13, 15, 17, 18, 21, 23–25), 19종의 리소인지질(No. 28-46), 그리고 8종의 기타 화합물(No. 2, 5, 7-9, 12, 16, 27) 등 총 46종의 주요 대사체가 동정되었다(Table 1). LC-MS chromatogram에서 검출된 대사체는 온라인 라이브러리 및 문헌과의 mass spectra 비교를 통해 동정하였으며, 각 화합물의 retention time, precursor ion, fragment ion, molecular formula 등의 정보는 Table 1에 제시하였다.
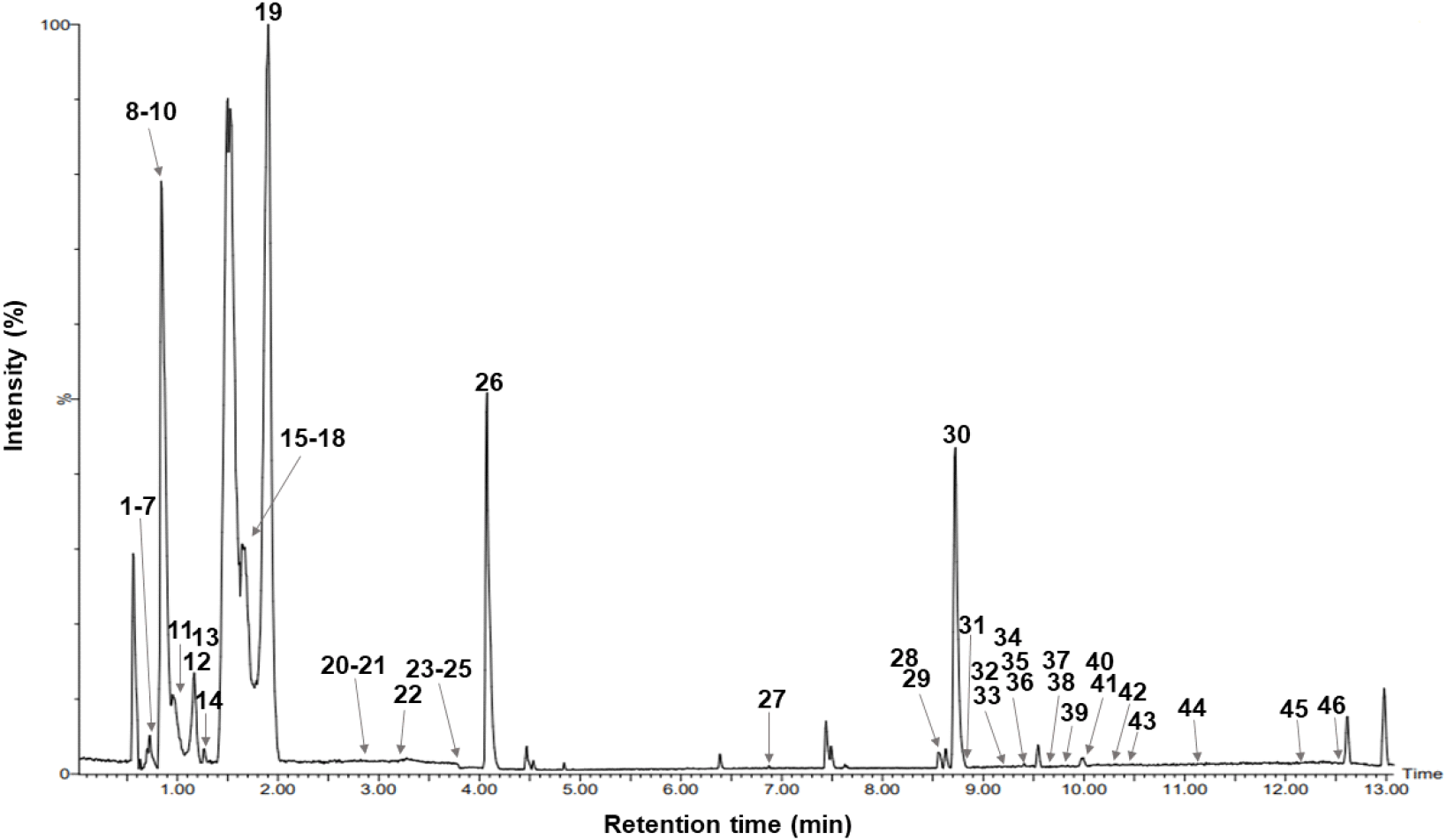
Metabolites were identified by (1), massbank; (2), lipid maps; (3), standards; (4), Geraldes and Pinto (2021); (5), Kamio et al. (2010); (6), Kawauchi et al. (1978); (7), Torres et al. (2018).
단백질은 김의 주요 구성성분 중 하나로, 마른김에는 31.1-40.1%가 함유되어 있다고 보고된 바 있다(Park 등, 2001). LC-MS 대사체 분석 결과에서 taurine, aspartic acid, alanine, glutamic acid가 김의 주요 유리아미노산으로 동정되었으며, 이는 앞서 제시한 유리아미노산 함량 분석 결과와 일치하였다. 따라서, 김의 주요 유리아미노산은 taurine, aspartic acid, alanine, glutamic acid임을 확인할 수 있었다.
MAAs는 cyclohexenone과 cyclohexenimine의 기본 골격에 amino acid 또는 imino-alcohol group이 결합하여 형성된 2차 대사산물로 알려져 있다. 특히, 이러한 화합물들은 녹조류나 홍조류를 포함한 다양한 해양식물에서 존재하고 있다고 보고되고 있다(Wada 등, 2015). 최근 김에도 shinorine과 porphyra-334를 포함한 MAAs가 존재하고 있음이 보고된 바 있어(Ying 등, 2019), 김의 유용성분 중 하나로 주목받고 있다. LC-MS 대사체 분석 결과에서 shinorine, asterina-330, porphyra-334, mycosporine-glycine-alanine, aplysiapalythine B, usujirne 등이 주요 MAAs로 검출되었다. 이들 화합물의 MS(positive) spectra에서는 [M-CH3+H]+., [M-H2O+H]+, 그리고 [M-CO2+H]+로 한 fragment ion peak들이 공통적으로 관찰되었다. 김의 주요 MAAs인 porphyra-334의 경우 m/z 347[M+H]+, 332[M-CH3+H]+., 303[M-C2H4O+H]+, 288[M-CH3-CO2+H]+., 244[M-CH3-2CO2+H]+., 200[M-CH3-CO2-C2H4O+H]+., 186[M-CH3-2CO2-C3H6O+H]+.이, 그리고 shinorine의 경우 m/z 333[M+H]+, 318[M-CH3+H]+., 303[M-CH2O+H]+, 274[M-CH3-CO2+H]+., 230[M-CH3-2CO2+H]+., 186[M-CH3-2CO2-C2H4O+H]+.이 특징적인 MS fragment ion임을 확인할 수 있었다.
핵산은 nucleotide와 nucleoside로 구성되어 있으며, 세포핵 내에 존재하며 세포의 분열, 성장 등을 조절하는데 중요한 역할을 한다(Minchin과 Lodge, 2019). 핵산의 기능으로는 세포 부활, 면역 강화, 과산화 지질 형성 억제, 항알레르기 등의 건강 기능성이 알려져 있다(Kim과 Kim, 2010). 그러므로, 핵산이 우리 몸에 생합성되지 않아 부족해질 경우 세포 기능이 저하되고 노화의 원인이 될 수 있으므로 식품으로부터 섭취할 필요가 있다(Qiu 등, 2016). 마른김에는 adenosine, cytidine, guanosine, inosine, uridine 등 5종 nucleoside와 5’-CMP, 5’-GMP, 5’-UMP, 5’-IMP 등 4종 nucleotide가 존재하고 있음을 LC-MS 분석을 통해 확인할 수 있었다. 리소인지질(lysophospholipid)은 세포막의 주요 구성물질로, lysophosphatidylcholine(LPC), lysophosphatidylethanolamine(LPE), lysophosphatidic acid(LPA), lysophosphatidylserine(Lyso-PS), lysophosphatidylinositol(LPI), 그리고 lysophosphatidylglycerol(LPG)로 크게 구분된다. 이러한 리소인지질은 glycerol의 sn-1 또는 sn-2에 결합된 지방산의 종류에 따라 구조적으로 매우 다양하다(D’Arrigo와 Servi, 2010). 본 연구에서는 12종 LPC류와 7종 LPE류를 포함한 총 19종의 리소인지질이 마른김의 주요 화합물로 동정되었다.
이상의 결과로부터 김에는 아미노산, MAAs, 핵산, 그리고 리소인지질 등이 주요 화합물로 존재하고 있음을 LC-MS 분석을 통해 확인할 수 있었다. 이러한 저분자 화합물들은 원산지에 따른 마른김의 성분학적 특성을 이해하는데 활용이 가능할 것으로 기대되었다.
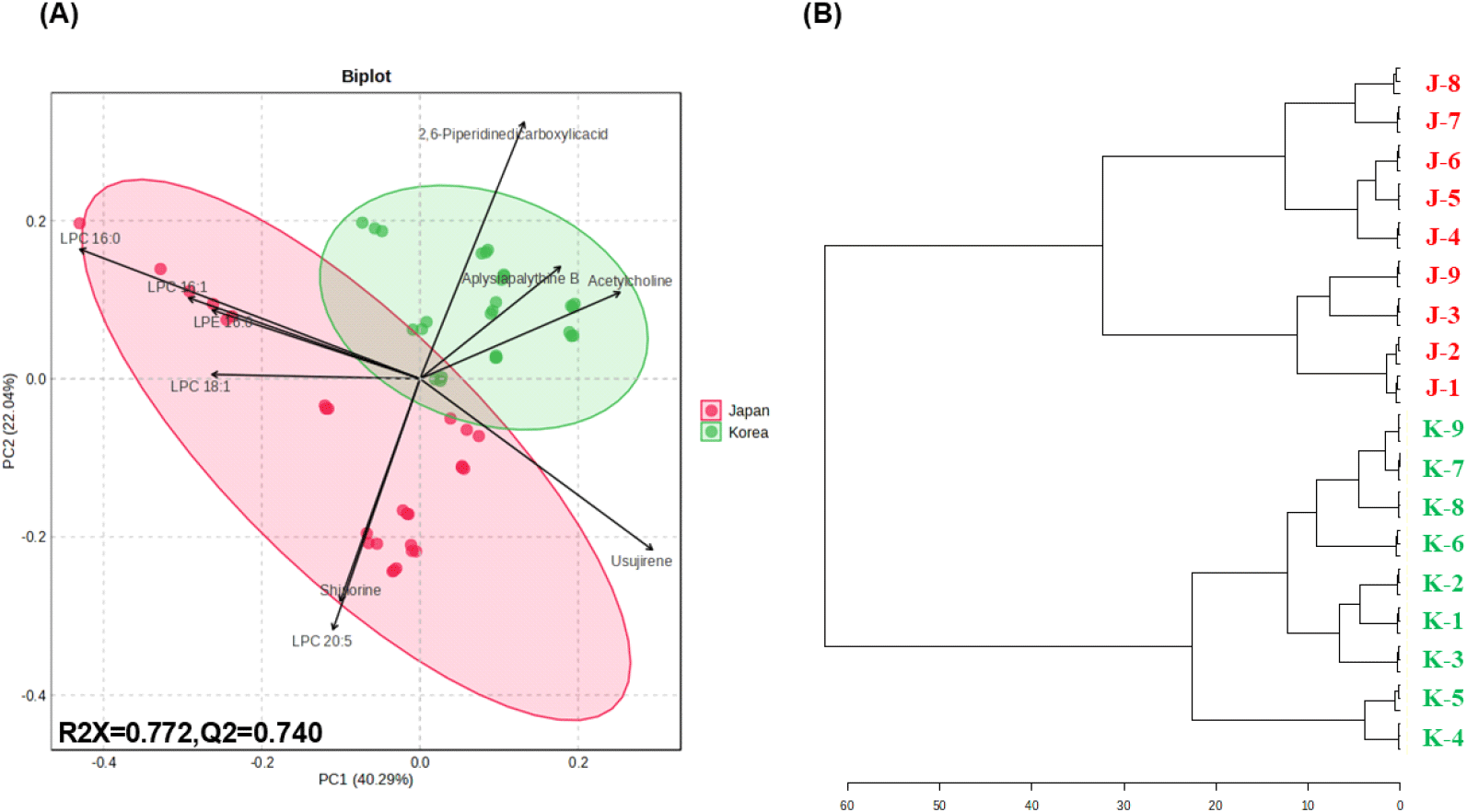
UPLC-QTOF-MS를 이용하여 마른김 대사체 동정을 진행한 후 다변량 통계분석을 실시하여 원산지별 대사체 차이를 비교하였다. 국내산 및 일본산 마른김의 성분학적 차이를 비교하기 위해 LC-MS 분석 결과를 기반으로 PCA의 biplot 모델을 적용하였다(Fig. 3A). Component 1은 전체 분산의 40.29%, Component 2는 22.04%를 설명하였으며, 모델의 적합도(R2X)는 0.772, 예측도(Q2)는 0.740으로 확인되었다. 국내산 및 일본산 마른김은 서로 다른 두 그룹으로 구별되는 경향이었으며, Component 1을 기준으로 양의 부분에는 국내산 마른김이, 음의 부분에는 일본산 마른김이 위치하였다. 국내산 마른김의 주성분은 acetylcholine(No. 9), 2,6-piperidinedicarboxylic acid (No. 12), 그리고 aplysiapalythine B(No. 22)로 확인되었다. 일본산 마른김의 경우 shinorine(No. 10)과 LPC 20:5(No. 30)가 주성분으로 확인되었으며, 일부 마른김에서는 LPE 16:1(No. 36), LPC 16:1(No. 37), LPE 16:0(No. 38), LPC 16:0(No. 40), 그리고 LPC 18:1(No. 43) 등의 리소인지질 함량이 높은 것으로 확인되었다. 핵산 함량은 채취시기에 따라 방사무늬김에서 유의적으로 차이가 있다고 보고한 바 있으나(Park 등, 2001), 본 연구결과에서는 국내산 및 일본산 마른김 간에 의미있는 차이를 나타내지 않았다. PCA는 마른김의 원산지를 기준으로 두 마른김 그룹이 구분되며, 각 그룹의 구분에 기여하는 주성분에 대한 차이를 확인할 수 있었다. 마른김의 원산지에 따른 군집(cluster) 형성을 더욱 명확하게 알아보기 위해 Spearman’s distance measure와 Ward’s 알고리즘을 사용하여 dendrogram 분석을 실시하였다(Fig. 3B). 그 결과, dendrogram에서 국내산 마른김과 일본산 마른김은 두 개의 주요 군집으로 구분되었다. 이는 원산지에 따른 대사체 차이가 명확하게 존재하는 것으로 시사된다. 그러나, 동일한 군집 내에서도 일부 시료들이 구분되는 경향을 보였다. 이러한 결과는 마른김의 대사체 조성이 원산지에 의해 크게 영향을 받으며, 채취시기 또한 일정 부분 그 차이에 기여할 수 있음을 의미한다.
원산지별 마른김 간의 구별에 기여하는 주요 인자를 확인하기 위해 OPLS-DA의 score plot과 S-plot 모델을 적용하였다. OPLS-DA 모델은 유의한 적합도(R2=0.812)와 높은 수준의 예측도(Q2=0.804)로 확인되었으며, 마른김의 원산지에 따라 OPLS-DA score plot에서 명확하게 구별이 되는 것을 확인하였다(Fig. 4A). 또한, OPLS-DA 모델의 유효성을 검증하기 위해 permutation test(n=1,000)를 수행한 결과(Fig. 4B), R2는 0.964, 그리고 Q2는 0.942이었으며 p<0.001에서 통계학적으로 의미가 있음이 확인되었다. OPLS-DA의 S-plot 모델은 두 그룹 간 대사체의 공분산(covariance)과 상관관계(correlation)를 시각적으로 나타내며, 중심축에서 멀리 위치한 변수들은 두 그룹을 구별하는 데 중요한 역할을 한다. 또한, S-plot에서 p(corr) 값이 높거나 낮을수록 해당 변수가 두 집단을 구별하는 데 기여하는 정도가 유의미하게 나타남을 의미한다(Shyti 등, 2015). OPLS-DA S-plot 모델을 통해 국내산 및 일본산 마른김의 구분에 기여도가 높은 화합물(VIP>1.3, p<0.001)을 동정한 결과 국내산 마른김은 acetylcholine(No. 9), 2,6-piperidinedicarboxylic acid(No. 12), aplysiapalythine B(No. 22)로 확인되었고, 일본산 마른김은 shinorine(No. 10)과 LPC 20:5(No. 30)로 확인되었다(Fig. 4C). 이들 OPLS-DA의 결과는 PCA biplot에서 확인된 결과와 유사한 것으로 관찰되었다. 다변량 통계분석을 통해 동정된 5종의 화합물을 대상으로 normalized concentration plot 분석을 실시한 결과는 Fig. 4D에 제시하였다. 분석 결과, 원산지에 따라 각 화합물의 함량 차이가 나타나는 경향을 보였으나, 동일한 지역에서 생산된 마른김일지라도 개별 화합물의 함량 차이가 확인되었다. 이는 같은 원산지 내에서도 생육환경, 채취시기의 차이가 대사체 조성에 영향을 미칠 것으로 추정된다.
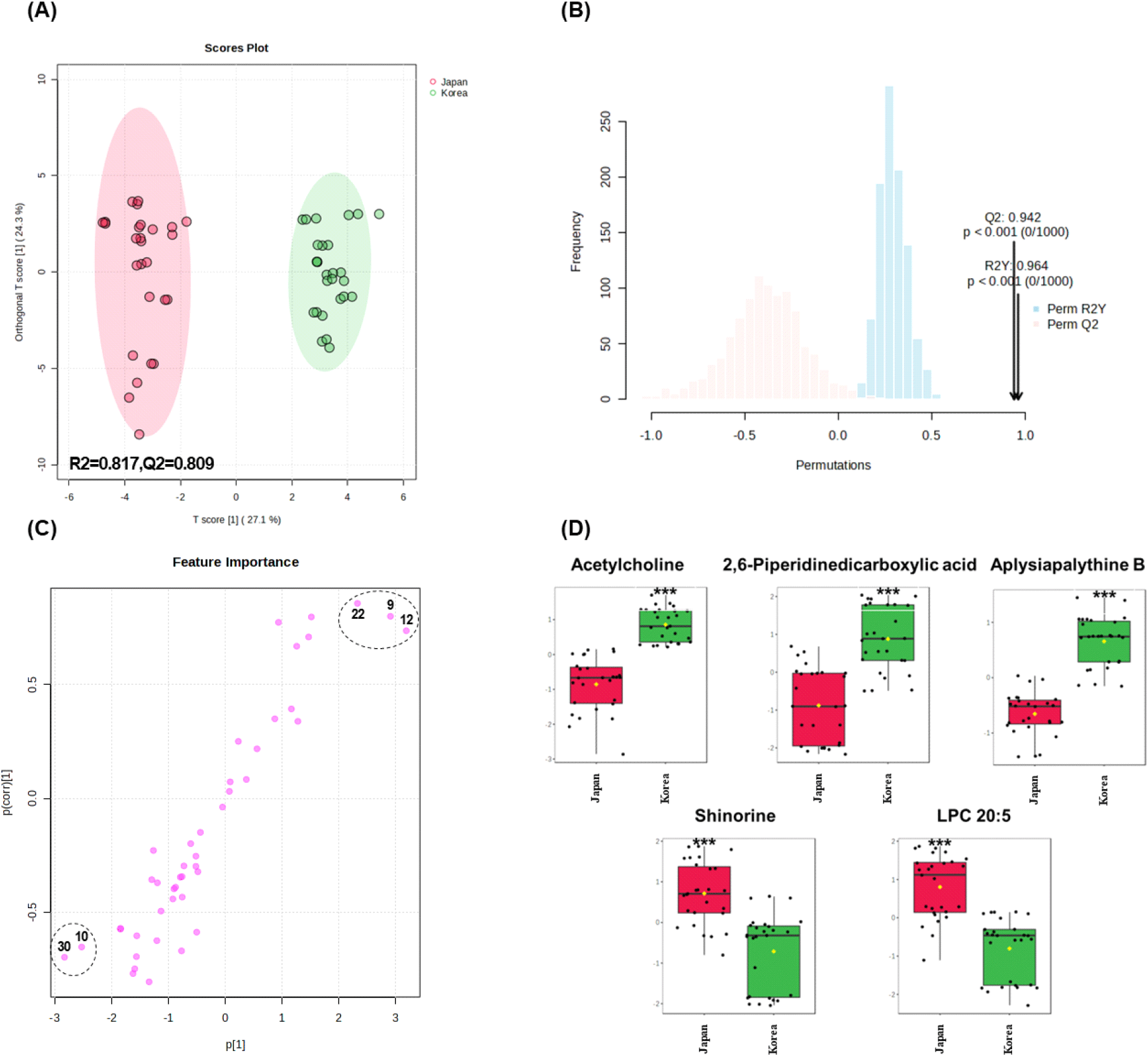
Acetylcholine은 신경계 및 다양한 신체 기관에서 중요한 역할을 하는 신경화학물질로, 다양한 생리적 기능에 기여하는 것으로 알려져 있다(Picciotto 등, 2012). 다양한 식품의 choline 함량은 조사되었으나(Cho 등, 2008; Zeisel, 2003), 해조류의 acetylcholine 함량에 관한 연구는 거의 보고된 바 없다. 2,6-Piperidinedicarboxylic acid는 참김(P. tenera)에서 보고된 바 있으며, 결핵균에 대한 항균 활성을 나타내는 것으로 알려져 있다(Paiva 등, 2001; Singh 등, 2012). LPC 20:5는 다가불포화지방산과 에스테르화되어 고도불포화지방산의 운반체로 작용하며, 항산화, 항염증, 항균 활성(alves 등, 2020; Lopes 등, 2014; Lopes 등, 2019) 등의 생리 활성 기능이 보고된 바 있다. Aplysiapalythine B와 shinorine은 MAAs에 속하며, 자외선 차단 효과, 항산화 활성, 항염증, 항노화, 항암, 지방세포 분화 억제, 상처 치료 효과 등 건강 기능성을 발휘한다고 보고되었다(Choi 등, 2022; Peng 등, 2023; Rosic, 2019).
다변량 통계분석 결과를 통해 국내산 및 일본산 마른김의 원산지에 따른 대사체들의 유의미한 관계를 확인하였다. UPLC-QTOF-MS 기반 대사체 분석은 국내산 및 일본산 마른김의 주요 화합물을 선정하는데 기초자료로 활용될 수 있을 것으로 판단되며, 동일한 품종을 활용한 최적의 양식 연구 및 국내외 다양한 원산지 판별 연구를 통해 추가적인 검증이 이루어진다면, 대사체학을 활용한 마른김의 원산지 판별 및 품질 평가에 적용 가능할 것으로 사료된다.
국내산 및 일본산 마른김의 LC-MS 기반 대사체 프로파일링 결과 shinorine, asterina-330, porphyra-334, mycosporine-glycine-alanine, aplysiapalythine B, usujirne 등 다수의 MAAs가 검출되었다. 다변량 분석 결과, shinorine은 원산지별 마른김 간 차이를 나타내는 주요 성분으로 확인되었으며, 이를 바탕으로 국내산 및 일본산 마른김을 대상으로 LC-MS를 이용하여 shinorine과 porphyra-334 함량을 조사하였다. 그 결과(Table 2), 총 MAAs 함량은 동일한 원산지 내에서도 다소 차이를 보였으나, 국내산 마른김(1,441.79-2,308.88 mg/100 g)이 일본산 마른김(1,625.19-2,362.56 mg/100 g)에 비해 유의적으로 낮았다. 마른김의 MAAs 조성은 porphyra-334가 shinorine에 비해 현저하게 높았다. Porphyra-334의 함량은 일본산 마른김(1,227.65-2,025.81 mg/100 g)과 국내산 마른김(1,265.02-2,192.52 mg/100 g) 간에 차이가 나타나지 않았다. 이전 연구에서는 방사무늬김으로 제조한 일본산 마른김의 porphyra-334 함량이 470-1,610 mg/100 g으로 보고된 바 있다(Ishihara 등, 2008). 이와 달리 본 연구에 사용된 마른김은 전반적으로 porphyra-334 함량이 더 높은 경향을 보였다. 한편, shinorine의 함량은 일본산 마른김(202.34-459.08 mg/100 g)이 국내산 마른김(117.19-295.43 mg/100 g)에 비해 높았다. 특히 1월에 채취된 일본산 마른김(J5)의 shinorine 함량이 459.08 mg/100 g으로 가장 높았으며, 이는 국내산 마른김 중 shinorine 함량이 가장 높은 K8(295.43 mg/100 g)보다 약 1.5배, 가장 낮은 K7(116.36 mg/100 g)보다 약 4배 높은 수준이었다. 원산지별 마른김의 총 MAAs 함량 차이는 shinorine에 기인한 것으로 판단된다. 김의 MAAs 함량은 양식환경의 다양한 요인에 영향을 받는 것으로 알려져 있으며(Briani 등, 2018; Peinado 등, 2004; Rosic, 2019), 특히 자외선(UV)과 질소화합물의 농도가 주요 인자로 작용할 수 있다. 이상의 결과를 종합해 보면, 김의 MAAs 함량은 차이는 원산지별 양식환경의 차이에 기인한 것으로 보이며, 국내산 마른김은 일본산 마른김에 비해 그 함량이 상대적으로 낮은 것으로 판단된다. Shinorine과 porphyra-334는 앞서 설명한 바와 같이 자외선 차단 효과, 항산화 활성, 항염증, 항노화, 항암, 지방세포 분화 억제, 상처 치료 효과 등의 생리활성을 가지는 것으로 보고되었으며, 이를 다량 함유한 마른김은 기능성 식품 소재로서의 활용 가능성이 높을 것으로 기대된다.
4. 요약
본 연구에서는 우리나라와 일본에서 널리 소비되고 있는 품종 중 하나인 방사무늬김(P. yezoensis)을 이용하여 제조된 국내산 및 일본산 마른김의 품질 특성을 파악하고자, 유리아미노산 조성 및 UPLC-QTOF-MS 기반 대사체 분석을 통해 성분학적 특성을 비교하였다. 마른김의 총유리아미노산 함량은 원산지 간 유의한 차이를 보이지 않았으나, taurine, threonine, asparagine, 그리고 phenylalanine 등을 제외한 개별 아미노산 대부분은 통계적으로 유의한 차이를 나타냈다. LC-MS 대사체 분석 결과로부터 아미노산, MAAs, 핵산, 리소인지질을 포함한 총 46종의 대사체들이 김의 주요 화합물로 동정되었다. PCA 및 OPLS-DA 분석 결과로부터 국내산과 일본산 마른김이 확연하게 구별되었으며, 국내산 마른김에서는 acetylcholine, 2,6-piperidinedicarboxylic acid, aplysiapalythine B가, 일본산 마른김에서는 shinorine 및 LPC 20:5 등이 특징적인 대사체임을 확인할 수 있었다. 김의 유용성분 중 하나인 porphyra-334의 함량은 국내산과 일본산 마른김 간에 유의적인 차이가 없었으나, shinorine의 함량은 일본산이 국내산보다 높았다. 이러한 결과들은 김의 원산지를 판별하거나 품질 관리에 있어서 기초 자료로 활용될 수 있을 것으로 기대된다. 본 연구에서 동정된 다양한 대사체들은 김의 생육환경에 따라 크게 변화되므로, 김의 품질 특성을 이해하기 위해서는 양식지역, 채취시기, 해황 등 생육환경 인자들을 고려한 지속적인 대사체 연구가 요구된다.
