1. 서론
대기오염은 전 세계적으로 많은 도시가 직면하고 있는 공중 보건 문제이다(Arias-Pérez 등, 2020). 급속한 산업화에 따른 화석 연료 소비 증가 및 도시화에 따른 인구 증가 등이 주요 요인으로 작용하며, 이는 오염물질 생성 및 배출을 증가시켜 인체 건강에 영향을 미친다(Arias-Pérez 등, 2020). 특히 대기오염으로 인한 건강 문제는 주로 대기 중에 널리 발견되는 미세먼지와 관련이 있다(Wang 등, 2022). 미세먼지(particulate matter, PM)는 입자 크기가 작아 호흡기 내로 침투가 가능하며, 체내에서 활성산소종(reactive oxygen species, ROS), 산화스트레스, 염증, 세포사멸 등을 유발함으로써 호흡기 질환을 유발한다(Kim 등, 2022b). PM은 공기역학적 직경에 따라 PM10(≤10 μm), PM2.5(≤2.5 μm) 및 PM0.1(≤0.1 μm)로 분류되며, 상대적으로 직경이 큰 PM10은 비강의 상피에 존재하는 섬모에 의해 걸러져 코, 비강, 구강, 부비동, 인두, 후두로 구성된 상기도에 영향을 미친다(Arias-Pérez 등, 2020; Kim 등, 2021). 반면, 직경이 작은 PM2.5와 PM0.1은 섬모에 의해 걸러지지 못하고 더 깊이 침투하여 기관, 기관지, 세기관지, 폐 세포로 이루어지는 하기도에 축적되어 높은 인체 유해성을 나타낸다(Kim 등, 2022b). 또한, PM의 입자 크기 외에도 화학적 구성이 PM의 독성 효과에 관여한다(Wang 등, 2022). PM은 중금속, 탄소계 물질, 다환 방향족 탄화수소(polycyclic aromatic hydrocarbons, PAHs)와 같은 화학적 및 생물학적 요소의 혼합물로 구성되며, 이들은 세포를 산화시키는 자유라디칼 및 ROS 생성을 유도한다(Arias-Pérez 등, 2020; Kim 등, 2021). ROS는 세포의 산화 · 환원 신호 및 면역 기능에 유익한 효과를 나타내지만, 그 함량이 높아질 경우 DNA, RNA, 지질, 단백질 등 주변의 생체 분자와 반응하여 세포 기능과 구조를 손상시킬 수 있다(Averill-Bates, 2024). 세포 내에서 과도한 ROS 생성은 산화 · 환원 간의 평형이 중단되어 항산화 시스템의 불균형 상태를 뜻하는 산화스트레스를 유발하여 산화적 손상을 야기한다(Dumanović 등, 2021).
폐는 호흡을 담당하는 기관으로 높은 산소 수치에 노출되며, 외부 주변 공기에 넓은 표면적을 제공하는 독특한 구조로 인해 공기에서 지속적으로 흡입되는 수많은 독성 물질에 취약하다(Azad 등, 2008). 이러한 폐의 구조에 기인하여 호흡 과정을 통해 침투한 PM은 Toll-like receptor 4(TLR-4)와 결합하여 myeloid differentiation primary response 88(MyD88) 의존적 신호 전달 경로를 통해 nuclear factor-κB(NF-κB)를 활성화하여 염증반응을 일으킨다(Wu 등, 2021). 또한, c-Jun N-terminal kinase(JNK)의 인산화를 활성화하여 하류 신호전달을 유도함으로써 inducible nitric oxide synthase(iNOS)와 같은 염증 매개체 및 염증성 사이토카인의 발현을 증가시키고, 이는 산화스트레스를 매개하여 세포사멸을 초래한다(Moon 등, 2022). 이는 폐 기능 저하로 이어져 만성 폐쇄성 폐 질환, 천식, 폐암과 같은 폐 질환의 발병에 기여한다(Arias-Pérez 등, 2020). 이처럼 PM 노출에 따른 건강 문제를 예방하기 위한 노력이 필요하나, 근원을 완전히 차단하기에 어려움이 존재하기에 PM 흡입으로 인한 염증반응 및 산화스트레스를 감소시킬 수 있는 천연 식품 소재를 섭취하여 예방하는 것이 중요하다.
한속단(Phlomis umbrosa Turcz.)은 꿀풀과에 속하는 다년생 초본 식물로 주로 중국 북부에서 자생한다(Zhang과 Wang, 2009). 이전 연구에 따르면, 한속단은 protocatechic acid, chlorogenic acid, rosmarinic acid, rutin과 같은 폴리페놀 화합물뿐만 아니라 iridoid, phenylethanoid 등의 다양한 생리활성 화합물을 함유하고 있다(Nguyen 등, 2018; Zhang과 Wang, 2009). 한속단의 뿌리에서 분리된 화합물은 수소 공여체 역할을 하여 1,1-diphenyl-2-picrylhydrazyl(DPPH)과 같은 라디칼 소거 활성을 통해 항산화 효과를 나타내었으며, 진통, 항염증 및 골 형성 효과 등 다양한 생리활성을 나타내는 것으로 알려져 있다(Chun 등, 2021; Le 등, 2019). 동의보감에 따르면, 한속단은 20세기까지 통증, 류마티스 관절염 및 골절 등 뼈 질환을 치료하는 데 사용된 한약재로 기술되어 있다(Lee 등, 2016). 또한, 한속단의 골 성장 효과를 연구한 Lee 등(2016)에 따르면, 한속단은 마우스의 종방향 뼈 성장 속도, 성장판 높이에 미치는 영향 및 연골 세포 증식에 대한 활성을 보였다(Lee 등, 2016). 이처럼 한속단은 주로 뼈 건강과 관련된 생리활성 연구가 보고되고 있으며, 항염 작용으로 인한 항알레르기 효과도 보고되고 있지만, 호흡기 건강에 관한 연구는 현재까지 미흡한 실정이다(Shin 등, 2008). 따라서, 본 연구는 한속단 뿌리 에탄올 추출물의 in vitro 항산화 활성 및 H2O2와 PM2.5로 산화스트레스가 유도된 호흡기 세포의 보호 효과와 개선 기작을 규명하고, 주요 생리활성 물질을 동정 및 정량함으로써 호흡기 질환을 예방하는 건강기능식품 소재로서의 산업적 활용 가능성을 평가하고자 연구를 수행하였다.
2. 재료 및 방법
본 실험에 사용된 시약인 Folin & Ciocalteu’s phenol reagent, sodium carbonate(Na2CO3), gallic acid, diethylene glycol, sodium hydroxide(NaOH), rutin, sodium phosphate, potassium persulfate, 2,2’-azino-bis(3-ethyl benzothiazoline-6-sulfonic acid) (ABTS), DPPH, 2,4,6-tri(2-pyridyl)-1,3,5-triazine(TPTZ), iron (III) chloride(FeCl3), trichloroacetic acid(TCA), 2-thiobarbituric acid(TBA), vitamin C, catechin, 2’,7’-dichlorodihydrofluorescein diacetate(DCF-DA), 3-(4,5-dimethyl-thiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT), Roswell Park Memorial Institute(RPMI) 1640, Minimum Essential Medium(MEM), fetal bovine serum(FBS), penicillin/streptomycin 및 H2O2는 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입하였다. Bovine serum albumin(BSA)은 GeneAll Biotechnology Co.(Seoul, Korea)에서 구입하여 사용하였으며, acarbose는 Thermo-Fisher Scientific (Waltham, MA, USA)로부터, aminoguanidin hydrochloride는 FUJIFILM Wako Pure Chemicals Co.(Osaka, Japan)로부터 구입하였다. PM2.5(평균직경 1.06 μm)는 Powder Technology Inc.(Arizona Test Dust, Arden Hills, MN, USA)로부터 구입하였으며, dimethyl sulfoxide(DMSO)는 Daejung Chemicals & Metals Co.(Siheung, Korea)로부터 구입하였다. Western blot assay에 사용된 1차 항체인 anti-mouse TLR-4(sc-52962), MyD88(sc-74532), p-JNK(sc-6254), p-NF-κB(sc-136548), β-actin(sc-69879)은 Santa Cruz Biotechnology Inc.(Dallas, TX, USA)에서, anti-rabbit iNOS(18985-1-AP)는 Proteintech Group, Inc.(Rosemont, IL, USA)에서 구입하였다. 또한, 2차 항체인 horse radish peroxidase(HRP)가 결합된 anti-mouse IgG(AP124P)는 Merck (Darmstadt, Land Hessen, Germany)에서 구입하였고, anti-rabbit IgG(7074S)는 Cell Signaling Technology(Danvers, MA, USA)에서 구입하여 실험에 사용하였다. 그 외 사용된 용매 및 시약은 모두 1급 이상의 등급을 사용하였다.
본 실험에 사용된 한속단 뿌리는 충청북도 괴산군의 농가에서 재배되어 판매되는 건조물을 2023년 1월에 구매하였다. 이를 분쇄하여 실험에 사용하였으며, 분쇄된 한속단 뿌리 20 g을 20% 에탄올 1 L와 혼합하고, 이를 40°C에서 환류 냉각 하에 2시간 동안 추출하였다. 추출액은 여과하여 회전진공농축기(N-N series, Eyela Co., Tokyo, Japan)를 사용하여 농축하였으며, 동결건조기(FDU-8612, Operon, Gimpo, Korea)를 사용하여 동결건조하였다. 이후 건조물은 −20°C에 냉동 보관하며 실험에 사용하였다.
총페놀성 화합물 함량 측정을 위하여 시료 1 mL와 증류수 9 mL, Folin & Ciocalteu’s phenol reagent 1 mL를 혼합하여 실온에서 5분 동안 반응시켰다. 이후 7% Na2CO3 10 mL와 증류수 4 mL를 첨가하여 실온에서 2시간 동안 반응시킨 후, 분광광도계(UV-1800, Shimadzu, Kyoto, Japan)를 사용하여 760 nm에서 흡광도를 측정하였다. 측정된 흡광도는 gallic acid를 사용하여 시료 용액과 동일한 방법을 통해 작성한 표준곡선으로 총페놀성 화합물 함량을 계산하였으며, 총페놀성 화합물 함량을 mg gallic acid equivalents(GAE)/g 단위로 나타내었다.
총플라보노이드 함량 측정을 위하여 시료 1 mL와 diethylene glycol 10 mL, 1 N NaOH 1 mL를 혼합하여 30°C에서 1시간 동안 반응시킨 후, 분광광도계(UV-1800, Shimadzu)를 사용하여 420 nm에서 흡광도를 측정하였다. 측정된 흡광도는 rutin을 사용하여 시료와 동일한 방법을 통해 작성한 표준곡선으로 총플라보노이드 함량을 계산하였으며, 총플라보노이드 함량을 mg rutin equivalents(RE)/g 단위로 나타내었다.
ABTS 라디칼 소거 활성 측정을 위하여 150 mM NaCl이 포함된 100 mM sodium phosphate buffer(pH 7.4), 7 mM ABTS 및 2.45 mM potassium persulfate를 혼합하여 68°C 항온수조에서 30분 동안 가열한 뒤, 실온에서 10분 동안 냉각하였다. 이후, 0.45 μm syringe filter를 사용해 여과하여 4°C에서 24시간 동안 냉장 보관하였으며, 734 nm에서 흡광도가 0.70±0.02가 되도록 조정하여 ABTS 라디칼 용액을 제조하였다. 시료 20 μL와 ABTS 라디칼 용액 980 μL를 혼합하여 37°C에서 10분간 반응시킨 후, 분광광도계(UV-1800, Shimadzu)를 사용하여 734 nm에서 흡광도를 측정하였다. 측정 후, 라디칼 소거 활성은 아래의 식을 이용하여 계산하였다.
DPPH 라디칼 소거 활성 측정을 위하여 0.1 mM DPPH를 80% 메탄올에 용해하여 514 nm에서 흡광도가 1.00±0.02가 되도록 조정하여 DPPH 라디칼 용액을 제조하였다. 시료 50 μL와 DPPH 라디칼 용액 1.45 mL를 혼합하여 암실에서 30분간 반응시킨 후, 분광광도계(UV-1800, Shimadzu)를 사용하여 517 nm에서 흡광도를 측정하였다. 측정 후, 라디칼 소거 활성은 아래의 식을 이용하여 계산하였다.
A: 흡광도 값
FRAP 측정을 위하여 300 mM sodium acetate buffer(pH 3.6)와 40 mM HCl이 포함된 10 mM TPTZ 용액, 20 mM FeCl3를 1:1:10의 비율로 배합하고 37°C에서 15분간 반응시켜 FRAP 혼합 용액을 제조하였다. 시료 50 μL와 FRAP 혼합 용액 1.5 mL를 혼합하여 실온에서 30분간 반응시킨 후, 분광광도계(UV-1800, Shimadzu)를 사용하여 593 nm에서 흡광도를 측정하였다.
뇌 조직을 이용하여 지질과산화물 생성 억제 활성 측정을 위하여 6주령의 암컷 Bagg’s Albino(BALB/c) 마우스를 실험동물 공급업체(Koatech, Pyeongtaek, Korea)로부터 구입하였다. 마우스를 항온(22±2°C), 항습(50-55%) 조건 하에서 12시간 주기로 낮과 밤을 교대시키며, 충분한 식수와 사료를 공급하는 환경에서 마우스를 1주일간 적응시켰다. 사육된 마우스의 뇌 조직을 적출하여 뇌 조직 무게의 10배에 달하는 20 mM Tris HCl buffer(pH 7.4)를 첨가하여 균질화하고, 균질액을 12,000 ×g, 4°C, 15분 조건으로 원심분리하여 얻어진 뇌 조직 상층액으로 이후 실험을 진행하였다. 시료 0.2 mL와 뇌 조직 상층액 0.1 mL, 10 μM FeSO4 0.1 mL, 0.1 mM ascorbic acid 0.1 mL를 혼합하여 37°C에서 1시간 동안 반응시켰다. 이후 30% TCA 0.1 mL와 1% TBA 0.3 mL를 첨가하여 80°C 항온수조에서 20분간 가열하였고, 원심분리한 후 상층액을 취하여 이를 분광광도계(UV-1800, Shimadzu)를 사용하여 532 nm에서 흡광도를 측정하였다. 측정 후, 지질과산화물 생성 억제 활성은 아래의 식을 이용하여 계산하였다. 본 연구는 경상국립대학교 동물윤리심의위원회 승인을 받아 수행하였다(경상국립대학교 동물실험 승인 번호: GNU-240405-M0076, 승인일: 2024.04.05.).
A: 흡광도 값
α-Glucosidase 억제 효과 측정을 위하여 시료 50 μL와 0.1 M sodium phosphate buffer(pH 6.9), 0.5 units/mL α-glucosidase 효소액 50 μL를 혼합하여 37°C에서 10분 동안 배양하였다. 이후 기질인 3 mM 4-nitrophenyl-α-D-glucopyranoside를 첨가하여 37°C에서 5분 동안 반응시킨 후, 마이크로플레이트 리더기(Epoch 2, BioTek Instruments, Inc., Winooski, VT, USA)를 사용하여 405 nm에서 흡광도를 측정하였다. 측정 후, α-glucosidase 억제 효과는 아래의 식을 이용하여 계산하였다.
ASE: 시료+효소 흡광도 값
ASO: 시료 흡광도 값
AE: 공시료+효소 흡광도 값
AO: 공시료 흡광도 값
AGEs 생성 억제 효과 측정을 위하여 시료 0.1 mL와 0.2 M phosphate buffer(pH 7.4), 0.02% sodium azide 0.9 mL, 50 mg/mL BSA 0.3 mL, 1.25 M fructose 0.3 mL를 혼합하여 37°C에서 3일 동안 반응시켰다. 이를 96-well black plate에 200 μL씩 분주하여 형광광도계(Infinite F200, TECAN, Mannedorf, Switzerland)를 사용하여 360 nm(excitation wave) 및 430 nm (emission wave)에서 형광강도를 측정하였다. 측정 후, 최종당화산물 생성 억제 효과는 아래의 식을 이용하여 계산하였다.
F.I.SE: 시료+효소 형광강도 값
F.I.SO: 시료 형광강도 값
F.I.E: 공시료+효소 형광강도 값
F.I.O: 공시료 형광강도 값
본 실험에 사용된 호흡기 세포인 비강 세포(RPMI 2650 cells)는 American Type Culture Collection(Manassas, VA, USA)으로부터 구매하였으며, 폐 세포(A549 cells)는 한국세포주은행(Korean Cell Line Bank, Seoul, Korea)으로부터 구입하여 사용하였다. RPMI 2650 세포는 인간의 비강 조직에서 유래된 세포주로, 10% FBS, 1% 50 units/mL penicillin 및 100 μg/mL streptomycin이 함유된 MEM 배지를 사용하여 37°C, 5% CO2 조건 하에서 배양되었다. A549 세포는 인간의 폐 조직에서 유래된 세포주로, 10% FBS, 1% 50 units/mL penicillin 및 100 μg/mL streptomycin이 함유된 RPMI 1640 배지를 사용하여 37°C, 5% CO2 조건 하에서 배양되었다.
호흡기 세포(RPMI 2650 및 A549 cells)에서 산화스트레스 유발원(H2O2 및 PM2.5)으로 유도된 산화스트레스 수준 측정을 위하여 DCF-DA 분석법을 이용하여 실험을 진행하였다. RPMI 2650 및 A549 세포를 1×104 cells/well 밀도로 96-well black plate에 분주한 뒤, 24시간 동안 배양하여 세포를 부착시켰다. H2O2 처리에 대한 산화스트레스 수준 측정을 위하여 시료 및 양성대조군을 처리하여 24시간 동안 배양한 뒤, 200 μM H2O2를 처리하여 3시간 동안 배양하였다. 또한, PM2.5 처리에 대한 산화스트레스 수준 측정을 위하여 배양액을 교체하여 1시간 동안 배양한 뒤, 시료 및 양성대조군을 처리하여 30분 동안 배양하고, 100 μg/mL PM2.5를 처리하여 24시간 동안 배양하였다. 이후 DCF-DA 시약을 처리하여 50분 동안 반응시킨 후, 형광광도계(Infinite F200, TECAN)를 사용하여 485 nm(excitation wave) 및 535 nm(emission wave)에서 형광 광도를 측정하였다.
호흡기 세포(RPMI 2650 및 A549 cells)에서 산화스트레스 유발원(H2O2 및 PM2.5)으로 유도된 세포 생존율 측정을 위하여 MTT 분석법을 이용하여 실험을 진행하였다. RPMI 2650 및 A549 세포를 1×104 cells/well 밀도로 96-well plate에 분주한 뒤, 24시간 동안 배양하여 세포를 부착시켰다. H2O2 처리에 대한 세포 생존율을 확인하기 위하여 시료 및 양성대조군을 처리하여 24시간 동안 배양한 뒤, 200 μM H2O2를 처리하여 3시간 동안 배양하였다. 또한, PM2.5 처리에 대한 세포 생존율을 확인하기 위하여 배양액을 교체하여 1시간 동안 배양한 뒤, 시료 및 양성대조군을 처리하여 30분 동안 배양하고, 100 μg/mL PM2.5를 처리하여 24시간 동안 배양하였다. 이후 MTT 시약을 처리하여 2시간 동안 반응시킨 후 배양액을 제거한 다음, DMSO를 첨가하였으며, 마이크로플레이트 리더기(Epoch 2, BioTek Instruments)를 사용하여 570 nm(determination wave)와 655 nm(reference wave)에서 흡광도를 측정하였다. 측정 후, 세포 생존율은 아래의 식을 이용하여 계산하였다.
A: 흡광도 값
A549 세포에서 PM2.5에 의해 유발된 NF-κB 신호전달 경로의 단백질 발현량을 확인하기 위하여 A549 세포를 2×105 cells/well 밀도로 6-well pate에 분주한 뒤, 배양하여 세포를 부착시켰다. 호흡기 세포에서 세포 생존율 측정 및 산화스트레스 수준 측정과 동일한 조건으로 시료와 PM2.5를 처리하여 배양한 후, 단백질을 추출하기 위해 1% protease inhibitor(Quartett, Berlin, Germany)가 포함된 ProtinExTM Animal cell/tissue(GeneAll Biotechnology)를 각 well 당 100 μL씩 분주하여 얼음 위에서 10분간 반응시켜 세포를 수집하였다. 이후 13,000 ×g, 4°C, 10분 조건으로 원심분리하여 상층액을 얻었으며, 이를 Bradford protein assay을 활용하여 단백질을 정량한 다음, 4X sample buffer(Bio-Rad, Hercules, CA, USA)와 혼합하여 샘플을 제조하였다. 제조된 샘플은 −20°C에 냉동 보관하며 실험에 사용하였다. 세포의 단백질을 sodium dodecyl sulfate polyacrylamide gel electrophoresis(SDS-PAGE)를 통해 크기별로 분리하고, 분리된 단백질을 polyvinylidene difluoride membrane(Milipore, Billerica, MA, USA)으로 이동시켜 5% skim milk로 1시간 동안 blocking한 뒤, Tris-buffered saline with 0.1% Tween 20 (TBST)을 사용하여 10분씩 3회 세척하였다. 이후 0.5% BSA와 0.1% sodium azide가 포함된 TBST를 이용하여 1:1,000으로 희석한 1차 항체와 membrane을 4°C에서 12시간 반응시켰으며, 반응이 끝나면 1:5,000으로 희석된 2차 항체와 상온에서 1시간 반응시켰다. 1차 및 2차 항체와 반응시킨 membrane을 ProNATM enhanced chemiluminescence(ECL) Ottimo(TransLab, Daejeon, Korea)로 발광시키고, ChemiDoc iBright Imager (CL1000 instrument, Thermo-Fisher Scientific)을 사용하여 밀도를 측정해 수치화하였으며, 수치화된 밀도 값은 β-actin을 기준으로 단백질 발현량을 계산하였다.
시료 내 함유된 생리활성물질을 동정하기 위하여 고성능 액체크로마토그래피[high performance liquid chromatograph, HPLC(Ultimate 3000 series system, Thermo-Fisher Scientific)]를 사용하여 분석하였다. 시료는 50% 메탄올로 용해한 뒤, 0.45 μm filter로 여과하여 분석에 사용하였으며, YMC-Triart C18(250 × 4.6 mm, 5 μm, YMC Korea, Seongnam, Korea)을 사용하여 분석을 진행하였다. 이동상은 0.1% formic acid가 함유된 증류수(A)와 0.1% formic acid가 함유된 아세토니트릴(B)로 구성되었으며, 이동상의 조성비는 0-30% B(0-15 min), 30-60% B(15-30 min), 60-100% B(30-40 min), 100-0%(40-42 min)로 설정하여 총 42분간 분석하였다. 시료의 주입량은 20 μL, 유속은 1 mL/min으로 설정하였으며, 검출기는 diode array detector(DAD)를 사용하여 254 nm에서 분석하였다. 이후 동일한 방법으로 분석된 표준물질의 머무름 시간(retention time, RT)과 UV spectrum을 시료 내 peak와 비교하여 유사도를 판단하고, 검출된 생리활성물질의 정량분석을 진행하였다. Chlorogenic acid와 ferulic acid 표준물질로 정량분석을 진행하였으며, 두 표준물질을 각각 2 μg/mL, 5 μg/mL, 10 μg/mL, 20 μg/mL, 50 μg/mL의 5개의 농도로 단계 희석하여 시료와 동일한 방법으로 분석한 뒤, 검량곡선을 작성하였으며, 검량곡선에 시료의 peak 면적을 대입하여 시료에 존재하는 표준물질의 함량을 계산하였다.
3. 결과 및 고찰
한속단 뿌리 20% 에탄올 추출물의 총페놀성 화합물 및 총플라보노이드 함량을 평가하였으며, 총페놀성 화합물 및 총플라보노이드의 함량은 각각 42.92±0.75 mg GAE/g 및 45.35± 0.30 mg RE/g으로 측정되었다(Table 1).
| TPC1) (mg GAE/g) | TFC2) (mg RE/g) |
|---|---|
| 42.92±0.753) | 45.35±0.30 |
페놀산 및 플라보노이드 등을 포함하는 폴리페놀 화합물은 식물에서 발견되는 2차 대사산물의 일종이다(Han 등, 2020). 폴리페놀은 방향족 고리에 하나 이상의 hydroxyl 그룹을 포함하는 구조로 이루어져 있으며, hydroxyl 그룹이 ROS를 소거함으로써 항산화, 항염 등의 기능을 나타낸다(Kim 등, 2021; Moon 등, 2022). 또한, 자유라디칼에 전자를 공여하여 항산화 작용을 할 뿐만 아니라 노화 방지와 같은 다양한 생리활성 기능을 가진다(Lee 등, 2019). 꿀풀과에 속하는 한속단은 페놀성 화합물 및 플라보노이드 화합물을 함유하고 있으며, 이에 관하여 한속단은 꿀풀과 식물 종자 추출물 10종 중 높은 총페놀성 화합물(6.2 mg GAEs/g seed)과 총플라보노이드 화합물(0.6 mg quercetin equivalents(QE)/g seed)을 가지고 있는 것으로 보고되어 있다(Kim 등, 2022a; Nguyen 등, 2018). 또한, 한속단은 ferulic acid, syringic acid, vanillic acid 등의 페놀산 화합물 외에도 다양한 생리활성 물질을 함유하고 있으며, 이들은 라디칼 소거 활성과 같은 항산화 능력과 연관이 있는 것으로 보고되어 있다(Nguyen 등, 2018). 이러한 연구 결과를 고려할 때, 본 연구에서 나타난 한속단 뿌리 20% 에탄올 추출물은 높은 총페놀성 화합물 및 총플라보노이드 화합물 함량으로부터 우수한 항산화 활성을 보일 것으로 기대된다.
한속단 뿌리 20% 에탄올 추출물의 ABTS 및 DPPH 라디칼 소거 활성을 통해 in vitro 항산화 활성을 평가하였으며, 한속단 뿌리 20% 에탄올 추출물의 ABTS 및 DPPH 라디칼 소거 활성은 농도 의존적으로 증가하는 경향을 나타내었다. 한속단 뿌리 20% 에탄올 추출물의 ABTS 및 DPPH 라디칼 소거 활성의 IC50은 각각 1,472.21 μg/mL 및 2,283.99 μg/mL로 측정되었으며, 양성대조군인 vitamin C의 ABTS 및 DPPH 라디칼 소거 활성의 IC50은 각각 114.79 μg/mL 및 122.48 μg/mL로 측정되었다(Fig. 1A와 1B).
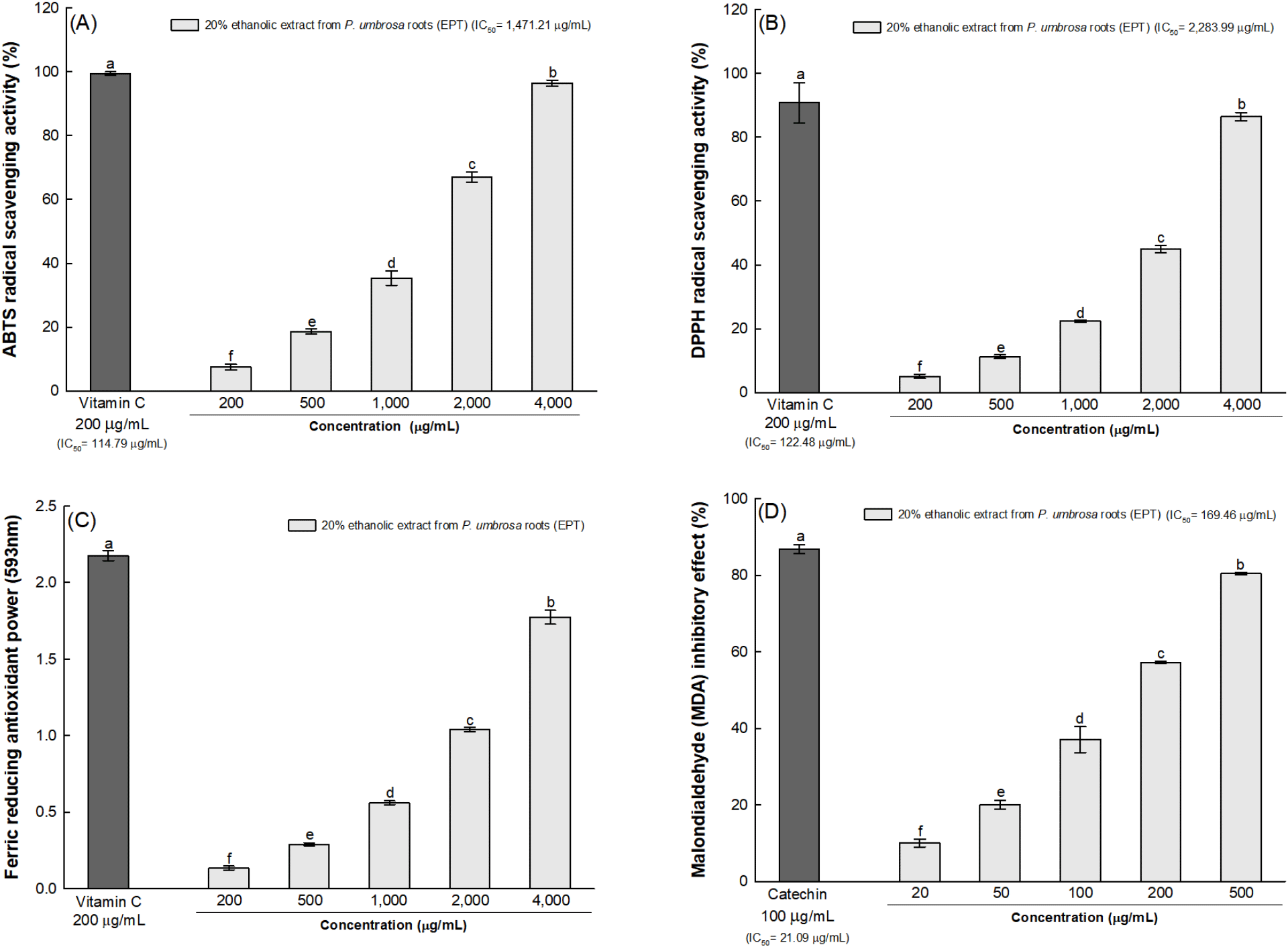
자유라디칼은 그 자체로 매우 불안정하여 높은 화학적 반응성을 가지고 있으며, 생체분자와 반응함으로써 체내 세포의 구조 및 구성성분을 변형하여 손상을 일으킨다(Han 등, 2020). Nguyen 등(2018)에 따르면, 한속단의 뿌리에서 분리된 항산화 화합물의 hydroxyl 그룹이 전자 및 수소 원자를 공여함으로써 ABTS 및 DPPH 라디칼과 같은 자유라디칼을 소거하는 것으로 보고하였다. 한속단과 같은 꿀풀과 식물을 비교한 Kim 등(2022a)은 꿀풀과 식물 종자 추출물 10종을 대상으로 항산화 활성을 조사하여 항산화 활성이 낮은 group 1에서 활성이 높은 group 3까지 3개의 group으로 분류하였으며, 순차적으로 group 1, 2, 3은 각각 92.3±5.0 μg/mL, 48.3±3.2 μg/mL, 26.4±0.4 μg/mL의 ABTS 라디칼 소거 활성의 EC50 값을, 또한 각각 141.2± 14.5 μg/mL, 108.7±7.5 μg/mL, 30.0±0.9 μg/mL의 DPPH 라디칼 소거 활성의 EC50 값을 나타내었다. 한속단의 라디칼 소거 활성은 vitamin C보다 낮은 것으로 확인되었으나, Kim 등(2022a)에 따르면, 한속단 종자는 group 2에 속하였으며, 이는 한속단이 식물 소재의 천연 항산화제로써 효과적으로 이용될 수 있음을 제시하였다. 또한, 한속단의 뿌리에서 분리된 iridoid와 phenylethanoid 화합물은 수소 공여체로 작용하여 DPPH 라디칼을 소거함으로써 상당한 항산화 효과를 나타낸 것으로 보고되어 있다(Le 등, 2019). 따라서, 한속단 뿌리 20% 에탄올 추출물의 항산화 활성은 폴리페놀 화합물을 포함한 생리활성 물질에서 기인한 것으로 판단된다.
한속단 뿌리 20% 에탄올 추출물의 FRAP 및 MDA 생성 억제 활성을 통해 잠재적인 항산화 활성을 평가하였다. 한속단 뿌리 20% 에탄올 추출물의 FRAP과 MDA 생성 억제 활성은 농도 의존적으로 증가하는 경향을 나타내었다. 한속단 뿌리 20% 에탄올 추출물은 4,000 μg/mL 농도에서 1.77의 FRAP을 가지는 것으로 확인되었으며, 양성대조군인 vitamin C는 200 μg/mL 농도에서 2.17의 FRAP를 가지는 것으로 확인되었다(Fig. 1C). 자유라디칼은 반감기가 짧아 수치를 직접 정량하기 어려운 반면, 안정한 상태에 도달하기 위해 지질, 단백질 및 핵산과 같은 거대 분자의 변형과 지질 과산화를 유도하여 최종산물인 MDA를 측정하는 것으로 간접적으로 평가할 수 있다(Atmaca 등, 2008). 이전 연구에 따르면, 한속단과 같은 뿌리 작물인 청미래덩굴의 MDA 생성 억제 활성은 라디칼 소거 활성과 비교하여 낮은 농도에서도 생리활성을 나타내었다(Jeong 등, 2013; Yalçin 등, 2010). 따라서, 한속단 뿌리 20% 에탄올 추출물의 MDA 생성 억제 활성 또한 낮은 농도에서 생리활성을 나타낼 것으로 판단하였다. 그리하여, MDA 생성 억제 활성 실험에서는 한속단 뿌리 20% 에탄올 추출물의 농도를 ABTS 및 DPPH 라디칼 소거 활성 평가 실험에 비해 낮은 농도로 설정하여 실험하였다. 그 결과, 한속단 뿌리 20% 에탄올 추출물의 MDA 생성 억제 활성의 IC50은 169.46 μg/mL로 측정되었으며, 500 μg/mL 농도에서 80.39%의 MDA 생성 억제 활성을 나타내었다(Fig. 1D). 양성대조군인 catechin은 21.09 μg/mL의 IC50 값을 보였고, 100 μg/mL 농도에서는 86.73%의 억제 활성으로, 500 μg/mL 농도의 한속단 뿌리 20% 에탄올 추출물의 MDA 생성 억제 활성과 유사하였다.
PM에 함유된 Fe2+ 및 Cu2+와 같은 반응성 금속은 조직 내에서 Fenton reaction을 일으켜 ROS 과잉 생성 및 산화스트레스를 유도하고, 이는 뇌의 불포화 지방산, 핵산, 단백질, 지질 등과 같은 세포 및 조직 성분과 반응하여 산화스트레스 지표의 일종인 MDA를 생성한다(Averill-Bates, 2024; Han 등, 2020; Leni 등, 2020). 또한, PM 내 함유되어 있는 PAH와 같은 독성물질은 PAH-DNA adduct를 형성하여 세포의 돌연변이나 전이금속 등으로 인한 산화적 손상 메커니즘과 연관성이 제기되고 있다(Song 등, 2009). 이에 관하여, Song 등(2009)은 산화스트레스의 생체 지표인 MDA를 측정하여 이들 관계에 대한 간접적인 연관성을 보고하였다. 반면, 폴리페놀 화합물과 같은 산화 방지제는 ROS 및 유리기에 전자를 공여하는 능력인 환원력을 지니고 있어 체내의 산화 반응을 억제하여 인체를 보호할 수 있다(Lee 등, 2019). Zhang과 Wang(2009)에 따르면, 한속단의 생리활성 물질로 검출된 protocatechic acid, chlorogenic acid, rosmarinic acid, rutin은 불안정한 자유라디칼에 전자를 기증하여 안정한 형태로 전환시킴으로써 항산화 활성을 나타낸다고 보고하였다. 그중에서도 chlorogenic acid는 당뇨병 마우스 모델에서 MDA 생성 감소 및 환원된 glutathione(GSH)과 같은 비효소적 항산화제 수치 증가를 통해 산화스트레스를 경감하였으며, 이로 인해 불균형한 세포 내 산화 · 환원 상태와 관련된 부작용이 완화되어 항산화 활성을 나타내었다(Liang과 Kitts, 2016). 따라서, 한속단 뿌리 20% 에탄올 추출물은 전자 공여능을 기반으로 환원력이 우수하며, Fenton reaction에 의한 다량의 ROS로부터 생성된 MDA 축적을 저해함으로써 산화스트레스를 완화해 항산화 체계의 불균형을 조절할 수 있을 것으로 판단된다.
장기간 지속되는 고혈당은 AGEs의 형성을 유도하며, AGEs와 최종당화산물 수용체(receptor for advanced glycation endproducts, RAGE)의 상호작용은 nicotinamide adenine dinucleotide phosphate hydrogen(NADPH) 산화효소 활성화나 미토콘드리아 기능 장애를 통해 산화스트레스를 증폭시킨다(Toma 등, 2020). 산화스트레스는 정상적인 폐혈관 기능에 기여하는 일산화질소(nitric oxide, NO)를 불활성화하고 내피세포를 손상시키는 반응성 질소 종인 과산화 질산염의 형성을 촉진하여 NO 생체 이용률을 감소시킨다(Mzimela 등, 2024). 이는 내피 기능 장애, 혈관 수축 및 혈관 평활근 성장 증가를 유발하여 폐혈관 리모델링 및 폐 혈관계 고혈압과 같은 폐혈관 질환의 병인에 기여한다(Mzimela 등, 2024). 따라서, 한속단 뿌리 20% 에탄올 추출물의 α-glucosidase 활성 및 AGEs 생성 억제 효과를 통해 높은 혈당 수준에 의한 산화적 폐 손상 예방에 도움이 되는 천연물 소재로서의 활용 가치를 평가하였다. 한속단 뿌리 20% 에탄올 추출물의 α-glucosidase 활성 및 AGEs 생성 억제 효과는 농도 의존적으로 증가하는 경향을 보였으며, 한속단 뿌리 20% 에탄올 추출물의 α-glucosidase 활성 억제 효과는 2,000 μg/mL 농도에서 43.72% 수준으로 억제하는 것으로 확인되었다(Fig. 2A). 또한, 한속단 뿌리 20% 에탄올 추출물의 AGEs 생성 억제 효과는 500 μg/mL 농도에서 67.66% 수준으로 억제하였으며, 한속단 뿌리 20% 에탄올 추출물과 양성대조군으로 사용된 aminoguanidine의 IC50은 각각 175.26 μg/mL 및 35.19 μg/mL로 나타났다(Fig. 2B).
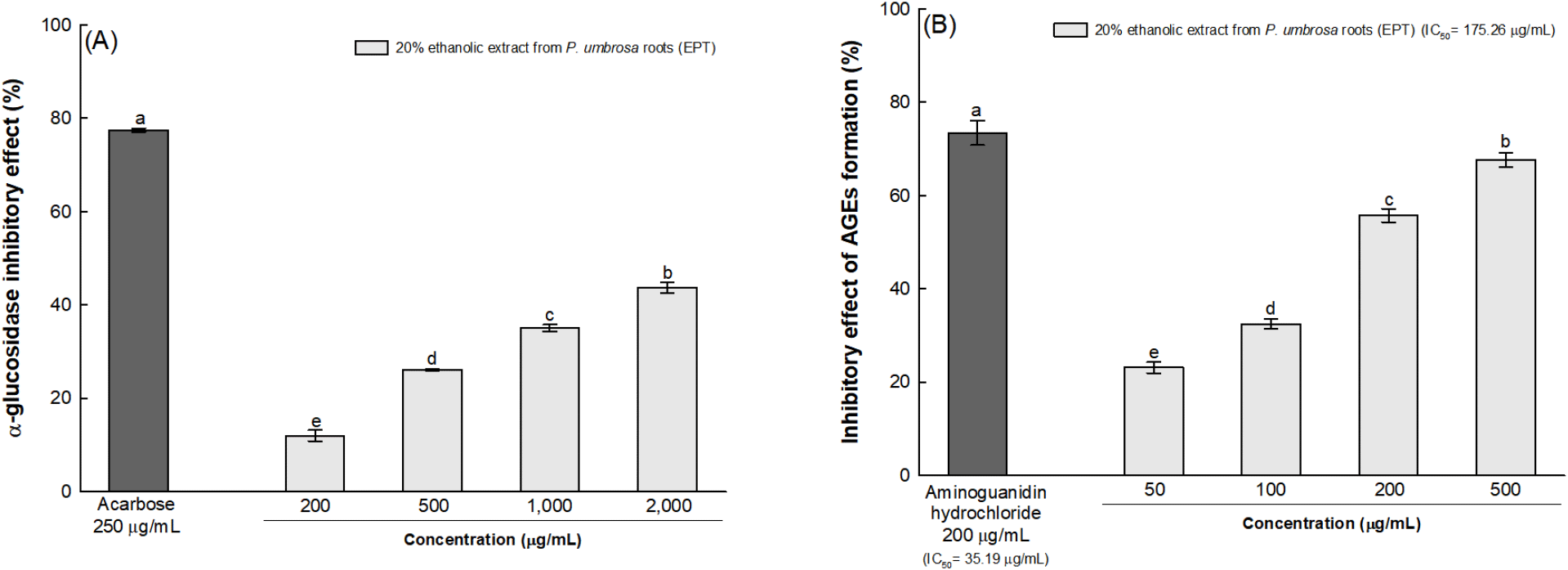
α-Glucosidase는 α-1,4 glycoside 및 α-1,6 glycoside 결합의 가수분해를 통해 탄수화물을 포도당과 같은 단당류로 분해하며, 최종적으로 당의 흡수가 이루어져 당뇨 환자의 식후 포도당 수치를 증가시킨다(Han 등, 2020). 혈중 포도당의 수치가 증가하면, 폴리올 경로(polyol pathway), NF-κB 경로 활성화를 포함한 다양한 생화학적 경로가 상향 조절되고, 산화스트레스가 유발되어 단백질의 비효소적 당화(glycation)를 가속화할 수 있으며, 이들은 상호 연관되어 당뇨성 폐 손상의 원인이 된다(Zheng 등, 2017). 이와 관련하여, Oczypok 등(2017)은 RAGE와 폐 질환 간의 연관성을 RAGE 신호 전달 경로에 초점을 맞추어 보고하였다. RAGE가 폐에서 고도로 발현되며, 이는 AGEs와 상호 작용하여 ROS를 형성하고, 염증반응과 관련된 세포 신호 전달 경로를 활성화함으로써 폐 염증을 증가시켜 만성 폐쇄성 폐 질환을 발병시킬 수 있다(Oczypok 등, 2017). 염증반응과 관련하여 한속단은 항염증 및 진통 효과를 나타내는 shanzhiside methyl ester를 포함하고 있으며, shanzhiside methyl ester는 당뇨병 마우스 모델에서 항염증 메커니즘을 통해 당뇨 합병증으로 유발된 뇌 허혈 및 재관류 손상을 완화시켰다(Chun 등, 2021; Zhang 등, 2014). 또한, 한속단의 생리활성 물질인 chlorogenic acid는 당뇨병 마우스 모델에서 폐 섬유화 관련 인자의 발현을 억제하고 항섬유화 관련 인자를 증가시킨 것으로 보고되고 있다(Kencana 등, 2024). Chlorogenic acid는 AGEs 생성 메커니즘에도 관여하여 AGEs의 전구체인 methylglyoxal(MGO)을 포획하는 능력이 우수한 것으로 알려져 있다(Fernandez-Gomez 등, 2015). 한속단에 함유된 iridoid 또한, MGO와 결합하여 carbonyl기를 소거함으로써 AGEs 생성을 제한하였으며, NF-κB와 DNA의 결합 억제, aldose 환원효소 억제 및 항산화 경로 강화 등을 통하여 천연 당화 반응 억제제로서 잠재력을 나타내었다(West 등, 2016). 이로 인해 한속단 뿌리 20% 에탄올 추출물의 AGEs 생성 억제 효과는 α-glucosidase 활성 억제 효과와 비교하여 상대적으로 낮은 처리 농도에서 생리활성이 나타난 것으로 판단되었다. 이전 연구에 따르면, 한속단의 생리활성 화합물은 장기간 지속된 고혈당에 의한 AGEs 생성을 제한하는 항당화 활성을 보였으며, 고혈당 마우스 모델에서 폐 손상에 대한 보호 효과를 나타내었다. 따라서, 본 연구에서 나타난 in vitro 항당뇨 활성을 통해 한속단 뿌리 20% 에탄올 추출물은 고혈당으로 유도되는 산화스트레스로 인한 폐 손상을 예방할 수 있는 천연 소재로서의 이용 가치가 있음을 확인하였다.
산화스트레스 유발원(H2O2 및 PM2.5)으로 유도된 호흡기 세포 내 ROS 함량 측정을 통해 한속단 뿌리 20% 에탄올 추출물의 산화스트레스 억제 효과를 평가하였다. 비강 세포(RPMI 2650 cells)에서 H2O2 및 PM2.5만 처리한 군의 세포 내 ROS 함량은 정상 대조군(100%) 대비 각각 160.49% 및 145.33%로 증가되었다(Fig. 3A와 3B). 반면, 한속단 뿌리 20% 에탄올 추출물 100 μg/mL를 처리한 군의 세포 내 ROS 함량은 각각 48.02% 및 37.72%로 감소되었으며, 양성대조군인 vitamin C (52.20%; 51.18%)와 비교하여 비강 세포 내 산화스트레스를 우수하게 억제시킨 것을 확인하였다. 또한, 폐 세포(A549 cells)에서 H2O2 및 PM2.5만 처리한 군의 세포 내 ROS 함량은 정상 대조군(100%) 대비 각각 121.06% 및 134.61%로 증가되었다(Fig. 3C와 3D). 반면, 한속단 뿌리 20% 에탄올 추출물 100 μg/mL를 처리한 군의 세포 내 ROS 함량은 각각 53.78% 및 87.54%로 감소되었으며, 양성대조군인 vitamin C(50.45%; 93.70%)와 비교하여 폐 세포 내 산화스트레스를 유사한 수준으로 억제시킨 것을 확인하였다.
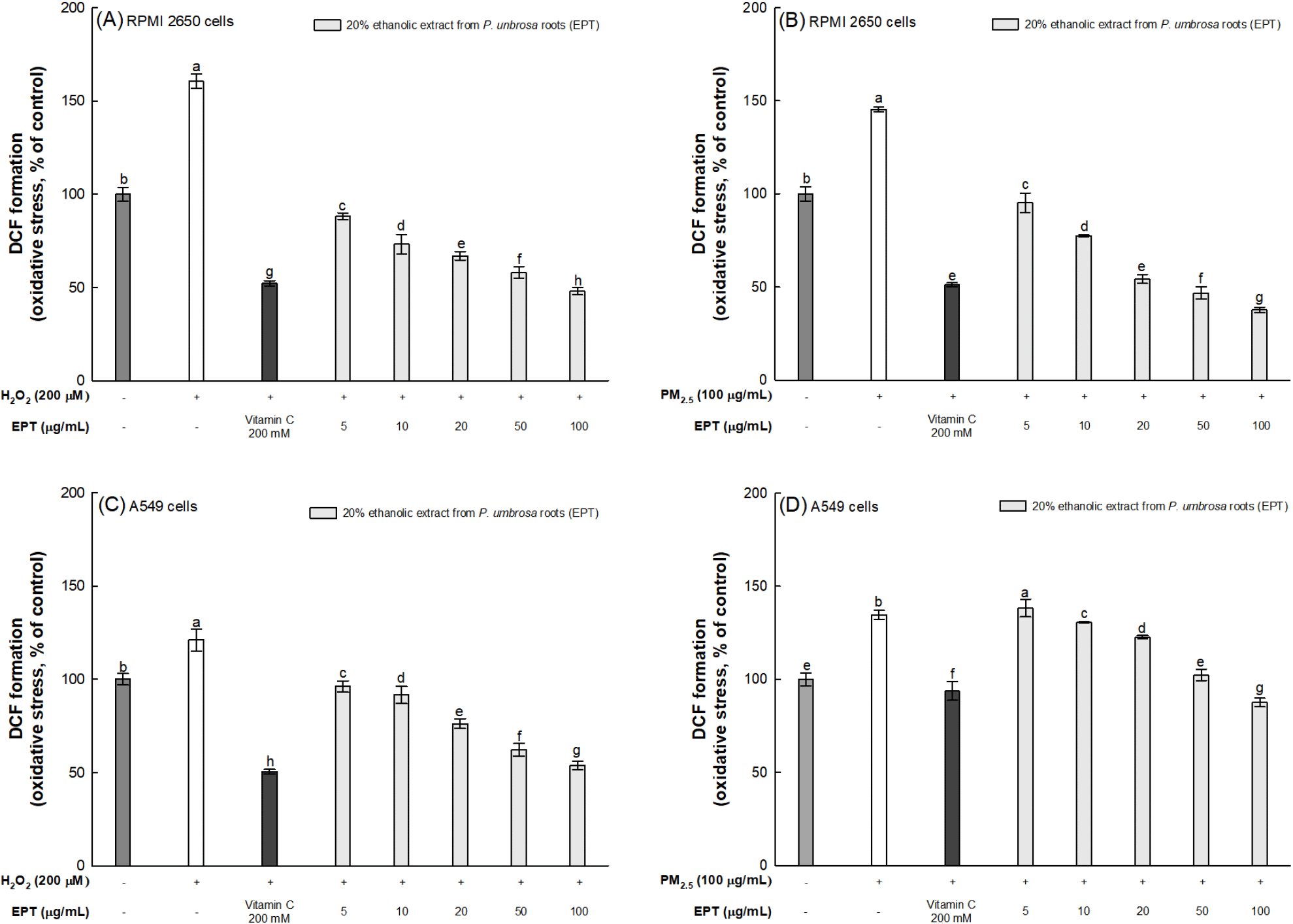
높은 수준의 산소에 노출되는 폐는 체내에서 일어나는 산화 · 환원 반응의 산물인 ROS로 인한 손상을 받기 쉽다(Park 등, 2009). ROS의 일종인 H2O2는 Fenton reaction 반응을 통해 반응성이 매우 높고 독성이 강한 hydroxyl 라디칼(·OH)의 생성에 기여하며, 이는 체내 독소로 작용하여 산화스트레스를 유발하고 산화적 손상의 주요 메커니즘으로 작용한다(Park 등, 2009). 또한, 산화스트레스는 PM으로 인해 유발되는 손상에도 공통적인 경로로 작용한다. Arias-Pérez 등(2020)의 연구에 따르면, 폐포 대식세포 및 기도 상피 세포는 폐 면역 반응을 매개하는 PM을 식세포작용한 후 염증성 매개체를 생성하여 산화스트레스와 ROS의 생성을 증가시켜 전신 염증을 유발한다(Arias-Pérez 등, 2020). 산화스트레스에 대하여 페놀성 및 플라보노이드 화합물은 ROS 생성을 억제하거나 ROS를 제거함으로써 항산화 활성을 나타내어 세포를 보호할 수 있다(Kim 등, 2021). 이와 관련하여, 페놀성 및 플라보노이드 화합물을 함유하고 있는 한속단은 유리지방산으로 유도된 간 세포(HepG2 세포)에서 superoxide dismutase(SOD), catalase(CAT), GSH reductase와 같은 항산화 효소의 활성을 증가시켰으며, 이는 세포 내 중성지방의 과잉 생성으로 인해 항산화 효소의 활성이 제한되어 증가된 산화스트레스를 한속단 뿌리 물 추출물을 처리함으로써 완화된 것으로 확인되었다(Hwang 등, 2024). 또한, Lee 등(2022)은 H2O2를 처리한 근육 세포(C2C12 세포)에서 한속단 물 추출물을 처리함으로써 ROS 생성이 감소되는 것을 확인하였으며, 항산화 효소와 MDA 생성 억제 활성에서 긍정적인 효과를 보여 근육 분해에 대한 완화 효과를 보고하였다. 한속단의 세포 보호 효과를 보고한 이전의 연구들과 본 연구에서, 한속단이 여러 조직의 세포 및 호흡기 세포에서 H2O2 및 PM2.5로 인해 증가된 산화스트레스로부터 보호 효과를 나타낸 것으로 확인되었다. 이를 통해, 다양한 조직에서의 항산화, 항염 활성을 나타내 산화스트레스로 유발되는 산화적 손상과 그로 인한 질환을 예방할 수 있을 것으로 판단된다.
산화스트레스 유발원(H2O2 및 PM2.5)으로 유도된 호흡기 세포의 생존율을 통해 세포 독성에 대한 한속단 뿌리 20% 에탄올 추출물의 세포 보호 효과를 평가하였다. 비강 세포(RPMI 2650 cells)에서 H2O2 및 PM2.5만 처리한 군의 세포 생존율은 정상 대조군(100%) 대비 각각 51.70% 및 34.06%로 감소되었다(Fig. 4A와 4B). 한속단 뿌리 20% 에탄올 추출물 100 μg/mL를 처리한 군의 세포 생존율은 각각 86.83% 및 78.33%로 증가되었으며, 양성대조군인 vitamin C(71.22%; 53.80%)와 비교하여 우수한 비강 세포 보호 효과를 나타내었다. 또한, 폐 세포(A549 cells)에서 H2O2 및 PM2.5만 처리한 군의 세포 생존율은 정상 대조군(100%) 대비 각각 63.84% 및 37.23%로 감소되었다(Fig. 4C와 4D). 한속단 뿌리 20% 에탄올 추출물 100 μg/mL를 처리한 군의 세포 생존율은 각각 100.45% 및 57.83%로 증가되었으며, 양성대조군인 vitamin C(90.73%; 62.19%)와 비교하여 유사한 수준으로 폐 세포 보호 효과를 나타내었다.
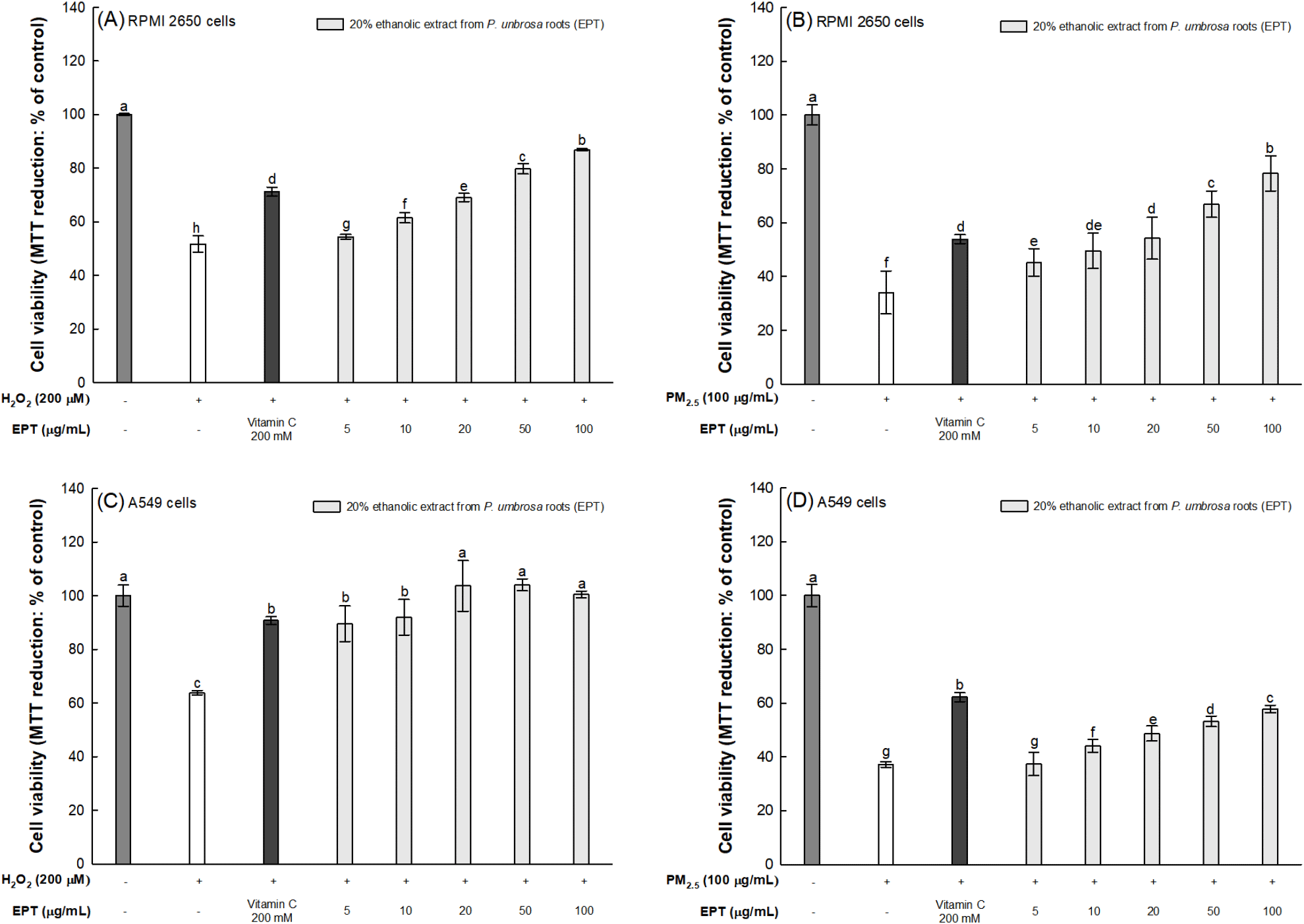
H2O2를 비롯한 ROS는 다양한 유형의 세포에서 생성되어 신호 분자로 작용하는 것으로 간주되고 있으며, 고농도로 생성되는 ROS는 세포 손상의 원인으로 간주되고 있다(Wang 등, 2008). ROS는 세포의 DNA, 지질 또는 단백질과 반응하여 산화스트레스를 유발해 세포 기능 저하 및 세포사멸을 유발하고, 이는 세포 생존율 감소를 특징으로 나타난다(Averill-Bates, 2024). 폐는 주변 공기와 직접 접촉하거나 광범위한 모세관 관류를 통해 전달되는 산화제에 의한 산화적 손상에 특히 취약하며, 이로 인해 산화스트레스로 매개되는 폐 질환이 유발될 수 있다(Wang 등, 2008). 이러한 산화스트레스로부터 폴리페놀 화합물은 강력한 항산화 작용을 나타내 세포를 보호하여 산화스트레스와 관련된 병리적 상태 또는 질병을 예방하는 것으로 보고된다(Rudrapal 등, 2022). 한속단이 포함하고 있는 폴리페놀 화합물인 chlorogenic acid는 H2O2로부터 세포 독성이 유도된 인간 림프 내피 세포(hLEC 세포)에서 b-cell lymphoma 2(Bcl-2), Bcl-2-associated X protein(BAX)과 같은 세포사멸 조절자의 발현을 조절하며, 세포 내 ROS 생성을 억제하고 세포 생존율을 증가시켜 H2O2로 유도된 산화스트레스로부터 세포를 보호하였다(Song 등, 2018). 또한, Herath 등(2024)은 PM2.5에 의해 산화스트레스가 유발된 각질형성세포(HaCaT 세포)에서 chlorogenic acid가 PM2.5 노출에 의한 NADP/NADPH 비율 및 NADPH oxidase의 발현 수준을 조절하여 항산화 효과를 나타내었으며, 이를 통해 세포 내 ROS 생성을 감소하고 세포 생존율을 증가시켜 PM2.5로 유도된 산화스트레스로 인해 발생하는 세포사멸에 대한 예방 효과를 보고하였다. 이러한 연구 결과와 더불어 본 실험에서 확인된 한속단 뿌리의 활성은 한속단의 생리활성 화합물의 효과에 비롯하여 H2O2 및 PM2.5로 인해 유발된 산화스트레스로부터 호흡기 세포를 보호함으로써 폐 질환을 예방할 수 있는 천연 소재로서 활용 가치가 높을 것으로 판단된다.
A549 세포에서 PM2.5로 유도되는 스트레스에 의한 염증반응의 기작과 한속단 뿌리 20% 에탄올 추출물의 보호 효과를 확인하고자 PM2.5를 처리한 A549 cells에서 염증 마커의 단백질 발현량을 측정하였다. PM2.5만 처리한 군은 정상 대조군(100%)과 비교하여 염증 마커인 TLR-4(136.39%), MyD88(122.18%), phospho-JNK(p-JNK, 144.93%), phospho-NF-κB(p-NF-κB, 113.29%), iNOS(149.88%)의 발현이 증가된 것을 확인하였다(Fig. 5). 반면, 한속단 뿌리 20% 에탄올 추출물 100 μg/mL를 처리한 군은 PM2.5 처리로 인해 증가된 염증 마커인 TLR-4 (124.49%), MyD88(110.19%), p-JNK(118.35%), p-NF-κB (60.31%), iNOS(111.27%)의 발현이 유의적으로 감소되어 이를 통해 한속단 뿌리 20% 에탄올 추출물의 보호 효과를 확인하였다.
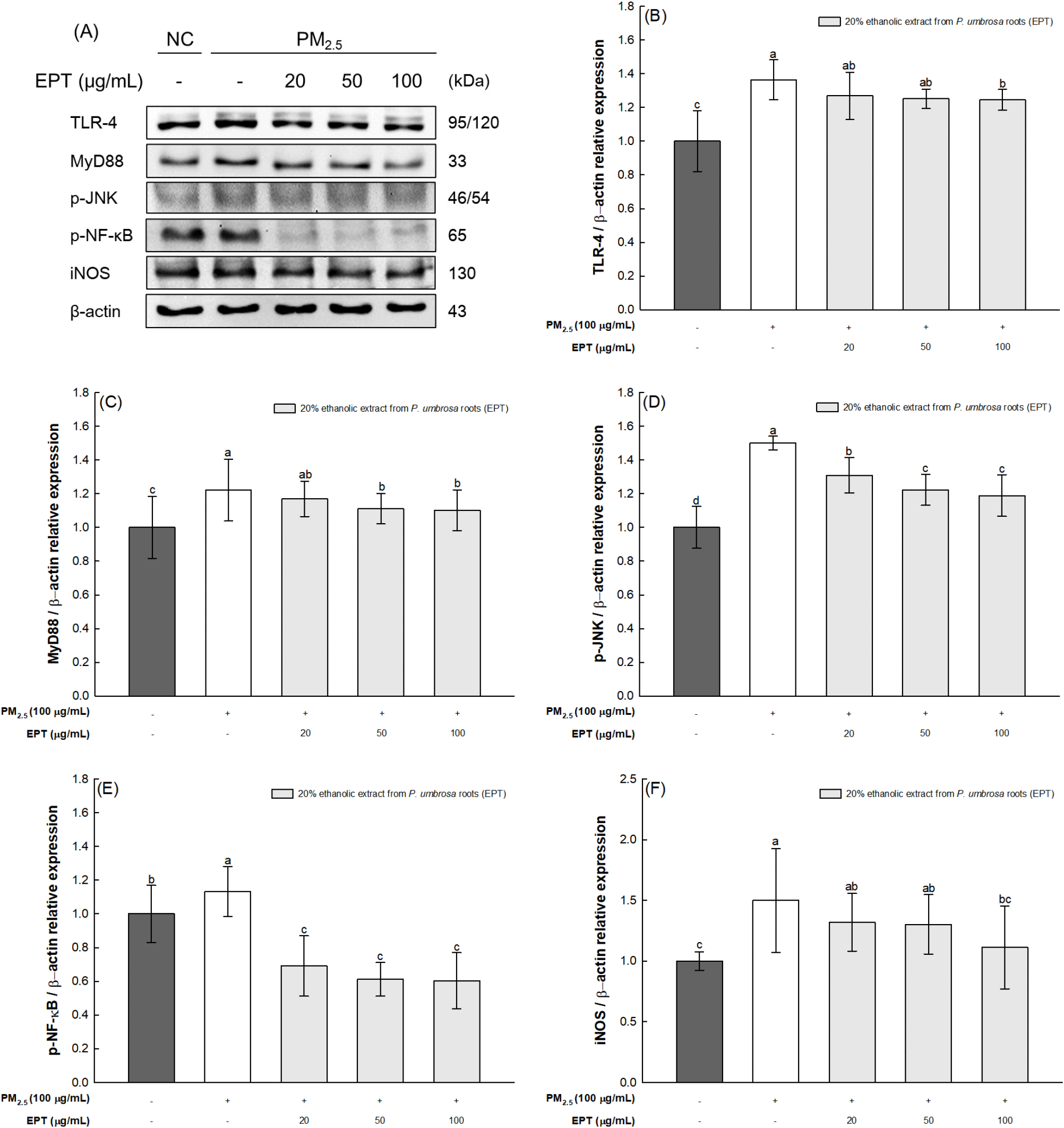
PM의 화학적 구성에 의한 독성학적 효과의 주요 표적 기관은 폐로, PM2.5는 크기가 작고 표면적이 크기 때문에 기관지와 폐에 침투하여 침전되며, 폐포 상피 장벽을 통과하여 폐 순환으로 이어진다(Wang 등, 2022). PM2.5 노출과 폐 염증 및 산화스트레스 사이에는 밀접한 관련이 있는 것으로 나타났다(Leni 등, 2020). PM 자체에는 ROS 생성으로 이어질 수 있는 산화 · 환원 활성 성분이 포함되어 있으며, 이는 과도한 양의 ROS를 생성해 산화스트레스를 유발하고 폐 조직을 손상시킨다(Leni 등, 2020). Zhang 등(2024)은 PM으로 유발된 폐 손상은 산화스트레스에 의해 TLR-4가 활성화되어 JNK 및 NF-κB 경로의 신호를 전달하게 되면서 매개되는 염증반응이 메커니즘으로 작용한다고 보고하였다. TLR은 선천성 면역과 밀접한 관련이 있는 막 관통 단백질로, 병원체 인식, 면역 활성화 및 염증 과정에서 핵심적인 역할을 한다(Wu 등, 2021). TLR-4는 PM을 인식하여 활성화되면서 세포질 어댑터 단백질인 MyD88과 결합을 이루고, 이는 TLR-4 및 MyD88 신호 전달 경로를 통해 세포사멸에 관여하는 JNK 경로와 염증반응에 관여하는 NF-κB 경로를 조절한다(Kim 등, 2021). JNK는 mitogen-activated protein kinase(MAPK) 상위 계열에 속하며, 하위 단백질 인산화효소의 순차적 활성화를 통해 세포 외 신호를 전달하여 세포사멸을 매개한다(Averill-Bates, 2024; Moon 등, 2022). NF-κB는 NF-κB 활성화를 억제하는 NF-κB inhibitor(IκB)와 결합하여 세포질 내에서 비활성화 상태로 존재하나, 외부에서 TLRs를 통해 세포가 자극되면, IκB를 인산화하여 복합체로부터 IκB를 분리함과 동시에 NF-κB가 핵막을 통과해 NF-κB가 활성화된다(Averill-Bates, 2024; Wu 등, 2021). 핵 내로 들어간 NF-κB는 interleukin(IL)-6, IL-1β 및 tumor necrosis factor-α(TNF-α)와 같은 염증성 사이토카인과 iNOS, cyclooxygenase-2(COX-2)와 같은 유도효소의 상향 조절 및 활성화를 유도하여 염증을 유발하고, 산화스트레스에 대한 과도한 반응을 초래해 궁극적으로 폐 손상을 유발한다(Chen 등, 2021). 염증 반응에 관하여 한속단은 기도 염증과 관련된 단백질 발현 조절 효과 및 항알레르기 효과가 보고되어 있다(Jang 등, 2024; Pak 등 2022). Jang 등(2024)은 한속단이 LPS로 자극된 RAW 264.7 세포 및 오브알부민(ovalbumin, OVA)으로 유도된 과민성 마우스 모델에서 NF-κB, MAPK, iNOS의 발현 감소 및 항산화 효소의 활성 증가를 나타내었으며, 이를 통해 기도 염증 완화 효과를 보여 한속단 물 추출물이 호흡기 응용 분야에서 유망한 항염제로 부상할 것이라고 보고하였다. Pak 등(2022)이 보고한 연구 결과에서도, OVA로 유도된 천식 마우스 모델에서 한속단 물 추출물은 기도 과민성, 호산구 증가, 염증성 사이토카인 및 OVA-specific immunoglobulin E의 생성을 현저히 감소시켰고, 기도 염증과 폐 조직의 점액 분비를 감소시켰으며, extracellular signal-regulated kinase(EPK) 및 NF-κB 인산화 억제와 matrix metalloproteinase-9(MMP-9)의 발현과 관련하여 알레르기 천식을 치료하는 데 잠재력이 있음을 시사하였다. 이러한 연구 결과를 고려하였을 때, 한속단 뿌리 20% 에탄올 추출물은 생리활성 화합물의 항산화 활성에 근거를 두어 PM2.5로부터 유도되는 산화스트레스에 의한 세포 독성 및 염증반응을 완화하여 호흡기 세포를 보호하는 데 도움을 줄 수 있을 것으로 판단된다.
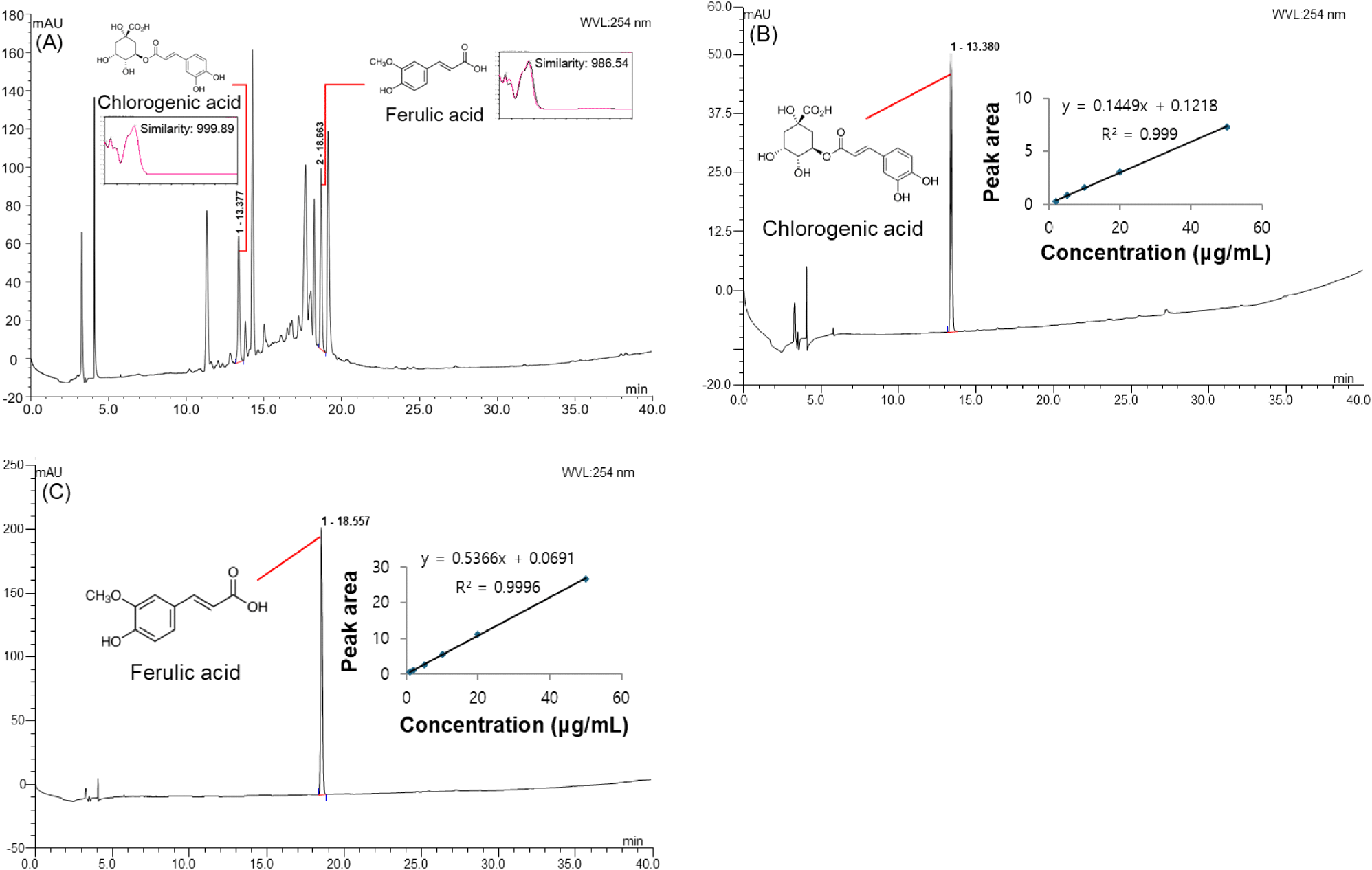
호흡기 세포에서 H2O2 및 PM2.5로 인해 증가된 산화스트레스로부터 보호 효과를 나타낸 한속단 뿌리 20% 에탄올 추출물의 주요 생리활성물질을 분석하고자 HPLC 분석을 진행하였다. 254 nm에서 RT가 13.377분 및 18.663분인 두 개의 peak가 분리되었으며, 이는 한속단 뿌리 20% 에탄올 추출물의 주요 생리활성물질로 분석되었다(Fig. 6). 시료와 동일한 방법으로 표준물질인 chlorogenic acid와 ferulic acid를 분석하여 RT와 UV-Vis spectrum을 비교한 결과, 999.89 및 986.54의 상동성을 보였으며, 이에 따라 chlorogenic acid 및 ferulic acid를 한속단 뿌리 20% 에탄올 추출물의 주요 생리활성 물질로 추정하였다. 한속단 뿌리 20% 에탄올 추출물에 함유되어 있는 chlorogenic acid 및 ferulic acid를 정량 분석한 결과, chlorogenic acid 및 ferulic acid 함량은 31.00±0.44 μg/mg of dried weight 및 10.92±1.13 μg/mg of dried weight로 측정되었다(Table 2).
| No. | Compound | Concentration (μg/mg of dried weight) |
|---|---|---|
| 1 | Chlorogenic acid | 31.00±0.441) |
| 2 | Ferulic acid | 10.92±1.13 |
폴리페놀은 하나 이상의 hydroxyl기를 갖는 방향족 고리가 하나 이상 존재하고 고도로 결합된 시스템이 존재하기 때문에 효율적으로 자유라디칼 및 ROS 제거제로 작용한다(Rudrapal 등, 2022). 이는 ROS를 무효화하거나 세포의 산화스트레스를 억제함으로써 지질, 단백질, DNA와 같은 생체 분자의 산화적 손상을 방지하고 조직 염증을 감소시켜 항산화 효과를 나타낸다(Rudrapal 등, 2022). 특히, chlorogenic acid는 cinnamic acid와 quinic acid의 ester화에서 유래되어 hydroxyl기를 가진 페놀산이며, 산화스트레스 매개 염증반응 및 광범위한 만성 질환에 대해 항산화, 항염증 활성을 나타냄으로써 다양한 질병 모델에서 산화 반응으로부터 생체를 보호하여 산화스트레스를 완화한다(Liang과 Kitts, 2016). 또한, ferulic acid는 폴리사카라이드(polysaccharide)에 공유 결합되어 구조적 무결성과 강성에 기여하며, 항산화, 항염증, 항섬유화, 항암 효과와 같은 뚜렷한 약리학적 효과를 토대로 폐 질환에 대한 치료 효과가 나타남을 보고하고 있다(Zhai 등, 2023). 따라서, 본 연구에서 한속단 뿌리 20% 에탄올 추출물의 항산화 활성 및 호흡기 세포 보호 효과는 chlorogenic acid와 ferulic acid 등의 폴리페놀 성분에서 기인한 것이며, 산화스트레스 매개 염증반응에 대한 폐 기능 강화에 도움을 줄 수 있는 천연 소재로서 활용가치가 높다고 판단된다. 한속단 뿌리 20% 에탄올 추출물에서 관찰된 항산화 활성 및 호흡기 세포 보호 효과는 한속단에 존재하는 chlorogenic acid와 ferulic acid와 같은 페놀성 화합물에서 기인한 것으로 판단된다.
4. 요약
본 연구는 한속단 뿌리 20% 에탄올 추출물의 항산화 활성과 H2O2 및 PM2.5로 유도된 산화스트레스로부터 호흡기 세포 보호 효과 및 기작을 확인하고 주요 생리활성물질을 분석하고자 수행되었다. 한속단 뿌리 20% 에탄올 추출물은 높은 ABTS 및 DPPH 라디칼 소거 활성과 FRAP 및 MDA 생성 억제 활성을 통해 직 · 간접적인 항산화 활성을 보였으며, 우수한 α-glucosidase 및 AGEs 생성 억제 효과를 나타내었다. 또한, 한속단 뿌리 20% 에탄올 추출물은 비강 세포인 RPMI 2650 세포와 폐 세포인 A549 세포에서 H2O2 및 PM2.5로 유도된 ROS의 생성을 억제하고 세포 생존율을 증가시킴으로써 호흡기 세포 보호 효과를 나타내었다. 이외에도, 한속단 뿌리 20% 에탄올 추출물은 TLR-4, MyD88, p-JNK, p-NF-κB 및 iNOS와 같은 염증성 단백질의 발현 수준을 유의적으로 억제함으로써 PM2.5로 유도된 염증반응을 완화하였다. 마지막으로, HPLC를 사용하여 한속단 뿌리 20% 에탄올 추출물의 주요 생리활성물질을 분석한 결과 chlorogenic acid와 ferulic acid가 분석되었다. 따라서, 본 연구 결과에서 나타난 한속단 뿌리 20% 에탄올 추출물의 항산화 활성 및 호흡기 세포 보호 효과는 chlorogenic acid와 ferulic acid를 포함한 다양한 폴리페놀 화합물에서 기인한 것으로 판단되며, 한속단은 호흡기 건강 개선에 도움을 줄 수 있는 건강기능식품의 천연물 소재로서 활용 가능할 것으로 판단된다.
