1. 서론
쑥속(Artemisia)은 국화과(Asteraceae)에 속하는 여러해살이 풀로 한국 및 중국, 일본 등 여러 지역에 분포되어 있는 식물이다(Kim과 Jang, 1994). 쑥의 물리화학적, 이화학적 특성 및 항산화능과 같은 생리활성, 휘발성 물질에 대한 연구가 다양하게 진행되어 왔다(Choi와 Ha, 2014; Hwang 등, 2014; Jang 등, 2005; Park 등, 2009; Park 등, 2011; Song, 2013).
식물의 향기성분은 심리적 안정과 중추신경계에 다양한 약리학적 효과가 있다고 보고되었는데(Almeida 등, 2001; Almeida 등, 2003; Paula 등, 2006; Silva 등, 2007), 향기성분을 분리하는 방법에는 연속 수증기 증류(simultaneous steam distillation extraction, SDE)법, 용매 추출(solvent extraction, SE)법, headspace법, 고체상 미세추출(solid-phase microextraction, SPME)법 등이 있다(Berger, 2007). Hong 등(2018)은 개똥쑥(Artemisia annua L.)을 대상으로 연속 수증기 증류(SDE)법과 고체상 미세추출(SPME)법을 이용하여 caryophyllene oxide, β-caryophyllene, camphor, β-selinene, γ-muurolene, eucalyptol, (E)-pinocarveol 및 pinocarvone 등을 포함한 휘발성 향기 성분을 확인, 비교하였으며, Choi(2015)는 수확 연도에 따라 쑥의 정유성분을 hydrodistillation extraction (HDE) 방법으로 추출하여 camphor, β-caryophyllene, dehydrocarveol, borneol, α-bisabolene epoxide, thujone 등이 존재함과 수확 연도별로 성분의 차이가 있다는 것을 알렸다. 또한 생쑥과 덖음쑥차를 대상으로 가공처리 방법에 따른 향기성분에 대한 비교 연구도 진행되었다(Kim 등, 1994).
큰비쑥(Artemisia fukudo Makino)은 염습지, 해안가 근처 등에서 자라는 염생식물(halophyte)로 녹백색을 띠고 고유의 향기가 있는 것이 특징이다(Lee, 2018). Kang 등(2024)에 의해 큰비쑥의 생육 환경 및 시기별 총 폴리페놀 함량, DPPH 라디칼 소거능, 무기질 함량과 같은 이화학적 특성에 대한 연구는 진행된 바 있지만 큰비쑥의 휘발성 향기 성분에 대한 연구는 미흡한 실정이다. 대부분의 농작물은 재배의 마지막 지점이나 최대 수확 단계에서 일 년에 한 번만 수확하지만, 허브와 같은 작물을 수확할 때는 유리한 기후 조건에서 여러 번 수확도 가능하기 때문에 최적의 수확 시기를 결정할 때 식물의 2차 대사산물에 미치는 계절적 영향에 대한 지식이 필수적이다(Figueiredo 등, 2008). 따라서 고유의 향기가 있는 큰비쑥의 휘발성 향기성분을 동정하고, 높은 수율을 위한 최적의 생육 환경과 수확 시기를 확인하여 생리기능적인 자료를 확보하고 천연향료로써 상업적 가치를 확인하고자 본 연구를 진행하였다.
2. 재료 및 방법
생육 환경(자생 및 재배) 및 수확 시기에 따라 큰비쑥(Artemisia fukudo Makino)을 채취하여 실험에 사용하였다. 자생 큰비쑥은 신안군 증도면 증도리의 태평염전 습지대 근처에서 2024년 5월부터 10월까지 채취하였으며, 재배 큰비쑥은 함평군 함평읍의 비닐하우스에서 재배하여 6월부터 10월까지 채취하였다. 큰비쑥을 수세하여 흙, 곤충과 같은 이물을 제거한 후 원물 그대로 즉시 밀봉하여 -70°C의 냉동고(DuoFreez U300, DAIHAN, Wonju, Korea)에 보관하면서 실험에 사용하였다.
향기성분 분석은 Kim 등(2022)의 방법을 참고하여 headspace법을 사용하였다. 분석 직전에 막자사발을 이용하여 큰비쑥을 균질화시킨 뒤 1 g을 정확하게 취해 20 mL의 headspace vial (Thermo Fisher Scientific Inc., Langerwehe, Germany)에 넣고 캡으로 밀봉하였다. 그 후 오토샘플러(TriPlus RSH auto sampler, Thermo Fisher Scientific Inc., Waltham, MA, USA)의 교반기에서 70°C로 30분간 가열하여 headspace vial의 공극 부분에 휘발성 향기성분을 포집하였다. 1 mL headspace용 syringe(Thermo Fisher Scientific Inc., Rockwood, TN, USA)를 이용하여 vial의 상단 기체(1 mL)를 수집한 후 GC의 injector에 주입하였다. GC-MS 분석은 HP-5MS(60 m × 0.25 mm, 0.25 μm, Agilent Technologies, Inc., Santa Clara, CA, USA)를 연결시킨 GC-MS(TSQ9000, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 사용하였으며, 기기분석 조건은 Table 1과 같다.
Retention index(RI) 확인을 위해 n-alkane(Qualitative Retention time index std, RESTEK, Bellefonte, PA, USA)을 분석에 이용하였으며, RI는 다음의 식에 준하여 계산하였다(Vandendool and Kratz, 1963). 계산식에서 n은 계산하고자 하는 peak보다 전에 나오는 n-alkane의 탄소수, m은 해당 peak보다 뒤에 나오는 n-alkane의 탄소수, tri는 해당 peak의 retention time(RT), trn은 해당 peak보다 앞에 나오는 n-alkane의 RT, trm은 해당 peak보다 뒤에 나오는 n-alkane의 RT이다. 분석을 통해 분리된 큰비쑥의 향기성분 중 반복실험에서 모두 검출된 성분들을 대상으로 NIST MS search 2.2 및 문헌상의 RI와 GC-MS 분석으로 확인된 RI를 비교하여 휘발성 향기성분을 동정하였다. 향기성분의 상대적 정량은 peak area을 기준으로 계산하였으며, 총 peak area를 구하여 각 향기성분들이 차지하는 peak area%를 산출하였다.
모든 실험 결과는 최소 5회 이상 반복 측정하여 평균값을 나타내었으며 IBM SPSS statistics 20.0 프로그램(IBM Corp., Armonk, NY, USA)을 이용하여 통계처리하였다. 수확 시기에 따라 휘발성 향기성분의 총 peak area가 유의한 차이를 보이는지 검증하고자 일원배치 분산분석(One-way ANOVA)을 실시하였으며 유의한 차이를 보일 때는 Duncan’s multiple range test로 시료 간의 유의성을 검증하여 결괏값이 p<0.05일 때에 통계적으로 유의한 것으로 간주하였다.
3. 결과 및 고찰
자생 큰비쑥과 재배 큰비쑥의 수확 시기별 GC-MS chromatogram은 Fig. 1에 도식하였으며, 25종의 monoterpene류, 3종의 sesquiterpene류, 4종의 ester류, 1종의 aldehyde류, 1종의 alcohol를 포함한 총 34종의 휘발성 향기성분이 동정되었다(Fig. 2). 동정된 화합물의 약 80%를 차지하는 terpenoid는 탄소수가 5개(C5)인 isoprene 단위로 머리와 꼬리가 서로 연결되어 있는 형태의 천연물이며 hemiterpene(C5), monoterpene (C10), sesquiterpene(C15), diterpene(C20) 등으로 분류할 수 있다(Dewik 등, 2013). 또한 식물에서 주로 발견되는 2차 대사산물로 향기가 나며 항염증, 항산화, 항균, 항알러지 등의 생리활성을 가진 것으로 보고된 바 있다(Fatima 등, 2023).
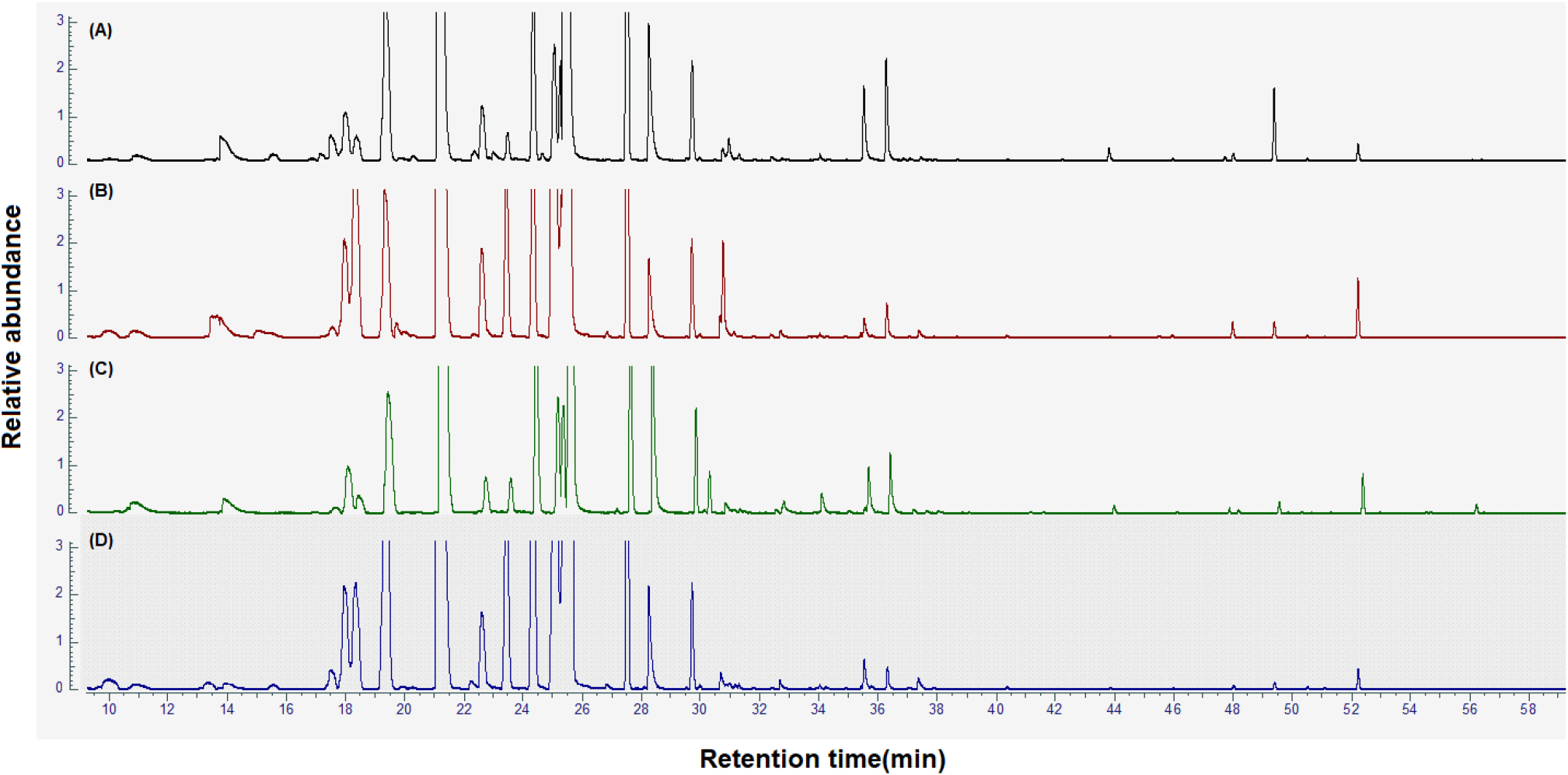
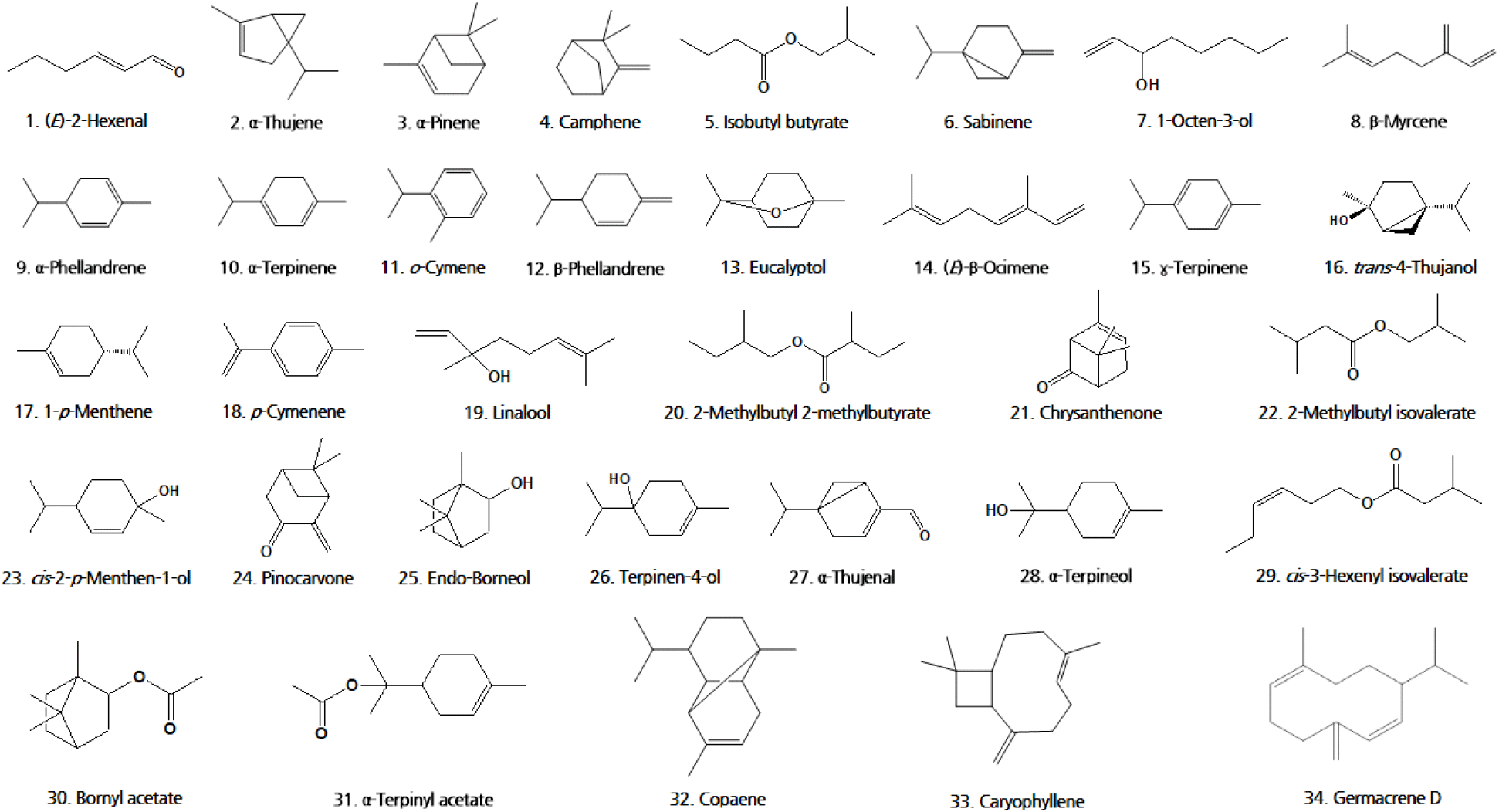
선행 연구를 통해 확인된 휘발성 향기성분의 향기 묘사와 검출 식물은 Table 2에 나타내었으며 큰비쑥에서 검출된 휘발성 향기성분은 신선한 나뭇잎향, 송진향, 레몬 및 시트러스 계열의 냄새, 흙 냄새 등으로 확인되었다. (E)-2-Hexenal은 항진균 효과(Ma 등, 2022), α-pinene은 항산화, 항염증, 신경보호 효과(Allenspach와 Steuer, 2021), camphene은 항비만 효과가 있었다(Vallianou와 Peroulis, 2011). Sabinene은 항염증 효과가 있고(Valente 등, 2013), eucalyptol은 오랫동안 의학적으로 사용되어 항염증, 항산화, 항균, 항암, 기관지 확장 및 세포 사멸 효과 등 다양한 생물학적 기능이 있는 것으로 보고된 바 있다(Hoch 등, 2023). γ-Terpinene은 항통증 효과(Passos 등, 2015), p-cymenene은 항균, 항바이러스 효과(Bagińska 등, 2023), endo-borneol은 항경련 효과가 있는 것이 입증되었다(Łuszczki 등, 2023). Terpinen-4-ol은 항균, 항독성, 항염증, 항고혈압, 항암 효과가 있었고(Prerna 등, 2024), α-terpineol은 항산화, 항암, 항경련, 항궤양(Khaleel 등, 2018), bornyl acetate는 항염증 효과가 있는 것으로 보고된 바 있다(Zhao 등, 2023).
| No. | Compound | RI1) | Structure | Odor description | Reference |
|---|---|---|---|---|---|
| 1 | (E)-2-Hexenal | 859 | Aldehyde | Green, banana-like2) | Artemisia princeps (Park et al., 2009) |
| 2 | α-Thujene | 929 |
Hydrocarbons (monoterpene) |
- | Pimpinella brachycarpa N. (Chang et al., 2007) |
| 3 | α-Pinene | 934 |
Hydrocarbons (monoterpene) |
Pine-like, resinous2) | Artemisia annua L. (Hong et al., 2021) |
| 4 | Camphene | 949 |
Hydrocarbons (monoterpene) |
− | Artemisia iwayomogi itamura (Hong, 2004) |
| 5 | Isobutyl butyrate | 958 | Ester | - | Mosla chinensis (Cao et al., 2011) |
| 6 | Sabinene | 976 |
Hydrocarbons (monoterpene) |
Warm, oily, peppery, green2) | Artemisia annua L. (Hong et al., 2018) |
| 7 | 1-Octen-3-ol | 993 | Alcohol | - | Artemisia princeps (Park et al., 2009) |
| 8 | β-Myrcene | 997 |
Hydrocarbons (monoterpene) |
Musty, wet soil2) | Artemisia princeps (Park et al., 2009) |
| 9 | α-Phellandrene | 1008 |
Hydrocarbons (monoterpene) |
- | Ligularis fischeri var. spiciformis (Yeon et al., 2012) |
| 10 | α-Terpinene | 1020 |
Hydrocarbons (monoterpene) |
Lemony, citrusy2) | Aster scaber (Lee et al., 2012) |
| 11 | ο-Cymene | 1030 |
Hydrocarbons (monoterpene) |
- | Chamaecyparis obtusa, Pinus densiflora, Pinus koraiensis (Yang et al., 2019) |
| 12 | β-Phellandrene | 1033 |
Hydrocarbons (monoterpene) |
- | Ligularia fischeri, Ligularis fischeri var. spiciformis (Yeon et al., 2012) |
| 13 | Eucalyptol | 1037 |
Hydrocarbons (monoterpene) |
− | Eucalyptus smithii, globulus, maideni, bicostata, sideroxylon, cineria, leucoxylon (Chandorkar et al., 2021) |
| 14 | (E)-β-Ocimene | 1055 |
Hydrocarbons (monoterpene) |
Herbaceous, sweet, tropical, warm2) | Fresh mandarin fruit (Tietel et al., 2011) |
| 15 | γ-Terpinene | 1064 |
Hydrocarbons (monoterpene) |
Lemony, lime-like2) | Artemisia annua L. (Hong et al., 2018) |
| 16 | trans-4-Thujanol | 1073 |
Hydrocarbons (monoterpene) |
- | Thymus quinquecostatus Celak (Baik et al., 2009) |
| 17 | 1-p-Menthene | 1094 |
Hydrocarbons (monoterpene) |
- | Notopterygium (Wang and Huang, 2015) |
| 18 | p-Cymenene | 1098 |
Hydrocarbons (monoterpene) |
- | Lavandula pubescens (Park et al., 2019) |
| 19 | Linalool | 1110 |
Hydrocarbons (monoterpene) |
Floral, green, citrus2) | Artemisia annua L. (Hong et al., 2018) |
| 20 | 2-Methylbutyl 2-methylbutyrate | 1112 | Ester | - | Hippophae rhamnoides L. ssp. Carpatica (Socaci et al., 2013) |
| 21 | Chrysanthenone | 1114 |
Hydrocarbons (monoterpene) |
- | Artemisia maritim (Jaitak et al., 2008) |
| 22 | 2-Methylbutyl isovalerate | 1117 | Ester | - | Hypericum Taxa (Maggi et al., 2010) |
| 23 | cis-2-p-Menthen-1-ol | 1131 |
Hydrocarbons (monoterpene) |
- | Achillea santolina L. (Dakah and Maarrouf, 2019) |
| 24 | Pinocarvone | 1173 |
Hydrocarbons (monoterpene) |
- | Eucalyptus globulus (Schmidt, 1947) |
| 25 | endo-Borneol | 1176 |
Hydrocarbons (monoterpene) |
Woody, burning, camphoraceous3) | Chrysanthemum zawadskii (Park and Kim, 2017) |
| 26 | Terpinen-4-ol | 1186 |
Hydrocarbons (monoterpene) |
Woody, earthy2) | Acorus calamus L. (Venskutonis and Dagilyte, 2003) |
| 27 | α-Thujenal | 1196 |
Hydrocarbons (monoterpene) |
- | Rosmarinus officinalis L. (Mena et al., 2016) |
| 28 | α-Terpineol | 1202 |
Hydrocarbons (monoterpene) |
Floral, lilac-like2) | Zingiber officinale Roscoe (Seo et al., 2006) |
| 29 | cis-3-Hexenyl isovalerate | 1246 | Ester | - | Ligularis fischeri var. spiciformis (Yeon et al., 2012) |
| 30 | Bornyl acetate | 1296 |
Hydrocarbons (monoterpene) |
- | Schizandra Chinensis Bullion (Kim and Jang, 1994) |
| 31 | α-Terpinyl acetate | 1361 |
Hydrocarbons (monoterpene) |
- | Eucalyptus camaldulensis Dehn. (Sabo and Knezevic, 2019) |
| 32 | Copaene | 1383 |
Hydrocarbons (sesquiterpene) |
- | Foeniculum vulgare Mill. (Hong et al., 2021) |
| 33 | Caryophyllene | 1428 |
Hydrocarbons (sesquiterpene) |
Woody, spicy2) | Ligularia fischeri, Ligularis fischeri var. spiciformis (Yeon et al., 2012) |
| 34 | Germacrene D | 1491 |
Hydrocarbons (sesquiterpene) |
- | Rosa hydrid (Lee et al., 2008) |
ref: Taste and aroma of fresh and stored mandarins (Tietel et al., 2011).
ref: Volatile flavor compounds from raw mugwort leaves and parched mugwort tea (Kim et al., 1994).
동정된 휘발성 향기 성분 34종의 각각의 peak area를 계산하여 Table 3에 나타내었다. 34종의 휘발성 향기성분은 자생 큰비쑥과 재배 큰비쑥에서 모두 검출이 되었으며 생육 환경에 따라 특이적으로 검출된 향기성분은 없었다.
자생 큰비쑥과 재배 큰비쑥에서 eucalyptol과 sabinene, camphene, ο-cymene, α-terpinene은 봄-여름까지는 점차 증가하다가 8월에 크게 감소하였으며 가을에 가까워질수록 증가하여 몇몇 휘발성 향기성분들은 수확 초기(5월, 6월)에 비해 1.63-8.11배까지 증가한 것을 확인하였다. 또한 linalool의 경우 자생 큰비쑥과 재배 큰비쑥 모두 수확 초기에는 검출되지 않았지만, 10월에는 자생 큰비쑥에서는 크게 증가하였으며(5.64E+08), 재배 큰비쑥에서는 소폭 증가하였다(2.68E+07). 앞서 언급한 화합물들은 수확 시기에 따른 peak area 변화 경향이 유사한 반면 γ-terpinene은 자생 큰비쑥에서 수확 초기에 비해 1.83배 증가하였고, 재배 큰비쑥에서는 수확 초기에 비해 0.86배 감소하여 생육 환경에 따른 차이가 있는 것으로 확인되었다. β-Phellandrene은 자생 큰비쑥에서 10월에 가장 높았는데(1.05E+ 09), 재배 큰비쑥에서는 8월 이후부터 감소해서 9월 이후 검출되지 않았다(ND). 2-Methylbutyl-2-methylbutyrate는 자생 큰비쑥에서는 생육기간 동안 점차 감소하여 9월 이후에 검출되지 않았으며(ND), 재배 큰비쑥에서는 봄부터 여름까지는 증가하다가 8월경에 감소하고 다시 증가하여 생육 내내 검출되었다. Barroso 등(1992)의 연구에 따르면 Crithmum maritimum에서 sabinene은 5월부터 10월까지 점차 증가하여 개화기간에 우세한 성분이었으며 계절적인 영향을 받는 것으로 보고되었다. 본 연구에서도 생육 초기인 봄부터 개화 시기에 가까워진 가을까지 증가하여 Barroso의 연구결과와 유사한 부분을 확인하였다.
동정된 휘발성 향기 성분 34종의 총 peak area를 계산하여 Fig. 3에 나타내었다. 자생 큰비쑥의 휘발성 향기성분은 봄(5월)부터 초여름(6월)까지 증가하다가 점차 감소하여 8월에 가장 낮았으며 개화 시기에 가까워질수록 점차 증가하며 10월에 가장 높은 것을 확인하였다. 재배 큰비쑥의 경우 초여름(6월)부터 7월까지 향기성분이 증가하다가 8월에 가장 낮았으며 다시 점차 증가하여 10월에 가장 높은 것을 확인하였다.
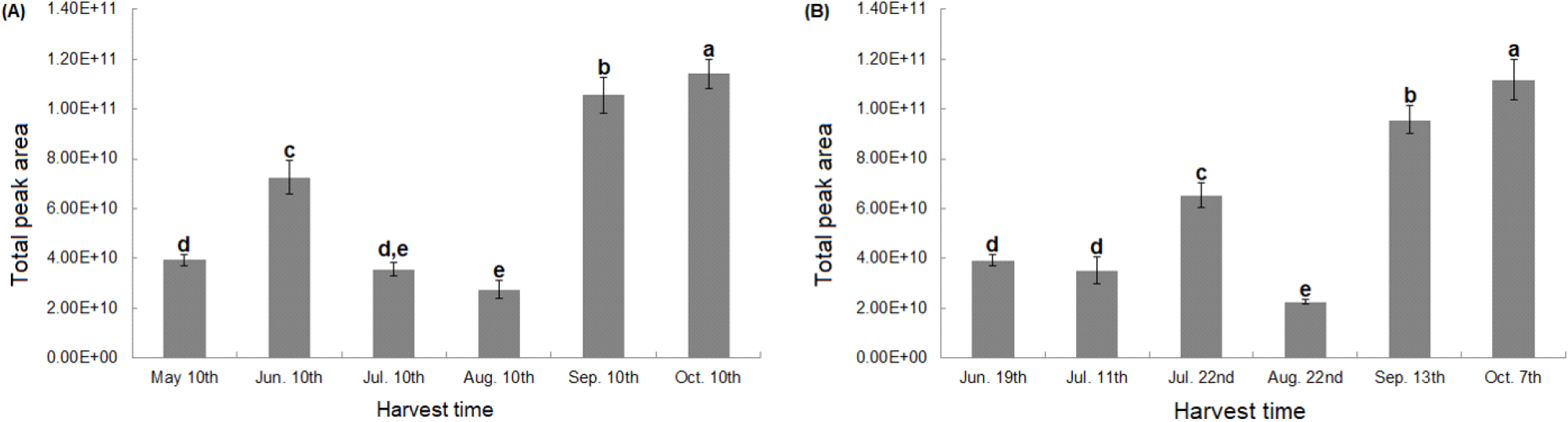
자생 및 재배 큰비쑥의 총 휘발성 향기성분은 생육 초기인 봄-여름에는 증가하다가 무더운 여름인 8월에 크게 감소하는 경향을 보였는데 이러한 부분은 생리적 활동이 시작되는 3월에 비해 생리적인 휴면이 시작되는 8월에 잣나무 내 terpenoid류의 함량이 크게 감소했다고 보고된 Song(1994)의 연구 결과와 유사하였다. Royal Botanic Gardens Kew(1909)에 따르면 큰비쑥은 생육 초기에 가는 줄기 잎의 형태로 자라다 점차 굵은 줄기가 생기며 가지 끝부분부터 꽃이 생긴다고 보고된 바 있는데 본 연구에서 채취한 큰 비쑥도 줄기 끝에 가지잎이 생기고 개화 시기에 가까워질수록 가는 줄기를 따라 노란색 꽃망울이 여러 개 생기는 것을 확인하였다(Fig. 4). Achillea ptarmica의 녹색 줄기와 뿌리에서 추출한 오일에는 monoterpene이 거의 존재하지 않았고 꽃 부분에서 다량 존재하였다고 보고된 바 있다(Kuropka 등, 1991). 꽃 향기의 대부분은 monoterpene에 기인하는데 개화 전에는 배당체 형태로 들어있는 monoterpene류가 싹이 틀 때 효소반응으로 유리되어 향기가 난다는 문헌(Woo, 2014)과 비교하였을 때 본 연구에서 큰비쑥의 휘발성 향기성분은 대부분 monoterpene로 동정되었으며 개화 시기인 가을에 가까워질수록 효소반응으로 배당체가 유리되어 향기가 나는 것으로 생각된다.

Hong(2015)의 생육환경에 따른 로즈마리 에센셜 오일의 함량 및 주요 향기성분에 관한 연구에서는 노지 재배에서 얻은 에센셜 오일이 시설 재배보다 유효성분의 peak area가 넓게 나타났다고 보고한 바 있고, Jang과 Baek(2022)의 연구에서는 노지 재배 달래가 시설 재배 달래에 비해 전반적인 향 강도가 강했으며 향 활성 화합물이 더 높은 농도로 존재하였다고 알린 바 있다. 반면 수경 재배와 노지 재배한 스위트 바질의 향기 성분을 비교한 연구에서는 정유 수득률의 차이는 있었지만, 향기성분의 80% 이상이 유사하거나 동일성을 가졌으며 향취도 큰 범주 내에서는 유사한 것을 확인하였다(Yeon, 2022). 본 연구에서 개화 시기의 휘발성 향기성분을 비교하였을 때 자생 큰비쑥과 재배 큰비쑥에서 동정된 향기성분의 구성과 총 peak area가 유사한 점을 보아 큰비쑥의 휘발성 향기성분은 생육 환경에 따른 유의한 차이가 없었기 때문에 식물의 특성이나 기후, 재배 방식, 분석 방법 등으로 인한 연구결과의 차이가 있을 것으로 생각된다. 따라서 생리적인 휴면이 시작되는 8월 중순에는 휘발성 향기성분의 추출 효율이 가장 낮고 큰비쑥의 개화 시기인 9-10월에 추출 효율이 가장 높을 것으로 생각되며, 염이 많은 환경에서 자란 자생 큰비쑥과 일반 토양에서 자란 재배 큰비쑥 간의 휘발성 향기성분이 큰 차이가 없어 큰비쑥을 대량 재배한다면 천연향료로써 이용 가능성이 높아질 것으로 생각된다.
자생 큰비쑥과 재배 큰비쑥의 수확 시기별 휘발성 향기성분 중 peak area%를 기준으로 1%가 넘어가는 성분을 큰비쑥의 주요 휘발성 향기성분으로 판단하고 Fig. 5에 나타내었다. 자생 큰비쑥의 휘발성 향기성분은 eucalyptol > sabinene > camphene > o-cymene > γ-terpinene > α-terpinene > α-pinene > (E)-2-hexenal > α-thujene의 순서로 차지하는 비중이 컸으며, eucalyptol은 생육 초기인 봄(5월)부터 여름(8월)까지 증감이 반복되다가 가을(10월)에 가장 적은 비율을 차지하였다(60.43%→45.40%). Sabinene은 봄(5월)부터 증감하다 가을(10월)에 가장 높은 비율을 차지하였으며(17.89%→28.71%), camphene은 약 3.31% 차지했던 봄(5월)과 가을(9, 10월)에 비해 여름(6-8월)에 약 9%로 가장 높은 비율을 차지하는 것을 확인하였다. o-Cymene은 봄(5월)부터 가을(10월)까지 증가하였으며(1.74%→4.92%), γ-terpinene은 봄(5월)부터 가을(10월)까지 감소하였다(3.42%→2.18%). α-Terpinene은 여름(7월)에 1.04%로 가장 낮았으며 다시 증가하여 가을(10월)에 가장 높은 것을 확인하였다(2.29%→3.80%).
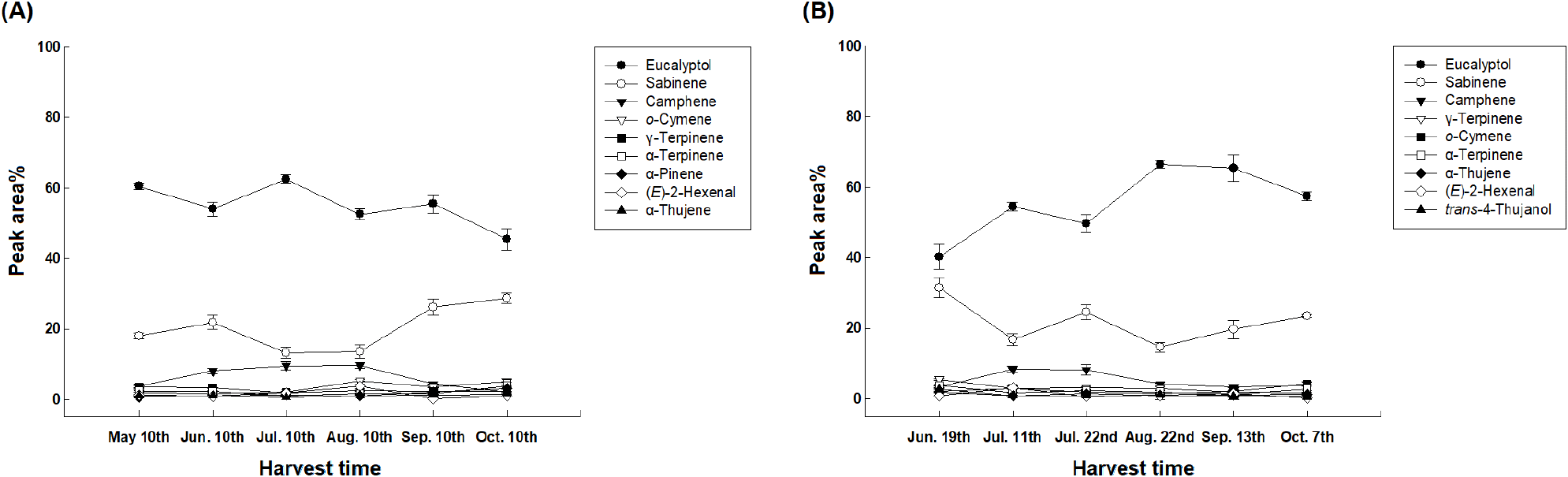
재배 큰비쑥의 휘발성 향기성분은 eucalyptol > sabinene > camphene > γ-terpinene > o-cymene > α-terpinene > α-thujene > (E)-2-hexenal > trans-4-thujanol의 순서로 차지하는 비중이 컸다. Eucalyptol은 6월에 40.21%로 가장 낮았다가 증감을 반복하고 66.54%로 8월에 가장 높고 가을(10월)까지 점차 감소하였다(40.21%→57.37%). Sabinene은 6월에 가장 높았고 이후 증감하다 8월에 14.58%로 가장 낮았으며 가을에 다시 증가하였고(31.49%→23.46%), camphene은 7월에 약 8.22%로 가장 높았으며 가을(10월)에 다시 감소하였다(3.33%→3.78%). γ-Terpinene은 여름(6월)부터 지속적으로 감소하여 가을(10월)에 가장 낮았다(5.45%→1.65%). o-Cymene은 2.01%로 6월에 가장 낮았으며 증감하다 개화 시기인 가을(10월)에 가까워질수록 점차 증가하였으며(2.01%→4.10%), α-terpinene은 여름(7월)에 3.68%로 가장 높았으며 증감을 반복하다 가을(10월)에 2.78%를 차지하였다(3.68%→2.78%).
자생 큰비쑥과 재배 큰 비쑥 모두 eucalyptol, sabinene, camphene, ο-cymene, γ-terpinene, α-terpinene이 약 90%를 차지하였으며 위 화합물들은 레몬 향기, 신선한 풀 냄새 등이 난다고 보고된 바 있어 큰비쑥 고유의 향에 기여하는 것으로 판단된다(Tietel et al., 2011). 또한, 항염증, 항균, 항암, 항통증 효과 등이 있다고 보고되었기 때문에 본 연구를 통해 큰비쑥이 가진 천연향료로써의 가치와 생리활성 물질의 존재까지 확인하였다.
4. 요약
국화과에 속하는 큰비쑥은 고유의 향기가 있고 녹백색을 띠는 염생식물이다. 큰비쑥의 생육 환경 및 시기별 이화학적 특성에 대한 연구는 진행되어 있지만 휘발성 향기성분에 대한 연구는 미흡한 실정이다. 따라서 큰비쑥의 휘발성 향기성분을 동정하여 천연향료로써의 가치를 확보하고 생육 환경 및 수확 시기별로 분석하여 생육 환경에 따른 생리기능적인 자료와 최적의 수확 시기를 확인하여 작물 이용성을 높이고자 본 연구를 진행하였다. 수확 시기별 자생 및 재배 큰비쑥의 휘발성 향기성분은 headspace법을 이용하여 GC-MS로 분석하였다. 25종의 monoterpene류, 3종의 sesquiterpene류, 4종의 ester류, 1종의 aldehyde류, 1종의 alcohol를 포함한 총 34종의 휘발성 향기성분이 분리동정되었다. 생육 환경에 따른 휘발성 향기성분은 유의한 차이가 없었으며, 자생 및 재배 큰비쑥의 휘발성 향기성분은 생육 초기인 봄에 증가하다가 무더운 여름에 감소하였으며 개화 시기인 가을에 크게 증가하는 경향을 보였다. 또한 자생 및 재배 큰비쑥의 주요 휘발성 향기성분은 eucalyptol, sabinene, camphene, ο-cymene, γ-terpinene, α-terpinene 등이다. 위 화합물들은 약 90% 정도 차지하였으며 레몬향, 풀 냄새 등이 나며 다양한 생리활성 효과가 있다. 결과적으로 본 연구를 통해 큰비쑥의 천연향료로써의 가치와 생리활성 물질의 존재를 확인하였으며 환경 관리와 수확이 수월한 재배 환경의 큰비쑥을 개화 시기인 9-10월에 수확하면 자생 큰비쑥에 비해 높은 수율의 휘발성 향기성분을 보다 수월하게 얻을 수 있을 것으로 생각된다.
