1. 서론
지구온난화와 대기 오염 문제로 인해 지속 가능한 에너지의 필요성이 대두되고 있다. 특히, 식량 낭비는 심각한 문제로 대두되고 있다. 유엔 식량농업기구(FAO)에 따르면, 매년 전 세계에서 소비되는 음식물의 약 3분의 1, 즉 약 13억 톤이 낭비되거나 손실된다 (FAO, 2011). 이러한 식량 폐기물로 인해 개발도상국에서는 약 6,800억 달러, 저소득 국가에서는 3,100억 달러의 경제적 손실이 발생하며, 이는 심각한 환경적, 사회적 문제를 초래한다(Hegnsholt 등, 2018).
감자는 세계 식량 안보에 중요한 역할을 하는 네 번째 주요 작물로, 2021년에는 전 세계적으로 약 3억 7,600만 톤이 생산되었다(Khanal 등, 2024). 감자를 가공하는 과정에서 발생하는 감자껍질은 연간 약 70-140천 톤에 이르며, 대부분이 매립되어 온실가스와 유독성 침출수를 발생시켜 환경에 부정적인 영향을 미친다(Chang, 2011; Khanal 등, 2024). 2030년까지 약 8,000천 톤의 감자껍질이 생성될 것으로 예상되며, 이로 인한 온실가스 배출량은 약 500만 톤의 이산화탄소에 달할 것으로 추정된다(Rodríguez-Martínez 등, 2023). 그러나 감자껍질은 총 고형물(total solids)의 50% 이상이 전분으로 구성되어 있으며, 이는 다른 식량 폐기물인 밀기울(9.10-38.9%)이나 맥주박(10-12%)보다 더 높은 전분 비율을 가진다(Jay 등, 2008; Martha, 2023; Onipe 등, 2015). 또한, 감자껍질은 섬유질과 단백질 함량도 적절히 포함하고 있어 바이오에탄올 생산에 필요한 발효 미생물의 성장과 효소 활성에 긍정적인 영향을 미칠 수 있다(Mushtaq 등, 2024; Soni 등, 2023). 따라서 감자껍질을 활용한 바이오에탄올 생산은 음식물 쓰레기를 줄이는 동시에 화석연료 대체 에너지로 활용될 수 있다.
화석연료의 과도한 소비로 인한 지구온난화와 에너지 가격 상승은 대체 에너지원으로서 바이오연료의 중요성을 부각시키고 있다. 이는 생물학적, 화학적 공정을 통해 바이오매스에서 생산되는 연료로 경제의 지속 가능한 발전에 기여할 수 있는 핵심 재생 에너지 운반체로 여겨진다(Ntaikou 등, 2020). 그 중 바이오에탄올과 그 혼합물은 운송 분야에서 대체 액체 연료로 널리 사용되고 있으며, 단독으로 사용하거나 화석 연료나 바이오디젤과 혼합하여 활용된다. 이러한 혼합물은 연소 특성을 더욱 향상시키는 장점이 있다(Teoh 등, 2019). 바이오에탄올은 주로 당질, 전분, 또는 섬유소 기반 바이오매스를 원료로 하여 생물공정을 통해 생산된다(Wang 등, 2023). 특히, 순수 바이오에탄올(E100)은 화석연료 기반 가솔린에 비해 CO2 배출량이 약 60% 적어, 지속 가능한 에너지 전환에 중요한 역할을 한다(Rimkus 등, 2024). 따라서 감자껍질을 활용한 바이오에탄올 생산은 음식물 쓰레기를 줄이는 동시에 화석연료 대체 에너지로 활용될 수 있다. 더불어, 감자껍질은 별도의 재배 과정 없이 식품 가공의 부산물로 얻을 수 있어 원료 비용이 매우 낮으며, 기존 경작지 기반 원료와 달리 환경적 부담(물 사용, 비료 투입 등)을 최소화할 수 있다.
전분으로부터 바이오에탄올을 생산하는 공정은 일반적으로 당화와 알코올 발효 과정을 거친다(Jang과 Chou, 2013). 당화는 산이나 효소를 이용해 진행되며, 강산을 이용한 당화는 장비의 부식 문제와 비용이 높다는 단점이 있지만, 효소 당화법은 효소의 가격이 비싸고 반응 시간이 길다는 한계가 있다(Yan 등, 2017). 이러한 문제를 해결하기 위한 방법 중 하나로 동시당화발효가 있다(Pinaki 등, 2015). 동시당화발효(simultaneous saccharification and fermentation, SSF) 공정은 효소에 의한 전분이나 셀룰로스의 가수분해(당화)와, 가수분해 과정에서 생성된 당의 발효를 하나의 반응기에서 동시에 진행하는 효율적인 바이오연료 생산 방법이다. 이 공정은 별도로 진행되는 당화와 발효를 결합함으로써 두 단계 사이의 간섭을 줄이고, 에너지와 시간 소비를 최소화할 수 있다(Olofsson 등, 2008). 최근에는 SSF 공정을 더욱 효율화하기 위한 연구가 진행되고 있다. 예를 들어, Petlyuk 시스템과 같은 공정 집약화 기술을 SSF에 도입하여, 기존보다 에너지 소비를 약 30% 감소시키는 데 성공하였다. 이러한 발전은 SSF 공정이 바이오연료 생산의 에너지 효율성과 비용 절감 측면에서 중요한 잠재력을 지니고 있음을 보여준다(García-Hernández 등, 2024). 동시당화발효는 당화와 발효를 하나의 공정으로 통합함으로써 반응 효율을 높이고 비용을 절감할 수 있지만, 당화와 발효의 최적 조건이 상이해 이를 조정하는 데 어려움이 있다. 동시당화발효의 주요 한계는 바이오매스 가수분해에 필요한 효소의 최적 온도(45-50°C)와 발효를 담당하는 미생물의 최적 온도(30°C)가 서로 다르다는 점이다(Choudhary 등, 2016).
일반적으로 종간 또는 종내의 유전적 특성을 결합하기 위해 사용된 유전적 기술인 Protoplast Fusion(원형질체 융합)은 세포벽을 제거하여 생성된 원형질체(protoplast)를 이용해 서로 다른 세포의 세포막을 융합시키는 과정이다(Goda 등, 2024; Sharma 등, 2021a). 이는 균주의 유전적 성질을 개선하는 생명공학적 기술로, 다양한 대사산물 생산과 환경 스트레스 내성 향상에 기여해 왔다(Sharma 등, 2021a; Zhao 등, 2024). 특히, Saccharomyces cerevisiae는 에탄올 생산에서 널리 사용되는 미생물이지만 전분 분해 효소가 부족하여 전분 활용에 한계가 있다(Viktor 등, 2013). 이를 해결하기 위해 전분 분해 효소를 가진 Saccharomycopsis fibuligera와 S. cerevisiae의 Protoplast Fusion이 효과적인 방법으로 고려된다. S. fibuligera는 α-amylase와 glucoamylase와 같은 전분 가수분해에 필수적인 효소를 보유하고 있어, 전분을 빠르게 분해하여 발효 가능한 당을 생성할 수 있다(Natalia 등, 2011; Xie 등, 2021). 이로 인해 S. cerevisiae가 에탄올 발효를 위해 필요한 발효성 당을 즉시 사용할 수 있게 되어 발효 공정의 효율성을 높인다. 선행 연구에서는 이 두 균주를 공배양한 발효 과정에서 각각 이론적 수율의 88%와 90%에 해당하는 높은 에탄올 생산성이 보고된 바 있다(Abouzied와 Reddy, 1987; Piršelová 등, 1993). 이러한 결과를 바탕으로, 두 균주의 특성을 결합한 Protoplast Fusion을 통해 공배양에서 확인된 이점을 기반으로 활용할 수 있을 것으로 기대된다. Protoplast Fusion 기술은 전분 기반 기질의 효율적 활용뿐만 아니라 발효 시간 단축과 에탄올 생산성 향상에도 기여할 수 있는 가능성을 제시한다.
본 연구에서는 두 균주를 융합하여 감자껍질을 활용한 동시당화발효 과정에서 최적의 효율을 발휘할 수 있는 새로운 균주를 개발하고, 이를 통해 발효 시간 단축, 효소 사용 비용 절감, 에탄올 수율 향상을 동시에 달성할 가능성을 탐구한다. 이러한 접근은 감자껍질의 효과적인 바이오에탄올 전환을 통해 바이오연료 생산 공정의 효율성을 높이고, 지속 가능한 에너지 생산에 기여하고자 한다.
2. 재료 및 방법
본 연구에서 사용된 균주는 경상북도 청도의 복숭아에서 분리된 S. cerevisiae Cheongdo(gup1Δ #2)(Jeong 등, 2018)와 누룩에서 분리된 S. fibuligera NK6이다. 두 균주는 2% 포도당 (Duksan Pure Chemicals Co., Ltd., Ansan, Korea)를 포함한 yeast peptone dextrose agar medium(YPD)[1% yeast extract (Becton, Dickinson and Company, Franklin Lakes, NJ, USA), 2% g/L peptone(Becton)]에 접종 후 30°C, 250 rpm에서 24시간 동안 전배양되었다. 이후 돌연변이 균주를 분리하기 위해 각각의 균주를 8% ethanol(Sigma-Aldrich Co. LLC., St. Louis, MO, USA)이 포함된 YPD agar와 2% soluble starch(Sigma-Aldrich Co. LLC.)가 포함된 yeast peptone starch agar medium 배지(YPS)에서 30°C, 2일 동안 배양하여 실험에 사용하였다. 이는 S. cerevisiae의 에탄올 내성과 S. fibuligera의 전분 대사 능력이 결여된 돌연변이를 제거하기 위한 과정이다.
Protoplast Fusion 이전에 균주의 표현형을 비교하기 위해 35%의 고농도 포도당을 포함한 YPD 배지를 사용하여 에탄올 생성 능력을 평가하였다. 35%의 포도당은 이론적으로 최대 178.5 g/L의 에탄올을 생성할 수 있다. 또한, 전분 분해 능력을 평가하기 위해 단일 탄소원으로 전분만을 제공하여 세포 성장과 에탄올 생성을 확인하였다. 이를 위해 30% 전분을 포함한 YPS 배지를 단일 탄소원으로 사용하여 배양한 후, 균주의 표현형을 분석하였다. 전배양된 균주는 멸균 증류수에 3회 세척한 후 5 mL에 1.5×107 CFU/mL로 맞추어 접종하였고, 30°C, 250 rpm(BF–30SI, BioFree, Seoul, Korea)에서 72시간 배양하였으며 24시간 간격으로 분석을 진행하였다. 전분 분해 효소(amylase) 활성을 확인하기 위해 YPS agar 배지[3% soluble starch, 1% yeast extract, 2% peptone, 2% agar(Becton)]에 효모 배양액을 1 mL 분주한 후 30°C에서 2일 동안 배양하였다. 이후 요오드 용액으로 염색하여 clear zone을 확인하였다(Lee 등, 2011). 이후 에탄올 생산 수율은 방정식 (1), (2), (3)을 통해 계산하였다. 여기서 이론적인 에탄올 수율은 포도당의 알코올 발효에 대한 Guy-Lussac 화학 방정식에 따라 0.51 g/g 당으로 가정되었다(Ntaikou 등, 2020).
Protoplast Fusion은 SH Choi 방법(Choi 등, 1997)을 변형하여 실시하였다. 두 균주는 YPD 액체 배지에 접종 후 30°C, 250 rpm에서 16시간 배양한 후 세척하여 1% 2-mercaptoethanol (Sigma-Aldrich Co. LLC.)이 포함된 반응 완충액(10 mM sodium phosphate buffer, 0.1 mM EDTA, 0.8 M sorbitol, pH 7.4)에 현탁하였다. 이후 0.01-0.1 mg/mL Zymolyase-20T(Zymo Research Corp., Irvine, CA, USA)를 1 μL/500 μL 농도로 사용하여 30°C에서 60분간 효소 처리를 통해 세포벽을 제거하였다. 원형질 상태의 두 균주는 Polyethylene Glycol(PEG) 4000 40%(Sigma-Aldrich Co. LLC.), 0.5 M KCl, 40 mM CaCl이 포함된 pH 7.5 융합 완충액에서 1:1 비율로 혼합한 후 30°C에서 20분 동안 처리하였다. 이후 PEG가 없는 융합 완충액(0.5 M KCl, 40 mM CaCl)으로 세척한 후, 제조된 배지에 혼합액을 1 mL 도말하여 30°C에서 3일간 배양하여 균주의 생육 여부를 확인하였다.
융합 유도 배지에서 우수한 성장을 보인 colony를 선별하여 전배양한 후, 2%의 soluble starch가 포함된 YPS 배지에서 30°C, 250 rpm 조건으로 48시간 배양하였다. 배양 후 흡광도(OD 600 nm)는 spectrophotometer(Optizen Nano, KLAB, Daejeon, Korea)로 측정하여 균주의 생장곡선을 확인하였으며, 성장이 우수한 균주 9종을 선별했다. 선별된 균주 에탄올 생성이 뛰어난 균주를 선정하기 위해 각각 전분(2% soluble starch)과 35%의 고농도 포도당을 단일 탄소원으로 사용하여 YPS 및 YPD 액체 배지에서 30°C, 250 rpm 조건으로 3일간 발효하였다. 발효 과정 중 균주의 성장과 에탄올 생산 능력을 24시간 간격으로 분석하였으며, 이를 바탕으로 최종적으로 전분 활용 능력과 에탄올 생성능이 우수한 균주를 선정하였다.
본 연구에서는 대구 북구 산격동의 식당에서 수집한 감자껍질을 사용하였다. 감자껍질을 깨끗이 씻어 Dry oven[ThermoStable OF-105(DAIHAN Scientific, Wonju, Gangwon, Korea)]에서 60°C, 48시간 건조 후 분말로 만들어 사용하였다. 감자껍질 (2% 또는 5%)에 0.2% yeast extract, 0.06% MgCl2, 0.0001% MnSO4 · 7H2O, 0.01% CaCl2 · 2H2O(모두 Sigma-Aldrich Co. LLC.), 1% w/v Tween 80(Duksan Pure Chemicals Co., Ltd., Ansan, Korea)을 혼합한 후 1 N HCl을 이용해서 pH 5.5±0.3으로 조정하고 121°C에서 15분 동안 열처리하였다. 30°C, 250 rpm에서 24시간 동안 전배양한 효모를 멸균 증류수에 3회 세척한 후 1.5×107 CFU/mL로 맞추어 접종하였다. 효소 활성과 에탄올 생성을 최적화 하기 위해 발효는 34°C, 80 rpm 조건에서 5일간 진행되었다. 발효 조건과 배양 배지는 Gonzalez 등(2008)의 연구를 참고했다. 12시간 또는 24시간 간격으로 환원당 및 에탄올 생성을 분석하였으며, 모든 발효는 3회 반복으로 수행되었다.
융합체 #20과 S. cerevisiae의 낮은 amylase 활성을 보완하기 위해 효소를 보충한 실험에서는 위와 동일한 조건에 효모 접종 시 α-amylase와 glucoamylase가 첨가되어 있는 주정용 정제효소(Chungmu Fermentation, Ulsan, Korea)나 α-Amylase from Aspergillus oryzae(Sigma-Aldrich Co. LLC.)를 0.5%씩 첨가하였다. 발효 조건도 위와 동일하였다.
모균주와 융합체의 α-amylase 활성은 DNSA(dinitrosalicylic acid) 방법을 사용하여 환원당 농도를 측정하였다(Miller, 1959). 효소 용액으로는 2%의 포도당이 포함된 YPD 배지에서 효모를 72시간 동안 전배양한 후 13,000 ×g, 10분동안 원심분리(mySPINTM 6, Thermo Fisher Scientific, Waltham, MA, USA)하여 cell을 제거한 상등액을 사용하였다. 0.9 mL의 0.05 M 인산염 완충 용액(pH 8.0), 0.1 mL의 효소 용액, 1.0 mL의 1% soluble starch 용액을 혼합하여 65°C에서 10분간 반응을 진행하였다. 반응을 종료하기 위해 1 mL의 DNSA 용액을 첨가한 후 혼합물을 100°C에서 10분간 가열하였다. 이후 혼합물의 흡광도를 540 nm에서 측정하였으며, 포도당을 표준물질로 사용하여 표준곡선을 작성하였다. α-amylase 활성은 1분 동안 1 μmol의 포도당을 방출하는 효소의 양을 1단위(unit)로 정의하여 계산하였다(Kim 등, 2019).
발효 특성 분석을 위한 포도당 및 에탄올 농도는 Refractive Index Detector가 장착된 high-performance liquid chromatography (HPLC, 1260 Series, Agilent Technologies, Santa Clara, CA, USA)를 사용하여 정량 분석하였다. 포도당과 에탄올(모두 Sigma-Aldrich Co. LLC., St. Louis, MO, USA)의 정량 분석을 위해 각 표준물질을 0.1, 0.2, 0.5, 1.0, 2.0 g/L의 농도로 제조한 후, HPLC를 이용하여 분석하였다. 측정된 농도와 면적(area) 값을 바탕으로 표준곡선을 작성하였으며, 이를 활용하여 시료의 정량 분석을 수행하였다. 분석을 위한 샘플은 24시간마다 채취하였으며, 10배 희석 후 13,000 ×g, 10분 동안 원심분리 하여 상층액을 수집하였다. 분석 전 추가적으로 0.2 μm 시린지 필터(Hyundai Micro Co., Ltd., Anseong, Korea)를 이용하여 여과하였다. 컬럼은 Rezex ROA-Organic Acid H+(8%) (Phenomenex Inc., Torrance, CA, USA)를 사용하였으며, 이동상은 0.005 N H2SO4(pH 2.8)로 50°C에서 0.6 mL/min 속도로 분석하였다.
3. 결과 및 고찰
S. cerevisiae Cheongdo(SC)와 S. fibuligera NK6(SF)의 동시당화발효(SSF) 효모균주로서의 적합성을 평가하기 위해 전분 또는 포도당을 단일 탄소원으로 설정하여 발효 실험을 진행하였다. 350 g/L 포도당 조건에서 SC는 48시간 이내에 포도당을 모두 소모(Fig. 1A)하며 148.14 g/L의 에탄올을 생성해 높은 에탄올 생성 능력(Fig. 1B)을 보여주었다. 이는 포도당 대비 에탄올 생산 수율로 환산하면 약 82.83%이다. 반면, SF는 72시간 동안 약 110 g/L의 포도당만 소모하였고 72.74 g/L의 에탄올을 생성하였다.
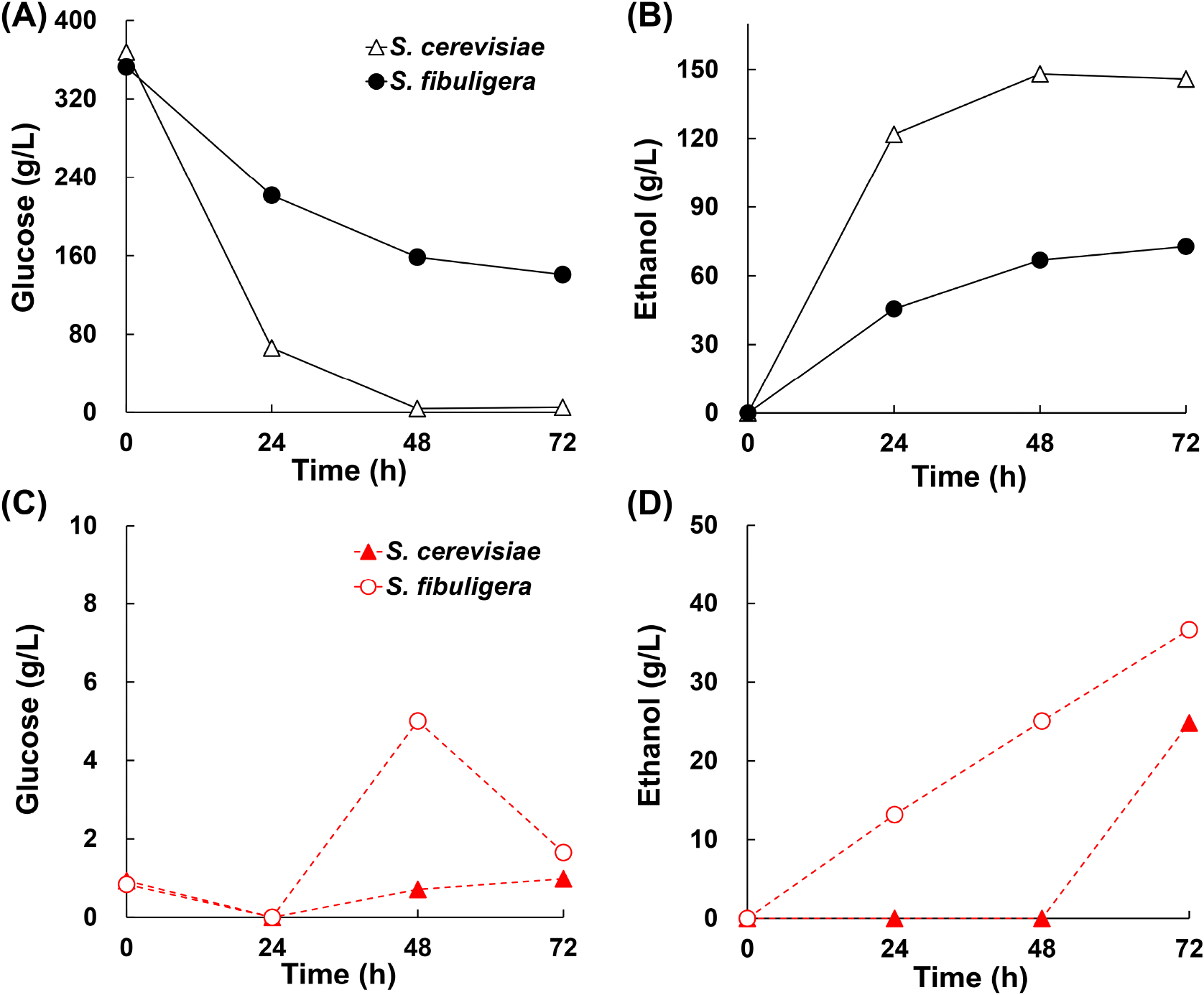
전분을 단일 탄소원으로 한 발효에서는, amylase 활성이 있는 것으로 알려진 SF가 72시간 동안 최대 36.66 g/L의 에탄올을 생성한 반면, SC는 48시간까지 에탄올을 생성하지 않다가 72시간에 24.82 g/L의 에탄올을 생성하였다(Fig. 1D). 전분을 분해하여 생성한 포도당 또한 SF에서 SC보다 더 많은 양을 생산한 것을 확인할 수 있었다. 이를 전분 대비 에탄올 생산 수율로 환산하면 약 21.54%이다. 요오드-녹말 반응을 통한 clear zone 실험에서는 SF에서만 clear zone이 확인되었으며, SC에서는 확인되지 않았다. 이를 통해 SC는 높은 에탄올 생산 능력을 가지고 있으나 전분 분해 능력이 부족하고, SF는 전분을 분해하는 능력이 우수하지만 높은 농도의 에탄올을 생산하지 못함을 확인할 수 있었다.
SSF용 균주를 개발하기 위해 SC와 SF를 Protoplast Fusion 기법을 이용하여 융합하였다. 융합 여부는 100 μg/mL clonnat이 포함된 YPS 배지에 도말 후 3일간 배양하여 확인하였다. 그 결과 6개의 배지에서 약 40개의 colony가 형성되었으며, 이는 선행 연구(Choi 등, 1997)와 일치하게 SC와 유사한 표현형을 보였으나 YPS에서 우수한 성장을 확인할 수 있었다. 이후 성장이 우수한 27개의 colony를 선별하고, 단일 콜로니 분리를 거쳐 연구에 사용하였다.
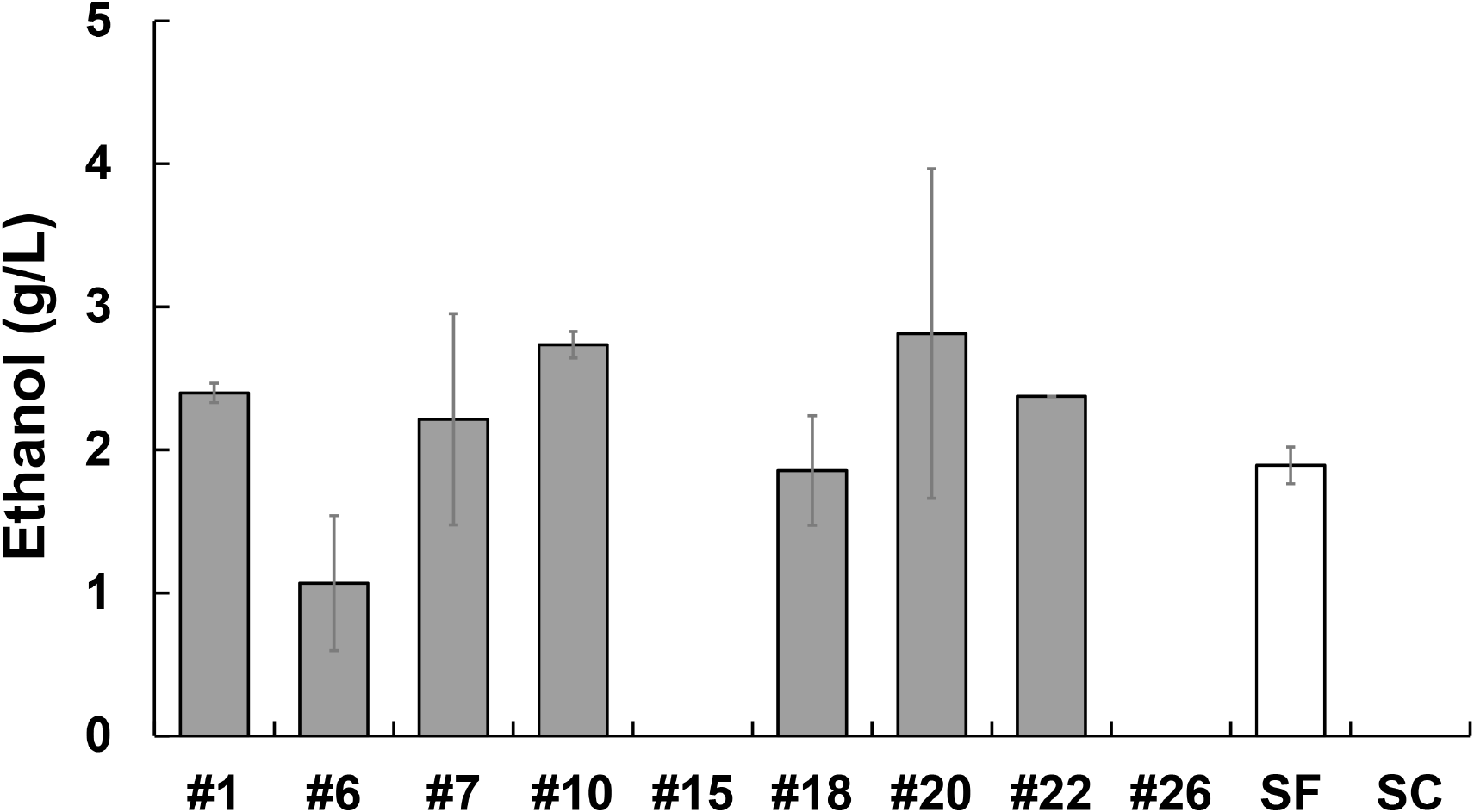
선별된 27개의 융합체와 SC, SF를 YPS에 접종하여 OD600을 통해 성장을 비교한 결과, 48시간 동안 OD 0.1에서 1.2 이상의 성장을 보인 9개의 균주(#1, #6, #7, #10, #15, #18, #20, #22, #26)를 선별하였다. 전분과 포도당을 각각 단일 탄소원으로 설정하여 에탄올 발효 능력을 비교한 결과, 전분 발효 조건(Fig. 2A와 2B)에서 9개 중 4개의 균주가 모균주보다 높은 에탄올 생산능을 보였다. 특히 #20 균주는 48시간 내에 약 2.8 g/L의 최대 에탄올 생성량에 도달하여 다른 균주들보다 발효가 빠르게 진행되었다(Fig. S1). 이는 발효 시간 단축을 통해 생산 효율을 극대화할 수 있는 잠재력을 보여준다. 3일차에도 3.7 g/L의 에탄올을 생성하며 #7 균주를 제외하고 다른 융합체 및 SC보다 높은 결과를 보였다.
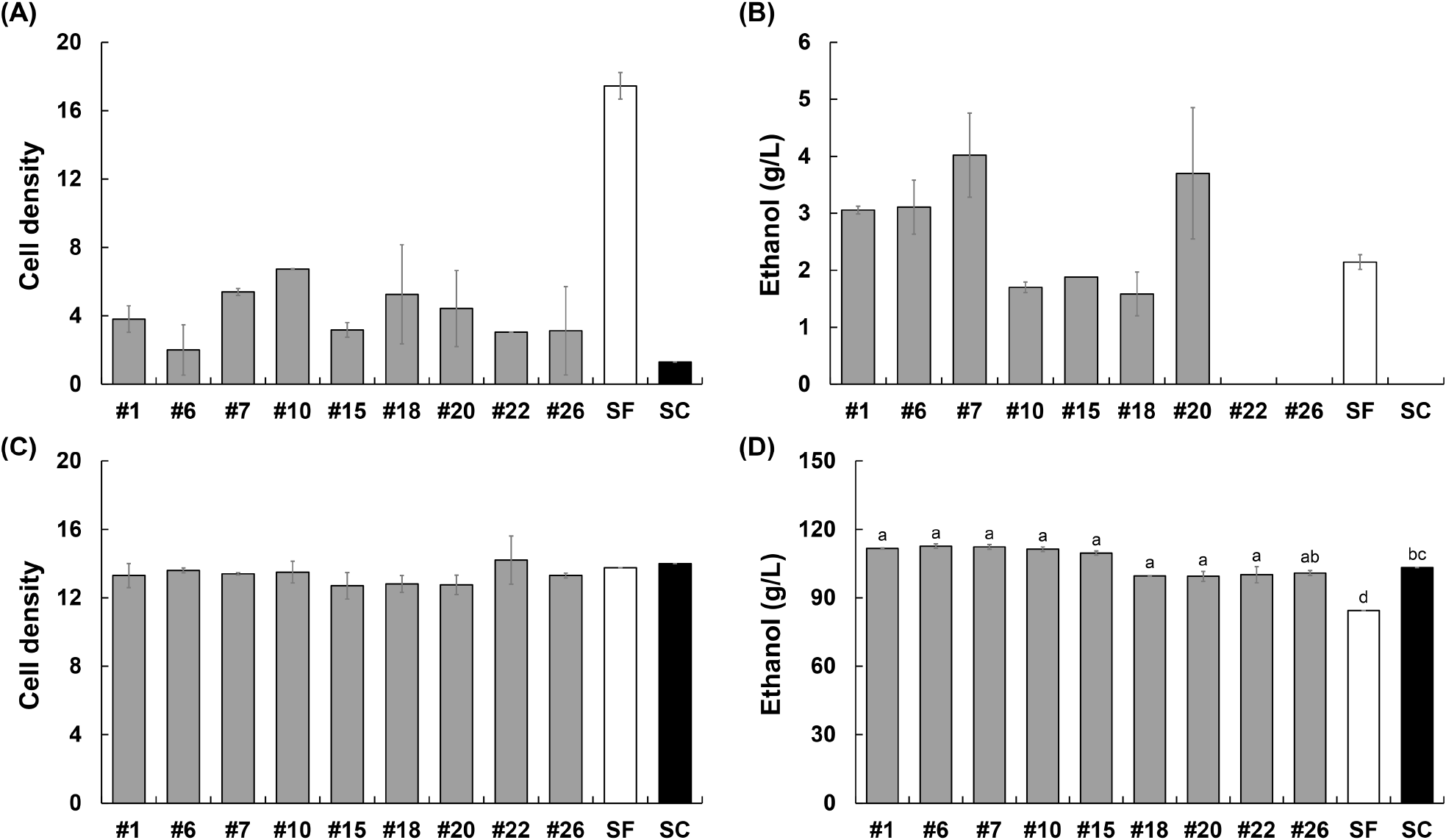
포도당 발효 조건(Fig. 2C와 2D)에서는 SF를 제외한 모든 균주가 유사한 에탄올 생산성을 보였다. 이 결과를 바탕으로 여러 우수한 균주 중에서 빠른 발효 속도와 높은 에탄올 생산성을 특징으로 하는 #20 균주를 대표 균주로 선정하였다.
융합체는 전분을 탄소원으로 사용할 수 있으므로, 감자껍질을 물로 세척한 후 열수 처리하여 발효에 활용하였다. 기존 화학적 전처리를 생략하여 간단한 절차로 진행되었으며, 이를 통해 비용과 시간을 절감할 수 있었다. 각각 2%와 5%의 감자껍질이 첨가된 배지(solid loading 조건)에서 모균주와 융합체의 발효 특성을 비교하였다. 2% 조건에서는 융합체 #20이 1.69 g/L의 에탄올을 생성하여 SF(1.47 g/L)보다 약 14.89%, SC (1.03 g/L)보다 약 63.64% 높은 생산성을 보였다(Fig. 3A). 반면, 5% 조건에서는 #20이 4.03 g/L의 에탄올을 생성하며 SF (4.74 g/L)보다 낮은 결과를 보였으나, SC(3.24 g/L)보다 약 24.26% 더 높은 에탄올 생산성을 나타냈다(Fig. 3B).
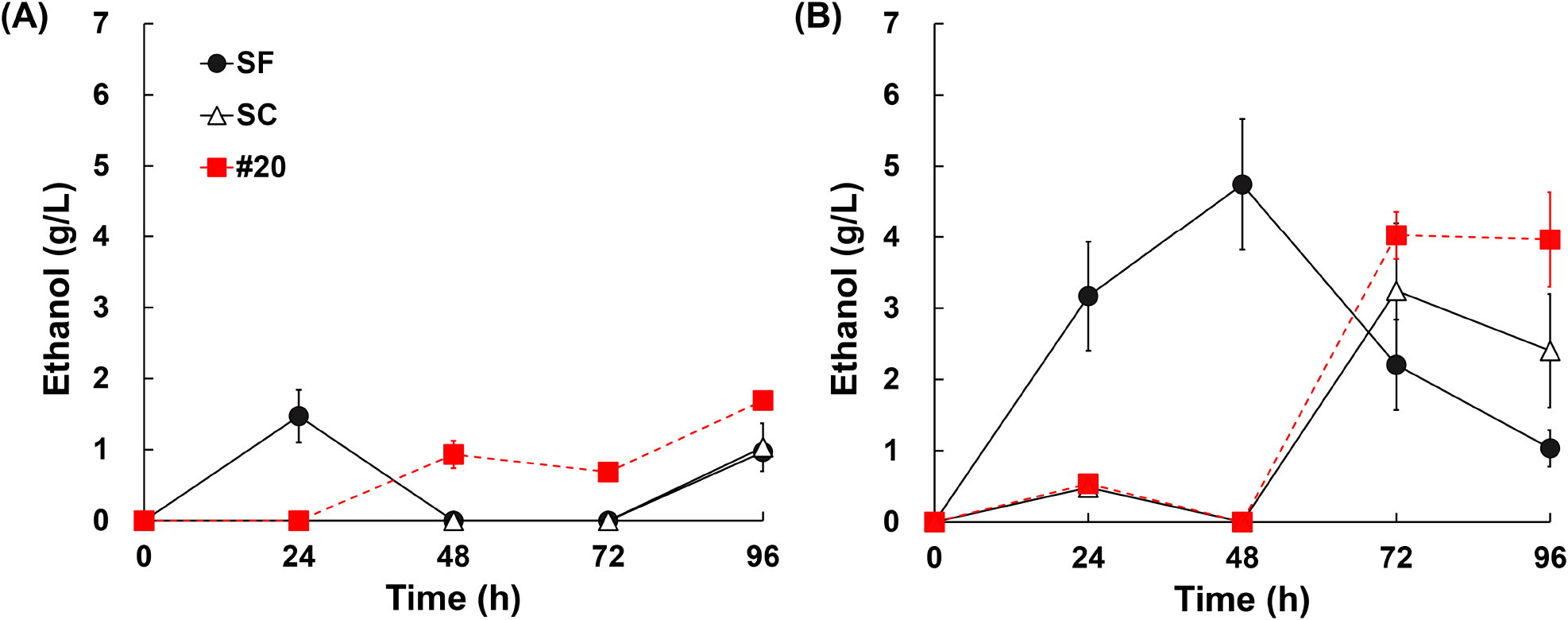
Fig. 3에서 확인할 수 있듯이, 2% 조건에서는 융합체 #20이 SF와 SC에 비해 전체 발효 기간 동안 안정적인 에탄올 생산성을 보였다. 그러나 5% 조건에서는 SF가 #20보다 에탄올을 더 많이 생산하며, 초기 48시간 내에서 더 빠르게 생산되는 경향을 보였다. 이러한 결과는 SF가 높은 기질 농도에서 더 효과적으로 발효를 수행할 수 있음을 시사한다. 선행 연구에서는 S. cerevisiae(SC)가 전분 기반 발효에서 외부 효소 보충 없이는 발효가 어렵다고 보고되었으나(Van Zyl 등, 2012), 본 연구에서 개발된 융합체 #20은 효소 보충 없이도 전분 기반 발효에서 SC를 능가하는 성능을 보였다. 이는 융합체 #20이 기존 균주에 비해 전분 기반 기질을 효율적으로 활용할 수 있는 잠재력을 가지고 있음을 나타낸다. 융합체 #20의 높은 성능은 S. fibuligera와 S. cerevisiae의 특성을 결합한 protoplast fusion 기술의 효과를 입증한다. S. fibuligera가 amylase를 활용해 전분을 빠르게 가수분해하고 발효 가능한 당을 공급함으로써 S. cerevisiae가 발효 과정을 효율적으로 진행할 수 있도록 도왔으며, 융합체 #20은 이러한 특성을 바탕으로 전분 기반 발효 효율을 극대화하였다. 선행 연구에서도 두 균주의 공배양이 높은 에탄올 생산성을 보인 사례가 보고된 바 있으며(Abouzied와 Reddy, 1987; Piršelová 등, 1993), 본 연구에서는 protoplast fusion을 통해 공배양에서의 이점을 더욱 강화한 결과를 확인하였다.
다만, 5% 조건에서 발효 능력이 저하된 것은 선행 연구에서 알려진 바와 같이 solid loading이 증가하면서 발효 억제제가 함께 증가했기 때문일 가능성이 있다(Sharma 등, 2021b). 이러한 억제제는 고농도 기질 조건에서 미생물의 대사 활동을 방해하며 발효 효율을 저하시킬 수 있다. protoplast fusion을 통해 생성된 융합체는 발효 억제제에 대해 더 낮은 내성을 보이는 것으로 보고되었으며(Hou와 Yao, 2012), 이로 인해 고농도 조건에서 융합체 #20의 발효 성능이 감소했을 가능성이 있다. 이러한 결과는 고농도 기질 조건에서 발효 성능을 개선하기 위해 융합체 설계와 대사 경로를 최적화하는 노력이 필요함을 시사한다. 이를 해결하기 위한 방법으로는 여러 가지 접근법이 제안될 수 있다. 첫째, 발효 미생물의 내성을 강화하기 위해 적응진화를 수행하는 방법이 있다. 예를 들어, 발효 환경에 적응한 내성 균주를 개발하면 억제제의 영향을 줄일 수 있다(Pan 등, 2015). 둘째, 발효 억제제가 포함된 가수분해물을 화학적 또는 물리적 방법으로 처리하여 억제제를 제거하거나 농도를 낮추는 방법이 있다. 이러한 처리는 발효 효율성을 높이는 데 효과적이다(Potumarthi 등, 2008). 셋째, 내성을 개선하기 위해 새로운 유전자 조합을 식별하고 이를 적용하는 전략도 유망하다. 이를 통해 억제제가 포함된 기질에서도 안정적인 발효가 가능해질 수 있다(Brandt 등, 2021). 이와 같은 전략들은 발효 공정에서 나타나는 주요 한계를 극복하고 생산성을 향상시키는 데 중요한 역할을 한다.
전분 발효 결과(Fig. 2A, 2B, 3)에 따르면, 융합체가 최대 에탄올을 생성하기까지 2-4일이 소요되었다. 이는 초기 단계에서 α-amylase의 활성이 충분히 발휘되지 않아 전분의 분해 속도가 느려지고, 이를 발효 가능한 당으로 전환하는 데 시간이 더 필요했기 때문으로 보인다. 초기 α-amylase 활성의 부족은 전분 분해 과정에서 효소 반응 속도를 제한하는 주요 요인으로 작용했으며, 이로 인해 에탄올 생산 속도가 지연된 것으로 판단된다 (Murthy 등, 2011). SSF에 사용된 균주들의 α-amylase 활성을 측정한 결과(Fig. 4), SF에서 1.52 U/mL로 가장 높은 활성이 나타났으며, 이는 전분 가수분해를 통한 말토덱스트린 생성이 가장 빠르게 진행되었음을 의미한다. 따라서 최대 에탄올도 가장 빠르게 도달한 것을 확인할 수 있다. 융합체 #20은 1.49 U/mL의 α-amylase 활성을 보였으며, 이는 SF보다는 낮았지만 SC(0.80 U/mL)와 비교하면 높은 활성이었다. 다만, α-amylase 활성은 초기 발효 속도를 빠르게 도와주지만, maltose를 분해하지 못해 완전한 전분 분해는 이루어지지 않는다(Henson 등, 2020). 따라서 이러한 한계로 느린 발효 경향을 보인 것으로 판단된다.
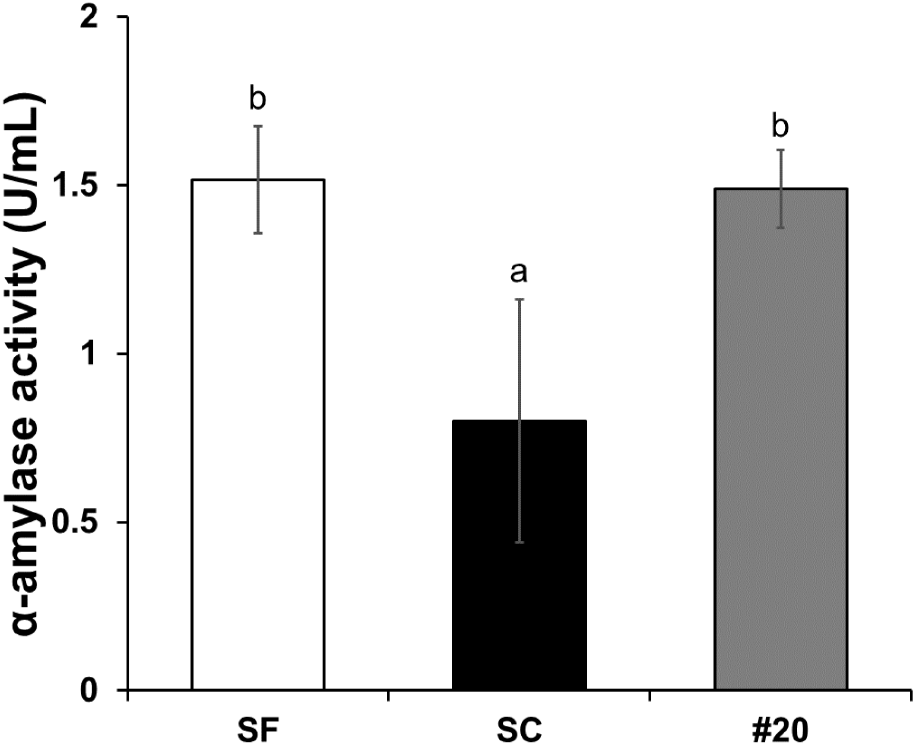
본 연구에서 확인한 α-amylase 활성은 일반적으로 선행 연구에서 보고된 활성보다 낮은 경향을 보였다. 예를 들어, Sandhu 등(1987)은 S. fibuligera의 α-amylase 활성을 6.56 U/mL로 보고하였으며, 이는 본 연구에서 관찰된 융합체 #20의 1.49 U/mL보다 훨씬 높은 값이다. Liu 등(2011)은 S. fibuligera A11이 41.26 U/mg cell dry weight(CDW)의 α-amylase 활성을 나타낸다고 보고했는데, 이를 1 mL 배양액이 1 g CDW를 포함한다고 가정하면 약 41,260 U/mL에 해당하는 매우 높은 활성을 의미한다. 반면, Gonzalez 등(2002)의 연구에서는 0.4 IU(약 0.8 U/mL)로 비교적 낮은 활성이 관찰되었다.
이처럼 선행 연구에서도 α-amylase 활성 값에 큰 차이가 나타나는데, 이는 주로 S. fibuligera 균주들의 특성과 실험 조건에 따라 달라질 수 있다. 본 연구의 융합체는 SF와 SC의 특성을 결합한 형태로, SF보다는 낮지만 SC보다는 높은 활성을 보여 이들 특성 간의 절충적인 형태를 띠는 것으로 판단된다. 특히 융합체의 α-amylase 활성은 초기 발효 속도를 높이는 데는 기여했으나, maltose를 완전히 분해하지 못하는 한계로 인해 발효 속도가 느려지는 결과를 초래한 것으로 보인다.
융합체의 낮은 α-amylase 활성을 보완하기 위해 α-amylase를 보충하여 감자껍질 발효를 진행하였다. 효소를 보충한 조건에서 발효 속도가 증가하여 2일차에 최대 에탄올 생산을 기록하여 최대 에탄올 생산 시간을 단축시켰다. 이는 α-amylase 보충이 전분의 가수분해를 가속화함으로써 초기 발효 속도를 개선한 결과로 해석된다.
최대 에탄올 생산량을 비교하면, SF는 가장 낮은 8.62 g/L의 에탄올을 생산했다. 반면, SC는 α-amylase와 glucoamylase를 함께 넣은 조건에서 10.74 g/L의 에탄올을 생산하여 α-amylase만 넣은 조건(9.77 g/L)보다 약 10% 높은 생산량을 보였다. 융합체 #20은 10.87 g/L로 SC를 넘어서는 에탄올을 생산하였으며, 이는 SC 대비 약 1.2% 더 높은 결과를 보여주었다(Fig. 5).
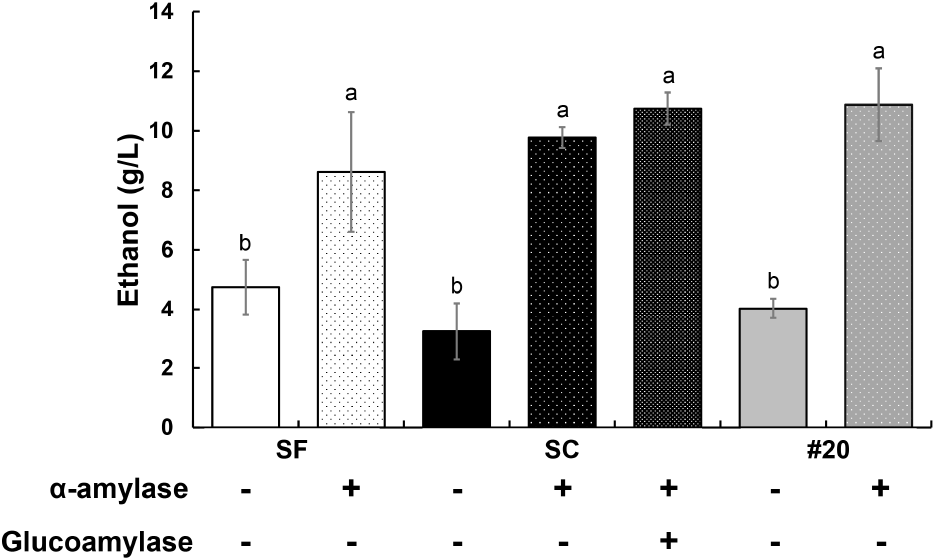
선행 연구에서는 감자껍질 6% 조건에서 산분해와 Ternamyl, Viscozyme, Celluclast의 효소 조합을 처리하여 총 7.58 g/L의 에탄올을 생성하였다고 보고되었다(Arapoglou 등, 2010). 이에 비해 본 연구의 융합체 #20은 감자껍질 5%, α-amylase 보충 조건에서 10.87 g/L의 에탄올을 생성하여 43% 이상의 높은 생산성을 보였다. 이러한 결과는 융합체 #20이 기존 연구 대비 효소 사용량과 발효 효율성 측면에서 우수한 잠재력을 가지고 있음을 나타낸다.
이러한 결과는 융합체 #20이 기존 균주에서 부족했던 효소 조합의 균형을 개선하여 전분 기반 발효 효율을 향상시킬 수 있음을 보여준다. 특히, α-amylase 보충을 통해 발효 시간이 단축되고 에탄올 생산성이 극대화되어 대규모 공정에서도 활용 가능성을 나타낸다. 더불어, glucoamylase 사용량을 줄이면서 효율적인 발효 공정을 구현할 수 있어 상업적 측면에서 비용 절감과 생산성 향상을 동시에 실현할 수 있는 잠재력을 입증하였다.
4. 요약
본 연구는 지구온난화와 대기 오염을 줄이기 위한 지속 가능한 에너지원으로서 식량 폐기물 활용의 가능성을 평가하였다. 특히, 식량 폐기물 중 하나인 감자껍질을 바이오에탄올 생산의 원료로 활용하기 위해 Saccharomyces cerevisiae와 Saccharomycopsis fibuligera의 protoplast fusion을 통해 융합 균주를 개발하였다. 감자껍질의 주요 성분인 전분을 효율적으로 당화하고 발효하기 위해 동시당화발효(SSF)를 적용하였으며, 최적 발효 조건과 α-amylase 보충을 통해 융합체의 에탄올 생산성을 평가하였다. 그 결과, 융합체 #20은 전분 및 포도당 기반 발효에서 높은 에탄올 생산 효율을 나타냈으며, 2% 전분 기반 발효에서 SF 대비 약 14.89% 높은 1.69 g/L의 에탄올을 생산하였으며, SC 대비 약 63.64% 높은 결과를 보였다. 특히 α-amylase 보충 시 최대 10.87 g/L의 에탄올을 생산하여 glucoamylase 사용량을 줄이고 효소 비용을 절감할 수 있는 가능성을 보여주었다. 이를 통해 감자껍질을 원료로 활용한 SSF 공정이 바이오에탄올 생산의 유망한 대체 에너지원으로 평가될 수 있음을 확인하였다.