1. 서론
세포막의 중요한 구성 요소인 인지질은 식품에서 식품첨가물뿐만 아니라 건강 보조 식품 및 기능성 식품의 원료로 널리 사용되고 있다. 인지질의 종류로는 포스파티딜콜린(PC), 포스파티딜에탄올아민(PE), 포스파티딜세린(PS), 포스파티딜이노시톨(PI) 등이 있으며, 이들은 각각 고유한 생리적 기능을 갖는다. 포스파티딜콜린(PC)과 포스파티딜에탄올아민(PE)은 뇌 건강 증진, 항염증 작용 등으로 요구되는 기능성을 제공하며(Bahn 등, 2005; Clarke, 2007), 다양한 기능성 제품에 활용된다. 연구에 따르면 콜린유래 PC는 기억력과 인지 기능 향상에 도움을 줄 수 있으며(Roy 등, 2022), PE는 세포막의 안정성을 유지하여 뇌 기능 증진에 기여할 수 있다(Sagaror과 Amenta, 2023). 또한, PI는 경미한 고콜레스테롤혈증을 완화하고 간 내 콜레스테롤 축적을 방지하여 콜레스테롤 대사를 개선하는 것으로 보고되고 있다(Shirouchi 등, 2009). 이러한 생리 활성 기능뿐만 아니라 기능성과 활용성이 높은 인지질은 연구가 활발히 이뤄지고 있으며, 유화제로 활용되어서 고부가가치 소재로 주목받고 있다. 인지질은 구조적으로 두 개의 지방산이 글리세롤 backbone에 에스터 결합으로 연결되어 소수성(hydrophobic)을 갖는 그룹과 인산기와 극성 head group이 결합되어 친수성(hydrophilic)을 갖는 그룹을 동시에 갖기 때문에 유화 안정성을 나타내는 유화제로 사용되고 있다. 현재 인지질의 권장 섭취량에 대한 명확한 기준은 설정되어 있지 않으나, 미국 식품영양위원회는 PC의 전구체인 콜린에 대해 성인 남성에게 하루 550 mg, 여성에게는 425 mg의 섭취를 권장하고 있다(Zhao 등, 2011). 세포막에서 콜린은 아세틸콜린 합성 및 콜린성 신경전달, 메틸 그룹 대사 등에 관여하여 세포의 정상적인 기능과 뇌 발달에 중요한 필수 영양성분이기 때문에 임신 중 태아 발달에 중요하다(Shim 등, 2022). 이에 따라 농식품 자원에 함유된 콜린 구조를 갖는 PC의 함량은 콜린의 공급원으로서 중요한 기능성 성분으로 주목받고 있다.
십자화과(Brassicaceae) 채소류에는 대표적으로 브로콜리, 양배추, 케일 등이 있으며, glucosinolates, carotenoids 등과 같은 생리활성 물질을 함유하고 있어서 항산화 및 항암 효과가 있는 것으로 알려져 있다(Jahangir 등, 2009; Raiola 등, 2018). 국내 다소비 식품인 채소류와 과일류는 비타민, 무기질, 식이섬유 등의 다양한 영양소를 함유하고 있으며, 국립농업과학원에서 발간하는 국가식품성분표에 그 영양성분 함량이 제시되어 기초자료로 널리 활용하고 있다. 그러나 국내에서 다빈도로 소비되는 십자화과 채소류 및 과실류에 함유된 콜린 유래 PC를 비롯한 인지질 함량에 대한 연구는 현재 거의 전무한 실정이다. 이들 다소비 농식품 자원에 함유된 기능성 인지질의 함량 데이터베이스 구축을 통하여 식품자원의 인지질 정보제공과 기능성 소재화 연구 및 응용에 필요한 기초자료를 제공할 수 있을 것으로 사료된다.
식품에 함유된 인지질 함량을 분석하는 방법으로는 박층 크로마토그래피(TLC), 고성능 액체 크로마토그래피(HPLC), 핵자기공명분광기(13P-NMR) 등이 활용되고 있다(Barry 등, 2016; Rombaut 등, 2005). 현재 인지질은 아세톤 불용물로서 무게를 측정하는 시험법과 refractive index detector(HPLC-RID)를 이용한 시험법, evaporative light scattering detector(HPLC-ELSD)에 의한 PS 정량 시험법 등이 건강기능식품 공전에 제시되어 있다(MFDS, 2025b). 그리고 식품공전에는 크릴유에 함유한 다량의 인지질을 13P-NMR로 분석하는 시험법(MFDS, 2025a)이 있다. HPLC-RID 분석법은 온도와 용매 기울기 변화에 민감하여 여러 인지질들을 동시 분리 및 정량 분석하는 데에는 적합하지 않다(Wang과 Zhou, 2017). 반면에 HPLC-ELSD 분석법은 감도가 높고 기울기 용출과의 호환성이 우수하여 다양한 식품 매트릭스에서 개별 인지질들을 동시에 정량 분석할 수 있는 방법으로 인정받고 있다(Mengesha과 Bummer, 2010; Rombaut 등, 2007; Soyseven 등, 2022).
본 연구에서는 HPLC-ELSD를 활용한 인지질 분석법을 확립하고, 이를 이용하여 농식품 자원 십자화과 16종, 국화과 19종, 과일류 21종에 함유된 개별 인지질들(PE, PC, PS, PI, LPC 등)을 정량 분석하고자 하였다. 식품에 함유된 인지질의 함량분석 database 구축은 식품원료에 대한 기능성 인지질 정보를 제공하며, 식품 자원을 활용한 기능성 소재화 연구의 기반을 구축하는 데 기여할 수 있을 것이다.
2. 재료 및 방법
농식품 자원으로부터 인지질 추출에 사용된 normal grade 용매인 methanol과 chloroform, 기기분석에 사용된 고순도인 acetic acid와 triethylamine들은 대정화금사(Siheung, Korea)에서 구입하였다. 시료 전처리에 사용된 anhydrous sodium sulfate는 Junsei Chemical Co.(Tokyo, Japan)에서 구입하였다. 인지질 정량 분석을 위해 사용된 표준품들은 L-α-phosphatidyleth anolamine(PE), L-α-phosphatidylcholine(PC)는 Sigma-Aldrich (St. Louis, MO, USA)로부터 구매하였으며, sphingomyelin(SM), L-α-lysophosphatidylethanolamine(LPE), L-α-phosphatidylinositol (PI), L-α-lysophosphatidylcholine(LPC)는 Avanti Polar Lipids (Alabaster, AL, USA)로부터 구입하였다. 인지질 정량 분석에 사용된 용매는 n-hexane, 2-propanol, methanol, chloroform으로 HPLC grade의 Fisher Scientific Korea Ltd.(Incheon, Korea)를 사용하였다.
본 연구에서는 총 56종의 시료를 사용하였으며, 이는 십자화과 16종(브로콜리 생것, 브로콜리 데친 것, 콜라비, 봄동 등), 국화과 19종(우엉, 양상추, 치커리 등), 과일류 21종(오렌지, 키위, 딸기 등)으로 구성되었다. 분석에 사용된 시료들은 다소비 K-농식품 자원의 기능성 인지질 DB구축의 일환으로 2023년과 2024년 동안 농촌진흥청으로부터 제공받은 것이었고, juice류를 제외한 모든 시료는 동결건조된 상태로 제공되었다. 배송된 시료는 냉동 상태로 수령하였고, 분석 전까지 −27°C에서 보관하였다. 분석을 수행하기 전, 시료들은 25°C의 물에서 20분 이상 해동한 후 충분히 균질화하여 인지질 분석을 위한 추출에 사용하였다.
시료에서 인지질을 추출하기 위해 Folch법(Folch 등, 1957)을 적용하여 조지방을 추출하였다. 균질화된 시료 대략 2 g을 50 mL vial에 넣고, 여기에 증류수 8 mL와 Folch 용액(chloroform: methanol=2:1, v/v) 24 mL를 첨가하였다. 다음 혼합물을 vortex mixer(KMC-1300V, Vision Scientific Co., Ltd., Daejeon, Korea)로 5분 동안 혼합한 다음, 5분 동안 sonication(JAC 2010, Kodo Technical Research Co., Hwaseong, Korea) 하였다. 층 분리를 위해 3,000 rpm에서 10분 동안 원심분리(Fleta 5, Hanil Scientific lnc., Gimpo, Korea)를 수행하였다. 분리된 하층액을 anhydrous sodium sulfate column을 통과하여 불순물 및 수분을 제거하였다. 마지막으로 수집된 하층액을 질소를 사용하여 유기용매를 완전히 제거한 후, 인지질 분석에 사용하였다.
인지질 정량분석은 식품공전의 일반시험법에서 6.3.2.3 어유에서 인지질 분석법에서 gradient elution 등 일부를 변경하여 분리도를 개선하였다(MFDS, 2025a). 인지질 분석은 ELSD (Agilent 385 model, Santa Clara, CA, USA) 검출기가 장착된 HPLC(Agilent 1100 series, Santa Clara, CA, USA) 시스템을 이용하였다. ELSD의 drift tube 온도는 60°C, 압력은 1.60 SLM으로 설정하였다. Column은 LiChrospher®100 Diol(250×4 mm, 5 μm, Merck KGaA, Darmstadet, Germany)를 사용하였으며, column oven 온도는 40°C로 설정하였다. 시료 주입량은 20 μL로 설정하였으며, 이동상은 1 mL/min의 유량으로 분석하였다. 이동상 A(n-hexane:2-propanol:acetic acid:triethylamine = 81.42: 17.00:1.50:0.08 by volume)용매와 이동상 B(2-propanol:water: acetic acid:triethylamine = 84.42:14.00:1.50:0.08 by volume)용매를 사용하여 gradient elution으로 설정하였다. 총 분석 시간은 60분이었으며, 0-3분(100% A용매), 3-8분(95% A용매, 8-15분(80% A용매), 15-30분(70% A용매), 30-35분(60% A용매), 35-43분(20% A용매), 43-55분(0% A용매), 55분-60분(100% A용매)으로 설정하였다. 개별 인지질(PE, PC, SM, PS, PI, LPE, LPC)의 정량을 위하여 표준품을 3.125-200 μg/mL의 농도 범위로 Table 1과 같이 검량선을 작성하였다. 식품에 함유된 개별 인지질의 정량값은 mg/100 g으로 나타내었다.
인지질 정량을 위한 분석법 검증을 위하여 International Council for Harmonization와 AOAC guideline에 따라서 직선성(linearity), 특이성(specificity), 정밀도(precision), 검출한계(limit of detection, LOD), 정량한계(limit of quantification, LOQ)를 확인하였다(Horwitz, 2002; ICH, 2022). 직선성은 각 인지질 표준용액의 농도별 피크면적으로 작성한 검량선의 상관계수(R2)를 이용하여 유효성을 확인하였다. 특이성은 개별 인지질의 peak 분리도(resolution)가 1.5 이상임을 확인하여 간섭영향이 없음을 검증하였다(Suh 등, 2016). 정밀도는 분석품질관리에 사용한 in-house material인 검은콩가루(black soybean powder, Designnongboo, Jeon-ju, Korea)를 분석하여 확인하였다. 반복성(repeatability)은 하루에 4회 3 반복 실험하여 평가하였으며, 재현성(reproducibility)은 4일 동안 하루에 1번씩 3 반복으로 분석하여 상대표준편차(relative standard deviation, RSD%)로 나타내어 확인하였다. 인지질 분석법의 검출한계(LOD)와 정량한계(LOQ)은 공시료(blank)로부터 얻은 signal-to-noise 면적의 평균값들과 표준편차(standard deviation, SD), 검량선의 기울기(slope)에 근거하여 각각 LOD=3.3×SD/slope와 LOQ=10×SD/slope에 대입하여 계산하였다.
분석품질관리를 위하여 시료를 분석하는 기간 동안 내부 분석 품질관리(In-house quality control, IHQC) 시료인 영유아용 분유(Imperial dream XO All New Adition 3, Namyang, Seoul, Korea)를 시료들과 함께 매회 분석하여 quality control chart(QC chart)를 작성하였다. QC chart의 평균값을 기준으로 관리 상한선(upper control lines, UCL)과 관리 하한선(lower control lines, LCL), 조치 상한선(upper action line, UAL)과 조치 하한선(lower action line, LAL)을 아래와 같이 계산하였다(Ahn과 Shin, 2023).
3. 결과 및 고찰
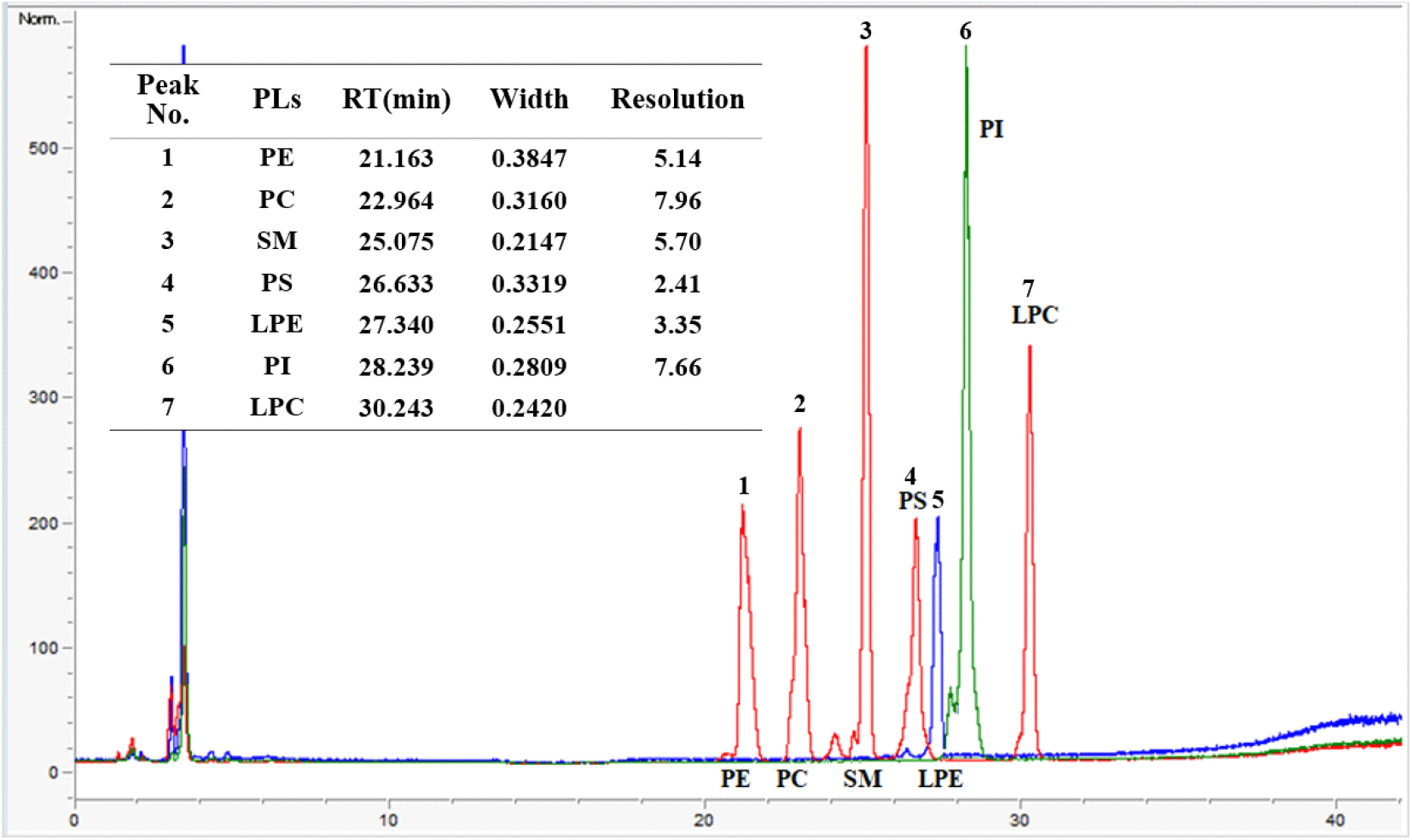
인지질 정량분석을 위한 HPLC-ELSD 분석법의 직선성, 검출한계(LOD), 정량한계(LOQ), 그리고 7종 인지질들(PE, PC, SM, PS, PI, LPE, PI, LPC)의 분리도(resolution)를 나타낸 특이성을 Table 1과 Fig. 1에 나타내었다. 7종 인지질들의 농도별(3.125-200 μg/mL) 검량선의 상관계수(R2)값은 0.9997-1.0000의 범위로 나타나 우수한 직선성을 확인하였다. 검량선 작성에 사용된 농도 범위와 검량선의 직선성은 Kelly 등(2016)과 유사한 결과이었다. 7종 인지질들의 LOD 값은 4.1-10.4 mg/100 g의 범위로 나타났고, LOQ 값은 4.6-11.0 mg/100 g 범위였다. 7종 인지질들의 분리 특이성은 인지질 표준용액을 분석하여 peak 분리도(resolution)을 확인하였다(Fig. 1). Fig. 1에서는 7종 인지질의 retention time(RT)과 peak의 폭(width), 그리고 계산된 peak 분리도(resolution)을 나타내었다. PE와 PC의 분리도는 5.14 이었으며, PC와 SM의 분리도는 7.96으로 가장 높았다. PS와 LPE의 분리도는 2.41이었으며, LPE와 PI의 분리도는 3.35, PI와 LPC의 분리도는 7.66으로 7종 인지질의 분리도가 모두 1.5 이상으로 특이적으로 높은 분리 효율을 나타냄을 확인하였다(Shin 등, 2023; Suh 등, 2016).
인지질 분석법의 정밀도는 콩가루 분석을 수행하여 Table 2에 나타내었다. 정밀도는 분석의 반복성과 재현성을 repeatability (intra-day)와 reproducibility(inter-day)로 나타내었으며, 이들의 반복적인 분석값들의 상대표준편차%(relative standard deviation%, RSD%)를 구하여 정밀도를 비교 검증하였다. 콩가루에는 PE 241.43-249.59 mg/100 g과 PC 582.35-595.27 mg/100 g, PI 96.11-98.40 mg/100 g을 함유하고 있었으며, 반복성과 재현성에서 RSD%가 각각 4.04-8.98%와 2.03-9.42%의 범위를 나타내었다. Ma 등(2017)은 인지질 분석법의 반복성 확인결과 8.5-108.7 mg/L의 모유에서 4-12%의 RSD를 나타내었다. 이로써 본 연구에서 사용한 인지질 분석법이 우수한 정밀도를 나타냄을 확인하였다.
Repeatability, refers to the results of independent determinations obtained by analyzing SP (soybean powder) samples four times on a same day.
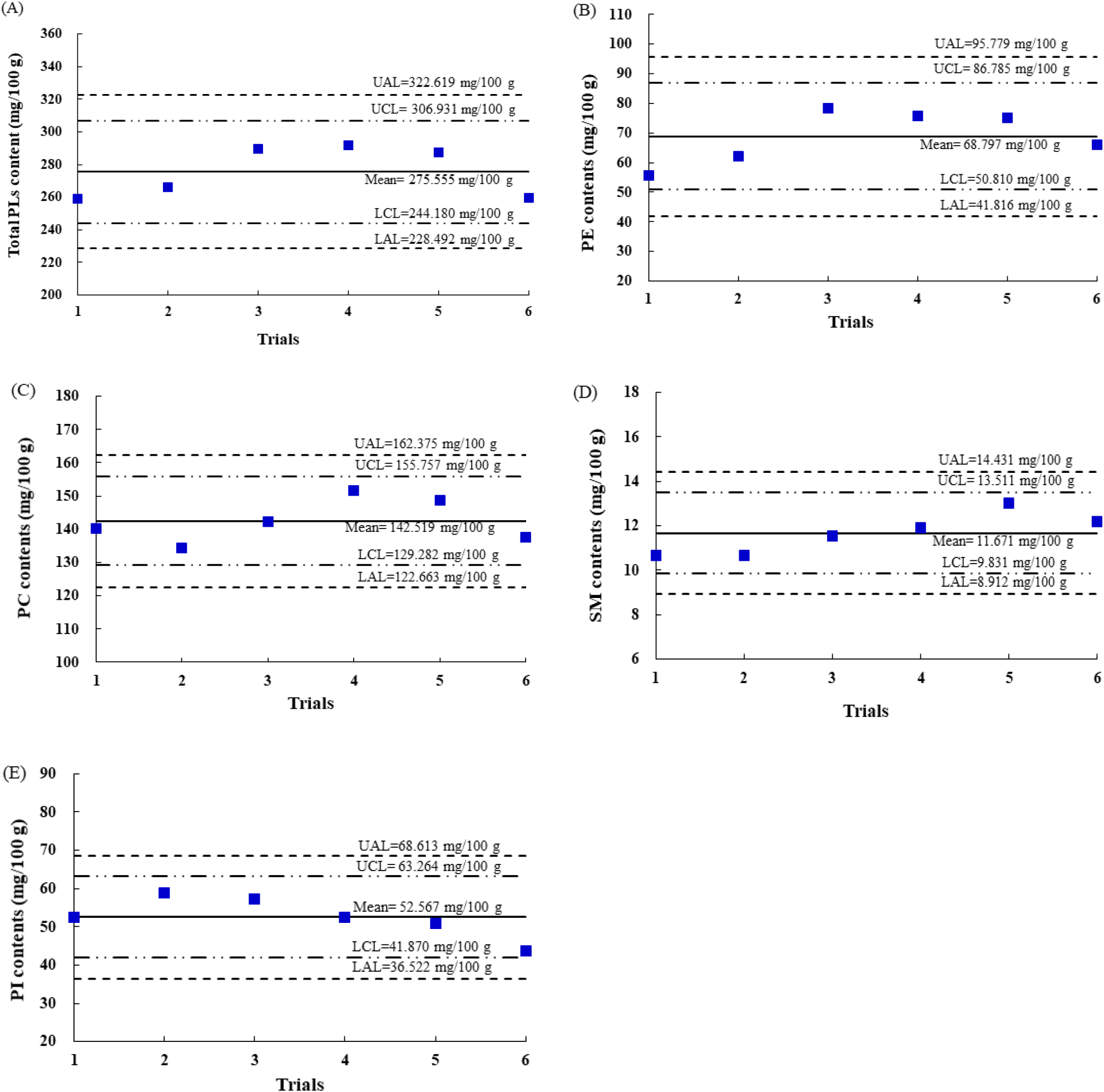
실험 중 다양한 환경적 요인이나 실험 조건의 변동으로 인해 분석 결과의 편차가 발생할 수 있기때문에 분석품질관리가 요구된다. 분석품질관리는 검증된 분석법이 일관되게 적용되고 있는지를 지속적으로 평가하고 유지하는 과정이다. 따라서 분석품질관리를 통하여 정확도가 높은 신뢰도가 확보된 데이터를 생산할 수 있다. 본 연구에서는 내부 품질관리시료(IHQC)인 영유아용 분유를 분석하여 품질관리선과 조치선이 설정된 QC chart를 작성하였다(AOAC, 2002). 인지질의 품질관리도표(quality control chart, QC chart) 결과는 Fig. 2에 나타내었다. 영유아용 분유에 함유된 총인지질(Total PLs) 함량은 기준값은 275.555 mg/100 g이었으며, 관리 상한선(UCL)과 하한선(LCL)은 각각 306.931 mg/100 g과 244.180 mg/100 g이었으며, 조치 상한선(UAL)과 하한선(LAL)은 각각 322.619 mg/100 g과 228.492 mg/100 g이었다. 시료 분석 동안 Total PLs 함량이 모두 관리 범위 내에 들어가는 것을 확인하였다. 영유아용 분유에 함유된 PE, PC, SM, PI의 기준값들은 각각 68.797 mg/100 g, 142.519 mg/100 g, 11.671 mg/100 g, 52.567 mg/100 g이었으며, 시료와 함께 분석하였던 영유아용 분유의 모든 분석 값들이 품질관리선(UCL과 LCL, UAL과 LAL)의 범위 안에 들어와서 분석값들에 대한 신뢰성을 확보하였다(Ahn과 Shin, 2023). 따라서 본 연구에서 사용한 인지질 분석법은 식품공전 “어유의 인지질 분석법(6.3.2.3.1)” 분석법에서 7종 인지질의 분리도를 높이기 위하여 이동상의 용리비율을 수정하였다. 분석법 검증결과 높은 정확도와 정밀도을 보였으며, 식품 내 인지질 함량을 분석하는 데 적합한 방법임을 확인할 수 있었다.
시료에 대한 정보는 Table 3에 제시하였으며, 십자화과 채소류 식품 16종(브로콜리, 콜라비, 냉이, 배추, 양배추, 청경채, 케일 등)에 함유된 인지질 함량(mg/100 g)을 Table 4에 나타내었다. 이들 십자화과 채소류 식품 16종들은 식이 방법에 따라 생것과 데친 것으로 구분하여 조리법에 따른 인지질 함량도 비교하였다. 십자화과 채소류의 조지방 함량은 양배추 착즙(Cr 7-1, 0.10%)을 제외한 시료들에서 1.53-7.78%의 범위로 비교적 낮은 함량을 나타내었다. 브로콜리, 냉이, 봄동배추, 양배추, 청경채의 생것 시료에서는 총인지질 함량이 27.79-210.81 mg/100 g의 범위를 보였다. 특히 브로콜리 생것(Cr 1-1)과 줄기 생것(Cr 2-1)에서 총인지질 함량은 27.79-28.66 mg/100 g이었으며, 주로 PC와 PI가 검출되었다. 이들을 각각 데친(blanched) 후 총인지질 함량은 313.52 mg/100 g(Cr 1-2)과 201.15 mg/100 g(Cr 2-2)으로 생것 시료 대비 7.2-10.9배 정도 증가하였다. 데친 브로콜리에서는 인지질들 중에서 PC가 68.5-70.4%를 차지하였으며, 다음 PE 18.3-23.6%, PI가 7.8-11.2% 순으로 분포하였다. Bernhardt와 Schlich(2006)에 따르면, 브로콜리의 경우 조리 후 세포벽의 파괴로 인하여 지용성 비타민들이 쉽게 용출되기 때문에 지용성 비타민들의 함량이 더 높게 검출되었다고 하였다. 따라서 지용성 성분인 인지질도 조리 과정에서 열에 의해 세포벽이 파괴되면서 복잡한 matrix에서 더 많이 분리되어 용출되었으며, 이로 인해 그 함량이 높게 검출된 것으로 보인다. 또한, Hwang와 Thi(2015)에 따르면, 양배추를 데치기, 찌기, 전자레인지 가열 등의 방법으로 조리했을 때 일부 생리활성 물질의 함량이 증가하는 경향을 보였다. 이는 열처리가 세포벽을 부분적으로 파괴하여 세포 내 성분의 추출을 용이하게 하였다고 판단하였다. 이러한 결과들은 십자화과 채소류가 생것보다 조리하였을 때 인지질 함량이 증가할 수 있음을 시사하였다. 콜라비 생것의 총인지질 함량은 100.61 mg/100 g(Cr 3-1)이었으며, PE(42.2%), PC(35.7%), PI(17.7%) 그리고 LPC(4.5%) 순으로 분포하였다. 이는 PC가 phospholipase A에 의해 가수분해되면서 LPC를 생성한 것으로 판단된다(Lee 등, 1997). 십자화과 채소 중에서 냉이(Cr 4-1), 봄동 배추(Cr 5-1), 청경채(Cr 8-1) 생것 시료에서는 76.11-170.71 mg/100 g의 총인지질이 검출되었고, 이들을 데친 후에서 951.04-1110.45 mg/100 g으로 생 것대비 6.5-13.3배로 총인지질 함량이 증가하는 경향을 보였다. 냉이 데친시료(Cr 4-2)에는 PC 59.7%, PE 33.7%, PI 6.6%로 구성되어 있었으며, 봄동 배추 데친시료(Cr 5-2)도 냉이와 유사하게 PC 함량이 가장 높았다. 청경채 데친 시료(Cr 8-2)에는 PC 47.2%와 PE 45.4%로 구성되었다. 제주 양배추(Cr 6-1)와 케일(Cr 9-1) 생것 시료에는 각각 210.81 mg/100 g과 126.80 mg/100 g의 인지질을 함유하였으며, 제주 양배추에는 PE 43.6%, PC 19.4%, PI 19.0% 순으로 인지질이 분포하였고, 케일에는 PI 52.3%와 PE 34.5% 가 주로 분포하였다. 제주 양배추를 데친 것(Cr 6-2)과 찐 것(Cr 6-3)에는 총인지질 함량이 289.38 mg/100 g과 351.61 mg/100 g이 검출되었으며, 이는 생것 대비 1.4-1.7배 높은 함량이었다. 조리한 제주 양배추에는 주로 PC와 PE를 함유하였다. 또한 PI의 함량은 조리한 것(18.44-32.62 g/100 g)이 생것(39.95 g/100 g)에 비해 1.2-2.2배 감소하였다. 양배추 착즙(Cr 7-1)에서는 총인지질 함량이 0.92 mg/100 g으로 가장 낮은 함량을 보였다. Kim 등(2024)의 연구에 따르면 양배추는 생것 대비 데쳤을 때 PE, PC 함량이 1.1-1.3배 증가하였으며, PI 함량은 데치거나 쪘을 때 생것 대비 1.2배 감소하여 본 연구 결과와 유사한 함량 차이를 나타내었다.
Phospholipids (PL) are PE, phosphatidylethanolamine; PC, phosphatidylcholine; SM, sphingomyelin; PS, phosphatidylserine; LPE, lysophosphatidylethanolamine; PI, phosphatidylinositol.
The values represent the weight percentages (wt%) of individual phospholipids relative to the total phospholipid content.
Phospholipids were extracted from juice-type samples made from raw materials (mg/100 g of fresh weight). The information regarding the samples is presented in Table 3.
조리법 혹은 품종에 따라 구분한 국화과 채소류 식품 19종(우엉, 상추, 치커리, 쑥갓, 취나물 등) 에 함유된 인지질 함량(mg/100 g)을 Table 5에 나타내었다. 국화과 채소류 식품 19종 중에서 우엉류(0.65-1.37%, Ca 1-1, 1-2, 1-3)를 제외한 식품들의 조지방 함량은 3.04-12.12% 범위를 보였다. 우엉의 경우 총인지질 함량은 생것(Ca 1-1, 25.73 mg/100 g)보다 데친 것(Ca 1-2, 221.74 mg/100 g)과 볶은 것(Ca 1-3, 121.47 mg/100 g)에서 각각 8.6배와 4.7배로 증가하는 경향을 보였다. 조리 후 우엉에는 PC 51.3-53.1%, PE 31.4-31.5%, 그리고 PI 6.9-12.5%의 인지질이 분포하였다. 상추 생것 5종(Ca 2-1, 3-1, 4-1, 5-1, 6-1)의 총인지질 함량은 74.84-113.13 mg/100 g이었으며, 주로 PE와 PI로 분포되어 있었다. 상추(로메인, 치마상추)의 조지방 함량(6.10-8.46%)과 유사한 수준의 치커리(Ca 7-1, 6.36%)는 총인지질 함량과 분포가 유사한 경향을 나타내었다. 쑥갓 생것(Ca 8-1)의 총인지질 함량은 103.65 mg/100 g이었으며, 데친 후(Ca 8-2) 6.1배 증가하였다. 데친 쑥갓에서는 PC(55.5%)와 PE(36.1%)가 주로 구성되어 있었다. 취나물(곰취, 참취)의 경우 생것(Ca 9-1, Ca 10-1)에 함유된 총인지질 함량은 97.30-150.77 mg/100 g이었으며, 이들을 각각 데쳤을 때 12.2배(Ca 9-2)와 4.8배(Ca 10-2)로 증가하는 경향을 보였다. 조리 전에는 PI, PE 등이 대부분을 차지하였으나, 조리 후 PC가 67.3%(Ca 9-2)와 46.2%(Ca 10-2)로 높게 증가하였다. 이러한 경향은 십자화과 채소류들과 마찬가지로, 조리 과정 중 열에 의해 세포벽이 파괴되면서 인지질 성분들이 쉽게 분리 및 용출되어 그 함량이 높게 검출된 것으로 사료된다(Bernhardt와 Schlich, 2006). 일부 보고에서 종자(seed flour) 생것과 볶은 것의 인지질 함량을 비교한 결과 PE는 36.6 mg/100 g에서 315 mg/100 g으로 증가하였으며, PI는 16.3 mg/100 g에서 716 mg/100 g으로 증가하여 총인지질 함량이 192 mg/100 g에서 1375 mg/100 g으로 7배 증가하는 경향을 보인것과 유사한 결과를 보였다(Adesina와 Adeyeye, 2017). 취나물을 삶아서 말린 것(Ca 10-3)과 이를 다시 데친 것(Ca 10-4)들에서도 640.95-898.97 mg/100 g의 총인지질 함량을 나타내었으며, 그 구성 인지질의 조성도 데친 시료(Ca 10-2)와 유사하였다. 곤드레 삶아서 말린 것(Ca 11-1)과 이를 다시 찐 것(Ca 11-2)에서는 총인지질 함량이 각각 868.98 mg/100 g과 788.09 mg/100 g이었으며, 이는 취나물 데친 것, 삶아서 말린 것과 유사한 인지질 조성을 나타내었다. Jin 등(2017)에 따르면 취나물(곰취, 참취)의 조지방 함량은 생것(2.33-4.5%) 대비 데친 것(3.37-5.66%)에서 더 높은 함량을 보였으며, 이외에도 민들레도 생것 대비 데쳤을 때 조지방 함량이 높아졌다. 이와 같이 국화과 채소류들은 데치거나 말리는 등의 조리 과정을 거칠 경우, 조지방 함량과 총인지질 함량이 증가하는 경향을 보였다. 특히 주요 인지질인 PE와 PC의 함량이 증가하였다.
Phospholipids (PL) used are PE, phosphatidylethanolamine; PC, phosphatidylcholine; SM, sphingomyelin; PS, phosphatidylserine; LPE, lysophosphatidylethanolamine; PI, phosphatidylinositol.
The values represent the weight percentages (wt%) of individual phospholipids relative to the total phospholipid content.
ND, not detected. The information regarding the samples is presented in Table 3.
과일류 식품 21종(오렌지, 자몽, 키위, 딸기, 망고 등)에 함유된 인지질 함량을 Table 6에 나타내었다. 과일류의 조지방 함량은 0.30-9.64% 범위를 보였으며, 총인지질 함량은 ND-339.54 mg/100 g 범위로 비교적 낮은 함량을 나타내었다. 오렌지 생것(F 1-1)에서는 총인지질 함량이 121.08 mg/100 g이었으나 오렌지 주스(F 1-2)와 귤 착즙 주스(F 2-1)에는 각각 11.03 mg/100 g과 11.69 mg/100 g으로 10배 내외로 감소하였다. 주스류(F 1-2, F 2-1)에는 PC 41.4-43.2%와 PE 31.8-36.7%가 주로 분포하였다. Ortutu 등(2024)에 따르면, 오렌지에는 PE와 PC가 주된 인지질로 존재하며 PE 함량이 PC보다 1.4배 높게 나타났으며, 숙성될수록 PE와 PI 함량이 증가한다고 보고하였다. 이러한 인지질 함량 증가는 과일 성숙에 따른 막 특성 변화와 관련이 있다(Wade와 Bishop, 1978). 본 연구에서도 오렌지 생것의 PE 함량(53.97 mg/100 g)이 PC 함량(44.49 mg/100 g)보다 대략 1.2배 높은 경향을 보였다. 자몽 생것(F 3-1)과 자몽 착즙 주스(F 3-2)에서도 오렌지와 비슷한 조지방 함량과 총인지질 함량을 나타내었다. 자몽 생것의 PE 함량(62.45 mg/100 g)은 PC 함량(59.46 mg/100 g)보다 1.1배 높았다. 키위 생것들 중 골드 키위(F 4-1)와 그린 키위(F 5-1)에서는 총인지질 함량이 각각 71.23 mg/100 g과 91.84 mg/100 g으로 그린 키위에서 대략 1.3배 높은 경향을 보였다. 이들의 인지질 구성은 골드 키위에서 PC 함량(41.6%)이 높았으며, 그린 키위에서는 PC 37.9%, PE 34.9%, PI 27.2% 순으로 분포하였다. 키위주스(F 6-1)에서는 낮은 조지방 함량(0.31%)과 총인지질 함량(4.58 mg/100 g)을 보였다. 일부 보고에 의하면 동결건조 시료가 액체 상태 시료보다 높은 지방함량을 보인다고 하였다(Ekpo 등, 2022). 이러한 결과는 건조처리된 시료에서 수분이 제거되며 고형분이 농축되어 상대적인 지방함량이 증가하였기 때문이다. 본 연구에서 사용된 오렌지, 자몽 등 역시 생 것과 주스 형태로 구분되며, 두 시료 간 수분 함량 차이로 인해 조지방량 및 인지질 함량에서 차이를 보였을 것으로 판단된다. 품종별 생딸기(F 7-1, 8-1, 9-1)의 조지방 함량과 총인지질 함량은 각각 2.09-2.48%와 222.27-339.54 mg/100 g를 나타내었다. 생딸기에 함유된 인지질의 조성은 PC, PE, PI 그리고 미량의 LPC 순으로 주로 분포하였다. Bianco 등(2020)의 연구에 따르면 딸기의 종자와 과육에서 검출되는 인지질이 PC, PE, PI, LPC라고 보고하였는데, 본 연구와 유사하였다. 가공품인 딸기 잼(F 10-1)에서는 인지질이 검출되지 않았고, 말린 크랜베리(F 11-1)에서도 PC 8.42 mg/100 g을 제외하고는 인지질이 검출되지 않았다. 천도 복숭아(F 12-1), 파인애플(F 13-1), 대추(F 19-1)에는 각각 총인지질 함량이 76.61 mg/100 g(PC 49.5%, PE 33.2%), 31.31 mg/100 g(PE 82.7%, LPC 17.3%), 27.23 mg/100 g(PC 64.6%, PE 35.4%)으로 비교적 낮았다. 망고 생것(F 14-1), 망고 말린 것(F 15-1), 애플망고 생것(F 16-1)에는 총인지질 함량이 11.55-62.25 mg/100 g 함유하였고, 무화과 생것(F 18-1)과 말린 제품에는 각각 112.23 mg/100 g과 15.70 mg/100 g 함유하였다. 전반적으로 과일류에는 0.3-9.64%의 조지방(평균 2.04%)과 0-339.54 mg/100 g의 총인지질 함량(평균 79.20 mg/100 g)을 나타내었다.
Phospholipids (PL) used are PE, phosphatidylethanolamine; PC, phosphatidylcholine; SM, sphingomyelin; PS, phosphatidylserine; LPE, lysophosphatidylethanolamine; PI, phosphatidylinositol.
The values represent the weight percentages (wt%) of individual phospholipids relative to the total phospholipid content.
Phospholipids were extracted from juice-type samples made from raw materials (mg/100 g of fresh weight).
ND, not detected. The information regarding the samples is presented in Table 3.
4. 요약
본 연구에서는 국내 다소비 농식품 자원 중 십자화과 채소류 16종, 국화과 채소류 19종, 과일류 21종에 대상으로 총인지질 함량과 개별 인지질(PE, PC, SM, PS, PI, LPC 등) 함량을 분석하였다. 이를 위해 HPLS-ELSD를 이용한 인지질 정량분석법을 확립하였으며, 검증을 통해 분석법의 신뢰성을 확보하였다. 7종 인지질의 검량선은 R2 값이 0.9997-1.0000으로 우수한 직선성을 보였으며, 검출한계(LOD)와 정량한계(LOQ)는 각각 4.1-10.4 mg/100 g, 4.6-11.0 mg/100 g로 나타났다. 또한, 인지질의 분리 효율을 나타내는 resolution 값은 모두 1.5를 초과하여 높은 분리도를 보였다. 콩가루 분석에서는 RSD%가 10% 이하로 분석법의 높은 정밀도가 확인되었다. 분석품질관리에서는 영유아용 분유를 분석하여 QC 차트를 작성하였고, 관리 범위 내에서 정확성이 높음이 확인되었다. 16종의 십자화과 채소를 분석한 결과, 생것(브로콜리, 냉이, 배추 양배추, 청경채)에서는 총인지질 함량이 27.79-210.81 mg/100 g 범위로 나타났고, 조리 후에는 201.15-1,110.45 mg/100 g(Cr 8-2, 청경채)까지 크게 증가하여 인지질 함량이 6.5-13.3배까지 증가하였다. 국화과 채소류도 십자화과 채소류와 유사하게 조리 후 인지질 함량이 증가하는 경향을 보였다. 과일류 21종에서의 총인지질 함량은 평균 79.20 mg/100 g(0-339.54 mg/100 g)이었고, 특히, 킹스베리 생딸기(339.54 mg/100 g)에서 높은 함량을 보였다. 특히, 오렌지 생것에는 121.08 mg/100 g의 인지질 함량을 보였으나, 주스 형태에서는 인지질 함량이 약 10 mg/100 g으로 거의 검출되지 않았다. 본 연구는 인지질 분석법의 정확성과 정밀성을 통해 다양한 식품의 인지질 함량을 신뢰성 있게 측정할 수 있음을 나타내었으며, 구축된 데이터는 향후 식품의 기능성 연구 및 건강기능식품 개발 등의 기초 자료로 제공될 수 있다.
