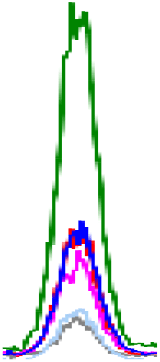1. 서론
돼지고기는 국내에서 가장 많이 소비되는 육류로서, 닭고기와 쇠고기보다 소비량이 약 2배 높다(AT FIS, 2023). 육류는 단백질과 지질의 주요 공급원이며, 소량의 무기질과 비타민을 포함하고 있다. 특히 돼지고기는 타 육류와 비교하여 비타민 B1의 함량이 높은데, 가식부위 100 g당 비타민 B1의 함량이 0.6 mg으로, 닭고기와 쇠고기에 비해 약 4-7배 높으며, 이는 비타민 B1 하루 권장 섭취량(0.9-1.2 mg/day; MHW, 2021)의 약 50%를 충족시킬 수 있다. 비타민 B1은 우울증 예방 및 항염증 등의 효과가 있으며, 결핍 시 대사성 산증 및 신경계 장애를 초래할 수 있다(Mrowicka 등, 2023). 또한, 돼지고기에는 셀레늄(Selenium, Se)이 26 μg /100 g 함유되어 있으며, 닭고기와 쇠고기에 비해 1.2-1.4배 높은 수준이다(Lombardi 등, 2005). 셀레늄은 암세포 발생을 조기에 억제하는 효과가 있고(Woo와 Lim, 2017), 결핍 시 염증성 화합물 형성을 촉진하고 심장병, 암, 관절염 등의 질병 발생 위험을 증가시킬 수 있다(Arthur 등, 2003; Ferreira 등, 2021). 반면, 돼지고기의 지방 함량은 약 22 g/100 g으로 닭고기와 쇠고기에 비해 약 1.5-2배 높은 수준으로(RDA, 2024), 과다 섭취 시 혈중 콜레스테롤 및 중성지방 함량 증가로 이어질 수 있어 적정 섭취가 요구된다.
지방은 글리세롤에 지방산이 에스테르 결합된 화합물로서 체내 주요 에너지원이다. 육류의 지방산은 인체 건강과 밀접한 연관성을 가지고, 육류의 색, 향 및 조직감 등의 품질을 결정하는 중요한 요소이다(Hur 등, 2005). 돼지고기의 주요 지방산은 포화지방산인 palmitic acid(C16:0, 23.46%)와 stearic acid(C18:0, 12.53%), 불포화지방산인 oleic acid(C18:1, n-9, 37.98%)와 linoleic acid(C18:2, n-6, 13.89%)이다(Jang 등, 2017; RDA, 2024). 포화지방산 함량이 높은 식품을 과다 섭취하면 인슐린 저항성을 유발할 수 있으나(Funaki, 2009), linoleic acid 등 다가불포화 지방산 함량이 높은 식품을 섭취하면 복부 지방 감소와 지방합성 억제 등의 효과가 있다(Summers 등, 2002). 콜레스테롤은 동물 조직의 주된 sterol로서(Patterson, 2009) 스테롤(sterol)에 하이드록시기(hydroxyl group, -OH)와 탄화수소 사슬로 구성되어 있으며(Norum 등, 1983), 세포막, 호르몬 대사 등 체내 대사 과정에 중요하게 관여한다. 그러나, 콜레스테롤을 과다 섭취하면, 당뇨, 비만 등 성인병을 유발할 수 있어 주의하여 섭취할 필요가 있다(Kim 등, 2002; Shim 등, 2006). 돼지고기의 콜레스테롤 함량은 평균 63 mg/100 g으로 안심, 갈비 등 일반 부위보다 간, 곱창 등 내장 부위에서 높다(RDA, 2024; Yang과 Ko, 2010).
인지질은 세포막 지질 이중층 구조의 주요 구성 요소로서 hydrophilic head와 hydrophobic fatty acid chain을 가진 양친매성 분자이며 glycerophospholipid와 sphingolipid로 나눌 수 있다. 돼지고기의 주요 인지질은 phosphatidylcholine(PC)과 phosphatidylethanolamine(PE)으로 전체 인지질의 약 70%를 차지하며 부위에 따라 sphingomyelin(SM), lyso-phosphatidylcholine (LPC) 등을 소량 함유한다(Boselli 등, 2008; Duan 등, 2024). PC는 지방간(Duric 등, 2012), 뇌 손상 및 기억력 감퇴의 개선(Zhou 등, 2016), PE는 세포막의 유동성 증가(Dawaliby 등, 2016), SM은 혈청 콜레스테롤, 간 지질 수치 및 체중 감소(Norris 등, 2016; Stein 등, 1976; Yamauchi 등, 2016) 및 공복혈당의 개선에 관여한다(Norris 등, 2016). LPC는 혈장 내에서 DHA 흡수를 위한 운반체 역할(Guemez-Gamboa 등, 2015), docosahexaenoic acid(22:6) 및 arachidonic acid(20:4)의 다중불포화지방산과 함께 우수한 항염증제로 사용될 수 있다(Huang 등, 2010).
돼지고기는 가열조리 후 섭취되어야 한다. 가열조리는 돼지고기의 냄새, 풍미, 조직감 및 색 등의 기호적 측면을 향상하며(Yang과 Ko, 2010), 굽기 등의 건열조리와 삶기 등의 습열 조리로 나뉜다. 돼지고기(등심, 삼겹살, 목살)의 조리 시 지방 프로파일 변화에 대한 연구에 의하면, 삶는 조리는 등심에서 수분 함량과 지방 함량을 감소시키고, 삼겹살과 목살에서는 수분 함량은 감소시키고 지방 함량은 증가시켰다(Yang과 Ko, 2010; Yang 등, 2009a; Yang 등, 2009b). 콜레스테롤 함량 변화는 부위에 따라 다른데, 특히 목심에서는 함량이 증가하였고, 지방산 조성은 조리 전후의 차이가 없었다(Yang과 Ko, 2010; Yang 등, 2009a; Yang 등, 2009b).
식품 성분 데이터베이스는 일반 소비자 및 전문가에게 정확한 영양 정보를 제공하고 국민 건강 관리 및 식품 연구 개발(R&D)을 지원하게 되므로 식품 산업의 활성화에 기여할 수 있다. 또한, 식단 설계와 영양소 섭취 관리 등의 영양 교육 자료로 활용 가능하다는 점에서 그 중요성이 크다. 국내에서는 농촌진흥청에서 1975년부터 국가표준식품성분표 DB 구축을 위해 탄수화물, 단백질, 지방, 비타민 등 영양성분 42개의 데이터베이스를 구축해 왔다(RDA, 2024). 그중 돼지고기는 주로 삼겹살, 안심 등의 일반 부위와 머리고기, 족발 등의 돼지고기 부산물 그리고 베이컨, 순대 등의 가공식품에 대한 식품 성분 DB를 제공하고 있으며, 지방 프로파일은 총지방량, 지방산 조성, 콜레스테롤 함량으로 구축되어 있다. 그러나, 돼지고기 설하살 등 특수 부위에 대한 지방 프로파일과 인지질 종류와 함량은 포함되지 않았다. 또한, 돼지고기의 일반 부위와 특수 부위의 지방 프로파일, 인지질 조성 및 조리 전후의 비교연구는 제한적이다. 따라서 본 연구에서는 국내 돼지고기 일반 부위 10종과 특수 부위 6종 및 가공육 1종을 삶는 조리한 후 조지방과 콜레스테롤 함량, 지방산과 인지질 조성을 비교 분석하고, 분석 결과값의 신뢰도 확보를 위해 콜레스테롤과 인지질 분석에 대한 분석법 검증을 수행하였다.
2. 재료 및 방법
돼지고기 시료로 일반 부위인 머리고기(head), 껍데기(skin), 항정살(jowls), 삼겹살(belly), 안심(tenderloin), 사태(shank), 앞다리살(picnic), 미박 앞다리살(picnic with skin), 뒷다리살(ham), 족발(feet)과 특수 부위인 두항정살(duhangjeongsal), 관자살(gwanjasal), 뽈살(ppolsal), 뽈항정살(ppolhangjeongsal), 설하살(seolhasal), 덜미살(deolmisal)과 가공육인 베이컨(bacon)을 사용하였다. 돼지고기는 대전시 소재 정육점에서 2024년 구입하여, 끓는 물에 20분간 삶고 찬물로 세척한 후 물기 제거 후 믹서기로 분쇄하여 균질화시킨 후 사용하였다. 족발은 1시간 삶아 균질화하였다.
표준물질인 cholesterol, 5-α-cholestane, PE, PC, SM은 Sigma-Aldrich Co., Ltd.(St. Louis, MO, USA)에서, lyso-phosphatidylethanolamine(LPE)과 LPC은 Avanti Polar Lipids, Inc.(Alabaster, AL, USA)에서 구매하였다. Triundecanoin(C11:0)은 Nu-Chek Prep, Inc.(Elysian, MN, USA)로부터 구입하였다. N,N-dimethylformamide(DMF)는 Tokyo chemical industry (Tokyo, Japan)에서, hexamethyldisilazane와 chlorotrimethylsilane는 Sigma-Aldrich Co., Ltd.로부터 구입하였다. Hexane, iso-propanol(IPA), water, acetic acid와 triethylamine은 Fisher Scientific Korea Ltd.(Incheon, Korea)에서, n-heptane, chloroform, methanol과 sodium sulfate는 Samchun pure chemical(Seoul, Korea)에서 구입하였다.
돼지고기(2.5 g)에 folch 용액(24 mL, chloroform:methanol =2:1, v/v)과 증류수 6 mL를 혼합한 후 1,763 ×g에서 10분간 원심분리(Labogene 1248, Gyrozen Co, Ltd, Seoul, Korea)하고 하층액을 취하였다. Chloroform 12 mL와 methanol 1 mL를 넣어 두 번 더 추출하고, 모은 하층액은 sodium sulfate column에 통과시켜 수분과 불순물을 제거한 후 질소(N2)로 용매를 제거하고 농축하였다.
돼지고기 추출지방의 콜레스테롤 유도체[cholesterol-trimethylsilyl ether(TMS)]를 HP-5ms column (25 m × 0.20 mm, 0.33 μm, Agilent Technologies Inc, Santa Clara, CA, USA)이 장착된 Gas chromatography-mass spectrometry(GC-MS)-QP2010 Plus (Shimadzu Corp, Kyoto, Japan)를 사용하여 콜레스테롤 정성분석을 실시하였다. Carrier gas는 helium(1 mL/min), injection volume은 2 μL(splitless mode), injector의 온도는 280°C로 설정하였다. GC column oven 온도는 250°C에서 10°C/min로 290°C까지 승온시켜 5분간 유지하고, 0.1°C/min로 291°C까지 승온시켜 1분간 유지하였다. MS의 interface와 ionization source 온도는 각각 300°C와 260°C로 설정하였다. 유도체화된 콜레스테롤(cholesterol-TMS)의 정성분석은 selected ion monitoring (SIM) mode를 통해 선택 이온 질량(m/z; 73, 129, 255, 329, 368, 458)을 확인하였다.
Poroshell 120 EC-C18 column(4.6 × 75mm, 2.7μm, Agilent Technologies Inc)와 Tandem MS (QTRAP 6500, AB Sciex, Framingham, MA, USA)를 장착한 Ultra high performance liquid chromatography(UHPLC) (A1290 Infinity ll, Agilent Technologies Inc)와 multiple reaction monitoring(MRM) mode를 활용하여 콜레스테롤의 정성분석을 실시하였다. Mobile phase의 이동상은 acetonitrile(100%)를 이용하였다. 돼지고기의 추출지방(2 mg/mL in methanol)과 표준물질인 콜레스테롤(0.05 mg/mL in methanol)을 injector에 5 μL 주입하였다. 콜레스테롤의 precursor ion은 369.5 m/z 이온, product ion은 81.0, 95.0, 147.0, 161.1, 189.1과 257.1 m/z 이온으로 설정하였다. 시료의 콜레스테롤에 해당하는 피크의 relative ratio (peak area of each product ion/the smallest peak area)을 구하여 표준물질과 비교하여 정성 분석하였다.
추출된 조지방(1 mg/mL DMF)에 hexamethyldisilazane(0.2 mL)와 chlorotrimethylsilane(0.1 mL)을 첨가하여 30초간 교반 후 15분간 실온에서 유도체화(cholesterol-TMS) 하였다. 내부표준용액(5-α-cholestene in heptane) 1 mL와 증류수 10 mL를 1분간 혼합하고 상층액을 취한 후 sodium sulfate column를 통과시켜 수분과 불순물을 제거하였다. 돼지고기 각 부위의 콜레스테롤 정량분석은 HP-ULTRA 2 column(25 m × 0.20 mm, 0.33 μm, Agilent Technologies Inc)과 flame ionization detector (FID)를 장착한 GC(GC 2010 plus, Shimadzu Corp)를 사용하였다. GC injector와 detector 온도는 각각 280°C와 300°C로 설정하고, column oven 온도는 260°C에서 2분간 유지한 후 10°C/min으로 285°C까지 승온시켜 15분간 유지하였다. Carrier gas는 N2(0.6 mL/min)를 사용하였다. 콜레스테롤 표준용액(0.3125-200.00 μg/mL)을 유도체화하여 standard curve를 얻은 후, 시료의 콜레스테롤 함량을 mg/100 g으로 계산하고, 3회 반복 실시하여 평균과 표준편차로 나타내었다.
돼지고기의 인지질은 LiChrospher 100 Diol column(250 × 4 mm, 5 μm, Merck, Darmstadt, Germany)와 evaporative light scattering detector(ELSD)(Sedex LT-ELSD Model 80LT, Sedere, Alfortville, France)를 장착한 HPLC(Shimadzu Corp)로 정성 및 정량 분석하였다. Oven과 drift tube 온도는 각각 40°C와 50°C, N2는 2.5 bar, 이동상의 유속은 1.0 mL/min, injection volume은 20 μL로 설정하였다. 추출된 지질은 hexane:iso-propanol(IPA) 용매(3:1, v/v)에 3.0-6.0 mg/mL 농도로 용해시켰다. Mobile phase의 기울기 용리(gradient elution)에 사용된 이동상은 용매(A); hexane:IPA:acetic acid:triethylamine =81.42:17.00:1.50:0.08(v/v/v/v)와 용매(B); IPA:water:acetic acid:triethylamine=84.42:14.00:1.50:0.08(v/v/v/v)이고, 용매(A) 비율을 100%(0-3분), 95%(3-8분), 80%(8-15분), 60%(15-25분), 20%(25-40분), 50%(40-45분), 100%(45-80분)로 설정하였다. 인지질 표준물질인 PE, PC, SM, LPC와 LPE에 대한 정량 곡선을 얻은 후 시료의 인지질 함량은 mg/100 g으로 구하고, 3회 반복하여 분석하였다.
돼지고기 추출 지방(50 mg), triundecanoin(내부표준물질, C11:0, 5 mg)와 methanolic NaOH(0.5N, 1.5 mL)를 conical tube에 첨가하여 1분간 혼합하고 saponification(85°C, 10분)하였다. 냉각 후 boron trifluoride(BF3) in methanol 2 mL를 첨가하여 1분간 교반한 후 methylation(85°C, 10분)을 하였다. Iso-octane 2 mL와 포화 NaCl 1 mL를 혼합한 후 1,224 ×g에서 5분간 원심분리 후 상층액을 취해 sodium sulfate column에 통과시켰다. 시료의 지방산 조성 분석은 SP™-2560 column(100 m × 0.25 mm, 0.2 μm, Supelco Inc., Bellfonte, PA, USA)와 FID가 장착된 GC를 이용하였다(Baek과 Lee, 2021). Carrier gas는 N2(1 mL/min), split ratio는 100:1, injector와 detector의 온도는 각각 250°C와 260°C 설정하였다. GC oven 온도는 100°C에서 5분간 유지, 4°C/min의 속도로 240°C까지 승온시킨 후 40분간 유지하였다. Standard fatty acids mixture(Nu-Check Prep Inc., Elysian, MN, USA)을 동일한 조건의 GC-FID로 분석한 후 얻은 chromatogram의 retention time과 비교하여 시료의 지방산을 identification한 후 상대적 피크 면적(area% of the total fatty acids)을 구하였다. 3회 반복 측정하여 평균과 표준편차로 나타내었다.
콜레스테롤과 인지질의 분석 방법은 International Council for Harmonization(ICH, 2022)의 가이드라인에 따라 linearity(직선성), specificity(특이성), sensitivity(민감도), accuracy(정확성), precision(정밀도)를 활용하여 검증하였다(ICH. 2022).
콜레스테롤과 인지질 분석의 특이성은 각각 GC-FID과 HPLC-ELSD에서 얻은 chromatogram에서 표준물질의 retention time (RT)을 비교하여 검증하였다. 콜레스테롤 표준용액은 0.31-200.00 μg/mL, 인지질 중 PE, PC, SM과 LPC의 표준용액은 1.95-500.00 μg/mL, LPE 표준용액은 3.91-500.00 μg/mL의 농도로 제조하여 peak 면적에 대한 검량선을 작성하였다(Choi 등, 2024; Lee 등, 2024). 콜레스테롤 분석의 직선성은 1차 함수, 인지질 분석의 직선성은 2차 함수의 선형회귀분석을 통해 검증하였고, 상관계수(R2)를 구하여 평가하였다.
콜레스테롤과 인지질 분석법의 민감성은 검출한계(limit of detection, LOD)와 정량한계(limit of quantification, LOQ)로 검증하였다. 공시험 시료(6개)를 각각 GC-FID와 HPLC-ELSD로 분석하여 얻은 chromatogram의 peak 면적으로 평균과 표준편차(SD)를 계산하고, 분석 방법의 background 반응에 대한 표준편차를 추정하였다. Peak 평균 면적에 각각 3.3과 10을 곱하여 해당 농도(A and B)를 구하고, A와 B의 농도를 포함한 5개의 표준용액으로 calibration curve를 작성하고 기울기(slope of calibration curve, S)를 이용하여 LOD(3.3×SD/S)와 LOQ (10×SD/S)를 산출하였다. 콜레스테롤 분석법의 정확성은 시료에 표준물질(0.1, 0.2, 0.4, 0.8 μg/mL)을 각각 첨가하여 회수율(recovery, %)로 측정(spiking recovery test)하였고, 각 농도별로 3회 반복하여 측정하였다. 콜레스테롤 분석법의 정밀성은 반복성으로 평가하여 상대표준편차(relative standard deviation, RSD, %)로 나타내었다.
3. 결과 및 고찰
생 돼지고기의 조지방 함량은 2.51-43.57% 범위이고, 삶은 후엔 0.83-49.76%로 부위에 따라 증가하거나 감소하는 경향을 보였다. 항정살, 안심, 사태, 미박 앞다리살, 관자살, 뽈살, 뽈항정살, 설하살, 베이컨은 삶는 조리 후 조지방 함량이 유의적으로 증가하였고(p<0.05), 앞다리, 뒷다리, 족발, 두항정살의 조지방 함량은 유의적으로 감소하였다(p<0.05; Table 1). 국가표준식품성분 DB에 의하면 돼지고기 생 삼겹살과 안심의 수분 함량은 각각 52.2%와 74.4%, 조지방 함량은 33.3%와 3.2%이며, 삶은 후에는 수분 함량이 각각 41.8%와 61.4%로 감소하고 조지방 함량은 36.6%와 4.3%로 증가하였다(RDA, 2024). 본 연구에서는 생 삼겹살과 안심의 조지방 함량은 각각 35.37%와 2.51%이고, 삶은 후에는 35.03%와 6.20%으로 나타났다. 삼겹살의 경우 조리 전후 유의적인 차이가 없었으나(p>0.05), 안심은 조리 후 지방 함량이 약 2.1배 증가하였다(p<0.05). 이는 안심이 삼겹살에 비해 수분 함량이 높아 삶는 조리 과정에서 수분 손실이 더 크게 일어나, 수분 함량이 감소하였고, 이로 인해 단위 중량 당 지방 함량이 상대적으로 증가한 것으로 생각된다.
A-KMeans with different capital letters in the same column are significantly different among boiled pork by Duncan’s multiple range test (p<0.05).
NSIndicates not significantly different raw and boiled pork within the same cut by Student’s t-test (p<0.05).
콜레스테롤 정성분석은 GC-MS/SIM과 UHPLC-MS/MS를 이용하여 실시하였다. GC-MS/SIM 분석 결과, 콜레스테롤 표준물질의 유도체(cholesterol-TMS)의 peak가 10.59분에 검출되었으며, mass spectra에서 특징적인 fragment ion인 m/z 73, 129, 255, 329, 353, 368, 443, 458이 확인되어(Fig. 1A), Valverde 등(2018)의 연구결과와 유사하였다. 돼지고기 앞다리(생것) 시료에서도 10.62분 peak에서 동일한 fragment ions이 검출되어, 해당 peak를 콜레스테롤로 정성하였다(Fig. 1B).
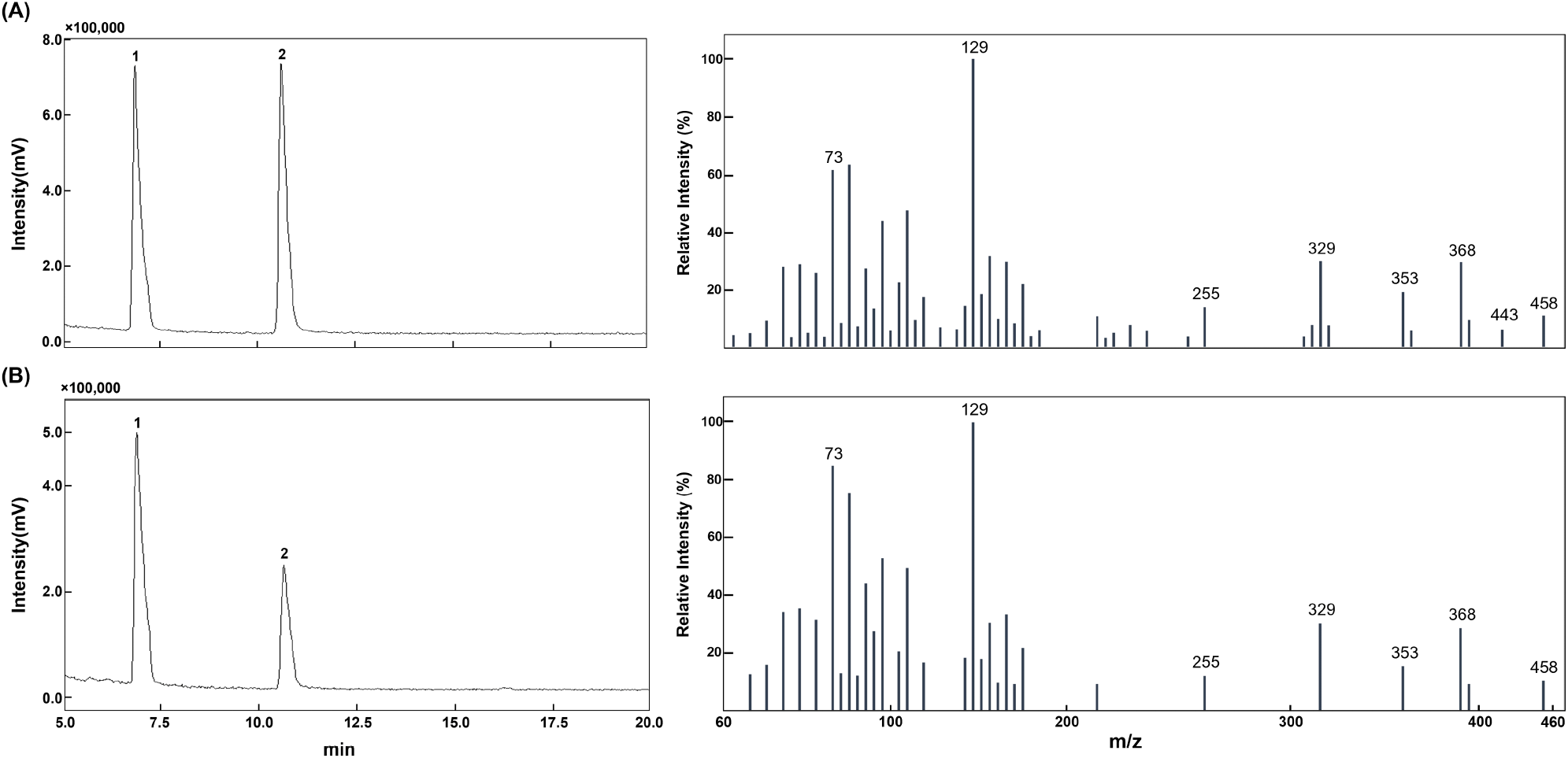
UHPLC-MS/MS의 MRM mode 분석에서는, 콜레스테롤 표준물질이 13.58분의 peak에서 identification 되었고, precursor ion은 m/z 369.5, product ion은 m/z 81, 95, 147, 161.1, 189.1, 257.1이었다(Table 2). 돼지고기 사태와 앞다리살 시료에서도 13.57-13.59분에 peak에 동일한 precursor ion과 product ion을 확인하여 콜레스테롤로 정성하였다. 또한, product ion인 m/z 257.1의 면적 대비 다른 product ions(m/z 81, 95, 147, 161.1, 189.1)의 상대 면적 비율(relative area ratio)이 표준물질과 시료 간 유사하여 정성분석 결과를 확인하였다(Table 2). 따라서, GC-MS/SIM 및 UHPLC-MS/MS 분석법을 통해 돼지고기 시료의 콜레스테롤을 정성 분석하였으며, 분석법의 특이성을 검증하였다.
돼지고기 일반부위(10종), 특수부위(6종)와 가공육(베이컨)의 삶기 전후 콜레스테롤 함량을 Table 2에 제시하였다. 생 돼지고기의 콜레스테롤 함량은 47.68-178.05 mg/100 g 범위였으며, 두항정살(178.05 mg/100 g)에서 가장 높고, 그 다음으로 설하살(175.37 mg/100 g)과 앞다리(153.76 mg/100 g)에서 높았다. 삶은 돼지고기의 콜레스테롤 함량은 6.66-246.05 mg/100 g으로 생 돼지고기에 비해 더 넓은 범위를 보였다. 이 중 설하살(246.05 mg/100 g)은 삶은 후에도 높은 콜레스테롤 함량을, 다음으로 뽈항정살(169.64 mg/100 g)과 두항정살(163.05 mg/100 g) 순으로 높았다. 본 연구 결과는 국가표준식품성분표 DB에서 제공된 안심, 사태와 족발(68-111 mg/100 g)보다는 낮은 수준이었으나, 머리고기, 삼겹살, 앞다리, 베이컨(55-110 mg/100 g)보다는 높은 경향이었다(RDA, 2024). 생 앞다리, 미박과 뒷다리(간것)의 콜레스테롤 함량은 국가표준식품성분표 DB 값(62-63 mg/100 g)보다 높았으나, 삶은 후에는 96.70-110.54 mg/100 g으로 상대적으로 낮았다. 조지방 대비 콜레스테롤 함량 비율은 생 돼지고기의 일반부위에서 0.28-2.05%, 특수부위에서 0.4-1.01%, 삶은 돼지고기에서 각각 0.27-1.65%와 0.50-1.20%이었다.
삶은 후 돼지고기 콜레스테롤 함량은 8.03%(미박 앞다리살)-109.78%(관자살) 증가하였고 지방 함량 변화와 비례하는 경향을 보였다(껍데기, 앞다리, 뒷다리, 족발, 두항정살과 뽈살 부위 제외; Table 2). 본 연구 결과는 RDA의 생 돼지고기(53.39-88.00 mg/100 g)를 삶았을 때(90.08-111.36 mg/100 g) 콜레스테롤 함량이 증가하는 경향과 유사하였으며(RDA, 2024), 지방 함량과 콜레스테롤 함량 간의 높은 상관관계가 있다고 보고한 Dorado 등(1999)의 연구 결과와 유사하였다(Dorado 등, 1999). 조리 시 수분 손실로 인해 전체 중량 대비 지방의 비율이 상대적으로 증가하여 콜레스테롤 함량이 증가한 것으로 생각된다. Park 등(2017)과 Bowers 등(1987)은 닭고기와 쇠고기를 가열 처리할 경우 근섬유 단백질의 수축 및 근절의 단절로 인해 수분이 손실되면서 지방 함량이 증가한다고 보고한 바 있다(Bowers 등, 1987; Park 등, 2017).
콜레스테롤은 담즙산 대사, 호르몬 합성 등 인체 대사 과정에서 중요한 생리적 기능을 하지만, 과잉 섭취 시 고혈압, 동맥경화 등 심혈관계 질환을 유발할 수 있어 하루 상한 섭취량은 300 mg 이하로 권고된다(MHW, 2020). 본 연구에서 삶은 돼지고기 100 g 섭취 시 일반부위의 콜레스테롤 섭취량은 6.66-135.58 mg/100 g으로 권고 섭취량의 2-45%를 차지하고, 특수부위는 66.35-246.05 mg/100 g으로 권고 섭취량의 22-82%을 차지하므로 섭취 시 주의가 필요함을 시사한다.
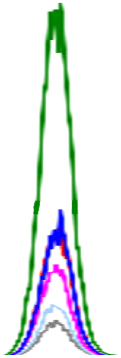
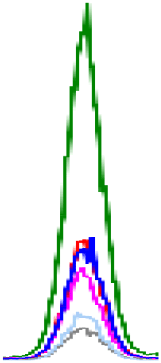
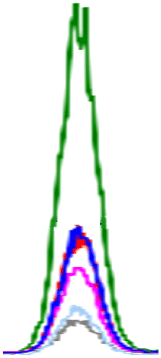
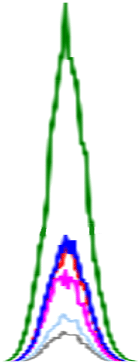
생 돼지고기에서 확인된 인지질은 PE, PC, SM, LPE, LPC이며, 이 중 PC 함량이 가장 높은 19.22-317.28 mg/100 g의 범위를 보였다. 다음으로 PE(5.34-31.81 mg/100 g), SM(8.20-36.91 mg/100 g)의 순으로 높은 함량을 나타내었다. LPE(5.43-8.37 mg/100 g)는 뽈살과 사태, LPC(10.89-12.36 mg/100 g)는 관자살과 뽈살에 미량으로 존재하거나 검출되지 않았다(Table 3, Fig. 2). 총 인지질 함량은 27.42-386.69 mg/100 g으로 넓은 범위를 보였고, 조지방 대비 총 인지질 함량의 비율은 0.18-10.36%로 다양하였다. 그중 안심의 지방 함량은 2.51-6.20 g/100 g으로 낮지만, 인지질 함량은 260.14-515.38 mg/100 g으로 조지방 대비 총 인지질 함량이 8.31-10.36%로 가장 높았다. 반면, 지방 함량이 가장 높은 두항정살(43.57%)은 조지방 대비 총 인지질 함량이 0.16-0.18%로 낮았다.
PLs, phospholipids; PE, phosphatidylethanolamine; PC, phosphatidylcholine; SM, sphingomyelin; LPE, lyso-phosphatidylethanolamine; LPC, lyso-phosphatidylcholine.
A-KMeans with different capital letters in the same column are significantly different among boiled pork by Duncan’s multiple range test p<0.05).
a-kMeans with different small letters in the same column are significantly different among raw pork’s by Duncan’s multiple range test p<0.05).
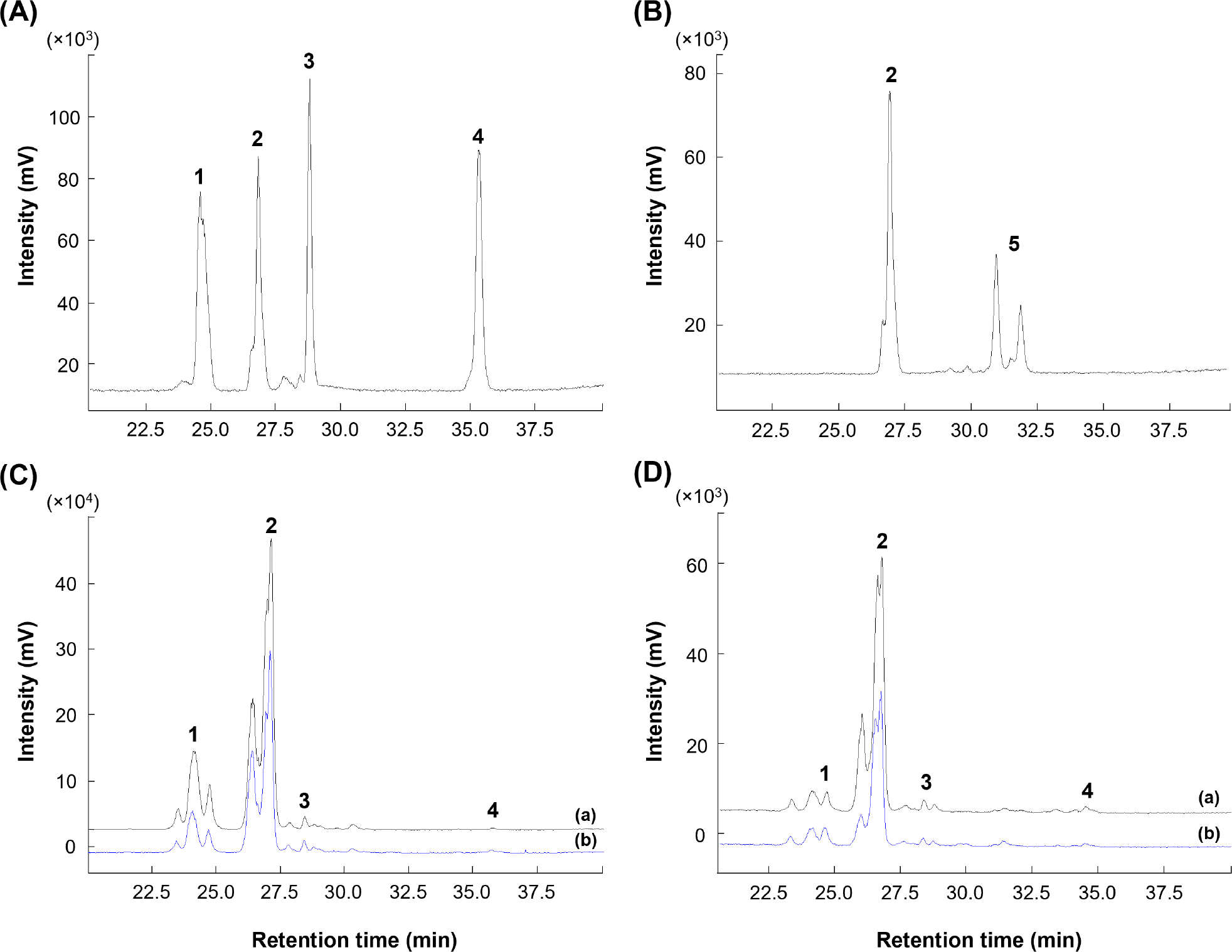
삶은 돼지고기의 주요 인지질은 PC(1.62-429.17 mg/100 g), PE(3.34-48.22 mg/100 g), SM(1.53-43.86 mg/100 g)이고, 부위에 따라 LPC과 LPE가 미량 존재하거나 미검출 되었다. 특히, LPC는 삶은 돼지고기의 관자살, 앞다리살, 뒷다리살과 족발에서만 확인되었다. 총 인지질 함량은 4.27 mg/100 g(족발)-515.38 mg/100 g(안심)으로, 생 돼지고기보다 1.07배(베이컨)-2.02배(삼겹살) 높았다(껍데기, 두항정살, 뽈살, 앞다리살, 뒷다리살, 족발 부위는 제외). 총 인지질 함량 비율은 조지방 함량 대비 0.16(두항정살)-8.31%(안심)의 범위를 보였다. 삶는 조리 전후 비교 결과, 일반 부위, 특수 부위 및 가공육(베이컨)에서 인지질 함량이 증가하는 경향을 보였다. 일반 부위(항정살, 삼겹살, 안심, 사태, 앞다리)는 PE 1.42-1.95배, PC 1.36-2.83배, SM 1.39-2.96배 증가하였고 사태 부위에서 LPE가 2.26배 증가하였다. 또한, 특수 부위(관자살, 뽈항정살, 덜미살)는 PE 1.53-1.73배, PC 1.09-1.46배 증가하였고 관자살 부위에서 LPC가 1.63배 증가하였다. 가공육인 베이컨에서도 조리 후 PC와 SM이 각 1.05배, 1.31배 증가하였다. 이는 조리 과정에서 수분이 손실되어 전체 중량 대비 인지질 함량이 증가한 것으로 보인다. 따라서, 돼지고기의 인지질 조성과 함량은 부위별 및 조리 과정에 따라 차이가 있으며, 일부 부위에서는 조리 후 인지질 함량이 현저히 증가함을 확인하였다.
PC는 지질의 소화 및 흡수(Blesso, 2015; Kennelly 등, 2018), 신경전달물질인 아세틸콜린의 생성(Blusztajn과 Wurtman, 1983), 혈중 콜레스테롤 농도 감소(Bahn 등, 2005; Park 등, 2006)와 항염 작용(Hartmann 등, 2009) 등의 다양한 생리활성에 관여한다. SM은 암세포 성장을 억제 및 예방 효과를 가지며(Schmelz, 2004), PE는 세포막의 유동성 증가시키고(Dawaliby 등, 2016), triglyceride와 지방산 대사 조절 인자를 활성화하여 비알코올성 지방간염(NASH) 개선에 기여한다(Grapentine 등, 2022). 인지질 함량이 높은 부위의 돼지고기 섭취는 건강에 긍정적 영향을 줄 수 있으나, 설하살과 삼겹살 등과 같은 지방 함량이 높은 부위는 과잉 섭취시 유의가 필요하므로, 소비자의 합리적인 선택과 섭취가 요구된다.
생 돼지고기의 주요 지방산은 oleic acid(C18:1n9, 38.2-49.9%), palmitic acid(C16:0, 22.4-27.7%), linoleic acid(C18:2n6, 6.7-17.4%), stearic acid(C18:0, 6.1-12.8%)이고, palmitoleic acid (C16:1, 2.5-4.8%)와 myristic acid(C14:0, 1.3-2.1%)은 미량 존재하였다(Table 4). 선행연구에서도 돈육의 주요 지방산은 oleic acid(33.4-34.2%), palmitic acid(19.3-24.1%), linoleic acid(13.9-19.5%), stearic acid(9.3-10.4%)으로 보고되고(Jang 등, 2017), 암퇘지의 등심, 뒷다리살, 삼겹살, 목살의 지방산은 oleic acid(36.40-42.57%)와 palmitic acid(24.06-25.47%)가 가장 높고, 단일불포화지방산이 40% 이상, 포화지방산은 30% 이상 함유됨을 보고하여(Duan 등, 2024; Wojciak 등, 2021), 본 연구 결과와 유사하였다. 총 포화지방산 함량은 32.3-43.2%, 총 불포화지방산 함량은 56.8-67.7%, 이중 단일불포화지방산은 44.0-58.3%, 다중불포화지방산은 8.6-20.1%이었다. 부위별 지방산 조성을 비교하면 포화지방산 함량은 생 삼겹살(43.2%)에서 유의적으로 가장 높고(p<0.05), 불포화지방산 함량은 껍데기(67.7%)에서 유의적으로 가장 높았다(p<0.05). 삶는 조리 과정 전후의 돼지고기 부위별 지방산 조성은 유사한 경향을 보였다. 이는 조리(삶기) 전후의 등심 부위 지방산 조성의 유의적인 차이가 없다고 보고한(p>0.05) 선행연구 결과와 유사하였다(Sugiyama과 Ishinaga, 1999).
SFA, saturated fatty acid; USFA, unsaturated fatty acid; MUFA, monounsaturated fatty acid; PUFA, polyunsaturated fatty acid.
A-KMeans with different capital letters (A-K) in the same column are significantly different among boiled pork by Duncan’s multiple range test (p<0.05).
NSIndicates not significantly different within the same variety of raw and boiled pork by Student’s t-test (p<0.05).
돼지고기에 가장 많이 함유된 oleic acid는 생 족발에 49.9%으로 가장 높았고, 안심(38.2%)과 비교해 1.31배 높은 수준으로 삶는 조리 후에도 동일한 수준으로 분석되었다. 또한, 앞다리살(picnic)에는 41.7-42.1%이지만, 껍질을 제거하지 않은 미박 앞다리살(picnic with skin)에는 46.6-46.7%로 분석되어(p<0.05), 돼지고기 부위별 정형 작업 시 껍질이 포함된 경우 oleic acid의 함량이 높을 것으로 생각된다. Oleic acid는 섭취 시 thromboxane A2의 분비와 low density lipoprotein(LDL) 농도를 감소시켜 심혈관질환 위험 요소를 조절한다고 보고된다(Bermudez 등, 2011; Karacor과 Cam, 2015). Palmitic acid는 생 삼겹살에 27.7%로 가장 높고, 생 껍데기(22.4%)와 족발(22.4%)에서 가장 낮았다(p<0.05). 삶은 삼겹살에는 27.4%, 족발에는 22.0%로 함유되어, 삶은 조리 후에도 유사한 함량으로 유지되었다(Agostoni 등, 2016). Palmitic acid는 과잉 섭취 시 이상지질혈증(dyslipidemia), 고혈당증(hyperglycemia), 이소성지방(ectopic fat) 증가와 같은 질환이 발생한다고 보고되었고(Carta 등, 2017), 선행연구에 따르면 다가불포화지방이 낮은 식이에 다량의 palmitic acid를 평균 24세 남성들에게 공급하였을 때 혈청 총콜레스테롤과 LDL 콜레스테롤 농도를 증가한다는 결과를 보고하였다(Clandinin 등, 2000).
돼지고기는 조리 전후 모두 oleic acid가 풍부하고 필수지방산인 linoleic acid를 함유하지만, 포화지방산인 palmitic acid와 stearic acid의 함량이 높아 소비자들은 건강을 고려하여 돼지고기 구입 시 적절한 부위를 선택하여 섭취할 필요가 있다.
콜레스테롤 분석법은 특이성, 직선성, 민감도(LOD, LOQ), 정확성과 정밀성으로 검증하였다(Table 5). 특이성(specificity)은 GC-FID, GC-MS/SIM과 UHPLC-MS/MS로 정성분석한 결과(Fig. 1과 Table 1), 직선성(linearity)은 검량선의 상관계수(R2=0.9997) 값으로 검증하였다. 민감도(sensitivity) 검증을 위한 LOD는 분석 성분을 검출할 수 있는 최소량 또는 최저 농도를 의미하며, LOQ는 사용된 분석 조건 하에서 허용 가능한 정밀성과 정확성을 가지고 특정 성분을 정량할 수 있는 최소량 혹은 최저 농도를 의미한다. 본 연구에서는 GC-FID으로 콜레스테롤을 분석한 결과, LOD와 LOQ는 각각 2.73 mg/100 g과 3.82 mg/100 g이었고, 이 결과는 Dinh 등(2012)이 보고한 육류와 가금류의 콜레스테롤 정량분석 시의 LOD 1.24 mg/100g과 LOQ 3.76 mg/100 g과 유사하였다(Dinh 등, 2012). 정확성(accuracy)은 회수율(recovery rate, %)로 검증하였다. 두항정살 추출 지방(0.2 mg/mL)에 콜레스테롤 표준물질 0.1-0.8 μg/mL를 spiking 첨가하여 정량 분석한 결과, 모든 농도에서 회수율은 98.02-103.03%이었다. 정밀도(precision)는 상대표준편차(RSD)로 검증하였으며, 콜레스테롤의 함량이 1,000 mg/100 g인 경우 RSD가 4% 이하 수준으로 수용되며, 함량이 1 mg/100 g인 경우 12% 이하 수준이면 우수하다고 볼 수 있다(AOAC, 2016). 본 연구에서는 0.20-14.81%의 RSD를 보였다.
인지질 분석법은 특이성, 직선성, LOD 및 LOQ으로 검증하여 Table 6와 Fig. 2에 제시하였다. 특이성은 인지질 PE, PC, SM, LPC와 LPE 표준물질의 돼지고기 시료의 HPLC-ELSD 크로마토그램의 RT를 비교한 정성분석 결과로 검증하였다. 직선성은 인지질 표준용액의 PE, PC, SM, LPC를 9개, LPE는 8개의 농도로 제조하여 이차함수로 검량선을 작성하고 구한 R2=0.9993-0.9999로 정량분석의 직선성을 검증되었다. HPLC-ELSD를 이용한 인지질 분석의 LOD는 0.14-0.26 μg/mL, LOQ는 0.40-0.86 μg/mL으로, LPC 분석에서 가장 낮은 LOD와 LOQ 값을 나타내었다. 이 결과는 Cascone 등(2006)이 HPLC-CAD으로 인지질 정량 분석하였을 때의 LOD 13.12-17.55 μg/mL와 LOQ 39.37-52.65 μg/mL보다 낮음을 확인하였다(Cascone 등, 2006).
4. 요약
돼지고기는 국내에서 가장 많이 소비되는 육류이지만, 부위별 지방 프로파일 및 조리 전후의 데이터베이스는 제한적인 실정이다. 본 연구에는 돼지고기의 부위별 지방 프로파일(조지방, 콜레스테롤, 인지질, 지방산)을 조리 전후 비교하였다. 생 돼지고기의 조지방 함량은 2.51-43.57%이고, 조리 후에는 0.83-49.76%로 부위에 따라 증가 또는 감소하였다. 생 돼지고기의 콜레스테롤 함량은 47.68-178.05 mg/100 g, 조리 후 6.66-246.05 mg/100 g으로 부위에 따라 다양하고 넓은 범위의 함량을 가졌으며, 이중 설하살은 175.05-246.05 mg/100 g으로 조리 전후 모두 높은 함량을 보였다. 돼지고기의 인지질은 PE, PC, SM, LPE, LPC으로 구성되었으며, 함량은 PC(1.62-429.17 mg/100 g) > PE(3.34-48.22 mg/100 g) > SM(1.53-43.86 mg/100 g) 순으로 높았다. LPE(5.43-12.27 mg/100 g)는 뽈살과 사태, LPC(1.12-25.86 mg/100 g)는 관자살과 뽈살에 미량으로 존재하거나 검출되지 않았고 조리 후 인지질 함량은 증가하는 경향을 보였다. 돼지고기의 주요 지방산 조성은 oleic acid > palmitic acid > linoleic acid > stearic acid 순으로 높았으며, 조리 전후 지방산 조성은 큰 차이를 보이지 않았다. 또한, 분석법의 특이성, 직선성, 민감도, 정밀도, 정확도를 검증하여 콜레스테롤과 인지질 분석값의 신뢰성을 확보하였다. 본 연구 결과는 삶는 조리에 따른 돼지고기의 부위별 지방 프로파일에 대한 표준화 데이터 구축의 기초자료로 활용할 수 있을 것이다.