1. 서론
최근 코로나-19 바이러스의 전 세계적인 유행과 분자생물학의 급격한 발전으로 세포 내의 거대한 네트워크로부터 이루어지는 신호전달 과정 조절에 따른 자연방어 시스템과 이에 작용하여 생체의 반응을 조절할 수 있는 생체 응답조절제(biological response modifier, BRM)에 대한 연구들이 활발히 이루어지고 있다(Ikewaki 등, 2022; Shim 등, 2004). BRM은 생체 내에서 독성을 거의 나타내지 않으면서 인체 내 부작용 없이 환경적, 생물학적 스트레스에 적용할 수 있도록 도와주는데, 다당체는 대표적인 BRM 중 하나이다(Cho, 2013; Hong, 2011; Lee와 Shin, 2020). 천연유래 다당체는 추출 및 분리를 위한 급원에 따라 곰팡이, 고등식물, 이끼 또는 조류, 동물 및 박테리아 유래의 5가지로 나눌 수 있으며, 약 300여 종이 연구되었는데, 고분자 다당체의 분자량은 평균 3,500-2,000,000 Da으로 면역조절, 항종양, 항염증 및 항산화 등과 같은 생리활성을 지닌다(Ha 등, 2017; Hong, 2011). 천연유래, 특히 인삼, 버섯, 동충하초, 알로에 등으로부터 얻어지는 식물 유래 다당은 낮은 독성과 약리활성을 지녀 이들을 새로운 기능성 식품소재로 활용하기 위한 연구가 활발히 진행되고 있다(Cha 등, 2021).
다당체를 유효성분으로 하는 대표적인 고등식물인 알로에는 건조한 환경에서도 생육 가능하며 환경에 맞추어 변이종들이 생겨나, 전 세계적으로 500여 종 이상이 존재하고, 이 중 75%는 현지에서 의학 및 기타 목적으로 사용되지만, 상업적으로 사용되는 종은 극소수로 우리나라 건강기능식품 공전에서는 Aloe vera(베라), Aloe arborescence(아보레센스), Aloe saponaria(사포나리아)가 원료로 인정되어 있다(Ahl 등, 2018; Lee 등, 2012). 알로에의 다당류는 분자 크기 변화에 따라 치료 효과가 달라지는데, 분자량이 적은 것은 항염증 효과가 우수하고, 200 kDa 이상의 분자량이 큰 것은 면역작용 효과를 가지는데, 5,000-50,000 Da 범위의 다당체는 위궤양 억제 및 치료 효과가 있는 것으로 알려져 있으며, 외피 주변일수록 분자량이 더 큰 다당체를 얻을 수 있다(Beak, 2008; Lee 등, 2012).
알로에는 녹색의 외피와 젤로 불리는 내부의 투명한 육질부로 구성되어 있는데, 육질부의 약 99%는 수분이고, 1% 정도는 다당체가 주요 성분으로, 이 중 3개의 mannose 분자당 하나의 acetyl group을 가지고 있는 acetylmannan이 60% 이상 함유되어 점액성을 부여하며 생리활성을 나타낸다(Im 등, 2016; Ryu와 Shin, 1997). 알로에 잎에서 추출된 acemannan은 대식세포의 탐식력 및 세포 표면분자의 발현을 증가시키며, 활성화된 대식세포는 여러 cytokine을 신호전달 매개체로 하여 T 세포를 활성화시킴으로써 백혈구의 생산 촉진, 면역력 강화, 방사선에 대한 방어효과 및 항암효과를 가지는 것으로 알려져 있다(Im 등, 2016; Wang 등, 2004).
이러한 기능성을 토대로 국내에서는 알로에를 활용한 식초(Lee 등, 1999), 식빵 및 베이글과 같은 빵류(Shin 등, 2007), 쿠키(Yu, 2014), 설기떡(Hwang과 Yoon, 2006), 생면(Jang 등, 2016) 등과 같은 가공품 개발 연구가 진행되어 있다. 생리활성 규명과 관련하여 알로에 베라 및 알로에 센스의 염증억제 효과(Cho 등, 2006), 알로에 베라 추출물이 간세포에 미치는 영향(Kim과 Kwon, 2006) 및 간독성에 대한 보호효과(Lim, 2008), 핑크 알로에의 항산화 및 세포재생활성(Lee 등, 2020) 등에 관한 연구와 더불어 알로에로부터 유효성분인 알로인의 분리 및 정량을 위한 연구(Kim 등, 1996), 다당체인 acemannan의 면역력 증강 효능(Im 등, 2016), acetylmannan의 ACE 저해활성(Ryu와 Shin, 1997) 및 가공조건을 최적화하기 위한 연구들이 수행되어 있다.
하지만 이들 연구들에서는 거의 대부분이 알로에 베라를 주 소재로 사용하고 있어 아보레센스나 사포나리아를 소재로 한 기능성 규명 및 산업적 활용을 위한 연구는 거의 진행되어 있지 않다. 알로에 베라는 줄기가 짧고 길이는 50-60 cm이며, 잎이 두껍고 색은 회백록색으로 기부는 넓지만 끝으로 갈수록 좁고 뾰족하며 잎의 가장자리에는 가시가 있다(Park과 Kim, 2002). 알로에 사포나리아는 잎에 흰색의 불규칙적인 반점이 있고, −7°C 이하의 온도에서도 생육 가능하며, 사포닌 함량이 더 높고 안트라퀴논(anthraquinone) 함량에서 차이를 가진다(Choi 등, 2016; Kweon 등, 2020). 사포닌은 영양소 흡수조절, 혈청콜레스테롤 감소, 항종양 및 항돌연변이 활성과 면역체계 보완효과를 가지며(Choi 등, 2016), 안트라퀴논류들은 단순포진 바이러스에 대한 항독성 작용과 저혈당 작용이 있다(Park 등, 1996). Anthraquinene glycoside인 바바로인(barbaloin)은 알로에의 항바이러스성 면역조절기능을 나타내는 대표적인 유효성분으로, 알로인(aloin)으로 불리는 황색의 쓴맛을 내는 물질로 하제작용을 나타낸다(Cho 등, 2006; Park 등, 1996).
본 연구에서는 상대적으로 온난한 기후로 인해 노지재배가 가능한 남해군에서 생산된 알로에 사포나리아의 기능성 규명을 위한 연구의 일환으로 투석막으로 다당체를 분리하여 항산화활성 및 세포 수준에서 항염증 활성을 검증하였다.
2. 재료 및 방법
경남 남해군에서 노지 재배된 잎 길이 25±7 cm, 폭 10±2 cm 크기의 알로에 사포나리아 잎을 재배농장에서 구입하여 실험재료로 사용하였다. 알로에 잎은 흐르는 물에 세척하여 자연건조한 다음 옆면의 가시 부위를 제거하고, 수평으로 6±1 cm 정도의 높이로 절단하여 열풍건조(60°C, 48-72 h)와 동결건조하였다. 건조 전 무게 대비 건조 후 무게로부터 건조수율을 산출하였으며, 건조된 알로에는 분쇄한 다음 분석 및 추출에 사용하였다.
알로에 분말에 3차 증류수를 가하여 3%(w/v) 수용액이 되게 수화시키고, 80°C에서 15시간 추출, 여과한 액을 동결건조하여 알로에 열수추출 분말을 제조하였다(HWE). 열수추출 분말에 무게 대비 100배의 3차 증류수(18.2 MΩ, Milli-Q, Millipore Co., Darmstadt, Hessen, Germany)를 가하여 6시간 간격으로 투석액을 교체하면서 3,500 mwco 투석막(50 mm, Themoscientific, Waltham, MA, USA)으로 24시간 동안 투석하였다. 투석 완료 후 투석 내액을 취하여 다시 동결건조하여 분말화한 것(IDS)을 알로에 다당체로 하여 활성검증용 시료로 사용하였다.
시료 중의 총다당체와 안트라귀논계 화합물은 건강기능식품 기준 및 규격에 따라 정량하였다(식품의약품안전처 식품공전, 2021). 총 다당체 정량을 위해 분말시료 1 g에 3차 증류수를 가하고, 2시간 동안 교반하여 충분히 용해 및 수화시킨 후 50 mL로 정용한 다음 원심분리(5,000 rpm, 30분)하여 상등액을 취하였다. 투석 전 1시간 동안 3차 증류수에서 활성화시킨 투석막에 상등액 25 mL를 담아 6시간 간격으로 투석외액을 교체하면서 24시간 동안 투석한 다음 투석내액을 50 mL로 정용해 시험용액으로 사용하였다. 시험용액과 표준용액 각각 200 μL에 5% phenol 용액 1 mL를 가하고 vortex mixer로 혼합한 후, sulfuric acid 5 mL를 가하여 상온에서 20분간 반응시킨 다음 분광광도계(Libra S35, Biochrom, Cambridge, UK)를 이용하여 490 nm에서 흡광도를 측정하고, 표준검량곡선으로부터 함량을 산출하였다. 이때 표준용액은 mannose(Sigma-Aldrich Co., St. Louis, MO, USA)를 10%(w/v) 농도가 되도록 증류수에 녹인 것을 0.01-0.5 mg/mL의 범위에서 단계별로 희석하여 사용하였다.
안트라퀴논계 화합물 함량은 알로에 분말 1 g에 methanol과 물 10 mL씩을 순차적으로 가한 다음 물 75 mL를 추가하여 30분간 진탕 혼합한 것을 여과지로 여과한 여액에 물을 가하여 200 mL가 되도록 하였다. 이 용액 10 mL를 취하여 60% 염화 제2철 용액 1 mL와 진한 염산 6 mL를 혼합한 후 1시간 동안 환류냉각시키면서 가열하였다. 가열 후 식힌 시험용액과 3차 증류수 5 mL, 1 N sodiumhydroxide 4 mL, dichloromethan 20 mL를 가하여 충분히 혼합한 다음 dichloromethan 층을 회수하였다. dichloromethan 층을 3회 반복 추출한 액을 모두 모아 100 mL로 정용하였다. 이 액 20 mL를 취하여 감압농축하고 잔류물에 methanol에 녹인 0.5% magnesium acetate 용액 10 mL를 가해 용해한 후 512 nm에서 methanol을 대조액으로 하여 흡광도를 측정한 다음, hydroxyanthracene 유도체 성분을 무수바바로인으로 산출하였다.
시료의 총페놀 함량은 Gutfinger(1981)의 방법을 변형하여 test tube에 1 mg/mL의 농도로 추출물을 증류수에 용해한 시료액 1 mL와 Foline-Ciocalteau 시약 1 mL를 넣고 3분 후 10% sodiumcarbonate 용액 1 mL를 혼합하여 실온의 암실에서 1시간 정치한 다음 760 nm에서 흡광도를 측정하였다. 표준물질로 gallic acid(Sigma-Aldrich Co.)를 사용하여 시료와 동일한 방법으로 분석해 얻은 검량선으로부터 총페놀 화합물의 함량을 산출하였다.
2,2-Azinobis-(3-ethylbenzo-thiazoline-6-sulphon-ate)(ABTS) 라디칼과 1,1-diphenyl-2-picrylhydrazyl (DPPH) 라디칼을 소거하는 시료의 IC50값을 산출하여 항산화 활성을 평가하였다. ABTS 라디칼 소거활성은 Re 등(1999)의 방법을 변형하여 7 mM의 ABTS 용액에 potassium persulfate를 2.4 mM이 되도록 용해시켜 암실에서 12-16시간 동안 반응시킨 후 415 nm에서 흡광도가 1.5가 되도록 증류수로 조정한 ABTS 용액 100 μL에 동량의 시료액을 혼합하고, 실온에서 10분간 반응시킨 다음 효소반응흡광광도계(Perkin-Elmer Inc., Waltham, MA, USA)를 이용하여 415 nm에서 흡광도를 측정하였다. DPPH 라디칼 소거활성은 Blois(1958)의 방법을 응용하여 DPPH 용액(5 mg/100 mL ethanol) 80 μL와 시료 120 μL를 혼합한 다음 실온에서 20분간 반응시킨 후 분광광도계를 이용하여 525 nm에서 흡광도를 측정하였다. ABTS 및 DPPH 라디칼 소거활성은 시료첨가구와 무첨가구의 흡광도 차이를 백분율로 산출하여 농도별 시료의 활성을 비교하였으며, 시료의 농도별 흡광도값으로부터 일차방정식을 구하여 라디칼 형성을 50% 억제하는 데 필요한 시료의 양(IC50, μg/mL)을 산출하였다.
RAW 264.7 마우스 대식세포는 한국세포주은행(KCLB, Korea Cell Line Bank, Seoul, Korea)에서 분양받아 사용하였다. RAW 264.7 대식세포는 10% fetal bovin serum (FBS, Gibco, Rockville, MD, USA) 및 1% penicillin (250 units/mL, Gibco)을 포함하는 DMEM(Gibco) 배지를 이용하여 37°C, 5% CO2 조건의 배양기에서 배양하였다.
세포에 대한 독성 측정은 3-(4,5-dimethylthiazole-2-yl)-2,5–diphenyltetrazolium bromide(MTT, Sigma-Aldrich Co.) 환원방법을 이용하여 측정하였다. 세포를 96 well-plate에 well당 5×104개가 되도록 분주하고 24시간 부착시킨 후, 시료 추출물 2종을 일정한 농도로 희석하여 세포에 처리한 다음 30분 후 0.5 μg/mL가 되도록 lipopolysaccharide(LPS, Sigma-Aldrich Co.)를 처리하여 24시간 동안 배양하였다. 이후 시료를 포함하는 배지를 제거한 후 serum-free 배지와 5 mg/mL의 MTT 용액을 첨가하였다. 37°C에서 1시간 더 배양한 다음 DMSO (Amresco, Solon, OH, USA) 용액을 분주하고, 10분간 교반하여 ELISA reader(Epoch BioTeck Instrument, Wiesbaden, VT, Germany)를 사용하여 570 nm에서 흡광도를 측정하였다. 세포 생존율은 LPS 처리군에 대한 백분율로 산출하였다.
NO 생성율은 RAW 264.7 대식세포를 6×104 cells/well의 농도로 24-well plate에 분주하여 24시간 배양한 후에 50 μg/mL와 100 μg/mL 농도의 각 추출물을 처리한 다음, 30분 뒤 LPS(0.5 μg/mL)를 처리하여 20시간 배양하였다. 이후 세포 배양액을 회수하고 원심분리(3,000 rpm, 5 min, 4°C)하여 얻은 세포 상등액을 Griess reagent system kit(Promega Corp., Madison, WI, USA)와 반응시킨 후 ELISA reader(Epoch BioTeck Instrument)를 이용하여 540 nm에서 흡광도를 측정한 다음 LPS 단독 처리 세포군에 대한 상대적인 생성율로 나타내었다.
시료 추출물들의 intracellular ROS 생성율은 intracellular ROS assay kit(Cell biolabs, San Diego, CA, USA)를 이용하여 측정하였다. 96 well black plate에 5×104 cell/well의 RAW 264.7 세포를 분주하여 20시간 배양한 후 각 시료를 농도별로 처리한 다음 30분 뒤 LPS(0.5 μg/mL)를 처리하고 24시간 더 배양하였다. PBS(pH 7.4, Gibco)로 3회 세척한 다음 1× DCFH-DA를 배지에 100 μL 첨가하여 1시간 배양한 후 다시 PBS로 3회 세척하였다. Lysis buffer 100 μL를 첨가하고 혼합한 후 효소반응흡광광도계(Perkin-Elmer Inc., Waltham, MA, USA)로 excitation 485 nm, emission 535 nm에서 형광을 측정하여, LPS 단독 처리군에 대한 상대적인 ROS 생성 억제율로 표기하였다.
Cytokine인 interleukin-1 beta(IL-1β), interleukin-6 (IL-6) and tumor necrosis factor-alpa(TNF-α) 생성량 측정을 위하여 RAW 264.7 세포를 24 well plate에 0.6×106 cell/well의 농도로 분주한 다음 24시간 배양하였다. 여기에 각 시료 추출물(50, 100 μg/mL)을 처리한 다음 30분 뒤 LPS(0.5 μg/mL)를 처리하였다. 이를 다시 20시간 배양한 후 세포의 상층액을 모아서 각각의 ELISA kit(Invitrogen Corp., Camarillo, CA, USA)를 이용하여 측정하였다.
3. 결과 및 고찰
남해산 사포나리아 알로에 잎의 열풍건조 수율은 3.72%였고, 동결건조 수율은 3.46%로 건조방법에 따른 수율의 차이는 미미하였다(Table 1). 생알로에 겔의 수분 함량은 98.5-99.5%라고 보고되어 있는데(Hamman, 2008), 본 연구에서는 알로에 겔만 분리하지 않고, 가시 부위만 제거한 후 껍질을 포함하여 건조하였기 때문에 상대적으로 수율이 더 높게 정량된 것으로 생각된다.
건강기능식품 공전(식약처, 2021)에서 알로에의 대표적인 지표성분은 총 다당체와 안트라퀴논계 화합물로써, 알로에 베라로부터 분리한 겔 분말의 경우 피부건강, 장 건강, 면역력 증진에 도움을 줄 수 있고, 안트라퀴논계 화합물의 함량은 0.005% 이하가 되어야 한다. 반면 알로에 전잎을 이용할 경우 배변활동 원활에 도움을 줄 수 있으며, 무수바바로인을 20-30 mg 함유하고 있어야 한다.
건조 방법에 따른 사포나리아의 총당 및 다당체 함량은 열풍건조하였을 때 동결건조한 알로에에 비해 유의적으로 높은 함량이었고, 안트라퀴논 함량은 두 시료 모두 건강기능식품 지표성분 규격을 만족하였으며, 건조방법에 따른 유의적인 차이는 없었다. 사포나리아의 총페놀화합물 함량도 건조방법에 따른 유의적인 차이는 없어 이후 실험에서는 열풍건조 분말을 시료로 사용하였다.
사포나리아 알로에로부터 다당체 분리를 위하여 열풍건조한 알로에 분말을 열수추출(HWE)한 다음 여과한 액을 모아 동결건조해 분말화하였다. 동결건조 분말을 24시간 동안 투석하여 얻어진 투석 내액을 회수하여 동결건조한 다당체 추출물(IDS)을 사포나리아 다당체로 하여 실험에 사용하였다.
이들 시료 제조 시 투입된 시료 무게 대비 얻어진 건물량으로부터 수율을 산출한 결과(Table 2), 투석막을 통해 얻어진 다당체의 수율은 27.1%로 투석 전 열수추출물에 비해 6.6% 더 수율이 높았다. HWE와 IDS 중의 총 다당체 함량은 각각 180.38 mg/g과 195.32 mg/g으로 통계적인 유의차가 없었다. 안트라퀴논의 함량은 투석을 거친 IDS에서 더 낮았는데, 이는 다당체에 비해 분자량이 적은 안트라퀴논 화합물들이 투석을 거치는 동안 투석외액으로 유출되었기 때문으로 생각된다. 총페놀화합물의 함량은 HWE에 비해 IDS에서 약 1.8배 더 높은 함량이었다.
ABTS와 DPPH 라디칼 소거능을 통해 HWE와 IDS의 항산화 활성을 평가하였다. ABTS 라디칼에 대한 항산화 활성이 DPPH 라디칼 소거활성보다 더 우수하여 IC50값은 DPPH 라디칼 소거활성이 1.7배 이상 높았다(Table 3). HWE와 IDS 간의 활성 차이도 ABTS 라디칼 소거활성의 IC50값은 IDS에서 795.76 μg/mL이었으나, HWE에서는 1.7배 더 높아 1,350.75 μg/mL이었다. 이러한 경향은 DPPH 라디칼 소거활성에서도 동일하여 HWE의 IC50값이 IDS의 1.8배 정도로 더 높았다.
HWE, hot water extract from hot-air dried saponaria aloe; IDS, intra-dialysis membrane substance from HWE.
알로에 ferox종을 물과 메탄올로 추출하여 항산화 활성을 비교한 결과, 0.1 mg/mL 이하의 농도에서는 ABTS라디칼 소거활성이 DPPH 소거활성에 비해 약 1.4-4.2배 정도 더 우수하였다고 보고(Haroon 등, 2018)되어 있다.
알로에 베라의 젤, 수분 삼출물 및 저분자 여과액을 각각 동결건조하여 항산화 활성을 비교한 결과, DPPH 라디칼보다 ABTS 라디칼에 대한 EC50값이 더 낮았으며, 수분 삼출물의 ABTS 라디칼에 대한 EC50값은 3.13 mg/mL였고, 젤과 저분자여과액의 EC50값은 이에 비해 각각 23배와 11배 정도 더 높았는데, 가장 활성이 높은 수분삼출물은 총페놀화합물과 플라보노이드의 함량이 타 시료에 비해 월등히 높았기 때문으로 보고되어 있다(Seol 등, 2012). 본 연구의 결과에서도 전처리 방법에 따라 항산화 활성에 차이가 있었으며, 페놀 화합물의 함량이 높은 시료에서 항산화 활성도 더 우수하여 알로에 추출물의 항산화 활성은 페놀 화합물이나 플라보노이드에 기인하는 것으로 판단된다.
RAW 264.7 대식세포에 독성을 미치지 않는 사포나리아 알로에 열수추출 분말(HWE) 및 투석 내액 분말(IDS)의 농도를 결정하기 위하여 MTT assay를 통한 세포생존율을 확인하였다. RAW 264.7 세포에 시료를 25-200 μg/mL의 범위로 처리한 결과(Fig. 1(A)), HWE는 200 μg/mL의 농도까지 대조구 대비 세포독성이 나타나지 않았으나 IDS는 200 μg/mL 처리 시 세포생존율이 20.62%로 크게 감소하였다.
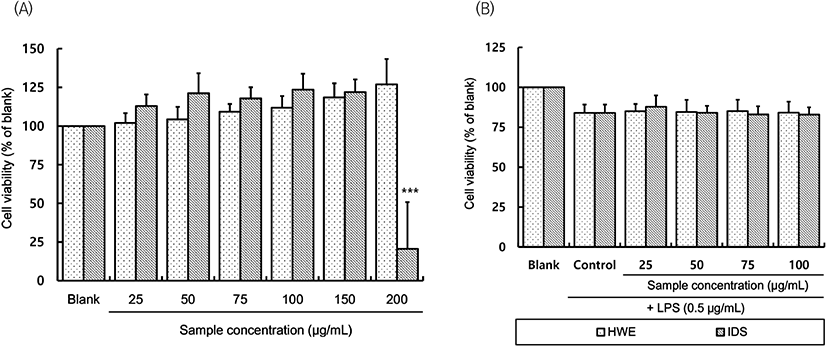
Fig. 1(B)는 세포독성이 없는 것으로 확인된 100 μg/mL 이하의 농도로 HWE와 IDS를 각각 처리하고, 30분 뒤 LPS를 처리한 후 RAW 264.7 세포의 세포생존율을 측정한 결과이다. LPS를 단독 처리(control)하였을 때 RAW 264.7 대식세포의 생존율은 무처리구(blank) 대비 82.88-87.78%로 LPS 자극으로 인한 세포독성이 관찰되었으나, LPS와 시료를 함께 처리하였을 때는 control 대비 유의적인 차이가 없어 실험된 범위 내에서 시료 처리로 인한 추가적인 세포독성은 없는 것을 확인하였다.
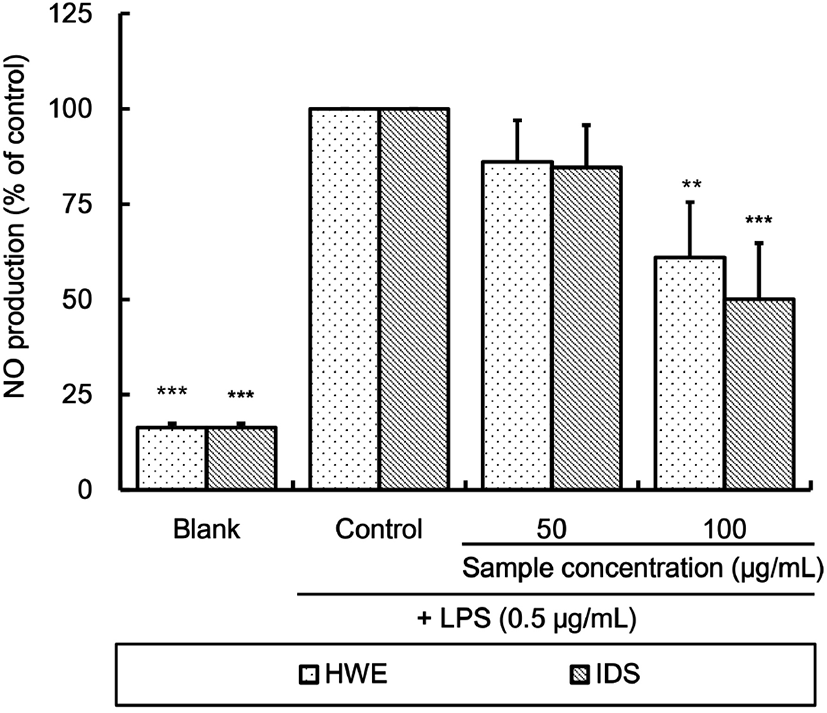
LPS를 처리하여 산화적 스트레스를 유발시킨 RAW 264.7 세포에 대한 알로에 사포나리아 열수 추출물 및 이로부터 분리한 다당체의 nitric oxide(NO) 생성 억제 효과를 측정한 결과는 Fig. 2와 같다.
RAW 264.7 대식세포를 LPS와 같은 외부 박테리아 독소에 노출시키면 inducible nitric oxide synthase (iNOS)와 cyclooxygenase-2(COX-2)에 의해 각각 NO와 prostaglandin E2(PGE2)를 포함하는 염증 유도 매개체가 분비된다(Park 등, 2009). 체내에서 iNOS는 숙주의 방어기전으로 NO를 다량 생산하는데, 과량의 NO는 COX-2의 활성을 촉진시키고 prostaglandin 등의 생합성을 유도하여 자가 면역질환을 일으키거나 만성염증을 발생시키는 것으로 알려져 있다(McCartcy-Francis 등, 1993; Pfeilschifter 등, 1996; Wolfe와 Dasta, 1995). NO는 생체 내의 2차 전달자로서 역할을 담당하는데, 면역계 방어물질로 작용하기도 하지만 병리적으로 염증반응을 매개하는 인자로도 작용하여 과도한 면역반응과 다양한 질병의 유발 인자가 되기도 하므로 염증반응의 억제와 치료를 위해서는 NO의 발생이 억제되어야 한다(Park 등, 2022).
본 실험에서도 LPS 처리를 통해 RAW 264.7 세포 내에서 NO의 생성이 증가되었으며, HWE 또는 IDS 처리를 통해 생성이 억제되었는데, 100 μg/mL의 농도로 처리하였을 때 NO 생성량은 control 대비 HWE 처리 시는 61.02% (p⟨0.01), IDS 처리 시는 50.09%(p⟨0.001)였다. 하지만 실험된 50 및 100 μg/mL 농도에서 HWE와 IDS 처리구 간에는 유의적인 차이가 없었다.
알로에 베라 및 센스 추출물을 60 및 80 μg/mL의 농도로 처리한 결과, NO 억제 활성을 나타내었다는 Cho 등(2006)의 보고와 알로에 세포외 다당체 분획물은 80-100 μg/mL의 농도에서 무처리 대조구 수준으로 NO 생성을 억제하였다는 결과(Kim 등, 2013)는 본 연구의 결과와 일치하는 경향이었다. Das 등(2011)은 알로에 베라 잎 겔에서 분리한 알로에 단백질이 lipoxygenase와 COX-2를 각각 84%, 73%를 억제하여 항염 효과가 있다고 보고한 바 있다. 본 실험의 결과, 사포나리아 알로에 추출물들의 NO 생성억제를 통한 항염 활성은 확인할 수 있었으나, 열수 추출물과 이로부터 분리한 다당체 추출물 간의 활성은 유의차가 없는 것으로 보아, 알로에의 NO 생성 억제에는 고분자 다당체 이외의 물질들이 미치는 영향이 더 큰 것으로 추정된다.
Fig. 3은 LPS 처리 RAW 264.7 세포에 대한 알로에 열수 추출물 및 열수 추출물로부터 분리한 다당체의 reactive oxygen species(ROS) 생성 억제 효과를 측정한 결과이다. 시료를 처리하지 않은 control 대비 HWE의 ROS 생성은 50 μg/mL 농도로 처리 시에는 유의적인 차이가 없었으나 100 μg/mL 농도로 처리 시 87.30%로 유의적으로 감소하였다. IDS는 50 μg/mL(86.76%)와 100 μg/mL(71.56%) 처리 시 control 대비 유의적으로 ROS 생성이 억제되었다. 동일 농도에서 IDS의 ROS 생성율은 HWE 처리 시에 비해 유의적으로 낮았다.
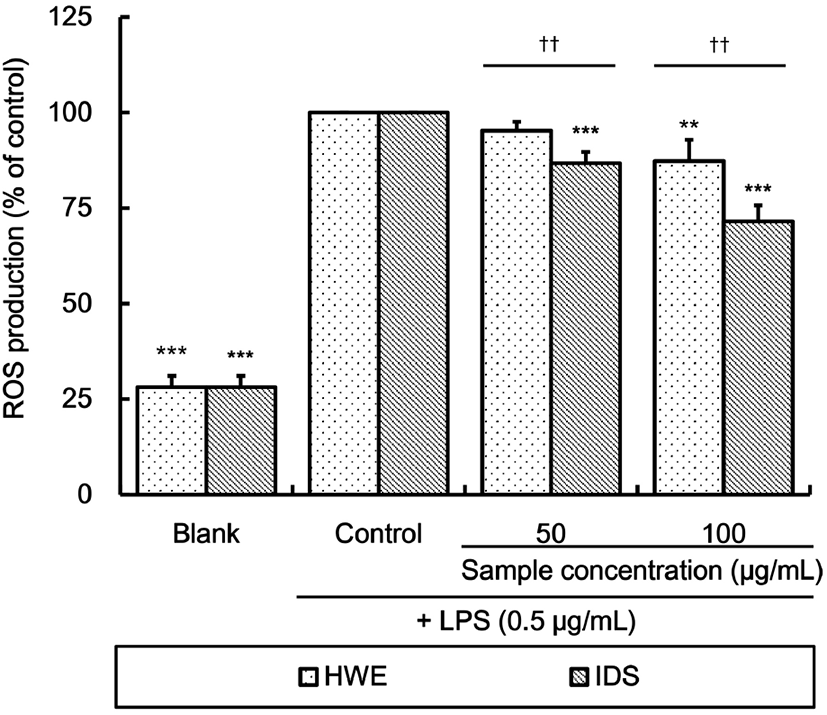
Kim 등(2011)은 플라보노이드와 폴리페놀을 많이 함유하고 있는 과일 추출물이 LPS로 자극한 RAW 264.7 세포의 ROS를 포착하고 제거할 뿐만 아니라, transcription factor의 발현을 조절하여 ROS 발생을 미연에 방지함으로써 산화적 스트레스를 효과적으로 억제할 수 있다고 보고하였다. Jung 등(2015)은 크랜베리에서 분리한 폴리페놀 분획물이 염증 반응으로 인해 발생하는 ROS 생성을 감소시켰다고 보고한 바 있는데, 이들 보고로 미루어 볼 때 IDS가 HWE보다 효과적으로 ROS 생성을 억제시킨 것도 HWE보다 IDS에 약 1.8배 더 많이 함유되어 있는 총페놀화합물의 영향인 것으로 생각된다.
알로에 사포나리아 추출물로부터 분리한 다당체는 열수 추출물보다 페놀성 화합물을 더 많이 함유하고 있어 생체 내 대사 과정 중에 발생하는 ROS의 생성을 보다 효과적으로 억제함으로써 산화적 스트레스를 감소시키고, 염증반응의 유도를 제어하여 염증 진행과정을 상쇄시킬 수 있을 것(Jo와 Bang, 2022)으로 판단된다.
대식세포는 염증 반응에 관여하는 주요 세포로 알려져 있으며, LPS 등 여러 자극에 의해 세포와 조직들의 유기적 작용과 조혈, 염증, 면역 반응 등을 조절하기 위하여 여러 cytokine을 분비하는데, IL-1β, IL-6 및 TNF-α는 대식세포가 분비하는 대표적인 염증반응 cytokine이다(Kim 등, 2018; Suhr 등, 2022). IL-6는 전염증성 세포활성물질로 외부 자극에 대한 반은 초기 염증조절에 중요한 역할을 하며, B-cell의 성장과 분화를 촉진하는 물질로 과량일 경우 염증성 질환의 발생 원인이 된다(Hirano 등, 1990; Nishimoto 등, 2000). TNF-α는 염증과 호중구의 활성화, 시상하부의 열, 간에서 단백질 합성, 근육의 이화작용, 세포고사 등에 관여하는 염증반응 조절물질로 과량 발현 시 심근수축력 감소, 혈압 강하, 대사과정의 손상 유발 원인이 되기도 한다(Eigler 등, 1997).
LPS로 자극을 가한 RAW 264.7 세포에 대한 남해산 사포나리아 알로에 열수 추출물 및 열수 추출물로부터 분리한 다당체의 염증성 사이토카인 억제 효과를 측정한 결과(Fig. 4), LPS만을 처리하여 자극을 준 control은 염증성 사이토카인 인자(IL-1β, IL-6 및 TNF-α)들이 blank와 비교하여 유의적으로 증가됨을 확인하였다. IL-1β는 control, HWE 및 IDS 처리구 간에 유의차는 없는 반면 IL-6와 TNF-α는 control과 비교하여 HWE와 IDS 처리 시 시료농도에 의존하여 유의적으로 생성이 감소하였다. 하지만 동일 농도 내에서 HWE와 IDS 처리구 간에는 유의적인 차이가 없었다.
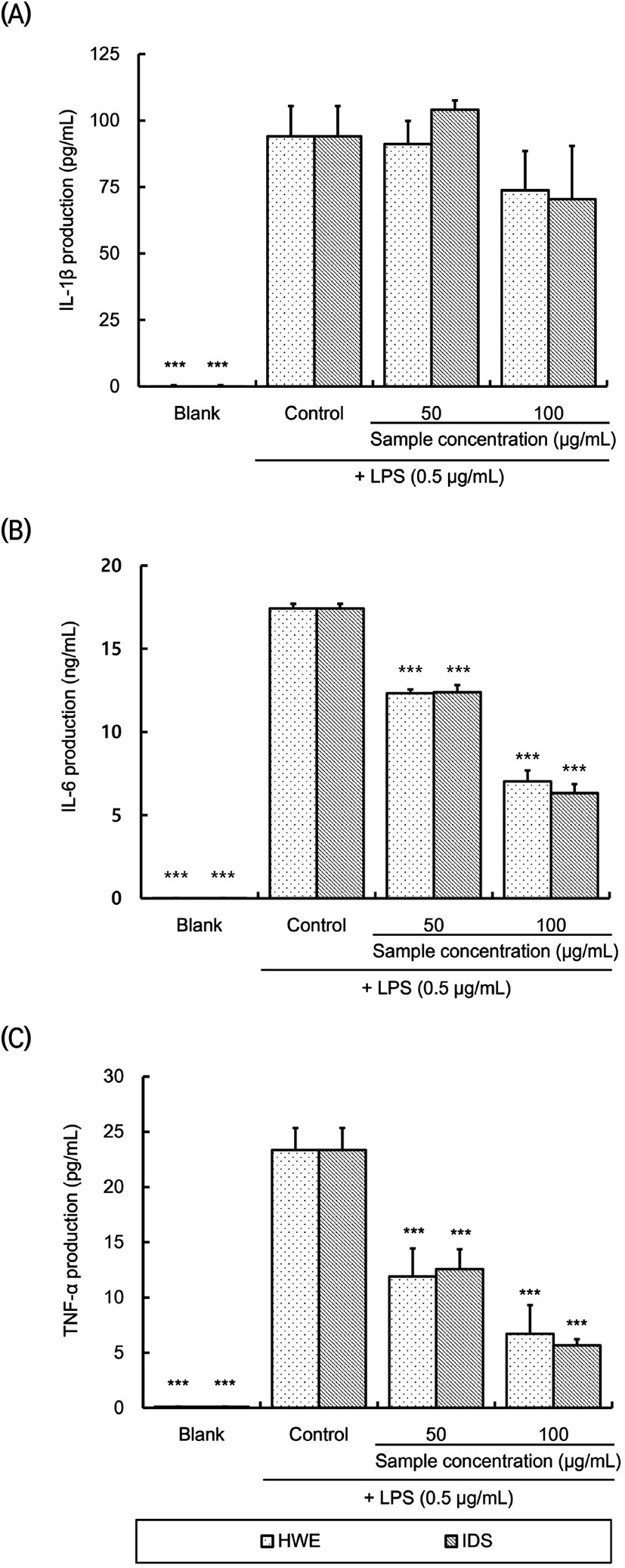
해조 다당류 성분 추출물은 LPS로 염증반응을 유도시켰을 때 IL-1β의 생성을 유의적으로 감소시키지 못하였으나, TNF-α에 대해서는 더 낮은 농도에서 유의적인 감소 효과가 있었다는 보고(Kim, 2018)는 본 연구의 결과와 유사한 경향이었다. 이러한 결과와 유사하게 막걸리로부터 분리한 다당체가 IL-6와 IL-12의 생성을 억제하였으나, TNF-α의 생성은 LPS 단독 처리 시에 비해 오히려 더 증가하여 동일 조건에서도 cytokine에 따라 분비량이 상이하다는 보고(Cho 등, 2014)가 있다. 우슬 다당체 추출물도 IL-1α와 IL-6의 생성을 억제하여 항염증 효과를 나타내었는데, 동일 농도에서 IL-1α의 억제능은 40%였으나, IL-6는 30%로 활성 정도는 서로 차이가 있었다고 보고되어 있다(Lee 등, 2008). 이러한 보고들로 미루어 볼 때 다당체는 구성당의 종류나 비율 등에 따라서 염증성 cytokine 생성 억제 효과가 상이하고, 억제 메커니즘도 차이가 있을 것으로 추정된다.
