1. 서론
최근 현대인들의 식습관 형태가 다양해지고 당류 섭취량이 증가하고 있으며, 스트레스 등의 원인으로 면역기능은 약화됨에 따라 다양한 구강 관련 질환들이 보고되고 있다(Jeong 등, 2008). 치주질환(periodontal disease)은 치아상실의 원인이 되는 염증성 질환으로 치은염(gingivitis)과 치주염(periodontitis)으로 나누어지며, 치은염은 염증이 치은에만 국한된 경우로 비특이적으로 발생되는 것을 말하고, 염증이 치주조직까지 침범한 상태로 그람음성 세균종 증식이 특이하게 발생하는 것을 치주염이라 한다(Lee 등, 2019). 치아우식증(dental caries)은 세균에 의해 발생되는 대표적인 감염성 질환으로 식이 탄수화물의 박테리아 발효로 인한 산성 부산물에 의한 민감한 치아 경조직의 국소적 파괴를 말하는 것으로, 세계에서 가장 흔한 만성질환 중 하나이다(Marsh 등, 2009; Rosan 등, 2000; Selwitz 등, 2007). 전 세계적으로 23억 명의 사람들이 영구치 우식증을 갖고 있으며, 5억 3천만 명의 어린이들이 유치 우식증을 갖고 있는 것으로 추산된다(James 등, 2017). 또한, 전 세계 성인의 60%가 치아우식증과 치주질환을 겪고 있다(Rosan 등, 2000).
Streptococcus mutans(S. mutans) 세균은 치아우식증의 주요 원인균으로 glucosyltransferase(GTFase)를 분비하며, 자당을 기질로 하여 점착성의 비수용성 글루칸을 합성하는 반응을 촉매한다(Kim 등, 2019). 또한, 이 GTFase가 음식물 중 sucrose를 기질로 하여 치면에 불용성 글루칸을 형성하게 되며(Lee 등, 2000), 치아면에 정착하여 당의 대사과정을 통해 유기산을 생성함으로써 치아 우식이 유발되어 구치, 구내염 등이 빈번하게 발생하게 된다(Jeun 등, 2002). 따라서 구강환경 내에서 원인 균주 및 치주염이나 구취 유발세균에 대해 선택적인 항균력을 지니면서 인체에 무해한 천연물질의 개발에 대한 필요성이 증대되고 있다.
인체의 부작용을 유발하지 않고, 항균력을 가지는 천연 소재로 보고되고 있는 것은 지실, 오리목, 정향, 고삼, 후박, 희렴, 은행, 사철쑥, 감초, 백지, 유자, 오매, 비파엽, 오가피, 오미자, 오레가노, 프로폴리스 등 다양한 식물성 소재들이 존재한다(Baek, 2007; Kim 등, 2002; Kim 등, 2005a). 그중 고삼(Sophorae flavescens)은 콩과(Leguminosae)에 속한 다년생 본초로 강한 쓴맛을 지니고 있고(Lee 등, 2000), 주요 성분으로는 alkaloid 1-2%와 flavonoid 0.5% 내외가 함유되었다고 보고되고 있다(Kang 등, 2000). 또한, 임상적으로 습진, 피부, 화농증, 여성의 음부소양 등의 피부병에 대하여 외용하며, 세균성이질 등 고삼의 항균력에 관한 보고도 있다(Woo 등, 1998). 오미자(Schizandra chinensis)는 목련과에 속하는 자생목으로 한국, 중국, 일본 및 대만 전 지역에서 자생하는 식물로, 식용 및 약용으로 애용되고 있으며(Chang 등, 2005), 항균성에 관한 보고는 오미자 종자나 오미자 추출물에 대한 식품학적 병원성 균주에 대한 보고가 이루어진 바 있다(Jeon 등, 2003; Kwon 등, 2008). 이와 같이 대부분의 천연 소재는 병원성 식중독균, 피부 상재균 등에 대한 항균효과(Kim 등, 2011)를 규명하는 데 치우쳐 있어 구강세균(S. mutans)에 대한 활성을 확인하는 추가적인 연구가 필요한 실정이다. 따라서 본 연구에서는 의치 내에 잔존할 수 있는 각종 미생물 제거에 유효한 효과를 보이며, 항균제 역할을 수행할 수 있는 천연물을 검색하여 구강세균에 대한 저해 활성을 검토하고, 선정된 천연물을 이용하여 최적 추출 조건 탐색과 추출물의 안정성 평가를 실시하여 다양한 제품들에 응용할 수 있는 기반을 마련하고자 이 연구를 수행하였다.
2. 재료 및 방법
항균 활성 천연 소재 선발 후보군에서 지실, 오리목, 정향, 고삼, 은행, 사철쑥, 감초, 비파엽, 오가피 및 오미자는 ㈜진도허브(Jindo, Korea), 후박, 희렴 및 백지는 서현생약영농조합(Nonsan, Korea), 유자는 ㈜산마을(Changnyeong, Korea), 오매는 ㈜자연초(Seoul, Korea) 그리고 오레가노는 금보종합식품(Seongju, Korea)에서 건조된 제품으로 구입하였고, 프로폴리스는 ㈜제너럴라이프(Seongnam, Korea)에서 구매하여 사용하였다. 모든 시료는 4°C 또는 실온보관하여 사용하였으며, 항균 활성 소재 후보군의 정보는 Table 1과 같다. 시약은 ethanol(94.5%), n-hexane (95%), ethyl ether(99%), ethyl acetate(99%), chloroform (99.5%), n-butanol(99%)은 Daejung사(Siheung, Korea)의 것을 구입하여 사용하였다. 유기물 분해 효소와 산화 효소제인 fungamyl(fungal alpha-amylase, Fun), termamyl (alpha-amylase, Ter), secura(beta-amylase, Sec), lactozym (beta-galctosidase, Lac), maltoginase(maltogenic amylase, Mal), invertase(beta-fructofuranosidase, Inv), flavourzyme(aminopeptidase, Fla), alcalase[protease (subtilisin), Alc], lipozyme(lipase, Lip), catazyme (catalase, Cat)는 ㈜바이오시스(Busan, Korea)에서 구입하였고, 산화제인 hydrogen peroxide(Hyp)는 Daejung사(Siheung, Korea)의 것을 구입하여 사용하였다.
본 실험에 사용한 균주는 Streptococcus mutans KCCM 40105로, 한국미생물보존센터(Korean Culture Center of Microorganism, Seoul, Korea)에서 분양받아 액체배지에 활성화시킨 후 S. mutans 균주 1 백금이를 취해 10 mL Brain Heart Infusion broth의 균 생육배지에 접종하고 37°C에서 3회 계대배양하여 사용하였다. 배지는 brain heart infusion broth(BHI)는 Difco사(Detroit, MI, USA)의 것을 구입하여 사용하였고, agar는 Daejung사(Siheung, Korea)의 것을 구입하여 사용하였다.
추출 용매별 항균 활성 측정은 고삼, 오미자 분말 시료 5 g에 hexane, ether, ethyl acetate, ethanol, water를 각각 50 mL씩 첨가하고, 24시간 동안 진탕 추출한 후 여과하여 한천배지확산법(Seo 등, 2008)으로 clear zone 생성 유무를 확인하였다. Ethanol 농도별 항균 활성 측정은 시료 5 g에 ethanol 농도를 0%, 30%, 50%, 70%, 94.5%로 조정한 용매 50 mL씩을 각각 첨가하여, 상온에서 24시간 동안 교반 침출시켜 추출한 후 filter paper No.2 (Advantec, Toyo Roshi Kaisah, Tokyo, Japan)로 여과하여 항균 활성을 비교하였다.
고삼 및 오미자 30% 에탄올 추출물을 hexane, chloroform, ethyl acetate, n-butanol 용매로 순차적으로 3회 반복 추출하여 각 용매별로 계통 분획 및 농축하였고, 남은 수용성 층은 water 분획으로 농축하였다. 순차적 용매 분획물의 농축한 시료를 paper disc(Advantec 8 mm, Toyo Roshi, Tokyo, Japan)에 4번에 나누어 흡수시킨 후, 추출 용매를 무균적인 조건하에서 완전히 날려 보낸 다음, 배지에 밀착시키고, 37°C에서 20-24시간 동안 배양한 다음 paper disc 주변의 clear zone 직경(mm)을 측정하여 항균 활성을 비교하였다.
각 추출물의 최소저해농도(minimum inhibitory concentration, MIC)는 한천배지확산법(Seo 등, 2008)으로 측정하였다. 시료 5 g에 30% ethanol 50 mL를 각각 첨가하여 추출 및 여과한 후 paper disc에 각 추출물의 농도를 1.0, 2.0, 3.0, 4.0 및 5.0 mg/mL가 되도록 로딩하여 추출 용매를 무균 조건하에서 완전히 건조하였다. 시험용 평판배지는 멸균된 기층용 배지인 BHI agar를 petri dish에 15 mL씩 분주하여 응고시키고, 중층용 BHI agar 배지를 약 10 mL 시험관에 분주하여 멸균한 후, 45°C 수욕상에서 보관하면서 전배양된 시험균 약 0.5 mL를 무균적으로 첨가하여 혼합하였다. 그 후 기존에 응고시켜둔 배지 위에 분주한 뒤 고르게 응고시키고, 2중의 균 접종 평판배지를 만들어 사용하였으며, 추출물이 포함된 paper disc를 응고된 배지에 놓아 밀착시키고, 37°C에서 20-24시간 동안 배양하여 저해환이 확인된 농도를 최소저해농도(MIC)로 결정하였다.
추출물의 열 안정성은 고삼, 오미자 30% ethanol 추출물을 60-121°C까지의 온도에서 열처리하였으며, 60°C, 80°C, 100°C에서 20°C 간격으로 각각 1시간씩, 121°C에서는 15분간 열처리한 후, 대조구는 열처리를 하지 않은 추출물을 시료구로 설정한 다음 항균 활성을 비교하였다. pH 안정성은 각각의 30% ethanol 추출물을 1 N NaOH와 1 N HCl로 pH 2, 4, 6, 8, 10으로 각각 pH를 조절한 후, pH를 조절하지 않은 추출물을 대조구로 하여 항균 활성을 비교하였다.
유기물 분해효소 처리 농도에 따른 항균 활성 측정은 고삼, 오미자 30% ethanol 추출물에 9가지 효소제(fungamyl, termamyl, secura, lactozym, maltoginase, invertase, flavourzyme, alcalase, lipozyme)를 각각 10 ppm, 100 ppm 및 1,000 ppm의 농도로 맞추어 각각 처리한 다음 30분간 방치하고, 효소 처리를 하지 않은 추출물을 대조구로 설정하여 항균 활성을 비교하였다. 유기물 분해효소 온도 처리에 따른 항균 활성은 고삼, 오미자 30% ethanol 추출물에 9가지 효소를 각각 100 ppm의 농도로 맞추어 처리한 다음, 20-40°C에 5°C 간격으로 각각 열처리를 30분간 처리하고, 효소 처리를 하지 않은 추출물을 대조구로 설정하여 항균 활성을 비교하였다.
산화효소와 과산화수소 처리에 따른 항균 활성은 고삼, 오미자 30% ethanol 추출물에 산화효소(catazyme)와 과산화수소(hydrogen peroxide)를 각각 10 ppm, 100 ppm 및 1,000 ppm의 농도로 맞추어 각각 처리한 다음 30분간 방치하고 산화제 처리를 하지 않은 추출물을 대조구로 설정하여 항균 활성을 비교하였다. 산화효소와 과산화수소 처리 온도에 따른 항균 활성을 측정하기 위해 고삼 및 오미자 30% ethanol 추출물에 산화효소와 과산화수소를 각각 100 ppm의 농도로 맞추어 처리한 다음 20-40°C에 5°C 간격으로 각각 열처리를 30분간 처리하고, 효소 처리를 하지 않은 추출물을 대조구로 설정하여 항균 활성을 비교하였다.
3. 결과 및 고찰
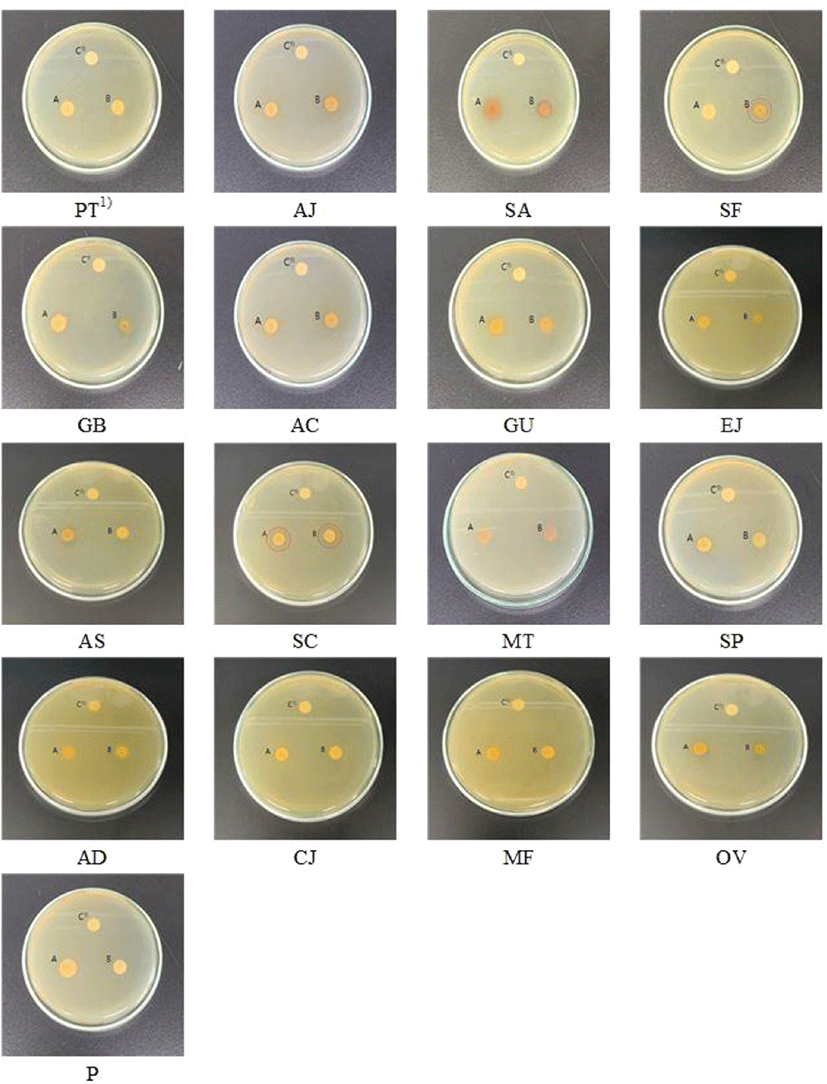
Streptococcus mutans(S. mutans) 균주의 항균 활성 효과 식품 소재 선발을 위해, 사전 조사를 통해 인간 및 식품의 유해 작용을 하는 미생물의 항균 활성이 보고(Choi 등, 2006; Choi 등, 2012; Eum, 2012; Jeon 등, 2004; Kim 등, 2005b; Lee 등, 2000; You 등, 1993)된 소재를 대상으로 S. mutans 균주의 항균 활성을 측정한 결과는 Table 2 및 Fig. 1과 같다. 17종의 천연 소재별 S. mutans 균주에 대한 항균 활성 측정 결과, 고삼과 오미자에서 항균 활성이 나타났고, 나머지 15종은 항균 활성을 나타내지 않았다 (Table 2 및 Fig. 1). 추출 용매별 S. mutans 균주에 대한 항균 활성은 고삼의 최소억제농도가 물 추출물은 200 μg/mL 이상이고, ethanol 추출물은 50 μg/mL로 보고하여, 물 추출물보다 ethanol 추출물이 높은 항균효과가 있다고 보고(Lee 등, 2000a)되어 있으며, 오미자는 ethanol 추출물보다 물 추출물에서 더 높은 항균 활성을 나타낸다고 보고(Yu 등, 2010a)하였다. 이는 본 연구 결과와 일치하는 경향으로 고삼의 물 추출물에서 항균 효과가 나타나지 않았으나, ethanol 추출물에서 10.67±0.70 mm로 활성을 나타내었으며, 오미자의 경우 ethanol 추출물과 물 추출물에서 각각 10.59±0.63 mm와 11.43±0.74 mm로 ethanol 추출물보다 물 추출물에서 높은 항균 활성을 나타내었다(Table 2 및 Fig. 1). 식품공전(MFDS, 2021)에 따르면, 일반 식품에 대한 공통기준 및 규격에 따라 오미자는 열매 부위를 식품에 사용할 수 있는 원료로 고시되어 있으나, 고삼은 식품 원료로의 사용을 제한하고 있다. 이와 같이 식품 원료 등록 여부가 다른 고삼과 오미자를 비교하고자 두 소재를 선정하여 다음 실험을 진행하였다.
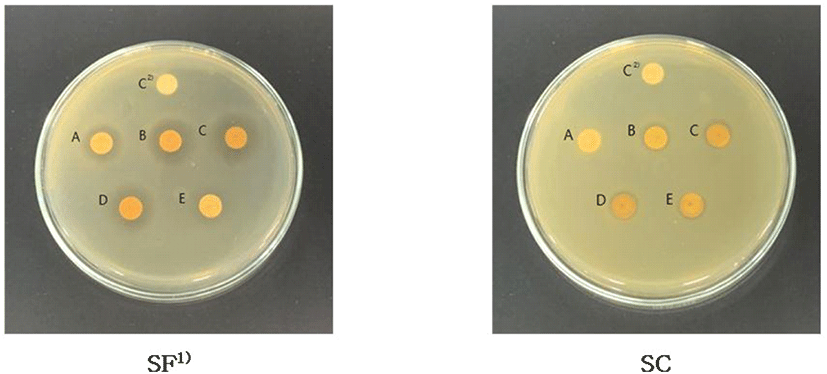
추출 용매에 따른 항균 활성 측정 결과, 고삼은 ether, ethyl acetate, ethanol 및 methanol 추출물에서 항균 활성을 나타내었으며, 오미자는 ethanol, methanol 및 water 추출물에서 항균 활성을 나타내었다(Table 3). Lee 등(2000b)은 용매에 따른 고삼 추출물의 S. mutans 균주에 대한 최소저해농도가 chloroform, methanol 그리고 ethanol이 25 μg/mL로 hexane과 water 추출물에 비해 항균효과가 높음을 보고하였으며, Yu 등(2010b)은 용매에 따른 오미자 추출물의 S. mutans 균주에 대한 항균 활성이 water, ethanol 및 methanol 추출물에서는 나타났으나, ethyl acetate 추출물에서는 항균 활성이 나타나지 않음을 보고하여 본 연구 결과와 일치하는 경향을 나타내었다. 고삼과 오미자의 추출 용매에 따른 S. mutans 균주에 대한 항균 활성은 공통적으로 ethanol과 methanol 추출물에서 항균 활성을 나타내어, 소재 비교를 위한 추출 용매는 ethanol로 선정하였다. 선정된 ethanol을 용매로 하여 ethanol 농도에 따른 항균 활성을 확인한 결과, 고삼은 0% ethanol 추출물에서 활성을 보이지 않았으나, 30% 이상 농도에서 10.31-10.89 mm로 항균 활성을 나타내었다. 오미자의 경우, 모든 ethanol 농도에서 9.68-14.67 mm의 활성을 나타내었으며, 두 소재 모두 각 용매 농도에 따른 유의적인 차이는 나타나지 않았다(Table 3 및 Fig. 2). 따라서 고삼 시료가 30% 이상 ethanol 농도에서 추출한 추출물이 항균 활성을 나타내었으므로, 고삼과 오미자의 30% ethanol 추출물을 이용하여 S. mutans 균주에 대한 항균 활성 비교 평가를 진행하였다.
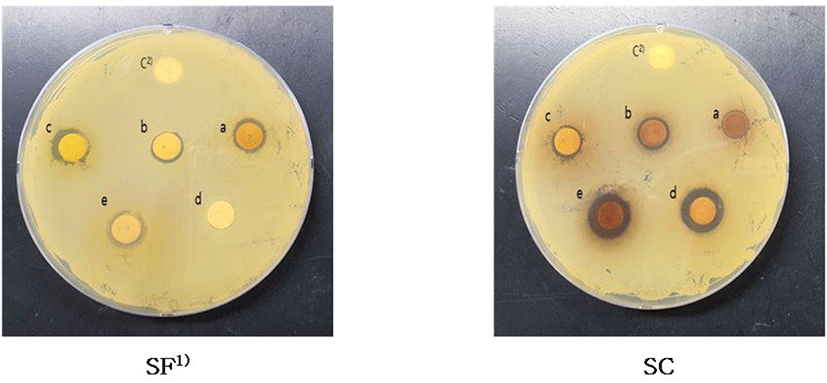
고삼, 오미자 30% ethanol 추출물의 용매 분획물별 S. mutans 균주에 대한 항균 활성 측정 결과는 Table 4 및 Fig. 3과 같다. 분획물별 활성 측정 결과, 고삼은 hexane층에서 11.74±1.12 mm의 가장 높은 활성을 나타냈고, 오미자는 n-butanol층에서 13.23±0.10 mm, water층에서 13.28±0.08 mm의 활성을 나타냈다. 이는 Son 등(2009)이 보고한 압출성형 백삼의 용매 분획 결과, S. mutans 균주에 대해 n-butanol과 n-hexane 분획물이 각각 10.8, 9.3 mm로 높은 저해 효과를 나타냈으며, 이는 인삼의 대표적인 성분인 사포닌과 페놀계 화합물의 영향일 것으로 보고하였다. 본 연구에서 사용된 고삼 또한 사포닌 성분이 포함되어 있다고 보고되어 있어(Kwon 등, 2020; Yang 등 2004), S. mutans 균주에 대해 사포닌 성분이 영향을 미쳤을 가능성이 있다고 추측할 수 있었다. Jung 등(2000)의 연구에 따르면 세균 5종(L. plantarum, B. subtilis, S. aureus, S. typhimurium, E. coli)에 대한 오미자 종자 methanol 추출물의 용매별 분획물에서 butanol 분획물의 활성이 높았고, water 분획물은 대체적으로 항균 활성이 낮게 나타났다고 보고해 본 연구와 약간의 차이를 보였다. 이러한 결과는 먼저 본 연구에서 사용한 오미자의 사용 부위는 종자를 제거한 과육 부위를 사용했고, Jung 등(2000)은 오미자 종자를 사용했기 때문에 사용 부위가 달라 항균 활성을 보이는 항균 물질이 차이가 있어 나타난 결과로 사료된다. 또한, 활성 평가 대상인 미생물의 생리적 기능 차이로도 볼 수 있을 것으로 사료된다. 또한, Lee 등(2001)의 보고에서는 오미자 methanol 추출물의 용매별 분획물에서 ethyl acetate층에서 가장 활성이 높게 나타났다고 보고해 본 연구 결과와 약간의 차이를 보였다.
고삼, 오미자 30% ethanol 추출물의 S. mutans 균주에 대한 최소저해농도(MIC) 측정 결과는 Table 5와 같다. 고삼은 2.0 mg/mL 이상의 농도에서 활성을 나타내었으며, 농도가 증가함에 따라 활성이 증가하는 것으로 나타났다(Table 5). Yim 등(2013)은 구강세균에 대한 한약재의 항균 활성 평가를 진행한 결과, 고삼 추출물의 S. mutans 균주 최소저해농도(MIC)를 1.25 mg/mL로 보고하여 본 연구 결과와 유사하게 나타났다. 오미자는 30% ethanol 추출물에서는 5.0 mg/mL 농도에서 활성이 나타났으며, Jeon 등(2003)은 오미자 추출물의 S. mutans 균주에 대한 최소저해농도(MIC)를 5 mg/mL로 보고하여 본 연구와 일치하는 결과를 나타내었다. 오미자의 S. mutans 균주에 대한 최소저해농도(MIC)는 고삼의 약 40%로 나타났으나, Jeong 등(2009)에 따르면 오미자 열수 추출물을 소장 정상상피세포인 Caco-2 cell에 처리한 후 MTT assay를 실시하여 세포 독성을 측정한 결과, 처리한 모든 농도(0.0625-5 mg/mL)에서 세포 독성이 없음을 보고하였다. 따라서 오미자는 S. mutans 균주에 대한 항균 활성과 더불어 안전성을 바탕으로 다양한 제품들에 응용할 수 있는 소재로 사료된다.
| Samples1) | Clear zone on plate (mm/disk) | MIC (mg/mL) | ||||
|---|---|---|---|---|---|---|
| 1.0 | 2.0 | 3.0 | 4.0 | 5.0 | ||
| SF | -2) | 9.46±0.473)c4) | 10.23±0.31b | 10.77±0.30ab | 11.29±0.25a | 2.0 |
| SC | - | - | - | - | 9.52±0.53 | 5.0 |
고삼, 오미자 30% ethanol 추출물의 열처리 조건에 따른 S. mutans 균주에 대한 항균 활성을 측정한 결과, 고삼은 60°C에서 121°C까지 8.54–10.30 mm의 clear zone을 생성하였으며, 오미자는 60°C에서 121°C까지 12.94–14.05 mm의 clear zone을 생성하는 것으로 나타났다(Table 6). 모든 시료구가 대조구 대비 열처리에 의해 S. mutans 균주에 대한 항균 활성이 약간 저하되었으나, 유의적인 차이를 나타내지 않았다. 이는 오미자 ethanol 추출물을 60-120°C 범위의 열처리를 통한 항균력을 측정한 결과, 온도가 증가함에 따라 오미자 추출물의 색이 심하게 변색되었으나 항균력의 변화는 관찰되지 않았으며, 미생물 증식이 억제된다는 보고와 유사한 결과를 나타내었다(Choi 등, 2013; Chung 등, 2001). 이와 같은 열 안정성은 가공식품, 천연 보존료 및 항균제 등등의 다양한 활용을 위한 열처리 공정에도 S. mutans 균주에 대한 항균 활성이 유지될 수 있을 것으로 사료된다.
Means with different superscript letters in the same row are significantly different at p<0.05 by Duncan’s multiple range test. a>b>c.
고삼, 오미자 30% ethanol 추출물의 pH에 따른 S. mutans 균주에 대한 항균 활성을 측정한 결과, 고삼은 모든 pH 범위에서 활성을 나타내었으나, pH가 저하됨에 따라 활성이 약간 감소되는 경향을 나타내었다. 이와 반대로 오미자는 pH 6 이상의 범위에서는 활성을 나타내지 않았으나, pH가 저하됨에 따라 항균 활성이 증가하는 경향을 나타내었다(Table 6). 오미자의 pH 저하에 따른 S. mutans 균주에 대한 항균 활성의 증가는 pH 4.5-5.5로 추정되는 구강 내 치태(Amissah 등, 2021; Bowen, 2013) 그리고 GTFase와 더불어 산을 생성하여 질환을 유발하는 S. mutans 균주(Yu 등, 2003a; Yu 등, 2003b)의 생장 억제에 적합한 소재로 사료된다.
구강에는 약 700여 종 이상의 미생물이 서식하고 있으며(Paster 등, 2006), 다양한 유기물 분해효소를 생성하는 것으로 알려져 있다(Hondoh 등, 2008). 이와 같은 유기물 분해효소에 대한 안정성을 확인을 위해 고삼과 오미자 30% ethanol 추출물을 9종의 효소제로 처리한 결과, 10-100 ppm 농도까지 S. mutans 균주에 대한 항균 활성을 보여 효소제에 대한 안정성을 나타내었으나, 1,000 ppm 농도에서는 고삼과 오미자 두 소재 모두 Lactozym(beta-galctosidase, Lac)과 Lipozyme(lipase, Lip) 효소제 처리에 의해 S. mutans 균주에 대한 항균 활성을 나타내지 않았으며, 오미자는 Lac과 Lip 효소제 처리와 더불어 Fungamyl(fungal alpha-amylase, Fun)과 Termamyl (alpha-amylase, Ter) 효소제 처리에 의해 S. mutans 균주에 대한 항균 활성을 나타내지 않았다(Table 7). 효소제의 처리 온도에 따른 안정성은 오미자의 경우 40°C 처리 시료구 중 Fun과 Ter 효소제는 대조구 대비 낮은 항균 활성을 보이는 것으로 나타났으나, 대부분의 20-40°C의 모든 처리 조건에서 S. mutans 균주에 대한 항균 활성을 나타내었다(Table 7). 고삼과 오미자의 유기물 분해효소에 대한 안정성은 구강 내 유기물 분해효소와 더불어 식품산업에서 protease, glycosidase 및 lipase 등 다양한 효소가 활용되고 있어(Oh, 2004), 다양한 제품과 가공 공정 과정 중 S. mutans 균주에 대한 항균 활성이 유지될 것으로 사료된다.
Fun, fungamyl; Ter, termamyl; Sec, secura; Lac, lactozym; Mal, maltoginase; Inv, invertase; Fla, flavourzyme; Alc, alcalase; Lip, lipozyme.
고삼 및 오미자 30% ethanol 추출물에 산화효소와 과산화수소 처리에 안정성이 있는지 확인하기 위하여, 산화효소인 catazyme과 과산화수소인 hydrogen peroxide를 고삼 및 오미자 30% ethanol 추출물에 각각 첨가하고 반응시킨 후 항균 활성을 확인하였다. 산화효소와 과산화수소의 처리 농도에 따른 항균 활성 측정 결과는 Table 8과 같다. 고삼 및 오미자 30% ethanol 추출물에 산화효소를 각각 10 ppm 농도로 처리했을 때 항균 활성이 높아졌고, 오미자 30% ethanol 100 ppm 농도에서는 대조구에 비해서 활성이 감소하였다(Table 8). 처리 온도별 결과에서 산화효소 처리구는 온도별 유의성이 없었고, 과산화수소 처리구는 처리하지 않은 대조구와 비교해 고삼 30% ethanol 추출물에서는 유의적 차이를 보이지 않았다. 따라서 Catazyme 효소와 과산화수소 처리에 따른 고삼 및 오미자 ethanol 30% 추출물 항균 활성은 크게 영향을 받지 않을 것으로 사료된다.
