1. 서론
알츠하이머성 치매(Alzheimer’s diseases, AD)는 전 세계적으로 약 3,500만 명에게 영향을 미치는 치매의 가장 흔한 형태이며, 전체 치매 환자의 60-70%를 차지하고 있다(Kumar와 Singh, 2015). AD 유병률은 연령에 따라 기하급수적으로 증가하고 있으며, 2050년에는 전 세계 인구 중 1억 4천만 명 이상이 AD를 겪을 것으로 예측된다(Sloane 등, 2015). 전형적인 퇴행성 뇌 질환 중 하나인 AD는 아밀로이드 베타(amyloid-beta, Aβ) 단백질의 과도한 엉킴으로 발생하는 아밀로이드 플라크(amyloid plaques) 단백질과 타우 단백질(tau protein)의 과도한 인산화가 주원인이다(Paula 등, 2009). 특히, Aβ는 뇌 조직에서 활성산소종(reactive oxygen species, ROS)과 활성질소종(reactive nitrogen species, RNS)과 자유 라디칼(free radical)의 생성을 통해 신경세포의 사멸을 초래하며, 다양한 염증반응을 통해 콜린계 신경(cholinergic neuron)의 활성이 감소되어 기억력 감퇴 및 인지기능의 장애를 초래한다(Campbell과 Bondy, 2000).
Aβ 단백질은 대뇌 피질(cerebral cortex) 및 해마(hippocampus), 아미그달라(amygdala) 등과 같은 조직의 지속적인 손상으로 인해 인지 및 학습행동의 이상을 나타내는 원인으로, 아밀로이드 전구단백질(amyloid precursor protein)이 β-secretase와 γ-secretase의 상호작용을 통해 생성된다(Basso 등, 2006; Tyler 등, 2002). 이는 쉽게 제거되지 않아 노인반의 형태나 아밀로이드 플라크로 축적되어 염증반응과 산화적 스트레스의 생성을 통해 다양한 경로로 뇌 조직을 손상시킨다(Dickson 등, 1988). 현재까지 미국 FDA의 승인을 통해 사용 중인 치료제는 타크린(tacrine), 메만틴(memantine), 도네페질(donepezil), 리바스티그민(rivastigmine), 갈란타민(galanthamine) 등이 있으며, 이들 치료제는 아세틸콜린 분해효소(acetylcholinesterase, AChE) 억제제로써 사용되고 있지만, 구토 및 간독성 등과 같은 다양한 부작용이 보고되어 제한적으로 이용되고 있다(Rafii와 Aisen, 2015). 따라서, 치료제의 개발과 이용의 어려움이 지속됨에 따라 AD의 발병이 일어나기 전, AD의 예방을 목적으로 하는 다양한 천연물의 건강기능식품 개발 연구가 지속되고 있다(Santos-Buelga 등, 2019).
마가목(Sorbus commixta bark)은 장미과의 낙엽활엽 소교목으로, 해발 500-1,200 m의 높은 고산지에서 자생하며 북아프리카, 유럽, 아시아 일부에 분포한다. 마가목의 가지는 달여 마시는 차 형태로 소비되며, 관절염과 성인병에 도움을 준다고 보고되고 있다(Kim 등, 2003b). 마가목의 수피는 신장 보호 효과와 호흡기 손상에 대한 개선 활성을 보이며, 항혈전 활성에 도움을 준다고 보고되었다(Kim 등, 2016; Na 등, 2009). 또한, 마가목은 당뇨 및 비만 억제 효과, 연골 손상 억제 효과, 조골세포 분화 촉진, 알코올 대사 개선, 항산화 활성 등이 알려져 있으며, 생리활성 성분으로는 lupeol, lupenone, neosakuranin, rutin, isoquercitrin, hyperoside 및 chlorogenic acid 등이 알려져 있다(Kim 등, 2017; Lee 등, 2006; Lee 등, 2012; Moon 등, 2019; Raudonė 등, 2015). 마가목에 대한 생리활성연구는 지속적으로 이루어지고 있으나, 인지기능 저하에 관한 개선 연구는 미흡한 실정이다. 따라서, 본 연구에서는 Aβ로 유도된 인지기능 손상에 대한 마가목의 보호 효과를 확인하고, AD 치료제인 memantine과 donepezil, 마가목의 주 생리활성 물질인 lupeol과 비교하여 마가목 추출물이 가지는 건강기능식품 소재로서의 산업적 활용 가능성을 평가하고자 하였다.
2. 재료 및 방법
본 실험에서 사용된 마가목(Sorbus commixta bark)은 2016년 충북 제천시의 재배 농가에서 채취된 것을 이용하여 실험에 사용하였다. 동결건조한 마가목 수피와 20배의 80% 에탄올을 첨가하여 100°C에서 4시간 동안 환류 추출하였다. 추출물을 No. 2 거름종이(Whatman PLC, Kent, UK)로 여과하고, 감압농축 후 동결 건조하여 최종 추출물(Sorbus commixta bark extract, SCBE)을 얻었다.
본 실험에 사용한 시약으로 소태아혈청(fetal bovine serum, FBS), penicillin, streptomycin, RPMI 1640, amyloid beta(Aβ)1-42, hydroxylamine, Tris, dithionitrobenzoic acid, acetylthiocholine chloride, phosphoric acid, thiobabituric acid, terminal deoxynucleotidyl transferase(TdT), triton X-100, peroxidase substrate, methyl green, calf serum, bovine serum albumin, 3,3’-diaminobenzidine tetrachloride(DAB)는 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)로부터 구입하여 사용하였으며, ApopTag Apoptosis Detection Kit (S7101)는 Merck Millipore(Burlington, MA, USA)로부터, anti-B-cell lymphoma 2(Bcl-2)(SC7382, 1:500 dilution, mouse monoclonal)는 Santa Cruz Biotechnology(Dallas, TX, USA)로부터, anti-Bcl-2-associated X protein(Bax)(AB7977, 1:500 dilution, rabbit polyclonal)은 Abcam(Cambridge, UK)으로부터, biotinylated anti-rabbit secondary antibody (1:200)는 Vector Laboratories(Burlingame, CA, USA)로부터 구입하여 사용하였으며, 그 외 사용된 시약은 모두 일급 이상의 등급을 사용하였다.
본 실험에서 사용한 세포주는 rat pheochromocytoma PC12로서 ATCC(American Type Culture Collection, Rockville, MD, USA)에서 분양받아 사용하였다. 분양받은 세포는 10% FBS, 100 unit/mL penicillin, 100 unit/mL streptomycin이 첨가된 RPMI1640 배지를 사용하여 5% CO2와 37°C의 조건에서 배양하여 실험에 사용하였다.
배양 세포들을 96 well plate에 2×104 cell/well 수준으로 분주하였고, 24시간 후 25 μM Aβ를 첨가하여 세포독성을 유발시켰다. SCBE를 농도별로 첨가하여 48시간 배양시켰고, 배양이 끝난 세포에 MTT 용액을 처리하여 2시간 동안 반응시킨 후, 570 nm(determination wave)와 690 nm(reference wave)에서 흡광도를 측정하였다(Heo 등, 2001).
6주령의 Sprague Dawley(SD) 수컷 래트를 Samtako (Osan, Korea)에서 구입하여 실험에 사용하였고, 일주일 동안 동물사육실의 표준환경에서 검역 및 적응시킨 후, 이상이 없는 개체를 선별하여 시험에 사용하였다. 본 시험의 환경은 온도 22±3°C, 상대습도 50±5%, 환기횟수 10-15회/시간, 조명주기 12시간(8:00-20:00), 조도 150-300 Lux의 사육환경으로 설정된 동물사육실에서 사료와 음용수를 급여하여 사육하였으며, 적응 및 시험 기간 동안 격리하여 사육하였다. 적응 기간 동안 이상이 발생한 개체와 정상적으로 체중이 증가하지 않은 개체를 제외한 후, 각 군간 평균 체중 및 표준편차가 균일하도록 실험군을 분리하였다. 본 동물실험은 연구원 실험동물윤리위원회(전남천연자원연구원)의 승인(승인번호: 32-35)을 받아 수행하였다. 실험군은 ⅰ) 정상대조군(control)[vehicle-intracerebroventricular (ICV) injection + saline administration group], ⅱ) Aβ 처리군(410 pM Aβ-ICV injection + saline administration group), ⅲ) memantine(양성대조군) 처리군(Aβ-ICV injection+1 mg/kg b.w. memantine administration), ⅳ) donepezil(양성대조군) 처리군(Aβ-ICV injection+1 mg/kg b.w. donepezil administration group), ⅴ) SCBE 100 mg/kg 처리군(Aβ-ICV injection+100 mg/kg b.w. SCBE administration group), ⅵ) SCBE 300 mg/kg 처리군(Aβ-ICV injection+300 mg/kg b.w. SCBE administration group), ⅶ) lupeol(양성대조군) 처리군(Aβ-ICV injection+1 mg/kg b.w. lupeol administration)으로 구성하여 진행하였다. 다양한 연구를 확인하여 마가목의 생리활성 물질로서 lupeol이 함유되어 있음을 확인하였고, lupeol을 양성대조군으로 사용하였다(Im 등, 2016; Na 등, 2009). 실험동물은 chloral hydrate (Sigma Aldrich Co., St. Louis, MO, USA)를 복강 주사하여 마취시킨 다음, 뇌정위수술틀(Stereotaxic frame, Narishige, Japan)을 준비하여 Laursen과 Belknap(1986)의 방법에 따라 Aβ 단백질을 주입하였다. 각 실험동물은 26-gauge needle이 달려 있는 50 μL Hamilton microsyringe로 Bregma에서 2.2 mm 깊이로 주입하였다. Aβ 단백질을 주입 후, 3일 동안 실험동물을 회복시켰으며, 회복이 끝난 뒤 in vivo 실험을 진행하였다.
Passive avoidance test는 조명이 있는 밝은 chamber와 어두운 chamber가 작은 통로로 붙어 있는 shuttle box에서 실험을 수행하였다. 밝은 공간의 chamber에 실험동물을 놓아두고, 본능적으로 어두운 chamber로 들어가게 되면, 전기 충격(75 V, 0.5 mA, 50 Hz)을 이용하여 혐오자극을 주어 공포학습을 시켰다. 8시간 후, 밝은 공간의 chamber에 실험동물을 두었을 때, 어두운 chamber에 다시 들어가는 시간을 측정하였다(Newman과 Kosson, 1986).
Morris water maze test는 Morris 실험법을 수정 보완한 것으로, 원형 수조(직경: 180 cm, 높이: 75 cm)에 물을 25±1 cm로 채우고, 탈출 platform(24 cm)을 수면 1 cm 아래에 숨겼다. Platform의 위치를 확인할 수 있도록 원형수조 벽의 4면에 공간단서를 설치하고, 오징어 먹물을 이용하여 원형 수조 아래의 탈출 platform을 육안으로 확인할 수 없게 하였다. 본 실험 수행 전 2일간 모든 실험군을 탈출 platform이 없는 원형 수조에서 자유롭게 수영하게 해, 수영하는 상황에 적응시켰다. Hidden test 상에서 platform이 놓인 사분면을 제외한 3곳 중 2곳에서 임의의 순서로 동물을 출발시켜 platform을 찾도록 하였다. Platform을 찾으면 그로부터 20초간 그 위에 머무르게 하고, 180초 안에 찾지 못하면 실험자가 손으로 동물을 platform까지 유도하여 20초간 머물도록 하였다. 20초간의 위치 학습이 끝나면 바로 임의의 분면에서 동물을 출발시켜 platform까지 찾아가는 시간과 이동거리를 하루에 총 3번, 4일 동안 시행하였다. 모든 데이터는 원형 수조 위에 설치된 카메라로 촬영되었으며, video tracking system(Panlab, Barcelona, Spain)으로 분석하였다. Hidden test 완료 후, probe trial을 시행하였으며 platform 없이 자유롭게 수영을 하게 하여 이전 platform의 위치에 대한 기억을 보유하고 있는지에 대한 검사를 진행하였고, 실험동물의 swimming speed가 15-25 cm/s의 범위에 해당하는 개체군을 선발하여 데이터를 분석하였다(Morris, 1984).
Vertical pole test는 grip strength와 균형감각을 측정하기 위해 기울어진 봉 위에서 수행하였다. 45°의 봉 중심부에 실험동물을 올려놓은 후 균형을 잃고 떨어질 때까지의 시간을 측정하였다. 2일 동안 1일에 1회 적응훈련을 시킨 후 3일째에 총 3회 측정하였다(Vena 등, 2015).
균형감각과 운동협응력을 측정하기 위해 rotarod test (five-lane accelerating rotarod; Jeung Do Bio & Plant, Seoul, Korea)를 실시하였다. 실험 전날 1분간 2회 회전하는 원통(diameter, 8 cm; rotation speed, 20 rpm) 위에 강제로 걷게 하는 적응훈련을 시켰고, 24시간 후 동일 조건의 회전하는 원통 위에서 균형을 잃고 떨어지는 시간을 측정하였다(Deacon, 2013).
실험동물의 뇌 조직에서 아세틸콜린(acetylcholine, ACh) 함량 측정은 동물 행동 실험이 완료된 후, 뇌를 적출하여 인산 완충용액(pH 6.4)에 넣어 균질화하였고, 이를 12,000 ×g, 30분, 4°C에서 원심분리하여 상등액을 실험에 사용하였다. 뇌 상등액과 알칼리 히드록실아민(alkaline hydroxylamine) 시약을 혼합한 후 염산을 이용하여 pH를 1.20±0.20으로 조절하여 10% 염화철(III)(in 0.1 N HCl)을 첨가하여 혼합하고, 이를 530 nm에서 흡광도를 측정하였다(Vincent 등, 1958).
아세틸콜린 분해효소(acetylcholinesterase, AChE)의 측정은 Ellman 등(1961)의 방법을 이용하여 측정하였으며, 0.1 M Tris buffer(pH 8.0 Tris HCl+Tris base), 0.01 M dithionitrobenzoic acid, 상등액을 연속적으로 첨가하고, 0.1 M acetylthiocholine chloride를 첨가하여, 405 nm에서 흡광도 변화를 5분 동안 관찰하였다.
뇌 조직에서의 지질과산화물의 함량을 측정하기 위해서 뇌 조직 상등액에 1% phosphoric acid와 0.67% thiobabituric acid를 첨가하여 95°C에서 1시간 반응시킨 후 5,000 rpm에서 10분간 원심분리하여 상등액을 얻은 뒤, 532 nm에서 흡광도를 측정하였다(Kim 등, 2003a).
TUNEL assay는 TdT를 사용하여 DNA 절단의 apoptosis를 표식하는 ApopTag Apoptosis Detection Kit를 사용하였으며, 과정은 제조사가 제공하는 설명서에 따랐다. TdT enzyme을 37°C 가습 인큐베이터에서 1시간 동안 반응시키고, PBS로 세척한 다음 anti-digoxigenin peroxidase conjugate에 30분간, peroxidase substrate에 약 5분간 반응시켜 발색시키고 증류수로 세척하였다. 다음 0.5% methyl green 용액으로 10분간 염색을 한 다음 탈수하고 봉입하여 조직표본을 제작하였다.
뇌조직을 0.05 M PBS로 5분간 3회 씻어내고, 1% H2O2에서 10분간 반응시킨 다음 다시 PBS로 3회 씻어낸 뒤 10% calf serum과 bovine serum albumin를 PBS에 섞은 blocking solution에 한 시간 동안 반응시켰다. 이후 PBS로 3회 씻어낸 후 1차 항체를 처리하였다. 1차 항체는 anti-Bax와 anti-Bcl-2를 사용하였으며, PBS와 Triton X-100을 섞은 용액으로 희석한 후 4°C에서 반응시켰다. 다음 biotinylated anti-rabbit secondary antibody(1:200)에 실온에서 1시간 동안 반응시키고, 조직을 PBS로 씻어낸 후 avidin-biotin immuno-peroxidase의 방법에 따라 각각 1시간씩 반응시켰다. 다음 0.05% 3,3’-diamino-benzidine tetrachloride에서 2분간 발색시키고, 수세하고 탈수한 다음 봉입하여 조직표본을 제작하였다(Darzynkiewicz 등, 2008).
3. 결과 및 고찰
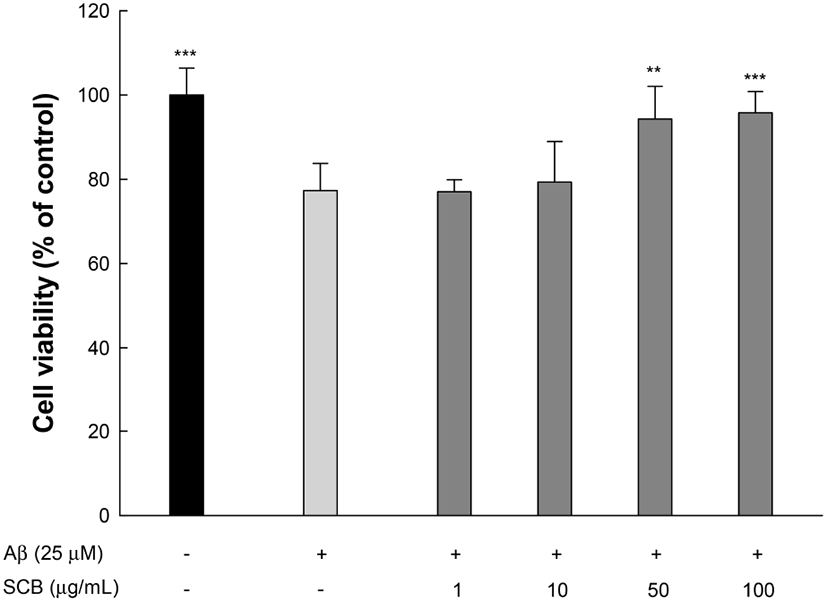
AD와 같은 퇴행성 뇌 질환은 Aβ 단백질이 가지는 독성과 Aβ 단백질로부터 유도된 다양한 산화적 스트레스로부터 뇌 신경세포가 사멸되어 나타난다고 보고되고 있다(Campbell과 Bondy, 2000). 뇌 신경세포는 다른 조직에 비해 불포화 지방산의 함량이 높지만, 항산화 시스템의 수준이 낮아 산화적 스트레스로부터 취약한 구조를 가지며, 외부 스트레스로 인해 뇌 조직이 손상되기 시작하면 회복이 어렵기 때문에, Aβ 단백질과 이로부터 유도되는 산화적 스트레스를 효과적으로 보호할 수 있는 천연 항산화제와 관련된 연구가 지속되고 있다(Dickson 등, 1988). 따라서 SCBE 추출물이 가지는 Aβ 단백질로부터 유도된 신경세포 사멸과 활성산소종 소거 활성에 대한 효과를 확인하기 위해 PC12 세포에서의 보호 효과를 측정하였다(Fig. 1). Aβ를 처리한 그룹은 정상대조군(100%)에 비해 77.29%로 유의적으로 감소하였으나, SCBE 추출물을 처리한 그룹은 50 μg/mL와 100 μg/mL 농도에서 각각 94.26%와 95.77%의 생존율을 나타내 Aβ 단백질에 대한 보호 효과를 보였다. 마가목은 다양한 생리활성 화합물을 함유하고 있으며, 특히 chlorogenic acid의 함량이 우수하다고 보고되고 있다(Raudonė 등, 2015). Chlorogenic acid는 Aβ 단백질로 유도된 PC12 세포에서 증가된 세포 내 Ca2+ 수준을 감소시키고, caspase-3, Bcl-2 및 Bax 등과 같은 apoptosis 관련 단백질 수준을 감소시켰다고 보고되었다(Lee 등, 2011). 또한, 마가목 수피 추출물은 인간 신경모세포종 SK-N-MC 세포에서 CoCl2로 유도된 신경세포 독성에 대해 HIF-1α 및 Bax, caspase-3의 발현을 유의적으로 감소시켜 신경세포 생존에 대한 보호 효과를 나타내었다(Sung 등, 2012). 이들 결과와 비교하였을 때, Aβ 단백질로부터 유도된 산화적 스트레스에 대한 마가목 추출물의 다양한 생리활성 물질에 의해 효과적으로 신경세포를 보호할 수 있을 것으로 판단된다.
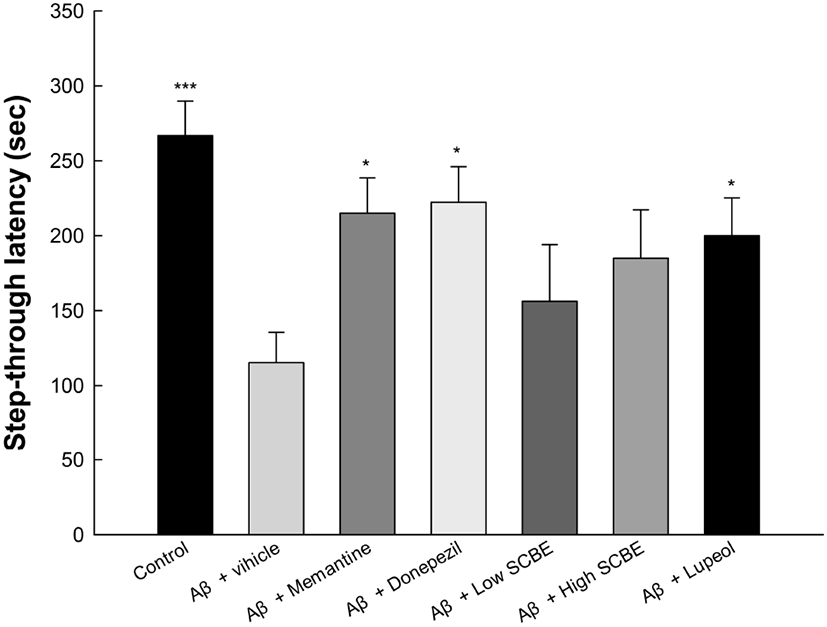
Aβ는 AD 환자에서 해마, 편도체, 시상 및 소뇌의 손상으로 행동 장애 및 기억 상실을 유발한다(Paula 등, 2009). 이 영역은 기억 처리, 단기기억과 장기기억 간의 정보 통합, 의사 결정과 유기적으로 관련되어 있다(Yao 등, 2010). Aβ는 산화 스트레스와 염증반응의 발생을 통해 다양한 뇌 기능의 이상을 유발하고, 결국 인지 장애로 이어진다(Campbell과 Bondy, 2000). 따라서 행동 평가를 통해 AD 초기 단계의 인지기능 장애를 평가하는 것이 중요하다. Passive avoidance test는 실험동물이 어두운 환경을 선호하는 습성을 이용한 것으로, 스트레스에 대한 학습 능력과 단기기억 능력을 측정하는 방법으로 결과는 Fig. 2와 같다. Aβ 처리군(115.33 sec)은 정상대조군(266.75 sec)에 비하여 유의적으로 단기기억능력이 감소하였으며, memantine과 donepezil 양성대조군은 각각 215.03 sec와 222.33 sec로 latency time이 개선되었다. 또한, SCBE 처리군(156.25 sec와 185.00 sec)과 lupeol 처리군(200.00 sec) 역시 Aβ 처리군과 비교하였을 때, 단기기억능력이 개선되는 경향을 보였다.
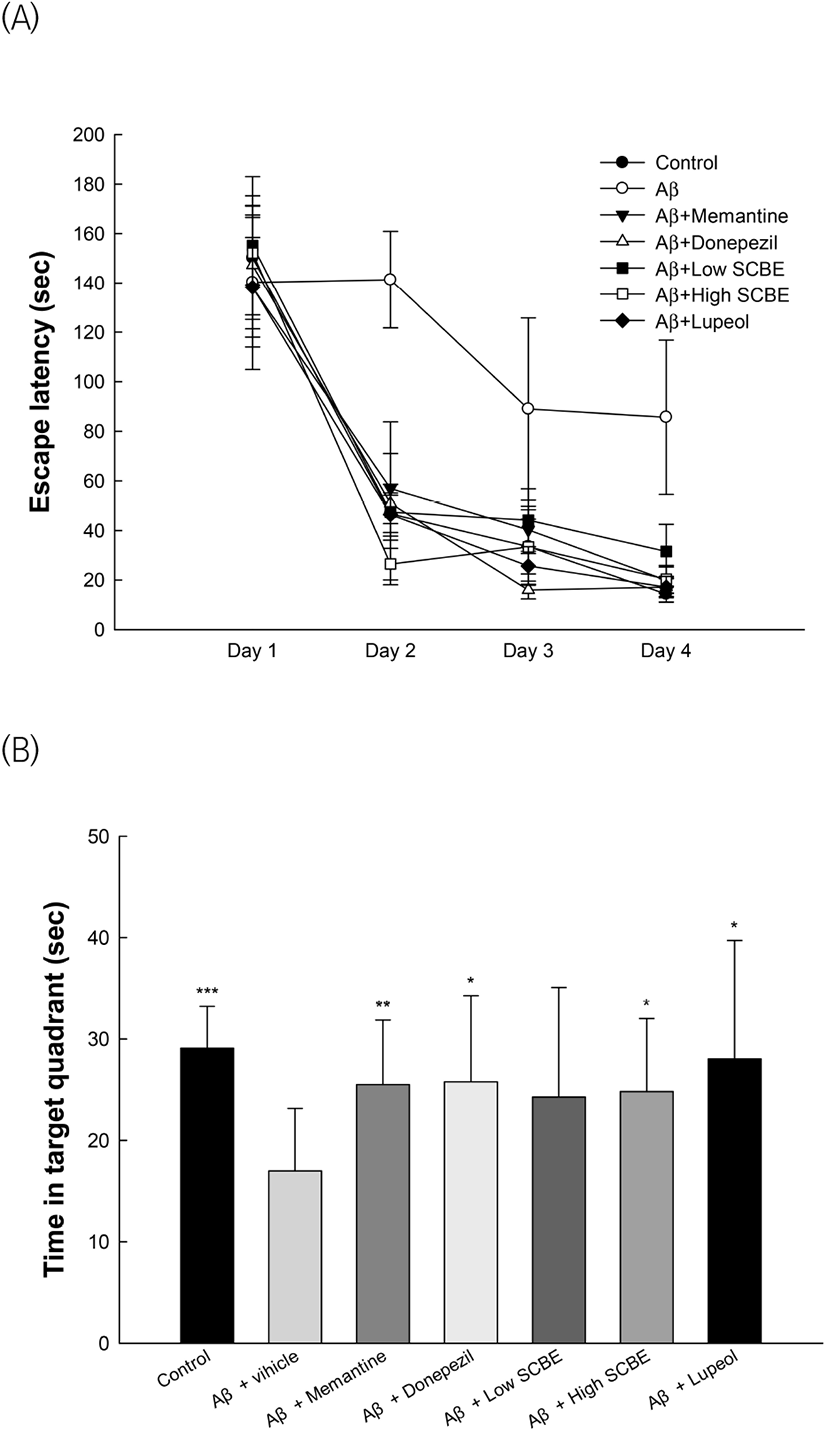
Morris water maze test는 실험동물을 수중 미로에 넣은 후, 주변의 단서를 이용해 숨겨진 platform을 찾는 시간을 측정하는 시험법으로, 설치류의 공간 학습과 장기기억 능력을 측정하는 방법이다(Fig. 3). Hidden trial의 4일째의 결과에서 정상대조군(14.33 sec)과 비교하였을 때 Aβ 처리군(85.67 sec)의 도피대를 찾아 올라가는 탈출 시간이 감소하지 않아, Aβ로 유도된 기억력 소실로 인한 장기기억 학습이 손상된 것을 확인하였다(Fig. 3(A)). 반면, memantine과 donepezil 양성대조군은 각각 19.91 sec와 17.13 sec로 개선된 것을 확인하였으며, SCBE 처리군(31.51 sec, 20.32 sec)과 lupeol 처리군(17.11 sec) 역시 유의적으로 탈출 시간이 감소하였다. 플랫폼에 머무르는 시간이 정상대조군(29.09 sec)과 비교하였을 때 Aβ 처리군(16.99 sec)의 시간이 유의적으로 감소하였다(Fig. 3(B)). 반면, memantine과 donepezil 양성대조군은 각각 25.50 sec, 25.78 sec로 개선된 것을 확인하였으며, SCBE 처리군(24.28 sec, 24.82 sec)과 lupeol 처리군(28.04 sec) 역시 개선되는 경향을 보였으며, 특히, SCBE 고농도 처리군과 lupeol 처리군은 유의적으로 개선되었다. 마가목의 생리활성 물질 중 하나인 lupeol은 streptozotocin(STZ)과 AlCl3로 유도된 인지기능 장애 모델에서 elevated plus maze test와 Morris water maze test를 통해 기억력 손상에 대한 우수한 개선 효과를 나타냈다(Hashmi 등, 2018). 또한, chlorogenic acid는 scopolamine으로 유도된 단기기억 장애 모델에서 Y-maze test, passive avoidance test와 Morris water maze test를 통해 인지기능에 대한 개선 효과를 보였다(Kwon 등, 2010). 따라서 SCBE가 가지는 우수한 인지기능 손상에 대한 보호 효과는 다양한 생리활성에서 기인되는 것으로 판단되며, 마가목의 섭취를 통해 Aβ 단백질로부터 유도된 인지기능 장애를 유의적으로 개선시킬 수 있을 것으로 판단된다.
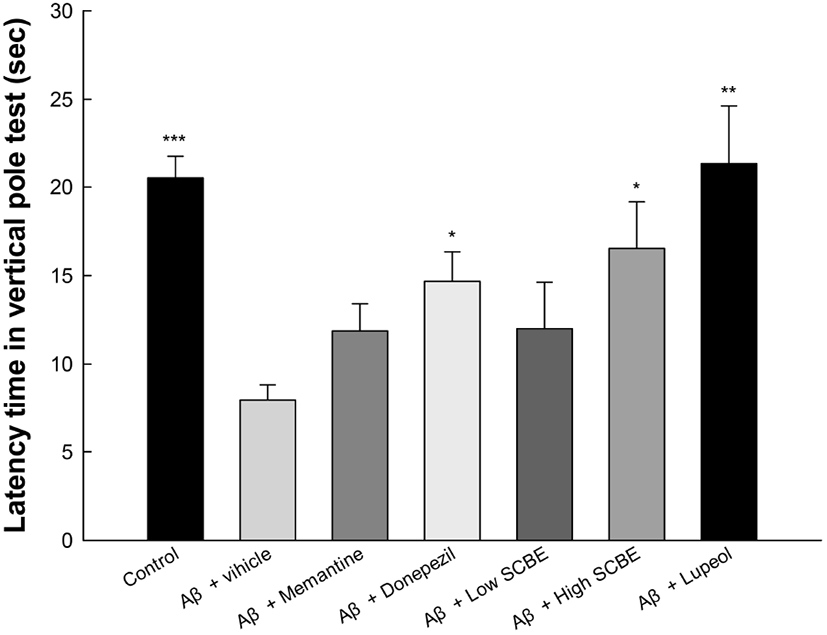
AD는 운동장애를 동반하는 인지기능 질환으로 보고되고 있다(Zawia 등, 2005). AD의 증상과 기능장애는 인지 및 실행 수준에 국한되지 않고, 여러 신체 및 생체 에너지 기능에 걸쳐 있다고 보고되었다(Jellinger 등, 2013). 또한, 신체 활동 수준과 밀접한 관련이 있는 심폐 건강이 인지 감퇴 속도와 밀접한 관련이 있어 운동능력의 장애는 AD와 연관이 지속적으로 보고되어 AD 초기 단계의 운동능력 장애에 대한 개선 활성 평가하는 것이 중요하다(Pedrinolla 등, 2018). Vertical pole test는 실험동물의 운동능력을 측정하는 실험방법으로 결과는 Fig. 4와 같다. Aβ 처리군(7.97 sec)은 정상대조군(20.50 sec)에 비하여 유의적으로 latency time이 감소하는 것을 확인하였으며, memantine과 donepezil 양성대조군은 각각 11.87 sec와 14.67 sec로 latency time이 개선되었다. 또한, SCBE 처리군(12.00 sec와 16.53 sec)과 lupeol 처리군(21.37 sec) 역시 Aβ 처리군과 비교하였을 때, latency time이 개선되는 경향을 보였으며, 특히, SCBE 고농도 처리군과 lupeol 처리군은 유의적으로 개선되었다.
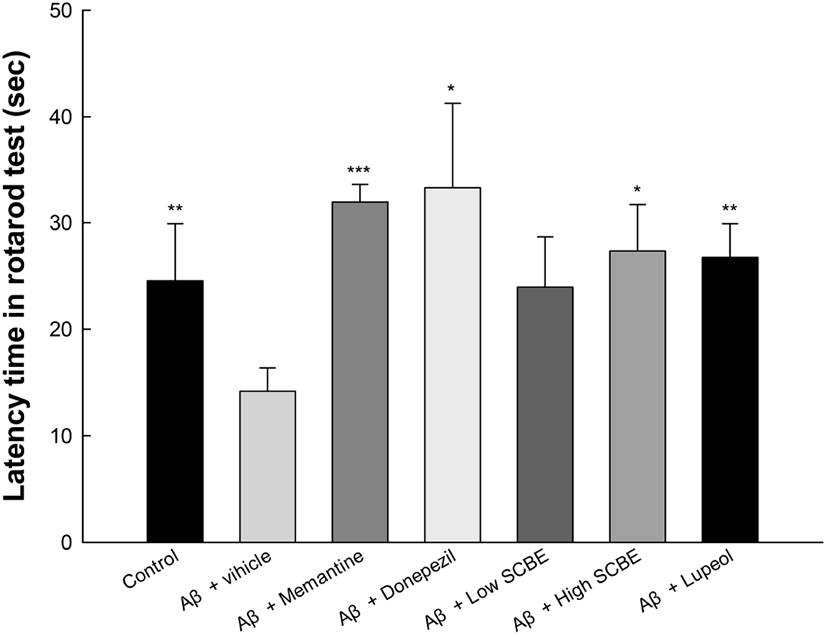
또한, rotarod test를 통해 운동능력을 측정한 방법은 Fig. 5와 같다. Aβ 처리군(14.17 sec)은 정상대조군(24.53 sec)에 비하여 유의적으로 latency time이 감소하는 것을 확인하였으며, memantine과 donepezil 양성대조군은 각각 31.93 sec와 33.27 sec로 latency time이 개선되었다. 또한, SCBE 처리군(23.94 sec와 27.33 sec)과 lupeol 처리군(23.73 sec) 역시 Aβ 처리군과 비교하였을 때, latency time이 개선되는 경향을 보였으며, 특히, SCBE 고농도 처리군과 lupeol 처리군은 유의적으로 개선되었다. 마가목에 다량 함유된 lupeol은 carrageenan으로 유도된 통각과민 및 수술 후 통증 모델에서 rotarod 및 open field 테스트를 통해 실험동물의 모터 성능에 우수한 개선 활성을 보였다(de Lima 등, 2013). Rutin은 쥐의 광혈전성 국소 허혈성 모델에서 증가된 matrix metalloproteinase-9 수준을 감소시켜 운동 기능을 개선한다고 보고되었다(Jang 등, 2014). 또한, 마가목 추출물은 초파리 모델에서 생존 및 운동성 감소, 세포 사멸을 개선하는 것으로 보고하여 Aβ1-42 신경독성에 대한 보호 효과를 보였다(Liu 등, 2015). 따라서 lupeol 등과 같은 다양한 생리활성 물질을 함유하는 마가목 추출물은 AD의 초기 증상인 운동능력 저하에 대한 유의적인 개선 효과를 가지는 것으로 판단된다.
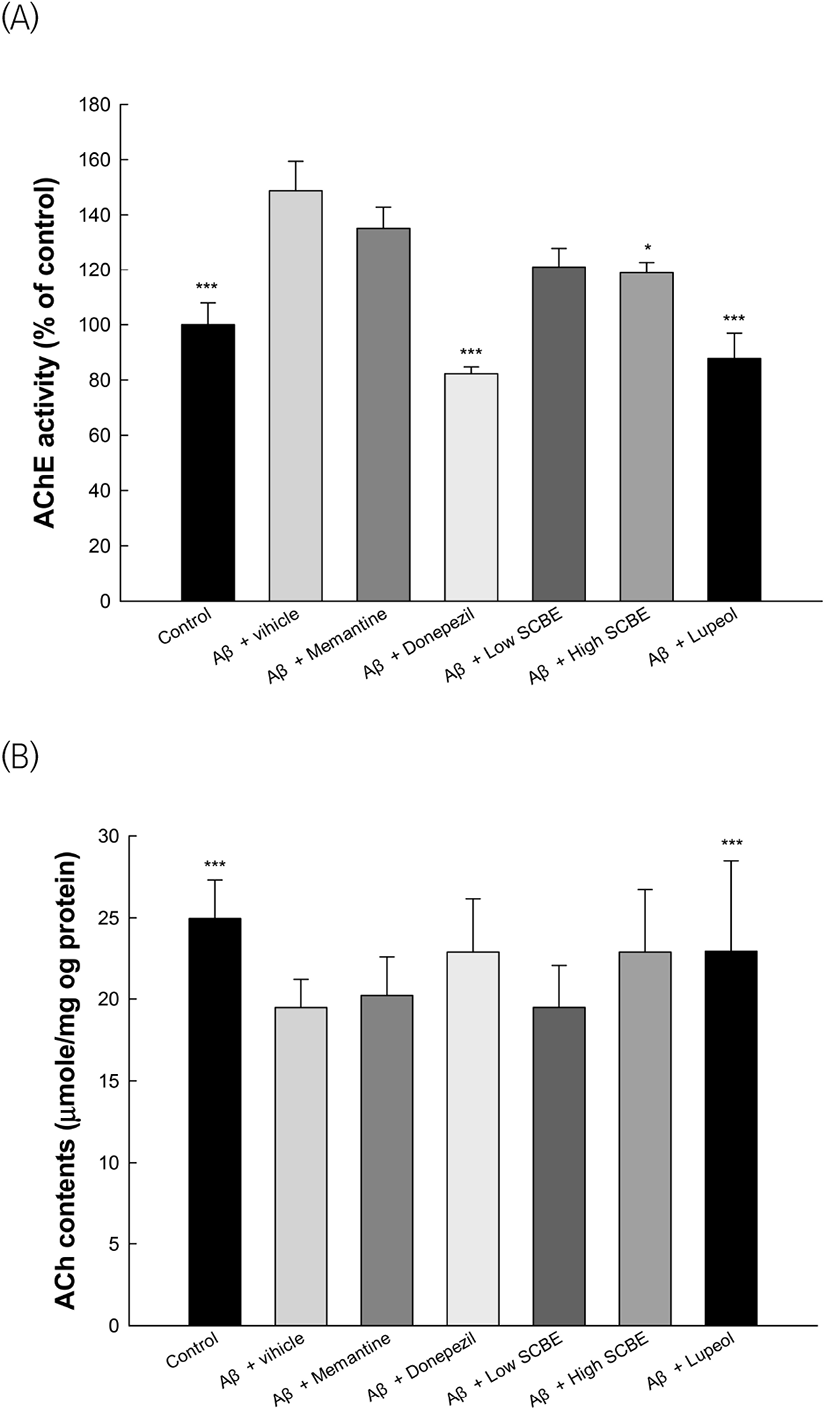
뇌 조직에서 신경전달을 통해 인지기능을 조절하는 콜린성 시스템의 손상은 AD의 발병과 연관성이 높은 것으로 알려져 있다(Kása 등, 1997). 특히, AChE는 신경전달물질 중 하나인 ACh의 함량을 유의적으로 감소시켜 인지기능 장애를 유도한다(Muir, 1997). 따라서 마가목 수피 추출물의 섭취를 통한 AChE의 저해활성을 확인한 결과는 Fig. 6(A)와 같다. Aβ 처리군(148.72% of control)은 정상대조군(100%)에 비하여 유의적으로 증가된 AChE 활성을 보였으며, memantine과 donepezil 양성대조군은 각각 135.11% of control과 82.21% of control로 개선된 것을 보였다. 또한, SCBE 처리군(121.11% of control과 118.88% of control)과 lupeol 처리군(87.72% of control) 역시 Aβ 처리군과 비교하였을 때, 유의적으로 AChE의 활성이 저해된 것을 확인하였다. 콜린성 시스템의 신경전달물질인 ACh의 함량을 측정한 결과는 Fig. 6(B)와 같다. Aβ 처리군(19.47 μmole/mg protein)은 정상대조군(24.96 μmole/mg protein)에 비하여 유의적으로 감소된 ACh 함량을 나타냈으며, memantine과 donepezil 양성대조군은 각각 20.21 μmole/mg protein과 22.91 μmole/mg protein으로 ACh 함량이 개선된 것을 보였다. 또한, SCBE 처리군(19.48 μmole/mg protein과 22.91 μmole/mg protein)과 lupeol 처리군(22.96 μmole/mg protein) 역시 Aβ 처리군과 비교하였을 때, ACh 함량이 개선되는 경향을 보였다. 마가목에 함유되어 있는 hyperoside는 quercetin의 배당체로서 고지방식이로 유도된 당뇨 rat에서 AChE의 활성 증가로 인한 기억력 저하를 개선시켰으며(Chen 등, 2021), procyanidin B1 역시 우수한 AChE 저해활성을 가지는 것으로 보고되었다(Floris 등, 2019). 특히, triterpenic skeleton과 C-3의 구조를 가지는 lupeol은 AChE에 대한 우수한 저해제로 보고되었다(Besbes 등, 2017). 이에 따라 본 연구에서도 Aβ로 인지기능 장애가 유도된 동물모델에서 다양한 생리활성 물질을 함유하는 SCBE 섭취를 통해 콜린성 시스템이 개선되는 것을 확인하였다. 다만, SCBE가 ACh의 분해에는 효과적인 저해활성을 보였으나, ACh 합성과 관련이 있는 choline acyltransferase(ChAT)의 발현량 조절에 관한 연구가 추가적으로 진행되어야 할 것이다.
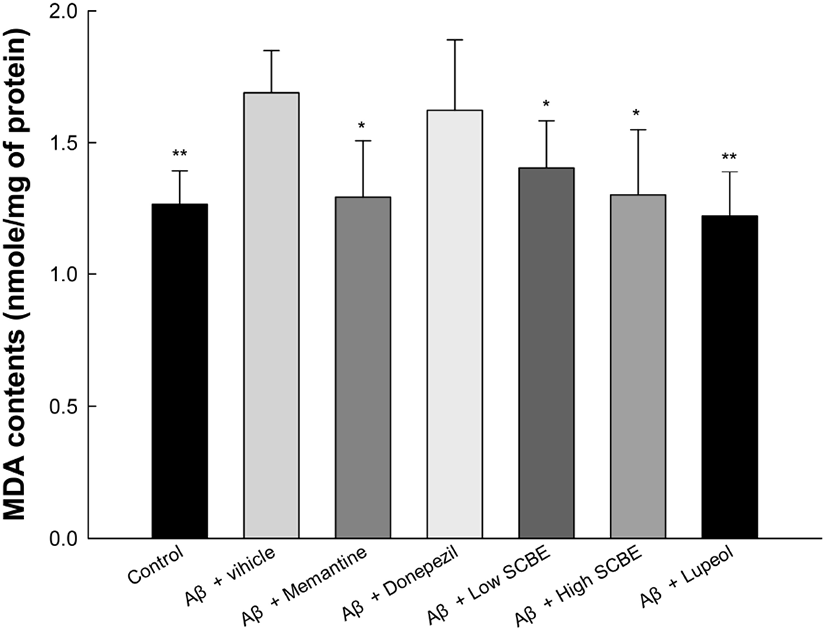
뇌 조직은 외부의 스트레스로부터 조직을 보호하기 위한 방어 시스템으로서 항산화 시스템을 가지고 있으며, superoxidse dismutase(SOD), glutathione(GSH), catalase (CAT) 등과 같은 항산화 효소로 이루어져 있다(Shim 등, 2017). 하지만 과도한 Aβ 단백질의 축적으로 인한 독성과 Aβ 단백질로부터 생성되는 산화적 스트레스는 체내 항산화 시스템의 손상을 일으키고, 뇌 조직에 존재하는 세포막 지방질의 지질과산화를 일으켜 malondialdehyde(MDA)와 같은 지질과산화물이 생성된다(Campbell과 Bondy, 2000). 특히, 뇌 조직은 다른 조직에 비해 불포화 지방산의 비율이 높아 스트레스에 취약한 구조를 가져 쉽게 손상되어 뇌 신경세포의 사멸을 초래할 수 있다(Bourre, 2004). 따라서 Aβ로 유도된 인지기능 장애 모델에서의 SCBE의 MDA 저해활성을 측정하였다(Fig. 7). Aβ 처리군(1.69 nmole/mg protein)은 정상대조군(1.26 nmole/mg protein)에 비하여 유의적으로 증가된 MDA 함량을 나타냈으며, memantine과 donepezil 양성대조군은 각각 1.29 nmole/mg protein과 1.62 nmole/mg protein으로 MDA 함량이 개선된 것을 보였다. 또한, SCBE 처리군(1.40 nmole/mg protein과 1.30 nmole/mg protein)과 lupeol 처리군(1.22 μmole/mg protein) 역시 Aβ 처리군과 비교하였을 때, MDA 함량이 유의적으로 개선된 것을 확인하였다. 마가목의 섭취는 알코올 투여로 인한 간 손상에 대해 GSH와 SOD, CAT의 수준을 증가시켜 지질과산화 수준을 유의적으로 감소시켰다(Lee 등, 2006). 마가목의 대표 생리활성 물질인 lupeol은 카드뮴(Cd)의 만성 노출에 의한 신장 조직의 지질과산화를 억제시키는 것으로 보고되었으며(Nagaraj 등, 2000), 테스토스테론으로 유도된 산화적 스트레스에 대한 전립선의 지질과산화 역시 억제되었다(Prasad 등, 2008). 따라서 다양한 조직에서의 마가목과 lupeol의 항산화 시스템 보호 효과와 지질과산화 억제활성은 뇌 조직에서 역시 우수한 보호 효과를 가질 수 있는 것으로 판단된다.
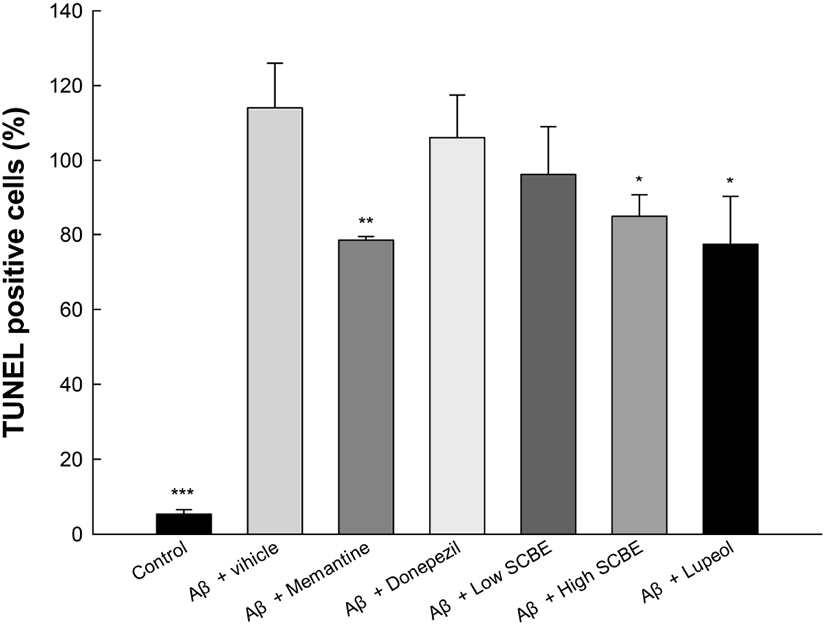
Aβ는 뇌 조직의 자동 apoptosis를 촉진시키며 뇌 조직에서 프로그램화된 apoptosis가 진행될 경우, 신경세포의 점진적인 퇴행을 나타낸다(Awasthi 등, 2005). 특히, 해마 조직의 CA1과 DG 부분에서의 뇌세포 사멸은 인지기능의 장애를 초래하여 궁극적으로 AD의 발현을 초래한다(Kerchner 등, 2012). 따라서 Aβ로 유도된 인지기능 장애 모델에서의 SCBE의 apoptosis 억제 활성을 평가하였다(Fig. 8). 뇌 조직에서의 TUNEL 분석 결과는 Aβ 처리군(114.08%)은 정상대조군(5.36%)에 비하여 유의적으로 증가된 positive cell을 나타냈으며, memantine과 donepezil 양성대조군은 각각 78.44%와 106.08%로 positive cell의 감소를 보였다. 또한, SCBE 처리군(96.29%, 84.87%)과 lupeol 처리군(77.40%) 역시 Aβ 처리군과 비교하였을 때, positive cell이 개선되는 경향을 보였으며, 특히, SCBE 고농도 처리군과 lupeol 처리군은 유의적으로 개선되었다. 마가목에 다량 함유된 isoquercitrin은 Aβ 단백질의 응집을 예방할 뿐만 아니라, 형성된 플라크의 분해에 효과가 있으며, isoquercitrin의 처리는 사전 배양된 Aβ25-35 단백질의 형광 강도를 감소시키며, Aβ25-35의 응집을 억제할 뿐만 아니라, 형성된 β-sheet를 분해하여 응집을 억제하는 효과를 가진다고 보고되었다(Carmona 등, 2020). 또한, 마가목에 lupeol과 더불어 다량 함유되어 있는 lupenone은 PI3K/Akt/mTOR 신호 전달 경로를 통해 메스암페타민(methamphetamine)으로 유도된 apoptosis로부터 신경모세포종 SH-SY5Y 세포를 보호한다고 보고하였다(Lee 등, 2020). 또한 마가목의 물 추출물은 lipopolysaccharide (LPS)로 유도된 macrophage에서 inducible NO synthase (iNOS) 및 cyclooxygenase-2(COX-2)의 mRNA 수준을 효과적으로 감소시켰고, protein kinase B(Akt), phosphoinositide-dependent kinase 1(PDK1), p85/phosphoinositide-3-kinase(PI3K)의 발현을 조절함으로써 염증반응과 세포 사멸을 억제하였다(Yu 등, 2011). 따라서 다양한 생리활성 물질을 함유하는 SCBE는 신경세포의 apoptosis를 유의적으로 억제함으로써 신경세포의 보호 효과를 가지며, 이는 궁극적으로 인지기능을 보호해 주는 것으로 판단된다.