1. 서론
건강 및 질환에 영향을 미치는 여러 가지 요인들 중에서 염증과 산화스트레스는 여러 질환의 발병에 관여되는 것으로 알려져 있다(Lee 등, 2013). 활성산소종(reactive oxyzen species, ROS)은 정상적인 세포 내 활성작용 과정에서 생성되며, 세포분화, 유전자의 발현, 사이토카인에 대한 반응 정도를 포함한 다양한 생물학적 과정에 연관되어 있다. 산화스트레스는 ROS의 생성과 이를 제거하는 항산화 반응 간의 불균형으로 인해 세포 내의 ROS가 증가하여 DNA나 단백질, 지질(lipid)과 반응하여 손상시키는 현상이며, 이는 노화나 심장과 관련된 질병들의 핵 심적인 원인으로 알려져 있다(Kang, 2013). 산화적 손상에 관여하는 대표적인 ROS와 RNS(reactive nitrogen species, RNS)에는 superoxide(O2-), nitric oxide(NO), hydroxyl ion(OH) 등의 free radical이 있고, 그 외로는 산소 유래종(oxygen-derived species)인 singlet oxygen (1O2), hydrogen peroxide(H2O2), hypochlorous acid (HOCl) 등도 있는데, 이들의 생성은 대부분 체내에서 기원한다. 그리고 세포 내에 존재하는 미토콘드리아, peroxisome, xanthine oxidase(XOD), NADPH oxidase 및 cyclooxygenase(COX) 등의 효소들은 지속적으로 ROS를 생성하고, RNS는 염증반응 시 대식세포, 호중구 및 다른 면역 세포들의 면역반응으로 인해 다량 생성되며, 이때 ROS도 같이 생성된다(Kim 등, 2009). 대식세포를 그람음성 균주의 세포벽 조각인 지질다당체인 lipopolysaccharide (LPS)로 자극하게 되면 tumor necrosis factor-α(TNF-α), interleukin-6(IL-6), interleukin-1β(IL-1β)와 같은 pro-inflammatory cytokine을 증가시키며, NO, prostaglandin E2(PGE2) 등의 염증매개물질을 분비한다. 또한, 염증상태에서는 cyclooxygenase-2(COX-2)와 NO synthase(NOS)가 유도되어 과량의 PGE2, NO 등이 생성되며 이것은 질병 악화의 원인이 된다(Lee와 Kim, 2015). LPS에 의한 신경염증반응은 Toll-like receptor 4(TLR 4) 신호전달 경로의 활성화에 의해 조절되거나, 독성물질로 작용하는 NO나 PG의 생성에 영향을 미치는 inducible nitric oxide synthase(iNOS), COX-2에 의해 조절되기도 하는데, 이러한 일련의 과정은 nuclear fator-kappa B(NF-κB)와 activator protein(AP)-1의 신호전달 조절 기전과 밀접한 연관성이 있는 것으로 알려져 있다(Park 등, 2017).
식물체 내에 존재하는 많은 화합물들은 부위별, 품종, 처리방법, 추출 용매 종류 및 용매 비, 추출온도 등 다양한 조건에서 추출하며, 식물 화합물의 함량뿐만 아니라, 항산화 및 생리활성 특성에 변화를 준다(Kim 등, 2001). 또한, 일부 식물 추출물이나 천연의 항산화 물질들이 염증반응 유발물질 중 하나인 lipopolysaccharide(LPS)를 처리한 RAW 264.7 대식세포에서 iNOS나 COX-2의 발현을 억제시킴으로써, NO와 PGE2의 생성을 감소시킴과 동시에 IL-1β, IL-6, TNF-α와 같은 염증성 매개물질들의 합성을 억제시키는 효과가 있음이 보고된 바가 있다(Kwak과 Choi, 2015).
찔레꽃(Rosa multiflora flower)은 장미과(Rosaceae)에 속하는 식물로 산이나 들의 기슭이나 계곡 등에서 쉽게 볼 수 있으며, 약성의 효능이 좋기 때문에 어느 하나 버릴 것 없이 오랫동안 한방에서 사용되었다. 찔레의 꽃과 열매, 뿌리, 씨앗 등 다양한 부위는 항산화 효과와 항염증 효과, 항균 효과, 발모 등에 우수한 소재로 알려져 있다. 이러한 찔레꽃의 알려진 유효 성분으로는 flavonoid의 계열인 quercetin 배당체(multinoside A, multinoside B, quercitrin 등), kaempferol 배당체(multiflorin A, multiflorin B, afzelin, astragalin 등), 탄닌 계열의 methyl gallate 및 과실의 홍색 색소인 lycopene 등이 보고되어 있다(Kim 등, 2018). 또한, 찔레꽃은 꽃차로도 활용이 되며, 찔레꽃의 맛과 약성을 취할 수 있는 장점이 있다. 찔레꽃과 관련하여 열수 추출물과 에탄올 추출물 간의 항산화 효과와 에탄올 추출물의 항산화 활성, 항균 활성 및 방부효과에 관한 연구가 보고되었으나 항염증에 관한 연구는 미흡한 실정이다.
따라서 본 연구에서는 찔레꽃을 열수, 에탄올 및 아세톤으로 추출하여 폴리페놀, 플라보노이드의 함량 및 항산화 효능을 확인하고, LPS로 유도된 RAW 264.7 대식세포에서 염증반응 억제 여부를 확인하기 위해 NO 생성저해 활성 및 염증반응을 매개하는 iNOS, COX-2 단백질의 발현을 확인하여 항산화 및 항염증 소재로서의 활용 가능성을 검증하였다.
2. 재료 및 방법
본 실험에 사용한 찔레꽃(R. multiflora)은 청도 각남면 예리 2리에서 2019년에 채집한 후에 자연 건조시켜 4°C 냉장실에 보관하고 사용하였다. 추출 방법은 침지법과 열수법을 사용하였다. 추출물은 건조된 시료 100 g을 별도의 분쇄과정 없이 2 L의 용매를 넣어서 추출하였다. 열수는 50°C에서 24시간 동안 추출하는 것을 2회 반복하였으며, 70% ethanol과 70% acetone 추출물은 실온에서 24시간 동안 침지시켜 추출한 것을 2회 반복하였다. 각각의 추출액을 여과지(No. 20 filter paper, Hyundai Micro Co., Ltd., Korea)로 여과, 농축, 동결건조하여 건조 추출물을 얻었다. 각 건조 추출물의 수율은 동결건조시킨 추출액을 건조 중량을 구하고, 추출액 조제에 사용한 원료 건물량에 대한 백분율로 계산하였다. 열수 추출물(RMW)의 수율은 6.93%, 70% ethanol 추출물(RME)의 수율은 23.66%, 70% acetone 추출물(RMA)의 수율은 20.08%이었다. 각 건조 추출물들은 4°C 냉장실에 보관하고 본 실험의 시료로 사용하였다.
항산화 효과 측정 실험에 사용된 시약은 2,2-disphenyl-1-picrylhydrazyl, 2,2-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid) diammonium salt, potassium peroxodisulfate, trizma base, L-acorbic acid, DL-α-tocopherol, tannic acid, pyrogallol, quercetin 등은 Sigma-Aldrich Co., Ltd.(St. Louis, MO, USA)의 제품을 사용하였고, sodium hydroxide, hydrochloric acid 등은 Duksan Pure Chemicals Co., Ltd(Ansan, Korea)의 제품을 사용하였으며, folin-ciocateu phenol reagent는 Junsei Chemical Co., Ltd.(Tokyo, Japan)의 제품을 사용하였다.
항염증 효과 실험에 사용된 세포주 murine macrophage cell(RAW 264.7)은 한국 세포주 은행(Seoul, Korea)에서 구매하였고, 세포 배양을 위한 fetal bovine serum(FBS), Dulbecco’s modified Eagle medium(DMEM), trypan blue stain, trypsin-EDTA, 3-[4,5-dimethylthiazol-2-yl]-2,5-dipheyl-tetrazolium bromide(MTT) 시약과 항염증 측정 실험에 사용된 시약인 Griess reagent, lipopolysaccharide 등은 Sigma-Aldrich Co., Ltd.(St. Louis, MO, USA)에서 구입하여 사용하였다. 본 실험에 사용된 기기는 ELISA reader(SpectraMax 190, Moleculer devices, Sunnyvale, California, USA), freeze dryer (Ilshin, Korea), microscope(Olympus Co., Ltd., Tokyo, Japan), rotary vacuum evaporator(Rikakikai Co., Ltd., Tokyo, Japan), digital reciprocating shaker (Daihan Scientific Co., Ltd., Gangwon, Korea), Western imaging system(CAS-400SM, Davinch-K Co., Ltd., Seoul, Korea), CO2 incubator(VS-9160GC, Hanbaek Scientiffic Co., Deajeon, Korea)를 사용하였다.
총폴리페놀 화합물은 Folin-Denis 방법(Folin과 Denis, 1912)으로 측정하였다. 시료는 증류수에 5, 10, 50, 100, 500, 1,000 μg/mL 농도로 희석하여 준비한다. 0.2 mL Folin Ciocalteu reagent를 첨가하여 잘 혼합한 후 3분 동안 실온에 반응시킨 후, 0.7 M Na2CO3 포화용액 0.5 mL를 가하여 섞은 후 각 추출물 0.5 mL씩 농도별로 넣은 후 1시간 반응시킨 뒤, 725 nm에서 흡광도를 측정하였다. Tannic acid를 사용한 표준곡선을 이용하여 양을 환산 후 총폴리페놀 함량을 표기하였다.
총플라보노이드 함량은 보고된 비색법, Brief(NFRI, 1990) 방법을 변형하여 측정하였다. 시료의 농도는 5, 10, 50, 100, 500, 1,000 μg/mL 농도로 희석하였다. 시료 0.05 mL에 1 N NaOH을 50 μL 및 diethylene glycol을 200 μL를 넣고 37°C에서 5분 동안 반응 후, 각 420 nm에서 흡광도를 측정하였다. Quercetin을 표준곡선으로 나타내어 양을 환산 후 총플라보노이드 함량을 표기하였다.
DPPH radical 소거능의 효과 측정은 Blois(Blois, 1958)의 방법으로 측정하였다. 2,2-Diphenyl-1-picrylhydrazyl (DPPH)를 0.45 mM 농도가 되도록 99% ethanol로 녹여 준비하고, 시료는 5, 10, 50, 100, 500, 1,000 μg/mL 농도로 희석하여 준비하였다. 양성 대조군으로는 ascorbic acid를 사용하였다. 이후 96 well plate에 각 추출물 120 μL와 DPPH 60 μL를 첨가하고, 실온에서 차광하여 15분 동안 반응시키며, 517 nm에서 흡광도 판독장치인ELISA reader를 사용하여 소거활성을 측정하였다.
ABTS+ cation decolorization assay 방법(Rice-Evans 등, 1999)에 따라 ABTS radical을 이용한 항산화력을 측정하였다. 7 mM 2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS) 시약과 2.4 mM potassium persulfate를 같은 비율로 섞고, 차광하여 12-24시간 동안 반응을 시킨 후 실험을 진행하였다. 시료는 5, 10, 50, 100, 500, 1,000 μg/mL 농도로 희석하여 준비하였고, 양성 대조군으로는 ascorbic acid를 사용하였다. 이후 96 well plate에 ABTS 시약 100 μL와 각 추출물 100 μL를 가하여 실온에서 7분간 반응시킨 뒤, 파장 734 nm에서 흡광도를 측정하고 저해율(%)로 나타내었다.
Marklund(Marklund와 Marklund, 1974)의 방법에 따라 superoxide dismutase(SOD) 유사활성을 측정하였다. 시료는 5, 10, 50, 100, 500, 1,000 μg/mL의 농도로 준비하였고, 양성 대조군으로는 ascorbic acid를 사용하였다. 96 well plate의 시료 20 μL에 50 mM Tris-HCl buffer(pH 8.5) 130 μL, 증류수에 녹인 7.2 mM pyrogallol 20 μL를 넣고 20분 동안 실온에서 차광하여 반응시킨 후, 420 nm에서 흡광도를 측정하여 pyrogallol의 양을 측정하였다.
본 실험에서 이용한 RAW 264.7 macrophage cell은 10% FBS와 1% penicillin/streptomycin(100 U/mL)을 첨가한 DMEM 배지를 사용하였으며, 37°C, 5% CO2 incubator에 적응시켜 계대배양하였다. RAW 264.7은 cell scraper를 이용해서 세포를 수확한 후에 계대배양하였다.
세포 독성 측정은 Carmichael 등(1987)의 방법에 따라 측정하였다. 96 well plate에 RAW 264.7 cell은 5×103 cells/well이 되게 분주하고, incubator에서 37°C, 5% CO2 조건으로 24시간 동안 배양시킨다. 시료를 5, 10, 25, 50, 100, 250, 500 μg/mL 농도별로 제조하여 0.02 mL를 첨가 후, 37°C, 5% CO2 incubator에서 6시간 배양하였다. 그 후 2.5 mg/mL 농도로 제조한 MTT 용액을 0.02 mL 첨가하여 4시간 동안 배양시킨다. 그 후 배양액을 최대한 제거하고, 각 well당 dimethyl sulfoxide(DMSO, DUSAN, Gyeonggi, Korea)를 0.1 mL 가하여 실온에서 30분간 충분히 반응시켜 ELISA reader로 540 nm에서 흡광도를 측정하였다.
NO 측정은 세포의 상등액에서 NO의 양을 nitrite and nitrate로 측정하였다(Green 등, 1982). 96 well plate에 세포주 RAW 264.7을 1×104 cells/well이 되도록 분주하고, incubator에서 37°C, 5% CO2 조건으로 24시간 동안 배양시킨다. 그 뒤에 배양액을 혈청 무첨가 DMEM 배지로 교환하고 lipopolysaccharide(LPS)를 처치하여 염증 반응을 유도한다. 따라서 LPS 1 ppm/well이 되도록 처리하고 각각의 시료용액을 농도별로 처리한 후, incubator에서 37°C, 5% CO2 조건으로 24시간 동안 배양시킨다. 그 뒤에 새로운 96 well plate에 세포 배양액 100 μL를 옮기고 Griess reagent를 100 μL 첨가하여 상온에서 5분 동안 반응시킨 뒤에 540 nm에서 흡광도를 측정하여 결과를 계산하였다.
6 well plate에 RAW 264.7 cell이 5×105 cells/well이 되도록 분주하고, 37°C, 5% CO2 incubator에서 24시간 동안 배양시킨다. 그 뒤에 배양액을 혈청 무첨가 DMEM 배지로 교환한 후, 항염증에 관련된 iNOS, COX-2 단백질 발현량을 측정하기 위해 LPS로 처리하고, 각 시료용액을 농도별로 처리 후 37°C, 5% CO2 incubator에서 24시간 배양시켰다.
그 뒤 배지를 제거하고 PBS로 1회 세척 후 모든 세포는 RIPA buffer로 처리하여 세포를 용해시키고, 원심분리기를 이용하여 4°C, 12,000 rpm에서 15분 동안 원심분리시킨 뒤 얻은 상등액을 새 튜브에 옮긴다. Membrane은 digital reciprocating shaker 기기를 이용하여 5% skim milk로 2시간 blocking한 다음, primary antibody로 3시간 반응시켜준 후, TBST solution으로 10분 간격으로 3회 세척을 반복하였다. 그 다음에 특정 단백질에 primary antibody가 붙은 membrane을 각 항체의 숙주에 해당하는 secondary antibody를 1시간 동안 반응시키고, TBST solution으로 10분 간격으로 3번 세척을 반복한 뒤 Davinch Western imaging system을 이용하여 단백질 발현량을 측정하였다.
3. 결과 및 고찰
일반적으로 총폴리페놀 함량이 증가할수록 항산화 등의 생리활성이 증가하는 경향으로 보고된다(Lee 등, 2012). 총폴리페놀 측정 시 사용되는 대표 표준물질로는 탄닌산, 카테킨, 갈릭산 등이 있으며, 다른 표준물질에 비해 상대적으로 저렴하고 건조 형태로 안정하여 단일 표준물질로 사용하기 용이하다(Hu 등, 2018). 본 실험에서는 tannic acid를 사용해 표준곡선을 나타내어 찔레꽃 추출물의 폴리페놀 함량을 측정하였다. RMW는 236.58 mg/g의 함량을 보였으며, RME는 198.15 mg/g, RMA는 216.97 mg/g의 폴리페놀 함량을 보였다. Choi 등(2019)의 연구결과, 장미꽃 품종인 Colorado, Onnuri, platyphylla Thory, Icewing의 건조 추출물은 각각 87.17 mg/g, 81.81 mg/g, 93.59 mg/g, 62.76 mg/g의 폴리페놀 함량을 보이며, 이 결과와 비교했을 때 가장 높은 Colorado 건조 추출물에 비해 찔레꽃 추출물이 더 높은 것을 알 수 있다.
식물에 널리 분포되어 있는 플라보노이드 성분 역시, 항산화능을 비롯한 여러 생리활성 기능이 최근 많은 연구에서 밝혀지고 있다(Lee 등, 2012). 항산화력이 탁월한 플라보노이드 중 하나인 quercetin은 신경보호 기능(neuroprotective), 심장보호 기능(cardionprotective), 혈관보호 기능(blood vessel protective), 항염 기능(anti-inflammatory), 항알러지(anti-allergic properties) 기능 등이 보고되어 있다(Pak 등, 2016). 본 실험에서는 quercetin을 사용해 표준곡선을 나타내어 찔레꽃 추출물의 플라보노이드 함량을 측정하였다. RMW는 16.91 mg/g의 함량을 보였으며, RME는 7.80 mg/g, RMA는 20.24 mg/g의 플라보노이드 함량을 보였다. 이는 Choi 등(2019)의 연구결과, 장미꽃 품종인 Colorado 건조 추출물은 4.52 mg/g, Onnuri 건조 추출물은 5.48 mg/g, platyphylla Thory 건조 추출물은 9.12 mg/g, Icewing 건조 추출물은 2.72 mg/g의 플라보노이드 함량을 보였으며, 이 결과와 비교했을 때 가장 많은 flavonoid 함유량을 가진 platyphylla Thory 건조 추출물에 비해 찔레꽃 에탄올 추출물이 비교적 함량이 낮았으나, 열수와 아세톤 추출물의 경우 플라보노이드 함량이 더 높은 것을 알 수 있다. 이러한 폴리페놀과 플라보노이드 화합물의 함량을 측정한 결과를 보아 항산화 기능성 소재로서 가치 및 가능성이 높을 것으로 사료된다(Table 1).
DPPH는 짙은 보라색을 띠는 비교적 안정한 free radical로서, 항산화 성분과 반응하게 되면 보라색이 무색으로 변하게 되는 특성을 가지고 있어 항산화 활성이 쉽게 검증 가능하므로, 다양한 천연소재로부터 항산화 물질의 전자공여능을 측정하는 데 많이 이용되고 있다(Song과 Choi, 2016). 항산화제(antioxidants)는 산화에 의한 변패나 영양소 손실을 방지하기 위한 물질로, 체내에서 비타민 C와 E 그리고 glutathione이 주로 이 역할을 담당하고 있다(Kim, 2011). 따라서 수용성 항산화제 ascorbic acid와 지용성 항산화제 tocopherol을 대조군으로 하여, Fig. 1에 찔레꽃 추출물에 DPPH radical 소거 활성을 측정한 결과를 나타내었다. 찔레꽃 추출물 모두 농도 의존적인 효과를 보였으며, 모두 50% 이상의 효능을 보이는 100 μg/mL에서 RMW는 52.45%의 저해효능을 보이고, RME는 59.88%, RMA는 59%의 저해효능을 보였다. Kim 등(2011)의 연구결과, 아까시아 꽃 물, 에탄올 추출물 각각 1,000 μg/mL 농도에서 14.06%, 10.91%의 소거능을 보였으며, 이 결과와 비교하였을 때 찔레꽃 추출물이 낮은 농도에서 더 높은 효능을 보이고, Ascorbic acid보다도 높은 효과를 보여준다. Tocopherol보다 낮은 효과를 보이긴 하나, Ascorbic acid보다 효과가 높은 것으로 보아 찔레꽃 추출물이 항산화 기능성 소재로서 긍정적인 영향을 미칠 것으로 사료된다.
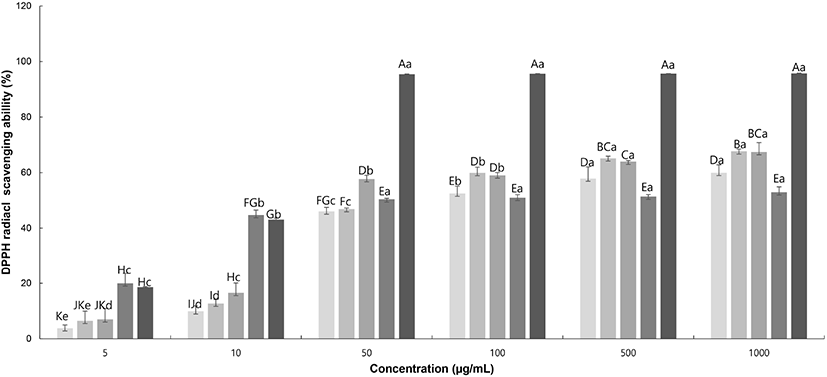
 RMW, Rosa multiflora flower water extract;
RMW, Rosa multiflora flower water extract;  RWE, Rosa multiflora flower 70% ethanol extract;
RWE, Rosa multiflora flower 70% ethanol extract;  RMA, Rosa multiflora flower 70% acetone extract;
RMA, Rosa multiflora flower 70% acetone extract;  L-ascorbic acid;
L-ascorbic acid;  DL-α-tocopherol.
DL-α-tocopherol.
ABTS+ radical 소거법은 potassium persulfate와 반응하여 형성된 청록색의 ABTS+ radical cation이 추출물의 항산화 물질에 의하여 소거되어 탈색되는 원리를 이용한 항산화 활성 측정법이다. ABTS+ radical 소거법은 극성과 비극성 시료의 소거활성을 모두 측정할 수 있으므로 DPPH radical 소거법보다 적용 범위가 넓다. 또한, DPPH radical은 free radical, ABTS+ radical은 cation radical로 기질의 특징이 서로 다르며, 추출물의 특성에 따라 free radical과 cation radical과의 결합 정도가 다를 수 있으므로, 추출물의 항산화 활성을 측정할 때에는 두 종류의 radical 소거능을 모두 분석할 필요가 있다(Shin와 Lee, 2010). 찔레꽃 추출물 용매에 따른 ABTS+ 라디칼 소거 능력을 농도별로 측정하여 비교한 결과를 Fig. 2에 나타내었다. 찔레꽃 추출물 모두 낮은 농도에서부터 농도 의존적인 효과를 보였으며, ABTS+ 소거활성능이 90% 이상인 50 μg/mL에서 RMW는 94.6%의 소거능을 보였고, RME는 92.5%, RMA는 99.1%의 소거능을 보였다. Go와 Choi(2018)의 연구결과와 비교했을 때 찔레나무 뿌리 초임계 추출물의 최고농도인 500 μg/mL에 비해 찔레꽃 추출물 50 μg/mL의 효능이 더 높게 나왔다. 또한 대조군인 tocopherol보다 높은 효능을 보였고, ascorbic acid와 유사한 효능을 보이는 것으로 보아, 찔레꽃 추출물이 항산화 기능성 소재로 활용 가치가 높을 것으로 사료된다.
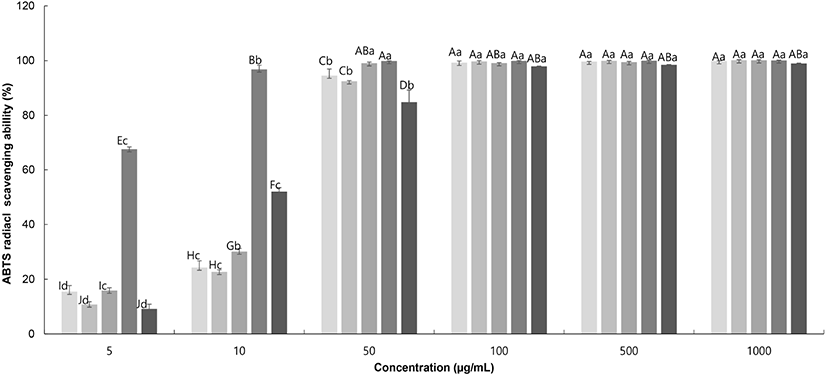
 RMW, Rosa multiflora flower water extract;
RMW, Rosa multiflora flower water extract;  RWE, Rosa multiflora flower 70% ethanol extract;
RWE, Rosa multiflora flower 70% ethanol extract;  RMA, Rosa multiflora flower 70% acetone extract;
RMA, Rosa multiflora flower 70% acetone extract;  L-ascorbic acid;
L-ascorbic acid;  DL-α-tocopherol.
DL-α-tocopherol.
Superoxide siemutase(SOD)는 세포에 해로운 활성산소종을 과산화수소로 전환시키는 반응을 촉매하는 효소이며, SOD에 의해 생성된 H2O2는 peroxidase나 catalase에 의해 무해한 물 분자와 산소 분자로 전환시켜, 유해한 활성산소종으로부터 우리 몸을 보호하는 중요한 항산화 효소 중 하나이다(Kim과 Kang, 2010). 찔레꽃 추출물의 SOD 유사활성능 측정 결과를 Fig. 3에 나타내었다. 최고농도인 1,000 μg/mL에서 RMW는 62.04%의 유사활성능을 보였으며, RME는 25.04%, RMA는 42.76%의 유사활성능을 보였다. 이는 Jeon 등(2014)의 망초꽃 에탄올 추출물 1 mg/mL 농도에서 15% 이하의 유사활성을 보인 결과와 비교하여, 찔레꽃 추출물은 효능이 높게 나온 것을 확인할 수 있었다. 지용성 항산화 물질들은 주로 과산화지질라디칼(lipid peroxyl radiacal, ROS)과 일중항산소(singlet oxygen, 1O2)로부터 하이드로페록사이드의 형성을 저지함으로써, 막에 일어나는 자유 라디칼 체인(free radical chain)을 중단시키기 때문에(Kim 등, 2014) ascorbic acid와 RMW에 비해 RME와 RMA의 활성이 낮은 것으로 보인다.
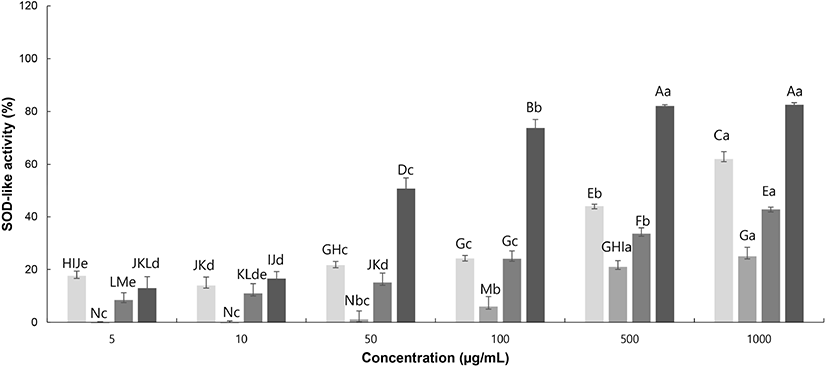
 RMW, Rosa multiflora flower water extract;
RMW, Rosa multiflora flower water extract;  RWE, Rosa multiflora flower 70% ethanol extract;
RWE, Rosa multiflora flower 70% ethanol extract;  RMA, Rosa multiflora flower 70% acetone extract;
RMA, Rosa multiflora flower 70% acetone extract;  L-ascorbic acid.
L-ascorbic acid.
찔레꽃에 의한 macrophage cell의 세포 생존율을 MTT assay를 통해 확인한 결과를 Fig. 4에 나타내었다. 측정한 결과, RMW, RME, RMA 모두 농도 250 μg/mL까지 90% 이상의 생존율을 보였다. 이 결과, 단백질 발현 측정을 위하여 농도를 250 μg/mL 이하로 설정하여 실험을 진행하였다(Fig. 5).
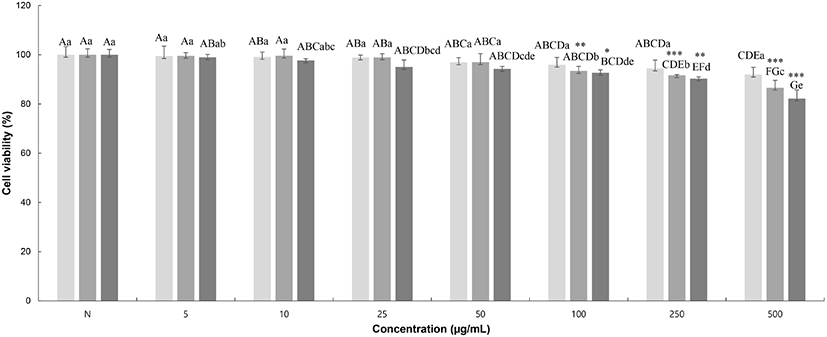
 RMW, Rosa multiflora flower water extract;
RMW, Rosa multiflora flower water extract;  RWE, Rosa multiflora flower 70% ethanol extract;
RWE, Rosa multiflora flower 70% ethanol extract;  RMA, Rosa multiflora flower 70% acetone extract.
RMA, Rosa multiflora flower 70% acetone extract.
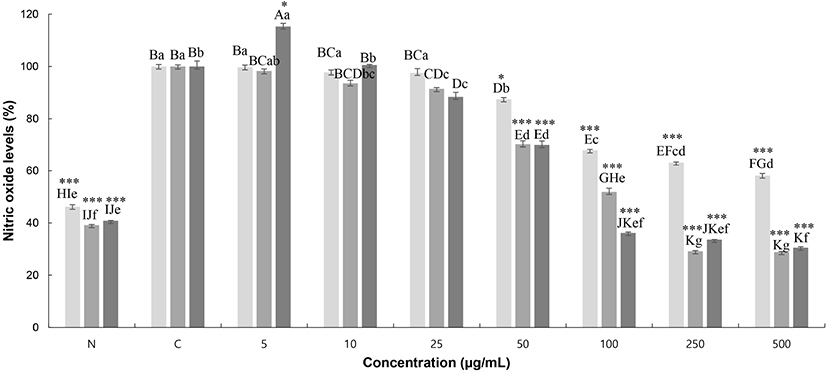
 RMW, Rosa multiflora flower water extract;
RMW, Rosa multiflora flower water extract;  RWE, Rosa multiflora flower 70% ethanol extract;
RWE, Rosa multiflora flower 70% ethanol extract;  RMA, Rosa multiflora flower 70% acetone extract.
RMA, Rosa multiflora flower 70% acetone extract.
NO는 NO 합성 효소에 의해 L-arginine으로부터 생성되는 무기 유리체로, 면역 반응, 세포독성, 신경전달계 및 혈관 이완 등 여러 생물학적인 과정에 관여하며 농도에 따라 세포 기능 유지에 중요한 작용을 하기도 하고, 세포 독성을 일으키기도 한다(Jeong 등, 2014). 찔레꽃에 의한 macrophage cell인 RAW 264.7 세포에서 NO 중의 nitrite(NO2) 억제 정도를 측정하기 위해 용매별, 농도별로 샘플을 처리하여 NO 저해 활성률을 측정한 결과를 Fig. 5에 나타내었다. NO 생성률은 LPS 무처리군에 비해 처리한 군은 50% 이상 증가하였고, 250 μg/mL 농도에서는 RMW는 36.81%, RME는 70.86%, RMA는 66.42% 저해활성을 나타내었다. Kim(2019)의 연구결과, 님 잎의 물, 에탄올 및 초음파 추출물은 LPS 처리군에 비하여 1,000 μg/mL에서 각각 14.0, 32.8, 26.0% 정도의 감소율을 나타내었고, 이 결과와 비교했을 때 님 잎의 추출물 1,000 μg/mL 농도보다 적은 250 μg/mL 농도의 찔레꽃 추출물이 NO 저해 활성이 더 효과적인 것을 볼 수 있다. 따라서 찔레꽃 추출물이 항염증 기능성 소재로서 긍정적인 영향을 미칠 것으로 사료된다.
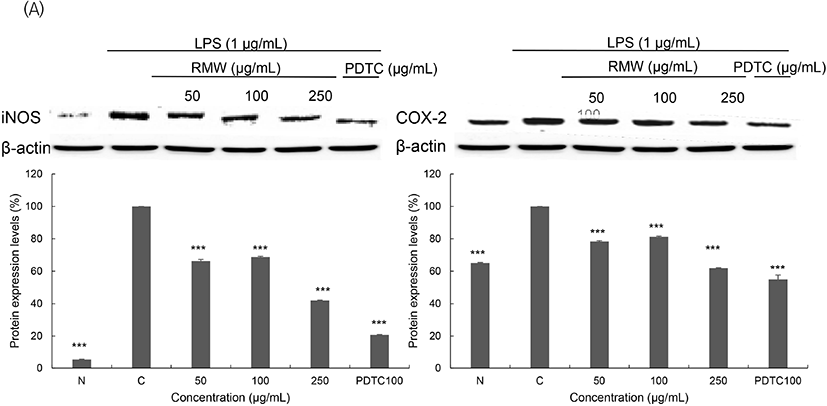
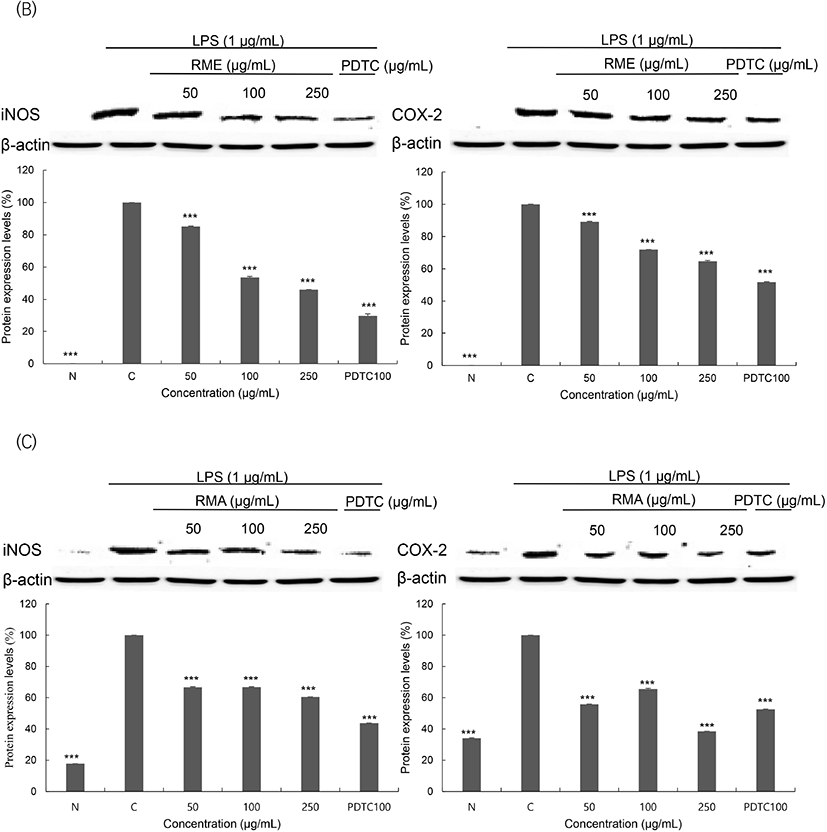
RAW 264.7 cell에 LPS로 자극을 준 뒤 샘플을 처리하여 염증관련 단백질인 iNOS와 COX-2의 단백질 발현 결과를 Fig. 6에 나타내었다. 세포의 종류나 환경에서도 발현 정도의 차이가 거의 없는 house keeping gene인 β-actin을 positive control로 사용하였고, 찔레꽃 추출물의 신경염증 저해 작용이 NF-κB 신호전달 경로를 통해 일어나는지를 검증하기 위해 NF-κB inhibitor인 pyrrolidine dithiocarbamate(PDTC)를 사용하였다(Lee, 2017; Park, 2017). iNOS 단백질 발현은 LPS 처리군이 무처리군보다 발현이 증가하였고, 250 μg/mL 농도에서 RMW는 39.54%, RME는 53.94%, RMA는 39.54% 저해됨을 확인하였다. 또한, COX-2 단백질 발현 역시 LPS 처리군이 무처리군보다 발현이 증가하였으며, 250 μg/mL 농도에서 RMW는 38.11%, RME는 35.34%, RMA는 61.48% 저해된 것을 확인하였다. 이 결과를 통해 찔레꽃 추출물이 항염증 기능성 소재로서의 활용 가능성이 높을 것으로 사료된다.