Article
베타-아미노이소부티르산과 분지쇄 아미노산 함량이 증강된 닭가슴살 가수분해물의 제조: 프로테아제의 종류 및 가수분해 조건의 영향
김은비
1,‡
, 김대운
1,‡
, 최한석
2
, 김영회
1
, 김명곤
1
Preparation of β-aminoisobutyric acid and branched chain amino acid-enhanced hydrolysates from chicken breast: Effect of protease types and hydrolysis conditions
Eun-Bee Kim
1,‡
, Dae-Woon Kim
1,‡
, Han-Suk Choi
2
, Young-Hoi Kim
1
, Myung-Kon Kim
1
1Department of Food Science and Technology, Jeonbuk National University, Jeonju 54896, Korea
2Department of Agriculture and Fisheries Processing, Korea National College of Agriculture and Fisheries, Jeonju 54874, Korea
These authors contributed equally to this study.
Citation: Kim EB, Kim DW, Choi HS, Kim YH, Kim MK. Preparation of β-aminoisobutyric acid and branched chain amino acid-enhanced hydrolysates from chicken breast: Effect of protease types and hydrolysis conditions. Korean J Food Preserv, 29(2), 276-291 (2022)
Copyright © The Korean Society of Food Preservation. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Oct 20, 2021; Revised: Nov 23, 2021; Accepted: Nov 24, 2021
Published Online: Apr 30, 2022
4. 요약
BAIBA와 BCAA의 함량이 높은 닭가슴살의 가수분해물을 제조하기 위하여, 시판되는 11종의 프로테아제를 닭가슴살에 대하여 4%씩 첨가 후 50°C에서 12시간 반응시켰을 때 단백질 가수분해도는 alcalase, flavourzyme, prozyme 2000P에 의한 가수분해물에서 높았다. 총유리아미노산 함량은 prozyme 2000P(492.71±35.03 mg/g), flavourzyme (379.84±27.44 mg/g) 및 sumizyme AP(307.36±23.81 mg/g)에 의한 가수분해물에서 높았고, papain, bromelain, ficin과 같은 식물성 프로테아제는 미생물 유래 프로테아제에 비해 가수분해도와 유리아미노산의 생성량이 낮은 편이었다. 가수분해물 중의 BAIBA 함량은 prozyme 2000P 〉 foodpro alkaline pretease 〉 alcalase 〉 flavourzyme의 순으로 높았으나 BCAA의 함량은 prozyme 2000P, flavourzyme, sumizyme LP에 의한 가수분해물에서 높았고, 기타 효소 처리구에서는 45 mg/g 이하로 낮은 편이었다. 이 효소들 중 BAIBA와 BCAA의 성량이 높은 3종의 프로테아제(alcalase, prozyme 2000P, foodpro alkaline protease)를 선정하여 반응액의 pH, 반응시간 및 효소 첨가량의 효과를 조사한 결과, BAIBA 생성량의 경우 alcalase와 foodpro alkaline protease에 의한 가수분해물에서는 pH 6-7 범위에서 높은 반면 prozyme 2000P는 pH 5에서 높았다. BCAA 생성량의 경우, alcalase와 foodpro alkaline protease에 의한 가수분해물에서는 pH 7.5에서 높은 반면에 prozyme 2000P는 pH 5-7.5 사이에서 높았다. 효소 첨가량의 영향을 조사한 결과, 3종의 효소 모두 첨가량이 4%였을 때 BAIBA와 BCAA 생성량이 최대값에 도달하였으며, 대표적으로 alcalase를 이용하여 반응시간의 영향을 조사한 결과, 두 성분의 최대생성을 위한 적정 반응시간은 8시간이었다. 본 연구결과는 시판 프로테아제를 이용하여 BAIBA와 BCAA의 함량이 높은 닭가슴살 가수분해물을 제조하는 데 유용한 자료로 활용할 수 있을 것으로 판단된다.
Abstract
Beta-aminoisobutyric acid (BAIBA) and branched-chain amino acids (BCAA) have recently received considerable attention because of their various health benefits. In this study, the hydrolysis characteristics of chicken breast for 11 commercially proteolytic enzymes were studied to evaluate the effect of protease type, reaction pH (5-8), leaction time (2-24 h) and enzyme concentration (0.25-8%), and the effect of two combined enzymes for the preparation of BAIBA- and BCAA-enriched chicken breast hydrolysates. The content of BAIBA was higher in hydrolysate by prozyme 2000P (38.72±3.01 mg/g, dry weight base), foodpro alkaline protease (30.24±2.54 mg/g) and alcalase (26.24±1.01 mg/g) while the BCAA content was higher in prozyme 2000P (108.96±2.63 mg/g), flavourzyme (81.12±4.78 mg/g) and sumizyme LP (62.88±3.83 mg/g). As the effects of reaction pH, time, and amount of added enzymes, the optimum condition for the preparation of BAIBA- and BCAA-enriched hydrolysates were as follows; reaction pH 6-7, reaction time 8-16 h and the amount of enzyme 4% (w/w) based on the dried chicken breast. However, no significant increase of BAIBA and BCAA content was observed when hydrolyzed with two combined enzymes. These results suggest that commercial proteolytic enzymes can be applied to prepare BAIBA- and BCAA-enriched chicken breast hydrolysates.
Keywords: chicken breast; proteolytic enzymes; BAIBA; BCAA; hydrolysis conditions
1. 서론
아미노산류는 단백질을 합성하기 위한 구성요소로서 중요한 역할을 하지만, 유리형의 아미노산 자체도 종류에 따라 각기 다른 다양한 생리적 기능성을 지니고 있다는 것이 밝혀져 있다(Pasini 등, 2018; Wu, 2010; Wu, 2013). 최근까지 자연계에서는 300종 이상의 아미노산류 가 발견되어 있으나 이들 중 오직 20종의 아미노산이 단백질 구성에 참여하며, 이들은 모두 α-형의 아미노산류이다(Wu, 2009). 자연에 존재하는 아미노산류 중에는 citrulline, ornithine과 같은 비단백질성 아미노산류나 taurine 및 β-alanine과 같은 분자구조상 α-형이 아닌 아미노산일지라도 인간의 성장과 세포의 재생 및 건강유지에 중요한 역할을 한다(Curis 등, 2007; Hu 등; 2008). 근래에는 의약분야뿐만 아니라, 식품산업 분야에서도 기능성 식품소재로서 아미노산 및 관련제품들이 시판되고 있다(Kim 등, 2015). 예로서 arginine과 citrulline은 혈관을 이완하는 물질인 산화질소 합성의 전구물질로 작용하여 이완에 도움을 주며, 고혈압 등 혈관질환의 예방 및 치료를 위한 주요 기능성 물질로서 사용되고 있으며, 이외에도 골밀도 감소 지연, 성기능 개선, 체지방 감소 등 다양한 생리활성에 관한 연구결과들이 보고되어 있다(Bahadoran 등, 2021). 또한, γ-aminobutyric acid(GABA)는 뇌에서 신경전달 물질인 아세틸콜린의 분비를 증가시켜 뇌기능을 촉진하는 물질로서, 혈압강하, 불안, 불면, 우울증, 통증 완화와 지방대사 및 간 기능을 부분적으로 개선시키는 것으로 알려져 있다(Diana 등, 2014; Ngo와 Vo, 2019).
비필수 아미노산류에 속하는 β-aminoisobutyric acid (BAIBA)는 포유동물에서 염기성분인 thymine과 필수아미노산인 valine이 체내에서 대사되는 과정에서 생성되는 것으로 알려진 물질로서(Begriche 등, 2010; Tanianskii 등, 2019) 백색 지방조직에서 갈색 지방세포 유전자의 발현을 증가시키고, 간에서 지방산 β-산화를 증가시킴으로써 비만 및 관련 대사장애 개선기능이 있는 것으로 밝혀져 있다(Barlow 등, 2020; Roberts 등, 2014). 이외에도 BAIBA는 근섬유에 의해 생성 및 방출되어 운동량을 증가시키고, 심혈관 질환 예방효과가 있는 것으로 밝혀져 있고(Roberts 등, 2014; Stautemas 등, 2019), 생쥐를 이용한 동물실험 결과에서 BAIBA는 포도당 대사를 개선함으로써 비만과 만성 대사질환 예방에 도움을 줄 뿐만 아니라, 노화로 인한 뼈 손실과 근육기능 손실을 방지하는 효과도 있는 것으로 보고되어 있다(Begriche 등, 2010; Kitase 등, 2018; Shi 등, 2016). 또한, 필수 아미노산이면서 분지쇄 아미노산(branched chain amino acid, BCAA)인 류신(leucine), 이소류신(isoleucine) 및 발린(valine)은 단백질 구성 아미노산류의 30-40%를 차지하며, 다른 아미노산류는 주로 간에서 대사되지만 BCAA의 대부분은 체순환계로 들어가 골격근, 지방조직 및 뇌에 도달하여 대사된다(Chung 등, 2010; Zhang 등, 2018). 따라서 BCAA의 보충은 운동 중에 피로를 감소시킬 수 있으며, BCAA가 풍부한 식단은 근육 단백질 대사, 신체 유지 및 유산소 운동을 개선하는 효과가 있음이 밝혀져 있어 현재는 건강 기능성소재, 의약품, 동물사료 첨가제 및 화장품 원료 등으로 널리 사용되고 있다(Liu 등, 2021).
한편, 프로테아제에 의한 단백질 가수분해물들은 오래전부터 의료용, 식품용, 동물사료용 및 기타 산업용으로 사용되어 왔다(Neklyudov 등, 2000). 단백질 가수분해물은 주로 유리된 아미노산류와 저분자의 펩타이드류가 주성분으로서 이러한 가수분해 생성물들은 단백질에 비해 장내 흡수가 용이하고 각종 생리활성을 지닌 저분자량의 펩타이드들이 함유되어 있어 영양 공급소재 또는 치료용 소재로 이용되고 있다(Korhonen과 Pihlanto, 2006; Sánchez와 Vázquez, 2017). 특히 저분자의 펩타이드류는 체내에서 쉽게 흡수되기 때문에 스포츠 영양에 있어 최적의 질소공급원이 될 뿐 아니라, 단백질 보조제로서 이용성이 높으며, 연구결과에 따르면 di- 및 tripeptide와 분자량이 작은 일부의 펩타이드들은 유리아미노산보다 더 빨리 흡수되는 것으로 알려져 있다(Manninen, 2009). 그동안 영양기능 증진 및 생리활성 강화를 목적으로 단백질 함량이 높은 동물성 식품(Ahhmed와 Muguruma, 2010; Rezaharsamto와 Subroto, 2019; Ryan 등, 2011; Vercruysse 등, 2005), 식물성 식품(Daliri 등, 2019; Kong 등, 2008; Leo 등, 2009; Sun, 2011; Wang 등, 2019; Wouters 등, 2016) 및 해산물(In 등, 2016; Lee 등, 2010; Nikoo 등, 2016; Vijaykrishnaraj와 Prabhasankar, 2015)을 대상으로 효소에 의한 단백질 가수분해 연구가 많이 수행되었다.
특히 닭가슴살은 지방과 탄수화물 함량은 매우 낮고 단백질 함량은 높아 웰빙 다이어트 식품으로 각광을 받고 있다. 닭가슴살은 저렴한 가격에 구할 수 있는 고단백 저지방 식재료로 꾸준하게 그 수요가 유지되고 있기는 하나, 육질이 부드럽지 못하고 퍽퍽한 식감 때문에 소비자들에게 각광을 받지 못하고 있다. 따라서 닭가슴살의 소비를 증대시키기 위해서는 새로운 가공기술 적용을 통한 고부가가치 제품의 개발이 요구되고 있으며, 닭가슴살에 함유된 단백질 가수분해에 관한 연구도 다수 수행되어 있다(Kurozawa 등, 2009; Lindberg 등, 2021; Nchienzia 등, 2010; Saiga 등, 2003; Sangsawad 등, 2017; Sun 등, 2012; Terashima 등, 2010; Wu 등, 2020). 닭가슴살이나 닭의 가공과정에서 산출되는 부산물들의 프로테아제에 의한 가수분해 연구는 주로 단백질을 정상적으로 소화하기 곤란한 고연령자나 병약자들을 위한 영양 공급원 또는 생리활성을 지닌 펩타이드류의 함량을 증대시킬 목적으로 되었으나 프로테아제에 의한 닭가슴살의 가수분해 조건이 BAIBA 및 BCAA의 생성에 미치는 영향에 대해서는 거의 알려진 바 없다. 따라서 본 연구에서는 상업적으로 시판되는 11종의 프로테아제를 사용하여 닭가슴살을 가수분해시킨 다음 생성된 아미노산의 조성을 분석하고, 가수분해 조건(프로테아제 종류, 반응 pH, 반응시간, 효소 첨가량)이 BAIBA 및 BCAA 생성에 미치는 영향을 조사하고자 하였다.
2. 재료 및 방법
2.1. 재료
닭가슴살은 (주)하림(Iksan, Korea)에서 가공된 것을 제공받아 (주)코아(Wanju, Jeonbuk, Korea)에서 열풍건조 방법으로 건조 후 분말형태로 분쇄하여 사용하였다. 분쇄한 시료는 밀폐된 용기에 넣은 다음 −20°C에서 보관하면서 이후의 실험에 사용하였다.
2.2. 효소 및 시약
단백질 가수분해효소인 alcalase 2.4 L FG(from Bacillus licheniformis), nutrase 0.8 L(from B. amyloliiensquefaciens), flavourzyme 1,000 L(from Aspergillus. oryzae), protamex (Bacillus sp.), papain T100 MG, bromelain DR 1200은 ㈜대종상사(Seoul, Korea)에서 입수하였고, prozyme 2000P와 foodpro alkaline proteases는 ㈜비젼바이오켐(Seongnam, Korea)으로부터 입수하여 사용하였다. Sumizyme LP(from Asp. oryzae)는 ㈜옥전바이오텍(Seoul, Korea), ficin(from fig tree latex), Asp. saitoi protease 및 thermolysin (from Geobacillus stearothermophilus)은 Sigma-Aldrich(St. Louis, MO, USA)에서 구입하여 사용하였으며, 본 실험에서 사용한 protease의 특성(가수분해 type, 반응 최적 pH 및 최적온도)은 Table 1과 같다. Casein(sodium salt from bovine milk), Folin-Ciocalteu 시약, L-BAIBA, L-leucine, tyrosine 및 sodium dodecyl sulfate(SDS)는 Sigma-Aldrich Co. Ltd(St. Louis, MO, USA)에서 구입하여 사용하였고, TNBS (2,4,6-trinitrobenzenesulfonic acid, 5% w/v methanol solution)는 Thermo Scientific Co.(Rockford, IL, USA)에서 구입하여 사용하였다. Amino acid standard mixture(1.0 μM/mL)는 Sykam GmbH(Gewerbering, Eresing, Germany)에서 구입하였고, 기타 일반 시약은 analytical grade를 대한과학(Wonju, Korea)에서 구입하여 사용하였다.
Table 1.
List of proteases used in this study
|
|
Enzyme |
Type |
Activity (U/mg) |
Optimal condition |
|
1 |
Alcalase 2.4 L FG |
Endo |
0.54±0.05 |
pH 6.5-8.5, 55-70°C |
|
2 |
Flavourzyme 1,000 L |
Exo |
0.76±0.09 |
pH 6, 55-60°C |
|
3 |
Neutrase 0.8 L |
Endo |
2.10±0.06 |
pH 8.0, 50°C |
|
4 |
Protamex |
Endo |
3.02±0.31 |
pH 5.5-7.5, 35-65°C |
|
5 |
Papain T100 MG |
Endo |
0.24±0.01 |
pH 5-8, 65°C |
|
6 |
Bromelain BR 1200 |
Endo²exo |
0.30±0.10 |
pH 7.0, 50°C |
|
7 |
Prozyme 2000P |
Exo |
3.60±0.10 |
pH 5-5.5, 55-60°C |
|
8 |
Foodpro alkaline protease |
Endo |
1.09±0.06 |
pH 6.5-9, 55-60°C |
|
9 |
Protease (Asp. saitoi) |
- |
0.09±0.04 |
pH 3.5-5.5, 45°C |
|
10 |
Ficin (fig tree latex) |
Endo |
0.20±0.05 |
pH 6.5, 60°C |
|
11 |
Sumizyme LP |
Endo |
0.69±0.03 |
pH 6.0, 50°C |
Download Excel Table
2.3. 포로테아제 활성 측정
프로테아제 활성은 He 등(2004)과 Joung 등(2018)의 방법을 약간 변형하여 측정하였다. 즉, 증류수를 사용하여 적정한 농도로 희석한 효소액 1 mL와 50 mM Tris-HCl buffer(pH 7.0) 0.9 mL 및 2% casein 용액 1 mL를 혼합하고 50°C에서 10분간 반응시킨 다음 0.4 M trichloroacetic acid 용액 2 mL를 가하여 반응을 종료시켰다. 이어서 반응액은 원심분리(12,000 ×g, 20분)하여 얻어진 상등액 1 mL를 취하여 0.4 M sodium carbonate 용액 5 mL와 1 N Folin-Ciocalteu 시약 1.0 mL를 가한 다음 40°C에서 20분간 반응시킨 후 UV-vis. spectrophotometer (Shimadzu UV-1601, Kyoto, Japan)를 사용하여 660 nm에서 흡광도를 측정하였다. 별도로 tyrosine(0.5-20 μg/mL)을 사용하여 작성한 검량선을 사용하여 프로테아제 활성을 계산하였다. 효소활성의 1 unit(U)는 casein에서 분당 1 μM의 tyrosine을 유리시키는 데 필요한 효소의 양으로 하였다.
2.4. 닭가슴살의 가수분해에 대한 pH의 영향 측정
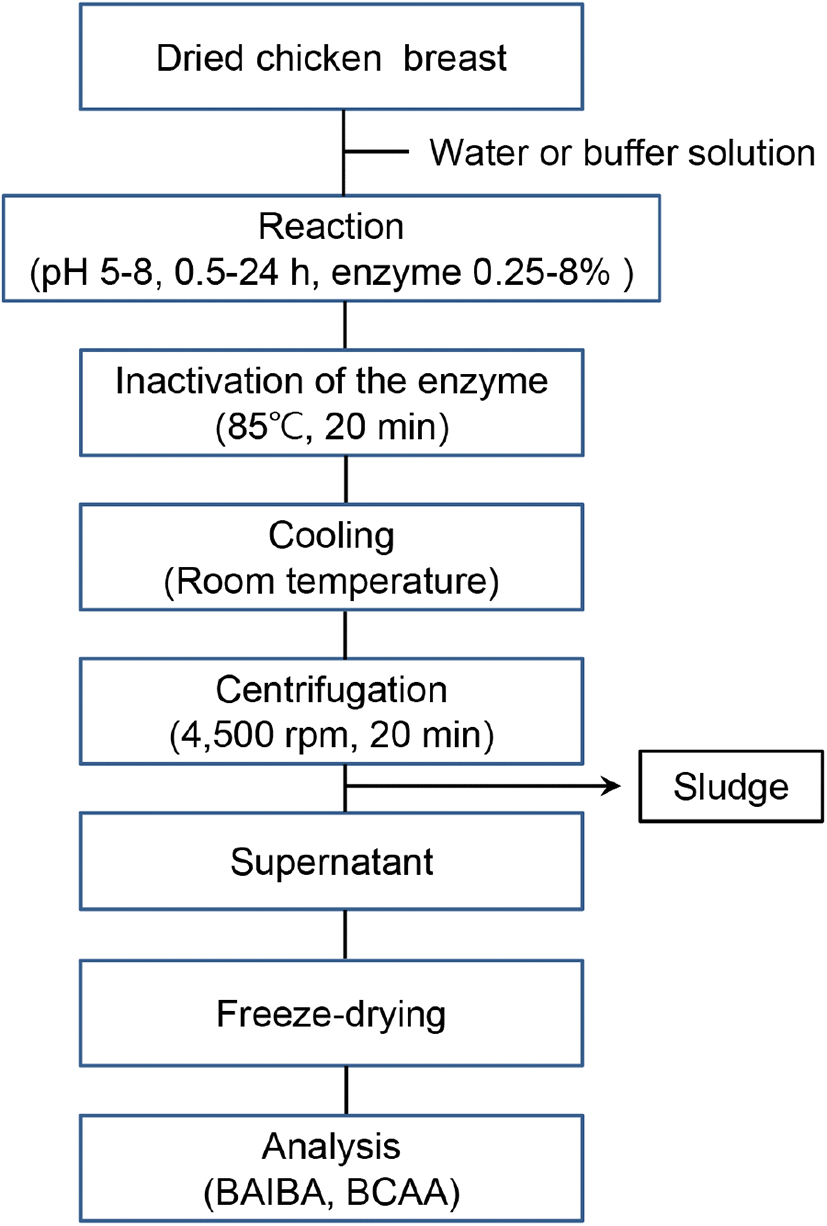
시판의 프로테아제에 의한 건조 닭가슴살의 가수분해에 대한 반응액 pH의 영향은 Fig. 1과 같은 순서로 수행하였으며, 반응액의 pH는 0.1 M sodium acetate 완충용액(pH 5)과 0.1 M sodium phosphate 완충용액(pH 6-8)을 사용하여 조절하였다. 즉, 건조 닭가슴살 1 g에 pH를 달리한 완충용액 8 mL씩을 가하고 예비실험 결과에서 BAIBA 및 BCAA 생성량이 높았던 효소인 alcalase, prozyme 2000P 또는 foodpro alkaline protease를 건조 닭가슴살에 대하여 각각 4%씩 첨가한 다음 50°C의 수욕조에서 진탕하면서 12시간 동안 반응시켰다. 각 반응액은 85°C에서 20분간 가열하여 효소를 불활성화시킨 후 3,400 ×g (gravity)로 10분 동안 원심분리 얻어진 상등액의 일부를 단백질 가수분해도 측정용 시료로 사용하였고, 나머지 시료는 동결건조하였다.
Fig. 1.
Flow diagram for the preparation of protein hydrolysates from chicken breast by commercial proteases.
Download Original Figure
2.5. 닭가슴살의 가수분해에 대한 반응시간 측정
건조 닭가슴살 1 g에 0.1 M sodium phosphate 완충용액(pH 7) 8 mL를 가하여 혼합한 다음 건조 닭가슴살에 대하여 4%가 되도록 alcalase를 첨가하고, 50°C의 수욕조에서 24시간 진탕반응을 시키면서 주기적으로 시료를 채취하였다. 각각의 반응액은 pH의 85°C에서 20분간 가열하여 효소를 불활성화시킨 후 3,400 ×g (gravity)로 10분 동안 원심분리하여 얻어진 상등액은 동결건조하였다.
2.6. 닭가슴살의 가수분해에 대한 효소첨가량 측정
건조 닭가슴살 1 g에 0.1 M sodium phosphate 완충용액(pH 7) 8 mL를 가하여 혼합한 다음 alcalase, prozyme 2000P 또는 foodpro alkaline protease를 건조 닭가슴살에 대하여 각각 0.25-8%씩 첨가하고, 50°C의 수욕조에서 12시간 동안 반응시켰다. 각각의 반응액은 pH의 85°C에서 20분간 가열하여 효소를 불활성화시킨 후 3,400 ×g (gravity)로 10분 동안 원심분리하여 얻어진 상등액은 동결건조하여 실험에 사용하였다.
2.7. 단백질 가수분해도 측정
시료의 가수분해는 건조 닭가슴살 1 g에 0.1 M sodium phosphate 완충용액(pH 7) 8 mL를 가하여 혼합한 다음, 각각의 효소를 건조 닭가슴살에 대하여 4%씩 첨가하고 50°C의 수욕조에서 50°C에서 12시간 진탕 반응시켰다. 또한 2종의 프로테아제를 혼합처리를 하였을 때 단백질 가수분해도에 미치는 영향을 알아보기 위하여, 건조 닭가슴살에 대하여 alcalase(endo-type)와 foodpro alkaline protease (endo-type)를 각각 2% 또는 alcalase(endo-type)와 prozyme 2000P(exo-type)를 각각 2%씩을 첨가한 다음 50°C의 수욕조에서 12시간 진탕 반응시켰다. 각각의 반응액은 pH의 85°C에서 20분간 가열하여 효소를 불활성화시킨 후, 원심분리(4,500 rpm, 10분)하여 얻어진 상등액을 단백질 가수분해도 측정용 시료로 사용하였다. TNBS법에 의한 단백질 가수분해도(degree of hydrolysis, DH %)는 Adler-Nissen(1979)의 방법에 따라 측정하였다. 즉, 효소 가수분해 후 얻어진 원심분리 상등액 1 mL를 1% SDS를 함유하는 증류수로 200배 희석한 용액 0.25 mL에 0.2 M sodium phosphate buffer(pH 8.2) 2.0 mL 및 0.1% TNBS 용액 2.0 mL를 가하고 50°C에서 1시간 동안 반응시켰다. 이어서 반응액에 0.1 M HCl 용액 4.0 mL를 가하고 상온에서 30분간 유지한 다음 UV-Vis spectrophotometer를 사용하여 340 nm에서 흡광도를 측정하였으며, 1% SDS를 함유하는 증류수로를 대조구로 하였다. TNBS법에 의한 단백질 가수분해도는 SDS를 1%의 농도로 첨가한 증류수에 용해시킨 L-leucine을 사용하여 작성한 검량선을 이용하여 계산하였다(Adler-Nissen, 1979; Spellman 등, 2003).
Formol법에 의한 가수분해도 측정을 위하여 아미노태 질소(α-amino nitrogen) 함량은 닭가슴살을 효소 가수분해한 다음 3,400 ×g (gravity)로 10분 동안 원심분리 하여 얻어진 상등액을 증류수로 200배 희석한 다음, 그중 2 mL를 취하여 Sorensen법(AOAC, 1995)에 따라 35% formaldehyde 용액으로 적정하였고, 건조 닭가슴살 중의 총질소 함량은 animal food analyzer(Kjeltec 8400, FOSS, Hillerod, Denmark)로 정량한 다음 아래와 같은 식에 따라 가수분해를 계산하였다.
2.8. 아미노산 분석
닭가슴살 중의 총아미노산은 분말시료 0.5 g에 6 N HCl 용액 10 mL를 가하고 질소가스로 치환한 다음 110°C에서 24시간 분해하였다. 분해액은 감압농축한 다음 농축액에 증류수를 10 mL씩을 가하여 다시 감압농축하는 과정을 2회 반복하여 HCl을 완전히 제거하였다. 농축액은 sample dilution buffer(pH 2.2)로 희석한 다음 membrane filter(0.45 μm)로 여과한 후 아미노산 분석기로 분석하였다. 프로테아제에 의한 가수분해물을 원심분리하여 얻어진 상등액의 동결건조 분말은 시료 0.2 g을 sample dilution buffer 25 mL에 용해시킨 다음 분석에 사용하였으며, 가수분해물 중의 BAIBA 및 BCAA 분석결과는 mg/g(dry weight base)으로 표시하였다. 또한 프로테아제에 의한 가수분해물에서 분석된 총유리아미노산(total amount of free amino acid, TFAA) 중에서 BAIBA 또는 BCAA가 차지하는 비율을 백분율(%)로 표시하였다.
아미노산 분석기는 Sykam GmbH사(Gewerbering, Eresing, Germany)의 S7130 amino acid reagent organizer, S5200 sample injector와 S2100 solvent delivery system을 사용하였으며, column은 cation separation column LCA K06/NA(4.6 mm×250 mm)를 사용하였다. 이동상의 유속은 0.45 mL/min, ninhydrin은 0.4 mL/min으로 하였으며, 각 성분의 함량은 Sykam사에 제공하는 유리 아미노산(45개 성분) 표준용액을 분석한 다음 아미노산 분석기에 내장된 프로그램을 이용하여 정량하였다.
2.9. 통계분석
각 실험은 3회 반복하여 얻은 결과를 평균±표준편차로 나타내었다. 또한, 실험값에 대한 통계분석에는 Statistical Package for the Social Sciences SPSS, IBM 20, NYC, USA) 프로그램을 이용하였고, one-way analysis of variance(ANOVA)로 분석한 후 Duncan’s multiple range test 방법을 이용하여 평균값 간에 유의수준 p⟨0.05에서 유의성을 검정하였다.
3. 결과 및 고찰
3.1. 단백질 가수분해도
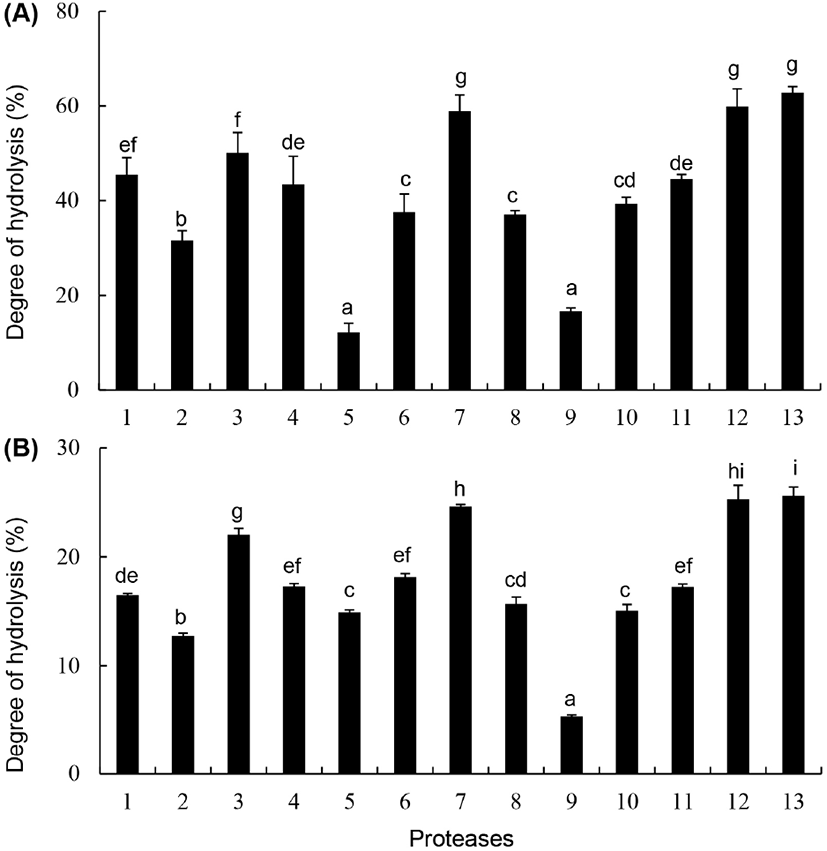
효소에 의한 단백질의 가수분해도 측정방법으로는 pH-stat법, TNBS법, formol 적정법, o-phthaldialdehyde (OPA)법, trichloroacetic acid-soluble nitrogen(SN-TCA)법, osmometric법 등 다양한 방법들이 사용된다. 가수분해도는 측정에 사용되는 반응시약이 단백질의 가수분해에 의해 생성된 유리아미노산 및 펩타이드에 반응하는 기전이나 감도가 달라 단일방법으로 전반적인 가수분해도를 나타낼 수는 없는 것으로 알려져 있다(Rutherfurd, 2010; Spellman 등, 2003). 따라서 단백질 가수분해도를 측정에 있어서는 2-3가지 방법을 함께 적용하여 측정하는 것이 바람직하며, 그중에서도 pH-stat법, TNBS법, OPA법, formol법이 가장 널리 이용되는 방법들이다(Rutherfurd, 2010; Spellman 등, 2003). 본 실험에서는 11종의 프로테아제를 건조 닭가슴살에 대하여 각각 4%씩 첨가 후 50°C에서 12시간 반응시킨 다음 TNBS법과 formol법으로 가수분해도를 측정한 결과는 Fig. 2와 같다. TNBS법에 의한 가수분해도 측정결과, prozyme 2000P(58.90±3.42%), flavourzyme(50.08±4.28%), alcalase(45.48±3.60%) 및 sumizyme LP(44.55±0.97%)로 가수분해하였을 때 가수분해도가 높았으며, formol법에 의한 측정결과에서도 역시 prozyme 2000P(24.62±0.20%), flavourzyme(22.04± 0.57%) 및 alcalase(16.50±0.14%)에 의한 가수분해물에서 높았다. 이와 같이 사용한 효소에 따라 닭가슴살에 함유된 단백질에 대한 가수분해도가 다른 이유는, 효소별 단위무게당 활성(specific acivity), 효소별 기질 특이성(substrate specificity), 펩타이드 결합에 의해 연결된 아미노산 사슬에 대한 작용방식의 차이에 기인한다고 할 수 있다(Tavano, 2013).
Fig. 2.
Comparison of degree of hydrolysis of chicken breast by proteases.
A, TNBS method; B, formol method; 1, alcalase; 2, nutrase; 3, flavourzyme; 4, protamex; 5, papain; 6, bromelain; 7, prozyme 2000P; 8, foodpro alkaline protease; 9, Asp. saitoi protease; 10, ficin; 11, sumizyme LP; 12, mixture alcalase (2%)²foodpro alkaline protease (2%); 13, mixture of alcalase (2%)²prozyme 2000P (2%). Values are means±standard deviation (SD) (n=3). Different superscripts in the same row indicate significant differences (p⟨0.05).
Download Original Figure
측정방법별로 비교하였을 때에는 TNBS법에 의한 가수분해도 측정결과가 formol법에 의한 측정결과보다 전반적으로 높게 나타났다. 프로테아제에 의한 단백질의 가수분해도는 가수분해에 사용된 효소의 종류, 반응온도, 반응액의 pH, 반응시간, 사용된 기질, 기질과 효소의 비율 및 측정방법에 따라 달라진다(Beaubier 등, 2019; Nielsen 등, 2001; Spellman 등, 2003). 예로서 Rutherfurd(2010)는 hemoglobin을 esperase와 flavourzyme을 연속적으로 처리한 후 pH-stat법, SN-TCA법, formol법으로 가수분해도를 측정하여 비교한 결과, formol법에 의한 측정값이 가장 낮았고, SN-TCA법에 의한 측정값은 formol법에 의한 측정값보다 2배 이상 높게 나타났다고 보고하였다. 또한, Kurozawa 등(2009)은 닭가슴살을 pH 8.0의 완충용액에 현탁시킨 다음, alcalase를 4.2% 첨가하고 반응시킨 다음 pH-stat법으로 가수분해도를 측정하였을 때 최적조건에서의 가수분해도는 약 30%였다고 보고하였다. Fallah-Delavar와 Farmani(2018)는 5종의 프로테아제로 닭 껍질을 pH 7-8.5, 온도 50°C에서 2시간 가수분해한 다음 가수분해도를 비교하였을 때, alcalase 처리구는 49.19%, protamex 31.65%, nutrase 25.05%, 그리고 flavourzyme 처리구는 8.92%였다고 보고하였고, Jung(2019)은 중-초고압 조건에서 닭가슴살을 alcalase와 flavourzyme으로 12시간 동안 가수분해하였을 때, 가수분해도는 alcalase 처리구에서는 효소 첨가량에 따라 50-52%, flavourzyme 처리구에서는 46-48% 범위이었다고 보고하였다. 반면에 Nchienzia 등(2010)은 닭고기를 alcalase, flavourzyme 및 protamex로 가수분해(pH 7.0, 50°C, 6시간, 효소첨가량 1-3%)하였을 때 가수분해도는 10-11% 수준이었다고 보고하였다.
또한, 효소의 혼합처리효과를 알아보기 위하여, alcalase (endo-type)와 foodpro alkaline protease(endo-type)를 각각 2% 또는 alcalase와 prozyme 2000P(exo-type)를 각각 2%씩 혼합처리하여 얻어진 시료의 가수분해도 측정결과, alcalase와 foodpro alkaline protease의 혼합처리구는 2종의 효소를 단독으로 처리하였을 때보다 가수분해도가 뚜렷하게 증가하였으나, alcalase와 prozyme 2000P의 혼합처리구는 prozyme 2000P의 단독처리구에 비해 가수분해도가 거의 증가하지 않았다.
3.2. 가수분해물의 아미노산 조성
본 실험에서 프로테아제에 의한 닭가슴살 가수분해물에서는 22종의 아미노산이 검출되었다. 이 중에서 가수분해도가 낮았던 Asp. saitoi 프로테아제에 의한 가수분해물을 제외하고, 나머지 프로테아제에 의한 가수분해물 중의 아미노산 조성을 분석한 결과는 Table 2와 같다. 효소 가수분해에 의해서 생성된 총유리아미노산 함량은 사용한 프로테아제에 따라 많은 차이를 보였는데 prozyme 2000P (492.71±35.03 mg/g), flavourzyme(379.84±27.44 mg/g), sumizyme LP(307.36±23.81 mg/g)에 의한 가수분해물에서 높았고, nutrase(121.07±11.42 mg/g), protamex(164.32±19.24 mg/g), papain(172.48±17.41 mg/g) 및 ficin(187.68±19.57 mg/g)에 의한 가수분해물에서 낮았다. 개별 아미노산의 함량도 처리한 프로테아제의 종류에 따라 차이가 있었는데, 모든 처리구에서 대체적으로 glutamic acid, leucine 및 lysine의 함량이 높은 편이었다. 개별 아미노산의 함량을 보면 alcalase 처리구에서는 BAIBA(26.24±1.01 mg/g), glutamic acid(25.76±2.27 mg/g), leucine(23.84±1.43 mg/g), β-alanine(23.04± 0.89 mg/g), flavourzyme 처리구에서는 glutamic acid (42.88±2.34 mg/g), leucine(40.32±2.32 mg/g), lysine (35.84±0.89 mg/g) 및 arginine(30.08±1.14 mg/g)의 함량이 높았다. 또한, prozyme 2000P 효소 처리구에서는 leucine(52.80±1.58 mg/g), glutamic acid(50.72±3.22 mg/g), lysine(42.88±1.23 mg/g), arginine(39.5±3.14 mg/g) 및 BAIBA(38.72±3.01 mg/g)의 함량이 높았고, 식물성 프로테아제인 bromelain, papain 및 ficin에 의한 가수분해물은, 미생물에서 유래하는 프로테아제에 비해 닭가슴살 단백질의 가수분해도도 낮고, 유리된 총유리아미노산의 함량도 낮은 편이었다. 이와 같이 사용한 효소에 따라 닭가슴살 가수분해물의 아미노산 조성이 다른 것은 단백질에 대한 효소별 기질 특이성(substrate specificity), 펩타이드 결합에 의해서 연결된 사슬에 대한 각 효소의 작용방식의 차이에 기인한다고 할 수 있다(Tavano, 2013).
Table 2.
Free amino acid composition in chicken breast hydrolysates by commercial proteases
1, alcalase 2.4 L; 2, nutrase 0.8 L; 3, flavourzyme 1,000 L; 4, protamex; 5, papain T100 MG; 6, bromelain BR 1200; 7, prozyme 2000P; 8, foodpro alkaline protease; 9, ficin; 10, sumizyme LP. BAIBA, Β-aminoiso butyric acid; GABA, γ-aminobutyric acid.
Values are expressed as mg/g (dry weight base) and means±SD (n=3). Different superscripts in the same row indicate significant differences (p⟨0.05).
|
Amino acid |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Aspartic acid |
8.80±1.30bc
|
3.52±0.64a
|
17.12±2.08e
|
5.76±1.07ab
|
9.60±1.19c
|
11.52±1.76cd
|
19.68±3.16e
|
9.12±1.84c
|
8.48±1.33bc
|
12.96±1.78d
|
|
Threonine |
5.12±0.78a
|
4.48±0.74a
|
18.72±1.84d
|
4.96±0.88a
|
5.60±0.62ab
|
8.16±2.26b
|
24.80±2.52e
|
5.12±0.95a
|
6.24±1.11ab
|
11.36±2.04c
|
|
Serine |
5.28±0.80ab
|
4.16±0.60a
|
14.4±1.73d
|
4.80±1.57ab
|
5.6±1.23ab
|
7.04±1.03b
|
14.88±1.51d
|
5.28±0.65ab
|
6.88±0.84b
|
9.12±1.21c
|
|
Asparagine |
3.52±0.50bc
|
1.28±0.36a
|
18.72±2.29f
|
2.56±0.47ab
|
2 24±0.66ab
|
4.00±0.56d
|
17.28±1.46e
|
2.40±0.56ab
|
3.20±0.68bc
|
8.96±1.11d
|
|
Glutamic acid |
25.76±2.27cd
|
10.40±1.60a
|
42.88±2.34f
|
17.92±2.46b
|
26.24±1.91cd
|
25.92±1.98cd
|
50.72±3.22g
|
28.48±2.10d
|
23.20±2.29c
|
32.48±2.12e
|
|
Proline |
3.84±0.46a
|
3.20±0.42a
|
6.56±0.95c
|
4.00±0.48a
|
3.20±0.49a
|
2.88±0.42a
|
8.88±1.05d
|
3.84±0.73a
|
3.04±0.42a
|
5.12±0.69b
|
|
Glycine |
1.76±0.41a
|
1.92±0.34ab
|
5.76±0.73d
|
1.76±0.45a
|
3.20±0.37c
|
3.84±0.95c
|
5.76±0.57d
|
1.76±0.57a
|
3.52±0.61c
|
2.88±0.41bc
|
|
Alanine |
10.08±0.46ab
|
8.64±0.31a
|
21.76±1.07e
|
8.80±0.50a
|
11.2±1.23b
|
15.2±0.77cd
|
23.2±1.54e
|
10.56±1.01b
|
13.92±1.04c
|
16.00±1.10d
|
|
Valine |
5.92±0.99a
|
7.2±0.52ab
|
22.56±1.48d
|
6.88±0.93ab
|
6.88±0.61ab
|
8.16±0.34b
|
28.8±1.29e
|
6.40±0.63a
|
7.52±0.59ab
|
13.28±0.82c
|
|
Cystine |
-1)
|
- |
3.04±0.32b
|
- |
- |
- |
3.20±0.28b
|
1.12±0.14a
|
1.12±0.21a
|
1.44±0.24a
|
|
Methionine |
8.48±0.69ab
|
7.2±0.43a
|
13.44±0.63d
|
8.8±0.53b
|
8.48±0.58ab
|
11.84±1.06c
|
17.44±0.75e
|
8.80±0.43b
|
9.60±1.11b
|
11.52±0.95c
|
|
Isoleucine |
5.12±0.46a
|
8.64±0.55c
|
18.24±1.33e
|
8.00±0.91c
|
6.4±0.62ab
|
7.52±0.93bc
|
27.36±1.22f
|
5.44±0.50a
|
7.36±0.75bc
|
13.28±0.78d
|
|
Leucine |
23.84±1.43a
|
24.32±0.80a
|
40.32±2.32d
|
29.28±2.30b
|
22.72±2.18a
|
28.48±2.00b
|
52.80±1.58e
|
24.00±1.09a
|
24.16±1.04a
|
36.32±0.89c
|
|
Tyrosine |
7.84±0.93bc
|
5.76±0.47a
|
15.52±1.11e
|
7.36±0.66ab
|
7.36±0.65ab
|
9.28±0.92c
|
20.32±1.47f
|
7.84±0.62bc
|
8.00±0.87bc
|
12.8±1.45d
|
|
Phenylalanine |
9.60±0.81ab
|
8.96±1.37a
|
17.60±0.68c
|
11.04±0.99b
|
8.64±0.95a
|
11.20±0.83b
|
25.28±1.59d
|
9.92±0.79ab
|
10.08±1.08ab
|
16.32±0.73c
|
|
β-Alanine |
23.04±0.89e
|
- |
- |
6.88±0.28b
|
- |
- |
10.88±1.20c
|
16.96±1.26d
|
3.36±0.51a
|
12.16±1.01c
|
|
BAIBA |
26.24±1.01C
|
5.12±0.62a
|
24.64±1.06c
|
12.64±0.96b
|
6.72±0.67a
|
6.72±0.56a
|
38.72±3.01e
|
30.24±25.4d
|
7.84±1.19a
|
25.76±1.76c
|
|
GABA |
3.68±0.42 |
- |
- |
- |
- |
4.48±0.52 |
- |
- |
- |
- |
|
Histidine |
2.24±0.28ab
|
1.60±0.43a
|
10.56±1.00d
|
1.76±0.30a
|
2.72±0.49b
|
3.04±0.39b
|
13.12±0.69e
|
2.08±0.27ab
|
2.88±0.41b
|
6.72±0.40c
|
|
Carnosine |
4.64±0.74cd
|
0.80±0.12a
|
2.08±0.18b
|
5.44±0.57d
|
4.8±0.54cd
|
2.40±0.41b
|
7.20±0.54e
|
4.00±0.23c
|
6.40±0.63e
|
4.48±0.69c
|
|
Lysine |
10.72±0.78b
|
7.04±0.65a
|
35.84±0.89e
|
8.16±0.55ab
|
16.32±0.61c
|
18.24±0.70c
|
42.88±1.23f
|
10.56±0.66b
|
16.48±0.60c
|
30.72±1.03d
|
|
Arginine |
10.08±1.56b
|
6.72±0.47a
|
30.08±1.14e
|
7.52±1.44ab
|
14.56±1.33c
|
15.36±1.44c
|
39.52±3.14f
|
8.16±1.52ab
|
14.40±1.28c
|
23.68±1.62d
|
|
Total |
205.6±18.96 |
121.07±11.42 |
379.84±27.44 |
164.32±19.24 |
172.48±17.41 |
205.29±20.34 |
492.71±35.03 |
202.09±19.07 |
187.68±19.57 |
307.36±23.81 |
Download Excel Table
Kurozawa 등(2009)은 alcalase에 의한 닭가슴살 가수분해물에서, 양적으로 많이 검출된 아미노산은 glutamic acid(14.80 g/100 g), tryptophan(9.01 g/100 g), lysine(8.79 g/100 g), aspartic acid(8.71 g/100 g) 및 leucine(7.91 g/100 g)이라고 보고한 바 있다. 또한, 육계와 산란계의 닭가슴살을 alcalase와 flavourzyme을 혼합처리한 가수분해물에서는 aspartic acid의 함량이 가장 높았고, 그다음으로 leucine, glutamic acid, BAIBA 및 arginine의 함량이 높은 것으로 보고되었다(Jo 등, 2021). 프로테아제에 의한 닭가슴살의 가수분해물의 아미노산 조성에서 본 실험과 문헌 보고된 결과와 다소 차이를 보이는 것은, 가수분해에 사용된 효소의 종류와 첨가량, 반응액의 pH, 반응온도와 시간 등의 차이에 기인할 것으로 판단된다.
3.3. 가수분해물 중 BAIBA 및 BCAA 함량 비교
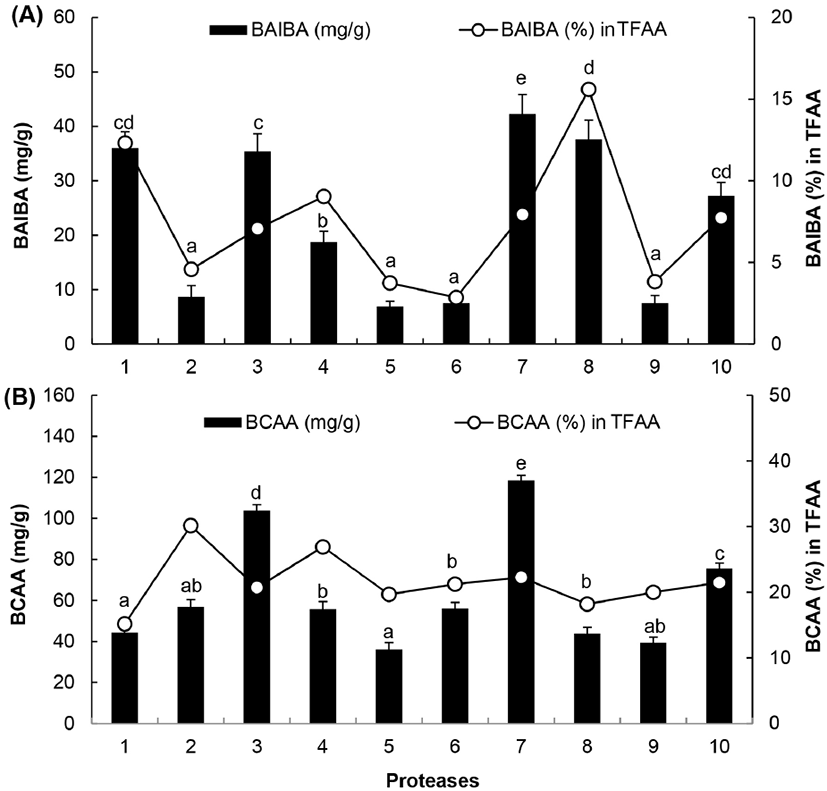
BAIBA는 인체 내에서 섭취된 단백질이 대사되는 과정에서 thymine으로부터 D-BAIBA, valine으로부터는 L-BAIBA가 생성되는 것으로 보고되어 있다(Begriche 등, 2010; Roberts 등, 2014; Tanianskii 등, 2019). BAIBA는 근육량을 증가시키고, 글리코겐 절약작용, 단백질 합성과 분해속도 조절작용, 운동에 의한 피로 감소, 유산소 운동을 개선하는 효과가 있는 것으로 밝혀져 있다(Begriche 등, 2010; Liu 등, 2021; Roberts 등, 2014). 닭가슴살을 가수분해도가 낮았던 Asp. saitoi 프로테아제를 제외한 10종의 프로테아제로 가수분해한 다음, 원심분리하여 얻어진 상등액의 동결건조 분말에서 BAIBA의 함량을 분석 비교한 결과는 Fig. 3(A)와 같다. Prozyme 2000P에 의한 닭가슴살의 가수분해물에서 BAIBA의 함량은 38.72±3.01 mg/g으로 본 실험에서 사용한 10종의 프로테아제 중에서 가장 높았고, 그다음은 foodpro alkaline protease(30.24±2.54 mg/g), alcalase (26.24±1.01 mg/g) 및 sumizyme AP(25.76±1.76 mg/g)에 의한 가수분해물에서 많이 검출되어 가수분해에 사용된 프로테아제의 종류에 따라 BAIBA 생성량에 많은 차이가 있음을 알 수 있다. 또한, 닭가슴살 가수분해물에서 검출된 총유리아미노산 중에서 BAIBA가 차지하는 비율을 백분율(%)로 환산하였을 때에는 foodpro alkaline protease (14.96%)와 alcalase(12.76%)에 의한 가수분해물에서 높았다. Jo 등(2021)은 alcalase와 flavourzyme에 의한 육계 가슴살의 가수분해물에서 BAIBA 함량은 0.98±0.9%, 산란계에서는 1.10±0.22%로서 aspartic acid, glutamic acid 및 leucine 다음으로 많이 함유되어 있었다고 보고하였다.
Fig. 3.
Comparison of BAIBA (A) and BCAA (B) content in chicken breast hydrolysates by proteases.
1, alcalase; 2, nutrase; 3, flavourzyme; 4, protamex; 5, papain; 6, bromelain; 7, prozyme 2000P; 8, foodpro alkaline protease; 9, ficin; 10, sumizyme LP; TFAA, total amount of free amino acid in hydrolysate. Values are means±SD (n=3). Different superscripts in the same row indicate significant differences (p⟨0.05).
Download Original Figure
한편, 본 실험에서 프로테아제에 의한 닭가슴살 분수분해물에서 BCAA의 함량을 분석하여 비교한 결과는 Fig. 3(B)와 같다. BCAA의 함량은 prozyme 2000P의 가수분해물에서 가장 높았고, 다음으로 flavourzyme과 sumizyme LP에 의한 가수분해물에서 높은 편이었다. 각 가수분해물에서 검출된 총유리아미노산 중에서, BCAA가 차지하는 비율은 nutrase에 의한 가수분해물에서 약 31%로서 가장 높았고 기타 프로테아제에 의한 가수분해물에서는 20% 수준이었다. Jo(2021)는 육계와 산란계의 닭가슴살을 alcalase와 flavourzyme을 혼합처리하여 얻어진 가수분해물에 함유된 총유리아미노산 중에서 BCAA가 차지하는 비율은 각각 15.3% 및 16.8%로 보고한 바 있으며, Sun 등(2012)은 papain에 의한 닭가슴살 가수분해물 중의 BCAA 함량은 54.2 mg/g이라고 보고하였다. 또한, 옥수수 단백질인 글루텐을 alcalase와 flavourzyme으로 혼합처리하여 얻어진 가수분해물에 함유된 총유리아미노산에서 BCAA가 차지하는 비율은 약 25.1% 정도인 것으로 보고되어 있다(Chung 등, 2010). Kurozawa 등(2008)은 닭가슴살을 alcalase에 의해 가수분해하여 생성된 아미노산을 phenylisothiocyanate(PITC)로 유도체화하여 분석하는 Pico-Tag method로 분석하였을 때, BCAA 함량은 173.7 mg/g으로 보고하여 본 실험에서 분석결과보다 높았는데, 이러한 차이는 분석방법의 차이로 인한 것으로 판단된다. 따라서 시판되는 프로테아제로 닭가슴살을 가수분해하여 BAIBA와 BCAA의 함량이 높은 가수분해물을 얻기 위해서는 prozyme 2000P, foodpro alkaline protease, alcalase 또는 flavourzyme으로 가수분해하는 것이 바람직할 것으로 판단된다.
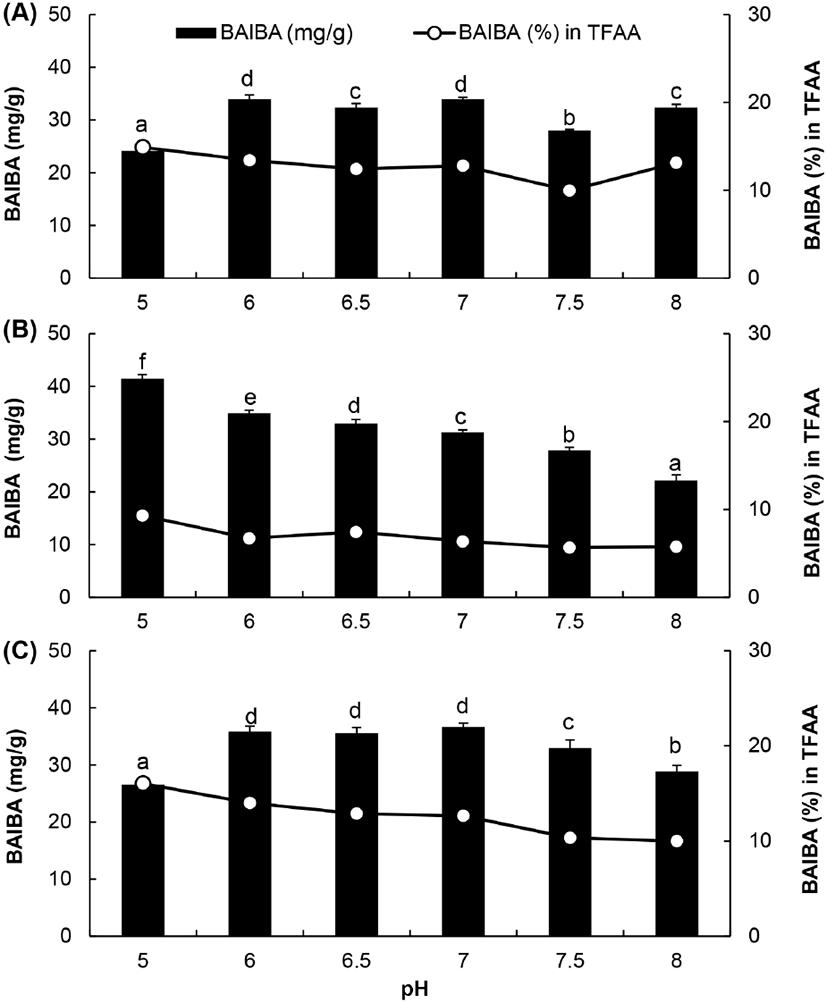
3.4. BAIBA 및 BCAA 생성에 대한 pH의 영향
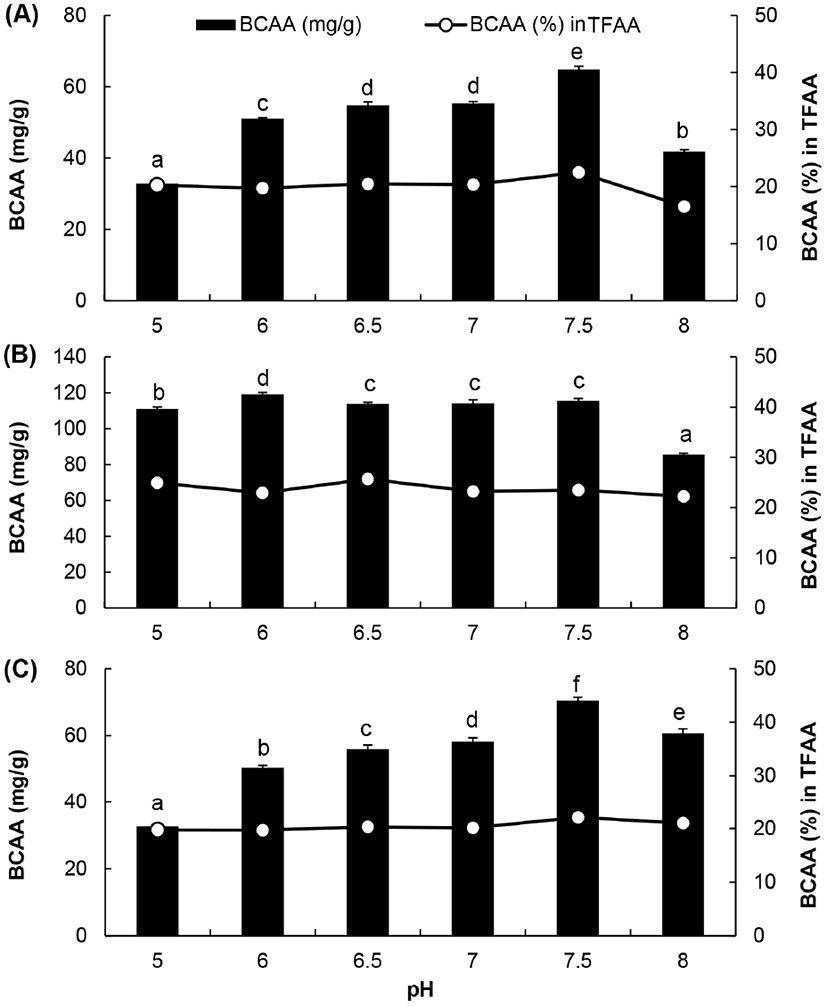
본 실험에서 특히 BAIBA의 생성량이 높았던 효소를 중심으로 대표적으로 3종의 효소(alcalase, prozyme 2000P, foodpro alkaline protease)를 선정하여 반응액의 pH가 BAIBA의 생성량에 미치는 영향을 조사한 결과는 Fig. 4와 같다. Alcalase에 의한 가수분해물의 경우, pH 6-8 범위에서 BAIBA의 생성량은 32.3±1.21-33.9±1.09 mg/g으로서 특히 pH 6-7 사이에서 높았다. 반면에 prozyme 2000P에 의한 가수분해물의 경우 반응액 pH 5 부근에서 BAIBA 생성량이 가장 높았고, pH가 증가할수록 생성량이 유의적으로 감소하는 경향을 보였다. Foodpro alkaline protease의 경우, BAIBA의 생성량은 pH 6-7 사이에서 높았으며, 이러한 결과는 각 효소별 단백질 가수분해를 위한 최적 pH 범위와 관련이 있을 것으로 판단된다. 한편, 3종의 프로테아제에 의한 가수분해물에서 BCAA의 함량을 비교하였을 때 alcalase와 foodpro alkaline protease의 경우 pH 7.5 부근의 용액에서 가수분해하였을 때 가장 많이 생성되었으며, 이때 가수분해물 중의 BCAA의 함량은 alcalase에 의한 가수분해물에서 64.8±0.74 mg/g, foodpro alkaline protease에 의한 가수분해물에서는 70.4±0.85 mg/g이었다. Prozyme 2000P에 의한 가수분해물에서 BCAA의 함량은 pH 5-6 사이에서 유의적으로 높았고, 그중에서도 특히 pH 6에서 가수분해하였을 때 119.0±0.92 mg/g으로서 가장 높았다(Fig. 5).
Fig. 4.
Effect of pH on BAIBA content in chicken breast hydrolysates by three proteases.
A, alcalase; B, prozyme 2000P; C, foodpro alkaline protease; TFAA, total amount of free amino acid in hydrolysate. The pH of the reaction solution was adjusted using 0.1 M sodium acetate buffer (pH 5) and sodium phosphate buffer (pH 6-8). Values are means±SD (n=3). Different superscripts in the same row indicate significant differences (p⟨0.05).
Download Original Figure
Fig. 5.
Effect of pH on BCAA content in chicken breast hydrolysates by three proteases.
A, alcalase; B, prozyme 2000P; C, foodpro alkaline protease; TFAA, total amount of free amino acid in hydrolysate. The pH of the reaction solution was adjusted using 0.1 M sodium acetate buffer (pH 5) and sodium phosphate buffer (pH 6-8). Values are means±SD (n=3). Different superscripts in the same row indicate significant differences (p⟨0.05).
Download Original Figure
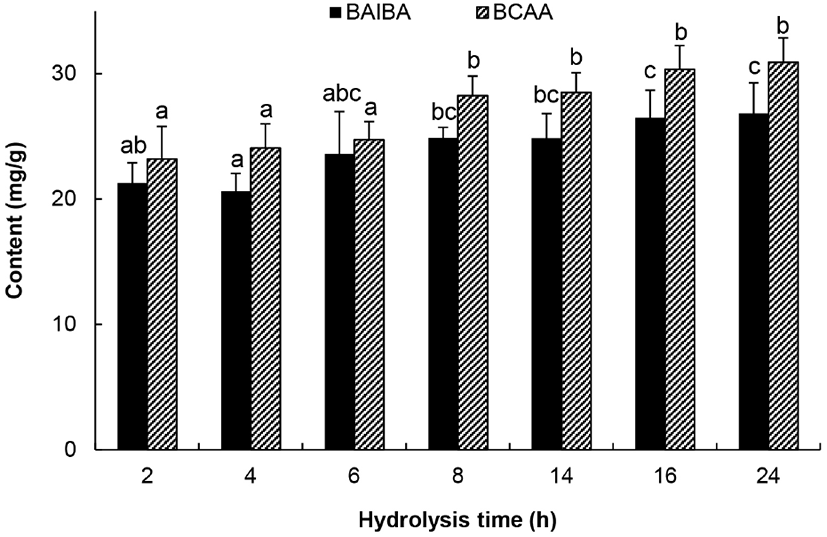
3.5. 반응시간의 영향
예비실험결과에서 alcalase, prozyme 2000P 및 foodpro alkaline protease를 사용하여 반응시간의 영향을 조사하였을 때 반응시간이 연장됨에 따라 BAIBA와 BCAA도 그에 비례하여 증가하는 경향을 보였다. 따라서 대표적으로 alcalase를 사용하여 24시간 동안 반응시키면서 BAIBA 및 BCAA의 생성량을 분석한 결과는 Fig. 6과 같다. BAIBA와 BCAA의 생성량은 반응시작 후 2시간 이내에 급격히 증가한 다음 그 이후 8시간까지는 완만하지만 지속적으로 증가하였고, 8시간 이후 16시간에 도달해도 별 차이가 없었다. 이러한 결과를 바탕으로 판단할 때 프로테아제에 의한 닭가슴살에 함유된 단백질의 가수분해는, 반응 초기단계인 2시간 이내에 급속하게 일어나기 때문에 BAIBA와 BCAA도 반응 초기단계에 급격히 생성될 것으로 판단된다.
Fig. 6.
Effect of hydrolysis time on BAIBA and BCAA content in chicken breast hydrolysates by alcalase.
Values are means±SD (n=3). Different superscripts in the same row indicate significant differences (p⟨0.05).
Download Original Figure
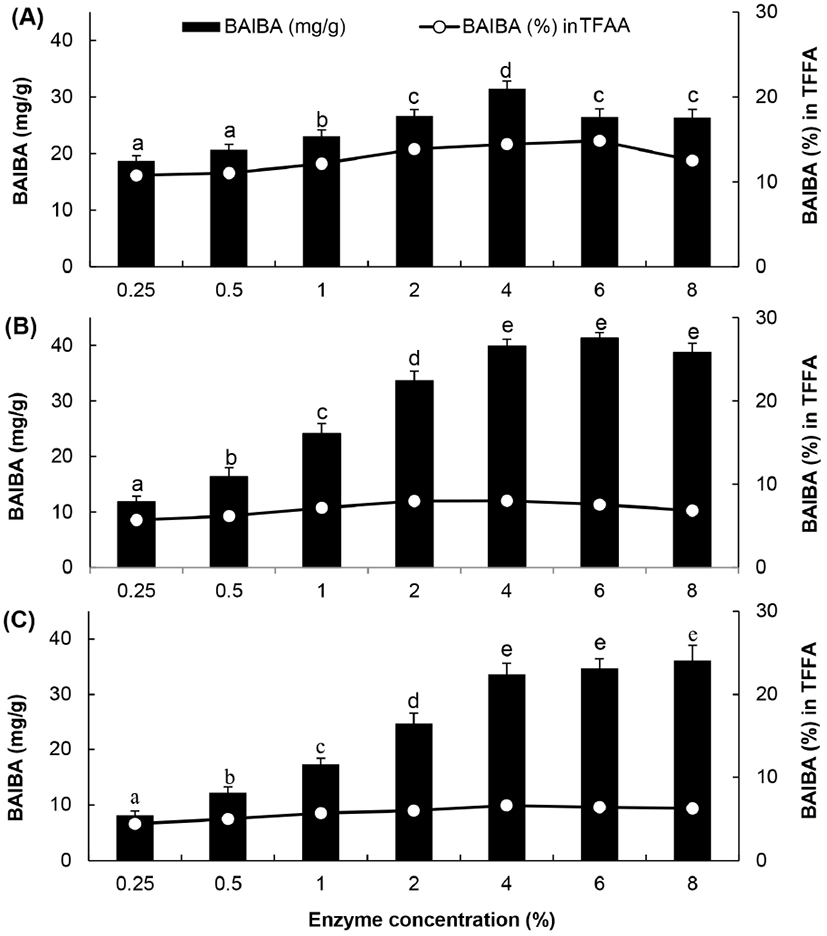
3.6. 효소 첨가량의 영향
프로테아제에 의한 단백질의 가수분해나 가수분해물의 조성은 반응 pH, 반응시간 이외에 효소 첨가량에 따라 많은 영향을 받는다(Kurozawa 등, 2008; Kurozawa 등, 2009; Jung 2019). 프로테아제로서 alcalase, prozyme 2000P 및 foodpro alkaline protease를 닭가슴살에 대해서 0.25–8%를 첨가한 다음, 50°C에서 12시간 반응시켜 얻어진 가수분해물에서 BIABA 함량을 분석한 결과는 Fig. 7과 같다. Alcalase에 의한 가수분해물의 경우 0.25–4%까지는 첨가농도에 비례하여 BAIBA 생성량도 유의적으로 증가하였으나, 그 이후 8%까지 효소첨가량을 증가시켰을 때에는 BAIBA 생성량이 감소하였다. Prozyme 2000P와 foodpro alkaline protease 첨가구에서도 역시 0.25–4%까지는 효소 첨가량과 비례하여 BAIBA 생성량도 유의적으로 증가하였으나, 효소 첨가량을 8%까지 증가시켜도 유의적인 BAIBA 생성량의 증가는 관찰되지 않았다. 이러한 결과는 본 실험에서 사용한 3종의 효소 모두 BAIBA 생성량을 극대화하기 위한 적정 첨가량은 약 4%라는 것을 나타내주는 결과이다. 효소 첨가량 4%를 기준으로 비교하였을 때 alcalase에 의한 가수분해물에서 BAIBA의 생성량 31.44± 1.36 mg/g이었으나 prozyme 2000P와 foodpro alkaline protease에 의한 가수분해물에서는 각각 39.84±1.31 mg/g 및 33.60±2.00 mg/g이었다.
Fig. 7.
Effect of enzyme concentration on BAIBA content in chicken breast hydrolysates by three proteases.
A, alcalase; B, prozyme 2000P; C, foodpro alkaline protease; TFAA, total amount of free amino acid in hydrolysate. Values are means±SD (n=3). Different superscripts in the same row indicate significant differences (p⟨0.05).
Download Original Figure
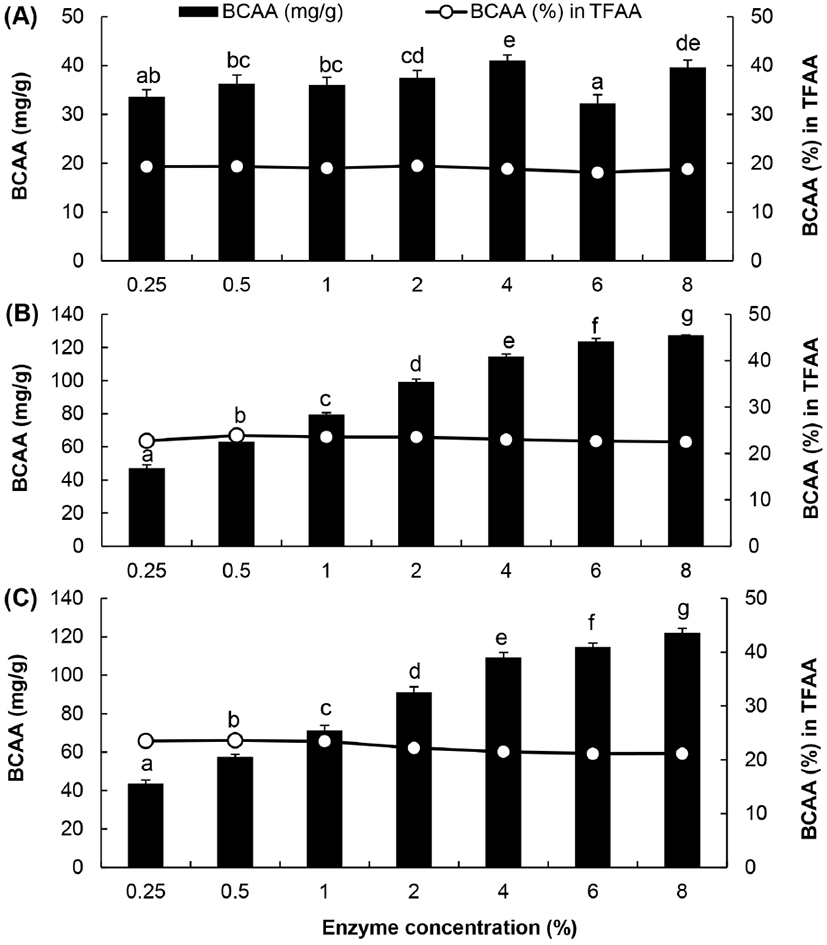
한편, BCAA 생성량의 경우 alcalase에 의한 가수분해물에서는 효소 첨가량이 증가함에 따라 BCAA의 생성량도 비례적으로 증가하여, 효소 첨가량이 4%였을 때 최대값에 도달하였다(Fig. 8). 또한, prozyme 2000P와 foodpro alkaline protease의 경우도 0.25-4%까지는 효소 첨가량에 비례하여 BCAA 생성량도 유의적으로 증가하였으며, 효소 첨가량을 4% 이상으로 증대시켰을 때 BCAA 생성량은 그 이상 증가하지 않았다. 이러한 결과는 3종의 프로테아제를 이용하여 BAIBA와 BCAA 함량이 증대된 닭가슴살의 가수분해물을 제조하기 위해서는 닭가슴살을 기준으로 효소를 4% 정도 첨가하는 것이 바람직하다는 것을 시사해주는 결과이다.
Fig. 8.
Effect of enzyme concentration on BCAA content in chicken breast hydrolysates by three proteases.
A, alcalase; B, prozyme 2000P; C, foodpro alkaline protease; TFAA, total amount of free amino acid in hydrolysate. Values are means±SD (n=3). Different superscripts in the same row indicate significant differences (p⟨0.05).
Download Original Figure
감사의 글
본 연구는 중소벤처기업부(과제번호 S2861066) 지원에 의한 연구과제의 일부로 이에 감사드립니다.
References
Adler-Nissen J. Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid. J Agric Food Chem, 27, 1256-1262 (1979)

,


Ahhmed AM, Muguruma M. A review of meat protein hydrolysates and hypertension. Meat Sci, 86, 110-118 (2010)

,


AOAC. Official Methods of Analysis, 16th ed, Association of Official Analytical Chemists, Washington DC, USA, p 7 (1995)

Bahadoran Z, Mirmiran P, Kashfi K, Ghasemi A. Endogenous flux of nitric oxide: Citrulline is preferred to arginine. Acta Physiol, 231, e13572 (2021)

,


Barlow JP, Karstoft K, Vigelso A, Gram M, Helge JW, Dela F, Pappan K, ONeil D, Dunn W, Solomon TPJ. Beta-aminoisobutyric acid is released by contracting human skeletal muscle and lowers insulin release from INS-1 832/3 cells by mediating mitochondrial energy metabolism. Metab Open, 7, 100053 (2020)

,

,


Beaubier S, Framboisier X, Ioannou I, Galet O, Kapel R. Simultaneous quantification of the degree of hydrolysis, protein conversion rate and mean molar weight of peptides released in the course of enzymatic proteolysis. J Chromatogr B, 1105, 1-9 (2019)

,


Begriche K, Massart J, Fromenty B. Effects of
β-aminoisobutyric acid on leptin production and lipid homeostasis: Mechanisms and possible relevance for the prevention of obesity. Fundam Clin Pharmacol, 24, 269-282 (2010)

,


Chung YL, Bae IN, Lee HG. Preparation of branched-chain amino acid (BCAA)-enriched hydrolysates from corn gluten. Korean J Food Sci Technol, 42, 39-44 (2010)

Curis E, Crenn P, Cynober L. Citrulline and the gut. Curr Opin Clin Nutr Metab Care, 10, 620-626 (2007)

,


Daliri EBM, Ofosu FK, Chelliah R, Park MH, Kim JH, Oh DH. Development of a soy protein hydrolysate with an antihypertensive effect. Int J Mol Sci, 20, 1496 (2019)

,

,


Diana M, Quilez J, Rafecas M. Gamma-aminobutyric acid as a bioactive compound in foods: A review. J Funct Foods, 10, 407-420 (2014)


Fallah-Delavar M, Farmani J. Recovery and characterization of enzymatic protein hydrolyzates and fat from chicken skin. J Am Oil Chem Soc, 95, 1151-1161 (2018)


He H, Chen X, Li J, Zhang Y, Gao P. Taste improvement of refrigerrated meat treated with cold-adapted protease. Food Chem, 84, 307-311 (2004)


Hu YH, Lin CL, Huang YW, Liu PE, Hwang DF. Dietary amino acid taurine ameliorates liver injury in chronic hepatitis patients. Amino Acids, 35, 469-473 (2008)

,


In YW, Yun HS, Bang E, Lee HJ, Lee MY, Cho HY. Selection of commercial proteolytic enzymes for the preparation of anchovy protein hydrolysates under pressurization. Food Eng Prog, 20, 89-97 (2016)


Jo S, Yim E, Kim YS, Lee C, Shin D. Comparison of the chemical and amino acid compositions of breast meat of broiler and laying hens. Korean J Food Preserv, 28, 297-302 (2021)


Joung JA, Park MN, You JY, Song BJ, Choi JH. Application of food-grade proteolytic enzyme for the hydrolysis of regenerated silk fibroin from
Bombyx mori. J Chem, Article 1285823, 1-9 (2018)


Jung DS. Production of chicken breast meat hydrolysates using enzymatic hydrolysis under medium-high hydrostatic pressure. MS Thesis, Yonsei Univerity, Korea, p 27-37 (2019)

Kim YC, Hong HD, Cho CW, Chung SK. The trends of functional foods in the USA. Food Ind Nutr, 20, 15-17 (2015)

Kitase Y, Vallejo JA, Guthe W, Zhou J, Brotto M, Bonewald LF.
β-Aminoisobutyric acid, L-BAIBA, is a muscle-derived osteocyte survival factor. Cell Rep, 22, 1531-1544 (2018)

,

,


Kong X, Guo M, Hua Y, Cao D, Zhang C. Enzymatic preparation of immunomodulating hydrolysates from soy proteins. Bioresour Technol, 99, 8873-8879 (2008)

,


Korhonen K, Pihlanto A. Bioactive peptides: Production and functionality. Inter Dairy J, 16, 945-960 (2006)


Kurozawa LE, Park KJ, Hubinger MD. Optimization of the enzymatic hydrolysis of chicken meat using response surface methodology. J Food Sci, 73, C405-C410 (2008)

,


Kurozawa LE, Park KJ, Hubinger MD. Production, properties and stability of chicken meat protein hydrolysate powder. In: Handbook of Nutritional Biochemistry: Genomics. Haugen S, Meijer S (Editors), Nova Science Publishers, 1-24 (2009)

Lee SH, Qian JJ, Kim SK. A novel angiotensin I converting enzyme inhibitory peptide from tuna frame protein hydrolysate and its antihypertensive effect in spontaneously hypertensive rats. Food Chem, 118, 96-102 (2010)


Leo FD, Panarese S, Gallerani R, Ceci LR. Angiotensin converting enzyme (ACE) inhibitory peptides: Production and implementation of functional food. Curr Pharm Des, 15, 3622-3643 (2009)

,


Lindberg D, Kristoffersen KA, Bosch HV, Wubshet SG, Bocker U, Rieder A, Fricke E, Afseth NK. Effects of poultry raw material variation and choice of protease on protein hydrolysate quality. Process Biochem, 110, 85-93 (2021)


Liu S, Sun Y, Zhao R, Wang Y, Zhang W, Pang W. Isoleucine increases muscle mass through promoting myogenesis and intramyocellular fat deposition. Food Funct, 12, 144-153 (2021)

,


Manninen AH. Protein hydrolysates in sports nutrition. Nutr Metab, 6, 1-5 (2009)

,

,


Nchienzia HA, Morawicki RO, Gadang VP. Enzymatic hydrolysis of poultry meal with endo- and exopeptidases. Poult Sci, 89, 2273-2280 (2010)

,


Neklyudov AD, Ivankin AN, Berdutina AV. Properties and use of protein hydrolysates (review). Appl Biochem Microbiol, 36, 452-459 (2000)


Ngo DH, Vo TS. An updated review on pharmaceutical properties of gamma-aminobutyric acid. Molecules, 24, 2678 (2019)

,

,


Nielsen PM, Petersen D, Dambmann C. Improved method for determining food protein degree of hydrolysis. J Food Sci, 66, 642-646 (2001)


Nikoo M, Benjakul S, Rahmanifarah K. Hydrolysates from marine sources as cryoprotective substances in seafoods and seafood products. Trends Food Sci Technol, 57, 40-51 (2016)


Pasini E, Giovanni G, Aquilani R, Romano C, Picca A, Calvani R, Dioguardi FS. Protein-amino acid metabolism disarrangements: The hidden enemy of chronic age-related conditions. Nutrients, 10, 391 (2018)

,

,


Rezaharsamto B, Subroto E. A review on bioactive peptides derived from various sources of meat and meat by products. Int J Sci Technol Res, 8, 3151-3156 (2019)

Roberts LD, Bostro P, O’Sullivan JF, Schinze RT, Lewis GD, Dejam A, Lee YK, Palma MJ, Calhoun S, Georgiadi A, Chen MH, Ramachandran VS, Larson MG, Bounchard C, Rankine T, Souza AL, Clish CB, Wang TJ, Estall JL, Soukas AA, Cowan CA, Spiegelman BM, Gerszten RE.
β-Aminoisobutyric acid induces browning of white fat and hepatic
β-oxidation and is inversely correlated with cardiometabolic risk factors. Cell Metab, 19, 96-108 (2014)

,

,


Rutherfurd SM. Methodology for determining degree of hydrolysis of proteins in hydrolysates: A review. J AOAC Int, 93, 1515-1522 (2010)

,


Ryan JT, Ross RP, Bolton D, Fitzgerald GF, Stanton C. Bioactive peptides from muscle sources: Meat and fish. Nutrients, 3, 765-791 (2011)

,

,


Saiga A, Okumura T, Makihara T, Katsuta S, Shimizu T, Yamada R, Nishimura T. Angiotensin I-converting enzyme inhibitory peptides in a hydrolyzed chicken breast muscle extract. J Agric Food Chem, 51, 1741-1745 (2003)

,


Sanchez A, Vazquez A. Bioactive peptides: A review. Food Qual Saf, 1, 29-46 (2017)


Sangsawad P, Roytrakul S, Yongsawatdigul J. Angiotensin converting enzyme (ACE) inhibitory peptides derived from the simulated
in vitro gastrointestinal digestion of cooked chicken breast. J Funct Foods, 29, 77-83 (2017)


Shi CX, Zhao MX, Shu XD, Xiong XQ, Wang JJ, Gao XY, Chen Q, Li YH, Kang YM, Zhu GQ.
β-Aminoisobutyric acid attenuates hepatic endoplasmic reticulum stress and glucose/lipid metabolic disturbance in mice with type 2 diabetes. Sci Rep, 6, 21924 (2016)

,

,


Spellman D, McEvoy E, Ocuinn G, FitzGerald RJ. Proteinase and exopeptidase hydrolysis of whey protein: Comparison of the TNBS, OPA and pH stat methods for quantification of degree of hydrolysis. Inter Dairy J, 13, 447-453 (2003)


Stautemas J, Van Kuilenburg ABP, Stroomer L, Vaz F, Blancquaert L, Lefevere FBD, Everaert I, Derave W. Acute aerobic exercise leads to increased plasma levels of R- and S-
β-aminoisobutyric acid in humans. Front Physiol, 10, 1240 (2019)

,

,


Sun XD. Enzymatic hydrolysis of soy proteins and the hydrolysates utilisation. Inter J Food Sci Technol, 46, 2447-2459 (2011)


Sun Y, Pan D, Guo Y, Li J. Purification of chicken breast protein hydrolysate and analysis of its antioxidant activity. Food Chem Toxicol, 50, 3397-3404 (2012)

,


Tanianskii DA, Jarzebska N, Birkenfeld AL, Osullivan JF, Rodionov RN. Beta-Aminoisobutyric acid as a novel regulator of carbohydrate and lipid metabolism. Nutrients, 11, 524 (2019)

,

,


Tavano OL. Protein hydrolysis using proteases: An important tool for food biotechnology. J Mol Catal B: Enzym, 90, 1-11 (2013)


Terashima M, Baba T, Ikemoto N, Katayama M, Morimoto, Matsumura S. Novel angiotensin-converting enzyme (ACE) inhibitory peptides derived from boneless chicken leg meat. J Agric Food Chem, 58, 7432-7436 (2010)

,


Vercruysse L, Camp JV, Smagghe G. ACE inhibitory peptides derived from enzymatic hydrolysates of animal muscle protein: A review. J Agric Food Chem, 53, 8106-8115 (2005)

,


Vijaykrishnaraj M, Prabhasankar P. Marine protein hydrolysates: Their present and future perspectives in food chemistry-A review. RSC Adv, 5, 34864 (2015)


Wang R, Zhao H, Pan X, Orfila C, Lu W, Ma Y. Preparation of bioactive peptides with antidiabetic, antihypertensive, and antioxidant activities and identification of
α-glucosidase inhibitory peptides from soy protein. Food Sci Nutr, 9, 1848-1856 (2019)

,

,


Wouters AGB, Rombouts I, Fierens E, Brijs K, Delcour JA. Relevance of the functional properties of enzymatic plant protein hydrolysates in food systems. Compr Rev Food Sci Food Saf, 15, 786-800 (2016)

,


Wu G. Amino acids: Metabolism, functions, and nutrition. Amino Acids, 37, 1-17 (2009)

,


Wu G. Functional amino acids in growth, reproduction, and health. Adv Nutr, 1, 31-37 (2010)

,

,


Wu G. Functional amino acids in nutrition and health. Amino Acids, 45, 407-411 (2013)

,


Wu PT, Lau YQ, Dai FJ, Lin JT, Kao HY, Chau CF. Ability of chicken protein hydrolysate to lower serum cholesterol through its bile acid binding activity. CYTA-J Food, 18, 493-499 (2020)


Zhang ZY, Monleon D, Verhamme P, Staessen JA. Branched-chain amino acids as critical switches in health and disease. Hypertension, 72, 1012-1022 (2018)

,