1. 서론
양배추(Brassica oleracea var. capitata)는 브로콜리, 컬리플라워 등과 함께 십자화과 식물에 속하며 가장 많이 소비되는 십자화과 채소 중 하나이고, 재배 역사가 가장 오래된 작물로 장수식품 중 하나로 여겨지며, 소비가 꾸준히 증가하고 있다(Hounsome 등, 2009). 양배추의 영양성분으로 비타민 A 및 B뿐만 아니라 비타민 C와 비타민 K, U 등을 함유하고 있으며, 리놀렌산, 라이신, 포도당이 많이 함유되어 있다(Plumb 등, 1997; Riba 등, 2018). 또한, caffeic acid, chlorogenic acid, ferulic acid, ρ-coumaric acid, lutein, zeaxanthin, sulforaphan, glucosinolate, S-methylmethionine 등의 생리활성 물질을 함유하고 있다(Hayes 등, 2008; Rice-Evans 등, 1996; Rice-Evans 등, 1997; Sim 등, 1992). 그중 isothiocyanates는 암 예방, 면역 기능 활성화, 항산화 효능 등이 있고, S-methylmethionine은 위궤양 예방 및 치료, 항염증, 통증 억제 효능 등이 있으며, sulforaphan은 항산화, 항암 효과 등이 알려져 있다(Conaway 등, 2002; Gessler 등, 1991; Hwang과 Nhuan, 2015; Li 등, 2012). 양배추의 생리활성에 대한 다양한 연구가 진행되어 위궤양 예방 및 치료뿐만 아니라 항암, 항산화, 면역 증강, 노화 방지, 체중조절, 혈중 지질 개선, 심혈관계 질환 예방 등이 보고되었다(Hong 등, 2013; Lee 등, 1990; Maritess 등, 2005; Nilsson 등, 2006; Samec 등, 2011; Suido 등, 2002; Zhu 등, 2000).
Lactococcus, Lactobacillus, Bifidobactenium 등을 포함하는 여러 유산균들은 발효를 통해 lactic acid와 여러 유용 대사산물을 생산하며, 장운동 촉진, 면역 증강, 장내 미생물 균총 개선 등의 기능을 하는 것으로 알려져 있다. 최근에는 유산균을 이용한 천연물 발효를 통해 항암, 항염, 항균, 항알러지, 피부노화, 미백 등 기능성 증진 및 기능성 소재에 관한 연구가 이루어지고 있으며, 이를 활용하여 발효식품, 건강기능식품, 의약품, 화장품 등 다양한 분야에서 이용되고 있다(Ha 등, 2010; Jeon 등, 2011; Jun 등, 2014; Kang 등, 2009; Kim과 Lim, 2018; Park, 2012; Park 등, 2006).
양배추 기능성 연구는 주로 용매 추출물을 이용한 연구가 대부분을 차지하고 있으며, 유산균 발효에 의한 양배추 발효물의 기능성을 분석한 연구는 미미한 실정이다. 따라서 본 연구에서는 L. plantarum을 이용하여 양배추 발효물의 항산화 활성, 소화효소 저해활성, 항염증, 항알레르기와 같은 생리활성을 분석함으로써 기능성 식품 소재로 개발하기 위한 가능성을 검토하고자 하였다.
2. 재료 및 방법
Latobacillus plantarum ATCC14917 균주는 농업유전자원정보센터(KACC)로부터 분양을 받아 사용하였다. L. plantarum는 lactobacilli MRS agar 배지(KisanBio, Seoul, Korea)에 도말하여 37°C에서 48시간 배양하여 형성된 single colony를 lactobacilli MRS broth 배지(KisanBio, Seoul, Korea)에 접종하여 37°C에서 24시간 배양한 후, 접종원으로 사용하였다.
양배추를 세척하고 0.5 mm로 분쇄한 후 L. plantarum 종균을 살균한 양배추 중량당 0.5%를 접종하여 37°C에서 7일간 정치배양하였다. 배양 종료 후 반고체 상태의 양배추 발효물과 비발효 양배추를 동결건조기(Ilshin Lab, Dongducheon, Korea)를 이용하여 분말시료를 제조하였으며 −20°C에서 보관하여 실험에 사용하였다.
생균수 측정은 배양액 1 mL에 멸균수 9 mL를 넣고 균질화한 다음 10배 희석법으로 희석하여 MRS agar 배지에 도말하였다. 35°C에서 72시간 배양한 다음 형성된 colony 수를 계측하고, 희석배수를 곱하여 유산균 수를 산출하였다. pH는 pH meter(Thermo scientific, Waltham, MA, USA)를 사용하여 측정하였다. 총 산도는 시료 1 mL를 증류수로 20배 희석한 후 1% phenolpthalein 용액을 가하고 0.1 N NaOH를 첨가하여 적정한 다음, 사용된 NaOH 용액의 양을 유기산 계수로 환산하여 총 산도를 산출하였다.
총폴리페놀 함량은 Folin-Denis법을 이용하여 측정하였다(Singleton과 Rossi, 1965). ethanol을 이용하여 1 mg/mL로 희석한 시료 100 μL에 Folin-Denis reagent를 100 μL를 가하여 혼합한 후 3분간 실온에서 반응시켰다. 3분 후 10% sodium carbonate solution 100 μL를 가하여 혼합하고, 1시간 반응시킨 후 상층액을 취하여 Microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 760 nm에서 흡광도를 측정하였다. 총폴리페놀 함량은 gallic acid를 이용하여 작성한 표준곡선을 통해 정량하였다.
총플라보노이드 함량은 Davis(1947)의 방법을 이용하여 측정하였다. ethanol을 이용하여 1 mg/mL로 희석한 시료 100 μL에 diethylene glycol을 1 mL씩 가하여 혼합한 후, 1 N NaOH를 100 μL 가하여 잘 혼합하고 37°C water bath에서 1시간 동안 반응시켰다. 1시간 후 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 420 nm에서 흡광도를 측정하였다. 총플라보노이드 함량은 naringin을 이용하여 작성한 표준곡선을 통해 정량하였다.
1,1-diphenyl-2-pycrylhydrazyl(DPPH) radical 소거능은 Blois(1958)의 방법을 이용하여 측정하였다. DPPH 시약은 0.1 mM 농도가 되도록 methanol에 녹여 사용하였다. methanol로 희석한 시료 100 μL와 DPPH 시약 0.5 mL를 넣고 20분 동안 빛을 차단한 조건에서 반응시킨 후 Microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 517 nm에서 흡광도를 측정하였다. DPPH radical 소거능은 다음과 같은 식을 이용하여 계산하였다.
α-Amylase 저해활성은 Lim 등(2005)의 방법을 이용하여 측정하였다. 증류수로 희석한 시료에 타액 유래 α-amylase 효소액(5 unit/mL, in 50 mM potassium phosphate buffer)와 혼합하여 실온에서 5분간 반응시킨 후 기질 용액인 1% starch를 넣어 교반한 후 실온에서 5분간 반응시켰다. 반응 후 3,5-dinitrosalicylic acid 용액을 넣고 100°C에서 5분간 끓여 발색시키고 냉각하여 DW를 넣고 교반한 뒤, microplate reader(Molecular Devices, Sunnyvale, CA, USA)로 550 nm에서 흡광도를 측정하여 활성을 평가하였다.
p-Nitrophenyl butyrate(PNPB)의 substrate(10 mM)를 이용하여 lipase 저해활성을 측정하였다(Park 등, 2014). Substrate solution에 증류수로 희석한 다양한 농도의 시료를 처리한 lipase 10 mU를 가하여 60°C에서 15분 반응시킨 후 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 405 nm에서 10분간 p-nitrophenol(PNP)을 측정하여 Vmax 또는 흡광도를 분석하였다.
RAW 264.7 세포, RBL-2H3 세포는 10% fetal bovine serum(FBS), 1X antibiotic-antimycotic를 포함하는 Dulbecco’s Modified Eagle’s Medium(DMEM) 배지를 사용하며, 37°C, 5% CO2 조건에서 배양하였다. 배양 flask에서 70-80% 정도로 자라게 되면 Trypsin-EDTA를 이용하여 계대배양하며 실험에 이용하였다.
세포의 생존율은 3-(4,5-dimethylthiazole-2-yl)-2,5-diphenyl-tetrazoliumbromide(MTT) 환원 방법을 이용하여 측정하였다(Van 등, 2011). 세포를 96-well plates에 분주한 뒤 12시간 동안 배양한 후, 시료를 세포에 처리하여 24시간 동안 배양하였다. 배양 후 배지로 희석한 MTT 용액(최종농도: 0.5 mg/mL)을 각 well에 100 μL씩 처리하고, 37°C에서 4시간 동안 배양하여 MTT를 환원시켰다. 배지를 제거하고 생성된 formazan을 녹이기 위해 dimethyl sulfoxide(DMSO)를 100 μL씩 분주하여 10분동안 혼합한 후 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 540 nm에서 흡광도를 측정하였다. 시료를 처리하지 않고 배지만 처리한 세포를 대조군으로 하여 상대적인 백분율로 세포 생존율을 나타내었다.
Nitric oxide(NO)의 생성은 griess reagent를 이용하여 측정하였다. 세포를 24-well plate에 분주하여 12시간 배양한 후에 시료를 농도별로 처리한 다음, lipopolysaccharide (LPS) from Escherichia coli O55:B5(1 μg/mL)를 처리하여 20시간 배양하였다. 세포 배양액 100 μL와 Griess (1% sulfanilamide in 5% phosphoric acid와 1% α-naphtylamide in H2O) 시약 100 μL를 혼합하여 상온에서 10분 동안 반응시킨 후, microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 550 nm에서 흡광도를 측정하였다. Sodium nitrate(NaNO2)로 표준곡선을 작성하여 NO 함량을 산출하였다. 배지만 처리한 세포를 음성 대조군, LPS만 처리한 세포를 양성 대조군으로 하여 시료 처리군과 활성을 비교하였다.
배지 내에 생성된 cytokine 및 Prostaglandin E2(PGE2)의 농도는 enzyme-linked immunosorbent assay kits (R&D Systems, Minneapolis, MN, USA)를 이용하여 측정하였다. 시료와 LPS를 처리하여 배양이 끝난 후 원심분리하여 상층액을 분리하고 −70°C에 보관하였다. 제조사에서 제공한 분석방법에 따라 수행하고, ELISA reader (Molecular Devices, CA, USA)를 이용하여 흡광도를 측정하였다. Standard의 흡광도로 표준곡선을 구하고, 이를 이용하여 사이토카인과 PGE2의 양을 정량하였다. 배지만 처리한 세포를 음성 대조군, LPS 또는 DNP-bovine serum albumin(DNP-BSA)만 처리한 세포를 양성 대조군하여 시료 처리군과 활성을 비교하였다.
탈과립은 β-hexosaminidase 측정을 이용하여 확인하였다(Matsuda, 2002). Dinitropheny-immunoglobulin E(DNP-IgE)를 함유한 DMEM 배지를 사용하여, 24-well plates에 세포를 분주하고 배양하였다. 각 세포들을 Siraganian buffer(119 mM NaCl, 5 mM KCl, 5.6 mM glucose, 0.4 mM MgCl2, 25 mM PIPES, 1 mM CaCl2, 0.1% BSA, pH 7.2)로 씻어준 후, 37°C에서 동일한 buffer로 10분간 전 배양하였다. 이후 시료를 농도별로 희석시켜 세포에 처리하고 30분 동안 반응시킨 후 DNP-BSA를 가하여 2시간 동안 반응시키고, ice bath에서 10분간 배양하여 반응을 종결시켰다. 상층액 40 μL에 substrate buffer(2 mM 4-p-nitrophenyl-N-acetyl-β-D-glucosaminide, 0.05 M sodium citrate, pH 4.5) 40 μL를 가하고, 37°C에서 1시간 동안 반응시킨 후 각 well에 stop solution (0.1 M Na2CO3/NaHCO3, pH 10.5) 200 μL를 가하여 반응을 종결시키고 405 nm에서 흡광도를 측정하였다.
Histamine은 Shore 등(2013)의 방법을 이용하여 측정하였다. 세포 배양액 25 μL를 넣고 0.1 N HCl 22.5 μL, 60% HClO 42.5 μL를 넣고 반응시킨 후 원심분리하고 상층액 40 μL와 5 N NaOH 25 μL, n-butanol 500 μL, NaCl 0.06 g을 혼합하여 진탕 후 원심분리하였다. Butanol층 400 μL와 0.1 N HCl 용액 150 μL, n-heptane 0.5 mL를 혼합하여 진탕 후 원심분리하고, 수층 100 μL와 1 N NaOH 용액 200 μL, 0.1% ο-phthaldialdehyde 용액 5 μL를 혼합 후 37°C에서 3분 동안 반응시켰다. 이후 3 N HCl 10 μL를 넣고 2분 동안 반응시킨 후 360 nm(excitation)와 450 nm(emission)에서 흡광도를 측정하였다.
배지만 처리한 세포를 음성 대조군, LPS 또는 DNP-BSA만 처리한 세포를 양성 대조군으로 하여 시료 처리군과 활성을 비교하였다.
3. 결과 및 고찰
유산균을 이용하여 발효된 양배추 발효물의 배양 시간별 생균수, pH 및 산도 변화는 Table 1에 나타내었다. 양배추의 발효 시간별 생균수는 1일 이후 7.53±0.31 log CFU/mL의 생균수를 나타내었으며, 발효 기간이 증가할수록 생균수는 증가하여 발효 7일에 생균수가 10.40±0.08 log CFU/mL로 최대값을 나타내었고, 발효 10일 후에는 9.05±0.13 log CFU/mL 감소하는 경향을 나타내었다. pH 및 산도는 무발효 시 pH 5.27 및 0.14%를 나타냈지만 발효 1일 이후 각각 pH 4.69 및 0.14%를 나타냈으며, 발효 10일 후에는 각각 pH 3.70 및 0.60으로 감소 및 증가를 나타냈다. 유산균 발효에 의한 pH의 감소 및 산도의 증가는 유산균에 의해 생성된 유기산, 젖산 및 아세트산 등에 의해 나타나는 것으로 여겨지며, 이는 Ryu 등(2018)의 연구에서 유산균 발효에 의해 pH의 감소, 산도가 증가한다는 보고와 유사한 결과를 나타냈다. 이러한 낮은 pH 및 높은 산도가 유산균 생육에 영향을 주어 생균수가 증가 후 감소하는 것으로 여겨지며, 생균수 측정 결과에 따라 최대값을 나타낸 발효 7일 후의 유산균 발효물을 이용하여 기능성을 평가하였다.
폴리페놀 화합물은 식물에 존재하는 대사산물로 다양한 분자구조를 가지며, 2개 이상의 phenolic hydroxyl(-OH)기를 가진다. 식물의 항산화 활성은 페놀화합물이 원인 물질로 알려져 있다. 항산화 외에도 항염 및 항암, 항에이즈, 충치예방 등과 같은 다양한 생리활성기능을 가지는 것으로 알려져 있다(Lee 등, 1992). 또한, 플라보노이드는 폴리페놀계 화합물 중 하나로 항산화 활성뿐만 아니라, 다양한 생리활성 기능을 수행하는 것으로 알려져 있다. 양배추 유산균 발효물의 총폴리페놀 및 총플라보노이드 함량에 대한 결과는 Table 2에 나타내었다. 총폴리페놀 함량 측정 결과, 15.84±0.25 mg GAE/g으로 측정되었으며, 총플라보노이드 함량 측정 결과 1.19±0.09 mg NA/g으로 측정되었다. 양배추 유산균 발효물에 함유된 폴리페놀계 화합물로부터 여러 가지 생리활성 기능을 기대할 수 있는 것으로 사료된다.
| Sample | Polyphenol contents (mg GAE1)/g) | Flavonoid contents (mg NA2)/g) |
|---|---|---|
| Fermented B. oleracea | 15.84±0.253) | 1.19±0.09 |
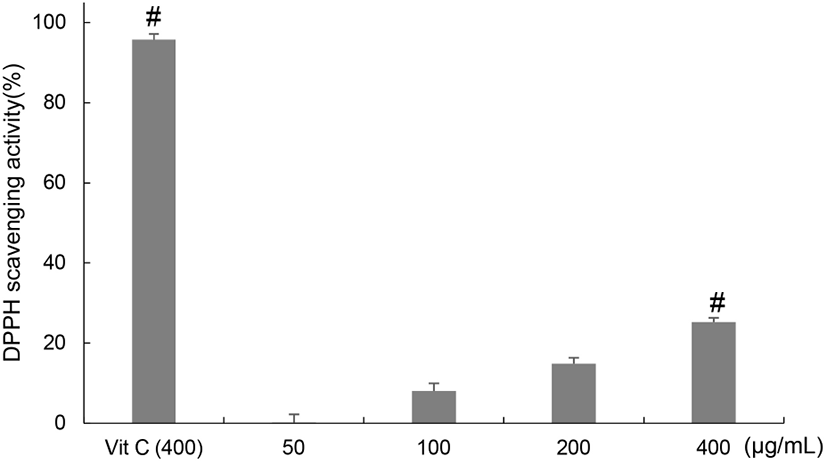
DPPH는 분자 내에 free radical을 함유하고 있으며, 항산화 물질에 의해 환원되어 자색이 탈색되는 정도를 측정하여 항산화 물질의 항산화 효과를 측정할 때 이용된다 (Ramrathnam 등, 1995). 양배추 유산균 발효물의 DPPH radical 소거활성을 평가한 결과, 50, 100, 200, 400 μg/mL에서 0.20±0.06, 8.04±0.06, 14.84±0.90, 25.24±0.37% 소거활성을 나타내었다(Fig. 1). 이를 통해 양배추 유산균 발효물의 DPPH radical 소거 활성을 확인하였으며 항산화 활성을 가진 천연소재로서 활용이 가능할 것으로 사료된다.
α-Amylase는 녹말, glycogen 등을 포함하는 다당류에 작용하여 포도당과 엿당으로 분해하는 소화효소다. 탄수화물의 분해와 포도당의 농도를 조절하는 데 중요한 역할을 하며, α-amylase의 억제는 혈당 상승을 억제하도록 돕는다(Tan 등, 2017). α-amylase 저해활성에 평가한 결과, 50, 100, 200, 400 μg/mL에서 각각 11.16±1.37, 25.82± 2.68, 39.08±3.85, 45.18±3.37%의 저해율을 확인하였다(Fig. 2(A)).
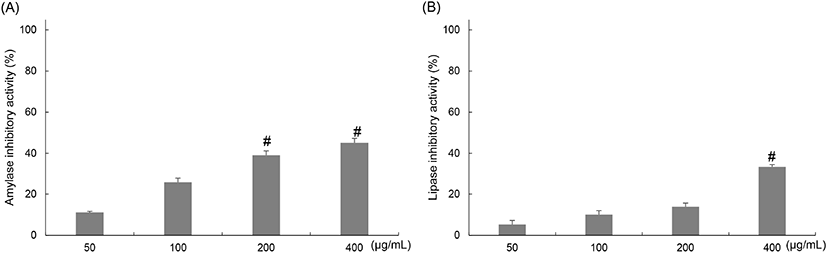
Lipase는 triacylglycerol을 2-monoacylglycerol과 두 분자의 fatty acid로 분해하는 효소로 작용하며, 섭취된 지방의 체내 흡수에 있어 매우 중요한 역할을 한다(Park 등, 2014). 양배추 유산균 발효물의 pancreatic lipase의 억제 활성을 in vitro에서 확인하였다. Lipase 저해활성을 평가한 결과, 50, 100, 200, 400 μg/mL에서 각각 5.22± 0.36, 10.08±0.58, 13.85±0.51, 33.28±0.63%의 저해활성을 확인했지만, α-amylase 저해활성에 비해 낮은 활성을 나타냈다(Fig. 2(B)). 이 결과를 통해 소화효소들의 억제 활성을 확인하였으며, 이러한 효소들의 억제를 통해 각 영양소의 흡수율을 억제시킴으로써 체내에 과도하게 지방이 축적되는 것을 예방할 수 있어 비만 개선에 도움을 줄 수 있을 것으로 판단된다.
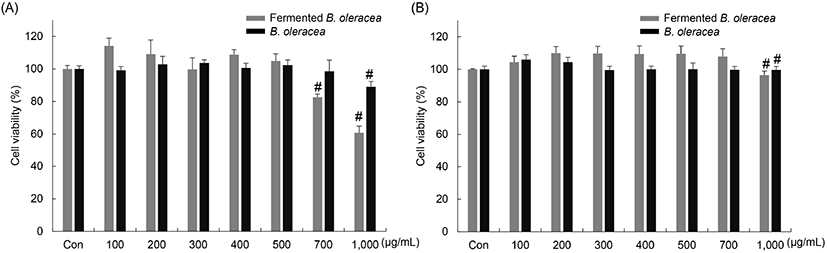
양배추 유산균 발효물이 RAW 264.7 세포와 RBL-2H3 세포의 세포 생존율에 미치는 영향을 MTT assay를 이용하여 확인하였다(Fig. 3). 비발효 양배추와 양배추 유산균 발효물을 0, 100, 200, 300, 400, 500, 700, 1,000 μg/mL 농도로 24시간 동안 처리였다. RAW 264.7 세포에서는 비발효 양배추는 1,000 μg/mL, 양배추 유산균 발효물은 700 μg/mL 이상의 농도에서 세포 생존율이 감소하였다. RBL-2H3 세포에서는 비발효 양배추, 양배추 유산균 발효물 모두 1,000 μg/mL에서 세포 생존율이 감소함을 확인하였다. 따라서 항염증 및 항알러지 실험은 세포 생존율에 영향을 주지 않는 농도 범위에서 진행하였다.
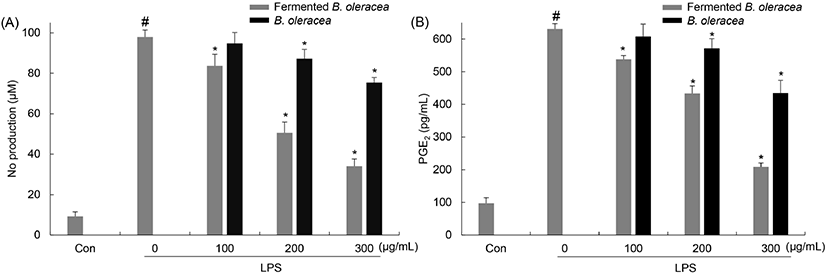
NO는 염증 매개 물질로 L-arginine에서 NO synthase (NOS)에 의해 합성된다. 박테리아나 종양을 제거하는 역할을 하기도 하지만 거의 모든 염증 반응에 관여한다. 과도하게 생성된 NO는 독성을 나타내며, 체내 조직의 손상, 관절염, 폐혈성 쇼크 등의 염증반응과 관련된 질병을 유발하기도 한다(Jung 등, 2010). 또, 다른 염증 매개 물질인 PGE2는 cyclooxygenase-2(COX-2)에 의해 합성되며, Th2 세포의 활성을 유도해 염증성 사이토카인의 생성을 유도한다. 이뿐만 아니라 종양의 세포 사멸을 억제하고 혈관 생성을 유도하여 종양 생성에 기여한다(Jang 등, 2006). 염증 반응 억제 효과를 확인하기 위해 NO와 PGE2의 생성에 대한 양배추 유산균 발효물의 억제 효과를 측정하였다. 비발효 양배추와 양배추 유산균 발효물을 100, 200, 300 μg/mL 농도로 전처리한 후 LPS를 처리하여 세포 배양액 중에 존재하는 NO 및 PGE2 양을 분석하였다(Fig. 4). LPS만 단독 처리한 군을 기준으로 양배추 유산균 발효물을 처리한 경우에는 14.57±0.25, 48.42±0.09, 65.26±0.18%, 비발효 양배추를 처리한 군에서는 3.24±0.31, 10.93±0.17, 23.02± 0.23%의 NO 생성이 감소되었으며, 비발효 양배추에 비해 양배추 유산균 발효물의 NO 생성 억제 효과가 높은 것으로 나타났다. PGE2의 경우, LPS만 단독 처리한 군을 기준으로 양배추 유산균 발효물을 처리한 경우에는 14.66±0.09, 31.26±0.10, 70.95±0.15%, 비발효 양배추를 처리한 군에서는 3.61±0.07, 9.39±0.11, 31.08±0.21%의 PGE2 생성이 감소되었으며, 비발효 양배추에 비해 양배추 유산균 발효물의 PGE2 생성 억제 효과가 높은 것으로 나타났다. Park 등(2018)의 연구에 의하면 L. plantarum 발효에 의해 층꽃나무의 항염증 능력이 향상되며, 미생물 발효가 생리활성 변화에 좋은 영향을 미치는 것으로 보고하였고, 본 연구와 유사한 경향을 나타내었다. 이 결과를 통해 유산균 발효에 의해 염증 억제 효과가 증가됨을 확인하였고, 양배추 유산균 발효물은 대식세포주에서 LPS에 의해 유발된 NO 및 PGE2와 같은 염증 매개 물질 억제를 시킴으로써 항염증 효과를 나타내는 것으로 사료된다.
사이토카인은 면역세포의 활성, 증식 및 분화를 조절하여 염증반응을 매개하는 인자로, 대식세포와 같은 면역 관련 세포에서 사이토카인을 분비하여 다양한 염증반응을 매개하며, NO와 PGE2 생성을 유도한다. 사이토카인 중 tumor necrosis factor(TNF)-α, interleukin(IL)-1β는 in vitro 및 in vivo에서 염증반응을 조절하는 물질로 대표적인 염증성 사이토카인으로 알려져 있다. TNF-α는 세포 증식, 생존, 분화, 사멸을 조절하며, 염증반응 동안 생성이 증가하여 IL-1β와 같은 염증성 사이토카인 생성에 주도적인 역할을 하며, IL-1β는 면역 방어와 상처에 대한 반응에 관여한다 (Kielian 등, 2004; Levine 등, 1990). LPS로 염증반응을 유도한 RAW 264.7 세포에서 염증성 사이토카인 생성에 미치는 영향을 알아보기 위해, 비발효 양배추와 양배추 유산균 발효물을 100, 200, 300 μg/mL 농도로 전처리하고, LPS를 처리한 후 ELISA를 이용하여 측정하였다(Fig. 5). IL-1β의 생성은 LPS만 단독 처리한 군을 기준으로 양배추 유산균 발효물을 처리한 군에서는 15.23±0.23, 30.19±1.01, 59.54±0.28%, 비발효 양배추를 처리한 군에서는 7.14± 0.02, 24.93±0.27, 48.10±0.34%의 IL-1β 생성이 감소하였으며, 유산균 발효에 의해 IL-1β 생성 억제 효과가 증가됨을 확인하였다. TNF-α의 경우에도 LPS만 단독 처리한 군을 기준으로 양배추 유산균 발효물을 처리한 군에서는 19.92±1.37, 45.31±0.16, 74.29±1.26%, 비발효 양배추를 처리한 군에서는 7.94±0.007, 28.35±0.33, 41.17± 0.22%의 TNF-α 생성이 감소하였으며, IL-1β 생성 억제와 유사한 양상을 나타냄을 확인하였다. Tak 등(2014)의 L. rhamnosus를 이용한 흑마늘 발효물의 800 μg/mL 농도에서 IL-1β는 41.4%, TNF-α는 35.4%의 억제율을 나타낸 결과와 비교했을 때, 양배추 유산균 발효물의 염증성 사이토카인 억제 효과가 우수하다는 것을 확인할 수 있었다. 따라서 양배추 유산균 발효물은 염증성 사이토카인의 분비 억제를 통해 염증 유도 및 관련인자를 조절하여 항염증 효과를 나타내는 것으로 사료된다.
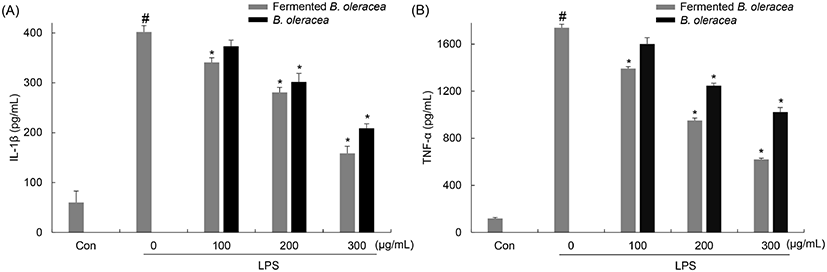
비만세포는 high-affinity IgE receptor(FcεRI)에 의해 다양한 사이토카인을 생성하며, 이로 인해 염증반응 유도인자들의 발현을 촉진시켜 염증성 알레르기 반응을 유발한다. 그 중, IL-4는 T림프구나 비만세포 등에서 생성되며, I형 알레르기 반응을 유발하는 IgE의 생성을 유도하고 매개성 면역반응을 조절하며, 실제 환자들에게서 IL-4의 생성이 증가되는 것이 보고되었다(Ngoc 등, 2005). 또한, TNF-α는 체내 알레르기 반응이 시작되면 비만세포에서 탈과립되면서 히스타민 및 다른 염증 매개인자들과 함께 유출되며 또 다른 사이토카인 및 염증반응 매개인자들의 생성을 유도하여 알레르기 및 염증 반응을 더욱 악화시킨다(Chung과 Barnes, 1999). 비발효 양배추와 양배추 유산균 발효물을 100, 200, 300 μg/mL 농도로 처리하여 DNP-BSA로 알레르기 반응을 유도한 RBL-2H3 세포에서 사이토카인의 생성에 미치는 영향을 알아보기 위해 ELISA를 이용하여 측정하였다(Fig. 6). IL-4의 경우, DNP-BSA만 단독 처리한 군을 기준으로 양배추 유산균 발효물을 처리한 군에서는 13.37± 0.22, 29.13±0.98, 47.76±1.07, 비발효 양배추를 처리한 군에서는 2.38±0.38, 14.28±0.09, 18.09± 0.05%를 감소하였다(Fig. 6). TNF-α의 경우에도 DNP-BSA만 단독 처리한 군을 기준으로 양배추 유산균 발효물을 처리한 군에서는 15.27±0.09, 40.27±2.17, 72.22± 1.95%, 비발효 양배추를 처리한 군에서는 1.02±0.02, 5.28±0.09, 29.16± 1.12%로 감소하였다(Fig. 6). 이 결과를 통해서 DNP-BSA 단독 처리군에 비해 양배추 유산균 발효물에 의해서 IL-4와 TNF-α 생성이 감소한 것을 나타냈으며, 유산균 발효에 의해 IL-4와 TNF-α 생성 억제 효과가 증가하였음을 확인하였다. Park 등(2018)의 연구에서 B. breve를 이용한 씀바귀와 씀바귀 발효물은 50 μg/mL 농도에서 각각 IL-4는 37%와 41.4%, TNF-α는 13%와 35.4%의 억제율을 나타냈으며, 발효에 의해 사이토카인의 생성 억제 효과가 증가됨이 보고되어 양배추 본 연구와 유사한 결과를 보여주었다. 따라서 양배추 유산균 발효물이 DNP-BSA로 자극한 RBL-2H3 세포에서 전염증성 사이토카인 IL-4와 TNF-α의 생성을 억제하여 염증성 알레르기를 억제하는 효능을 가지고 있는 것으로 사료된다.
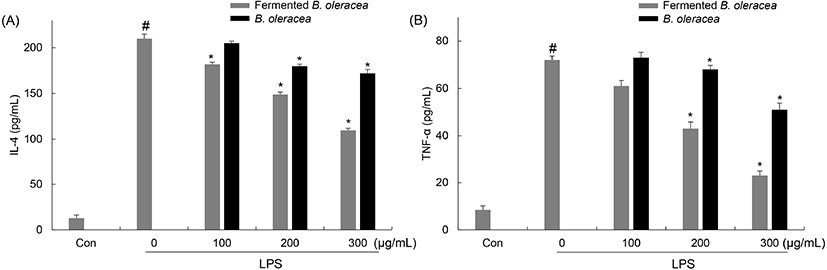
Histamine은 알레르기 반응 전에도 존재하고 있으며, 알레르기 유발 자극을 받으면 외부로 유리된다(Schwartz와 Huff, 1998). β-Hexosaminidase은 비만세포의 분비 과립 안에 저장되어 있으며, 알레르기 반응에 의해 histamine을 세포 밖으로 분비하므로 비만세포 탈과립의 지표인자로 이용된다(Galli 등, 2005). 비발효 양배추와 양배추 유산균 발효물을 100, 200, 300 μg/mL 농도로 처리한 후 RBL-2H3 세포 배양액 중에 존재하는 β-hexosaminidase 활성과 histamine 분비량을 분석하였다(Fig. 7). 탈과립에 의해 분비된 β-hexosaminidase 활성을 측정한 결과, 배지만 처리한 군에 비해 DNP-BSA만 단독 처리한 군에서는 β-hexosaminidase 생성이 195%로 증가하였고, 양배추 유산균 발효물을 처리한 군에서는 180, 163, 121%, 비발효 양배추를 처리한 군에서는 192, 188, 173%로 생성이 감소하였다. 이를 통해서 유산균 발효에 의해 β-hexosaminidase 생성 억제 효과가 증가함을 확인하였다. Kang과 Kim(2011)의 연구에서 유산균 발효에 의한 발효 한약이 RBL-2H3 세포 내 β-hexosaminidase의 방출을 억제하는 것을 통해 알레르기 저해 효과를 나타내었으며, 이는 비발효 한약보다 높은 저해 효과를 나타낸다고 보고되어 본 연구와 유사한 결과를 보여주었다.
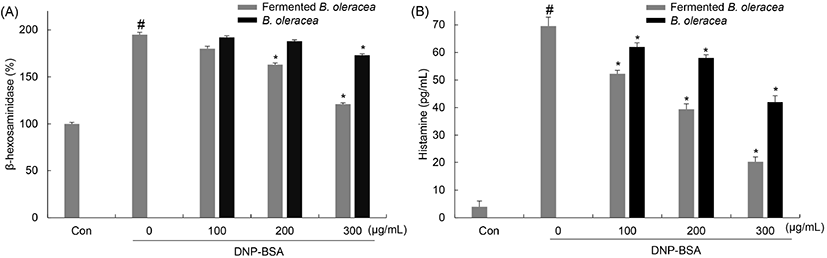
또한, 탈과립 후 유리되는 histamine 양을 측정한 결과, DNP-BSA만 단독 처리한 군을 기준으로 비발효 양배추를 처리한 군에서는 24.87±1.75, 43.39±2.01, 70.93±1.99%, 양배추 유산균 발효물을 처리한 군에서는 10.87±0.08, 16.62±1.31, 39.62±1.74%로 histamine 생성이 감소하였으며, β-hexosaminidase와 유사한 경향을 나타냈다(Fig. 7). 이러한 결과를 통해서 양배추 유산균 발효물은 활성화된 비만세포에서 β-hexosaminidase와 histamine 분비를 억제함으로써 알레르기 증상 개선에 효과가 있을 것으로 사료된다.
