1. 서론
현대 사회는 경제적 발전과 의학 기술 발달로 인해 평균수명이 증가하고 있으며, 이로 인해 고령화 인구 비율이 높아지고 있어 초고령화 사회로의 진입을 앞두고 있다. 노인 인구의 증가는 노화와 관련된 다양한 질병의 발생이 증가할 것으로 예상되고, 이는 노화로 인한 체내 항산화 시스템의 불균형화와 복잡한 관련이 있다. 노화로 인한 질병의 예방은 노화가 시작되기 전에 실시되어야 노년의 삶의 질이 높아질 수 있다. 체내의 정상 세포를 공격하여 노화나 각종질병의 원인으로 작용하는 활성산소(reactive oxygen)는 singlet oxygen(O21) 및 superoxide anion radical(O2−), hydroxyl radical(HO−), peroxyl radical(ROO−), hydrogen peroxide(H2O2), hypochlorous (HOCl) 등으로 세포 산화에 따른 스트레스를 유발하는 것으로 알려져 있다(Droge 등, 2002). Antioxidant란 인간의 호흡으로부터 만들어진 잔류 활성산소를 제거해 염증, 암 등과 같은 다양한 질병을 예방하는 것을 의미한다. 이러한 활성산소를 제거하는 주요 효능 성분으로는 vitamin C, epigallocatechin gallate(EGCG), butylated hydroxyanisole (BHA), butylated hydroxytoluene(BHT) 등이 있으며 이들은 free radical을 제거하는 –hydroxyl group을 통해 활성산소를 소거한다(Guo 등, 2008). 또한, 폴리페놀 화합물과 비타민 E, C, 카로티노이드, 플라보노이드 등과 같은 식이성 항산화제는 비효소적 항산화제로 산화에 따른 스트레스와 관련 있는 질병의 예방에 효과가 있는 것으로 알려져 있다(Ames 등, 1995). 또한, 생체 내에서 노화를 억제하거나, 염증, 암 등과 같은 질병을 예방하는 데 천연 항산화제가 매우 효과적인 것으로 보고되어 있어 천연 식물체의 항산화 작용에 관한 연구 등이 많이 이루어지고 있다(Kim, 2012).
금화규는 골든히비스커스, 황금해바라기 등의 다양한 명칭으로 사용되고 있다. 금화규의 학명은 “Abelmoschus manihot”이며 닥풀과 같은 과에 해당하는 품종으로, 중국이 원산지이며 한국의 전 지역에 분포된 1년생 초본식물로 식용이 가능한 약용식물이다(Yun 등, 2020). 금화규 꽃에는 myricetin, cannabiscitrin, myricetin-3-O-beta-D-glucopyranoside, glycerolmonopalmitate, 2, 4-dihydroxy benzoic acid, guanosine, adenosine 등의 많은 성분들이 함유되어 있다(Lai 등, 2006). 위 화합물들은 강한 항산화제로 알려져 있을 뿐만 아니라, 항암제 등으로 사용된다(Kian 등, 1997). 현재 금화규 꽃은 꽃차로 많이 사용되고 있으며 금화규 꽃잎은 중국에서 황달과 다양한 유형의 만성 간염 치료에 사용되며, 항염증, 항균, 항산화, 황경련제, 심근경색 및 신경보호 작용과 같은 다양한 생물학적 활동을 가지고 있다(Guo 등, 2013). 또한, 금화규 꽃잎은 샐러드에 첨가되거나 요리에 사용되며 높은 단백질 함량 때문에 세계에서 가장 영양가 있는 잎이 많은 채소 중 하나로 꼽힌다(Todarwal 등, 2011).
본 연구에서는 금화규 꽃을 열수와 70% 에탄올 용매로 추출하였을 때 항산화 활성 및 페놀, 플라보노이드 함량을 비교 분석함으로써 기능성식품 또는 화장품 소재로서의 활용 가능성을 알아보고자 한다.
2. 재료 및 방법
본 실험에 사용한 금화규(A. manihot) 꽃은 영주시 풍기읍에서 공급받아 꽃 부위만 따로 분리하여 −20°C 냉동실에 보관하면서 본 실험의 시료로 사용하였다. 금화규 꽃 열수 추출물(AMW)은 시료 200 g 중량의 30배 증류수를 가하여 99°C에서 3시간 동안 총 3회 반복하여 추출하였으며, 70% 에탄올 추출물(AME)은 시료 400 g 중량의 20배 70% 에탄올을 가하여 실온에서 24시간 동안 총 3회 반복하여 추출하였다. 각각의 추출액을 여과지(Whatman No.2, Sigma-Aldrich Co., MO, USA)로 여과한 뒤 rotary vacuum evaporator(HS-10SP, Hahnshin S&T, Korea)를 사용하여 농축한 후 동결건조기(FD5525, Ilshin BioBase, Korea)로 동결 건조하여 냉동실에 보관하며 사용하였다. AMW의 수율은 36.94%, AME의 수율은 41.46%이었다.
ABTS radical scavenging assay는 Rice-Evans 등(1999)에 따라 실험을 진행하였다. ABTS+ radical은 7.4 mM 2.2-Azino-bis(3-ethylbenzth iazoline-6-sulfonicacid)와 2.6 mM potassium persulfate를 1:1 비율로 혼합하여 상온 암실 상태에서 24시간 동안 반응시켜 734 nm에서 흡광값이 0.700±0.001이 되도록 물로 희석하여 사용했다. 100 μL의 시료 용액에 100 μL의 ABTS+ 용액을 첨가하고 1분간 상온에서 차광한 후 734 nm에서 흡광도를 측정하였다. Radical scavenging activity는 시료 용액 첨가군과 무첨가군의 용액의 흡광도 감소 비율로 표현되었다.
Electron donating ability는 Blois(1958)의 방법을 변형하여 실험을 진행하였다. 50 μL의 0.2 mM 1,1-diphenyl-2-picrylhydrazyl(DPPH)를 각 시료 용액 100 μL에 첨가하여 상온에서 30분간 차광한 후 517 nm에서 흡광도를 측정하였다. Electron donating ability는 시료 용액의 첨가군과 무첨가군의 흡광도 감소 비율로 표현되었다.
Superoxide dismutase(SOD)-like activity는 Marklund와 Marklund(1974)의 방법을 이용하여 실험을 진행하였다. 샘플 용액 200 μL, 0.05 M Tris-HCl Buffer(pH 8.5) 2.6 mL, 7.2 mM pyrogallol 200 μL를 혼합하여 37°C에서 10분간 방치하여 반응액을 제조하였다. 산화 pyrogallol은 100 μL의 1 N HCl을 첨가하여 반응을 중단한 후 420 nm에서 흡광도를 측정하였다.
FRAP reducing antioxidant power assay는 Benzie와 Strain(1996)의 방법을 변형하여 실험에 이용하였다. FRAP 시약을 0.3 M sodium acetate 완충액(pH 3.6), 10 mM 2,4,6-tripyridyl-s-triazine(TPTZ) 용액 및 20 mM ferric chloride로 10 : 1의 비율로 희석하고 37°C에서 10분간 반응하여 제조하였다. 각 농도의 시료 30 μL에 1.5 mL의 FRAP 시약을 넣고 37°C에서 30분간 반응시킨 용액을 590 nm의 흡광도로 측정하였다.
Reducing power assay는 Oyaizu(1986)의 방법을 이용하여 실험을 진행하였다. 0.3 mL의 각 농도 시료를 0.3 mL의 200 mM sodium phosphate buffer(pH 6.6) 및 0.3 mL의 1% potassium ferricyanide와 혼합하여 제조하였다. 혼합물을 50°C에서 20분 동안 반응시킨 후 0.3 mL의 10% TCA(trichloroacetic acid)를 첨가하여 반응을 중단시켰다. 반응을 중지시킨 다음 14,000 ×g에서 10분 동안 원심 분리하였다. 0.5 mL의 상층액에 deionized water 0.5 mL와 0.1% ferric chloride 0.1 mL를 혼합하여 10분간 반응시켰다. 반응 용액을 ELISA reader(PowerWave XS, Biotek, Winooski, VT, USA) 판독기를 사용하여 700 nm에서 흡광도를 측정하였다.
Total phenol content는 Folin-Ciocalteau(Slinkard 와 Singleton, 1977) 등의 방법을 이용하여 실험을 진행하였다. 50 μL의 각 농도의 시료를 50 μL의 Folin-Ciocalteau 시약과 혼합시켰다. 5분 후 50 μL의 10% Na2CO3를 첨가하고 간헐적으로 흔들어 혼합시킨 후 반응 혼합물을 실온에서 60분 동안 반응시켰다. 마지막으로 640 nm에서 흡광도를 측정하고 데이터는 tannic acid를 희석하여 검량선을 만들어 추출물 g당 tannic acid equivalent(TAE) mg으로 계산하였다.
Total flavonoid content는 colorimetric의 방법을 이용하여 실험을 진행하였다(NFRI, 1990). 200 μL의 시료와 quercetin을 2 mL의 dimethylene glycol 및 2 mL의 1 N NaOH와 혼합하여 실험을 진행하였다. 37°C에서 60분간 반응시킨 후 각 반응 혼합물의 흡광도를 420 nm에서 측정하였다. 결과는 quercetin을 희석하여 검량선을 만들어 추출물 g당 quercetin equivant(QE) mg으로 계산하였다.
Xanthine oxidase inhibition activity는 Stirpe와 Corte(1969)의 방법을 이용하여 실험을 진행하였다. 분석 혼합물은 시료 용액 100 μL, phosphate buffer 600 μL (0.1 M, pH 7.5), 2 mM substrate solution 200 μL, xanthine oxidase enzyme solution 100 μL(0.049 units/mL)로 구성되었으며, 37°C에서 15분간 반응하였다. 100 μL의 1 N hydrochloric acid를 첨가하여 반응을 중단하고 UV spectrophotometer를 사용하였으며 290 nm에서 흡광도를 측정하였다. Xanthine oxidase inhibition activity는 시료 용액의 첨가군과 무첨가군의 흡광도 감소 비율로 표현되었다.
모든 실험은 3회 반복하여 측정하였다. 결과는 평균값 mean±standard devision(SD)로 나타내었다. 시험군 간의 유의성을 검정하기 위하여 Statistical Package for the Social Sciences(SPSS) software package(version 22.0; IBM, NY, USA)을 사용하였으며 각 처리군 간의 유의성에 대한 검증은 분산분석(analysis of variance, ANOVA)을 이용하여 유의성을 확인한 후, p<0.05 수준에서 Duncan’s multiple rage test를 이용하여 분석하였다.
3. 결과 및 고찰
ABTS radical 소거능은 산화성 물질을 만나 청록색이 탈색되는 것으로 흡광도를 측정하여 추출물의 radical 소거 활성능을 측정할 수 있다(Lee 등, 2016).
50 μg/mL에서 AMW는 44.6%, AME는 65.5%의 활성을 나타내었으며, 가장 높은 농도인 1,000 μg/mL에서 AMW는 100%, AME는 99.9%로 높은 radical 소거 활성능을 나타내었다(Fig. 1). AMW와 AME 측정 결과 모두 농도 의존적으로 높아질수록 radical 소거 활성능력이 증가하는 경향을 나타내었다. 모든 농도에서 AME의 활성이 AMW의 활성보다 radical 소거 활성능이 높았다. Jo 등(2014)에 따르면 아마란스 꽃 추출물은 250 μg/mL에서 붉은색 꽃 메탄올 추출물, 보라색 꽃 메탄올 추출물, 붉은색 꽃 열수 추출물, 보라색 꽃 열수 추출물 각각 30.34%, 53.16%, 30.52%, 41.55%의 활성을 나타내었다. 이 결과와 비교하여 보면 금화규 꽃 추출물이 더 우수한 ABTS+ radical 소거능을 나타낸 것으로 판단된다.
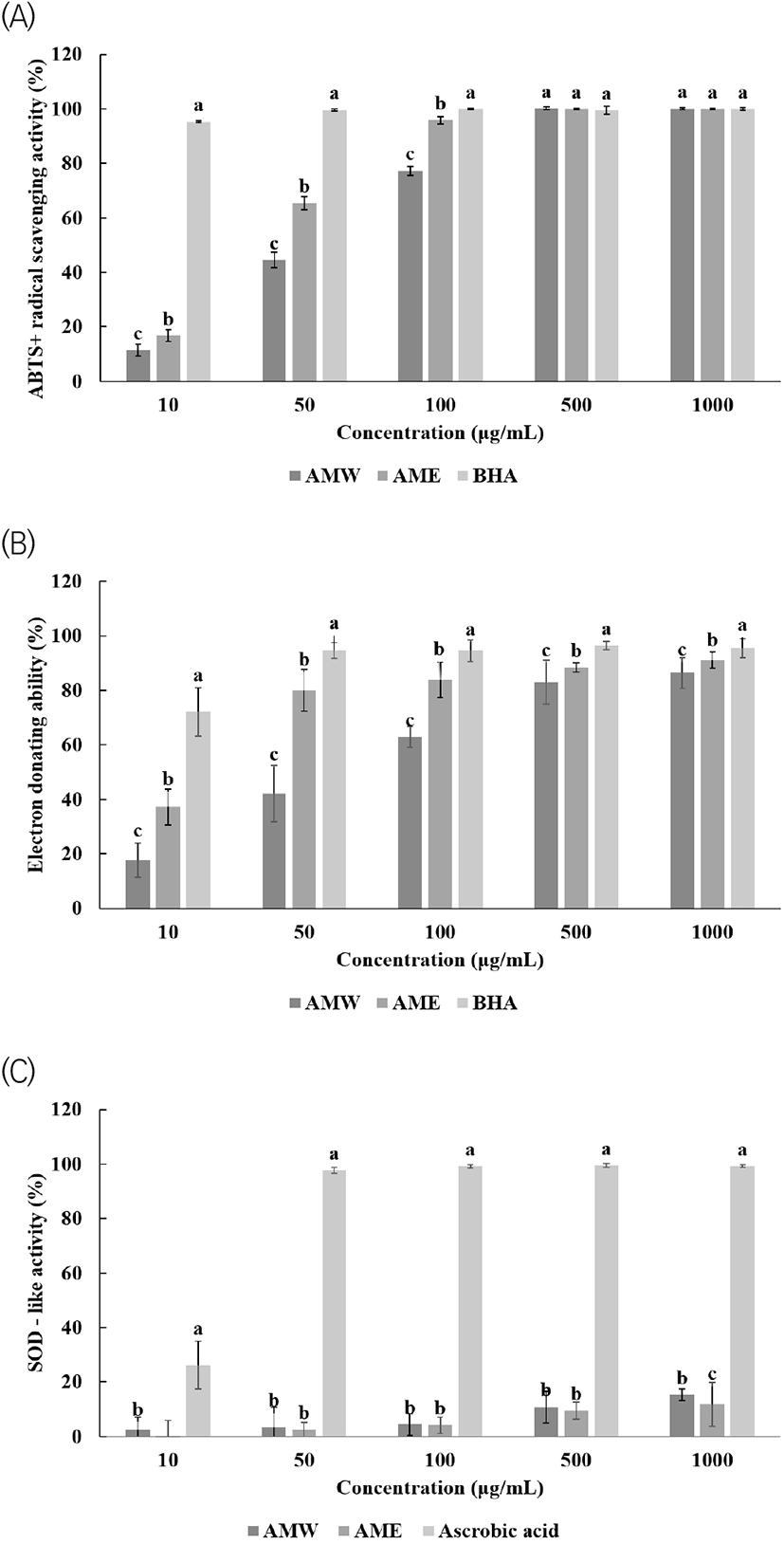
전자공여능은 DPPH에 의해 수소 공여 효과로 산화성 물질을 만나 보라색이 탈색되어 연한 노란색이 되는 것으로 흡광도를 측정하여 추출물의 radical 소거 활성능을 측정할 수 있다(Blois, 1958). AMW와 AME 측정 결과 모두 농도 의존적으로 올라갈수록 DPPH에 대한 전자공여 활성능이 올라가는 경향을 나타내었다. 모든 농도에서 AME의 활성이 AMW의 활성보다 전자공여능이 높았다. 50 μg/mL의 농도에서 AMW는 42.0%, AME는 80.0%의 활성을 나타내었으며, 가장 높은 농도인 1,000 μg/mL에서 AMW는 86.4%, AME는 91.1%로 높은 활성을 나타내었다(Fig. 1). Oh 등(2008)에 따르면 등나무 꽃 추출물 1,000 μg/mL 농도에서 보라색은 58.21%, 흰색은 93.00%의 활성을 보였다. 이 결과를 비교하여 보면 금화규 꽃 추출물이 1,000 μg/mL 농도에서 높은 항산화 활성을 보였다.
SOD는 활성산소종인 superoxide radical, hydrogen peroxide 등을 과산화수소(H2O2)로 전환시키는 효소이다. 과산화수소로 전환을 촉매하는 pyrogallol의 생성량을 측정하여 Marklund와 Marklund(1974)의 방법을 일부 변형하여 SOD-like ability를 나타내었다. AMW와 AME의 SOD 유사 활성능 측정 결과 농도 의존적으로 높아지는 유의적인 차이는 보이지 않았다. AMW의 활성이 AME의 활성보다 SOD 유사 활성능이 높았다. 1,000 μg/mL에서 AMW는 15.3%, AME는 11.8%, 대조군인 ascorbic acid는 99.1%의 저해활성을 나타내었다(Fig. 1). Jo 등(2014)에 따르면 100 μg/mL 농도에서 아마란스 꽃 추출물은 붉은색 꽃 메탄올 추출물, 보라색 꽃 메탄올 추출물, 붉은색 꽃 열수 추출물, 보라색 꽃 열수 추출물 각각 15.78%, 7.83%, 18.59%, 25.51%의 활성을 나타내었다. 위 실험의 결과 금화규 꽃 추출물은 아마란스 꽃 추출물에 비교하여 보면 낮은 활성을 보였다.
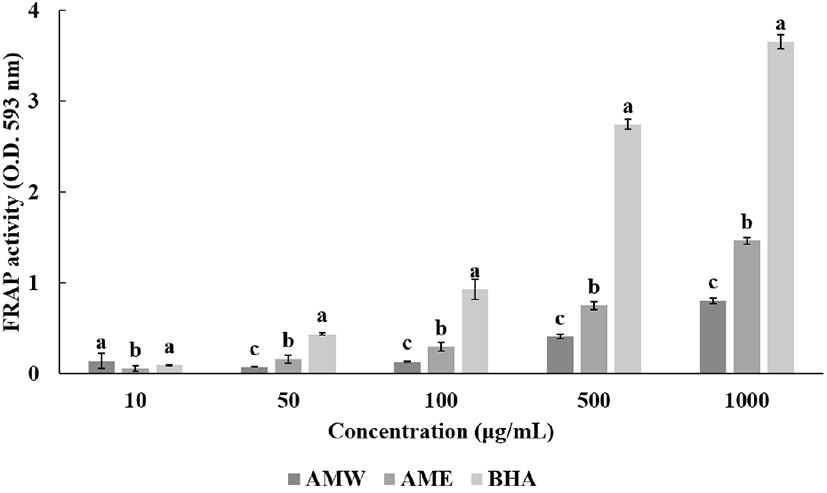
FRAP는 낮은 pH에서 항산화 작용으로 인해 Fe3+-TPTZ가 Fe2+-TPTZ으로 환원된다는 원리를 이용하여 항산화 활성을 측정하는 방법으로, Ferric tripyridyltriazine(Fe3+-TPTZ)복합체에 반응하는 항산화 물질의 양에 의한 색의 변화를 593 nm에서 흡광도 측정을 통하여 계측하였다(Benzie와 Strain, 1996). 따라서 본 실험의 결과는 다음과 같다(Fig. 2). AMW와 AME 측정 결과 모두 농도 의존적으로 올라갈수록 활성이 올라가는 경향을 나타내었다. 모든 농도에서 AME의 활성이 AMW의 활성보다 항산화 활성능이 높았다. 가장 고농도인 1,000 μg/mL에서 AMW는 0.8로 나타났으며, AME는 1.46의 활성을 보였으며, 같은 농도에서 대조군인 BHA는 3.65의 활성을 보였다. Kim 등(2017)에 따르면 매화꽃 봉오리 추출물은 FRAP 측정 결과 에탄올 추출물 2.23, 메탄올 추출물 2.22, 열수 추출물 1.25 순으로 측정되었다. 위 실험결과와 비교했을 때 금화규 꽃 열수 추출물과 에탄올 추출물 모두 매화꽃 봉오리 추출물보다 낮은 항산화능을 가진다.
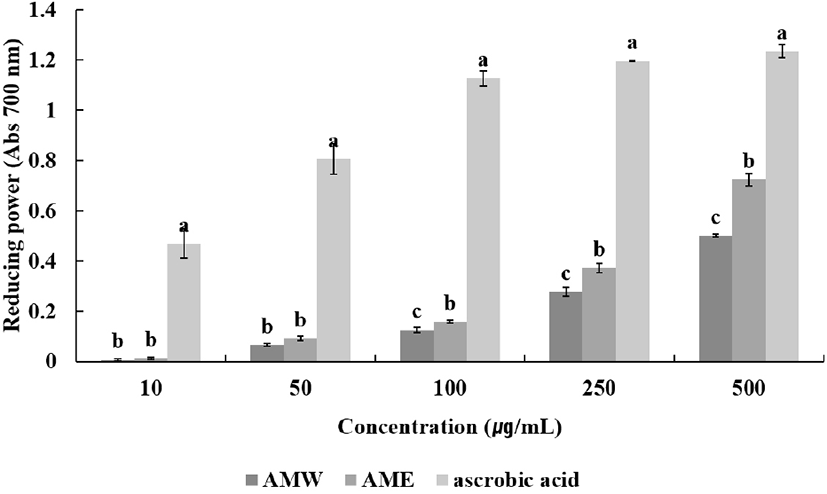
Reducing power는 항산화 활동의 다양한 메커니즘 중 활성산소와 자유라디칼에 전자를 제공하는 능력을 측정하는 실험이다. Ferric-ferricyanide(Fe3+) 혼합물이 수소를 공여하여 ferrous(Fe2+)로 전환하는 환원력을 700 nm 흡광도를 측정하여 값을 나타낸 것이다(Kim 등, 2011). 금화규 열수 추출물과 에탄올 추출물 측정 결과 모두 농도 의존적으로 올라갈수록 환원력이 올라가는 경향을 나타내었다. 모든 농도에서 AME의 활성이 AMW의 활성보다 환원력이 높았다. 최고농도인 500 μg/mL에서 AMW는 0.50, AME는 0.72 ascorbic acid는 1.24의 효과를 나타내었다(Fig. 3). Oh 등(2008)에 따르면 등나무 꽃 추출물 500 μg/mL 농도에서 보라색 꽃 에탄올 추출물은 0.50, 열수 추출물은 0.35의 환원력을 보였으며, 흰색 꽃 에탄올 추출물은 0.35, 열수 추출물은 0.40의 환원력을 보였다. 이러한 결과로 볼 때 금화규 꽃 추출물은 등나무 꽃 추출물보다 상대적으로 높은 환원력을 가진다.
폴리페놀 화합물은 분자에 많은 hydroxyl 그룹으로 −OH을 포함하고 있으며, 항암 및 콜레스테롤 억제 효과가 있다. 또한, free radical을 소거하며 지질과산화반응을 안정화시켜 산화에 따른 스트레스로부터 세포를 보호하는 역할을 한다(Loliger, 1991). 페놀 hydroxyl 그룹은 활성산소종을 효과적으로 제거하고 산화 방지 및 노화 방제제 역할을 한다. 페놀성 화합물은 식물계에 널리 분포되어 있어 2차 대사 산물의 하나로 항산화, 항염 등의 기능을 나타낸다(Bourne, 1976). 금화규 추출물의 페놀 함량을 측정하기 위해 표준용액인 tannic acid를 사용하여 검량선을 작성하여 페놀 함량을 측정하였다. 100 μg/mL의 농도에서 AMW는 127.8 mg TAE/g, AME는 153.39 mg TAE/g의 함량을 나타내었다(Table 1). Woo 등(2010)에 따르면 15종의 꽃으로부터 조제된 추출물은 25.67-68.83 mg/g의 함량을 가지며, 15종 꽃의 평균은 42.91 mg/g의 함량을 가진다. 위 실험의 결과 금화규 꽃 열수 추출물과 70% 에탄올 추출물의 폴리페놀 함량은 15종의 꽃으로부터 조제된 추출물의 평균 함량보다 약 3배 이상의 함량을 가지며, 금화규 꽃 70% 에탄올 추출물이 열수 추출물보다 높은 페놀 함량을 가지고 있다.
| Total phenol contents (mg TAE1)/g) | Total flavonoid contents (mg QE2)/g) | |
|---|---|---|
| AMW (100 μg/mL) | 127.8±1.9 | 145.6±20.0 |
| AME (100 μg/mL) | 153.3±8.4 | 147.6±13.2 |
Results are expressed as means±SD of triplicate data.
AMW, A. manihot flower water extract; AME, A. manihot flower 70% ethanol extract.
플라보노이드는 폴리페놀 화합물 중 하나이며, 항산화 작용뿐만 아니라 다양한 생리활성 기능을 가지는 것으로 알려져 있다(Lee 등, 2011). 금화규 추출물의 플라보노이드 함량을 측정하기 위해 표준용액인 quercetin을 사용하여 검량선을 작성하여 플라보노이드 함량을 측정하였다. 100 μg/mL의 농도에서 AMW는 145.6 mg QE/g, AME는 147.6 mg QE/g의 함량을 나타냈다(Table 1). Yeo 등(2014)에 따르면 찔레꽃 열수 추출물과 에탄올 추출물의 경우 각각 45.31 mg/g, 42.68 mg/g의 플라보노이드 함량을 가진다(Yeo 등, 2014). 위 결과와 비교하여 보면 금화규 꽃 추출물은 찔레꽃 추출물의 플라보노이드 함량보다 상대적으로 높은 함량을 가지고 있다.
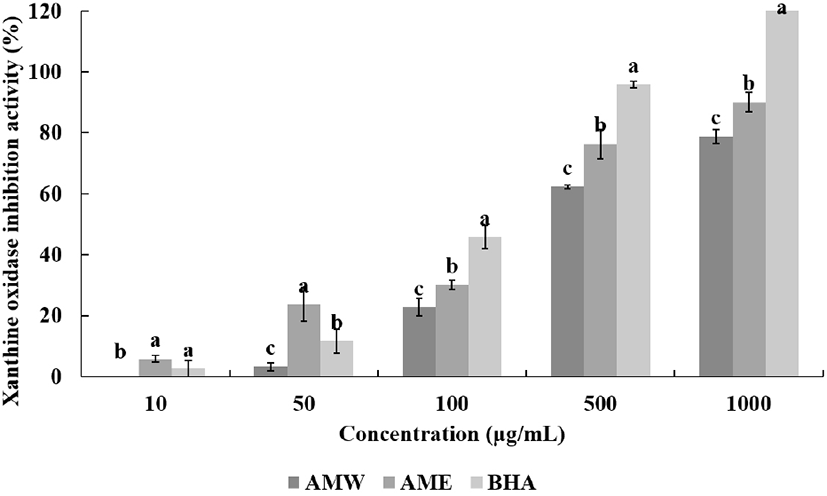
Xanthine oxidase는 생체 내 퓨린 대사에 관여하는 효소이다. 혈장에 과도하게 존재하며, 골절에 축적되어, 심한 통증을 유발하는 통풍과 신장에 침착되어 신장 질환을 일으키는 것으로 알려져 있다(Do 등, 2019). 또한, 생물학적 조직에 산화 손상을 일으키고 염증, 동맥 경화, 암 및 노화와 같은 다양한 질병을 유발할 수 있는 superoxide radical을 생성한다(Duke 등, 1973). 금화규 열수 추출물과 에탄올 추출물 측정 결과 모두 농도 의존적으로 높아질수록 XOase 저해 활성이 우수한 경향을 나타내었다. 모든 농도에서 AME의 활성이 AMW의 활성보다 XOase 저해 활성이 높았다. 최고농도인 1,000 μg/mL에서 AMW는 78.7%, AME는 90%의 활성을 보였으며, 대조군으로 사용된 BHA는 121.5%의 효과를 나타내었다. 저농도인 50 μg/mL에서는 AME가 대조군인 BHA보다 더 높은 활성을 보였다(Fig. 4). Jeon 등(2012)에 따르면 골담초 꽃 추출물 1,000 μg/mL 농도의 경우 열수 추출물은 17.2%의 저해 활성을 나타내었으며, 70% 에탄올 추출물은 49.1%의 저해 활성을 나타내었다. 이러한 결과로 비교하여 금화규 꽃 열수 추출물과 70% 에탄올 추출물은 골담초 열수 추출물과 70% 에탄올 추출물보다 높은 XOase 저해 활성을 가진다.