1. 서론
식초는 효모에 의해 당류 등의 원료를 알코올 발효한 후, 초산균으로 초산 발효시킨 전통 발효식품이다. 효모와 초산균은 신맛을 내는 초산 성분을 비롯하여 각종 휘발성 및 비휘발성 물질인 당, 유기산, 아미노산, 고급 알코올, 에테르 등 각종 영양물질을 생산한다(Jeong과 Lee, 2000). 식초는 예로부터 소염다초로 가정에서 산미 조미료이자 식품을 저장하기 위한 방부제뿐만 아니라 살균제 및 치료제로도 널리 사용되고 있다(Budak 등, 2014; Yeo, 2021). 일반적으로 식초는 식욕을 자극하는 향과 맛을 가져 음식물의 맛을 좋게 할 뿐 아니라 짠맛을 덜어주고 지방을 중화시켜 주는 작용을 한다. 최근에는 생체 조직 내에서 쉽게 분해되어 피를 맑게 하고 열량을 빠르게 발생시켜 피로 해소에 효과가 크며 동맥경화, 고혈압 등의 성인병 예방효과, 식중독균의 살균효과 등 기능성 식품으로 인정되고 있다(Baek 등, 2016; Chou 등, 2015; Lee 등, 2019). 식초에 함유된 유기산과 아미노산 등은 질병에 대한 저항력을 높여 주고 위에서 흡수되어 산성 체질을 개선하는 효과가 있어 다양한 용도로의 개발이 진행되고 있다(Casale 등, 2006; Vogel 등, 2000).
초산균은 당류와 알코올과 같은 불완전한 탄소 기질을 산화시켜 알데히드, 케톤, 및 유기산 같은 대사산물을 주변 매질로 방출하는 산화한 발효(Adachi 등, 2003)를 통해 초산을 생성하기에 식초산업뿐만 아니라 생명공학 기술에 이용되고 있다. 초산균은 다른 미생물보다 적은 바이오매스를 이용해 많은 양의 초산을 생산(López-Garzón와 Straathof, 2014)하기 때문에 곡류식초 및 과일식초, 글루콘산 생산, 바이오 에너지 개발에 널리 사용되는 주요한 산업 미생물이다(Lynch 등, 2019; Misra 등, 2012; Sainz 등, 2016). 특히, 식초 제조에 있어서 가장 중요한 맛과 향은 발효 미생물인 초산균에 의해서 좌우된다. 이러한 초산균은 Acetobacteraceae family에 속하며, 현재까지 Acetobacter, Gluconobacter, Gluconacetobacter, Komagataeibacter 등의 19속(genus)이 보고되었다(Trček 와 Barja, 2015). Acetobacter 속은 알코올과 초산 내성이 강하여 산업적으로 가장 많이 사용하는 초산균이며, 식약처의 식초 생산용 GRAS(generally recognized as safe) 균주로 A. aceti, A. pasteurianus, Glu. europaeus, Glu. oxydans가 식품에 제한적으로 사용할 수가 있다(Ministry of Food and Drug Safety Potal, 식품의 기준 및 규격, 제2021-69호, 2021. 8. 9).
최근, 품질이 우수한 발효식초에 대한 소비자의 관심이 높아지면서 식초 제조용 초산균 관련 연구가 관심을 받고 있다. 더욱이 2018년 8월 나고야 의정서가 시행됨에 따라 수입 초산균을 대체하기 위해 토착 종균의 자원화와 제형화 등 기술 개발 필요성이 대두되고 있다. 현재 보고된 대부분의 연구는 초산균을 이용한 식초 제조와 품질 특성 규명으로서 초산균의 균학적 특성과 생리활성에 관한 보고는 거의 없는 실정이다. 따라서, 본 연구진은 발효식초의 품질 차별화 및 현대화를 위해 소규모 식초를 제조 판매하는 농가형 발효식초로부터 우수한 초산균을 탐색, 발굴하여 균학적 특성과 유용성을 규명하여 산업적 활용성을 증진하고자 한다. 이를 통하여 수입 종균 사용에 따른 로열티 지불을 경감하고 초산균의 국산화에 이바지하고자 한다. 본 논문에서는 전국에서 생산된 농가형 식초들로부터 산 생성능이 우수한 초산균을 분리·동정하여 이들 초산균에 대한 생육 최적조건과 알코올 분해능뿐만 아니라 항균활성과 항산화능, angiotensin converting enzyme(ACE) 저해 활성, 혈전용해 활성, α-Glucosidase 저해 활성 등이 우수한 종균을 식초산업에 사용함으로써 국산 초산균의 활용 가치를 높이고자 한다.
2. 재료 및 방법
초산 생성능이 우수한 균주를 발굴하고자 강원도 홍천의 현미식초(GHR), 서울의 쌀 식초(SR), 경북 영천의 보리식초(GY), 강원도 홍천의 자두식초(GHF), 전북 순창의 현미식초(JS)로부터 초산균 분리용 YGC 고체배지(yeast extract 0.5%, glucose 3.0%, CaCO3 1.0%, agar 2.0%, ethanol 3%, w/v)에 100-200 μL를 spread plating하고 이를 30°C에서 2-3일간 배양하였다. 대조구보다 분리 초산균 집락 주변에 CaCO3가 분해되어 투명 환(clear zone)이 크게 형성된 6주의 초산균을 정성적으로 선발하였다. 이때, 투명 환의 크기는 디지털 캘리퍼스로 지름을 측정하였다.
선발한 초산균 동정은 16S rDNA 유전자 염기서열로 분석하였다. 프라이머는 universal PCR primer인 27F(5’-AGAGTTTGATCCTGGCTCAG-3')와 1492R(5'-GGTTA CCTTGTTACGACTT-3')을 사용하였고, PCR는 initial denaturation 5분, 그리고 94°C에서 45초간 denaturation, 55°C에서 60초간 annealing 및 72°C에서 60초간 extension cycle을 35회 수행하였다. PCR 산물의 염기서열은 ㈜제노셀에 의뢰하여 염기서열을 분석하였고(Kim 등, 2008), Phylogenetic tree는 The National Center for Biotechnology Information(NCBI, http://www.ncbi.nlm.nih.gov/)에서 제공하는 Advanced Blast Search 프로그램을 통하여 GenBank에 보고된 표준 균주와의 염기서열을 비교하여 계통분류학적 유연관계를 분석한 후, MEGA V6.0을 이용하여 Tamura-Nei distance model과 neighborjoining method에 의해 계통도를 작성하였다(Tamura 등, 2013).
분리된 초산균 집락(colony)을 YGC 배지에 도말한 후, 배양 온도별(10, 20, 30, 및 40°C)로 14일 배양하면서 7일 간격으로 CaCO3가 분해되어 나타난 투명 환의 크기(mm)를 측정하여 산 생성능이 우수한 균주를 정성적으로 선발하였다. 측정 방법은 디지털 캘리퍼스를 사용하여 투명 환 지름을 소수점 둘째 자리까지 측정하였는데 환의 크기가 20 mm 이상일 때, 산 생성능을 “+++”, 10 mm 이상을 “++”, 10 mm 미만을 “+”, 생육하지 않을 것을 “-”로 표기하였다. 한편, 초기 pH(2.0, 3.0, 4.0)별로 조정된 액체배지(yeast extract 0.5%, glucose 0.5%, glycerol 1.0%, MgSO4·7H2O 0.02%, ethanol 4.0%, acetic acid 1.0%, w/w)에 초산균 집락(colony) 1 loop를 접종하여 30°C에서 15일 배양하면서 3일 간격으로 샘플링하여 분광광도계(660 nm)로 초산균의 생육능을 정량적으로 조사하였다.
액체 배양한 초산 발효물 10 mL를 취하여 pH meter (Orion 3 star, Thremo Scientific Co., Beverly, MA, USA)로 측정하였다.
각각 분취한 초산 발효물 1 mL에 증류수 9 mL로 희석하여 지시약인 1% phenolphthalein 용액 2-3방울 떨어뜨린 후 0.1N NaOH 중화 적정하여 소비된 용액 양을 acetic acid(%)로 환산하였다.
초산균의 알코올 분해능을 조사하기 위해, ethanol assay kit(K-ETOH, Megazyme Co., Wicklow, Ireland)의 방법에 따라 흡광도(BioTek®, Gen5TM, Winooski, VT, USA) 340 nm에서 잔존한 알코올을 산출하였다(Beutler, 1988). 기질인 알코올로부터 만들어지는 초산은 2가지 효소(alcohol dehydrogenase와 aldehyde dehydrogenase)의 작용으로 생성되기에 알코올 분해능은 두 단계로 분석하였다. 처음에는 alcohol dehydrogenase(ADH) 촉매로 NAD+에 의해 에탄올이 acetaldehyde 산화되는 단계 I(A1)과 aldehyde dehydrogenase(Al-DH)와 NAD+ 존재에서 acetaldehyde가 acetic acid 산화되는 단계 II(A2)를 통해 NADH의 소멸 계수로 잔존 알코올을 측정하였다. 이는 두 단계에서 측정된 340 nm 흡광도(BioTek®, Gen5TM)의 차이(A2-A1)로 환산하였다.
각 초산균의 알코올 소비 관련 계산식, (%) = 100 - [(A2 - A1) of sample / (A2 - A1) of control] × 100]에 의하여 산출하였다.
초산균의 항균활성은 유해 세균인 그람양성(Bacillus cereus 와 Staphylococcus aureus)과 그람음성(E. coli 와 Salmonella typhimurium) 세균에 대해 고체배지에서 Agar 확산법(Kim 등, 2003)으로 측정하였다. 즉 유해 세균을 TSB(tryptic soy broth, L; pancreatic digest of casein 17 g, papaic digest of soybean 3 g, dextrose 2.5 g, sodium chloride 5 g, dipotassium phosphate 2.5 g) 액체배지에서 16시간 이상 배양시켜 활성화한 후, 0.6% TSA top agar에 0.1%(v/v)를 접종하여 평판배지 위에 덮고, 각 초산균(OD660=0.5) 배양액 50 μL을 흡수, 건조한 paper disc(ø8 mm, Toyo Roshi Kaisha, Ltd.)를 올려놓은 후, 30°C에서 24시간 배양하였다. 항균력은 paper disc 주위에 형성된 저해 환의 지름(mm)을 3회 반복한 평균값으로 나타내었다.
분리한 초산균의 항산화 활성은 DPPH(2,2-diphenyl-1-picrylhydrazyl, Sigma-Aldrich, St, Louis, MO, USA) 유리기 소거능과 ABTS(2,2-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid), Sigma-Aldrich) 유리기 소거능으로 측정하였다. DPPH 유리기 소거능은 각 초산균 상등액 0.2 mL에 0.4 mM DPPH 용액 0.8 mL를 가하여 암실에서 10분 반응시킨 후 525 nm 흡광도를 측정하여 소거능을 산출하였다. 대조군으로는 초산균 액체배양 배지를 사용하였다.
ABTS 유리기 소거능은 7.4 mM ABTS와 2.6 mM potassium persulfate를 혼합하여 실온의 암소에 24시간 방치하여 radical을 형성시킨 후, ABTS 용액을 732 nm에서 흡광도가 0.700±0.030이 되도록 phosphate buffer saline(PBS, pH 7.4)로 희석하여 사용하였다. 희석된 용액 950 μL에 각각의 초산균 상등액 50 μL를 가하여 암실에서 10분 반응시킨 후, 732 nm 흡광도를 측정하여 계산식, (%) = 100 - [OD of sample / OD of control] × 100]에 의하여 소거능을 산출하였다.
ACE(angiotensin converting enzyme) 저해 활성은 각각의 초산 발효물의 상등액 50 μL과 450 mM sodium borate buffer(pH 8.3) 2.5 mL에 녹인 2.5 mM 기질(Hippuryl-L-Leucine)을 50 μL 첨가한 후, 5분 동안 37°C에서 반응시켰다. 이에 10 mU ACE 용액 50 μL를 넣고 37°C에서 40분간 반응시켜 1 N HCl 250 μL를 가하여 반응을 정지시키고 ethyl acetate 1.5 mL를 가하여 30초간 교반한 후, 3,000 rpm으로 5분간 원심분리하여 상등액 1 mL를 취한다. 이 상등액을 heat-block 100°C에서 완전히 건조시킨 후, 증류수 1 mL를 넣어 용해하고 228 nm 흡광도에서 측정하였다. 이때 대조구는 시료 대신에 증류수 50 μL를 사용하였고 Blank는 효소원을 첨가하기 전에 1 N HCl 250 μL을 첨가하여 반응을 정지시킨 후 효소원을 첨가하였다. 이때 양성 대조군은 ACE 저해제로 널리 사용되는 captopril(0.01%와 0.1%)을 사용하였고 ACE 저해 활성도는 아래의 식에 따라 계산하였다.
S: Sample의 흡광도
C: Control의 흡광도
SB: Sample blank의 흡광도
CB: Control blank의 흡광도
혈전용해 활성은 Astrup과 Műllertz(1952)의 fibrin 평판법을 응용하여 사용하였다. 먼저 0.17 mol/L 붕산 완충액(pH 7.8) 22 mL에 피브리노겐 110 mg을 실온에서 1시간 방치하면서 녹인 후, 여과지로 불용성 물질을 제거하였다. 붕산 완충액으로 녹인 트롬빈 용액을 제조했다. 여과된 20 mL 피브리노겐 용액에 50 U/mL 트롬빈 용액 1 mL를 섞어 페트리디쉬에 부어 30분 방치하여 굳혔다. 여기에 8 mm paper disk를 올리고 각각의 초산 발효물의 상등액 20 μL를 주입하여 반응시켰다. 37°C에 6시간 이상 배양하면서 투명 환이 형성되는 것을 조사하였다. 양성 대조군으로 플라스민을 농도별로 사용하여 표준곡선을 작성하고 초산균의 혈전 용해능은 플라스민의 투명환 대비 %로 환산하였다.
α-Glucosidase에 대한 저해능은 탄수화물 식이 후 혈당 상승을 억제할 수 있어 항당뇨 활성(α-glucosidase inhibition) 측정법으로 분석하였다. α-Glucosidase inhibition은 α-glucosidase activity assay kit(Sigma-Aldrich, Cat No. MAK123)에서 negative 활성을 100으로 시료의 활성을 환산하여 저해율을 구하였다. 각 초산균 상등액 20 μL에 master reaction mix(assay buffer 200 μL + alpha-NPG substrate 8 μL) 200 μL를 혼합하였다. 흡광도 405 nm에서 초기 값(A405) initial을 측정하고, 이후 37°C에서 20분 반응시킨 후, 최종 흡광도(A405) final을 측정하였다. 양성 대조군으로 acetic acid(12.5 mg/mL)를 사용하였다. α-glucosidase inhibition rate(%)는 다음과 같은 식으로 계산했다.
A405 calibrator: 20분 반응 후 calibrator 흡광도 값
A405 water: 20분 반응 후 water 흡광도 값
3. 결과 및 고찰
농가형 발효식초(강원도, 서울, 경북, 전북)로부터 초산 생성능이 우수한 균주를 선발하기 위해, 탄산칼슘(CaCO3, 1.0%, v/v)이 첨가된 고체배지에서 분리 초산균이 분비한 산에 의해 투명 환(clear zone)을 크게 형성하는 6주를 선별하였다(Table 1). 디지털 캘리퍼스로 측정한 결과, SR-A24와 JS-B7 초산균 투명 환이 30 mm 이상으로 산 생성능이 가장 우수하였고, GHUR-A11-2와 GY-A26은 20 mm 이상, GHF-A37과 JS-C1은 20 mm 미만으로 나타났다. 분리한 6주의 초산균은 대조구로 사용한 A. pasteurianus CV3(KACC 17058) 투명 환(18.2 mm)보다 초산 생성능이 뛰어났다. 이러한 방법은 초산균이 분비한 초산이 탄산칼슘(CaCO3)을 분해하면서 분리 균주 주위에 투명 환이 형성(clear zone)되는 것으로 산 생성능이 우수한 균주를 선발할 수 있다(Baek 등, 2014; Ouoba 등, 2012).
| Acetobacter sp. | Clear zone (mm)1) |
|---|---|
| GHUR-A11-2 | 23.5±0.2d2) |
| SR-A24 | 30.5±0.1b |
| GY-A26 | 24.1±0.1c |
| GHF-A37 | 19.1±0.2e |
| JS-B7 | 34.5±0.2a |
| JS-C1 | 18.5±0.1f |
| CV3 (KACC 17058) | 18.2±0.1g |
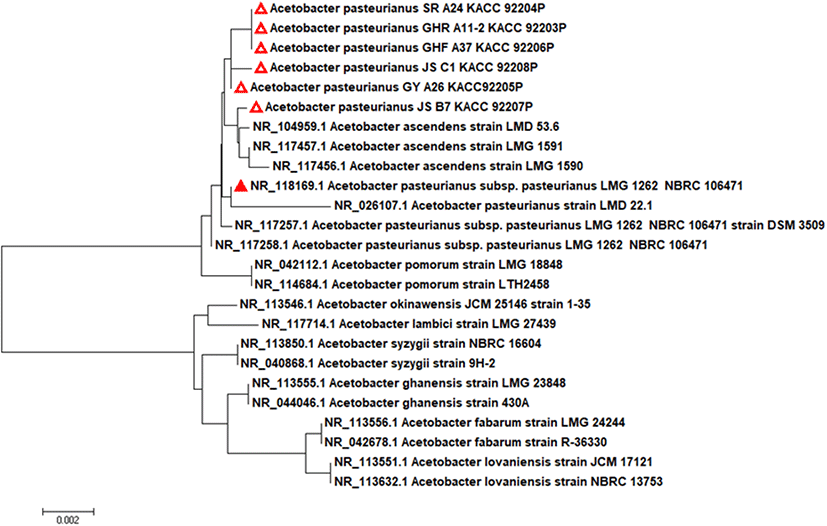
선발된 6주의 초산균을 16S rDNA 염기서열 분석을 통해 동정하였다. Acetobacteraceae 과에 속하는 Acetobacter 종 및 기타 구성원의 19개 유형 균주의 16S rRNA 염기서열을 바탕으로 계통도를 Fig. 1에 나타냈다. 선발된 초산균의 NCBI blast에 의한 염기서열 분석 결과, 모두 A. pasteurianus와 높은 상동성을 나타냈으며 type strain인 A. pasteurianus LMG 1262와 16S rDNA 유전자 염기서열이 99.7% 이상 일치하였다(Table 2). 특히, A. pasteurianus는 초산발효에 사용되는 균주(Matsutani 등, 2013)로서 일본에서는 쌀 식초와 현미식초에 가장 많이 우점하는 균주로 알려져 있다(Nanda 등, 2001).
모든 생명체는 생육 최적 온도 이상이 되면 비활성이 되기 때문에 온도 최적화는 박테리아에게 중요하다. 비활성화가 되면 필수 효소 변성, 세포 구성 성분의 산란을 유발하는 막 손상 및 유기체가 아세트산의 독성 효과에 더 민감해지기 때문이다(Sharafi 등, 2010). 농가형 발효식초로부터 선발한 6주 초산균의 생육능을 조사하기 위해, 다양한 온도(10, 20, 30, 및 40°C) 조건에서 생육시킨 결과를 Table 3에 나타내었다. 14일간 낮은 온도(10, 20°C)에서 배양한 결과, 선발 초산균은 저온에 적응하는 시간이 길어져 잘 생육하지 못하였지만, 30°C에서는 생육이 가장 우수하였다. 흥미로운 것은 GHF-A37를 제외하고는 40°C에서도 생육이 양호하였다. 산업용 식초 생산에서 내열성 AAB 균주에 대한 상한 온도의 연구가 보고된 바 있다(Moonmangmee 등, 2000). 내열성 AAB 균주는 상한 온도(38-40°C)와 높은 알코올(9% 이상)에서도 에탄올을 빠르게 산화시킬 수 있다. Ndoye 등(2006)이 분리한 A. tropicalis와 A. pasteurianus 균주는 40°C와 45°C에서도 생육할 수 있다는 보고가 있어 향후, 식초 산업에 고온과 알코올 내성을 가지는 유용 초산균의 활용 가치가 높아질 것으로 기대된다.
Symbols (size of halo): +++ (more 20 mm), ++ (more 10 mm), + (less 10 mm), - (halo not shown).
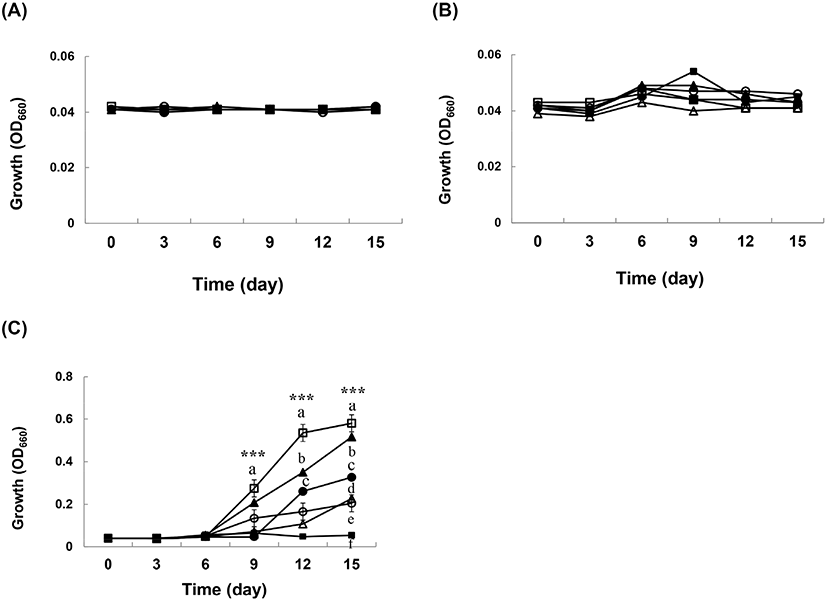
초기 pH 설정에 따른 초산균의 생육능을 조사하기 위해, 30°C에서 15일간 배양한 결과를 Fig. 2에 나타내었다. SR-A24, GY-A26, JS-B7, JS-C1을 제외한 GHUR-A11-2, GHF-A37 초산균은 초기 pH 4에서 배양 9일부터 생육이 양호하였다(Fig. 2(C)). 초기 pH 2와 3에서는 배양 기간과 상관없이 생육 상태가 저조하였다(Fig. 2(A), 2(B)). 초산균(AAB)의 생육과 산 생성 최적 pH는 넓게 잡아 3.0-5.0이다. 반면에 pH 3 이하에서도 잘 생육하는 초산균이 있는데 이는 알코올 농도나 산화 능력과 같은 또 다른 영향 지수를 고려해 보아야 한다. 따라서 산업용 식초를 제조하기에 앞서 생산업체는 발효 최적 조건에 맞추어서 균주를 선택하는 것이 바람직하다고 생각한다.
초산균은 알코올과 같은 탄소원을 세포막에 있는 alcohol dehydrogenase(ADH)와 acetaldehyde dehydrogenase (ALDH)를 통해 초산을 포함한 여러 대사물질을 만들어 세포 밖으로 방출하여 배양 배지에 축적한다(Adachi 등, 2001). 산성화된 주변 환경은 초산균에 스트레스이고 세포 내 항상성을 유지하기 위해 많은 에너지가 사용되기 때문에 초기 생육은 제한적이다. 점점 산에 내성이 생기면 에탄올에서 초산으로서의 전환율이 커지면서 초산의 생물 전환 효과는 증가하게 된다(Illeghems 등, 2013). 그러므로 초산균의 알코올 소비능은 초산균의 고산도 식초를 만드는 균주 선발에 중요한 지표라 생각한다.
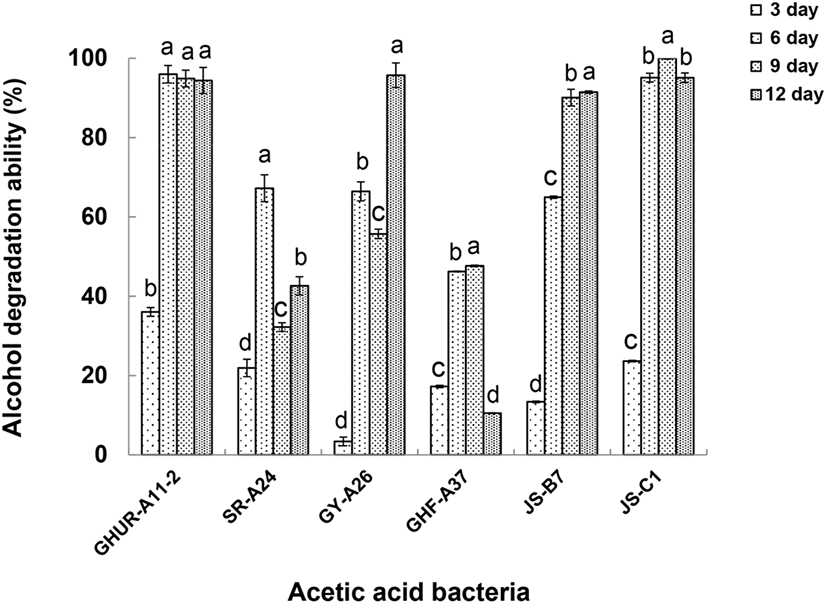
선발한 6주 초산균을 초기 pH 4로 조정한 액체배지(yeast extract 0.5%, glucose 0.5%, glycerin 1%, MgSO4·7H2O 0.02%, acetic acid 1%)에 4% 알코올을 첨가하여 30°C에서 12일 동안 배양하면서 3일 간격으로 알코올 소비능을 계산하였다(Fig. 3). 이때 변화되는 초산균의 산도와 pH를 Table 4에 나타내었다. 초산균이 배양 환경에 적응하고 에너지원(알코올)을 최대로 소비하면서 산도가 점진적으로 높아지고 pH가 낮아지는 것을 볼 수 있다. 균주 GHUR-A11-2와 JS-C1는 배양 6일에 알코올 소비능이 최대 96%, 95%로 산도는 4.3%, 4.0%, pH 3.4, 3.5로 각각 투입된 알코올이 모두 초산발효로 전환되는 것을 알 수 있다. JS-B7 초산균은 배양 9일에 알코올 소비능이 최대 90%로 산도 5.0%, pH 3.4의 효과를, GY-A26은 배양 12일에 알코올 소비능이 최대 96%로 산도 4.9%, pH 3.6을 나타내었다. SR-A24와 GHF-A37은 알코올 소비능이 다른 균주에 비해 현저히 떨어지고 초산 생성과 이에 따른 pH 변화도 미미하였다. 위의 결과를 통해 알코올 소비능이 최대일 때 최대의 산 생성과 낮은 pH의 상관성을 볼 수 있었다.
선발한 초산균 6주의 유해 세균 증식 억제 관련 항균력을 Table 5에 나타낸 것처럼 그람양성 세균인 B. cereus와 St. aureus, 그람음성 세균 E. coli 와 S. typhimurium에 대해 대부분 항균활성을 나타내었다. 양성 대조구로서 초산균의 주요 유기산인 acetic acid(AA)를 농도별(mg/mL)로 처리하여 비교하였다.
유기산은 방부제로 식품 안전용으로 많이 사용(Lingham 등, 2012)되고 FDA에서 일반적으로 안전한 물질(GRAS)로 인정되고 있으며, 유럽 연합 집행위원회와 FAO/WHO 식품 첨가물로 승인된 대사산물이다(Surekha 등, 2000). 다양한 유형의 병원성 세균에 대한 유기산의 항균효과는 타르타르산, 구연산, 젖산, 말산, 프로피온산 및 초산(Lingham 등, 2012)이며 그 중, 초산은 살모넬라 또는 대장균과 같은 세균의 오염을 제거하고 저장 기간을 연장하기 위해 가금류, 쇠고기 및 돼지고기를 포함한 육류의 대표적인 항균제로 쓰이고 있다(Sakhare 등, 1999).
농가형 발효식초에서 분리한 6주의 초산균은 St. aureus, E. coli, S. typhimurium보다 그람양성 세균인 B. cereus가 더 효과적인 항균력을 나타내었다. 그람양성 세균은 외막을 가지고 있어서 그람 음성균보다 다양한 종류의 항균제에 민감하다는 보고가 알려져 있다(Hwang 등, 1999). 초산균의 항균활성은 초산균이 생산하는 초산으로 인해, 주변 환경의 pH가 낮아져 유해 세균의 세포벽 및 세포막이 약화되고 세포 구조가 붕괴하여 세포의 내용물이 세포 외로 유출(Axe와 Bailey, 1995; Ishii 등, 2012; Russel, 1992)됨으로써 균의 성장이 억제되는 것으로 여겨진다.
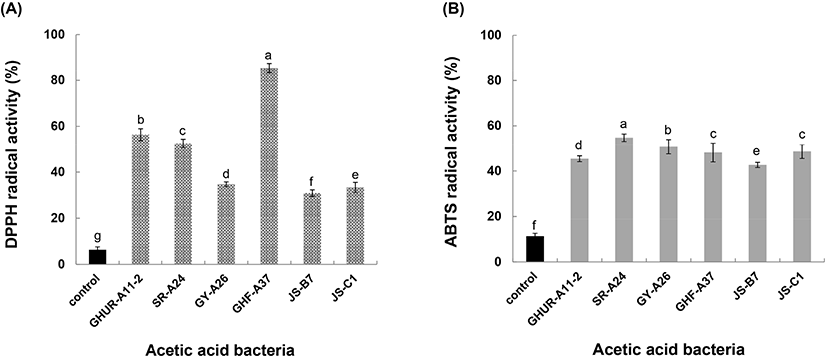
항산화제는 세포의 산화 스트레스를 감소시키고 인간의 질병을 치료하는 데 효과적인 물질로 알려져 있다(Nishidai 등, 2000). DPPH 라디칼(보라색)은 전자공여체인 항산화제와 만나면 전자를 얻어 환원(노란색/무색)이 되며, 환원된 정도가 클수록 측정 흡광도 값은 작아지고 상대적으로 전자 공여능은 높아진다. 6주 초산균의 DPPH 라디칼 소거능을 조사한 결과, 대조구(6.3%)보다 5배(50.9%)에서 15배(85.4%)의 높은 항산화 활성을 나타내었다(Fig. 4(A)). 이와 더불어 ABTS 라디칼 소거능은 ABTS와 potassium persulfate 반응으로 ABTS 라디칼(청록색) 생성이 시료의 첨가 때문에 연한 녹색으로 decolorization 되는 항산화능을 측정할 수 있다. 선발한 6주 초산균의 ABTS 라디칼 소거능은 대조구(11.31%)보다 4-5배(42.7%-54.8%)의 활성 효과를 나타냈다(Fig. 4(B)). 따라서 활성 라디칼에 전자 공여능이 큰 전자공여체는 식품 중의 지방 산화를 억제하고 인체 내 활성 라디칼에 의한 노화를 억제하는 작용을 하므로 6주 초산균의 산업적 활용 가치가 기대된다.
고혈압이 발생하는 작용에서 renin-angiotensin system은 혈압조절이 매우 중요한 역할을 한다. ACE은 angiotensin I에서 angiotensin II를 합성하는 마지막 단계에 관여하는 효소이다(Noh와 Song, 2001). Angiotensin II는 A-II 수용체와 결합하여 동맥과 소동맥을 수축시키고 부신피질을 흥분시켜 알도스테론의 유리를 촉진해 결과적으로 혈압의 증가를 가져온다. 따라서 ACE 저해물질은 ACE의 활성을 억제함으로써 고혈압을 직접적으로 억제할 수 있다(Funayama와 Hikono, 1979). ACE 저해 작용을 하는 대표적인 약물로는 captopril이 알려져 있다(Vermeirsscna 등, 2002). 선발한 각각의 초산균 배양액으로부터 얻은 상등액을 취하여 ACE 저해 활성 결과를 Fig. 5(A)에 나타내었다. 현재, 시판되는 항고혈압제인 captopril 0.1%는 138%, 0.01%는 78%의 ACE 저해 활성을 보였다. 농가형 발효식초에서 선발한 GHUR-A11-2와 SR-A24 및 JS-C1 초산균은 174.9%와 154.1%, 154.6%로 양성 대조군인 captopril (0.1%)보다 높은 ACE 저해 활성 효과를 보였다. 초산균 GY-A26은 64.8%로, GHF-A37은 11.5%의 ACE 저해 활성을 보여 양성대조군 0.01% captopril보다 낮은 효과를 나타내었다. 현재, 항고혈압제로 사용되는 captopril(0.1%)보다 ACE 저해 활성에 영향력을 발휘한 GHUR-A11-2, SR-A24 및 JS-C1 초산균의 초산 물질이 효과적으로 영향력을 미치는지는 초산(AA 12.5 mg/mL)의 157% ACE 저해 활성이 잘 보여 주고 있다. 일반적으로 단백질의 아미드 결합과 페놀성 수산기 간의 수소결합에 의한 반응으로서 단백질과 복합체의 침전물을 형성하는 이러한 반응은 pH, 이온강도, 단백질 및 phenol 농도에 의한 상호작용으로 비경쟁적 효소를 저해함으로써 불활성화를 일으키는 것으로 보고되었다(Funayama와 Hikono, 1979). 합성 고혈압 치료제의 부작용에 대비하여 식품 유래의 ACE 저해 활성물질에 관한 연구가 요구되는 시점에서 농가형 발효식초부터 선발한 초산균이 ACE 저해 활성이 높아 식초산업 활용성이 기대된다(Fig. 5(A)).
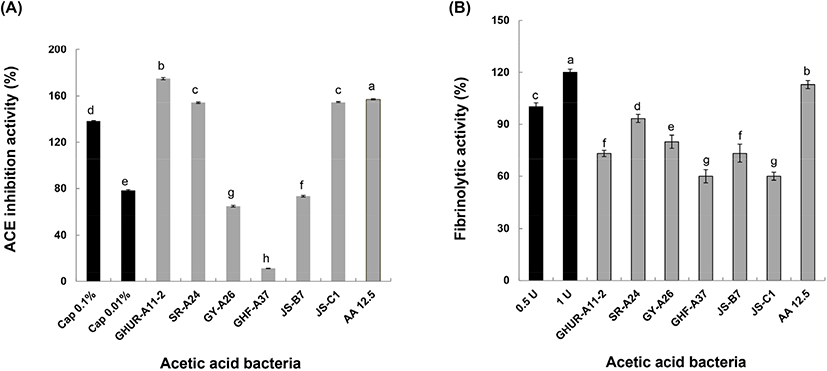
한편, 선발한 초산균의 혈전용해 활성은 피브린 평판에서 투명 환의 크기로 조사하였다. 일반적으로 지혈 과정에서 피브리노겐이 피브린으로 전환되어 혈전이 형성된다(Yun 등, 1996). 그러나 손상된 혈관이 회복되면서 혈전은 떨어져 나오고 플라스민에 의해 혈관의 흐름이 정상적으로 유지될 수 있기(Lee 등, 2001) 때문에 이러한 혈전 용해능은 혈압을 정상적으로 유지하는 것과 관련이 있다. 양성 대조군 플라스민을 농도별로 표준곡선을 작성하고 이들 초산균의 혈전 용해능은 생성한 플라스민의 투명 환 대비(%)로 환산하여 Fig. 5(B)에 나타내었다. 플라스민 0,5 U(15 mm) 대비 각 균주의 혈전 용해능은 초산(AA 12.5 mg/mL)의 113% 활성만큼이나 SR-A24가 93.3%(14 mm)로 제일 높았고, GHUR-A11-2와 JS-B7은 73.3%(11 mm), GY-A26은 80.0%(12 mm), GHF-A37과 JS-C1은 60.0%(9 mm)의 효과를 나타냈다. 식품 유래의 혈전용해 효소를 찾는 연구들이 수행되고 발효식품으로부터 혈전용해 효소 생산 균주의 분리가 요구되는 관점에서 A. pasteurianus를 이용한 양파 식초의 혈전 용해능의 경우, 플라스민의 활성에 대한 1.5배 활성을 보인 Jeong 등(2016)의 보고를 참조하더라도 본 연구에서 선발한 6주의 A. pasteurianus는 혈전 용해능이 뛰어난 기능성 식품으로 활용성이 기대된다.
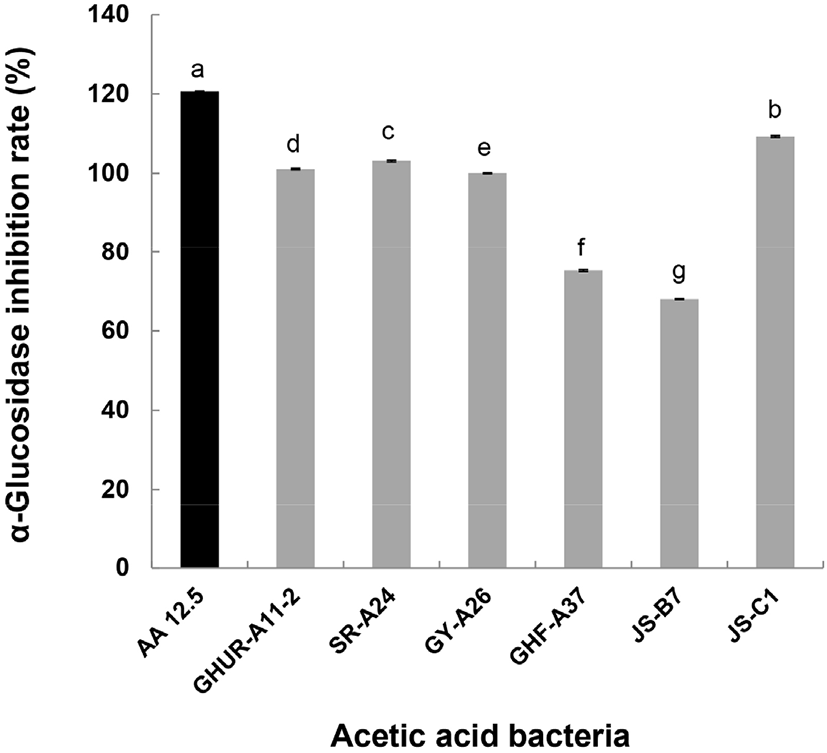
α-Glucosidase는 α-amylase에 의해 분해된 이당류를 최종적으로 단당류로 분해하여 소장의 융모로 흡수되어 혈관으로 이동되기 때문에 이러한 효소의 활성 저해는 당질 가수분해와 흡수과정을 지연시킴으로 식후 혈당이 급격히 상승하는 것을 억제할 수 있다(Shinde 등, 2008). Baron (1998)은 α-glucosidase 저해제는 당뇨와 같은 당질 관련 질병을 위한 치료제 개발에 유용하다고 보고하였다. 6주 초산균의 α-glucosidase 저해능을 Fig. 6에 나타냈다. Positive control로 사용된 12.5 mg/mL acetic acid(AA 12.5)는 120.6%의 저해능을 나타냈다. 초산균 GHF-A37(75.3%)과 JS-B7(68.0%)를 제외한 나머지 초산균의 항당뇨 활성은 100% 이상의 활성을 나타냈다(96.9%-103.1%). 이들 초산균은 기능성이 뛰어난 후보 균주들로 초산균을 이용한 꾸지뽕 발효식초의 α-glucosidase 저해능이 91.40%(발효 72 hr)였음을 보고한 Yim 등(2015) 발표가 좋은 예라 할 수 있다.