1. 서론
전통주 제조시에는 다양한 미생물이 관여하며, 이러한 미생물의 종류 및 활성 등에 따라서 술의 품질이 결정된다(Han 등, 1997; Kim 등, 1997; Park 등, 2002). 따라서 전통주 연구에서는 재래누룩의 미생물 군집이 발효 과정에 따른 발효 특성에 미치는 영향과 더불어 술의 향, 맛과 같은 관능적 특성에 미치는 영향을 밝히는 것이 중요하다(Park 등, 2018). 과거 술은 규제 대상의 하나로서 산업화와 전통주 관련 연구가 부족한 실정이다. 그러나 최근 한국 문화의 세계화와 한류의 영향으로 국내·외적으로 전통주에 대한 관심이 높아지고 있으며, 전통주 복원에 대한 노력도 시도되고 있다(Yeo 등, 2010). 누룩은 원료, 곡물의 분쇄정도, 배양 환경, 제조 시기, 성형 형태 등에 따라 여러 가지 종류로 나누어지고 그 제조법 또한 다양하다(Bae 등, 2002). 일반적인 누룩의 제조방식은 밀 등 주재료를 물과 함께 섞어 원반모양 등으로 성형하고, 볏짚, 연잎, 공기 등에 존재하는 미생물을 누룩 내외부로 번식시켜 숙성한 후 건조하는 방식으로 이루어져 있다(Yang 등, 2011). 누룩은 다양한 미생물이 생육하기 때문에 전분, 단백질, 지방 등을 분해하는 효소뿐 아니라 미생물에 의해 수 많은 대사산물이 생성된다(Park 등, 1995). 이렇게 누룩 제조 시 생성되는 미생물과 효소, 대사산물 등은 차후 알코올 발효에서 주류의 품질이나 생산량에 영향을 미쳐 전통주 제조에 있어서 가장 중요한 요소라고 할 수 있다. 누룩의 미생물에 관한 연구는 1970년대부터 일부 연구되다가(Song 등, 2013), 최근 유전자 분석 등을 활용한 연구들을 통해 Aspergillus 속, Lichtheimia 속, Rhizopus 속, Saccharomycopsis 속, Saccharomyces 속, Monascus 속 등의 곰팡이와 Pediococcus 속, Weissella 속, Lactobacillus 속 등과 같은 젖산균, Bacillus 속의 고초균 등의 다양한 세균이 생육하는 것으로 보고되어지고 있다(Bal 등, 2014; Bal 등, 2015; Jung 등, 2012; Kim 등, 2014; Song 등, 2013). 최근 차세대염기서열 분석의 개발로 다양한 발효식품 중 미생물 군집 분석이 보다 정확하게 가능해졌다. 과거에는 미생물을 분리·동정된 미생물만 확인 가능하였지만, 현재는 기술의 발달로 분리하기 어려운 미생물까지 확인할 수 있게 되었다(Koo 등, 2018). 현재까지 누룩에 관한 대부분의 연구는 누룩을 이용해 제조된 발효주의 품질 특성에 관한 내용에 치우쳐 있고, 누룩 자체의 배양 특성에 대한 연구는 부족한 실정이다. 따라서 본 연구에서는 일반적인 방법으로 제조한 누룩의 배양기간 중 미생물 천이와 품질 특성 등을 분석하였는 바, 그 결과를 보고하고자 한다.
2. 재료 및 방법
밀을 분쇄한 후, 원료 무게 대비 25%의 물을 가하여 혼합한 후 지름 22 cm의 원형 틀에 넣고 누룩 성형기를 이용하여 4.5 cm의 두께로 성형하였다. 제조된 누룩은 30°C, 습도 80% 조건에서 30일간 배양하였으며, 누룩 품질을 분석하기 위해 배양기간별(0, 1, 2, 3, 4, 5, 7, 10, 14 및 30일)로 샘플링하여 누룩의 배양 특성을 조사하였다.
각 시료는 일루미나 16S 메타게놈 시퀀싱 라이브러리 프로토콜에 따라 준비하였다. DNA의 총량과 품질은 PicoGreen (PerkinElmer, Waltham, USA)과 Nanodrop (Agilent, Santa Clara, USA)을 이용하여 측정하였다. 세균의 군집분석은 16S ribosomal RNA(16S rRNA) 유전자의 V3-V4 영역을 증폭하는 프라이머(forward: 5' TCGTCGGCAGCGT CAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG, reverse: 5' GTCTCGTGGGCTCGGAGATGTGT ATAAGAGACAGGACTACHVGGGTATCTAATCC)를 사용하였고, 진균의 군집분석은 internal transcribed spacer(ITS) 유전자의 ITS3-ITS4 영역을 증폭하는 프라이머(forward: 5' TCGTCGGCAGCGTCAGATGTGTATA AGAGACAGGCATCGATGAAGAACGCAGC, reverse: 5' GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGTCCTCCGCTTATTGATATGC)를 사용하였다. 이어서 다중 인덱스와 일루미나 시퀀싱어답터 부착을 위해 limited-cycle amplification을 8 cycle 진행하였다. 최종 산물은 PicoGreen으로 정규화와 통합하였고, TapeStation DNA Screentape D1000(Agilent, Santa Clara, CA, USA)을 이용하여 라이브러리 사이즈를 확인하였다. 메타게놈 염기서열 분석은 Macrogen(Seoul, Korea)에 의뢰하여 분석을 진행하였다,
메타게놈 시퀀싱 결과는 MSR(MiSeq Reporter)로 FASTQ 파일을 생성하고, Burrows-Wheller Aligner를 사용하여 PhiX 시퀀스를 제거하였다. 각 샘플별 paired-end data는 FLASH 1.2.11(JOHNS HOPKINS UNIVERSITY CCB, Baltimore, USA)를 사용하여 분류하였다. 세균은 총 시퀀스가 440-465 bp인 고품질 서열을, 진균은 총 시퀀스가 300-430 bp인 고품질 서열을 취했다. 얻어진 시퀀스는 CD-HIT-OTU(Weizhong Li's Group at J. Craig Venter Institute, San Diego, USA)를 사용하여 시퀀스에러로 간주되는 낮은 품질의 시퀀스, 모호한 시퀀스, 키메라 시퀀스 등을 제거하고, 97% 이상의 서열 유사도를 바탕으로 군집화하여 종 수준의 OTU(operational taxonomic units)를 선발하였다. 각 OTU의 대표서열은 각각의 데이터베이스(세균: RDP release 11, 진균: UNITE 6.0)에 UCLUST (Edgar 등, 2010)를 수행하였고, 유사성이 가장 높은 것의 유기체 구분 정보로 분류 할당하였다. 이를 바탕으로 QIIME v1.8(Knight and Caporaso lab, USA)을 이용하여 미생물 군집 분석을 수행하였다. 샘플 내 미생물 군집의 종 다양도와 균등도 확인을 위해, Shannon index, inversed simpson Index를 산출하고, rarefaction curve, Chao1으로부터 alpha diversity를 분석하였다.
효소활성 측정을 위한 조효소액은 시료 20 g에 0.5% NaCl(Sodium chloride, Junsei Chemical Co., Ltd., Tokyo, Japan) 함유 10 mM acetate buffer(pH 5.0) 100 mL를 가하고 실온에서 3시간 동안 3-4회 정도 교반하여 추출한 후 원심분리기(CR 22G, Hitachi Koki Co., Tokyo, Japan)로 원심분리(7,000 rpm, 15 min, 4°C) 한 후, 상등액을 회수한 다음 여과지(filter paper No. 2, Whatman International Ltd., Maidstone, England)를 이용해 여과하여 사용하였다.
Kikkoman 당화력분별정량키트(60212, Kikkoman Co., Tokyo, Japan)의 기질용액과 효소용액을 각 0.5 mL씩 혼합한 반응액을 1 mL씩 시험관에 분주하였다. 37°C에서 5분간 예열한 후, 0.1 mL의 조효소액을 첨가하고 교반하여 37°C에서 10분간 반응시켰다. 반응정지액 2 mL를 넣고 혼합하여 400 nm에서 흡광도를 측정하였다. Blank는 반응액 1 mL를 15분간 가온하였다. 반응정지액 2 mL와 조효소액 0.1 mL를 넣고 400 nm에서 흡광도를 측정하였다.
Es: 시료의 흡광도
Eb: Blank 흡광도
Kikkoman α-Amylase 정량키트(Kikkoman Co., Tokyo, Japan)의 기질용액과 효소용액을 각 0.5 mL씩 섞은 반응액을 1 mL씩 시험관에 분주하여 37°C에서 5분간 예열하였다. 0.1 mL의 조효소액을 넣고 교반하여 37°C에서 10분간 반응시켰다. 반응정지액 2 mL를 넣고 400 nm에서 흡광도를 측정하였다. Blank는 기질용액, 효소용액 0.5 mL씩 넣은 반응액 1 mL를 15분간 가온하였다. 반응정지액 2 mL와 조효소액 0.1 mL를 넣고 400 nm에서 흡광도를 측정한 값을 사용하였다.
Es: 시료의 흡광도
Eb: Blank 흡광도
Kikkoman carboxy peptidase 분석키트(Kikkoman Co., Tokyo, Japan)의 기질용액을 1 mL를 37°C에서 5분간 예열하였다. 0.1 mL의 조효소액을 넣고 교반하여 37°C에서 10분간 반응시켰다. 반응정지액 2 mL를 넣고 5분간 예열하였다. 정량효소액을 0.1 mL를 혼합하여 20분간 정량반응을 실시하였다. 여기에 정량발색액을 0.1 mL를 혼합하여 10분간 반응시킨 후 460 nm에서 흡광도를 측정하였다. Blank는 기질용액 1 mL를 15분간 가온하였다. 반응정지액 2 mL와 조효소액 0.1 mL를 넣고 이후의 반응은 효소반응액과 동일하게 처리하였다. 표준반응액은 조효소액 대신 표준액 0.1 mL를 사용하였다. 증류수 반응액은 증류수 0.1 mL를 넣고 그 외의 반응은 효소반응액과 동일하게 처리하였다.
Es: 시료의 흡광도
Eb: Blank 흡광도
Estd: 표준반응액의 흡광도
Ec: 증류수 반응액의 흡광도
Lipase 분석키트의 calibrator와 증류수를 각 96-well plate에 150 μL씩 분주하고, 각 시료 10 μL와 lipase 분석 키트의 Color Reagent 5 mg과 Assay Buffer 140 μL와 BALB Reagent 8 μL를 섞어 제조한 Working Reagent 140 μL를 섞어 96-well plate에 150 μL씩 분주하였다. 96-well plate를 37°C Incubator에서 10분간 반응시키고 412 nm로 측정한 후, 37°C Incubator에서 10분간 더 반응시킨 후 412 nm로 측정하여 아래 식으로 산출하였다.
3. 결과 및 고찰
주류 제조시 전분 등의 탄수화물이 곰팡이에서 분비되는 당화효소에 의하여 당류가 생성되고 이를 이용하는 효모에 의해 혐기적인 상태에서 에틸알코올이 생성된다. 특히 효모는 당을 이용하여 알코올을 만들어 내는 미생물로 대표적으로는 Saccharomyces cerevisiae가 있으며, 주류 제조에 널리 사용되고 있다. 따라서 진균류는 주류 제조에 있어서 중요한 역할을 한다고 할 수 있다(Park 등, 2018).
진균류를 분석한 재래누룩의 다양도(diversity)와 풍부도(richness)를 나타내는 alpha diversity 지수를 Table 1에 나타내었다. Sequence similarity를 기반으로 측정된 OTUs의 개수는 배양 0일차 70에서 급격하게 감소하여 배양 1일차에 22로 나타났으며, 그 후 배양 30일차까지 19-23으로 비슷한 경향을 나타내었다. Chao 1로 표현되는 미생물의 풍부도는 배양 0일차 70으로 나타났으며, 그 후 감소하여 19.25-34로 나타내었다. 이는 재래누룩의 배양이 진행됨에 따라 초기 진균류 중 배양환경에서 생존하기 적합한 종이 우점하며 다양성이 감소하는 것으로 판단된다. 재래누룩의 Shannon 값은 발효 0일차 2.66으로 나타난 후 배양 1일차 급격하게 감소하여 0.11을 나타내었고, 그 후 점차 증가하여 배양 30일차에는 1.07을 나타내었다.
누룩에서 세균은 알코올발효보다 젖산균에 의한 pH를 낮추어 주류 품질 저하를 유발할 수 있는 세균들을 제어하고, 다양한 유기산, 유리당 및 유리아미노산 등을 생성하여 주류의 품질과 맛을 결정짓는 역할을 한다(Park 등, 2018).
세균류를 분석한 재래누룩의 다양도(diversity)와 풍부도(richness)를 나타내는 alpha diversity 지수를 Table 1에 나타내었다. 재래누룩의 OTUs의 개수는 배양초기 65에서 점차 감소하다가 배양 4일차에 급격히 증가하여 72를 보인 후 다시 서서히 감소하여 배양 30일차에는 43을 나타내었다. Chao 1로 표현되는 미생물의 풍부도는 배양 0-3일차에 72에서 28까지 감소하다가 배양 4일차에 72로 급격한 증가를 보인 후 서서히 감소하여 배양 30일차에 45를 나타내었다. 재래누룩의 Shannon 값은 배양 2일차에 2.26으로 가장 높은 값을 나타낸 후 배양 30일까지 서서히 감소하였다.
본 연구에서 제조한 누룩의 배양기간에 따른 진균, 세균류 군집 분석 결과를 Fig. 1에 나타냈다. 누룩에는 젖산균, 효모, 곰팡이를 비롯한 세균 등 다양한 미생물이 존재한다. 대표적으로 누룩에 존재하는 미생물은 Aspergillus sp., Rhizopus sp., Mucor sp., Penicillium sp., Saccharomyces cerevisiae 등이 있으며, 누룩의 제조 과정 특성상 생전분 분해능력이 우수한 Rhizopus oryzae가 주요 균주로 분리된다. 이러한 누룩에 존재하는 여러 미생물은 알코올 발효력과 효소활성, 유기산과 유리아미노산 생성능 등에서 차이를 보이게 되고 결국 막걸리의 향기, 색, 맛 등의 품질 특성에 영향을 미치게 된다(Kim 등, 2018).
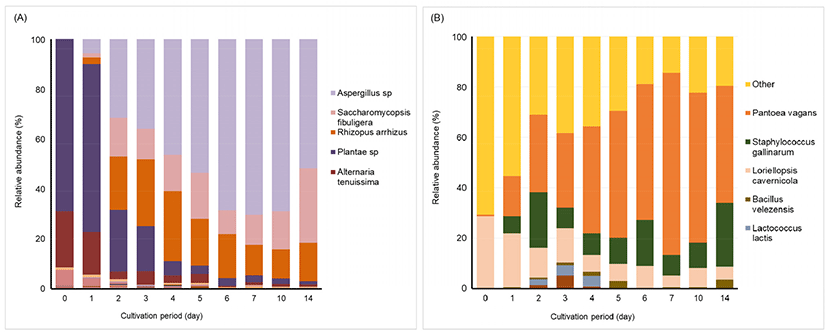
누룩에 생육하고 있는 주요 곰팡이 중 배양과정에서 핵심적인 역할을 하는 것은 Aspergillus 속, Rhizopus 속이 있으며, 이 곰팡이는 α-amylase, glucoamylase 등 전분을 분해하는 효소를 분비하여 곡류 중 전분을 당화하는 역할을 한다(Choi 등, 2016). Aspergillus 속은 증자한 쌀에서 생육력이 높게 나타나며 강력한 당화효소를 생성하고, Rhizopus 속은 소맥분의 증자여부에 상관없이 생육 및 효소 생성도가 높다(Kim 등, 2018).
현재까지 16S rRNA와 28S rRNA gene sequencing, DGGE, pyrosequencing 등을 이용한 전통누룩의 균주에 관한 연구 결과, 진균류로 Aspergillus, Rhizopus, Mucor, Penicillum, Absidia, Actionmucor, Geotrichum, Cephalosporium, Curvularia, Monascus, Botryotrichum, Torula, Saccharomycopsis, Aamyolmyces, Trichosporon, Mycoderma, Endomyces, Willia, Sachsia, Monilia, Oidium, Endomycopsis, Talaromyces, Rhosotorula, Lichtheimia, Paecilomyces 속이 보고된 바 있다(Nam 등, 2015).
배양 초기에는 아직 밝혀지지 않은 미생물이 다량 존재하였으나 점차 Ascomycota 문에 속하는 Aspergillus 속이 2일차부터 급상승하여 7일차에 70.4%로 최댓값을 나타냈다. 이 외에도 non-Saccharomyces로 전분을 분해하여 이용할 수 있다고(González 등, 2008) 알려진 Saccharmycopsis fibuligera도 지속적으로 분포율이 높아져 4일차에 28.01%를 차지하였다. 이 외에도 R. arrhizus는 2일차부터 급격히 상승하여 4일차에는 28.0%로 최댓값을 나타냈다. R. arrhizus는 차세대염기서열분석시, R. oryzae와 구분이 어려우며, R. oryzae는 메주와 재래누룩에서 주로 분리되는 균으로 알려져 있다. 우리나라와 더불어 중국, 일본 등에서 전통주를 제조할 때 사용되는 균이기도 하다. 일반적으로 R. arrhizus는 병원균으로도 알려져 있으나, R. oryzae는 누룩에서 주로 분리되는 곰팡이로 전통적인 발효식품 제조에서 중요한 곰팡이로 알려져 있다(Kim 등, 2014). 하지만 이를 활용하기 위해서는 추가적인 안전성 검사는 필요할 것으로 생각된다. Aspergillus 속은 0일차에 0.01% 비율로 매우 낮은 비율을 차지했지만 배양기간이 경과됨에 따라 증가하는 경향을 나타내었다. 이는 누룩에서 R. oryzae가 배양 초기 1차 침투자로 누룩 내 쉽게 이용할 수 있는 기질을 이용하지만(Kim 등, 2014). 온도에 민감하여 배양기간 동안 누룩 내부 온도가 올라가면서 점차 A. oryzae와 같은 고온성 곰팡이와의 경쟁에서 밀려나 감소하는 것으로 사료된다(Yang 등, 2011).
과거 누룩의 세균에 대한 고찰(Yu 등, 1998)에서 국내 누룩에서 분리된 세균은 5종의 Bacillus 속과 4종의 Microcococcus 속을 포함하여 총 9속, 17종이 분리되었다고 보고되었고, 1945년 이후 누룩의 세균에 관한 연구에서는 Lactobacillus, Lactococcus, Leuconostoc, Pediococcus 속 등의 유산균을 포함하여 15속, 39종이 분리되었다고 보고된 바 있다(Yu와 Yu, 2011). 또한, 파이로시퀀싱을 이용한 Park 등(2018)의 상업용 전통 누룩의 미생물에 관한 연구에서는 Leuconostoc 속, Lactobacillus 속, Pediococcus 속 등과 같은 유산균 이외에 방선균인 Proteobacteria 문에 속하는 Ralstonia 속, Saccharopolyspora 속 등의 다양한 원핵 미생물 균종들이 검출되었다. 하지만 이들이 술덧 발효 중 어떠한 역할을 하는지에 관한 연구가 미미한 실정이다.
배양기간에 따른 누룩의 세균류 군집 분석 결과, Pantoea vagans은 배양 0일차부터 서서히 증가하여 배양 7일차에 69.76%를 최댓값은 나타냈다. 이후 배양 완료일까지 감소하는 경향을 보였지만 14일차에도 44.80%로 가장 우점하고 있었다. 누룩 중 가장 우점하고 있는 Pantoea vagans은 토양, 물과 같은 자연에 분포하며 이 중 일부 종은 무기 인산 분해능, 식물 병 저항성 증진 등의 유익한 작용을 하는 것으로 알려져 있으며, 특히 본 연구에서 확인된 Pantoea vagans는 다양한 유기산 생성으로 pH를 감소시켜 무기 인산 분해 활성을 나타낸다고 보고하였다(Yun 등, 2016).
본 연구에서 제조한 누룩의 배양기간에 따른 수분함량, pH, 총산, 아미노산 변화를 Table 2에 나타내었다.
누룩의 수분함량은 배양이 진행될수록 감소하는 경향을 나타내었으며, 배양 초기 대비 종료시점에 40.81% 감소율을 나타내었다. 누룩의 성형 직후 수분함량은 29.97%이었으며, 배양 0일차에서 2일차까지 누룩의 수분함량이 급격하게 감소하다가 배양기간이 경과함에 따라 서서히 감소하여 배양 30일차에는 12.23%의 수분함량을 나타내었다. 이러한 누룩의 수분함량 감소는 배양 중 미생물에 의한 이용 또는 증발에 의한 것으로 사료된다. 일반적으로 누룩의 수분함량은 10-13%이며, 누룩의 수분함량이 14% 이상일 경우 배양 지연 및 저장성 감소 등의 문제점을 가져올 수 있다. Lee 등(2009)의 연구 결과에서 배양 초기 누룩의 수분함량이 24.20%에서 배양 기간 중 점차 감소하여 배양 완료 시 13.60%라고 보고하였고, 이는 본 실험과 유사한 경향을 나타냈다.
누룩 내에 존재하는 젖산균이 배양초기에 유기산을 생성하여 pH를 낮춤으로 잡균에 의한 오염을 막는다. 또한, 일반적으로 재래누룩의 pH는 중성이나 약한 산성을 띠고, 총산은 0.2-0.9%로 알려져 있다. 누룩의 pH는 배양기간 동안 6.17-6.71의 범위로 나타났으며, 배양 초기부터 발효 30일차까지 미세하게 pH 값이 증가하였다. Choi 등(2012)의 연구에서 재래누룩의 pH가 배양기간이 지날수록 증가하여 본 실험결과와 유사한 경향을 나타내었다.
누룩의 총산은 배양기간이 경과함에 따라 증가하는 경향을 나타내었다. 누룩의 총산은 배양 0일차에서 1일차까지 급격하게 증가하다가 배양 7일차까지는 유지되었고, 7일차 이후 서서히 증가하여 배양 30일차에는 0.40%를 나타내었다. 이러한 실험 결과는 국내 시판 누룩 중 송학곡자(0.40%), 진주곡자(0.40%)와 비슷한 수치를 나타내었다.
누룩의 아미노산도는 배양 7일차까지 서서히 증가하다가 이후부터 감소하여 배양 30일차에는 1.25 mg/100 mL로 감소하는 경향을 나타내었다. Mun 등(2018)의 연구에서 누룩의 아미노산도는 배양 6일차에 최대 활성을 가진다고 보고한 바 있어, 배양 7일에 가장 높게 나타난 본 실험결과와 유사한 경향을 나타내었다. 아미노산은 누룩 내에 함유된 단백질이 배양기간 중 미생물이 생산하는 acidic protease와 peptidase 등의 단백질 분해 효소의 작용으로 생성된다고 보고된 바 있다(Park 등, 2010). 본 연구에서 재래누룩의 배양기간에 따른 carboxy peptidase 활성이 발효 7일차에 가장 높은 활성을 나타낸 후 감소하여 아미노산도와 유사한 경향을 나타내어 아미노산이 단백질 분해 효소의 작용에 의해 생산된 것으로 사료된다.
누룩의 배양기간에 따른 saccharification power, α-amylase, carboxy peptidase, lipase 활성 변화를 Fig. 2에 나타내었다. 쌀을 원료로 제조할 경우, 전분을 효모가 이용가능하도록 전분을 분해하는 당화과정이 필요하다. 이러한 당화과정을 도와주는 것이 미생물이 만들어내는 효소이며 그 중 당화력은 주류를 제조할 때 누룩의 사용량을 결정짓는 주요 요소이다. 국내 양조업체에서 주로 사용하는 시판 누룩의 당화력은 각각 291, 292, 340, 528, 1199 SP로 보고된 바 있다(Choi 등, 2011). 누룩의 당화력은 배양 초기부터 꾸준히 증가하여 배양 7일차에 3,099.26 unit/g으로 가장 높은 활성을 나타낸 이후 감소하여 배양 30일차에는 1,865.34 unit/g으로 나타났다.
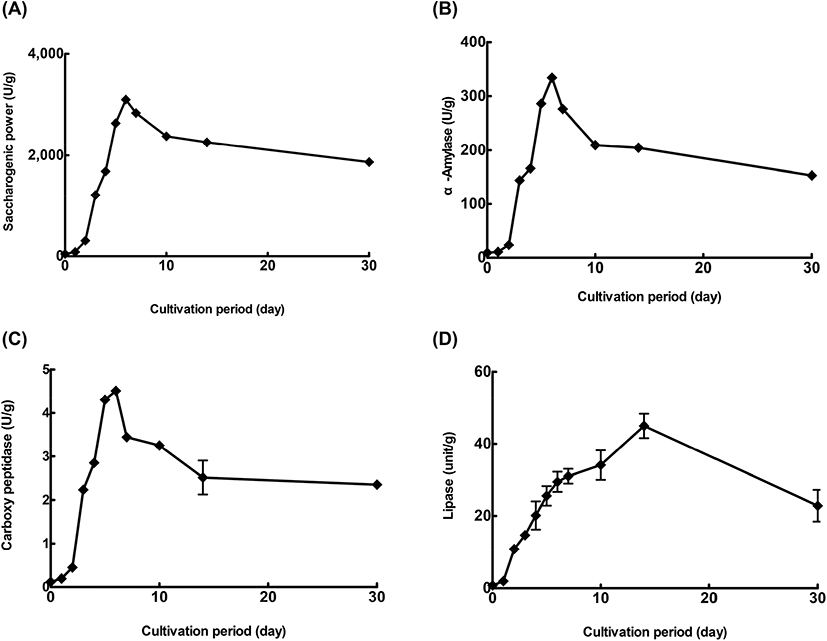
α-Amylase는 액화형 효소라고도 하며, amylopectin과 amylose의 α-1,4-glucan 결합을 불규칙하게 가수분해시키는 효소이다(Kim과 Kim, 2015). 누룩의 전분 분해에 관여하는 효소인 α-amylase 활성은 배양 초기부터 꾸준히 증가하다가 2-3일차와 4-5일차에 급격하게 증가하였고, 배양 7일차에 334.00 unit/g으로 가장 높은 활성을 나타낸 이후 감소하여 배양 30일차에는 152.93 unit/g을 나타내었다.
Lee 등(2009)에서 전통누룩의 α-amylase 활성은 배양 초기에 1,416.67 unit/g에서 배양 과정을 거치면서 급격히 증가하여 배양 15일에 2,833.00 unit/g으로 나타나 본 실험 결과와는 다소 차이를 나타내었고, Jung 등(2000)의 NTG에 의한 amylase활성이 높은 누룩 사상균의 변이주 분리에 대한 연구에서 α-amylase 활성이 배양 7일에 1,348.00 unit/g으로 최대 활성을 나타낸다고 보고하여, 배양 7일에 334.00 unit/g으로 가장 높은 활성을 나타낸 본 실험결과와 유사한 경향을 나타내었다.
따라서 누룩을 효소제로 이용할 경우 배양기간을 30일로 할 것이 아니라 7일까지만 배양하는 것을 제안하지만, 누룩에 함유되어 있는 당분이나 아미노산 및 지방 분해물 등 술의 품질에 미칠 수 있는 다른 요소에 관해서는 더 깊이 있는 연구가 필요하다.
주류 발효 중 단백질 분해량은 적지만 주류의 맛에 영향을 미치며, 전분 분해와 마찬가지로 중요하다. 발효 중 생성되는 아미노산의 80%는 단백질 분해 효소인 carboxy peptidase 효소에 의한 것이다(Kim 등, 2010; Sung 등, 2017). 누룩의 carboxy peptidase 활성은 배양 초기부터 꾸준히 증가하였고, 특히 2-3일차와 4-5일차에 급격히 증가하였으며, 배양 7일차에 4.51 unit/g으로 가장 높은 활성을 나타낸 이후 감소하여 배양 30일차에는 2.35 unit/g으로 나타냈다. Baek 등(2012)의 연구에서 A. oryzae와 A. kawachii를 혼용하여 제조한 누룩의 Acidic protease 활성이 배양 7일에 709(PU)로 가장 높은 활성을 나타낸 후 점차 감소하는 경향을 나타내어 배양 7일에 4.51 unit/g으로 가장 높은 활성을 나타낸 본 실험과 유사한 경향을 나타내었다.
누룩의 lipase 활성은 배양이 진행됨에 따라 꾸준히 증가하여 배양 14일차에 44.97 unit/g으로 가장 높은 활성을 나타낸 이후 급격하게 감소하여 배양 30일차에는 22.85 unit/g로 나타났다. 따라서 누룩을 지방 분해를 위해 사용할 경우에는 배양 14일차 누룩을 사용하는 것이 가장 우수할 것으로 사료된다.
