Article
꾸지뽕 열매 발효식초의 3T3-L1 세포에서 항염증 및 인슐린 저항성 개선 효과
박세은
1
, 김승
1,*
Maclura tricuspidata fruit vinegar improves the inflammation and insulin resistance in 3T3-L1 adipocytes
Se-Eun Park
1
, Seung Kim
1,*
1Department of Food Science and Biotechnology, Gwangju University, Gwangju 61743, Korea
Copyright © The Korean Society of Food Preservation. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jul 30, 2021; Revised: Sep 28, 2021; Accepted: Oct 02, 2021
Published Online: Dec 31, 2021
요약
본 연구는 꾸지뽕(C. tricuspidata) 열매 발효식초가 TNF-α에 의해 유도된 지방세포의 인슐린 저항성과 염증반응 개선에 미치는 효과를 연구하였다. 꾸지뽕 열매 발효식초는 TNF-α에 의해 감소된 lipid droplet 및 glucose uptake를 증가시켰다. 또한, 만성적인 염증과 인슐린 저항성을 유도하는 염증성 사이토카인(IL-6, MCP-1)의 생성을 감소시켰으며, 항염증 및 인슐린 감수성을 증가시키는 adiponectin 생성을 증가시킴을 확인하였다. 인슐린 신호전달 및 감수성에 관여하는 인자의 발현을 확인한 결과, PPARγ의 발현 증가 및 IRS-1의 인산화 감소를 확인하였으며 인슐린에 의한 당 흡수에 관여하는 GLUT4의 발현을 증가시킴을 확인하였다. 이러한 결과들을 통해 꾸지뽕 열매 발효식초는 TNF-α에 의해 유도된 염증 반응, 당 흡수 감소, 인슐린 저항성에 대한 개선 효과를 보여주고 있어 만성적인 염증과 인슐린 저항성에 의한 대사증후군의 치료를 위한 기능성 소재로서 이용 가능할 것으로 사료된다.
Abstract
Obesity is associated with chronic low-grade adipose tissue inflammation, leading to insulin resistance. Inflammation associated with insulin resistance is an interesting area of biomedical research and is expected to affect insulin signaling pathways via the downregulation of glucose transporters. In the present study, we investigated the inhibitory effects of Maclura tricuspidata fruit vinegar (MFV) against TNF-α-induced inflammation and insulin resistance in 3T3-L1 adipocytes. Differentiated 3T3-L1 adipocytes were pretreated with MFV at various concentrations and then cultured with TNF-α to induce insulin resistance. Then, lipid droplets, inflammatory cytokine and glucose uptake, PPARγ and GLUT4 expression, and IRS-1 phosphorylation were analyzed. MFV attenuated the TNF-α-induced decrease in lipid droplets and glucose uptake and inhibited TNF-α-induced inflammatory cytokine, IL-6, and MCP-1 production. MFV reversed the decrease in adiponectin produced by TNF-α. Furthermore, MFV upregulated the TNF-α-induced suppression of PPARγ and GLUT4 protein expression and reduced the TNF-α-induced phosphorylation of IRS-1. These findings suggest that MFV effectively ameliorates TNF-α-induced insulin resistance; accordingly, we recommend the use of MFV for the control and management of insulin resistance and its associated complications.
Keywords: Maclura tricuspidata fruits vinegar; adipocyte; TNF-α; inflammation; insulin resistance
서 론
비만과 인슐린 저항성은 당뇨병, 심혈관계질환과 같은 대사증후군의 주된 원인으로 알려져 있다. 비만에 의한 인슐린 저항성은 인슐린의 작용을 저해하는 만성적인 낮은 수준의 염증 반응이 특징적으로 나타난다. 지방조직은 지방세포뿐만 아니라 대식세포를 포함하는 내분비 기관으로 interleukin- 6(IL-6), tumor necrosis factor-α(TNF-α), adiponectin, leptin 등과 같은 adipokine을 분비한다(Erin 등, 2004). 지방조직에서 염증성 사이토카인인 monocyte chemoattractant protein-1 (MCP-1), IL-6, TNF-α와 항염증성 사이토카인인 adiponectin는 비만으로 유도되는 만성적인 염증 및 인슐린 저항성과 관련되어 있는 것으로 보고되고 있다(Ahima 등, 2012; Fontana 등, 2007). 비만에 의해 비대해진 지방세포에서 분비된 MCP-1은 지방조직으로 대식세포의 침윤을 유도하며 대식세포의 TNF-α 발현을 증가시킨다(Coope 등, 2016). 이로 인해 대식세포의 염증반응이 증가하고 발현된 TNF-α는 지방세포의 염증반응을 증가시키며 악순환의 고리를 형성하여 지방조직의 지속적인 염증과 인슐린 저항성을 유발한다(Suganami 등, 2005). TNF-α와는 달리 adiponectin, peroxisome proliferator activated receptor(PPARγ)는 지방조직에서 발현되며 인슐린 감수성, 항염증 기능을 하며 이들의 발현은 비만과 인슐린 저항성 개선에 중요한 요소로 작용한다.
세포 내 포도당 수송과정은 인슐린 신호전달로 매개된다. 인슐린이 인슐린 수용체에 결합하면 insulin receptor substrate (IRS)의 tyrosine 잔기를 인산화시키고, 인산화된 IRS는 SH2 domain을 가진 단백질들과 결합해 경로를 활성화시키며 이 경로를 통해 Glucose Transporter Type 4(GLUT4)가 translocation되며 포도당 수송이 이루어진다(White, 2003). 그러나 인슐린 저항성이 발생하면 IRS의 serine 잔기를 인산화시키고 GLUT4의 translocation 및 발현이 감소하여 인슐린 신호전달에 의한 포도당 수송이 감소하게 된다(Lee 등, 2003).
식초는 고혈압, 동맥경화와 같은 대사증후군 예방, 콜레스테롤 저하 및 체지방 감소, 면역력 증진, 항당뇨 등의 효능이 입증되면서 단순한 조미 용도의 식초가 기능성 식품으로 연구개발되고 있으며 유효성분과 추가적인 기능성에 대해 지속적인 연구가 이루어지고 있다(Cho 등, 2013; Kwon 등, 2000; Lee 등, 2009).
꾸지뽕(Maclura tricuspidata) 열매는 polyphenol과 flavonoid계 물질의 함량이 높았으며 지방세포 분화와 관련된 유전자의 발현 억제, 인슐린 저항성 개선, 항비만, 항염증, 항암, 항산화, 신경세포 보호 및 면역 증강 효과 등을 가지고 있다고 보고 되었다(Joo와 Lim, 2009; Kang 등, 2011; Kim, 2015; Lee 등, 2005; Park, 2018; Yoon 등, 2016). 추출물뿐만 아니라 발효를 이용한 bioconversion으로 기능성 증진에 대한 연구가 이루어지고 있다(Kang 등, 2011; Seo, 2013). 꾸지뽕 열매 발효 식초에 대한 연구는 주로 식초 제조와 성분 분석이 주를 이루고 있으며 그 외에 지방세포 분화 억제 및 염증 반응 억제 효과에 대해 보고되어 있지만 인슐린 저항성과 관련된 연구에 대해서는 미비한 실정이다(Kim 등, 2020; Park 등, 2020; Yim 등, 2015).
따라서 본 연구에서는 꾸지뽕 열매 발효식초가 TNF-α에 의한 인슐린 저항성에 미치는 영향과 분비 및 유전자 발현 변화를 조사하였다. 꾸지뽕 열매 발효식초의 항염 활성과 지방세포에서 인슐린 감수성을 높이는 효과를 통해 비만 및 인슐린 저항에 의한 대사증후군 치료를 위한 기능성 소재로서의 이용 가능성을 확인하였다.
재료 및 방법
실험재료 및 제조
이전 연구에서 Kim 등(2020)의 방법을 참고하여 발효시켜 제조한 꾸지뽕 열매 발효식초를 동결건조하였다. 분말형태로 만들어 꾸지뽕 열매 발효식초 분말은 4°C에 보관하면서 PBS로 희석하여 실험에 사용하였다.
이화학적 특성 분석
pH는 pH meter(Thermo scientific, Waltham, MA, USA)를 사용하여 측정하였으며, 총 산도는 시료 1 mL를 증류수로 20배 희석한 후 1% phenolpthalein 용액을 가하고 0.1 N NaOH를 첨가한 다음, 0.1 N NaOH 용액의 양을 기준으로 acetic acid로서 총 산도를 산출하였다. 총 폴리페놀 함량은 Folin-Denis법을 이용하여 측정하였다. 시료 100 μL에 Folin- Denis reagent를 100 μL를 가하여 혼합하고 3분간 실온에서 반응시켰다. 10% sodium carbonate solution 100 μL를 가하여 혼합하고 1시간 반응시킨 후 상층액을 취하여 Microplate reader(Molecular Devices, San Jose, CA, USA)를 이용하여 760 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 gallic acid를 이용하여 작성한 표준곡선을 구해 정량하였다.
세포배양 및 분화 유도
3T3-L1 지방전구세포 분화를 위해 Dulbecco’s modified Eagle’s medium(DMEM)(10% Bovine serum(BS), 100 unit/mL penicillin, 100 μg/mL streptomycin 함유) 배지를 이용하여 5% CO2, 37°C 배양기에서 배양하였다. 배양한 세포가 100% confluent에 도달하면 분화 유도인자(0.5 mM 3-isobutyl- methylxanthine, 2 M Dexamethsone, 5 mg/mL Insulin)를 포함하는 10% Fetal bovine serum(FBS)-DMEM 배지로 교체하여 2일 동안 지방세포로 분화를 유도하였고, 분화 유도 후 2일마다 5 mg/mL insulin이 포함된 10% FBS-DMEM 배지로 교체하며 배양하였다. 3T3-L1 지방전구세포는 분화 유도 후 꾸찌뽕 열매 발효식초와 TNF-α를 처리하고 분석하였다.
MTT assay
3T3-L1 지방전구세포를 1×103 cells/well로 96 well plate의 각 well에 분주한 후 지방세포로 분화시켰다. 분화된 3T3-L1 세포에 농도별로 꾸지뽕 열매 발효식초를 24시간 처리한 후 TNF-α(5 ng/mL)를 24시간 처리하였다. 배지를 제거한 후 5 mg/mL의 농도로 phosphate buffered saline(PBS)에 녹인 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) 용액을 희석하여 100 μL(최종 농도: 0.5 μg/ mL)씩 처리하고 4시간 동안 반응시키고 MTT 용액을 제거하였다. 각 well에 남은 formazan을 dimethly sulfoxide(DMSO) 로 용해시킨 후, ELISA reader(Molecular Devices, San Jose, CA, USA)를 이용하여 540 nm에서 흡광도를 측정하였으며 무처리 대조군 대비 백분율로 세포 생존율을 나타내었다.
Oil Red O 염색
3T3-L1 지방전구세포를 24-well plate에 분주하여 분화 유도한 후 꾸지뽕 발효 식초(100, 150, 200 μg/mL)를 농도별로 24시간 처리한 후 TNF-α(5 ng/mL)를 24시간 처리하였다. 세포를 PBS로 2회 세척하고 10% formaldehyde 용액으로 세포를 상온에서 1시간 동안 고정하였다. 고정된 세포는 증류수로 3회 세척하고 60% isopropyl alcohol을 5분간 처리 후 완전히 건조하였다. Oil Red O 염색 시약으로 실온에서 1시간 염색시킨 후 증류수로 세척하였다. 증류수를 제거하고 완전히 건조시킨 후 isopropyl alcohol로 oil red O를 용출시켜 ELISA reader(Molecular Devices, San Jose, CA, USA)를 이용하여 520 nm에서 흡광도를 측정하였다.
Glucose uptake
꾸지뽕 발효 식초(100, 150, 200 μg/mL)와 TNF-α(5 ng/mL) 처리 후, 1시간 동안 100 M 2-(N-(7-Nitrobenz-2-oxa-1,3-diazol- 4-yl)Amino)-2-Deoxyglucose(2-NBDG)가 포함된 glucose-free DMEM배지를 이용하여 배양하였다. 배양 후 PBS로 세포를 씻어준 후 2-NBDG 흡수량을 확인하기 위해 485 nm/535 nm에서 흡광도를 측정하였다.
ELISA
배지 내에 생성된 염증성 cytokine 및 adiponectin의 농도는 enzyme-linked immunosorbent assay kits(R&D Systems, Minneapolis, MN, USA)를 이용하여 측정하였다. 꾸지뽕 열매 발효식초와 TNF-α를 처리하여 배양이 끝난 후 원심분리하여 상층액을 분리하고 -70°C에 보관하였다. 제조사에서 제공한 분석방법에 따라 수행하고 ELISA reader를 이용하여 흡광도 측정 후 cykokine 및 adiponectin의 함량을 계산하였다.
Western blot 분석
배양이 끝난 후 세포를 PBS로 세척하여 수거한 세포에 RIPA buffer(50 mM Tris-HCl, pH 8.0, 150 mM NaCl, 1% NP-40, 0.5% Nadeoxycholate and 0.1% SDS)에 넣고 20분간 4°C에서 방치하였다. 그 후 12,000 rpm, 4°C에서 20분간 원심분리하고 상등액을 회수하여 단백질 양을 정량하였다. 동일한 양의 단백질에 5× sample loading buffer를 가하고, 100°C에서 5분간 가열하여 변성시킨 단백질을 10% sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE)로 분리하고 PVDF membrane에 전이시켰다. Skim milk가 포함된 TBST(10 mM Tris, 100 mM NaCl, 0.1% Tween20)를 이용하여 상온에서 2시간 동안 blocking 시킨 후, 1차 antibody를 1:1000으로 희석하여 4°C에서 하룻밤 동안 반응시켰다. TBST로 Membrane을 3회 세척 후, 2차 antibody 1:2500으로 희석하여 상온에서 2시간 반응시켰다. 반응이 끝난 membrane을 TBST로 3회 세척 후 enhanced chemiluminesce kit(Thermofisher, Waltham, MA, USA)를 이용하여 발색시켰다. Membrane에 생성된 band를 image reader(Microchemi 4.2, DNR, Neve Yamin, IS)로 확인 후 단백질 발현량을 분석하였다.
통계처리
모든 실험은 3회 이상 반복하여 실시하였으며, 실험결과는 평균표준편차로 나타내었다. 각 결과에 대한 유의성 검증은 대조군과 비교하여 Student’s test 한 후 p<0.05, p<0.01 수준에서 유의성을 검증하였다.
결과 및 고찰
꾸지뽕 열매 발효식초의 이화학적 특성
꾸지뽕 열매 발효식초의 총산도와 pH, 총 폴리페놀 함량을 측정한 결과는 Table 1과 같다. 식초의 총 산도는 제조과정 중에 생성되며 총 산도에 따라서 저산도(4-5%), 일반산도(6-7%), 2배(12-14%), 3배(18-19%) 식초로 나눌 수 있으며 식초에 대한 품질 규격으로 총산 함량을 4-20% 범위로 정해놓았다(KFDA, 2020). 또한 초산균이 알코올을 에너지원과 발효기질로 사용하여 초산 발효가 진행이 되면 acetic acid가 생성되기 때문에 산도가 높아지고 pH가 낮아지게 된다. 꾸지뽕 열매 발효식초의 총산도와 pH를 측정한 결과, pH 3.4, 총 산도는 7.4%를 나타냈다.
Table 1.
Physicochemical properties of vinegar samples used in this study
|
Sample |
pH |
Total acidity (%) |
Total polyphenol contents (mg GAE/mL) |
|
Maclura tricuspidata fruits vinegar |
3.4±0.0 |
7.4±0.0 |
3.334±19.31),2)
|
Download Excel Table
폴리페놀 화합물은 천연물에 함유되어 있는 성분으로 2개 이상의 phenolic hydroxyl(-OH)기를 가지고 있으며, 항산화 외에도 항염 및 항암, 항에이즈, 충치예방 등과 같은 다양한 생리활성기능을 가지는 것으로 알려져 있다(Lee 등, 1992). 꾸지 열매 발효식초의 폴리페놀 함량을 분석한 결과, 3.334± 19.3 mg GAE/mL를 나타냈다.
3T3-L1세포의 세포생존율 및 lipid droplet 생성에 미치는 영향
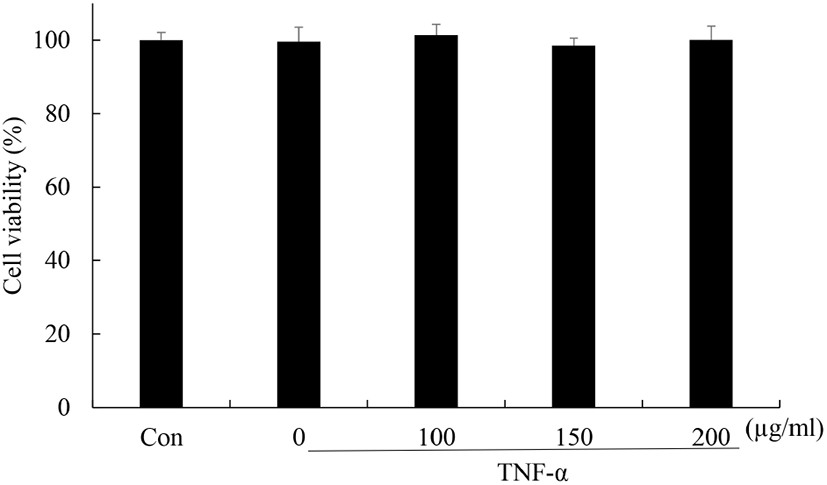
꾸지뽕 열매 발효식초와 TNF-α가 분화된 3T3-L1 세포의 세포 생존율에 미치는 영향을 MTT assay를 이용하여 확인하였다(Fig. 1). 그 결과, 꾸지뽕 열매 발효식초(100, 150, 200 μg/mL)와 TNF-α(5 ng/mL)를 처리하였을 때 세포 생존율이 감소하지 않음을 확인하였다.
Fig. 1.
Effect of Maclura tricuspidata fruit vinegar (MFV) and TNF-α on cell viability of 3T3-L1 cells.
Differentiated 3T3-L1 cells were treated with or without MFV for 24 h prior to TNF-α (5 ng/mL) treatment for 24 h. After incubation, cell viability was assessed using the MTT method. Values are expressed as mean±SD (n=4).
Download Original Figure
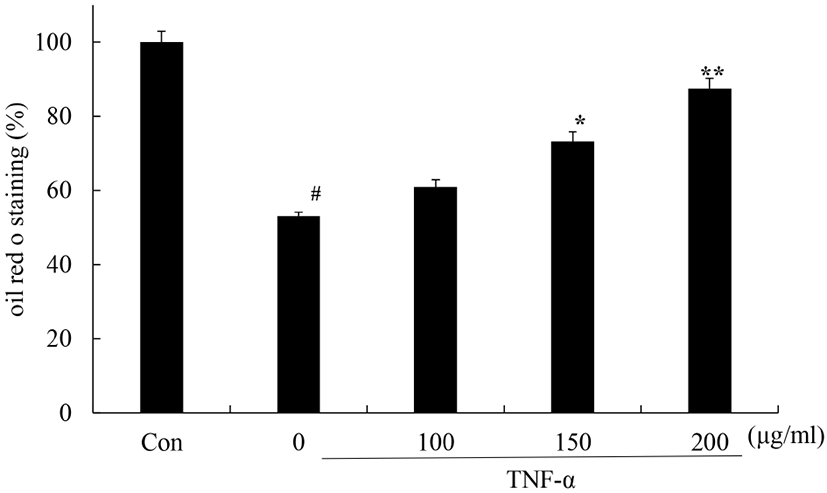
TNF-α는 과도하게 생성되면 지방조직의 기능 이상을 유발하여 지방분해를 증가시키고 혈중 유리지방산의 농도를 증가시켜 인슐린 신호 전달에 이상을 가져와 인슐린 저항성을 유발한다(Shulman, 2000; Yang 등, 2021; Ye, 2008; Yu 등, 2002). 꾸지뽕 열매 발효식초가 TNF-α에 의한 지방세포 내 lipid droplet 감소를 억제시키는지를 확인하기 위해 분화된 3T3L-1 세포에 꾸지뽕 열매 발효식초 전 처리 후 TNF-α를 처리하고 Oil Red O 염색을 이용하여 확인하였다(Fig. 2). 그 결과 무처리군에 비해 TNF-α만 단독으로 처리한 군에서는 lipid droplet이 53%로 감소하였지만, 꾸지뽕 열매 발효식초를 처리하였을 때, 농도의존적으로 60, 73, 87%로 증가하여 lipid droplet 감소가 억제되었다. 이 결과를 통해 지방세포에서 꾸지뽕 열매 발효식초가 TNF-α에 의한 지방분해를 억제하는 효과를 가지고 있음을 확인하였다.
Fig. 2.
Effects of Maclura tricuspidata fruit vinegar (MFV) on the lipid droplet formation in 3T3-L1 cells.
Differentiated 3T3-L1 cells were treated with or without with MFV (100, 150, 200 μg/mL) for 24 h prior to TNF-α (5 ng/mL) treatment for 24 h. Lipid droplet formation were determined by Oil Red O stain. The values were calculated as a percentage of absorbance of Control. The data presented are the means±SD of three independent experiments. #p<0.05 vs. control group; **p<0.05, *P<0.01 vs. TNF-α treated group.
Download Original Figure
3T3-L1세포 내 사이토카인 생성에 미치는 영향
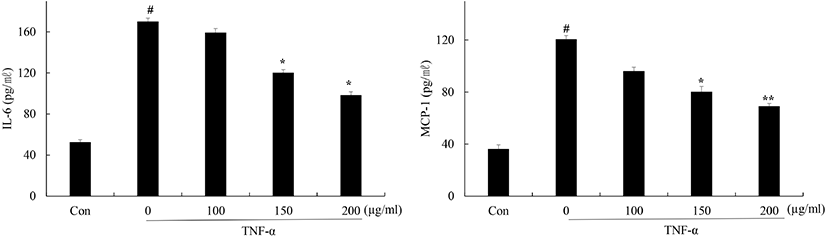
비만은 만성적인 낮은 수준의 염증반응이 특징적으로 나타나며 지방조직에서는 염증성 사이토카인들을 분비한다. 이로 인해 만성적인 염증반응이 지속되며 인슐린 저항성을 동반한다(Suganami 등, 2005). 지방조직에서는 염증과 관련된 물질들과 사이토카인들을 분비하며 지방세포와 면역세포 간의 상호작용을 유도하여 염증반응을 유도하거나 억제시키는 역할을 한다(Chiellini 등, 2002; Qatanani과 Lazar, 2007; Suganami 등, 2007). 지방조직에서 생성되는 염증성 사이토카인들 중 하나인 IL-6와 MCP-1은 인슐린 저항성을 증가시키는 주요인자이다. MCP-1은 지방조직으로 대식세포와 수지상세포를 동원하며 염증 상태를 유지하고 인슐린 저항성을 일으키는 사이토카인의 생성을 유도한다(Kahn 등, 2006; Rull 등, 2010). IL-6는 GLUT4와 IRS-1의 발현을 억제시킴으로써 인슐린 저항성을 유발하는 것으로 알려져 있다(Chen 등, 2015; Maachi 등, 2004). 꾸지뽕 열매 발효식초의 염증성 사이토카인 생성 억제 효과를 확인하기 위해 분화된 지방세포에 TNF-α 처리 후 만성적인 염증에 관여하는 IL-6, MCP-1 생성 억제 여부를 ELISA를 이용하여 확인하였다(Fig. 3). 그 결과, 무처리군에 비해 TNF-α 단독 처리군의 경우, IL-6, MCP-1의 생성이 각각 170 pg/mL, 120 pg/mL로 증가하였다. 꾸지뽕 열매 발효식초를 전처리한 군에서는 IL-6는 159, 120, 95 pg/mL, MCP-1는 96, 80, 69 pg/mL로 생성이 감소하였다. 이러한 결과들을 통해서 꾸지뽕 열매 발효식초가 TNF-α에 의한 지방세포의 만성적인 염증 반응을 억제하는 효과가 있음을 확인하였다.
Fig. 3.
Effect of Maclura tricuspidata fruit vinegar (MFV) on TNF-α-induced inflammatory cytokine levels in 3T3-L1 cells.
Differentiated 3T3-L1 cells were treated with or without with MFV (100, 150, 200 μg/mL) for 24 h prior to TNF-α (5 ng/mL) treatment for 24 h. Cytokines were determined by ELISA. The data presented are the means±SD of three independent experiments. #p<0.05 vs. control group; **p<0.05, *p<0.01 vs. TNF-α treated group.
Download Original Figure
3T3-L1세포 내 glucose uptake에 미치는 영향
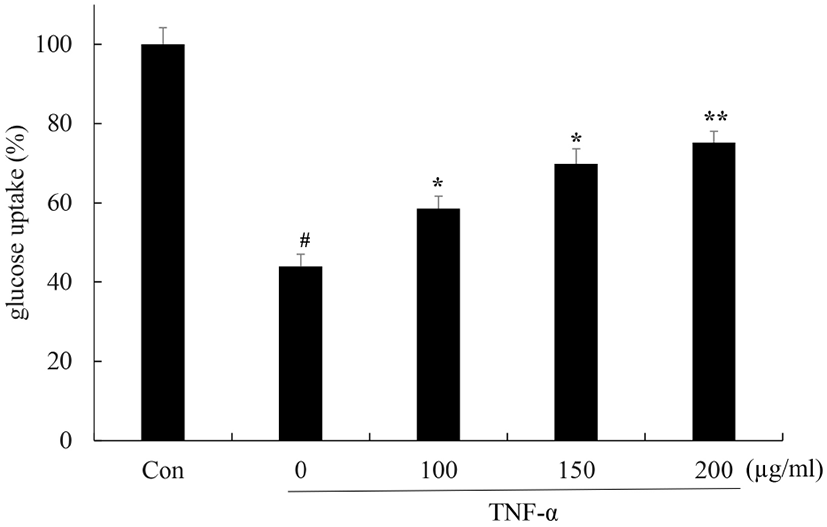
인슐린은 지방조직 내로 포도당과 지방산의 흡수를 유도하며 중성지방의 합성과 저장을 촉진한다. 비만에 의한 만성적 염증은 인슐린 저항성 생성에 기여하며 지방조직의 인슐린에 대한 감수성과 포도당 흡수를 저해하며 다양한 대사질환의 발생을 증가시킨다(Cawthorn과 Sethi, 2008). 꾸지뽕 열매 발효식초에 의한 지방세포에서 인슐린 감수성 개선 효과를 glucose uptake assay를 이용하여 확인하였다. TNF-α 단독 처리군에서는 무처리군에 비해 43%로 glucose uptake가 감소하였지만 꾸지뽕 열매 발효식초 처리군에서는 58, 63, 87%로 glucose uptake가 증가되었다(Fig. 4). 이러한 결과를 통해 TNF-α는 지방세포에서 인슐린 저항성을 유발하여 glucose uptake를 감소시켰으며 꾸지뽕 열매 발효식초는 인슐린 저항성을 개선시킴으로써 glucose uptake를 증가시키는 것을 확인하였다.
Fig. 4.
Effect of Maclura tricuspidata fruit vinegar (MFV) on TNF-α-induced suppression of glucose uptake in 3T3-L1 cells.
Differentiated 3T3-L1 cells were treated with or without with MFV (100, 150, 200 μg/mL) for 24 h prior to TNF-α (5 ng/mL) treatment for 24 h. Glucose uptake was determined by amount of 2-NBDG. The values were calculated as a percentage of absorbance of Control. The data presented are the means±SD of three independent experiments. #p<0.05 vs. control group; **p<0.05, *p<0.01 vs. TNF-α treated group.
Download Original Figure
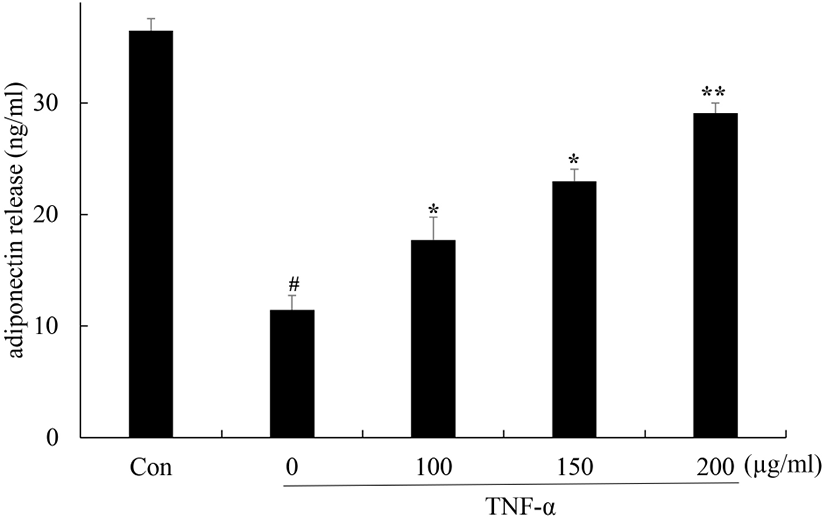
3T3-L1세포 내 adiponectin 생성에 미치는 영향
지방조직에서 분비되는 adiponectin은 IL-6와 같은 염증성 사이토카인의 생성을 저해하며 항염증 효과를 나타낼 뿐만 아니라 당과 지질대사를 조절하는 인슐린 감수성 효과를 가지고 있어 인슐린과 관련된 조직의 인슐린 감수성을 증가시키는 작용을 한다. TNF-α는 PPARγ 발현 억제를 통해 adiponectin의 생성을 억제하며 이로 인한 만성적인 염증과 인슐린 저항성을 유발한다. 꾸지뽕 열매 발효식초의 adiponectin 생성 증가를 확인하기 위해 adiponectin 생성 여부를 ELISA를 이용하여 확인하였다(Fig. 5). 그 결과, 무처리군에 비해 TNF-α 단독 처리군의 경우, adiponectin의 생성이 11 ng/mL로 감소하였다. 꾸지뽕 열매 발효식초를 전처리한 군에서는 adiponectin의 생성이 17, 22, 34 ng/mL로 증가함을 확인하였다. 이러한 결과를 통해서 꾸지뽕 열매 발효식초가 adiponectin 생성을 증가시킴으로써 인슐린 저항성을 개선하며 염증반응을 감소시킴을 확인하였다.
Fig. 5.
Effect of Maclura tricuspidata fruit vinegar (MFV) on TNF-α-induced suppression of adiponectin in 3T3-L1 cells.
Differentiated 3T3-L1 cells were treated with or without with MFV (100, 150, 200 μg/mL) for 24 h prior to TNF-α (5 ng/mL) treatment for 24 h. Adiponectin was determined by ELISA. The data presented are the means±SD of three independent experiments. #p<0.05 vs. control group; **p<0.05, *p<0.01 vs. TNF-α treated group.
Download Original Figure
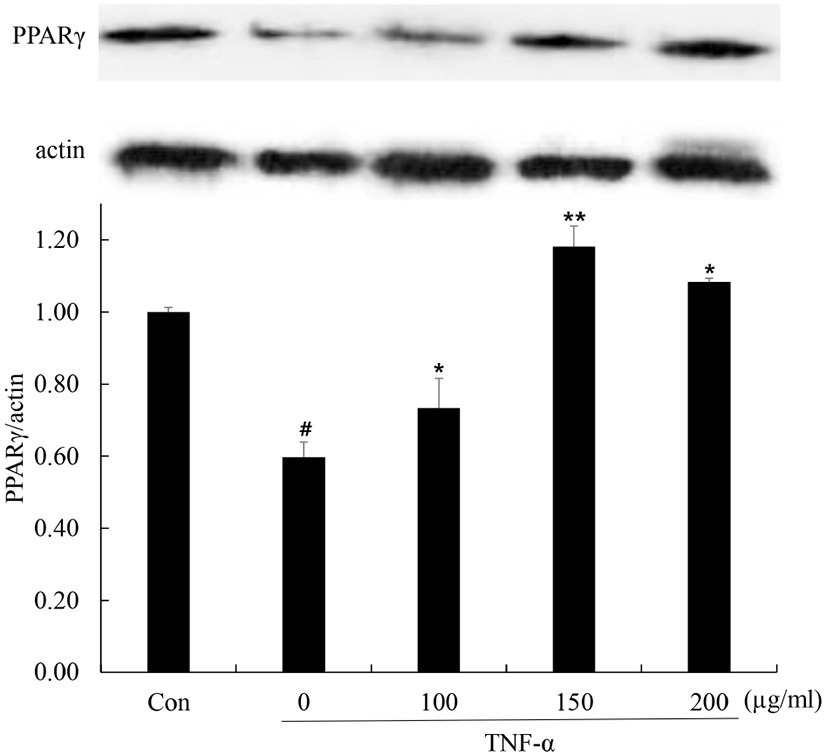
3T3-L1세포 내 PPARγ 발현에 미치는 영향
PPARγ는 지방세포 분화 및 중성지방의 합성을 조절하는 전사인자 역할을 한다. 또한 비만에 의한 만성적인 염증반응을 유도하는 IL-6, TNF-α, MCP-1 등의 염증성 아디포카인의 발현 억제 및 adiponectin과 같은 항염증 아디포카인의 발현 증가를 통해 인슐린 감수성 증가 중요한 역할을 한다(Rotter 등, 2003; Maeda 등, 2001; Yamauchi 등, 2002). TNF-α는 지방조직에서 인슐린저항성을 유도하는 것으로 알려져 있으며, 이는 지방세포의 주된 조절자인 PPARγ의 억제에 의해 매개된다(Cawthorn과 Sethi, 2008). 분화된 지방세포에서 꾸지뽕 열매 발효 식초에 의한 PPARγ 발현 변화를 확인하기 위해 TNF-α를 처리하고 단백질 발현을 확인하였다(Fig. 6). 그 결과, 무처리군에 비해 TNF-α 단독 처리군의 경우, PPARγ의 발현이 감소하였고 꾸지뽕 열매 발효식초를 처리한 군에서는 PPARγ의 발현이 증가함을 확인하였다. 이러한 결과들을 통해서 꾸지뽕 열매 발효식초가 TNF-α에 의해 감소된 PPARγ의 발현을 증가시킴으로써 지방세포의 염증 반응을 억제시킴을 확인하였다.
Fig. 6.
Effect of Maclura tricuspidata fruit vinegar (MFV) on TNF-α-suppressed protein expression of PPARγ in 3T3-L1 cells.
Differentiated 3T3-L1 cells were treated with or without with MFV (100, 150, 200 μg/mL) for 24 h prior to TNF-α (5 ng/mL) treatment for 24 h. Protein expression levels were determined western blot. The data presented are the means±SD of three independent experiments. #p<0.05 vs. control group; **p<0.05, *p<0.01 vs. TNF-α treated group.
Download Original Figure
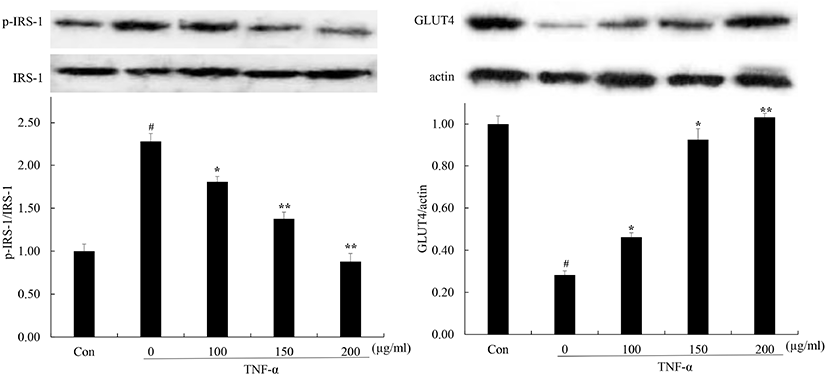
3T3-L1세포 내 IRS, GLUT4 발현에 미치는 영향
IRS는 인슐린 신호전달의 중요한 매개체로 인슐린수용체가 IRS 단백질의 tyrosine 잔기들을 인산화시킴으로써 신호전달이 진행된다(White, 2003). 인산화된 IRS에 결합한 여러 단백질 kinase들이 활성화되며 포도당 수송과 glycogen 합성들이 이루어진다. TNF-α와 같은 염증성 사이토카인들은 IRS-1의 serine 잔기를 인산화시킴으로써 IRS-1의 분해를 촉진하여 지속적인 인슐린 신호전달 저해가 나타나면 인슐린 저항성이 나타난다(Greene 등, 2003; White, 2003; Zick, 2001). 또한, 인슐린 저항성으로 인해 인슐린 분비 증가도 IRS-1의 serine 인산화를 증가시켜 인슐린 저항성을 악화시킨다(Lee 등, 2003). GLUT4는 인슐린 신호전달체계에 의해 조절되며 GLUT4에 의한 포도당 수송은 rate limiting step으로 체내 포도당 유입으로 분비된 인슐린은 IRS-1를 인산화시키고 순차적으로 SH domain을 가진 단백질을 활성화시켜 최종적으로 GLUT4의 translocation과 발현을 유도한다. 인슐린 신호전달 체계 저해가 일어나면 세포질로부터 GLUT4 translocation 감소, PPARγ 발현 감소에 의한 GLUT4의 발현 감소로 세포 내 포도당 수송이 감소되며 인슐린 저항성이 나타난다(Garvey 등, 1991; James 등, 1988; Wu 등, 1998; Zhou 등, 2007). GLUT4 발현은 인슐린 감수성에 영향을 미치며 GLUT4 발현 이상은 인슐린 저항성의 중요한 요소로 여겨진다(Minokoshi 등, 2003).
TNF-α와 같은 염증성 사이토카인에 의한 IRS serine 잔기를 인산화 및 GLUT4 발현 저해는 인슐린 저항성을 유발한다. 분화된 지방세포에서 꾸지뽕 열매 발효 식초에 의한 IRS-1 인산화와 GLUT4 발현 변화를 확인하기 위해 TNF-α를 처리하고 단백질 발현을 확인하였다(Fig. 7). 그 결과, IRS-1는 무처리군에 비해 TNF-α 단독 처리군의 경우, IRS-1의 인산화가 증가하였고 꾸지뽕 열매 발효식초를 처리한 군에서는 IRS-1의 인산화가 감소함을 확인하였다. 또한 GLUT4는 무처리군에 비해 TNF-α 단독 처리군의 경우, GLUT4의 발현이 감소하였고 꾸지뽕 열매 발효식초를 처리한 군에서는 GLUT4의 발현이 증가함을 확인하였다. 이러한 결과를 통해 꾸지뽕 열매 발효식초는 GLUT 발현 증가 및 IRS-1 인산화 감소시킴으로써 인슐린 저항성을 개선시키며 glucose uptake를 증가시킴을 확인하였다.
Fig. 7.
Effect of Maclura tricuspidata fruit vinegar (MFV) on TNF-α-suppressed protein expression of IRS-1 and GLUT4 in 3T3-L1 cells.
Differentiated 3T3-L1 cells were treated with or without with MFV (100, 150, 200 μg/mL) for 24 h prior to TNF-α (5 ng/mL) treatment for 24 h. Protein expression levels were determined western blot. The data presented are the means±SD of three independent experiments. #p<0.05 vs. control group; **p<0.05, *p<0.01 vs. TNF-α treated group.
Download Original Figure
본 연구를 통해 분화된 지방세포 내에서 TNF-α에 의해 유도된 염증 반응 및 인슐린 저항성에 대한 꾸지뽕 열매 발효식초의 개선 효과를 확인함으로서 비만에 의한 만성적인 염증 및 인슐린 저항성을 개선시킬 수 있는 기능성 소재로서 이용 가능할 것으로 사료된다. 또한 꾸지뽕 열매와 꾸지뽕 열매 발효식초에서 분리한 protocatechuic acid, chlorogenic acid, p-hydroxybenzoic acid, rutin 등은 항산화, 항염증뿐만 아니라 인슐린 저항성 및 혈당 저하에 효과적인 것으로 보고 되어 있어 이러한 성분에 의해 꾸지뽕 열매 발효 식초가 항염증 및 인슐린 저항성 개선 효과를 나타내는 것으로 판단된다 (Barragn-Zarate 등; 2021; Choi 등, 2020; Guo 등, 2020; Kim 등, 2020; Park, 2018; Rebollo-Hernanz 등, 2019).
감사의 글
본 연구는 2021년도 광주대학교 대학연구비의 지원을 받아 수행되었습니다.
References
Barragn-Zarate GS, Alexander-Aguilera A, Lagunez-Rivera L, Solano R, Soto-Rodrguez I. Bioactive compounds from
Prosthechea karwinskii decrease obesity, insulin resistance, pro-inflammatory status, and cardiovascular risk in Wistar rats with metabolic syndrome. J Ethnopharmacol, 279, 1-10 (2021)



Chiellini C, Bertacca A, Novelli SE, Gorgun CZ, Ciccarone A, Giordano A, Xu H, Soukas A, Costa M, Gandini D, Dimitri R, Bottone P, Cecchetti P, Pardini E, Perego L, Navalesi R, Folli F, Benzi L, Cinti S, Friedman JM, Hotamisligil GS, Maffei M. Obesity modulates the expression of haptoglobin in the white adipose tissue via TNF alpha. J Cell Physiol, 190, 251-258 (2002)



Cho KM, Shin JH, Seo WT. Production of Korean domestic wheat (Keumkangmil) vinegar with
Acetobacter pasteurianus A8. Korean J Food Sci Technol, 45, 252-256 (2013)


Guo CC, Zhang XY, Wang YX, Xie L, Chang CQ. Effects of chlorogenic acid on glucose tolerance and its curve characteristics in high-fat diet-induced obesity rats. Beijing Da Xue Xue Bao Yi Xue Ban, 52, 269-274 (2020)

Joo HY, Lim KT. Glycoprotein isolated from
Cudrania tricuspidata Bureau inhibits iNOS and COX-2 expression through modulation of NF-κB in LPS-stimulated RAW 264.7 cells. Environ Toxicol Phar, 27, 247-252 (2009)



Kang DH, Kim JW, Youn KS. Antioxidant activities of extracts from fermented mulberry (
Cudrania tricuspidata) fruit and inhibitory actions on elastase and tyrosinase. Korean J Food Preserv, 18, 236-243 (2011)


KFDA. Korea Food Standard Code. Ministry of Food and Drug Safety, Osong, Korea, p 188 (2020)

Kim DW, Kim DH, Kim JK, Yeo SH, Choi HS, Kim YH, Kim MK. Comparison of volatile compounds in
Maclura tricuspidata fruit vinegar and commercial vinegars. Korean J Food Preserv, 27, 85-97 (2020)


Kwon SH, Jeong EJ, Lee GD, Jeong YJ. Preparation method of fruit vinegars by two stage fermentation and beverage including vinegar. Food Ind Nutr, 5, 18-24 (2000)

Lee BW, Lee JH, Lee ST, Lee HS, Lee WS, Jeong TS, Park KH. Antioxidant and cytotoxic activities of xanthones from
Cudrania tricuspidata. Bioorg Med Chem Lett, 15, 5548-5552 (2005)



Lee KD, Kim JS, Bae JO, Yoon HS. Antioxidative effectiveness of water extract and ether in wormwood (
Artemisia montana Pampan). J Korean Soc Food Nutr, 21, 17-22 (1992)

Lee SM, Choi YM, Kin YW, Kim DJ, Lee JS. Antioxidant activity of vinegars commercially available in Korean markets. Food Eng Pro, 13, 221-225 (2009).

Maeda N, Takahashi M, Funahashi T, Kihara S, Nishizawa H, Kishida K, Nagaretani H, Matsuda M, Komuro R, Ouchi N, Kuriyama H, Hotta K, Nakamura T, Shimomura I, Matsuzawa Y. PPARgamma ligands increase expression and plasma concentrations of adiponectin, an adipose- derived protein. Diabetes, 50, 2094-2099 (2001).



Oh PS, Lee HJ, Lim KT. Inhibitory effect of glycoprotein isolated from
Cudrania tricuspidata Bureau on histamine release and COX-2 activity in RBL-2H3 cells. Korean J Food Sci Technol, 41, 405-412 (2009)

Park JK. Antithrombotic and antiadipogenic effects of
Cudrania tricuspidata fruit extract. Ph D Thesis, Kyung hee University, Korea, p 1-2 (2018)

Park SE, Yeo SH, Kim S. The effect of
Cudrania tricuspidata fruit vinegar on LPS-induced inflammation in 3T3-L1 adipocytes. Korean J Food Preserv, 27, 809-816 (2020)


Rebollo-Hernanz M, Zhang Q, Aguilera Y, Martn-Cabrejas MA, de Mejia EG. Cocoa shell aqueous phenolic extract preserves mitochondrial function and insulin sensitivity by attenuating inflammation between macrophages and adipocytes
in vitro. Mol Nutr Food Res, 63, e1801413 (2019)



Seo MJ, Kang BW, Park JU, Kim MJ, Lee HH, Kim NH, Kim KH, Rhu EJ, Jeong YK. Effect of fermented
Cudrania tricuspidata fruit extracts on the generation of the cytokines in mouse spleen cell. Kor J Life Sci, 23, 682-688 (2013)


Suganami T, Tanimoto-Koyama K, Nishida J, Itoh M, Yuan XM, Mizuarai S, Kotani H, Yamaoka S, Miyake K, Aoe S, Kamei Y, Ogawa Y. Role of the toll-like receptor 4/NF-kappaB pathway in saturated fatty acid-induced inflammatory changes in the interaction between adipocytes and macrophages. Arterioscler Thromb Vasc Biol, 27, 84-91 (2007)



Yamauchi T, Kamon J, Wak H, Murakami K, Motojima K, Komeda K, Ide T, Kubota N, Terauchi Y, Tobe K, Miki H, Tsuchida A, Akanuma Y, Nagai R, Kimura S, Kadowaki T. The mechanisms by which both heterozygous peroxisome proliferator activated receptor gamma (PPARgamma) deficiency and PPARgamma agonist improve insulin resistance. J Biol Chem, 276, 41245- 41254 (2001).



Yim EJ, Jo SW, Lee ES, Park HW, Ryu MS, Uhm TB, Kim HY, Cho SH. Fermentation characteristics of mulberry (
Cudrania tricuspidata) fruit vinegar produced by acetic acid bacteria isolated from traditional fermented foods. Korean J Food Preserv, 22, 108-118 (2015)


Yoon SY, Kim SJ, Sim SJ, Lee HJ. Development of quantitative analytical method for isoflavonoid compounds from fruits of
Cudrania tricuspidata. J Korean Wood Sci Technol, 44, 337-349 (2016)


Yu C, Chen Y, Cline GW, Zhang D, Zong H, Wang Y, Bergeron R, Kim JK, Cushman SW, Cooney GJ, Atcheson B, White MF, Kraegen EW, Shulman GI. Mechanism by which fatty acids inhibit insulin activation of insulin receptor substrate-1 (IRS-1)- associated phosphatidylinositol 3-kinase activity in muscle. J Biol Chem, 277, 50230-50236 (2002)



Zhou L, Yang Y, Wang X, Liu S, Shang W, Yuan G, Li F, Tang J, Chen M, Chen J. Berberine stimulates glucose transport through a mechanism distinct from insulin. Metabolism, 56, 405-412 (2007)



Zick Y. Insulin resistance: A phosphorylation-based uncoupling of insulin signaling. Thnds Cell Biol, 11, 437-441 (2001)