서 론
체내에서 염증반응은 주로 대식세포(macrophage)와 미세아교세포(microglia)에 의해서 조절되는데, 미세아교세포는 뇌의 해마에 다량 존재하는 대식세포이고 단핵구(monocyte)에서 분화되어 중추신경계(central nerve system)에 산재하는 비신경세포이다(Kreutzberg, 1996). 뇌 손상이나 감염 등에 의해 염증반응을 증가시키는 nitric oxide(NO), cyclooxygenase-2 (COX-2)와 같은 염증 매개체들과, interleukin-1β(IL-1β), IL-6, tumor necrosis factor-α(TNF-α)와 같은 염증성 싸이토카인의 분비량이 증가하여 알츠하이머 질환(Alzheimer’s disease), 파킨슨 질환(Parkinson’s disease) 등과 같은 퇴행성 신경 질환의 주요 원인이 되는 것으로 알려져 있다(McGeer과 McGeer, 2004). 염증이 과하게 증가하면 NO 분비량이 증가하고, NO는 peroxynitrite(ONOO-), superoxide anion(O2∙-), H2O2 등과 같은 활성산소종(reactive oxygen species, ROS)을 생성하여 체내 산화적 스트레스(oxidative stress)를 증가시킨다(McCord, 1974; Ryu 등, 2003). 따라서, 이러한 염증 유발 매개체들과 염증성 싸이토카인의 분비를 조절하는 것이 염증성 질환을 치료할 수 있는 방법으로 제시되고 있다.
참취(Aster scaber)는 우리나라에서 나물로 식용되어 오거나 약용으로 사용되는 산채류 중의 하나로 함유된 주요 물질인 astragalin(Ast)과 isoquercitrin이다(Chung 등, 2016).
Astragalin은 대식세포에서 염증반응에 의해 활성화된 NF-kB/mitogen-activated protein kinases(MAPKs) 신호전달 경로(signaling pathway)를 억제함으로써 IL-1β, IL-6 그리고 TNF-α 분비량을 감소시켜 항염증 반응이 있다는 것이 이미 보고되었다(Li 등, 2017; Soromou 등, 2012). 그러나 활성화된 미세아교세포에서 과량 분비되는 NO에 대항하여 참취에서 분리된 astragalin이 뇌신경세포를 보호할 수 있는지에 관한 연구는 전무하다.
본 연구에서는 참취에서 분리된 astragalin의 Raw264.7 대식세포에서 항염증 효과 및 MAPK 신호전달 경로에 관한 기전 연구를 하였고, 뇌 해마와 같은 미세아교세포와 뇌신경세포가 공존하는 유사 조건을 만들어 미세아교세포가 염증반응으로 과량의 NO가 분비될 때 astragalin이 뇌신경세포를 보호할 수 있는지 알아보았다.
재료 및 방법
본 연구에 사용한 참취(A. scaber)는 강원도 양양에서 채취하였고, 세척 및 건조 후 에탄올을 가한 뒤 환류 장치를 이용하여 추출한 후 Whatman NO.1 filter paper(Whatman International Ltd., Springfield Mill, Kent, UK)로 여과하여 감압 농축기(Büchi Rotovapor R-205, Büchi Labortechnik AG, Switzerland)를 사용하여 농축하였다. 농축된 추출물은 물에 현탁하여 용매 극성 차이에 따라 헥산(hexane), 클로로포름(chloroform), 에틸아세테이트(ethyl acetate), 부탄올(butanol) 및 물(aqueous) 분획물 순서로 분획물들을 얻은 후 감압 농축기(Büchi Rotovapor R-205)를 사용하여 분획 용매를 제거한 후 동결건조기(Clean vac 8, Hanil, Incheon, Korea)로 동결건조 한 분말은 -20°C에 보관하였다. 헥산, 클로로포름, 에틸아세테이트, 부탄올 및 물 분획물의 동결건조 분말을 각각 HX, CH, EA, BU 및 AQ라 하였다. 에탄올 추출물의 동결건조 분말은 EtOH라고 하였다.
2,2-diphenyl-1-picrylhydrazyl(DPPH; Sigma-Aldrich Co., St. Louis, MO, USA) free radical 소거활성은 참취(A. scaber) 추출물 및 분획물들인 EtOH, EA, BU, AQ, CH 그리고 HX을 4, 8, 15, 30, 60, 125, 250 그리고 500 μg/mL 농도로 제조한 후 시료(540 μL)와 DPPH(1.5×10-4 M, 360 μL) 용액을 섞은 후 37°C에서 30분간 반응시켰다. UV-vis spectrophotometer (Model Ultrospec 3000, Pharmacia Biotech, Cambridge, England)로 517 nm에서 흡광도를 측정하였다. DPPH 라디칼 소거 활성은 대조구에 대한 시료 첨가구의 흡광도를 비교하여 [1 - (시료의 흡광도 / 대조구의 흡광도)] × 100에 의하여 %로 나타내었다.
Agilent reverse-phase HLPC system(Agilent 1260 Infinity II Quat Pump, CA, USA; DAD WR detector, CA, USA) 에 INNO C18 역상 칼럼(25 cm × 4.6 mm, 5 μm; Young Jin Biochrom Co. Ltd., Korea)을 장착하여 분석하였다. 0.5% acetic acid가 포함된 물과 acetonitrile 용매 조성이 90:10에서 30분 후 50:50의 용매 조성이 되게 기울기 용리 방법으로 분석하였다. 파장은 270 nm, 유속은 1 mL/min 그리고 주입량은 10 μL이었다.
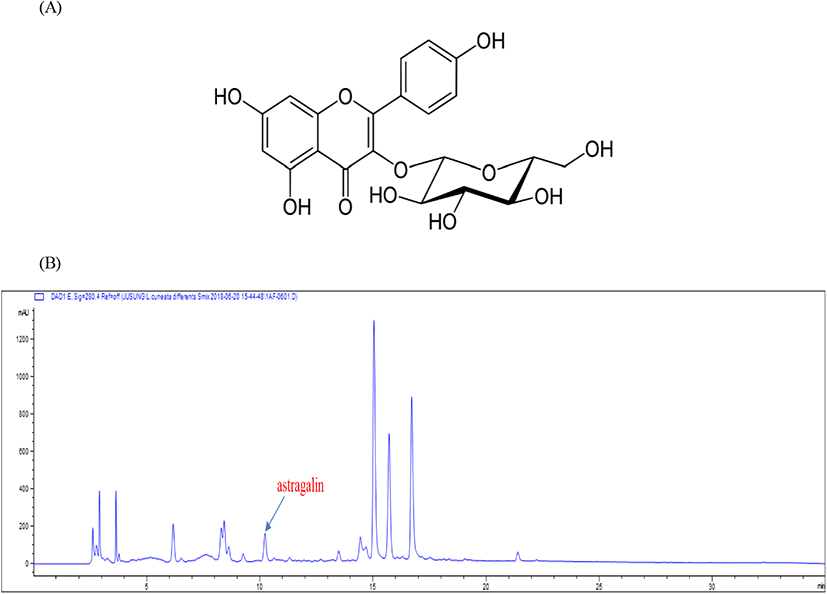
참취(Aster scaber) 에탄올 추출물 및 그 분획물들의 뇌신경세포 보호 효과(data not shown) 및 항산화 효과들을 분석한 결과, 가장 우수한 에틸아세테이트 분획물로부터 astragalin을 분리하였다. 즉, EA 13 g을 silica gel(200-400 mesh ASTM; Merck, Co., Germany) column에 dichloromethane을 이용하여 로딩(loading)하였고, dichloromethane 100%에서 methanol 100%가 되게 조정된 전개 용매를 이용하여 open chromatography로 총 17개의 소분획물(sub-fractions)을 얻었다. 그 중에서 sub-fraction 10을 재칼럼하여 12개의 소분획물(sub- fraction)을 분리하였으며, 그 중 sub-fraction 10-10을 박막크로마토그래피(prep-Thin Layer Chromatography, Merck, Darmstadt, Germany)를 이용하여 분리하였다. Kiesel gel 60 F254(Art. 5715, Merck Co., Darmstadt, Germany) plates(silica gel, 0.25 mm layer thickness)를 사용하여 분리된 물질들은 TLC 전개를 통하여 Rf값을 확인하면서 진행하였고, Rf값과 TLC의 패턴이 같은 물질끼리 grouping을 하였다(Lee 등, 2019). Grouping을 하여 얻은 총 3개의 sub-fraction을 재칼럼 한 결과 sub-fraction 10-10-2에서 astragalin을 얻었다. 물질 확인은 TLC를 이용하여 확인하였는데 TLC의 전개 용매 조성은 dichloromethane 80%, methanol 20%를 사용하여 시행하였다. 화합물의 구조동정은 Bruker AVANCE 500(Bruker, Bremen, Germany)를 이용해 측정한 1H-nuclear magnetic resonance(NMR) spectrum과 13C-NMR spectrum 분석을 통하여 하였고, 최종적으로 astragalin(=kaempferol 3-O-glucoside)으로 동정하였다(Chung 등, 2016).
마우스 대식세포주 Raw264.7 세포는 한국세포주은행(Seoul, Korea)에서 구입하여 사용하였고, 미세아교세포(microgila, EOC20)와 신경모세포종 SK-N-SH 세포는 ATCC(American Type Culture Collection, Manassas, VA, USA)에서 구입하여 사용하였다. Raw264.7 대식세포와 미세아교세포의 성장배지는 Dulbecco’s modified Eagle’s medium(DMEM; WelGene Co.)에 10% 비활성화 우태아 혈청(fetal bovine serum, FBS; WelGene Co., Daegu, Korea) 및 1% penicillin and streptomycin(PEST; WelGene Co.) 용액을 더한 것이고, SK-N-SH 세포의 성장배지는 Minimum Essential Medium Eagle(MEM; WelGene Co.)에 10% FBS 및 1% PEST를 함유한 것이다. Raw264.7 세포, 미세아교세포 및 SK-N-SH 세포에 배양 배지를 더한 후 5% CO2가 공급되는 배양기(Thermo Fisher Scientific, Waltham, MA, USA)에서 37°C 조건으로 배양하였다.
Raw264.7 대식세포, 미세아교세포(microgila, EOC20) 및 SK-N-SH 세포는 부착된 세포를 떼어 낸 후 24-well plates에 세포수를 1×105 cells/well로 조정하여 깐 후 24시간 동안 배양하여 2시간 기아 상태를 유지한 후 Raw264.7 대식세포에서 세포 독성을 알아보기 위해 Ast 0, 0.5, 1, 2.5 그리고 5 μg/mL 24시간 처리하였다. Sodium nitroprusside(SNP; Sigma- Aldrich Co., St. Louis, MO, USA) 처리농도를 정하기 위해 SK-N-SH 세포에 SNP 0, 0.025, 0.05, 0.1, 0.25, 0.5, 1, 2, 4 그리고 8 mM 24시간 처리하였다. 미세아교세포는 SNP 1 mM을 18시간 처리하였다. 더하여 SK-N-SH 세포는 Ast 0.5, 1, 2.5 그리고 5 μg/mL 처리한 2시간 후 1 mM SNP를 처리하여 18시간 재배양하였다. SK-N-SH 세포와 미세아교세포 혼합시스템에서 SK-N-SH 세포의 세포 생존율을 측정하였다. 혼합시스템에서의 처리농도는 “신경세포와 미세아교세포 혼합시스템 구축” 실험방법에 자세히 설명하였다.
세포 생존율은 Kim 등(2018)이 사용한 3-(4,5-dimethythiazol- 2-yl)-2,5-dipheyl terazolium bromid(MTT) 환원 방법을 이용하여 측정하였다. 시료 처리가 끝이 난 세포에 FBS가 함유되어 있지 않은 배지에 MTT 용액(5 mg/mL)을 10분의 1을 넣었다. 50 mL가 필요할 경우 1% PEST만 든 배지 45 mL와 MTT 용액(5 mg/mL) 5 mL를 섞어 준비하였다. 각 well에 MTT 용액이 든 배지로 교체한 후 다시 37°C에서 4시간 더 배양하였다. MTT를 환원시켜 생성된 formazon이 배지에 따라 나가지 않도록 배지를 조심스럽게 제거하고, 남아 있는 배지를 완전히 제거하기 위해 실온에서 30분간 방치한 후 DMSO(Sigma-Aldrich Co.)를 이용하여 시료를 녹였다. UV-vis spectrophotometer(Model Ultrospec 3000)로 570 nm에서 흡광도를 측정하였다. 흡광도 측정 시 공시료는 DMSO로 하였고, 세포의 생존율은 아래와 같이 계산하였다.
부착된 세포를 떼어 낸 후 성장 배지에 세포수를 1×105 cells/well로 조정하여 24-well plates에 세포를 깐 후 24시간 동안 배양하여 2시간 기아 상태를 유지한 후 Ast 0.5, 1, 2.5 그리고 5 μg/mL를 2시간 동안 처리하였다. Raw264.7 대식세포는 2시간 후 0.5 μg/mL의 LPS를 처리한 후 18시간 재배양하였다. 혼합시스템에서의 처리농도는 “신경세포와 미세아교세포 혼합시스템 구축” 실험방법에 자세히 설명하였다. 세포 배양 상등액과 동량의 Griess 시약(1% sulfanilamide in 5% phosphoric acid and 1% α-naphtylamide in H2O)을 넣어 혼합하고 암실에서 10분간 반응시킨 후, UV-vis spectrophotometer(Model Ultrospec 3000)로 540 nm에서 흡광도를 측정하였다. NO의 농도는 NaNO2(sodium nitrite)를 농도별로 희석하여 준비한 시료의 흡광도 값으로 그린 검량선으로 산출하였다(Choi 등, 2008).
Raw264.7 대식세포를 6-well plates에 세포수를 1×106 cells/well로 조정하여 깐 후 24시간 동안 배양하였다. 시료 처리는 2시간 기아 상태를 유지한 후 Ast 0.5, 1, 2.5 그리고 5 μg/mL를 2시간 동안 처리하였고, 2시간 후 0.5 μg/mL의 LPS를 처리한 후 30분간 재배양한다. Radioimmunoprecipitation assay(RIPA) buffer(50 mM Tris, 150 mM NaCl, 2 mM EDTA, 0.1% Tween-20, 0.1% SDS, pH 7.8)에 protease와 phosphatase inhibitor cocktails(Roche Applied Science, Mannheim, Germany)을 더하여 준비하였다. 배양이 끝난 세포를 Dulbecco’s phosphate buffered saline(DPBS, 1× WelGene Co.)로 3회 세척하였다. RIPA buffer를 첨가하여 세포 균질액을 얻은 후 원심분리(13,000 rpm, 10분, 4°C)하여 상층액을 얻었다. 상층액의 단백질 함량은 Bio-Rad protein kit(Hercules, CA, USA)을 이용하여 제조사 지침에 따라 측정하였다. 20 μg 단백질을 함유한 상층액을 12% sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS- PAGE)로 크기별로 분리한 후, 이 gel을 nitrocellulose blotting membrane(GE Healthcare Life Sciences, Freiburg, Germany)으로 전이시켰다. Antibody의 비특이적 결합을 억제하기 위해 5% non-fat dry milk 용액을 각각의 membrane이 잠길 정도로 부어 1시간 반응을 시킨 후 TBS-T(20 mM tris-HCl, 150 mM NaCl, 0.05% Tween-20, pH 7.5)로 15분씩 3회 세척하였으며, p-Erk(phospho-Erk; Cell Signaling Technology, Danvers MA, USA), Erk(Cell Signaling Technology), p-p38(Cell Signaling Technology), p38(Cell Signaling Technology)과 β-actin(Cell Signaling Technology) 1차 항체를 1:1,000으로 희석하여 첨가한 후 4°C에서 18시간 동안 overnight 하면서 반응시킨 다음 TBS-T로 15분씩 3회 세척하였다. 이후 1:2,000으로 희석한 2차 항체(anti-rabbit IgG, HRP-linked antibody; Cell Signaling Technology)를 1시간 동안 반응시켰다. TBS-T로 15분마다 3회 세척 후 2차 항체와 결합된 단백질은 AbSignal western detection kit (AbClon Inc., Seoul, Korea)으로 처리하였고, 암실에서 Agfa X-ray film(Agfa HealthCare NV, Mortsel, Belgium)으로 밴드를 시각화하여 스캔하였다. 그 밴드의 강도를 SigmaGel (Jandel Scientific, San Rafael, CA, USA) 소프트웨어에 의해 분석 정량하였고, 단백질 정량은 β-actin을 참고로 하여 분석하였다.
Raw264.7 대식세포는 12-well plates에 세포수를 1×105 cells/well로 조정하여 깐 후 24시간 동안 배양하여 2시간 기아 상태를 유지하였다. Raw264.7 대식세포에 Ast 0, 1, 2.5 그리고 5 μg/mL을 2시간 동안 처리한 후 대조군을 제외하고 0.5 μg/mL의 LPS를 처리하여 18시간 재배양한 후 배양 배지를 얻어 원심분리(10,000 rpm, 10분, 4°C)하였다. 원심분리 후 상층액에 함유된 TNF-α과 IL-6 사이토카인 분비량을 ELISA kit(eBioscience Co., San Diego, CA, USA)를 이용하여 제조사 지침에 따라 측정하였다.
미세아교세포(EOC-20 microglial cells, 1×105 cells/cell insert)는 Falcon cell inserts(Cyclopore polyethylene terephthalate ‘filters’, Pore density: 1.6±0.6×106/cm2, pore size: 0.1 μm)에 분주하였고, 뇌신경세포인 SK-N-SH 세포(1×105 cells/well)는 12-well culture plate에 분주하였다. Falcon cell inserts는 12-well culture plate에 걸 수 있고 cell inserts의 일정 부분이 12-well culture plate에 잠겨 미세아교세포와 SK-N-SH 세포가 서로 물질교환이 가능할 수 있는 시스템을 만들었다. 12-well culture plate에 배양하고 있는 SK-N-SH 세포에 Ast 1 그리고 5 μg/mL을 처리하였고, 동시에 cell inserts에 배양 중인 미세아교세포는 1 mM SNP를 처리하여 18시간 배양하였다. 이때 SK-N-SH 세포를 배양 중인 12-well culture plate에 첨가한 astragalin이 함유한 배지의 양은 1 mL로 cell inserts가 SK-N-SH 배양 plate에 1/2 정도 잠겨 서로 물질교환이 가능할 수 있는 시스템을 구축하였다.
결과 및 고찰
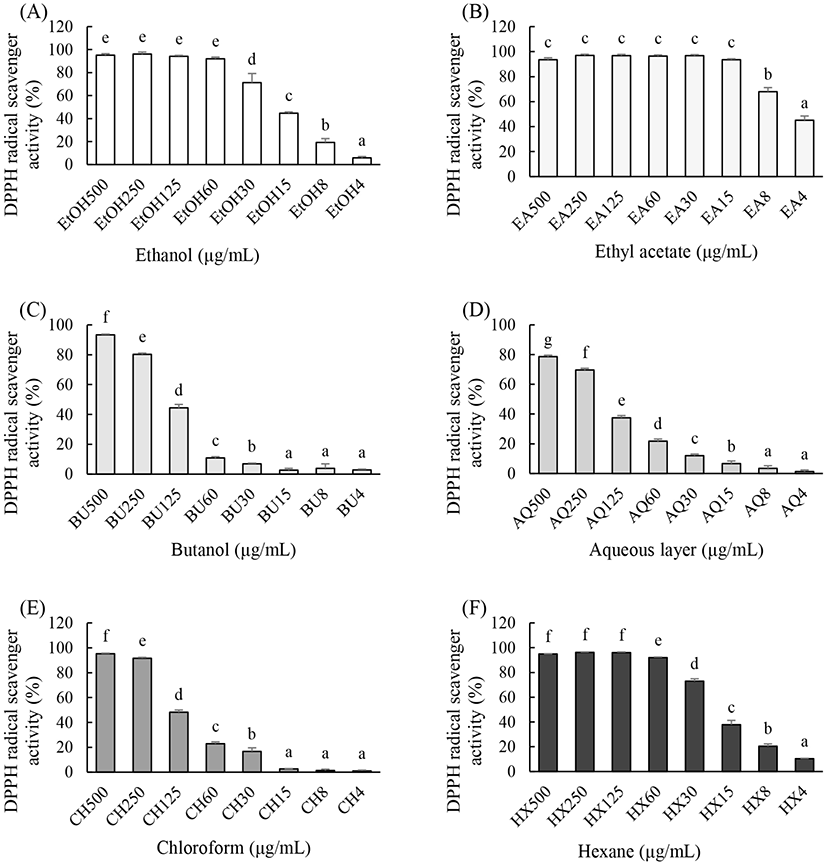
참취 에탄올 추출물(EtOH), 에틸아세테이트 분획물(EA), 부탄올 분획물(BU), 클로로포름 분획물(CH), 헥산 분획물(HX) 및 물층(AQ)의 DPPH 라디칼 소거작용을 알아본 결과 실험한 모든 시료 중에 EA가 가장 높은 DPPH 라디칼 소거작용을 나타내었다(Fig. 1(B)). 항산화 효과가 뛰어난 EA로부터 astragalin을 Chung 등(2016)과 같은 방법으로 분리 및 분석하였고, 참취 에탄올 추출물을 HPLC로 분석한 결과 astragalin이 함유되어 있다는 것을 알 수 있었고(Fig. 2(B)), 참취 추출물의 EA로부터 얻은 astragalin(Fig. 2(A))을 본 연구에 사용하였다.
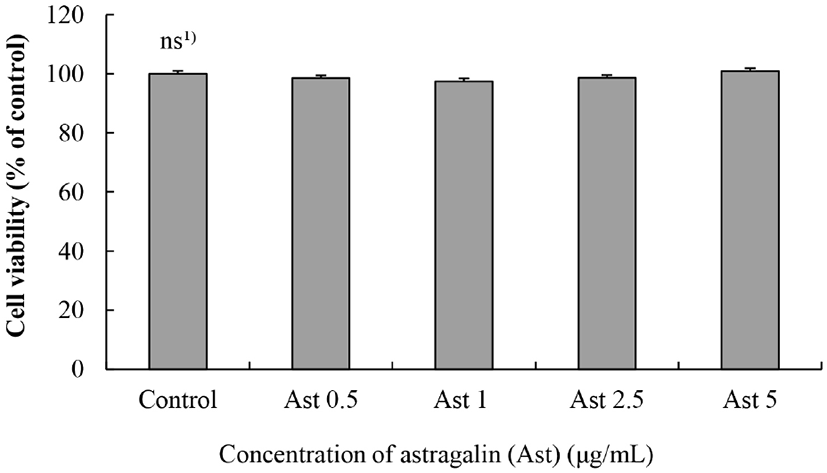
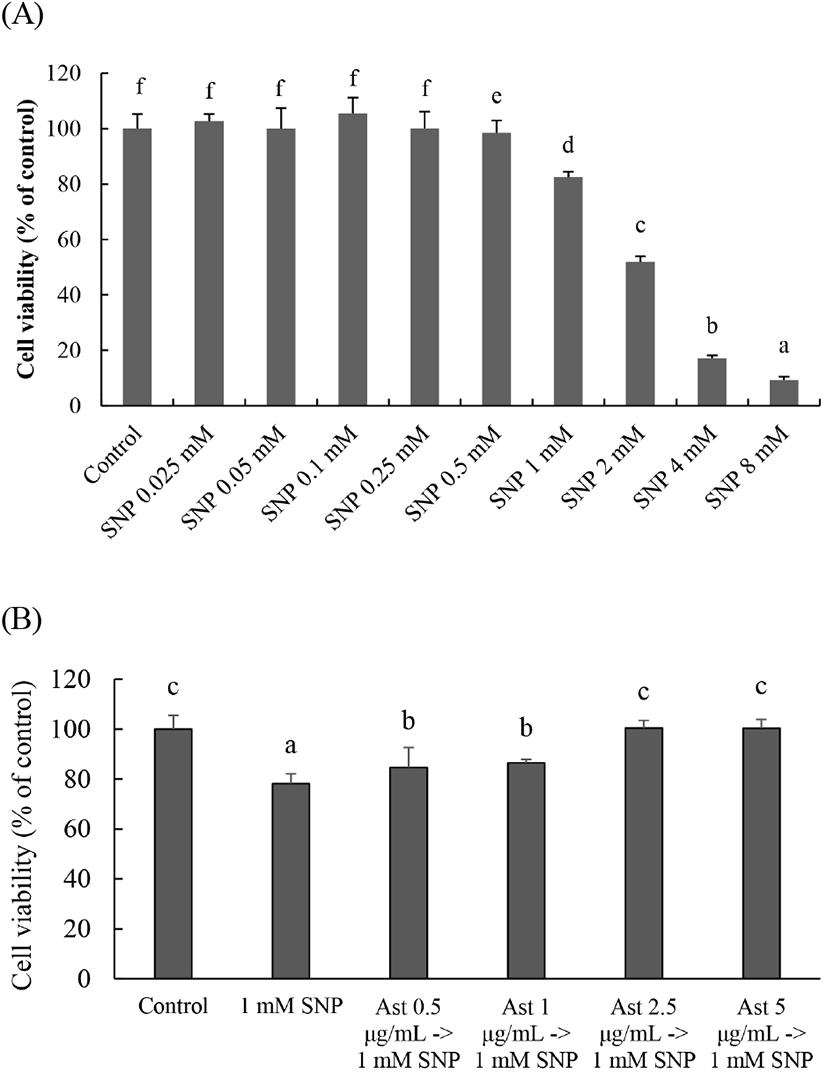
Raw264.7 대식세포에 0.5, 1, 2.5 그리고 5 μg/mL Ast를 처리하여 24시간 동안 배양한 후 세포독성을 알아본 결과는 Fig. 3과 같다. 참취(Aster scaber)에서 분리된 Ast는 모든 농도에서 세포 생존율이 Ast를 처리하지 않은 대조군(100%)과 비교하여 유의적 차이가 없었으므로, Ast는 5 μg/mL까지 세포독성이 없다는 것을 알 수 있었다(Fig. 3). 따라서 독성이 나타나지 않는 5 μg/mL Ast를 최고 농도로 하여 계속되는 실험을 진행하였다.
내독소의 하나인 LPS를 처리한 후 대식세포에서 과량의 전염증성 사이토카인(TNF-α, IL-6, IL-1β 등), NO 등의 과분비를 확인함으로써 염증 유발 세포모델이라는 것을 알 수 있다(Lee과 Lim, 2008).
본 연구에서는 astragalin의 항염증 효과를 알아보기 위해 Raw264.7 대식세포에 Ast를 먼저 처리한 후 LPS를 처리하였다. Ast 0.5, 1, 2.5 그리고 5 μg/mL를 처리한 결과 LPS에 의해 과분비 된 NO가 농도 의존적으로 감소하였다(Fig. 4(A)). Ast를 처리한 후 LPS를 처리하였고, 18시간 후 배지에 TNF-α와 IL-6 분비량을 측정한 결과 LPS에 의해 과분비 된 TNF-α와 IL-6 분비량 농도 의존적으로 감소하였다(Fig. 4(B), 4(C)).
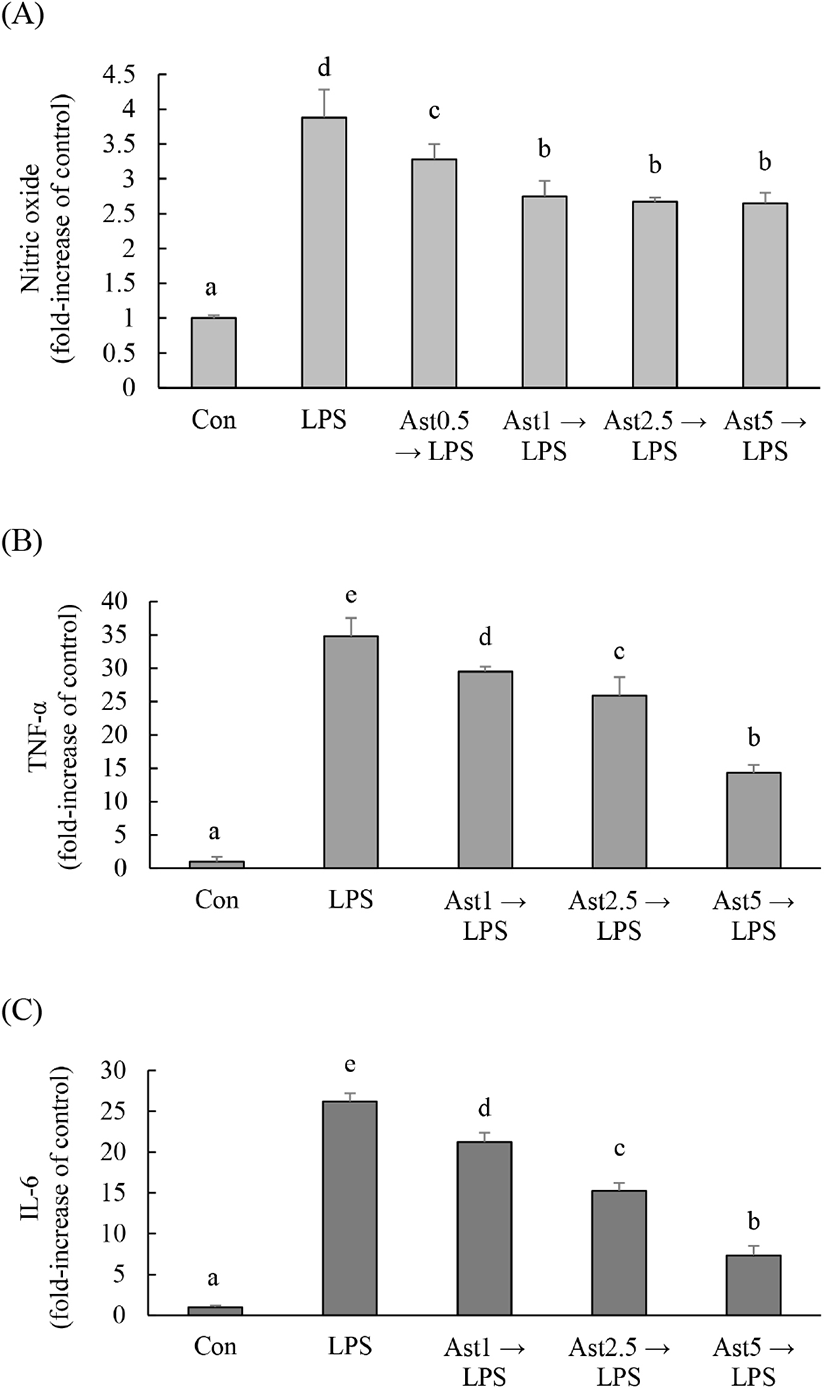
마우스 복강대식세포에서 상엽 유래 astragaline을 처리한 2시간 후에 LPS(1 μg/mL)로 자극하여 24시간 배양한 다음 세포 상층액을 분리하여 NO, PGE2 와 IL-6를 측정한 결과 astragalin 처리로 이들 물질이 유의적으로 감소하였다고 하였는데 본 연구 결과와 유사하였다(Mok 등, 2011). 마우스에 astragaline을 구강 투여 후 LPS를 처리했을 때 폐에서 LPS에 의해 유도된 NF-kB/MAPK 활성을 억제함으로써 TNF-α, IL-1β 그리고 IL-6의 함량을 감소시켰다(Li 등, 2017; Soramou 등, 2012). 따라서 본 연구에서는 참취에서 분리된 astragalin이 대식세포에서 어떤 기전에 의해 NO 및 cytokines 생성을 억제하는지 알아보았다.
대식세포 내 Erk, JNK 및 p38을 포함한 MAPKs 신호 경로는 염증성 시스템의 중요한 신호전달 반응을 매개하고(Erwig과 Henson, 2007; Medzhitov과 Janeway, 1998), 항염증 효과를 가진 천연소재들은 NF-κB/MAPK 신호 전달경로를 억제함으로써 LPS에 의해 활성화된 Raw264.7 세포에서 염증성 사이토카인 분비를 억제하는 것으로 알려져 있다(Li 등, 2017).
참취에서 분리한 astragalin 0, 0.5, 1, 2.5 그리고 5 μg/mL를 2시간 처리 후 LPS를 30분 처리한 결과 LPS 처리한 Raw264.7 대식세포 내 Erk와 p38의 인산화(p-Erk와 p-p38)가 무처리군인 대조군과 비교하여 3.4배와 2.4배 증가하였고, Ast 처리에 의해 증가한 p-Erk와 p-p38 단백질 함량이 유의적으로 감소하였다(Fig. 5).
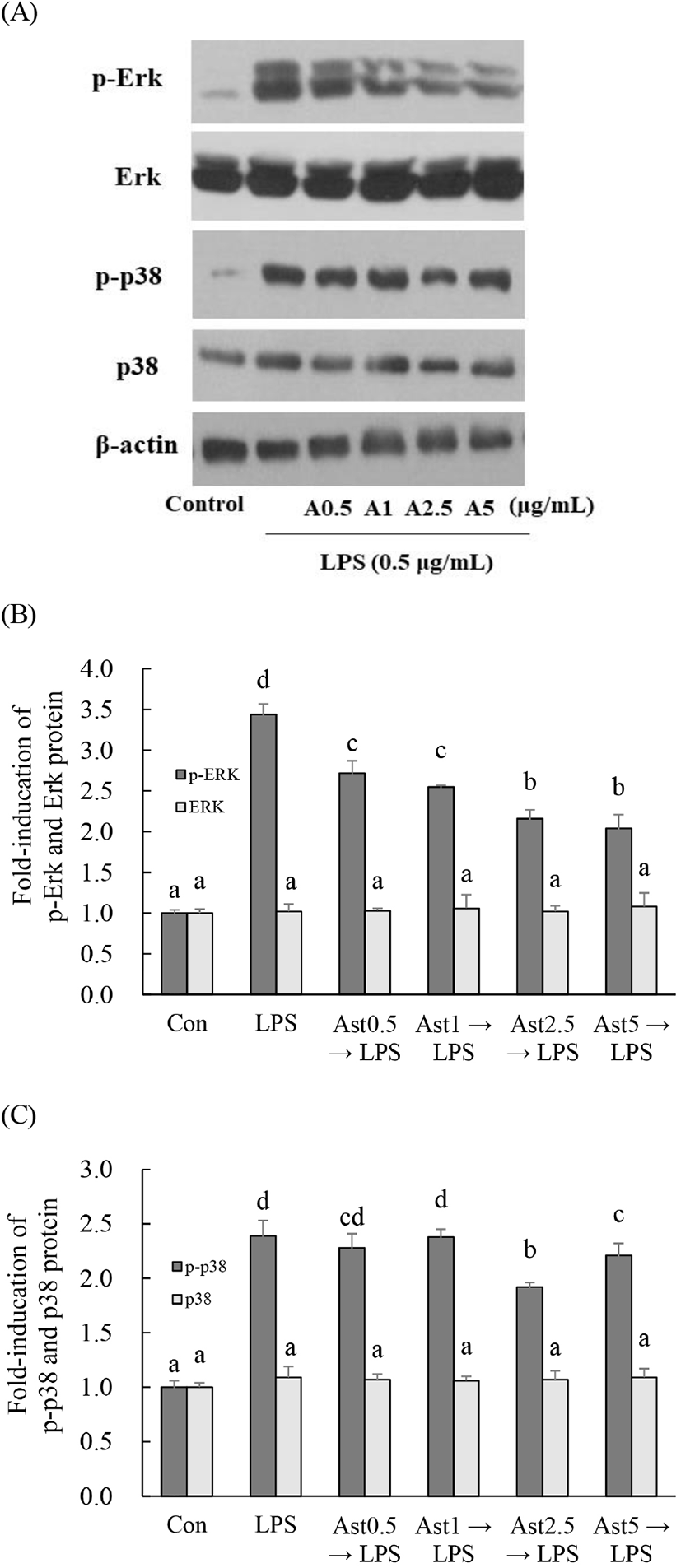
Raw264.7 대식세포에서 LPS에 의해 증가한 MAPKs(Erk, JNK 그리고 p-38)의 신호 전달 경로는 헛개나무 추출물, stevioside 그리고 7,8-dihydroxyflavone에 의해 억제되었다(Fengyang 등, 2012; Park 등, 2012; Woo 등, 2018). Raw264.7 대식세포에서 Koumine과 isoquercitrin은 LPS 처리로 활성화된 ERK와 p38 신호전달경로 억제를 통해 항염증 효과를 나타낸다고 하였는데(Lee 등, 2019; Yuan 등, 2016), 본 연구에서도 astragalin에 의해 억제된 Erk와 p38의 신호 경로에 의해 염증성 사이토카인 분비가 감소되어 항염증 효과를 나타낼 수 있을 것으로 예측된다.
본 연구에서는 계속하여 대식세포의 항염증 효과를 가진 astragalin이 해마에 신경세포와 함께 분포된 활성화된 미세아교세포에서 과량으로 분비되는 NO를 감소시켜 뇌신경세포 보호 효과를 가지고 있는지 알아보는 실험을 진행하였다. SNP는 세포내에서 NO를 과량 생성할 수 있는 NO donor로 사용하였다.
인간 신경모세포종 SK-N-SH 세포에 0.025, 0.05, 0.1, 0.25, 0.5, 1, 2, 4 그리고 8 mM SNP를 18시간 처리한 결과, 0.5 mM SNP 처리군에서는 대조군과 비교하여 유의적 차이가 없었고 1 mM SNP 처리에 의해 대조군(생존율 100%)과 비교하여 생존율이 82.4%로 유의적으로 SK-N-SH 세포가 사멸하였다(Fig. 6(A)). Ast 0.5, 1, 2.5 그리고 5 μg/mL를 2시간 동안 처리한 후 1 mM SNP를 18시간 처리한 결과, 농도 의존적으로 SN-N-SH 세포 생존율이 증가하여 Ast 2.5 그리고 5 μg/mL 처리군은 LPS를 처리하지 않은 대조군 수준으로 회복하였다(Fig. 6(B)). 미세아교세포(EOC20)에 1 mM SNP를 18 h 처리한 결과, 세포 생존율은 90%이고, NO는 무처리군인 대조군과 비교하여 약 18배 증가하였다(data not shown).
알츠하이머 질환(Alzheimer’s disease)은 뇌 내 amyloid β(Aβ) 펩타이드가 비정상적으로 다량 만들어져 뇌 조직에 senile plaque가 형성되면 microglia가 이를 항원으로 인식하여 활성화되고 염증을 일으키는 proinflammatory cytokines 및 NO를 과량 방출하여 염증 반응을 유발한다(Selkoe, 2001). 미세아교세포와 뇌신경세포가 공존하고 있는 뇌 해마에서 활성화된 미세아교세포는 과량의 NO, proinflammatory cytokines를 분비하여 뇌신경세포가 손상되어 알츠하이머 질환, 파킨슨 질환(Parkinson’s disease) 등과 같은 퇴행성 신경 질환이 유발될 수 있다(Chung 등, 2016; Lee 등, 2018; Lee 등, 2019; Meda 등, 1995). 본 연구에서는 미세아교세포와 뇌신경세포가 공존해 있는 해마와 같은 유사한 시스템을 구축하기 위해 미세아교세포(EOC-20 microglia)는 cell inserts에 배양하였고, 뇌신경세포(SK-N-SH 세포)는 cell inserts를 걸 수 있도록 제작된 12-well culture plate에 배양하였다.
활성화된 미세아교세포(microglia)는 TNF-α, IL-6 그리고 NO를 과량 분비하여 염증을 유발하고, 뇌의 해마에 존재하는 미세아교세포 활성화에 의한 cytokines와 NO의 과량 분비는 뇌염증을 유발할 수 있으며, 이들 물질을 억제하는 항염증 효과 및 뇌염증 효과에 의한 뇌질환 예방 및 개선 천연소재 발굴이 가능할 것이다(Yang 등, 2020).
SNP는 NO donor로 이것을 처리하면 미세아교세포가 염증반응에 의해 NO가 증가한 것과 같은 과량의 NO가 생성된 염증세포 모델이 될 수 있다(Lee 등, 2019). Cell inserts는 물질교환이 가능한 막으로 구성되어 있으며 1/2정도 12-well culture plate에 잠겨 있으므로 SNP 처리에 의한 미세아교세포로부터 과분비 되는 NO가 cell inserts 막을 통해 아래에 배양 중인 SK-N-SH 세포 사멸에 영향을 줄 수 있도록 혼합배양 시스템을 구축하였다.
미세아교세포에 대조군을 제외하고 모든 군에 1 mM SNP를 처리할 때 SK-N-SH 세포 내 NO의 함량은 대조군보다 현저하게 증가하였고, SK-N-SH에 Ast 처리로 이들 증가는 유의적으로 감소하였다(Fig. 7(A)). SK-N-SH 세포의 세포 생존율은 미세아교세포에 처리한 SNP 처리 때문에 유의적으로 감소하였으나 SK-N-SH 세포에 Ast를 처리했을 때 세포 생존율이 유의적으로 증가하였다(Fig. 7(B)).
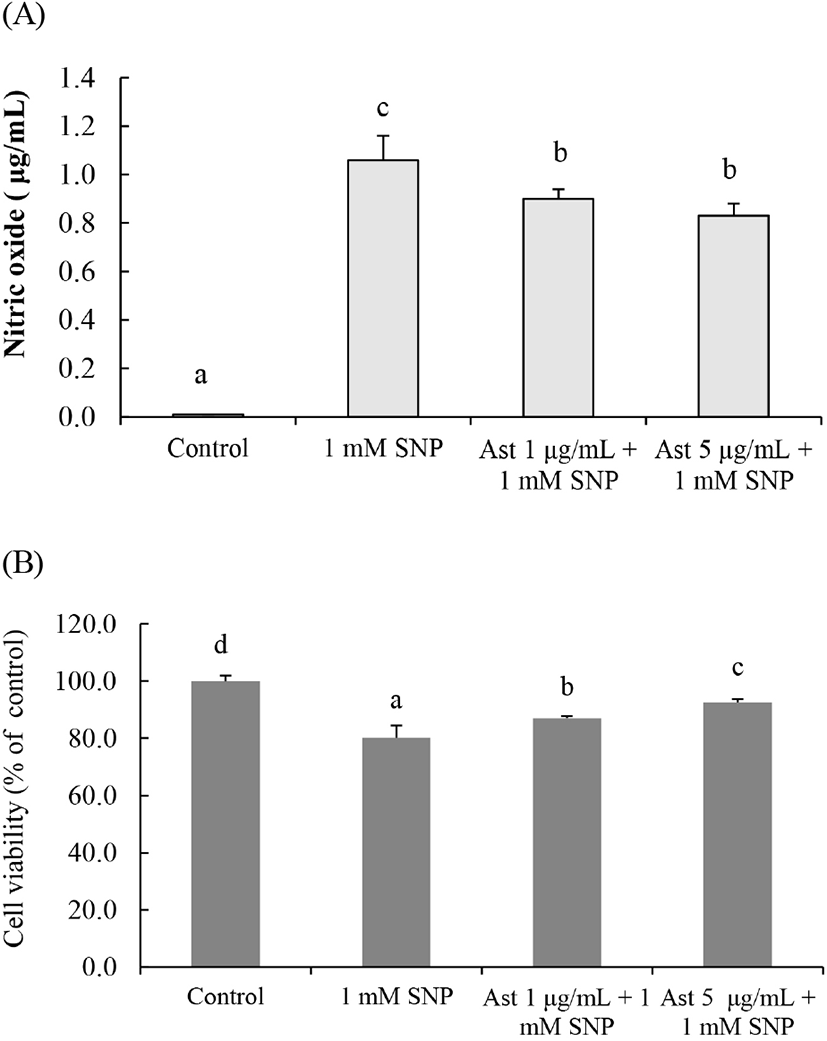
따라서 본 연구 결과는 해마에서 미세아교세포가 활성화되어 과량의 NO를 분비하여도 Ast에 의해 뇌신경세포 사멸이 억제될 수 있을 것이라는 것을 추측할 수 있지만 Ast가 해마까지 물질 전달이 가능한지에 관한 연구들이 필요할 것으로 생각된다.
