서 론
전통적인 한국 주류에는 약주, 탁주, 청주 등이 있으며, 가장 오래된 전통주 중 하나인 약주는 전통적으로 쌀과 누룩, 물 등을 원료로 하여 제조되었으나, 최근 들어 전분질 원료, 국, 물 등을 주원료로 발효시킨 술덧을 여과하여 제조되고 있다(Lee 등, 1996). 품질이 우수한 약주의 생산을 위해 좋은 원료와 우수한 효모를 사용하는 것이 필수적인 요인이나, 우리나라 약주의 제조를 위한 종균 제품이 자체 개발된 바가 없으며, 재래 종균을 사용하여 약주를 제조할 시 제품의 균일성을 유지하기 어렵기 때문에 상업화하기 힘든 실정이다 (Park 등, 2012). 이에 따라 수입 종균을 대체하기 위해 국산 종균의 발굴과 종균 제조 기술의 개발이 필요하다(Kim 등, 2018). 약주에 사용되는 전분질 원료의 종류는 곡류, 서류와 이를 가공하여 만든 당류 등이 있으며 곡류는 주로 쌀과 잡곡인 소맥분, 옥수수, 보리쌀 등이 있고, 서류는 고구마, 당류는 전분당이 있다. 쌀은 약주의 가장 중요한 원료로 찹쌀의 전분은 amylopectin으로 구성되어 있으며, 멥쌀의 전분은 amylose (20-25%), amylopectin(75-80%)으로 구성되어 있다. Amylose와 amylopectin 함량 차이에 따라 수분흡수율, 흡수 속도, 증자 조건 등이 달라지며, 찹쌀과 멥쌀에 따라 약주 주질의 특성이 달라진다(Kwon 등, 2010). 발효 과정에서 효모는 당을 알코올로 전환하고 휘발성 향기 성분과 대사산물의 생산에 있어서 중요한 역할을 하며, 효모가 생산하는 효소에 따라 발효주의 특성이 달라진다(Pires 등, 2014). Saccharomyces cerevisiae를 산업적으로 이용하기 위해서는 일반적으로 복원성과 저장성을 높이는 종균화 과정을 거치게 된다. 효모의 종균화 제품은 고상형과 액상형 제품 두 종류가 있으며, 산업적으로는 분말 형태의 고상형 건조 제품이 주로 이용된다. 종균 제품의 제조에 가장 많이 이용되는 건조 기법의 하나인 동결건조의 경우에는 고정단가와 제조단가가 진공건조, 분무건조, 드럼건조, 유동층 건조, 송풍건조 등에 비하여 월등히 높다는 단점을 지니고 있다. 이 중에서 송풍건조는 동결건조 대비 고정단가 비율이 5.3%, 제조단가의 비율이 17.9%로 생산비용이 매우 저렴하며(Santivarangkna 등, 2007), 높은 온도로 건조시키는 분무건조, 유동층 건조 등의 기법에 비하여 매우 높은 생존율을 나타내어 대체 건조 기법으로 기대되고 있다(Lee 등, 2016a). 건조 종균 제품 제작을 위한 기술로써 송풍건조를 보편화하기 위해서는 기존의 동결건조 제품에 상응하는 균체 생존율을 확보하는 것이 중요하며, 미생물의 건조 과정 중에 생존율에 영향을 미치는 인자로는 배양 배지 조건, 초기 미생물 농도, 보호첨가제, 재수화 조건 등이 있다. 보호첨가제의 경우에는 미생물 종류에 따라 세포벽의 구성 등이 달라 서로 다른 최적 조건을 가지고 있다(Costa 등, 2000; de Valdez 등, 1983; Lee 등, 2016b). 또한, 건조된 미생물은 재수화 과정에서 다시 활성을 띄게 되며, 재수화 용액 등의 환경에 의해 생존율에 영향을 미친다는 연구도 보고되어 있으며(Leach, 1959; Rodriguez-Porrata, 2008), S. cerevisiae D8 효모에 대하여 저온송풍건조를 진행하여 건조 직후 최대 97.54%의 높은 생존율을 나타내고, 2달간 보관하였을 때도 매우 우수한 생존율을 나타냄을 확인해 송풍건조가 동결건조의 대체 기술이 될 가능성을 지님을 확인한 연구도 보고되어 있다(Lee 등, 2016a). 본 연구에서는 저온 발효능이 우수한 토착형 효모를 이용하여 쌀 종류별(멥쌀, 찹쌀, 멥쌀·찹쌀 혼합) 약주 발효특성을 조사하고, 저온송풍건조를 통하여 약주용 효모를 종균화 하였으며, 적합한 건조보호제와 재수화 용액 조건에 관해 저장성을 확인하였다.
재료 및 방법
약주 제조에 사용된 원료미는 2019년에 생산되고 2020년 8월 도정된 동진찰 품종 찹쌀(대구시 달성군)과 2019년에 생산되고 2020년 8월 도정된 백진주 품종 멥쌀(경기도 연천군)을 구입하여 사용하였다. 입국은 ㈜조은곡식(경기도 화성군)에서 생산된 쌀입국(Aspergillus luchuensis, sp 60)을 사용하였고, 양조 용수는 시판 생수(삼정샘물, 울산시 울주군)를 구입하여 사용하였다. 본 연구에 사용한 효모는 저온 발효능 및 β-glucosidase 활성이 우수하여 약주 발효에 적합한 Saccharomyces cerevisiae W153과 S. cerevisiae W149를 사용하였고(Park, 2020), 대조균주로는 탁약주 제조용 효모인 S. cerevisiae KCCM 11215를 이용하였다. 모든 균주는 YPD 액체 배지(2% glucose, 2% peptone, 1% yeast extract)에 균주의 전 배양액을 균주별로 5%(v/v)씩 접종하여 30°C, 150 rpm으로 배양해 효모의 활성이 가장 뛰어난 시점에 원심 분리(SUPRA 22k PLUS, Hanil Co., Daejeon, Korea) 후 활용하였다.
약주 제조는 일반적인 전통 약주의 담금법을 일부 변형하여 제조하였다(Kwon 등, 2010). 주모 제조는 도정된 각 원료쌀 80 g을 세척하여 1시간 동안 수침한 다음, 1시간 정도 물빼기를 수행하고, 찜통에서 40분간 증자하여 고두밥을 제조하였다. 상온에서 냉각한 고두밥에 입국 40 g과 생수 240 mL를 혼합한 후 각 효모를 YPD 액체배지 15 mL에서 배양시켜 집균한 후 접종하여 주모를 제조하였다. 주모는 15°C에서 3일간 발효하였다. 본 담금은 주모 제조와 같은 방식으로 쌀 1 kg을 세척, 침지, 증자한 고두밥을 사용하였고, 시료별로 찹쌀과 멥쌀의 비율을 달리 하였다. 이렇게 제조한 고두밥을 넣은 발효조에 입국 500 g, 생수 2.25 L를 넣은 후, 주모 50 mL를 첨가하였다. 담금을 완료한 술덧은 15°C에서 20일간 발효를 진행하였다. 발효가 종료된 술덧은 원심분리(4,973 ×g, 20 min)한 후 얻은 맑은 상등액을 filter paper(No.2, Advantec Co., Japan)로 여과하여 약주를 제조하였다.
약주의 발효 특성과 이화학적 품질 특성 분석은 약주의 일부를 취하여 원심분리(4,973 ×g, 10 min)한 후 얻은 상등액을 이용하였다. pH는 pH meter(Mettler-Toledo MP225K, Schwerzenbach, Switzerland)를 이용하여 측정하였고, 총산은 AOAC 표준시험법으로 측정하였다(AOAC, 2000). 알코올 함량은 15°C에서 시료 100 mL를 취하여 증류한 증류액을 주정계를 이용하여 측정하였으며, 가용성 고형분(°Brix)은 굴절당도계(ATAGO, Co, N-1a, Kyoto, Japan)를 이용하여 측정하였다. 환원당 함량은 DNS(dinitrosalicylic acid) 시약을 사용하여 비색 정량법에 따라 측정하였다(Ahmed, 2004). 시료 0.3 mL에 DNS 시약 1 mL를 첨가하여 95°C에서 5분간 반응 후, 증류수 7 mL를 첨가하여 분광광도계(Shimazdu Co. UV-1601, Kyoto, Japan)를 이용하여 550 nm에서 흡광도를 측정하고, glucose 표준곡선으로부터 환원당 함량을 환산하였다.
약주의 관능검사는 관능평가 경험이 있는 대학원생 16명을 대상으로 실험 방법과 목적을 설명한 후, 무작위로 제시된 시료에 대하여 색, 향미, 단맛, 신맛 및 전반적인 기호도에 대하여 평가하였다. 7점 척도법으로 평가하였으며, 7점은 매우 좋다, 1점은 매우 나쁘다로 평가하였다. 본 연구의 관능평가는 경북대학교 생명윤리심의위원회의 규정에 따라 심의하여 승인번호(2020-0075)를 받아 진행하였다.
각 효모 균주를 100 mL YPD 액체 배지에서 30°C, 16시간 동안 배양하였으며, 배양 후 원심분리(4,973 ×g, 10 min)하여 효모 세포를 회수하고, 0.85% NaCl 용액에서 2회 세척하였다. 그런 다음, pellet을 lactomil 7 g과 함께 탈지유, 당류를 함유하는 보호제 용액 1 mL와 혼합하였다. 혼합 효모 세포 pellet을 무진건조기(HB-509C, HanBaek, Bucheon, Korea)를 사용하여 건조된 효모 종균의 수분 함량이 10±2%에 도달할 때까지 37°C에서 건조시켰다. 송풍건조 후 샘플을 즉시 분석하여 적절한 수분 함량과 생존율을 확인하였으며, 4°C에서 3개월 동안 보관하고 생존율을 다시 측정하였다.
저온송풍건조에 사용되는 건조보호제는 10% skim milk 용액에 6종의 당류로 fructose, glucose, maltose, raffinose, sucrose, trehalose 각각을 10%씩 첨가하여 비교하였다. 부형제로는 lactose 89%, maltodextrin 11%로 구성된 lactomil (Seo Kang Dairy & Food Co., Ltd., Sacheon, Korea)을 활용하였으며, pellet과 lactomil 비가 1 : 3.5(w/w)가 되게 첨가하였다(Lee 등, 2016a). 부형제와 건조호보제에 따라, 송풍건조 직후의 생존율과 보관 중 종균의 생존력을 알아보았으며, skim milk와 당류로 구성된 보호용액은 121°C에서 15분간 멸균하였고, 모든 용액은 실험 직전에 준비하고 무균적으로 혼합하였다.
재수화 조건이 분말 종균에 미치는 영향을 알아보기 위해 재수화 용액으로 PBS buffer 용액과 0.85% NaCl 용액, 1% peptone water 용액 3가지를 사용하였으며, 대조군으로는 멸균증류수(distilled water, DW)를 활용하였다. 분말 종균에 재수화 용액을 넣고 초기 부피로 복원시킨 후 25°C에서 1시간 재수화 하였다. 이 후 DW로 단계 희석하여 YPD 고체 배지(2% glucose, 2% peptone, 1% yeast extract, 2% agar)에서 생존율을 측정하였다.
초기 균수(N0)는 YPD 액체 배지에서 30°C, 150 rpm, 16시간 배양이 끝난 후 저온송풍건조 전 샘플 1 mL를 취해 DW로 단계 희석한 후 YPD 고체 배지에서 30°C, 48시간 배양시켜 생성된 colony를 계수하였다. 처리 조건별 균주의 생존율(survival rate)은 송풍건조가 완료된 균주를 재수화 용액을 이용하여 초기 부피로 복원하고 초기 생균수 조건으로 배양한 뒤 균수(N)를 측정하여, survival rate(%) = (N / N0) × 100으로 나타내었다. 균체와 건조보호제, 부형제를 혼합하여 수분함량이 8-12%가 될 때까지 37°C에서 60분간 건조하여 분말 상태의 종균을 제조하였다. 수분함량은 샘플을 칭량하고 105°C 드라이 오븐에서 3-4시간 건조한 뒤, 데시케이터에서 30분간 방랭하고 항량에 도달할 때까지 무게를 측정해 구하였다(AOAC, 2000).
설정된 최적 조건의 부형제 및 건조보호제에 고정화된 송풍건조 효모 세포의 형태를 SEM(Scanning Electron Microscope)으로 관찰하였다(Hongpattarakere 등, 2013). 송풍건조효모 샘플을 양면 금속 접착 테이프를 사용하여 stub에 부착한 다음 Hitachi E-1030 ion sputter coater(Hitachi, Tokyo, Japan)를 사용하여 금으로 코팅하였다. 샘플의 형태는 5 kV의 가속 전압에서 작동되는 SU8220 주사 전자 현미경(Hitachi, Tokyo, Japan)으로 관찰되었다.
결과 및 고찰
본 연구에서는 찹쌀, 멥쌀, 그리고 찹쌀 멥쌀을 각각 50%씩 혼합하여 제조한 약주의 발효의 특성 분석 결과는 Table 1와 같으며, 전반적으로 균주별, 쌀 종류별로 다른 값을 나타내었다. 당도와 환원당 함량은 쌀 종류와 관계없이 S. cerevisiae W149에서 높은 결과가 나왔으며, 이는 당을 이용한 에탄올 발효로 인해 당도와 환원당 함량이 빠른 속도로 줄어드는데, 타 균주에 비해 S. cerevisiae W149는 느린 속도로 에탄올 발효가 진행되는 것을 알 수 있다(Kim 등, 2012). 이와 달리 다른 균주들의 당도는 8.57-9.07 °Brix, 환원당은 0.21-0.36%로 에탄올 발효가 빠르게 진행되는 경향을 보인다. S. cerevisiae W149를 제외한 두 균주는 쌀 종류에 따라 당도가 다른 차이를 보였으나, 환원당은 S. cerevisiae KCCM 11215, W153 순으로 높은 경향을 나타내었다. 이에 따라 S. cerevisiae W153의 에탄올 발효가 가장 빠르게 진행되는 것으로 볼 수 있다. S. cerevisiae W149로 제조한 약주의 환원당 함량은 찹쌀 약주의 경우 1.63%, 찹쌀과 멥쌀 혼합 약주의 경우 1.68%, 멥쌀 약주의 경우에는 1.85%로서 다른 균주에 비해 높은 수준을 나타내었다. S. cerevisiae W149로 제조한 찹쌀 약주의 경우 환원당의 함량은 1.63%로서 S. cerevisiae W153으로 제조한 약주의 0.21%보다 환원당의 함량이 높게 나타났음에도 불구하고, 알코올의 함량이 15.37%로서 S. cerevisiae W153 약주의 14.83%에 비하여 높게 나타났다. 이러한 현상은 찹쌀과 멥쌀 혼합 약주의 경우에도 마찬가지로 S. cerevisiae W149 약주의 환원당 함량은 1.68%로서 S. cerevisiae W153 약주의 0.23%에 비하여 높음에도 불구하고, 알코올의 함량이 16.07%로서 S. cerevisiae W153 약주의 14.90%보다 상당히 높은 수준을 나타내었다. 멥쌀 약주의 경우에는 찹쌀을 첨가한 약주와는 달리 이러한 현상이 관찰되지 않았다. pH와 총산의 경우 균주별로 유사한 양상을 띠며, 이는 효모마다 생산하는 유기산의 종류나 함량이 다르기 때문이다(Contreras 등, 2014). pH의 경우, S. cerevisiae KCCM 11215가 쌀의 종류에 관계없이 가장 높은 값을 나타내었으며, 총산의 경우 S. cerevisiae W149의 값이 가장 높고, 다음으로 S. cerevisiae W153이 높으며, 멥쌀의 경우를 제외하고 S. cerevisiae KCCM 11215 순으로 높은 값을 나타내었다. 알코올 함량은 14.90-16.07%로 전반적으로 상온 발효에 비해 알코올 함량이 더 높은데, 상온 발효에서는 빠른 알코올 발효와 함께 효모의 피로도가 증가하고, 효모 활성도 빨리 잃어 알코올 발효가 이르게 종료되기 때문이다(Shim 등, 2016). 재료의 종류에 따라, 찹쌀의 경우 S. cerevisiae W149, 찹쌀 50% 멥쌀 50%의 경우 S. cerevisiae W149, 멥쌀의 경우 S. cerevisiae W153가 높은 알코올 함량을 나타내었다.
균주를 달리하여 제조한 찹쌀 약주, 찹쌀과 멥쌀 혼합 약주 및 멥쌀 약주의 관능평가 결과는 Table 2와 같다. 약주의 외관상 품질을 결정하는 색의 경우에는 시료간 유의한 차이를 나타내지 않았다. 약주의 향미는 찹쌀 실험구가 4.75-5.00로 타 원료들에 비해 전반적으로 기호도가 좋았으며, S. cerevisiae W153 균주를 사용한 약주는 쌀의 종류와 관계없이 다른 균주들에 비해 높은 기호도를 나타내었으며, 특히 찹쌀 실험구에서 5.00으로 가장 높은 점수를 받았다. 단맛은 2.81-4.25로 모든 조건에서 5점을 넘지 않았다. 찹쌀 약주에서는 S. cerevisiae W149, KCCM 11215, W153의 순으로 높은 점수를 받았고, 혼합 약주에서는 S. cerevisiae KCCM 11215, W153, W149 순으로 높았다. 멥쌀 약주에서는 S. cerevisiae KCCM 11215, W149, W153 순으로 높았으며, S. cerevisiae KCCM 11215 균주를 사용한 혼합 약주가 4.25로 모든 조건 중에 가장 높게 나타났다. 신맛의 경우, 전반적으로 S. cerevisiae KCCM 11215는 모든 실험구에서 가장 낮은 기호도를 나타냈고, 쌀의 종류와 관계없이 S. cerevisiae W153과 W149는 전반적으로 높은 기호도를 나타냈다. 찹쌀 약주에서는 S. cerevisiae W153과 W149의 기호도가 같았으며, 혼합 약주에서는 S. cerevisiae W149가 5.75로 유의적으로 가장 높은 점수를 나타냈으며, 모든 조건에서도 가장 높은 기호도를 나타냈다. 멥쌀 약주에서는 S. cerevisiae W153, W149, KCCM 11215의 순으로 점수가 높았다. 종합적 기호도에서는 찹쌀 약주의 경우 S. cerevisiae W153이, 혼합 약주와 멥쌀 약주에서는 S. cerevisiae KCCM 11215가 가장 높게 평가되었다. 이는 sniffing test 결과와 비교해 보았을 때 유사한 경향을 나타내는데(data not shown), 이는 향미가 종합적 기호도 점수에 영향을 준 것으로 볼 수 있다(Chae, 2020). 관능평가의 결과에 따라 찹쌀 약주 제조시 S. cerevisiae W153을 이용하면 색과 향미, 신맛, 종합적 기호도 면에서 좋은 품질의 약주를 제조할 수 있을 것으로 사료된다.
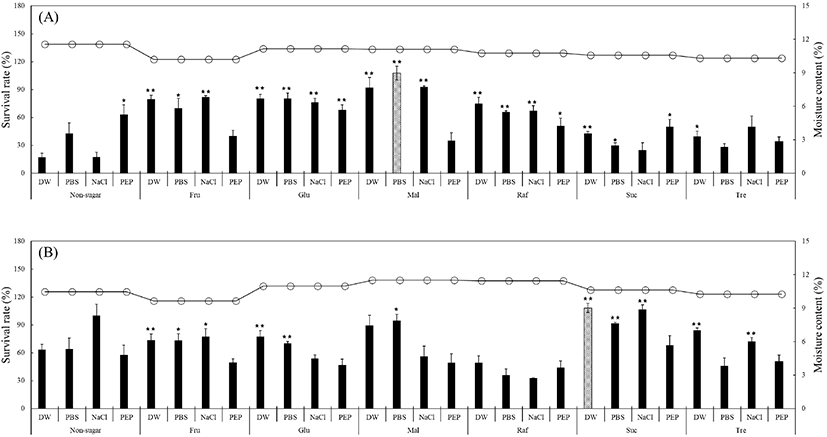
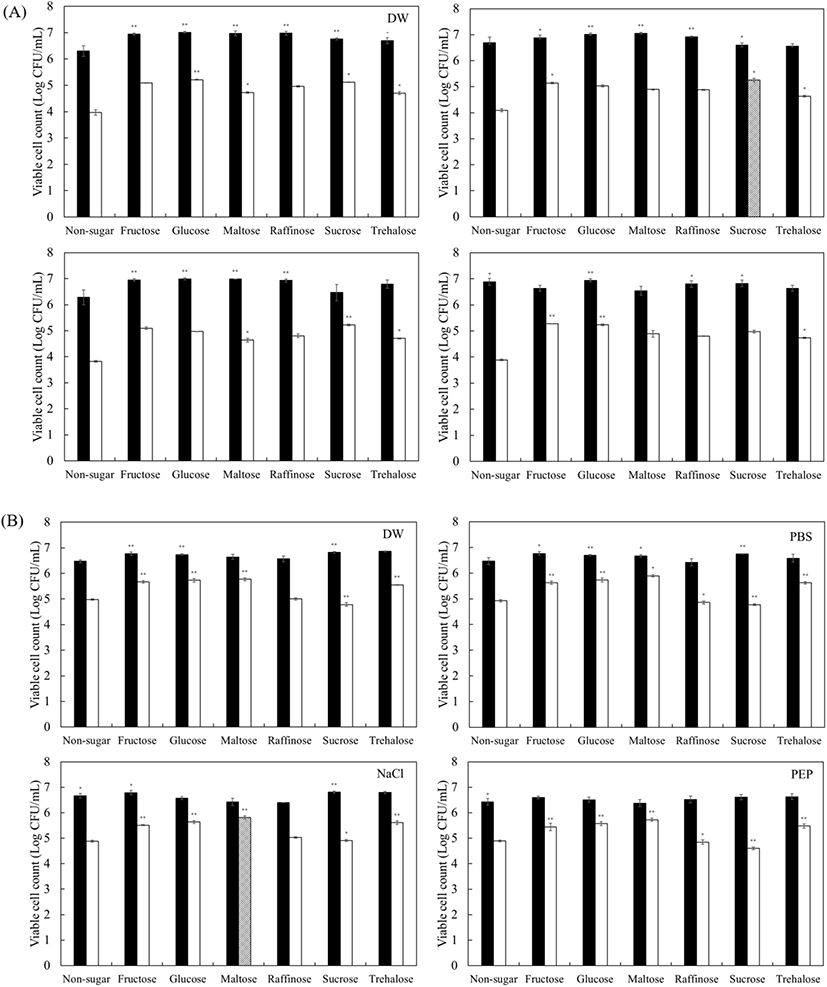
균주 건조 시 적절한 건조보호제는 미생물의 단백질과 막을 보호한다(Champagne 등, 2012). Skim milk와 함께 건조보호제로서 사용되어지는 당(sugar)은 건조 중 세포의 세포막에서 유출되는 구조수를 대체하며, 세포 내에 수소결합하고 있는 극성 단백질 그룹 간의 풀림 및 응집을 막는 역할을 한다(Costa 등, 2000). 또한, Santivarangkna 등(2007)에 따르면 균주 별로 서로 다른 당에서 최적의 건조 보호 효과를 나타낸다고 보고하였으며, Leslie 등(1995)에 따르면 trehalose와 sucrose가 건조보호제로 사용되었을 때 대조군에 비해 생존율이 증가하였다고 보고하였다. 건조 과정 후 건조된 미생물을 회수하는 재수화 과정은 필수적이며, 건조 균체의 생존율을 높이는 중요한 단계이다. 냉동 혹은 건조 상태의 균주는 재수화 과정에서 생존율이 낮아질 수 있으므로, 생존율을 높이기 위해 미생물마다 적절한 재수화 용액을 택하는 것이 중요하다(Fry와 Greaves, 1951; Lee 등, 2016b). S. cerevisiae D8을 송풍건조하여 최적의 종균화 조건을 연구한 선행연구에서는 skim milk와 각종 당류를 각각 5%와 10% 처리하여 생존율을 비교하였으며, 10% skim milk와 10% 당류에서 최적의 생존율을 나타냄을 확인하였다(Lee 등, 2016a). 또한, Lee 등(2016b)은 건조 균체의 생존율이 0시간에 비해 1시간 동안 세포를 재수화 하였을 때 증가하였음을 보고하였다. 따라서 본 연구에서는 선정된 2종의 효모에 각각 fructose, glucose, maltose, raffinose, sucrose, trehalose를 10%씩 처리하여 10% skim milk와 혼합한 후 37°C에서 1시간 송풍건조한 다음, 건조효모를 각각 DW, PBS, 0.85% NaCl, 1% peptone water에 넣고 25°C에서 1시간 동안 재수화 하여 생존율을 비교하였다. 모든 처리구의 수분함량은 건조 후 균주의 생존율이 가장 높다고 알려진 10±2%로 조절하였다(Beker와 Rapoport, 1987). S. cerevisiae W153의 경우, glucose, maltose, sucrose, trehalose 첨가구에서 DW 용액으로 재수화 하였을 때 높은 생존율을 나타내었으며, 일부 당류에서는 PBS 용액과 0.85% NaCl 용액도 우수한 재수화 조건임을 확인하였다(Fig. 1). 특히 10% sucrose 첨가구를 DW 용액으로 1시간 재수화 하였을 때 108.21%로 가장 높은 생존율을 나타내었으며, 동일 첨가구에서 0.85% NaCl 용액 또한 106.56%로 높은 생존율을 나타내었다. 또한, 생존율이 100%가 넘어가는 것은 재수화 과정 중 적절한 환경에서 효모들이 증식하였기 때문으로 판단된다(Kim 등, 2019). S. cerevisiae W149의 경우, fructose, glucose, maltose, raffinose 첨가구에서 PBS 용액으로 재수화 하였을 때 높은 생존율을 나타내었으며, 일부 당류에서는 0.85% NaCl 용액도 우수한 재수화 조건임을 확인하였다(Fig. 1). 특히 10% maltose 첨가구를 PBS 용액으로 1시간 재수화 하였을 때 107.72%로 가장 높은 생존율을 나타내었다. 또한 S. cerevisiae W153과 비교하였을 때 전반적으로 낮은 수치를 나타내기 때문에 S. cerevisiae W153이 S. cerevisiae W149에 비해 저온송풍건조에 보다 적합한 것으로 사료된다. 본 연구에서 확립된 건조보호제인 10% 당류 및 10% skim milk로 송풍건조된 효모를 주사전자현미경(SEM)을 이용하여 그 형태를 관찰하였다(Fig. 2). 현미경 관찰 결과, 각 효모들은 skim milk로 추정되는 매우 큰 입자들과 아주 작은 결정 구조의 당류에 둘러싸여 밀집된 형태로 존재하였다. 모든 효모들에서 출아흔이 발견되어, 1시간 재수화 용액 처리 동안 멈추어져 있던 출아가 다시 진행되어 생존율이 증가하는 원인이 되는 것으로 판단하였다. 종균 개발 시 건조 방법과 재수화 조건 이외에 저장성 또한 중요한 요소이다. Baek 등(2017)은 S. cerevisiae Y297의 건조보호제 종류별 건조 균체의 저장 기간에 따른 생존율에 대해 분석하였으며, 건조보호제에 따라 저장 기간이 길어질수록 생존율의 감소폭이 다른 것으로 보고하였다. Lee 등(2016a)은 송풍건조 시 가장 높은 생존율일 때의 건조보호제가 S. cerevisiae D8은 trehalose이며, H. uvarum S6은 sucrose라고 보고하였는데, 이는 효모 균주마다 가지는 특성의 차이와 건조 방법에 따라 맞춤형 건조보호제가 필요함을 알 수 있다. 또한, 4°C에서 3개월 동안 송풍 건조한 샘플을 저장하며, 1개월 단위로 재수화 하여 생존율과 생균수를 확인해 균주별 장기 저장 적합성을 판단하였고, 생존율과 생균수가 비슷한 경향을 나타냄을 확인하였다. 따라서 본 연구에서는 선정된 2종의 효모에 각각 fructose, glucose, maltose, raffinose, sucrose, trehalose를 10%씩 처리하여 10% skim milk와 혼합한 후, 37°C에서 1시간 송풍건조한 건조효모를 4°C에 보관하며 건조 직후, 그리고 1개월, 2개월, 3개월이 지난 시점에 각각 DW, PBS, 0.85% NaCl, 1% peptone water에 넣고 25°C에서 1시간 동안 재수화 한 뒤 생균수를 분석하여 비교하였다. S. cerevisiae W153의 경우, 3개월 후 control을 포함한 모든 처리구에서 당 별로 유사한 경향이 나타남을 확인하였다(Fig. 3). Control의 생균수는 4.98 log CFU/mL이며, fructose, glucose, maltose, trehalose 처리구의 생균수는 5.7 log CFU/mL 대의 수치를 나타내었다. 특히 10% maltose를 첨가하여 PBS 용액으로 1시간 재수화 하였을 때, 5.90 log CFU/mL로 가장 높은 수치를 나타내었다. 따라서 S. cerevisiae W153 균주의 장기 저장에 fructose, glucose, maltose, trehalose 건조보호제와 PBS 재수화 조건이 가장 효과적임을 확인하였다. 효모를 송풍건조한 후 항산화제를 첨가해 2개월 간 저장성을 확인한 선행연구에서는 항산화제 첨가에 따라 균주별로 생균수가 증가하였으며, 항산화제를 첨가함으로써 장기 저장성에 적합한 균주의 저장 성능을 보다 향상시킬 것으로 사료된다(Kim 등, 2019). S. cerevisiae W149의 경우 또한 3개월 후 control을 포함한 모든 처리구에서 당 별로 유사한 경향이 나타남을 확인하였으며, 모든 당 처리구에서 control보다 수치가 높았다(Fig. 3). Fructose, glucose, sucrose 처리구의 생균수는 5 log CFU/mL 대의 수치를 나타내었고 control의 생균수는 3.97 log CFU/mL를 나타내었다. 그 중 10% fructose를 첨가하여 1% peptone water 용액으로 1시간 재수화 하였을 때, 5.27 log CFU/mL로 가장 높은 수치를 나타내었다. Lee 등(2016a)에 따르면 S. cerevisiae D8의 경우 10% trehalose를 건조보호제로 사용하였을 때 높은 생존율을 나타낸다고 하였으나, 동종의 S. cerevisiae 임에도 본 연구의 당 건조보호제와 차이가 있었다. S. cerevisiae W149 균주의 장기저장에는 fructose, glucose, sucrose 당 건조보호제와 1% peptone water 재수화 조건이 가장 효과적이었다. S. cerevisiae W153과 비교하였을 때 전반적으로 낮은 수치를 보이므로 S. cerevisiae W153이 S. cerevisiae W149에 비해 저온송풍건조를 이용한 장기 저장에 보다 적합한 것으로 사료된다.