서 론
복분자(Rubus occidentalis)는 장미과의 낙엽활엽 덩굴성 식물로 우리나라 중남부지역에서 주로 재배하고 있다. 줄기에 가시가 있는 외형적 특징을 가지고 있으며, 일반적으로 초여름에 열매를 수확한다. 복분자는 항산화, 항암, 항염, 항당뇨, 항알레르기, 간 기능 강화, 시력 증진, 이뇨, 천식, 성 기능 개선, 당뇨병 등의 효능을 가지고 있다. 인체 건강에 유익하여 소비자의 관심이 증대되면서 건강기능식품이나 기호식품으로 섭취가 증가함에 따라 기능성 및 생리활성 물질에 대한 연구가 증가하고 있다(Chae 등, 2014; Stoner 등, 2006; Wang과 Lin, 2000; Wang과 Liu, 2000). 함유 성분은 ellagic acid, gallic acid, p-coumaric acid, quercetin, proanthocyanidin, cyanidin-3-glucoside, cyanidin-3-rutinoside, cyanidin-3- sambubioside, cyanidin-3-xylosylrutinoside 등이다(Chae 등, 2014; Kim 등, 2012; Kim 등, 2014; Kim 등, 2016). 복분자 성분 중 ellagic acid는 폴리페놀 화합물로 항산화, 항암, 노화 억제, 항섬유화, 콜레스테롤 억제 등 효능을 갖고 있다. Ellagic acid는 블랙베리, 딸기, 산딸기, 라즈베리, 석류, 호두, 채소, 과일 등에 유리형, ellagic acid glycoside, 포도당과 ester 결합한 ellagictannin의 형태로 존재하며, 유리형인 ellagic acid는 소량 존재한다(Lee 등, 2014; Namkoong 등, 2012; Yong 등, 2019). 식물에 함유된 ellagic acid의 전체 함량을 측정하기 위해서는 산이나 알칼리 용액을 이용하여 유리형 ellagic acid로 가수분해시켜야 한다(Lee 등, 2014; Namkoong 등, 2012; Yong 등, 2019; Zafrilla 등, 2001). 산 가수분해는 무기산(염산, 황산 등), 유기산(구연산, 아세트산, 아스코르빈산 등), 고체산(양이온 교환 수지, 양이온 교환섬유 등) 등으로 분해시키며, 식물 등 천연물의 가수분해에 주로 이용된다(Kang 등, 2005; Kim 등, 2013; Kim 등, 2019).
천연 유래 기능성 식품 소재는 오랫동안 섭취 경험을 통해 효능과 안전성을 입증하고 있지만, 채취시기, 재배조건, 생산지 등에 따라 품질과 기능성 성분의 함량 차이가 있다(Chae 등, 2014; Kim 등, 2013; Lim 등, 2020). 인체 건강에 유익한 기능성 천연소재를 이용하여 건강기능식품을 개발하기 위해서는 기능성 원료가 인증되어야 한다. 기능성 원료의 기능성 성분은 기능성분(biological active compound)과 지표성분(marker compound)으로 구분한다. 기능성분은 기능성 소재에 함유된 성분의 효능과 원료의 효능이 유사한 경우에 설정한다. 이 경우에는 기능성분의 효능과 해당 성분의 농도 간에 상관관계가 있어야 한다. 만약 해당 성분의 양이 정확하지 않고 기능성과의 상관성이 낮으면 기능성분에 대한 표준화가 어렵다. 지표성분은 기능성 소재에 함유된 성분의 효능과 원료의 효능간에 상관관계가 명확하지 않을 경우에 설정한다. 이 경우에는 원재료를 확인할 수 있어야 한다(KFDA, 2008; Kim 등, 2012; Kwon 등, 2016; Jung 등, 2016). 이에 따라 지표성분 분석을 위해서는 분석법을 명확하게 설정하는 분석방법이나 실험방법에 대한 재현성 및 시험결과에 대한 신뢰성에 대한 분석법 검증(validation)이 매우 중요하다. 지표성분과 기능성분에 대한 함량 검증은 기능성 소재에 대한 안전성과 기능성을 과학적으로 입증하는 방법이다. 지표성분과 기능성분의 함량 분석은 기능성 소재의 품질 관리 및 제품의 품질관리 지표로 이용된다(Ahn 등, 2017; Jung 등, 2016; Kim 등, 2012). 따라서 건강기능식품을 개발하기 위해서는 기능성 원료에 대한 표준화 및 기준 규격 설정이 매우 중요하다(Ahn 등, 2017; Jo 등, 2018; Kwon 등, 2016). 지표성분과 기능성분 분석은 공인된 방법이나 정밀하다고 판단되는 분석법으로 검증하여야 하며, 반드시 과학적 타당성과 신뢰성이 검증되어야 한다(Ahn 등, 2017; Jang 등, 2019; Jeong 등, 2019; Jo 등 2018). 복분자를 건강기능식품으로 개발하기 위해서는 기능성 원료를 인증하여야 한다. 기능성 원료 인증을 위한 분석은 범용 분석장비를 이용하여 정확하고 신뢰성 있는 분석결과를 도출할 수 있는 분석방법을 확립하여야 한다. 일반적으로 분석기기는 high performance liquid chromatography (HPLC)을 이용한 정성/정량분석과 질량분석기(mass spectrometry)를 이용하여 분석한다. Ellagic acid는 폴리페놀화합물로서 복분자에 다량 함유된 것으로 알려져 있다. Ellagic acid를 기능성/지표성분으로 설정하기 위해서는 식물체내에서 ellagitannins 형태로 존재하는 ellagic acid의 총 함량을 측정하기 위해서는 일반적으로 산을 이용하여 가수분해시킨 후 분석한다(Chae 등, 2014; Jung 등, 2021; Kim 등, 2012).
이에 따라 본 연구는 복분자를 이용하여 기능성 소재를 개발하기 위한 기초자료를 확보하기 위하여 HPLC를 이용하여 ellagic acid에 대한 분석법 설정과 분석법 검증(validation), 함량, 항산화 활성을 측정하여 보고하는 바이다.
재료 및 방법
실험에 사용한 시료는 2019년 전북 순창에서 재배된 복분자(Rubus occidentalis) 품종을 빛깔, 모양 등 외부형태를 확인하고 실험에 사용하였으며, 표본은 (재)순창건강장수연구소에 보관되어 있다. 복분자는 동결건조기(LP20, IlShinBioBase, Dongducheon, Korea)를 이용하여 완전 건조시킨 후 분쇄기 (HGB2WTS3, Waring, Torrington, USA)로 분쇄하여 100 mesh로 거른 분말 20 g에 증류수 400 mL를 첨가한 후 추출하였다. 추출시간은 1, 2, 3시간, 추출온도 20, 60, 90°C로 추출하였다. 추출물은 원심분리기(Super-22K, Hanil science industrial, Incheon, Korea)를 이용하여 3,000 rpm, 15분간 원심 분리시켜 고형물을 제거하고, 0.4 μm 필터로 감압 여과시켰다. 여과액은 감압농축기(N-1000, Eyela, Tokyo, Japan)를 이용하여 30 °Brix 이하로 농축시킨 후, 동결건조기(LP20, IlShinBioBase, Dongducheon, Korea)를 이용하여 완전 건조 시켜 복분자 물추출물(RC)을 제조하여 실험에 사용하였다.
Folin-Ciocalteu’s phenol reagent, potassium persulfate (K2S2O8), 2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid), ellagic acid은 Sigma Aldrich(St. Louis, MO, USA)를 사용하였으며, HPLC 분석 및 시료 조제에 사용한 용매와 이동상 용매는 모두 HPLC급(Burdick & Jackson Co., Muskegon, MI, USA)을 사용하였다. HPLC 시스템은 Nanospace SI-2 (Shiseido, Tokyo, Japan), PDA detector는 Nanospace PDA85 (Shiseido, Tokyo, Japan), 컬럼은 Capcellpak C18 Type MGⅡ(5 μm, 4.6×250 mm, Shiseido, Tokyp, Japan), 이동상은 0.1% formic acid(A)와 acetonitrile/methanol(85:15 v/v, B), 유속은 1.0 mL/min, 시료 10 μL를 주입하여 검출파장 254 nm에서 분석하였으며, 분석조건은 Table 1과 같다(Kim 등, 2012; Kim 등, 2013; Lee 등, 2014; Namkoong 등, 2015).
복분자 물추출물(RC)을 0.5 μg/10 mL (DMSO) 농도로 용해시킨 시료추출액 200 μL와 증류수 1.8 mL, Folin-Ciocalteu’s phenol regent 200 μL를 혼합하여 5분간 반응시킨 후 7% Na2CO3 2 mL와 증류수 0.8 mL를 혼합한 다음 실온에서 90분 동안 반응시킨 후 750 nm에서 흡광도를 측정하였다(Singleton과 Rossi, 1983).
ABTS 라디칼 소거 활성을 측정하기 위하여 7.4 mM- ABTS를 2.45 mM-potassium persulfate(K2S2O8)에 녹이고, 빛을 차단하여 상온에서 16시간 반응시켜 ABTS radical cation를 형성시키고, 실험 직전에 2,2'-azino-bis-3-ethylben zothiazoline-6-sulfonic acid(ABTS) 용액을 732 nm에서 흡광도가 0.7이 되도록 PBS(phosphate-buffered saline; pH 7.4)를 이용하여 희석하였다. 96 well에 농도별로 희석한 시료액 10 μL와 흡광도 값이 0.7로 희석된 ABTS 용액 190 μL를 넣고 빛을 차단하여 상온에서 10분 동안 반응시킨 후, microplate reader system(Nano Quant, Infinite 200 PRO, Tecan, Austria)을 이용하여 732 nm에서 흡광도를 측정하였다. 추출물을 첨가하지 않은 대조군의 흡광도가 50%로 환원시키는 데 필요한 추출물의 농도인 IC50 값으로 나타내었으며, 양성대조군은 ascorbic acid를 사용하였다(Robert 등, 1999).
시험용액은 완전하게 건조된 복분자 물추출물(RC) 0.1 g을 전처리 용매(HCl:distilled:ethanol=2:2:6; v/v) 10 mL에 녹인 후 95°C에서 30분간 산 가수분해한 후, 실온에서 냉각하고 100 mL volumetric flask에 넣고 HPLC 등급 methanol을 가하여 표선에 맞추어 복분자 추출물의 산 가수분해물(RCH)을 조제하였으며, 사용 전 0.45 μm PTFE syringe filter로 여과하여 사용하였다. 가수분해 시간에 따른 ellagic acid 함량을 측정하기 위하여 1-6시간 가수분해시켜 분석하였다(Jeon 등, 2016; Owczarek 등, 2015; Theocharis와 Andlauer, 2012; Vekiari 등, 2008).
표준용액은 검교정이 완료된 미세저울을 이용하여 ellagic acid를 5.0 mg을 정확하게 칭량하여 10 mL volumetric flask에 넣고 HPLC 등급 methanol을 10 mL 표선을 맞춰 500 μg/mL 농도의 stock solution을 조제하였다. 조제된 stock solution은 4°C에 보관하면서 사용 전에 희석하여 사용하였다.
식품의약품안전처의 의약품 등 시험방법 밸리데이션 가이드라인을 근거하여 특이성(specificity), 직선성 및 범위(linearity and range), 정확성(accuracy)과 회수율(recovery), 반복성(repeatability), 정밀성(precision), 검출한계(limit of detection, LOD, S/N=3.3), 정량한계(limit of quantitation, LOQ, S/N= 10)를 분석하였다(Chae 등, 2014; Jo 등, 2018; KFDA, 2008; Kim 등, 2012; Kim 등, 2019; Kwon 등, 2016).
Blank(MeOH), 표준용액(ellagic acid 200 μg/mL), 시험용액(RCH 10 μg/mL), 검액(ellagic acid 200 μg/mL+RCH 10 μg/mL)을 조제한 뒤 0.45 μm PTFE syringe filter로 여과하여 분석에 사용하였다. 특이성 분석은 분석대상 물질인 ellagic acid에 대한 피크의 간섭, 표준액과 시험용액 및 검액의 피크 검출시간과 유지시간을 photo diode array(PDA) spectrum의 동일성으로 확인하였다(Kwon 등, 2016; Kwon 등, 2017).
표준물질 1 mg/mL를 HPLC용 methanol로써 순차적으로 희석한 ellagic acid 표준용액을 HPLC로 분석하여 농도에 대한 면적에 대하여 검량선을 작성하고, 작성한 검량선의 상관계수(R2)값을 작성하였다(Lee 등, 2017; Yoo 등, 2019).
반복성(repeatability)은 표준용액과 같은 농도로 조제한 시험용액에 대한 피크면적과 머무름 시간의 재현성으로 확인하였다. 실험실 내 정밀성(intermediate precision)은 여러번 채취한 균일한 검체를 동일 실험실 내에서 각각 다른 실험일자, 시험자, 기구 등을 달리하여 측정한 측정값 간의 근접성으로 평균, 표준편차, 상대표준편차(relative standard deviation, RSD %)를 구하였다. 일내분석(intra-day)은 1일 3구간 진행하였고, 일간분석(inter-day)은 1일 1구간으로 3일간 실시하였다(Hwang 등, 2019; Kim 등, 2012; Owczarek 등, 2015).
Ellagic acid 표준용액 2.5, 5, 10 μg/mL에 RCH 0.1 g을 각각 첨가한 후 동일한 분석조건으로 분석하였으며, 직선성 시험에서 얻은 검량선을 이용하여 각 검액의 실측 농도 값을 구하였고, 실제 첨가된 이론 농도값에 대한 회수율(recovery %)로 나타내어 정확성을 평가하였다(Ahn 등, 2017; Kwon 등, 2017).
직선성 검증을 통해 얻은 시험결과에 대한 검량선의 기울기 평균값과 y절편에 대한 표준편차를 이용하여 아래 식에 대입하여 검출한계(limit of detection, LOD) 및 정량한계(limit of quantification, LOQ)를 계산하였다(Jang 등, 2019; Jo 등, 2018; Kwon 등, 2016).
결과 및 고찰
식물의 페놀성 화합물은 식품의 2차 대사산물로서 방향족 고리의 화학구조를 가지고 있으며, 세포의 활성산소를 제거하여 산화적 스트레스를 완화시키는 항산화 활성 성분으로 항균, 항종양, 항바이러스 등 다양한 생리활성을 가지고 있다(Erkan 등, 2008; Lee 등, 2018; Park 등, 2020). 폴리페놀 화합물은 phenolic hydroxyl(OH)기와 탈수소 반응을 일으켜 수소원자를 공유하여 자유 라디칼을 안정한 형태로 형성시켜 활성산소에 의한 산화를 억제시킨다(Kang 등, 2017; Kwon 등, 2013; Kwon 등, 2014). 식물의 항산화 활성은 폴리페놀 함량과 비례하며, 폴리페놀 함량이 높을수록 라디칼 제거능이 증가하는 것은 폴리페놀의 hydroxyl가 ABTS 라디칼에 수소 또는 전자를 공여함으로써 반응성을 안정화시킨다고 보고되었다(Kim과 Son, 2016; Park 등, 2007). ABTS 라디칼 소거활성은 항산화 활성 물질에 의하여 탈색되는 현상을 이용하는 실험방법으로 청록색을 띠는 ABTS가 항산화 물질과 반응하면 투명색으로 변한다(Lee 등, 2002; Woo 등, 2016).
복분자에 함유된 ellagic acid는 페놀성 화합물로서 항산화, 암세포 증식 억제 활성을 갖는다(Namkoong 등, 2012). 이에 따라 복분자를 추출온도 및 추출시간을 달리하여 추출한 추출물 RC에 대한 ABTS 라디칼 소거능과 폴리페놀 함량을 측정하였다(Table 2). 복분자를 90°C 3시간 추출물에서 폴리페놀 함량이 30.60±1.27 mg/g으로 분석되었으며, ABTS 라디칼 소거능(IC50)은 176.49±3.95 μg/mL로 측정되었고, 60°C 3시간 추출물에서 폴리페놀 함량이 30.32±1.66 mg/g으로 분석되었으며, ABTS 라디칼 소거능(IC50)은 189.65± 3.54 μg/mL으로 측정되었다. 20°C 1시간 추출물에서 폴리페놀 함량이 29.12±0.57 mg/g, ABTS 라디칼 소거능(IC50)은 206.25± 4.32 μg/mL로 분석되었으며, 대조군인 ascorbic acid는 18.45±0.54 μg/mL이었다. 20°C 1시간 추출물에서는 추출시간이 증가함에 따라 총페놀 함량과 ABTS 라디칼 소거 활성이 저하되었다. Kim 등(2014)에 따르면 토종 및 외래종 복분자의 물 또는 에탄올추출물의 총폴리페놀 함량 분석 연구에서 외래종 복분자 50% 에탄올추출물에서 총폴리페놀 함량이 46.97±2.79 mg/g이었으며, 토종 복분자는 물추출물에서 31.00±1.49 mg/g으로 분석되었다고 보고하였다. Lee 등(2019)에 따르면 이팝나무 꽃을 증류수를 이용하여 80°C, 110°C 3시간 추출물에 대한 ABTS radical 소거 활성(IC50)을 측정한 결과, 80°C 추출물의 처리농도 31.25 μg/mL에서 46.91± 2.34%, 62.5 μg/mL에서 56.90%, 110°C 추출물의 처리농도 31.25 μg/mL에서 43.70±1.48%, 62.5 μg/mL에서 52.36± 0.88%으로 추출물의 처리 농도가 증가함에 따라 ABTS radical 소거 활성도 증가하였다고 보고된 연구결과와 유사하였다.
IC50 value in the concentration (μg/mL) of sample required for 50% inhibition.
All values are expressed as mean±SD of triplicate determinations.
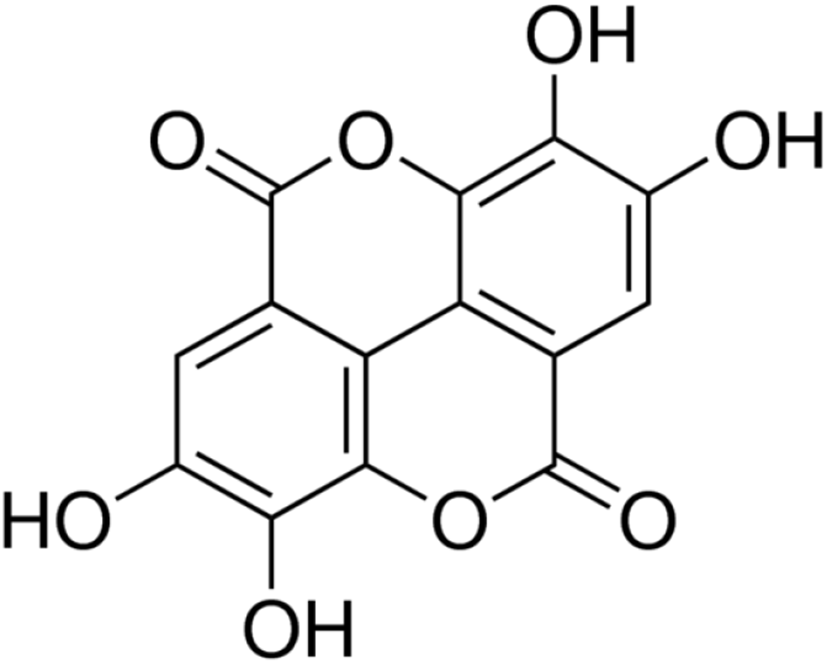
Ellagic acid는 강력한 항산화 활성을 지닌 폴리페놀로서 식물체내에 유리된 상태와 전구물질인 ellagitannin 형태로 존재하고 있어 산으로 가수분해시키면 ellagic acid 함량이 높아진다고 알려져 있다(Lee 등, 2014; Namkoong 등, 2012; Yong 등, 2019; Zafrilla 등, 2001). 복분자를 추출 온도 20, 60, 90°C로, 1, 2, 3시간 추출한 후 산 가수분해시킨 RCH를 확립된 분석방법으로 ellagic acid 함량을 분석하였으며, ellagic acid의 화학구조는 Fig. 1과 같다. 20°C, 3시간 추출물에서 3.48±0.20 mg/g, 60°C, 3시간 추출물에서 5.40±0.13 mg/g, 90°C, 3시간 추출물에서 6.17±0.80 mg/g으로 가장 높게 분석되었다. 복분자에 함유된 ellagic acid는 추출 온도와 추출 시간이 증가함에 함량도 증가하였다(Table 3). Lee와 Kim(2018)에 따르면 한국 및 중국 재배종 미숙과 복분자의 ellagic acid 함량 비교 연구에서 국내 재배종 미숙과 복분자 열수추출물에서 11.59±0.48 mg/g, 중국 재배종 미숙과 11.07±1.17 mg/g으로 분석되었으며, Choi 등(2013)의 연구에서 고창군에서 재배된 미숙과 복분자 열수추출물에서 ellagic acid 함량이 8.50 mg/g으로 분석되었다고 보고하였다. 본 연구결과와 ellagic acid의 함량이 상이한 것은 채취시기와 추출 시간에 의한 것이라 판단된다.
| Temperature (°C) | Time (h) | Content (mg/g) |
|---|---|---|
| 20 | 1 | 3.18±0.32a1) |
| 2 | 3.40±0.45ab | |
| 3 | 3.48±0.20ab | |
| 60 | 1 | 3.76±0.09a |
| 2 | 4.90±0.54b | |
| 3 | 5.40±0.13bc | |
| 90 | 1 | 4.83±0.06a |
| 2 | 5.67±0.19b | |
| 3 | 6.17±0.80b |
All values are expressed as mean±SD of triplicate determinations.
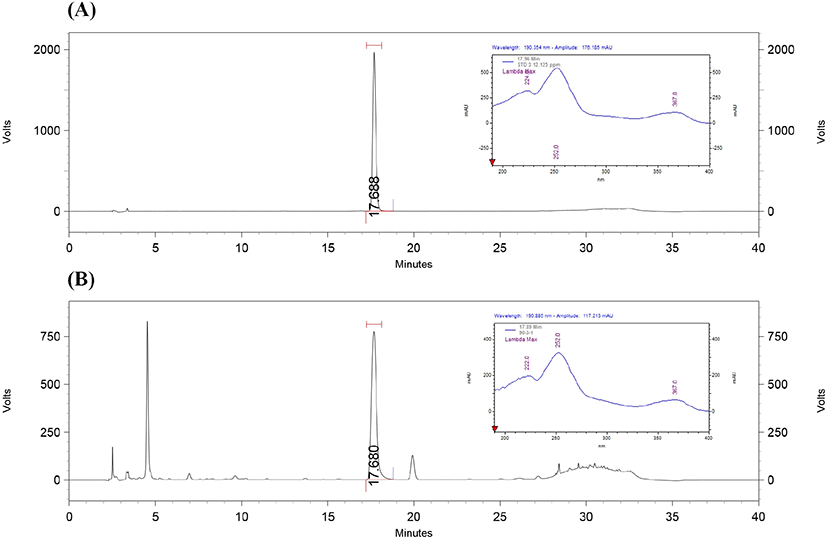
분석시료에 불순물, 배합성분, 분해 생성물, 첨가물질 등이 혼합된 상태에서 분석하는 물질에 영향을 받지 않고 분석물질만 선택적이고 정확하게 분석하는 특이성을 측정하였다(Jeon 등, 2012; Jeon 등, 2016; Moon 등, 2014). 복분자 물추출물을 건강기능식품으로 개발시 기능/지표성분으로 ellagic acid로 설정 가능성을 검증하기 위하여 복분자를 증류수를 이용하여 90°C에서 3시간 추출한 후, 추출물을 산 가수분해 시켜 RCH를 제조한 후 HPLC를 이용하여 분석하였다. Ellagic acid를 선택적인 분석을 위하여 컬럼, 이동용매, PDA 검출 파장을 최적화시킨 후 Table 1과 같은 조건으로 분석하였다. Ellagic acid 표준물질과 RCH의 크로마토그램의 피크 분리를 확인한 결과, 다른 물질의 간섭 없이 단일 피크로 분리되었으며, ellagic acid 표준용액과 RCH는 검출시간 및 피크유지시간(retention time)이 일치하였다. Ellagic acid 표준물질과 RCH 모두에서 약 17.9분에서 피크가 검출되어 동일한 물질임을 확인하였으며, 주변 피크의 간섭이 없어 완전히 분리되었다. PDA spectrum 190-400 nm에서 표준물질인 ellagic acid와 RCH의 스펙트럼을 확인하였다. Ellagic acid의 스펙트럼을 확인한 결과, 254 nm에서 최대 흡광도가 나타났으며, RCH에서도 동일한 패턴의 스펙트럼이 확인되어 분석방법의 특이성이 있음을 확인하였다(Fig. 2). 고창복분자 추출물을 HPLC를 이용하여 UV detector 254 nm, 1% formic acid와 acetonitrile을 이용하여 gradient로 분석한 결과, ellagic acid 표준용액과 고창복분자 추출물의 스펙트럼이 동일하였고, 크로마토그램의 머무름 시간이 22.2분대로 동일하게 측정되었다고 보고되었으며(Kim 등, 2012), 복분자 추출물을 HPLC를 이용하여 PDA detector 370 nm, 0.1% phosphoric acid와 methanol을 이용하여 gradient로 분석한 결과, 약 12분대에 크로마토그램이 동일하게 검출되어 동일한 물질임을 확인하였으며, 시험용액의 ellagic acid 피크가 단일 피크 검출되었고, 다른 피크의 간섭 없이 완전히 분리되었다고 보고되었다(Chae 등, 2014). 본 연구에서 17.9분에서 크로마토그램이 검출된 결과와 유사하게 분석되었지만, 크로마토그램 검출시간이 다른 것은 flow rate와 column temperature, gradient 용매 조건에 의한 것으로 판단된다.
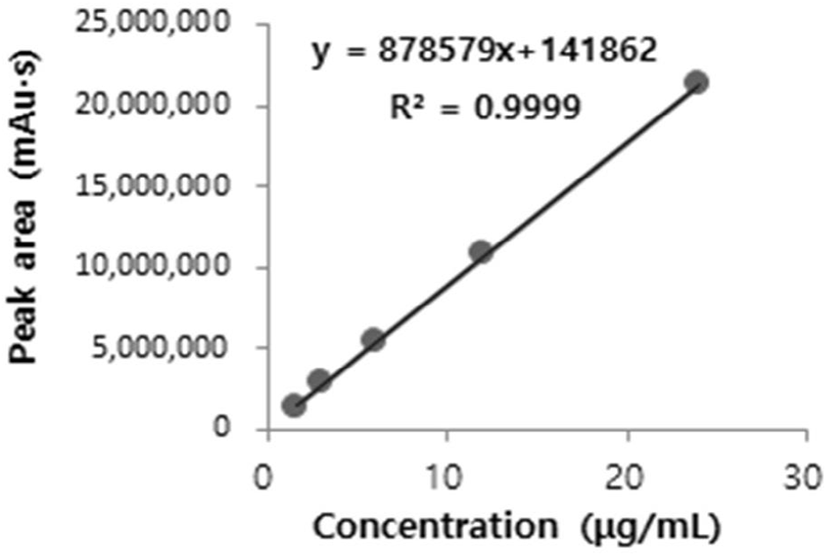
직선성은 시료 중 분석대상 물질의 양 또는 농도에 대한 직선적인 측정값을 의미하는 것으로 피크 면적비와 농도비에 대한 표준검량선을 이용하여 산출한다(Choi 등, 2017; Ham 등, 2018; Jeon 등, 2018). 분석하는 검체 중 일정 농도 범위의 ellagic acid 농도에 대하여 직선적 측정값을 확인하기 위하여 ellagic acid 표준물질에 대한 직선성을 확인하였다. 표준검량선은 Fig. 3과 같이 1.5-24.0 μg/mL 농도에서 상관계수(R2)는 모두 0.9999 이상의 직선성이 나타났다. Chae 등(2014)의 연구에서 ellagic acid 물질의 표준검량선은 6.25- 200 μg/mL 농도에서 상관계수(R2)가 0.9999로 직선성이 나타내었다고 보고하였으며, Kim 등(2012)의 연구에서 농도별로 조제한 ellagic acid 표준원액에 대한 직선성을 측정한 결과, 1-10 μg/mL 범위에서 상관계수(R2)가 0.9996으로 선형성을 나타내었다고 보고하였다.
반복성 실험(repeatability)과 실험실 내 정밀성(intermediate precision)으로 정밀성(precision)을 평가하였다. 반복성 실험(repeatability)은 균일한 시료에서 동일한 실험자가 동일한 장치와 기구, 동일한 시료, 동일한 조작 조건 하에서 얻은 검체를 반복 분석하여 얻은 측정값들 사이의 근접성(분산정도)을 의미한다. 실험실 내 정밀성(intermediate precision)은 실험실 내에서 분석일자, 분석자, 분석기구 등을 달리하여 측정하는 방법이다(Jang 등, 2018; Kim 등, 2019). 반복성 실험은 농도별로 조제된 표준액을 분석하여 검량선을 작성하였으며, 반복 측정한 농도 값의 평균, 표준편차(SD), 상대표준편차(RSD)를 계산하였다. 각 일자에서 ellagic acid의 함량은 평균 12.95-13.48 mg/g, RSD는 1.38-3.70%로 분석되었다. 실험실내 정밀성을 측정하기 위하여 분석자 및 분석일자를 달리하여 3일간 두 명의 시험자가 분석한 결과, ellagic acid의 함량은 평균 13.16-13.41 mg/g, RSD는 1.19-2.51%로 분석되었다(Table 4). 딸기에 함유된 ellagic acid를 분석한 결과, 농도에 따른 RSD는 intra-day 실험에서 0.82-5.30%, inter-day 실험에서 0.20-5.31%이었으며, 정밀성 분석에서는 10 μg/mL에서 5.30%, 50 μg/mL에서 0.88%, 100 μg/mL에서 0.82%의 RSD값이 나타나 정밀성이 있다고 보고되었다(Yong 등, 2019). 고창 복분자의 intra-day 실험에서 RSD는 0.30-2.28%, inter -day에서 0.12-2.84%의 정밀도를 나타냈다고 보고된(Kim 등, 2012) 연구결과와 유사하게 나타났다.
정확성은 측정값이 이미 알고 있는 농도의 참값이나, 표준값에 근접한 정도로써 실험값이 참값에 얼마나 근접한 가를 의미한다. 회수율은 알고 있는 농도의 표준용액을 분석시료에 첨가한 후 회수되는 양을 백분율로 환산한다(Chae 등, 2014; Hong 등, 2015; Kim 등, 2012). RCH에 표준용액을 첨가한 HPLC 분석결과를 기초하여 정확성과 회수율(%)을 분석하였다. RCH 0.1 g에 ellagic acid 0. 2.5, 5, 10 μg/mL를 첨가한 후 분석한 결과, 회수율은 99.11-115.46%로 나타났으며, RSD는 2.5 μg/mL 농도에서 1.31%, 5 μg/mL 농도에서 1.22%, 10 μg/mL 농도에서 3.86%로 나타났다(Table 5). 고창 복분자 추출물의 ellagic acid 회수율은 89.17-97.92% 이내, RSD는 0.2% 이내이었다고 보고되었으며(Kim 등, 2012), Chae 등(2014)은 복분자 80°C 물추출물에서 ellagic acid 분석결과 89.08-100.22%의 회수율이 나타났다고 보고된 결과와 유사하게 분석되었다.
| Concentration (μg/mL) | Recovery | |
|---|---|---|
| Mean±SD (%) | RSD (%)2) | |
| 5 | 99.11±1.301) | 1.31 |
| 10 | 114.23±1.39 | 1.22 |
| 20 | 115.46±4.46 | 3.86 |
검출한계(LOD)는 시료에 함유된 성분의 검출이 가능한 최소량 또는 최저 농도이며, 정량한계(LOQ)는 시료에 함유된 성분의 정량이 가능한 최소량 또는 최저 농도이다. 직선성 검증을 통해 얻은 검량선의 기울기와 표준편차(y절편)를 통해 검출한계와 정량한계를 분석하였다. 검출한계는 0.1330 μg/mL 범위, 정량한계 0.4029 μg/mL로 나타났다(Table 6). Yong 등(2019)에 따르면 딸기 물추출물을 HPLC를 이용한 ellagic acid를 분석한 결과, 검출한계는 2.35 μg/mL, 정량한계는 7.12 μg/mL로 분석되었다고 보고되었으며, Chae 등(2014)은 복분자 추출물의 ellagic acid 지표성분 분석 연구에서 검출한계는 0.6 μg/mL, 정량한계는 1.9 μg/mL였다고 보고한 연구결과와 유사하게 나타났다.
| LOD (μg/mL) | LOQ (μg/mL) |
|---|---|
| 0.1330 | 0.4029 |
복분자 추출물의 가수분해 시간에 따른 ellagic acid 함량을 측정하기 위하여 95°C에서 1-6시간 가수분해한 후 ellagic acid 함량을 측정하였다. 5시간 가수분해물에서 ellagic acid 함량이 19.56±3.56 mg/g으로 가장 높았으며, 1시간 가수분해물에서 3.95±0.85 mg/g으로 가장 낮게 검출되었다. 가수분해 5시간까지는 가수분해 시간이 증가함에 따라 ellagic acid 함량이 증가하였으나, 6시간 이후에는 감소하였다(Table 7). Lee 등(2014)의 연구에서 딸기를 산 가수분해한 후 ellagic acid를 분석한 결과, 9.2-22.9 μg/mL 함유되어 있다고 보고하였다.
| Time (h) | Content (mg/g) |
|---|---|
| 1 | 3.95±0.85a1) |
| 2 | 9.88±1.25b |
| 3 | 11.65±2.51c |
| 4 | 16.46±2.85d |
| 5 | 19.56±3.56df |
| 6 | 18.93±2.59df |
All values are expressed as mean±SD of triplicate determinations.