서 론
커피는 독특한 맛과 향으로 전 세계에서 가장 인기 있는 음료 중 하나이다(Bresin 등, 2015). 식품의약품안전처 「식품의 기준 및 규격」(고시 제2020-128호)의 식품원료 분류에 따르면 커피원두는 견과종실류 중 음료 및 감미종실류에 속하는 식물성 원료이고, 이 커피원두를 볶은 것 또는 이를 분쇄한 것을 볶은커피라고 한다. 커피나무는 꼭두서니과 커피나무속에 속하는 상록 쌍떡잎식물로 남․북회귀선 사이의 열대 및 아열대 기후 지역에서 주로 재배되는데, 이 지역을 커피 벨트(coffee belt) 혹은 커피 존(coffee zone)이라고 부른다(Consonni, 2012). 이 지역은 평균 기온이 약 20°C로 연간 큰 기온차가 없고 강우량은 평균 1,500 mm-1,600 mm이고, 토양에는 유기질이 풍부하여 커피 재배에 적당한 조건을 가지고 있다(KCA, 2019). 커피나무의 열매인 커피체리가 다 익고 나면 핸드피킹(hand picking), 스트리핑(stripping), 기계수확 등의 방법으로 수확을 하게 되고, 과육 부분을 제거하기 위해 건식법, 습식법 등의 가공처리를 거치게 된다(KCA, 2019).
커피나무는 여러 해충과 곰팡이 및 질병에 다소 취약하여, 대량 생산을 위해서는 살균제 및 살충제 사용이 불가피한 것으로 알려져 있다(Avelino 등, 2015; Oliveira 등, 2016; Silva 등, 2006). 커피나무의 대표적인 질병에는 커피녹병(coffee leaf rust)과 커피열매병(coffee berry disease), 커피천공충(coffee berry borer) 등이 있는데, 커피녹병은 커피나무 잎에 곰팡이가 번식하는 병으로 감염된 잎이 가지에서 떨어지면서 수확량을 급격히 감소시킨다(Avelino 등, 2015). 커피열매병은 커피열매에 곰팡이가 발생하는 병으로 열매가 검게 변하며 괴사하게 되고(Silva 등, 2006), 커피천공충은 커피열매 내부에서 번식하는 작은 딱정벌레로 커피 농장에 가장 해로운 해충 중 하나이다(Damon, 2000). 이러한 질병에 대응하기 위해 커피 품종을 개발하거나 살균제 및 살충제를 살포하는 등의 노력을 하고 있다.
커피나무속에는 많은 종이 존재하나, 이 가운데 전 세계적 규모로 재배되는 종은 Coffea arabica(아라비카종)와 C. canephora(로부스타종)이다(Kim 등, 2016; Lee 등, 2013). 총 재배량의 75-80%를 차지하고 있는 아라비카종은 주로 고지대에서 재배되어 풍미가 좋고 카페인 함량이 낮은 편이나, 기후나 토양 등의 환경에 매우 민감하고 병충해에 약하여 재배가 까다로운 편이다. 반면, 총 재배량의 약 20%를 차지하는 로부스타종은 상대적으로 저지대에서 재배되며, 카페인 함량이 높고 아라비카종에 비해 향기가 약하고 쓴맛이 강하나 재배환경 및 질병에는 강한 편이다(Bliss, 2017; Lee 등, 2013; Lee, 2020a; Lee, 2020b).
관세청 자료에 따르면 커피원두는 해마다 수입량이 꾸준히 늘어나고 있고, 2019년 한 해 커피원두(볶은커피 포함) 수입량은 약 16만 5천 톤으로 전년 대비 약 5.4% 증가했다(KCS, 2018a; KCS, 2019). 2018년 한 해 수입식품 중에서는 커피원두가 전체 수입량 20위를 차지하였다(MFDS, 2019). 현대경제연구원 조사에 따르면 2018년 기준 20세 이상 인구의 연간 1인당 커피 소비량은 약 353잔으로, 동일 기간 세계 인구 연간 1인당 커피 소비량(132잔)의 약 3배 수준이다(HRI, 2019). 커피 섭취가 당뇨병, 심혈관 질환 및 산화스트레스와 관련된 기타 질병의 예방과 관련이 있다는 연구들도 다수 보고됨에 따라(Bidel과 Tuomilehto, 2013; Ranheim과 Halvorsen, 2005), 향후 커피 시장의 규모 및 커피 소비는 지속적으로 증가할 전망이다.
지금까지 커피에 관한 연구는 카페인, 클로로겐산 등 각종 화학성분 및 로스팅(roasting), 브루잉(brewing) 등의 가공 과정에 따른 이화학적 변화에 관한 연구가 주를 이루고 있으며, 본 연구의 주제인 커피원두의 잔류농약 실태보고는 드문 실정이다. 따라서 본 연구에서는 온라인에서 유통 중인 커피원두를 수거하여 잔류농약 실태를 조사함으로써 커피원두의 안전성을 확인하고자 한다.
재료 및 방법
2019년 11월부터 2020년 7월까지 온라인에서 유통 중인 커피원두 총 80건을 수거하였다. 2018년 수입국가 순위(중량 기준)를 참고하여(KCS, 2018b) 브라질 등 총 10개국에서 수입된 커피원두를 수거하였으며, 품종별로는 아라비카종 65건, 로부스타종 15건이었다. 수거 목록은 Table 1에 표시하였다.
분석대상 농약은 식품의약품안전처 「식품의 기준 및 규격」(고시 제2019-89호)의 농산물 농약잔류허용기준에서 커피원두에 기준이 설정된 농약 중 동시 분석이 가능한 41종으로, ㈜태산(Anyang, Korea)의 stock solution 1,000 mg/L 및 100 mg/L를 사용하였다. 시료의 전처리 과정에서는 acetonitrile (Honeywell, Charlotte, NC, USA), acetic acid(99.9%)(Wako Pure Chemical, Osaka, Japan), QuEChERS(Quick, Easy, Cheap, Effective, Rugged and Safe) kit(Agilent, Santa Clara, CA, USA)를 사용하였다. 추출 단계에서는 QuEChERS Extraction kit(magnesium sulfate(MgSO4); 98.5-101.5%, sodium acetate(NaOAc); 99.8%)를 사용하였고, 정제 단계에서는 QuEChERS dispersive solid phase extraction(dSPE) kit (MgSO4, primary secondary amine(PSA), octadecysilane(C18), graphitized carbon black(GCB))를 사용하였다. Syringe filter는 polytetrafluoroethylene(PTFE) 재질의 13 mm, 0.2 μm 규격(Whatman, Dassel, Germany)을 사용하였다. Liquid chromatography(LC) 이동상은 methanol(Wako Pure Chemical, Osaka, Japan), formic acid(98.0%)(Wako Pure Chemical, Osaka, Japan), Ammonium formate(99.995%)(Sigma-Aldrich, Steinheim, Germany)를 사용하였고, 증류수는 초순수제조기(Milli-Q Direct 8, Merck KGaA, Darmstadt, Germany)로 정제하여(비저항 18.2 MΩ) 사용하였다. 이동상은 0.2 μm nylon membrane filter(Whatman, Dassel, Germany)로 여과 후 탈기하여 사용하였다.
시료의 추출 및 정제는 선행연구를 참고하여 QuEChERS 분석법을 선택하였다(Mekonen 등, 2015; Oliveira 등, 2016; Reichert 등, 2018). QuEChERS 분석법은 Anastassia 등(2003)에 의해 개발된 방법으로 미국 공인분석화학회(Association of Official Analytical Chemists, AOAC)에서는 2007년 1월부터 농약다성분 분석법으로 인정한 방법이다(Lehotay 등, 2007). 기존 농약 잔류분석법과 달리 분석방법이 간단하고 다양한 매트릭스에 적용할 수 있다는 장점이 있다.
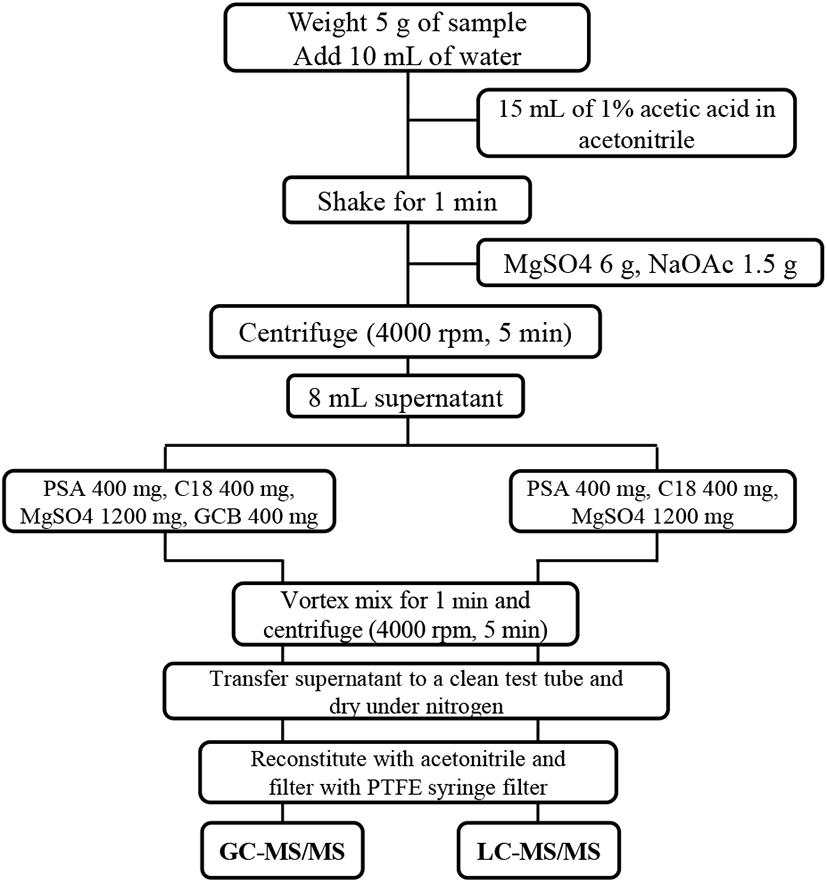
먼저 균질화된 시료 5 g을 50 mL centrifuge tube에 칭량한 후 증류수 10 mL를 넣어 30분간 습윤화시켰다. 여기에 1% acetic acid가 포함된 acetonitrile 용액 15 mL를 넣고 1-2분간 진탕한 후, MgSO4 6.0 g과 NaOAc 1.5 g을 넣고 1분간 상하좌우로 강하게 흔들어 혼합하였다. 이 혼합액을 4,000 rpm에서 5분간 원심분리한 뒤 상등액 8 mL를 취했다.
이 상등액을 gas chromatography-tandem mass spectrometry (GC-MS/MS) 시험용액의 경우에는 PSA 400 mg, MgSO4 1,200 mg, C18 400 mg, GCB 400 mg이 담긴 15 mL centrifuge tube에 넣었고, liquid chromatography-tandem mass spectrometry (LC-MS/MS) 시험용액의 경우에는 PSA 400 mg, MgSO4 1,200 mg, C18 400 mg이 담긴 15 mL centrifuge tube에 넣었다. 각각의 tube를 1분간 강하게 흔들어 준 후 4,000 rpm에서 5분간 원심분리하여 상등액 일부를 취해 40°C 이하 수욕 상에서 질소 농축하였다. 농축 건고물은 일정량의 acetonitrile로 재용해하고, PTFE syringe filter로 여과하여 시험용액으로 한 후, 각각 GC-MS/MS, LC-MS/MS로 분석하였다(Fig. 1).
GC-MS/MS는 Thermofisher scientific사(Waltham, MA, USA)의 TSQ 9000 GC-MS/MS 기기를 사용하였고, 컬럼은 TG-5(30 m×0.25 mm, 0.25 μm, Thermofisher scientific)를 사용하였다. LC-MS/MS는 Thermofisher scientific사의 Q exactive focus LC-MS/MS 기기를 사용하였고, 컬럼은 CAPCELL CORE C18(2.1 mm×150 mm, 2.7 μm, OSAKA SODA, Osaka, Japan)를 사용하였다.
GC-MS/MS 분석대상 농약은 23종(25항목)이고, LC-MS/MS 분석대상 농약은 18종(18항목)으로 총 41종의 농약 모두 multiple reaction monitoring(MRM) method로 분석하였다. 데이터 처리는 Trace finder 소프트웨어(Thermofisher scientific)를 사용하였고, 정량분석은 혼합표준용액(matrix matched standard)으로 작성한 표준 검량선을 이용하여 계산하였다. 각 기기의 분석 조건은 Table 2, 3에 나타내었고, 분석대상 농약 41종에 대한 MRM 조건은 각각 Table 4, 5에 나타내었다.
분석 방법에 대한 유효성 검증은 식품의약품안전처 식품의약품안전평가원의 식품 등 시험법 마련 표준절차에 관한 가이드라인(NIFDS, 2016)에 따라 실시하였다.
농약 표준품을 농도가 0.01, 0.02, 0.04, 0.1, 0.2, 0.5 mg/L가 되도록 acetonitrile로 희석한 후 5회 반복하여 측정하였다. 검량선의 직선성은 결정계수(coefficient of determination, R2)로 확인하였고, 검출한계(limit of detection, LOD) 및 정량한계(limit of quantitation, LOQ)는 아래의 산출 방법에 따라 구하였다.
표준용액의 검량선과 불검출 시료에 표준물질을 첨가한 검량선의 기울기 차이를 이용해 matrix effect를 계산하였다. Matrix effect의 산출식은 다음과 같다(Reichert 등, 2018).
-
a: The slope of the calibration curve obtained from standard solutions in blank coffee extract
-
b: The slope of the calibration curve obtained from standard solutions in organic solvent
회수율 시험은 농약이 검출되지 않은 커피원두를 시료로 하여 표준용액을 각각 정량한계(0.01 mg/kg), 정량한계의 10배(0.1 mg/kg), 정량한계의 50배(0.5 mg/kg) 수준으로 처리 후 상기 전처리 방법에 따라 3회 반복 수행하였다.
결과 및 고찰
직선성 및 검출한계, 정량한계, matrix effect 결과는 Table 6에 나타내었다. 검량선의 직선성은 0.01-0.5 mg/kg 범위에서 모두 R2>0.99이었고, 검출한계는 0.0003-0.0031 mg/kg, 정량한계는 0.0009-0.0093 mg/kg으로 나타나 시료 중에 함유된 미량의 농약성분도 검출이 가능한 것으로 판단되었다.
Acetonitrile로 희석한 표준용액과 matrix-matched 표준용액의 검량선 기울기 차이를 통해 matrix effect를 분석하였다. Kmellár 등(2008)은 matrix effect를 0±20% mild, ±20-50% medium, ±50% 이상 strong으로 평가하였는데, 본 연구에서는 대부분의 농약이 ±50% 이상으로 matrix effect가 큰 것으로 나타나 matrix matched standard로 작성한 표준 검량선으로 정량분석하였다.
회수율 결과는 Table 7, 8과 같다. 식품 등 시험법 마련 표준절차에 관한 가이드라인(NIFDS, 2016)의 회수율 기준은 10 μg/kg 이하의 농도는 회수율 60-120%, 상대표준편차(relative standard deviation, RSD) 32% 이하, 10 μg/kg 초과 100 μg/kg 이하의 농도는 회수율 70-120%, 상대표준편차 22% 이하, 100 μg/kg 초과 1,000 μg/kg 이하의 농도는 회수율 70-110%, 상대표준편차 18% 이하로 제시하고 있다. LC- MS/MS 분석대상 농약성분들의 경우는 회수율을 모두 만족하였다(Table 8). GC-MS/MS 분석대상 농약성분들은 0.01 mg/kg 농도 수준에서는 disulfoton, terbufos 등 2항목의 농약을 제외하고 회수율을 만족하였고, 0.1, 0.5 mg/kg 농도 수준에서는 disulfoton, terbufos, dicloran, diphenylamine, phorate 등 5항목의 농약을 제외하고 회수율을 만족하였다(Table 7). 회수율을 만족하지 않은 5항목의 경우 screening 용도로는 분석이 가능하다고 보아, 본 방법은 연구수행에 적합한 것으로 판단하였다.
커피원두는 일반적으로 분석하기 어려운 매트릭스를 가지고 있다(Pizzutti 등, 2012). 본 연구에서 LC-MS/MS 분석대상 농약성분들의 matrix effect는 대부분이 0±20%로 나타났고, GC-MS/MS 성분들의 matrix effect는 대부분이 50% 이상으로 나타났다. Matirx effect 보정을 위하여 matrix-matched standard로 정량을 하였으나, GC-MS/MS 분석시 내부표준물질 첨가나 analyte protectants(APs) 사용 등으로 matrix effect를 줄일 수 있는 추가적인 연구가 필요할 것으로 보인다.
온라인에서 유통 중인 커피원두의 잔류농약 분석 결과를 Table 9에 나타내었다. 총 80건 중 15건(18.8%)에서 농약이 검출되었다. 원산지별로 살펴보면 브라질 11건, 콜럼비아 2건, 케냐 1건, 인도 1건에서 잔류농약이 검출되었고, 품종별로 살펴보면 아라비카종 65건 중 15건에서 농약이 검출되었고, 로부스타종은 모두 불검출이었다. 브라질의 경우는 수거한 시료 11건 모두에서 농약이 검출되었다. 대부분의 나라가 소규모 커피농장에서 커피원두를 생산하는 반면, 브라질은 자본집약적인 대규모 농장을 갖추고 있고, 재배 고도가 낮아서 기계식 영농이 가능함에 따라 생산성을 늘리기 위한 비료나 농약 투입량이 많은 것으로 보고되고 있다(Chmielewska와 Souza, 2011; Lewin 등, 2004; Pignati 등, 2017). 따라서 다른 국가에 비해 브라질산 커피원두의 잔류농약 검출율이 높게 나타난 것으로 사료된다.
품종별로는 아라비카종에서만 검출되었는데, 이는 아라비카종이 로부스타종보다 카페인 함량이 낮고 질병에 취약한 품종이라 상대적으로 농약 사용량이 많았기 때문인 것으로 판단된다.
검출된 농약은 chlorpyrifos, triadimenol, thiamethoxam, imidacloprid, clothianidin 등 총 5종으로 triadimenol은 살균제이고, 나머지 4종은 살충제이다. 검출시료 중 브라질산을 제외한 콜롬비아산 2건, 케냐산 1건, 인도산 1건에서는 모두 chlorpyrifos만 검출이 되었고, 검출농도는 0.0063-0.0086 mg/kg이었다. 브라질산 커피원두에서는 총 4종의 농약이 검출되었는데, imidacloprid(10), thiamethoxam(6), clothianidin(5), triadimenol(4) 순으로 검출빈도가 높았다. 식품의약품안전처 「식품의 기준 및 규격」(고시 제2019-89호)에서 제시된 잔류농약허용기준(maximum residues limits, MRLs)을 초과한 시료는 없었다.
커피원두에 대한 잔류농약 모니터링은 수입 통관 절차에서 이루어지는 경우가 대부분이다. 커피원두의 잔류농약에 대한 연구논문은 대부분 분석방법 등에 관한 내용으로 연구차원의 잔류농약 모니터링 연구는 드문 실정이다. 미국 Food and Drug Administration(FDA) 모니터링 원자료를 통해 커피원두의 잔류농약 검출이력을 살펴본 결과(FDA, 2020), 2017년에는 콜롬비아산에서 chlorpyrifos가 검출되었고, 2016년에는 브라질산에서 clothianidin, imidacloprid, thiamethoxam, flutriafol 등 4종, 페루산에서 piperonyl butoxide, 잠비아산에서 azoxystrobin이 검출되었다. 2015년에는 브라질산에서 clothianidin, thiamethoxam, triadimenol, chlorpyrifos, cyproconazole 등 5종이 검출되었고, 멕시코산에서 piperonyl butoxide, 케냐산에서 pyraclostrobin이 검출되었다. 일본은 후생노동성 홈페이지에서 잔류농약 부적합 자료를 공개하고 있는데, 수입식품의 경우 원산지가 따로 표시되어 있지 않고 수입으로만 표시되어 있다. 2014년부터 2018년까지의 자료를 살펴본 결과, 2,4-D, endosulfan, chlorpyrifos, triadimenol, pyraclostrobin, flutriafol cyproconazole, deltamethrin & tralomethrin, propoxur 등의 부적합 이력이 있었다(MHLW, 2020). 미국과 일본에서 검출 및 부적합 이력이 있는 농약 성분 중 piperonyl butoxide, 2,4-D, flutriafol, deltamethrin & tralomethrin, propoxur 등은 국내 잔류농약허용기준이 설정되어 있지 않으므로 향후 추가적인 기준 설정이 필요할 것으로 보인다.
Chlopyrifos는 유기인계 살충제로 신경전달물질인 아세틸콜린의 분해효소 활성을 저해함으로써 살충력을 발휘한다. 친유성이라 곤충의 체내에 쉽게 침투하고, 식물의 경엽으로부터 침투가 쉬워 주로 접촉독제, 침투성 살충제, 식독제로도 작용한다(Kim 등, 2014; Kim 등, 2020a). Triadimenol은 triazole계 살균제로 세포막 성분인 ergosterol의 생합성을 저해하여 살균작용을 나타내며, 침투이행성이 높다(Chu 등, 2016; Kim 등, 2020b). Thiamethoxam, imidacloprid, clothianidine은 모두 neonicotinoid 계통의 살충제로 침투이행성이 높고, 해충의 니코틴성 아세틸콜린 수용체에 작용해 자극전달을 과다하게 함으로써 해충을 치사시키는 것으로 알려져 있다(Matsuda 등, 2001; Zhang 등, 2000). 기존에 많이 사용되고 있는 유기인계, 카바메이트계, 합성 pyrethroid계 살충제와는 그 기작이 상이하여 이들 살충제에 저항성을 나타내는 해충에 대하여 저약량으로도 높은 살충 활성을 보이는 특징이 있다(Jang 등, 1998; Kim 등, 2020c). 검출된 농약들은 모두 침투성이 높은 농약으로 작물체 내부로 흡수 이동되어 약제가 처리되지 않은 부분까지 유효성분이 이행함으로써 약효가 고르게 나타나고, 약효 지속 기간이 길게 나타나는 특징이 있다.
커피원두의 잔류농약 검출률 및 검출농도가 낮은 이유는 커피열매의 수확 후 이루어지는 가공 과정에서 세척 및 건조 등의 공정을 통해 외피, 과육, 내과피까지 제거되면서 잔류량이 감소하였기 때문이라 생각된다. 또한 커피원두는 음용을 위해 로스팅(roasting)이라는 가공 과정이 필요한데, Mekonen 등(2015)과 Sakamoto 등(2012)의 연구 결과에 따르면 로스팅 후 잔류농약 검출농도는 더욱 낮아질 것으로 예상된다.
본 연구를 통해 온라인에서 유통 중인 커피원두의 잔류농약 안전성을 확인하였다. 커피원두 15건에서 검출된 농약은 모두 잔류농약허용기준(MRLs) 이하의 안전한 수준이었으나, 커피 소비가 점점 늘어나고 시장 규모가 커짐에 따라 추가적인 기준 설정 및 지속적인 모니터링이 필요할 것으로 사료된다.