서 론
우리나라 국민 1인당 연간 육류 소비량은 지난 10년간 36.8 kg(2009년)에서 54.6 kg(2019년)으로 약 48.4% 증가하였다. 이 중에서 닭고기 1인당 연간 소비량은 9.6 kg(2009년)에서 14.8 kg(2019년)으로 약 54.2% 증가하였다(Ministry of Agriculture, Food and Rural Affairs, 2020). 다른 육류에 비해 닭고기는 상대적으로 저렴하고 지방함량이 낮아 소비자 인식 변화 등의 이유로 닭고기에 대한 수요가 증가하고 있다(Henchion 등, 2014; Tan 등, 2018). 닭고기 부위별 소비 의향도 ‘닭 한 마리’가 15.4%, ‘닭 부분육’은 32.8%로 2017년보다 각각 0.6%p, 3.8%p 상승한 것으로 나타나, 국내 소비자들은 통닭 위주로 구매하는 소비 패턴에서 벗어나 점차 부분육(닭다리 등) 소비가 크게 늘어날 것으로 예상된다(Bae 등, 2020). 또한 국내 소비자들이 닭고기 구매 시 고려하는 기준은 신선도(63.6%), 가격(39.9%), 육질(36.9%), 유통기한(29.1%) 순으로 중요하게 여기는 것으로 나타났다(Bae 등, 2020).
이렇게 소비량이 증가하는 닭고기도 도계 및 유통 과정 중에 미생물에 오염되기 쉽고 부패 속도가 빨라 위생관리가 중요하다(Rukchon 등, 2014). 닭고기에 존재하는 단백질, 유리 아미노산, 지방 등이 미생물의 생존에 영향을 주며, 특히 Pseudomonas spp., 유산균, 효모와 같은 미생물에 의해 닭고기 변색이 일어나거나, 점액(slime) 등이 형성된다(Casaburi 등, 2015; Dave와 Ghaly, 2011; Doulgeraki 등, 2012; Ercolini 등, 2010). 특히 미생물의 단백질 분해효소가 활성화되면서 닭고기 내 단백질과 아미노산은 산화적 탈아미노화, 카르복실화 및 탈황화를 거쳐 NH3, CO2, H2S와 같은 가스를 생성하게 된다(Rukchon 등, 2014). 닭고기의 신선도를 평가하기 위해 닭고기 내 미생물 생장 평가(total viable counts, TVC) 외에도 닭고기의 단백질 분해로 인한 휘발성 화합물 분석(total volatile basic nitrogen, TVB-N) 및 지방 산패도(thiobarbituric acid reactive substances, TBARS)와 같은 저장특성 연구(Balamatsia 등, 2007; 2006; Doulgeraki 등, 2012)가 수행된 바 있다. 일반적으로 닭고기의 유통기한은 TVC의 최소 부패 수준으로 예측되며, 대개 도계 후 7일 이내에 부패가 진행된다(Bruckner 등, 2012). 그러나 포장 기술 및 저장 온도뿐만 아니라, 미생물 초기 오염 수준에 따라 닭고기의 부패 진행속도가 달라지기 때문에 실제 유통 및 소비단계에서 닭고기의 품질상태에 대한 관심과 관리가 매우 중요하다.
육류의 부패는 미생물 대사에 의해 생성되는 휘발성 및 비휘발성 화합물의 존재로 냄새와 변색으로 나타나게 된다(Borch 등, 1996). 부패취는 식품의 감각적 품질을 결정하는 주요 매개 변수가 될 수 있으며, 식품의 신선도를 판별하는 잠재적인 부패 지수로 사용될 수 있다(Huis in’t Veld, 1996). 선행연구는 미생물의 생장 특성과 닭가슴살의 휘발성 유기화합물 발생 성분과의 관계(Miks-Krajnik 등, 2016), 닭가슴살에서의 미생물 생장에 따른 미생물 대사산물 분석(Alexandrakis 등, 2012) 등이 이뤄진 바가 있다. 대부분 닭가슴살을 이용한 닭고기 부패 특성에 대한 연구가 수행되었으나, 동일한 조건에서 저장된 닭고기 부분육 간의 부패 특성을 비교한 연구는 미비한 실정이며, 닭고기의 부위 및 저장 기간에 따른 미생물 생장 특성과 부패취 발생량 간의 관계는 아직 확립되지 않았다. 닭고기는 부위에 따라 영양학적 성분이 다르며, 최근 부분육에 대한 수요가 증가하고 있는 만큼 닭고기 저장기간에 따른 부위별 부패 특성에 대한 연구가 필요하다.
따라서 본 연구에서는 닭고기 저장기간에 따른 이화학적 및 미생물학적 특성과 함께 휘발성 황화합물 발생량을 조사하고, 부위별(통닭, 닭가슴, 닭다리) 부패 특성을 비교하였다.
재료 및 방법
닭고기는 하림(Harim, Iksan, Korea)에서 2020년 7월 21일 및 12월 8일에 도계된 다음 날 오전에 구입하였다. 시료 부위는 통닭(14호), 껍질 제거된 닭가슴살(14호), 닭다리(장각, 14호)를 사용하였고, 각 부위별로 5수씩 배치하여 2반복 실험 수행하였다. 처리구는 가스시료 채집용 테들러(Tedlar; 10 L, polyvinyl fluoride) 백(Dongbang Hitech Inc., Seoul, Korea)에 넣고, 열 접착기(SK-410, Sambo Tech Inc., Gimpo, Korea)로 밀봉하여 함기포장하였으며, 저장기간(1, 3, 5, 7, 9일) 동안 4°C에 보관하면서 품질 변화 및 휘발성 황화합물 성분 분석을 실시하였다. 미생물 및 이화학 실험에 사용하는 시료는 다음과 같이 준비하였다. 각 저장기간 별로 통닭 시료는 다리육을 먼저 절단한 후 다리, 가슴, 등 및 날개 순서로 발골하였다. 통닭과 닭다리는 발골 후 껍질과 살코기를 믹서기로 분쇄하였으며, 닭가슴살은 통째로 분쇄하여 시료로 사용하였다.
닭고기 시료의 미생물 분석은 일반 미생물과 Pseudomonas spp. 수에 대해 실시하였다. 시료 10 g과 멸균수 90 mL를 멸균된 filter bag에 넣고 2분 동안 균질화 하였다. 일반 미생물 수 측정은 페트리 필름(Aerobic count plate, 3M, St. Paul, Minnesota, USA)을 배지로 사용하여 단계별 희석액 1 mL를 접종한 뒤 37°C에서 24시간 동안 배양하여 형성된 집락수를 측정하였으며, colony forming units(CFU)/g으로 나타내었다.
Pseudomonas spp. 수는 Pseudomonas Agar base(MB-P1071, KisanBio, Seoul, Korea)에 Cetrimide-fusidine-cephaloridine (CFC) supplement (MB-C1849, KisanBio, Seoul, Korea)를 첨가한 배지를 사용하여 측정하였다. 희석액 1 mL를 도말한 뒤 30°C에서 24시간 배양하여 동그란 형태의 유백색을 띠는 집락에 대해 계수하였다,
닭고기 시료의 pH를 측정하기 위해 닭고기 샘플 5 g을 채취하여 증류수 20 mL와 혼합한 뒤 균질화 하였다. Whatman No. 1 filter paper로 거른 여과액을 pH-meter(SevenEasy pH, Mettler-Toledo AG, Schwerzenbach, Switzerland)를 사용하여 측정하였다.
단백질 변패 정도를 조사하기 위해 휘발성 염기질소 함량을 Conway 미량 확산법(Pearson, 1968)을 일부 변형하여 측정하였다. VBN 측정을 위해 시료 10 g에 증류수 50 mL를 넣어 균질화한 뒤 균질액은 여과지(Whatman No. 1)를 이용하여 여과하였다. 여과된 1 mL를 Conway unit 외실에 넣고, 내실에는 Conway’s borate buffer 1 mL를 떨어뜨렸다. Conway’s borate buffer는 에탄올을 이용하여 제조한 Conway reagent (0.066% methylred+0.033% bromocresol green)를 1% boric acid에 1% 농도로 첨가하여 제조하였다. Conway’s unit의 뚜껑과 접착 부위에 바세린을 바르고 뚜껑을 닫은 후 saturated K2CO3 용액 1 mL를 외실에 넣었으며, 즉시 뚜껑을 닫고 조심스레 섞어주었다. 이후 37°C에서 120분 반응시키고, 0.01 N H2SO4로 적정하여 분홍색이 되는 양을 측정하였다. VBN 함량은 아래의 식을 사용하여 계산하였으며, S는 시료 무게(g), a는 시료를 적정한 H2SO4의 부피(mL), b는 blank로 적정한 H2SO4의 부피(mL), F는 0.01 N H2SO4의 표준화 지수(factor), D는 희석배수(50)이다.
TBARS는 Witte 등(1970)의 방법에 따라 시료 5 g에 4% perchloric acid (PCA) 시약 15 mL를 첨가하여 homogenizer (Polytron PT-MR 2100, Kinematica AG, Werkstrasse, Switzerland)로 1분간 균질화시킨 후 여과지(Whatman No. 1)로 여과하였다. 시험관 내에 여과액 5 mL를 0.02 M thiobarbituric acid (TBA) 5 mL와 혼합한 다음 80°C 항온수조에서 60분간 열처리한 후 10분간 냉각시켰다. 시료액을 532 nm에서 흡광도(OD)를 측정하였으며, TBARS 값은 다음의 식에 의해 산출하였다.
닭고기 유래 휘발성 황화합물 가스 채취는 간접흡인상자법(Ministry of Environment, 2019)을 사용하였다. 10 L 테들러 백과 간접흡인상자를 이용하여 저장된 닭고기로부터 발생된 가스를 포집하였으며, 채취된 시료는 48시간 이내에 측정하였다. 저온 농축관을 지닌 열탈착 시스템(thermal desorption, TD(Unity2+air server, Markes, UK))과 CP-Sil 5CB(60 m, 0.32 mm, 5 μm) 컬럼이 장착된 GC/PFPD(456-GC, Scion instruments, Goes, Netherlands)를 이용하여 분석하였다. 오븐온도는 3분 동안 60°C로 유지한 후 160°C까지 8°C/min으로 승온시켰으며, 160°C에서 9분 동안 유지하였다. 본 연구에서는 주요 황화합물인 hydrogen sulfide(HS), methyl mercaptan (MM), dimethyl disulfide(DMDS), dimethyl sulfide(DMS) 4종에 대해 정량 분석하였으며, 측정된 값은 시료 100 g에 대한 발생량(ppb)으로 환산하여 사용하였다.
결과 및 고찰
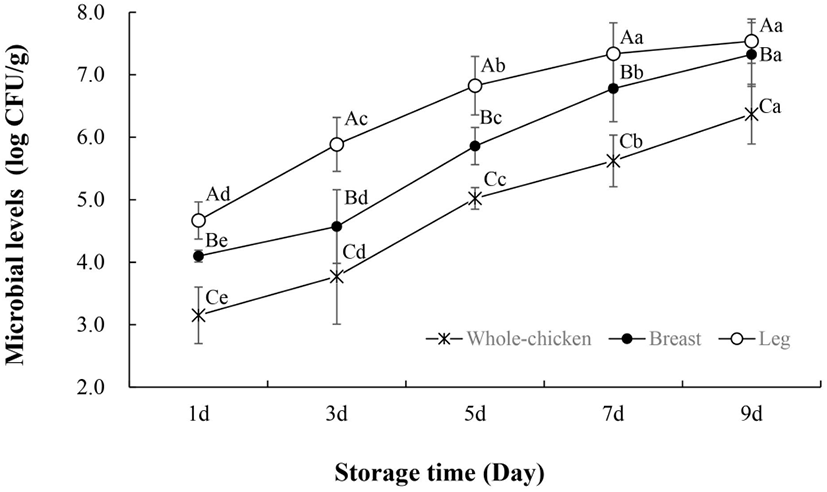
냉장 보관한 닭고기의 일반 미생물 수 변화는 Fig. 1과 같다. 통닭, 닭가슴살, 닭다리의 부위별 초기 미생물 수는 차이가 있었으나, 저장기간이 지남에 따라 미생물 수는 증가하였다. 저장 9일 차의 일반 미생물 수는 닭고기 부위별로 유의적 차이가 보였으며(p<0.05), 이는 초기 미생물 수와 부위별 영양학적 특성 차이에서 기인한 것으로 여겨진다. 대개 일반 미생물 수가 7-8 log CFU/g에 도달하면 가금류 제품은 소비에 부적절한 것으로 간주된다(Rukchon 등, 2014; Senter 등, 2000). Khanjari 등(2013)은 일반 미생물 수 기준(7 log CFU/g)에 따라 4°C에서 보관된 닭가슴살의 저장수명은 6일로 설정하였으며, Kuswandi 등(2014)은 4°C에서 저장한 육계의 유통기한을 7일로 제시하였다. 우리나라 식품공전(Ministry of Korea Food and Drug Safety, 2021)에서는 식육 중 일반 미생물 검사 결과의 권장기준을 6 log CFU/g 이하로 제시하고 있으며, 본 연구결과에서는 닭고기 부위별로 6 log CFU/g을 초과한 시기가 각각 9일(통닭), 7일(닭가슴), 5일(닭다리)인 것으로 나타냈다. 이를 미루어 보아 부위별 특성에 따라 부패속도 및 시기가 다르므로 부위별로 유통기한이 고려되어야 할 것으로 보인다.
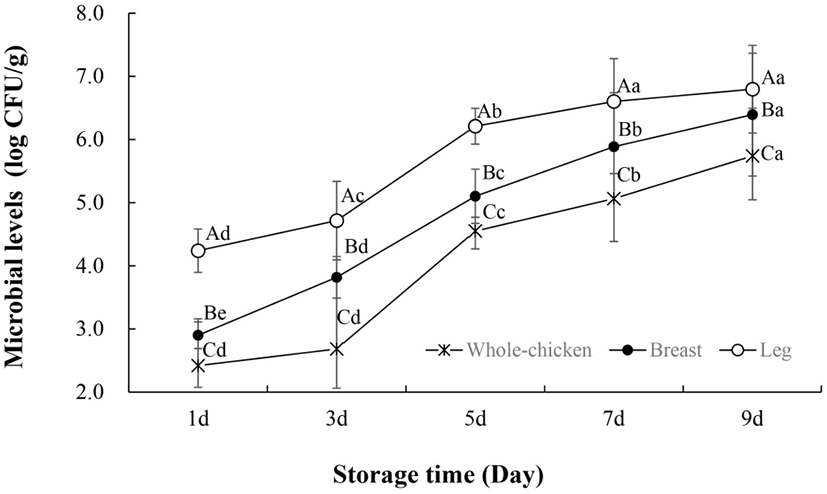
Pseudomonas spp. 역시 저장기간이 경과됨에 따라 미생물 수준이 증가하였다(Fig. 2). 일반적으로 냉장 온도에서 호기성으로 저장되는 생 닭고기는 P. fragi, P. fluorescens, P. putida 등과 같은 Pseudomonas spp.로 우점되면서 단백질 분해로 인한 슬라임(slime)이 만들어진다(Hinton 등, 2004; Rouger 등, 2017). Pseudomonas spp.는 Enter-Doudoroff 경로를 통해 글루코스를 2-oxo-gluconate와 gluconate로 대사함으로써 다른 부패균보다 경쟁적 우점을 확보한다(Dainty, 1996). 이 물질들은 포도당이 고갈되었을 때 사용할 수 있는 대체 에너지로 이용되어 Pseudomonas spp.의 생존에 영향을 준다(Dainty, 1996). 결과적으로 Pseudomonas ssp.는 생닭 표면에서 빠르게 성장하고, 전체 세균 개체군의 50-90%를 차지하는데(Katiyo 등, 2020), 이는 Fig. 1과 Fig. 2의 경향과 유사한 것으로 보여진다.
통닭의 pH는 5.99, 닭가슴 5.89, 닭다리 6.71로 닭고기 부위에 따라 초기 pH는 차이가 있었으며(p<0.05), 통닭, 닭가슴살, 닭다리 모두 다 저장기간에 따라 증가하는 경향성을 보였다(p<0.05)(Table 1). Zhang 등(2016)은 4°C에서 15일 동안 함기포장된 닭가슴살의 pH가 5.65에서 6.66으로 증가한다고 보고하였고, Katiyo 등(2020)은 호기성 냉장조건에서 닭다리를 14일 동안 저장하였을 때 각각의 pH가 6.70(1일), 6.92(3일) 7.08(10일), 7.28(14일)로 현저하게 증가했다고 제시하였다. 본 연구에서는 닭다리, 통닭, 닭가슴살 순서로 pH가 높게 나타났으며, p<0.05 수준에서 부위별 시료 간에 유의적인 차이를 나타냈다. 이러한 pH 변화는 냉장 보관하면서 암모니아와 아민류와 같은 알칼리성 질소 화합물이 물 분자를 만나면서 육류의 pH가 증가된 것이며(Allen 등, 1997; Zhang 등, 2016), 부위 및 저장기간에 따른 pH 변화는 닭고기 부위, 보관 기간, 보관 온도 그리고 닭고기 초기 미생물군에 의한 영향으로 보여진다(Katiyo 등, 2020).
닭고기 부위별 저장기간에 따른 VBN 변화는 Table 2에 나타내었다. 1일 차의 통닭, 닭가슴, 닭다리의 값은 각각 8.18, 10.69, 6.36 mg%를 나타냈으며, 저장기간에 따라 VBN 값은 유의적으로 증가하였다(p<0.05). Park과 Kim(2012)은 저장기간 10일 동안 닭가슴살의 VBN 값은 6.27에서 20.99 mg%로 증가하였으며, 닭다리의 값은 6.08에서 21.45 mg%로 증가한 것을 확인하였다. Kim 등(2020)은 닭가슴살의 VBN 값이 9일 차에 20 mg%를 초과하였다고 보고하였다. VBN 값은 신선도를 나타내는 지표로 사용되며, 값이 높을수록 닭고기가 덜 신선함을 나타낸다. 우리나라 식품공전(Ministry of Korea Food and Drug Safety, 2021) 기준에 따라 VBN 20 mg% 이상이면 부패육으로 판정된다. VBN은 미생물의 대사과정으로 인한 단백질 분해 과정에서 발생하는 것으로 VBN의 발생 수준은 부패 미생물의 생장과 관련 있다(Rukchon 등, 2014). 따라서 선행연구에서 닭가슴 혹은 닭다리의 저장기간이 지남에 따라 VBN이 증가한다고 보고(Jang 등, 2010; Rukchon 등, 2014)하였으며, 본 실험도 저장기간에 따라 VBN 값이 증가하였다. 그러나 일반 미생물 수 6 log CFU/g 초과한 시기의 VBN 값(mg%)은 각각 16.70(통닭, 9일), 14.63(닭가슴살, 7일), 8.41(닭다리, 5일)로 나타났다. 즉, 미생물학적으로 부패가 시작되는 시기의 VBN 값은 20 mg% 이하로 신선한 상태인 것으로 보여주고 있어 VBN 단독으로 사용하여 닭고기 부패 정도를 추측하는 데에 한계가 있어 보인다.
또한 저장 1일 차 VBN 값은 부위별로 다르게 나타났으며, 부위별로 VBN 20 mg%에 도달하는 시기가 각기 달랐다. 닭다리 근육과 닭가슴 근육의 단백질 함량이 각각 15.8-17.9% 및 21.9-23.5%로 확인된 바 있으며(Zlender 등, 1995), 이러한 닭고기 부위별 단백질 함량 차이로 인해 저장 초기(1일-5일)의 닭가슴살은 단백질 분해에 의해 부패가 주로 이뤄진 것으로 판단된다.
TBARS 값은 식육의 산패정도를 나타내는 척도가 되며, 산화된 지질분자, lipid hydroperoxides의 분해로 형성된 2차 지질산화물에 따라 값이 측정한다(Brannan, 2008). 닭고기 부위 및 저장기간(1, 3, 5, 7, 9일)이 닭고기의 지방산패도에 미치는 영향을 Table 3에 나타내었다. 통닭, 닭가슴, 닭다리 모두 냉장 저장 기간 동안 TBARS 값이 유의적으로 증가하였다(p<0.05). Kim 등(2020)은 닭가슴살을 9일 동안 저장하였을 때 TBARS 값이 0.13에서 0.33 mg MDA/kg으로 증가하였다고 보고하였다. 또, 다른 연구에서 닭고기를 10일 동안 저장하였을 때 닭가슴살의 값은 0.28에서 0.44 mg MDA/kg으로 증가하였으며, 닭다리의 값은 0.26에서 0.52 mg MDA/kg으로 증가한다고 보고된 바가 있다(Park과 Kim, 2012). 본 연구도 선행연구와 비슷한 경향성을 보였으나, 닭가슴살은 통닭과 닭다리와 달리 저장 9일이 지난 후에도 TBARS 0.30 mg MDA/kg을 초과하지 않았다. 닭다리 근육과 닭가슴 근육의 지방 함량은 각각 6.54-8.29% 및 2.41-2.81%인데(Kucukyilmaz 등, 2012), 부위별 지방함량 차이로 인해 부분육에 따라 지방산패 속도가 다르게 나타난 것으로 보인다. 또한 일반 미생물 수 6 log CFU/g을 초과한 시기인 9일(통닭), 7일(닭가슴), 5일(닭다리)의 TBARS 값을 살펴보면 각각 0.30 mg MDA/kg (통닭), 0.26 mg MDA/kg(닭가슴), 0.30 mg MDA/kg(닭다리)를 나타내고 있으며, 저장 5일 차에서 닭다리는 0.30 mg MDA/kg으로 통닭과 닭가슴살보다 유의적으로 높게 나왔다(p<0.05). 육류의 부패는 저장 온도, 포장 처리, 육류 성분, 초기 미생물 분포 등 여러 요인의 영향을 받으며(Zhou 등, 2010), 선행연구에서 제시하는 지방산패도 부패기준 값은 시료의 종류와 실험조건에 따라 상이하였다. Brewer 등(1992)은 신선한 육류의 기준으로 TBARS 값 수준이 0.2 mg MDA/kg 미만이어야 한다고 보고하였으며, Kim 등(2016)은 육류의 지방산패도 부패기준으로 0.25 mg MDA/kg으로 제시하였다. 또 다른 연구에 따르면 지방산패도가 0.6-2.0 mg MDA/kg 범위에서는 소비자들이 알데히드, 케톤 및 알코올과 같은 산물로 인해 이취를 감지할 수 있다고 보고된 바가 있다(Mohan 등, 2017). 그러나 선행연구에 제시하고 있는 TBARS에 의한 부패 기준값을 각 부분육에 대해 동일하게 적용하여 닭고기의 신선도를 추정하기는 어려울 것으로 보인다. 본 연구결과에서는 미생물학적 부패가 시작되는 시기의 닭고기 부위별 TBARS 값이 0.26-0.30 mg MDA/kg을 나타내고 있으며, 이를 종합적으로 살펴보았을 때, 통닭 및 닭다리는 0.30 mg MDA/kg, 닭가슴살은 0.26 mg MDA/kg을 TBARS에 의한 신선도 기준으로 봐야 할 것으로 판단된다.
닭고기 부위별 저장기간에 따른 주요 황화합물(4종) 발생량은 Table 4-7에 나타내었다. 3개의 부위(통닭, 닭가슴, 닭다리)에서는 저장기간에 따라 4종의 황화합물 발생량이 대체로 증가하는 경향성을 보였다. 닭가슴살을 제외한 통닭과 닭다리의 HS 발생량은 저장 9일 차에서만 유의적으로 증가하였다(p<0.05)(Table 4). MM와 DMDS의 발생량 역시 저장 9일 차에서 유의적으로 증가하였으며(p<0.05), 3개의 처리구 모두 동일한 경향성을 보였다(Table 5, Table 6). DMS 역시 저장기간에 따라 증가하는 경향성을 보였으며, 저장 7일(통닭), 9일(닭가슴살, 닭다리)에 DMS 발생량이 크게 증가하였다(Table 7). Freeman 등(1976)의 연구에서는 호기성 환경에서 닭가슴살에서는 HS, MM, DMS, DMDS 등의 휘발성 성분이 발생한다고 보고하였으며, 본 연구에서도 닭가슴살 뿐만 아니라, 통닭 및 닭다리에서 4종의 황화합물 발생량을 확인하였다. 부패취 성분인 황화합물 발생량 결과를 종합적으로 비교해 보았을 때, 황화합물 중 DMS가 주요 부패취 성분으로 신선도 측정 지표로 활용 가능할 것으로 보인다. 일반 미생물 수 6 log CFU/g에 도달한 시기의 DMS 발생량은 각각 55.91 ppb(통닭, 9일), 50.86 ppb(닭가슴살, 7일), 8.61 ppb(닭다리, 5일)로 확인되었다. 또한 일반 미생물 수 7 log CFU/g 도달 시기의 DMS 발생량은 194.87 ppb(닭가슴살, 9일), 143.05 ppb(닭다리, 7일)이다. 통닭의 경우 일반 미생물 수 7 log CFU/g일 때 DMS 발생량을 확인할 수가 없었으나, 닭가슴살과 닭다리는 각각 7일, 5일 차에 비해 DMS 발생량이 급격하게 증가한 것을 볼 수 있다. 일반적으로 냉장 호기성 조건에서 보관된 가금류에서 표면 미생물이 약 7 log CFU/g에 도달하면서 상한 냄새가 나기 시작하는데(Alexandrakis 등, 2012; Balamatsia 등, 2006; Lin 등, 2004), 본 연구결과에서도 일반 미생물 수가 7 log CFU/g 초과할 때 DMS가 크게 증가하였다. 이는 미생물이 가장 선호하는 에너지인 포도당이 고갈되면서 나타난 결과로 보인다. 미생물은 포도당, 젖산, 피루브산, 글루콘산과 같은 다른 에너지 기질을 순차적으로 사용하고, 이후에 황 함유 아미노산인 시스테인, 시스틴 및 메티오닌 등을 분해하면서 황화합물을 형성하게 된다(Ellis 등, 2002). 이러한 황화합물은 비린내, 썩은 달걀, 암모니아와 같은 특유의 냄새를 연상시키는데, Vasconcelos 등(2014)은 7-8 log CFU/g 사이에서 닭고기는 반 신선한 상태(semi-fresh)로 분류하며, 8 log CFU/g을 초과한 후에야 이취가 쉽게 인지 가능하여 고기가 부패한 것으로 보았다. 그러나 본 연구에서는 이런 특징적인 이취가 저장 5일 차 닭가슴 및 닭다리에서 확인되면서 선행연구와 다른 결과를 나타냈다. 저장 5일 차 닭가슴 및 닭다리는 일반미생물 수가 7 log CFU/g에 도달하지 않았으나, DMS 발생량은 각각 24.61 및 8.61 ppb로 확인되었다. DMS의 최소 감지값이 3ppb(Nagata, 2003)임을 고려하였을 때, DMS 농도 8-25 ppb는 충분히 감지가 가능한 수준이다.
한편, 비슷한 미생물 수 수준(7 log CFU/g)에서의 DMS의 발생량을 부위(닭가슴 및 닭다리) 별로 비교하였을 때, 닭가슴살의 DMS(194.87 ppb)가 닭다리의 것(143.05 ppb)보다 높게 나타남을 확인할 수 있다(Table 7). 이는 황 함유 아미노산의 닭고기 부위별 함량 차이로 인한 결과로 판단된다. DMS는 L-methionine(Met), L-cysteine(Cys)과 같은 황 함유 아미노산으로부터 미생물의 대사과정을 거쳐 합성되는데(Casaburi 등, 2015), 닭가슴살의 황 함유 아미노산 함량은 Met 2.55%, Cys 1.15%이며, 닭다리는 Met 1.82%, Cys 0.85%로 알려져 있다(Hascik 등, 2020).
즉, DMS 발생량은 닭고기의 황 함유 아미노산 함량 차이로 인해 부위별 차이가 있었으나, 전반적으로 DMS 발생량은 미생물 생장과 관련 있는 것으로 확인되었다. 특히 일반미생물 수 7 log CFU/g에 도달함에 따라 닭고기 유래 DMS 발생량이 크게 증가한 한편, 5-7 log CFU/g 범위에서도 감지가 가능한 수준으로 DMS가 발생되었다. 따라서 본 연구결과는 DMS를 미생물에 의한 부패취로써 또 하나의 신선도 지표로 활용할 수 있는 가능성으로 보인다.
