서 론
포도당의 중합체인 dextran은 주요 당 사슬에 전체 결합의 50% 이상을 연속적인 α-1,6 결합을 지닌 것이 특징이며, 가변에 일부 α-1,2, α-1,3, α-1,4형 분지결합에서 유래하는 측쇄가 있는 α-D-glucan이다. 이는 점질물을 생성하는 미생물에서 분리된 biopolymer(Naessens 등, 2005a)로서, 분자량, 구성당의 종류, 결합 순서·양식·위치 및 분지결합 유무에 따라 독특한 물성과 생리활성 등 다양한 기능성을 나타낸다(Son 등, 1996). Dextran은 주로 유산균(Leuconostoc mesenteroides)의 dextran sucrase(DSase; EC 2.4.1.5) 효소에 의해 sucrose 내 glucose 잔기의 transglucosylation 작용으로 합성된 고분자 다당류로 알려져 있다(Lindberg와 Svensson, 1968; Robyt와 Walseth, 1979). 이 외에도 맥주의 점성 물질을 생성하는 초산균(Gluconobacter oxydans)에 의한 dextran 생성이 보고되었으며(Hehre와 Hamilton, 1949), dextran이 유래한 미생물 및 효소에 따라 분지결합 형태 및 함량이 다른 것으로 알려져 있다(Leathers, 2002). 일반적으로 고분자 다당류는 젤 형성능, 유화 안정력 및 필름형성능 등의 광범위한 기능 특성으로 인해 수용액의 rheology적 특성을 크게 변화시키므로 점도는 미용 및 의료용 소재 등 다양한 산업 적용 시 중요한 정보를 제공한다(Jang, 2019).
G. oxydans 유래 dextran dextrinase(DDase; EC2.4.1.2)는 maltodextrin 내 α-1,4 glycosidic linkage로 결합된 glucosyl unit를 donor molecule에서 acceptor molecule로 전달하는 transglucosidase의 활성을 통하여, α-1,6 glycosidic linked chain 형태로 결합된 당전이 생성물인 dextran을 생성한다(Naessens와 Vandamme, 2001). G. oxydans는 Acetobacteraceae과에 속하는 그람 음성균으로 산화·발효과정에서 광범위한 탄수화물 이용능 및 알코올의 불완전한 산화능을 가지며(Prust 등, 2005), cellulose, dextran과 같은 biopolymer 생산 및 transglucosylation 효소(DDase) 생산 관점에서 잠재적 능력이 있는 균주로 보고되고 있다(De Muynck 등, 2007). G. oxydans 유래의 기능성 다당류 생산을 위한 노력의 일환으로, DDase 효소 작용기전(Hehre, 1951; Yamamoto 등, 1993), G. oxydans ATCC 11894 유래의 DDase 효소 정제 및 생화학적 특성(Suzuki 등, 1999; Suzuki 등, 2000) 및 기질 특이성(Naessens와 Vandamme, 2001; Yamamoto 등, 1994) 등에 대한 다양한 연구가 진행되었다. 그리고 G. oxydans 유래의 세포 내 DDase 회수 최적화를 위한 탄소원 및 질소원 탐색 연구에서 glycerol, mannitol, mycological peptone이 효소 활성도 및 생육 증진에 효과가 있으며(Naessens 등, 2004), dehydroxyacetone 생산 시 glycerol의 농도에 따라 농도 의존적으로 G. oxydans의 생육이 증가한다고 알려져 있다(Gaetgens 등, 2007).
G. oxydans는 식품소재 생산 측면에서 잠재력이 매우 높은 균주로, 이를 활용하여 제약·식품·화학 업종에 폭넓게 적용되는 기능성 다당류인 dextran을 생산하고자 산업적으로 생물공학 기술을 적용하고 있다(Mao 등, 2012). 하지만 대사공학 및 효소공학 방법을 적용할 경우, 식품 소재로 사용하기 위해서는 안전성 검증 등의 이유로 오랜 연구기간이 필요하다는 한계가 있다. 최근, 목적 물질을 생산하는 미생물의 최적배양을 통하여 배양액 내 생성 물질을 이용하는 생물전환 방법에 대한 관심이 증가하고 있으나, 국내에서는 당전이 활성이 있는 G. oxydans의 생물전환을 통해 dextrin을 기능성 다당류인 dextran으로 전환하는 연구가 부족한 실정이다. 해외 사례로는 Weisella confusa 균주의 10%(w/v) sucrose 함유 MRS 배지 배양으로 dextran 전환 및 물성특성 연구 사례가 보고되어 있다(Netsopa 등, 2018).
따라서 본 연구에서는 G. oxydans의 배양 중 전구체로 작용하는 maltodextrin의 중합도, 첨가수준 및 다가알코올류 첨가에 따른 생육특성과, 배양상등액으로부터 회수된 다당류의 특성 분석을 통하여 G. oxydans의 효과적인 생물전환 작용을 유도하는 배양조건을 탐색하고자 하였고, G. oxydans 균주를 이용한 maltodextrin으로부터 dextran으로의 생물전환의 기초 자료를 확보하고자 하였다.
재료 및 방법
본 실험에서 구성당 분석을 위해 사용된 표준물질 fructose (F), glucose(G), sucrose(S), nigerose(N), maltose(M2), kojibiose (K), isomaltose(IM2), maltotriose(M3), panose(P), isomaltotriose (IM3), maltoheptaose(M7)은 Sigma-Aldrich(St. Louis, Mo, USA), maltotetraose(M4), isomaltotetraose(IM4), maltopentaose (M5), isomaltopentaose(IM5), maltohexaose(M6)는 TRC(Toronto, Canada), isomaltohexaose(IM6), isomaltoheptaose(IM7)는 Omicron(Amherst, MA, USA), dextran(Mw=40,000)은 TCI (Tokyo, Japan)에서 HPLC-grade 시약을 구입하여 사용하였다.
본 연구에 사용된 초산균 표준균주는 국립농업과학원 미생물은행(KACC)으로부터 Gluconobacter oxydans을 분양받았으며, 초산균 배양배지는 acetic acid bacterium(AAB; peptone 5 g/L, yeast extract 5 g/L, glucose 5 g/L, MgSO4·7H2O 1 g/L, pH 6.6-7.0) media를 사용하였다. 다당류 제조를 위한 배양배지는 AAB media에 1%, 5% maltodextrin(dextrose equivalent 4.0-7.0, MD1, Sigma-Aldrich) 또는 1%, 5% maltodextrin(dextrose equivalent 13.0-17.0, MD2)을 첨가하여 제조하였다. Naessens 등(2005b)에 따르면, 배지 내 다가알코올(glycerol)의 첨가를 통한 G. oxydans의 생육 증진 효과가 보고되었으며, 이때 사용된 glycerol 농도를 참고하여(Kooi와 Grange, 1958) 예비실험 결과, 본 연구에서는 다당류 제조를 위한 배양배지에 2%(v/v)의 glycerol(TNT research, Jeonju, Korea)을 추가로 첨가해 총 7종의 배지를 제조하여 실험을 진행하였다(Table 1). G. oxydans의 배양은 5 mL의 AAB media가 담긴 test tube에서 전배양(30℃, 200 rpm, 18시간)하고, 250 mL의 AAB media에 2%(v/v) seed를 접종하여 본배양(30℃, 200 rpm)하였다. 이후, 7일 동안 진탕배양(30℃, 200 rpm)하며, 24시간마다 배양액을 회수하여 600 nm에서 흡광도를 측정함으로써 초산균의 생육곡선을 조사하였다.
본 연구에 사용된 G. oxydans의 DDase gene 보유 여부를 확인하기 위하여, G. oxydans ATCC 11894(accession number: LC008541)의 DDase gene 서열을 참고로 primer를 제작하였다. DDase gene을 보유하였을 경우, 약 300-500 bp의 PCR product가 증폭되도록 specific PCR primer를 제작하였고, DDase gene의 전체 서열 분석을 위한 primer를 제작하였다. Primer 제작에는 NCBI primer blast program(https://www.ncbi.nlm.nih.gov/tools/primer-blast)을 사용하였고, 제작된 primer 서열 및 예상 PCR product의 크기는 Table 2에 나타내었다. G. oxydans의 genomic DNA는 genomic DNA extraction kit(Bead Genomic DNA Prep Kit For Bacterium, Cultured Cell, Biofact, Daejeon, Korea)를 이용하여 회수하였고, 이를 주형가닥으로 사용하였다. Specific PCR 수행 조건은 pre-denaturation(94℃, 2분); denaturation(94℃, 30초), annealing(60℃, 1분), extension(72℃, 2분), 30 cycle; final extension(72℃, 5분); storage(4℃)이다. 증폭된 DNA의 검출을 위해 agarose(Sepro, GenDEPOT, USA)와 1X TAE buffer를 사용하여 1% gel을 만든 후 전기영동 장치(Mupid-2plus, Takara, Kushikatsu, Japan)를 통해 100 volt/cm의 전류로 25분 동안 진행하여 확인하였다.
pH 및 산도는 초산균 배양액을 원심분리(4℃, 19,010 ×g, 10분, Himac CR21GⅡ, Hitachi, Tokyo, Japan) 후, 배양상등액을 회수하여 측정하였다. pH는 배양상등액을 증류수로 10배 희석 후, pH meter(Orion 3 star, Thermo scientific Co., Waltham, MA, USA)를 이용하여 상온에서 측정하였다. 총산도는 시료 1 mL에 증류수 9 mL를 첨가하여 10배 희석 후, 0.1% phenolphthalein solution을 2-3방울 가하여 붉은색이 보일 때까지 0.1 N NaOH로 중화 적정하였고, 소비된 NaOH의 양을 아래의 식에 대입하여 acetic acid로 환산하여 %로 표시하였다.
A: 소비된 0.1 N NaOH 용액의 mL 수
60: 0.1 N NaOH 1 mL에 상당하는 acetic acid(g)
F: 0.1 N NaOH 용액의 역가
S: 적정에 사용된 배양 상등액의 양(mL)
0.1: NaOH의 농도
환원당은 glucose oxidase/peroxidase 또는 hexokinase/G6P-DH 효소 작용을 기반으로 분석 가능한 GOPOD kit (D-glucose assay kit, Megazyme, Bray, Co. Wicklow, Ireland)를 이용하여 각 배지별 G. oxydans 배양상등액의 환원당 함량을 측정하였다(www.megazyme.com). D-glucose 포함된 배양상등액 1 mL에 GOPOD reagent 3 mL를 혼합하여 40℃에서 20분간 반응시킨 후, microplate reader(Multiskan Sky, Thermo Scientific Co.)를 이용하여 OD510 nm에서 흡광도를 측정하였다. 측정된 흡광도 값을 아래의 식에 대입하여 환원당의 함량을 계산하였다.
배지의 구성(첨가된 기질의 중합도 및 농도)에 따른 초산균의 다당류 생성 유무를 확인하기 위하여 배양액을 원심분리(19,010 ×g, 10분)한 후, 배양상등액의 유변학적 특성을 분석하였다. 유동 특성은 rherometer(MCR 302, Anton Paar Co., Graz, Austria)를 사용하여 측정하였으며, probe는 PP-50, 온도는 25℃, shear rate는 0.01-300의 범위 내에서 총 30번 측정하였다(Im 등, 2015).
초산균 배양 시 배지의 구성(첨가된 기질의 중합도 및 농도)에 따라 생성되는 다당류의 차이를 확인하기 위하여, 배양상등액을 이용해 HPAEC를 수행하였다. 배양상등액을 증류수로 5배 희석하여 0.22 μm syringe filter(13 mm, 0.22 μm, NYLON, Thermo Fisher Scientific Co.)로 여과하여 분석시료로 사용하였다. 각 배양상등액이 함유하고 있는 구성 당류의 패턴 분석을 위해 Jeong 등(2019)의 연구에서 적용한 방법을 참고하였다. ICS 5000 Dionex chromatography system (ICS-5000+ Capillary HPIC™ System, Thermo Fisher Scientific Co.)에 CarboPac PA200 column(3×250 mm, Dionex)를 장착하여 분석하였고, 분석시스템은 PEEK tube(0.24 mm i.d.), a gradient mixer(2 mm), ED amperometry cell with 0.25 μL channel volume, a pH-Ag/AgCl reference electrode, 0.002 in gasket, and gold electrodes을 포함하였다. 분석조건으로 분석용매는 100 mM sodium hydroxide와 1 M sodium acetate를 사용하였고, sodium acetate는 15-50분 동안 0-400 mM까지 농도구배를 주어 분석하였으며, column의 온도는 40℃, 샘플 주입량은 5μL, 용매 유속은 0.5 mL/min의 조건으로 분석하였다.
배지의 구성(첨가된 기질의 중합도 및 농도)에 따라 생성된 다당류의 당 분자 간 α-1,4 및 α-1,6 결합의 함량 분석을 위하여, 배양상등액을 이용해 1H-NMR spectroscopy(500 MHz FT-NMR, JEOL, Tokoy, Japan)를 수행하였다. 동결 건조된 sample(20 mg/mL)을 산화중수소(D2O)에 녹여준 뒤 40℃에서 10분간 반응시킨 후 다시 동결건조하였다. 동결건조된 시료를 20 mg/mL의 농도가 되도록 산화중수소에 다시 용해한 후, 1H-NMR 분석을 수행하였다.
결과 및 고찰
G. oxydans 균주 내 당전이 활성이 있는 효소, dextran-dextrinase(DDase) gene 보유 여부를 확인하기 위하여, NCBI에서 G. oxydans ATCC 11894의 DDase gene sequence를 참고로 제작한 specific PCR pirmer를 이용하여 PCR을 수행하였다. G. oxydans의 genomic DNA를 주형가닥으로 PCR 실시 후 DNA 전기영동 결과, 예상 크기인 342, 434, 364 bp에서 PCR product가 검출되었으므로(Fig. 1A), 실험에 사용된 G. oxydans 균주의 염색체 내 DDase gene을 포함하고 있을 것으로 추정되었다. DDase gene의 domain 분석 결과, G. oxydans의 DDase gene 보유 여부를 확인하기 위해 제작된 primer set 5의 경우 DDase gene을 구성하고 있는 COG2931 family sequence 내에 위치함으로 DDase specific PCR primer로 사용이 가능함을 확인하였다(Fig. 1B).

G. oxydans ATCC 11894 서열을 참고하여 3.4 kb 상당의 DDase gene 증폭용 primer(Table 2)를 제작하여 PCR을 수행하였고, PCR product의 서열을 분석하여 분양받은 G. oxydans 유래의 DDase gene 서열을 확보하였다(data not shown). DDase gene의 서열 분석을 통해 기존에 보고된 G. oxydans ATCC 11894의 DDase gene 서열과 99% 상동성(3,848/3,855 nucleotides)이 확인되었다. 서열분석된 DDase gene(PCR product)을 NCBI의 blastX 프로그램을 이용하여 데이터베이스 상에 등록된 아미노산 서열과 비교분석한 결과, Gluconobacter sp. LMG 31484, Gluconobacter cerevisiae, Acetobater malorum, Gluconaetobacter sacchari, Nguyenibacter vanlangensis의 hypothetical protein과 99% 상동성을 확인하였으며, DDase gene은 CBM6-CBM5, GH(glycoside hydrolase) family 15 및 COG2931 family의 3개 domain으로 구성되어 있음을 확인하였다. 따라서 본 연구를 위해 분양받은 G. oxydans는 DDase gene을 함유하고 있으므로 다당류를 제조하기 위해 적합한 균주로 예상된다.
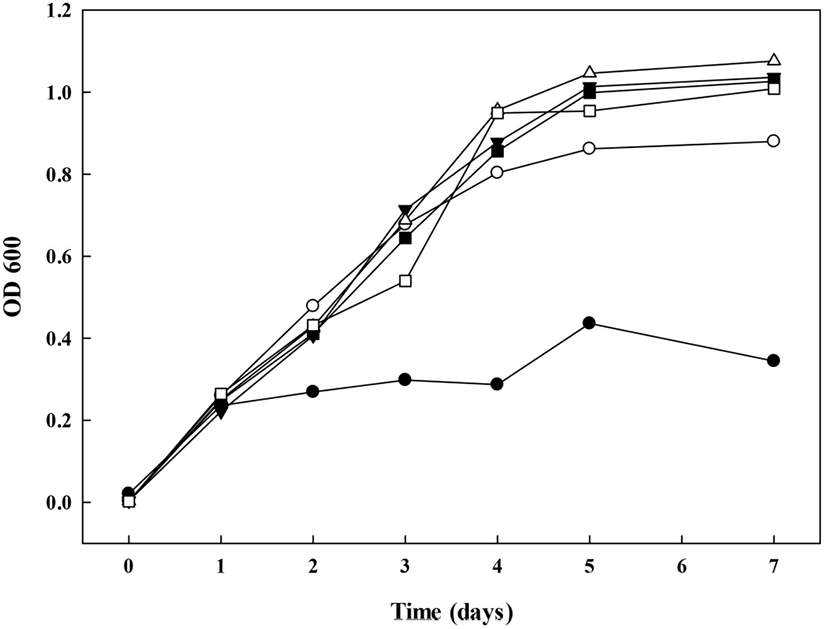
G. oxydans의 배양을 통해 dextrin을 dextran으로 생물전환하기 위하여, 초산균 배양에 적합한 배지조건을 탐색하고자 하였다. 일반적으로 초산균 배양 시, acetic acid 등의 대사산물의 생성으로 인해 배지의 산성화가 발생하며, 이에 따른 catabolite repression에 의해 장시간 배양이 어려운 것으로 알려져 있다(Brueckner와 Titgemeyer, 2002). Naessens 등(2005b)및 Kooi와 Grange(1958)에 따르면 배지 내 glycerol, sorbitol 등 다가알코올 첨가가 완충작용을 통해 초산균의 생육을 증진시킨다고 보고하였다. 2%(v/v) glycerol 첨가군과 무첨가군 배양배지를 제조하여 glycerol 첨가로 인한 생육 증진 확인 및 dextran 전환의 기질로 사용되는 dextrin의 중합도(MD1, MD2) 및 첨가 수준별(1%, 5%) 생육곡선을 확인하였다. 각 배양배지의 조건에서 배양 7일차까지 G. oxydans의 생육을 비교한 결과, 배양 1일차에는 모든 시험구 간에 유의적인 차이를 확인할 수 없었다. Glycerol 무첨가구(⬤)의 경우 배양 5일차에 0.44±0.01, 배양 7일차에 0.35±0.00, glycerol 첨가구(◯)의 경우 배양 5일차에 0.80±0.00, 배양 7일차에 0.88±0.02의 흡광도를 보였으므로, glycerol의 첨가가 G. oxydans의 생육을 증가시키는 것을 확인하였다(Fig. 2). 또한 glycerol 첨가군 간에는 배양 2일차까지 시료 간의 유의적인 차이가 없었으나, 배양 3일차부터 유의적인 차이가 발생하였다. 배양 3일차에 G(+)AAB+5%MD2(□)가 다른 glycerol 첨가구에 비하여 낮은 생육도를 보였으며, 배양 4일차부터 maltodextrin 무첨가구인 G(+)AAB(◯)의 생육이 maltodextrin 첨가군(▼, △, ◼, □)에 비하여 유의적으로 낮은 생육이 확인되었다(p<0.05). 따라서 maltodextrin의 첨가가 G. oxydans의 생육에 영향을 미치는 것을 확인할 수 있었다. 이는 G. oxydnas를 60L scale로 배양하며, 탄소원 및 질소원을 조사한 연구(Naessens 등, 2004; Naessens 등, 2005b)에서 보고한 결과와 유사한 경향을 나타냄으로써 DDase 당전이 활성이 있는 초산균 배양 시 maltodextrin 첨가는 생육 증진에 유효한 효과를 보이는 것을 확인하였다.
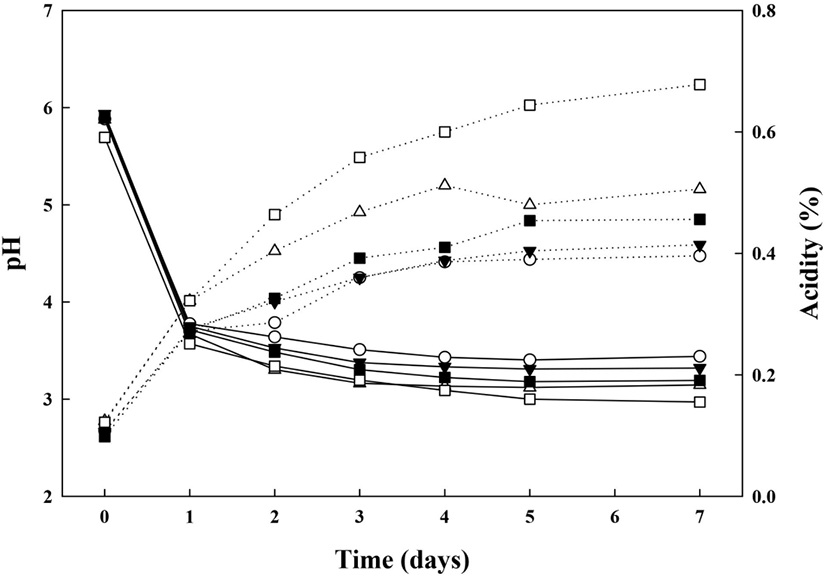
G. oxydans 배양을 통한 효율적 dextran 생물전환을 위한 배지탐색을 위해 G. oxydans의 배지조건 및 배양기간에 따른 pH, 산도의 변화를 조사하여 그림에 나타내었다(Fig. 3). 모든 시험구에서 초기 산도는 pH 5.7-5.9로 유의적인 차이가 없었으며, 배양 1일차에 pH가 급격히 감소하여 pH 3.5-3.7을 나타내었다. 이후에는 배양 7일까지 pH가 점차 감소하는 경향을 보였으며, 배양기간이 증가할수록 시료 간의 유의적인 차이를 보임을 확인하였다(p<0.05). 이는 초산균의 배양 시, 배양 대사산물로 acetic acid가 생성되어 배양 1일차에 pH가 급격히 낮아진 것으로 예상되며, 발효 초기 pH가 낮을 경우, 초산균의 유도기가 증가되어 발효가 제대로 일어나지 않기 때문에 pH의 감소가 적다고 보고되어진 Kim 등(1985)의 연구와 초기 pH가 6.0-6.5인 환경에서 초산균의 생육도가 우수하다고 보고한 Kim 등(2012)의 연구와 같이 배양 1일 이후에 pH가 약 3.5-3.7로 낮은 pH의 배양조건이 형성되었으므로 G. oxydans의 생육도가 낮은 것은 이와 연관이 있을 것으로 사료된다. 산도는 중합도가 다른 당(MD1, MD2)을 2가지 농도(1%, 5%)로 첨가하였을 경우, 모든 시험구에서 배양 0일차에는 0.10-0.12%로 유의적인 차이가 없었으나, 배양 1일차에 급격히 증가하였고, 이후 배양기간 동안 계속하여 증가하는 경향을 보였다. 배양 7일차에는 당 무첨가구인 G(+)AAB(⬤)는 0.40±0.01%로 나타났으며, 당 첨가구인 G(+)AAB+ 1%MD1(▼)은 0.41±0.01%, G(+)AAB+5%MD1(△)은 0.51± 0.01%, G(+)AAB+1%MD2(◼)는 0.46±0.01%, G(+)AAB+ 5%MD2(□) 0.68±0.01%로 나타나, MD1에 비하여 MD2를 첨가한 시험구에서 다소 높은 산도가 확인되었으며, 당 무첨가구(⬤)에 비해 1.05, 1.28, 1.15, 1.71배 높은 산도가 확인되었다. 그리고 배양기간이 증가하고, 당의 함량이 높아질수록 산도가 더 큰 폭으로 증가하는 경향을 확인하였다.
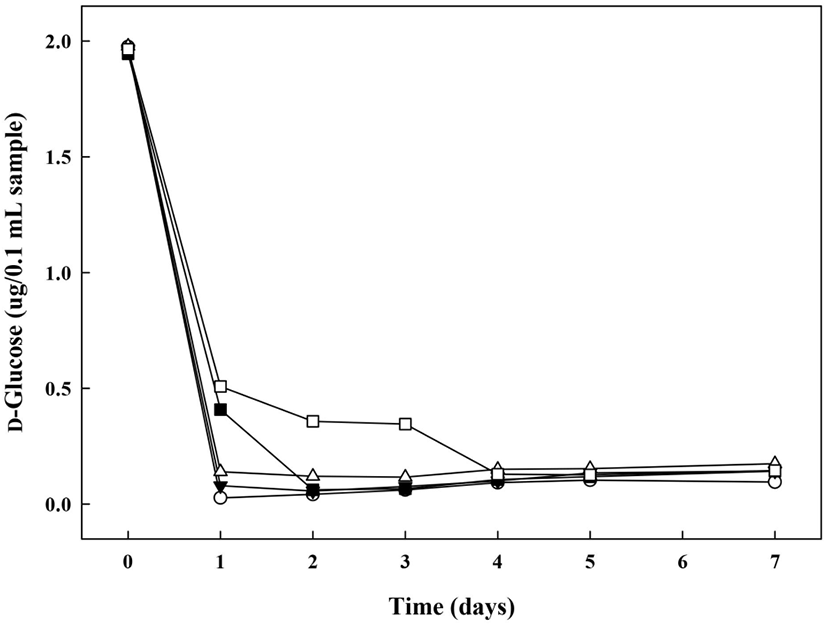
당전이 활성이 있는 초산균인 G. oxydans의 배양조건별 다당류 제조능을 확인하기 위하여 glycerol 첨가군의 배양기간에 따른 환원당의 당량 변화를 조사하였다(Fig. 4). 환원당은 반응성이 있는 알데히드기나 케톤기를 갖고 금속염 알칼리 용액을 환원시키는 성질을 갖는 당을 말하며(Lee 등, 2018), glycerol 첨가군의 배양 0일차 환원당의 함량은 1.94-1.98 μg/0.1 mL로 시험구 간의 유의적인 차이가 없었으나, 배양 1일차에는 G(+)AAB(⬤), G(+)AAB+1%MD1(▼), G(+)AAB+5%MD1(△), G(+)AAB+1%MD2(◼), G(+)AAB+ 5%MD2(□)의 순으로 0.03±0.00, 0.08±0.00, 0.14±0.00, 0.41±0.00, 0.51±0.00 μg/0.1 mL으로 환원당의 함량이 급격히 감소하였다. 이는 Kim 등(1993)에 의하면 미생물 생육 시 환원당을 기질로 사용함으로써 배지 내 환원당의 함량이 감소한다는 보고한 바와 같이, 배양 초기 다당류 생산을 위해 첨가한 maltodextrin을 G. oxydans가 생육을 위해 이용함으로써 배양 1일차에 환원당의 함량이 급속히 감소한 경향을 나타내는 것으로 보인다. G(+)AAB+5%MD2(□) 배지의 경우, 다른 시험구에 비하여 배양 3일차에 다소 낮은 생육을 나타내다가 배양 4일차에 다시 증가하는 것을 확인한 반면, 환원당 함량은 생육이 증가하는 배양 4일차에 감소하였으므로, G. oxydans가 maltodextrin을 기질로 사용하여 생육함으로써 환원당의 함량이 감소한 것으로 예상된다. 그리고 dextran dextrinase 작용을 통해 dextran 전환 시, 환원성 말단의 glucose 잔기를 가수분해하여 당전이 생성물을 형성하므로 중합도가 낮은 MD2의 환원당 함량이 높은 경향을 보이는 것으로 예상된다. 또한, dextran으로부터 isomaltooligosaccharide 제조를 위한 dextranase 고정화 연구(Bertrand 등, 2014)에서는 dextran의 가수분해로 인해 생성된 환원당 증가를 통해 시간에 따른 효소반응 생성물 증가를 설명하는 등 환원당 함량변화는 가수분해 및 당전이 효소 반응물의 생성 여부를 판단하는 척도가 될 수 있음을 알 수 있다.
배지 구성별 당전이 활성 균주의 배양 전 후 점도의 변화를 측정하기 위하여 배양 전 배지 및 7일 배양 후 배지의 점도를 조사하였다. G. oxydans 균주 접종 전 모든 배지의 점도는 전단속도가 증가할수록 전단응력이 비례하여 증가하는 경향을 보여 newtonian 성질의 유체임을 확인하였다(Fig. 5A). 그러나 7일간 배양 후 회수한 배양 상등액의 경우, shear rate 증가에 따른 전단응력(shear stress)이 감소하는 pseudoplastic한 성질의 유체 특성을 보였다. 이는 다당류 생성 증가로 인한 shear-thinning한 성질이 강화됨으로써 유동 특성이 변한 것으로 판단되었다.
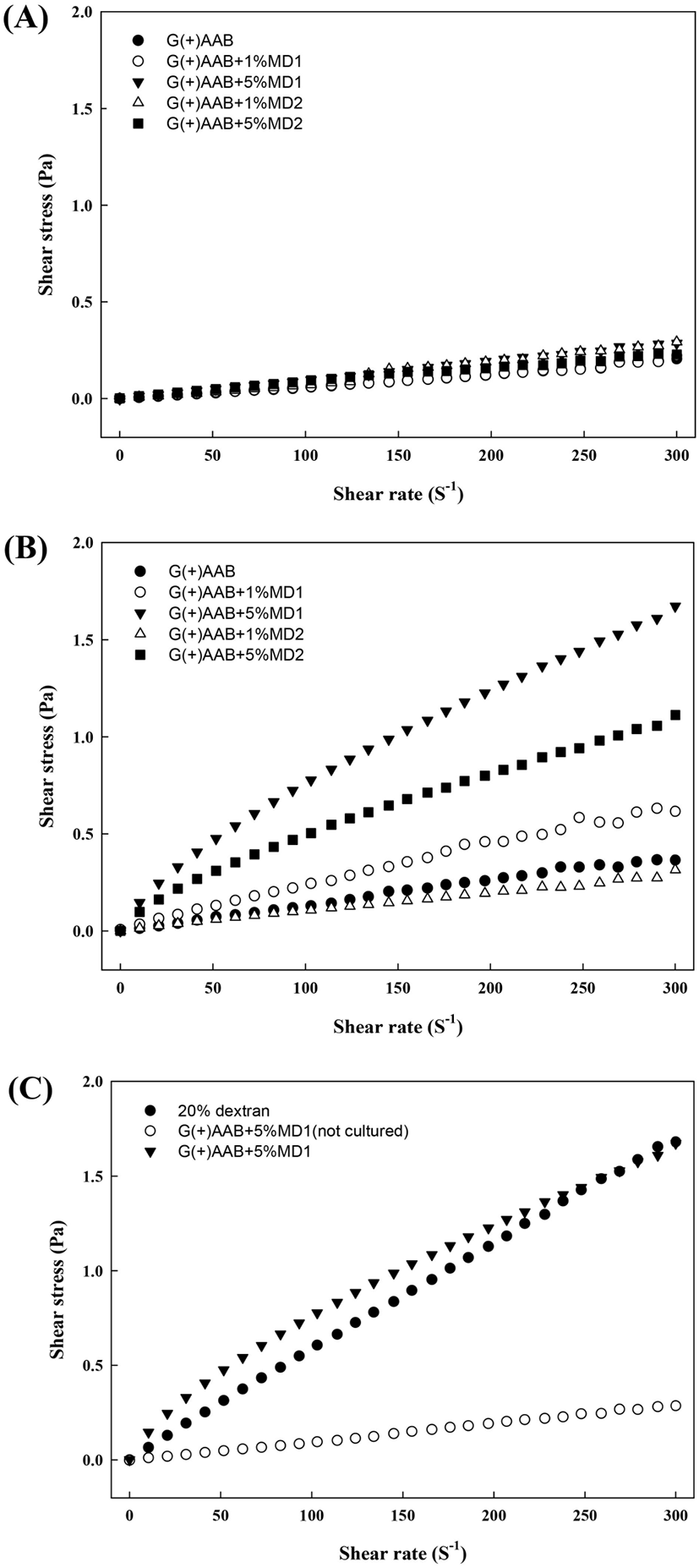
특히 초산균의 당전이 효소의 기질로 사용되는 dextrin의 중합도 및 첨가수준별 배양 상등액의 차이로는, dextrin 1% 첨가군(G(+)AAB+1%MD1, G(+)AAB+1%MD2) 대비 5% 첨가군 배지 배양액(G(+)AAB+5%MD1, ▼; G(+)AAB+5%MD2 ◼)에서 전단율이 증가할수록 증단응력의 증가율이 감소하는 특성이 강하게 나타나, dextrin의 첨가수준이 높은 처리구 내 고분자 다당류 생성량이 높을 것으로 추정하였다.
고분자 다당류인 dextran과의 전단응력을 비교하기 위하여 20% dextran 수용액의 점도 특성을 비교하였다(Fig. 5C). G. oxydans를 G(+)AAB+5%MD1에 접종·배양하여 회수한 배양상등액의 경우, 다당류 생성으로 인하여 20% dextran의 겉보기 점도(apparent viscosity)인 5.87±0.19 mPa·s 와 유사한 값인 5.53±0.05 mPa·s로 확인되었다(Table 3). 기질의 중합도 차이에 대하여는 maltodextrin의 중합도가 낮은 G(+)AAB+5%MD2 처리구 대비 G(+)AAB+5%MD1 배양 상등액의 전단응력의 변화가 더 두드러졌음을 확인하였다(Fig. 5B). 이러한 기울기의 변화는 전단속도의 증가에 따른 응집구조의 파괴로 인한 shear thining 현상으로 보고(Tako 등, 1977)되고 있으며, Lee 등(1996)은 고분자 수용액은 입자간의 2차 결합력 등 구조형성능력으로 인해 항복응력 값과 밀접한 관련이 있고, 고분자 용액의 농도가 증가할수록 분자간의 엉킴 밀도가 증가하여 엉킴의 정도에 의해 외부에서 가해지는 힘에 대한 반응이 다르게 나타나는 현상이라고 보고하였다. Vuillemin 등(2018)의 연구에서는 O. kitaharae DSM 17330 유래 dextransucrase 활성으로 생성된 dextran의 점도를 확인한 결과, 산업적으로 활용되는 L. mesenteroides NRRL 유래 dextran보다 더 높은 점도와 독특한 유변학적 특성을 보인다고 하였다. 이는 다양한 균주 유래의 효소는 서로 다른 효소 활성을 보여 다양한 생성물을 합성하기 때문이며(Pazur와 Ando, 1961), 따라서 분리된 균주별 생성물의 특성 차이를 파악하기 위한 기초 연구들이 더욱 활발히 수행되어야 할 것으로 사료된다.
| Sample1) | Apparent viscosity (mPa·s) |
|---|---|
| 20% dextran solution | 5.87±0.19 |
| G(+)AAB+1%MD1 | 1.80±0.22 |
| G(+)AAB+5%MD1 | 5.53±0.05 |
| G(+)AAB+1%MD2 | 1.03±0.05 |
| G(+)AAB+5%MD2 | 3.67±0.12 |
Abbreviations: See the Table 1 except dextran.
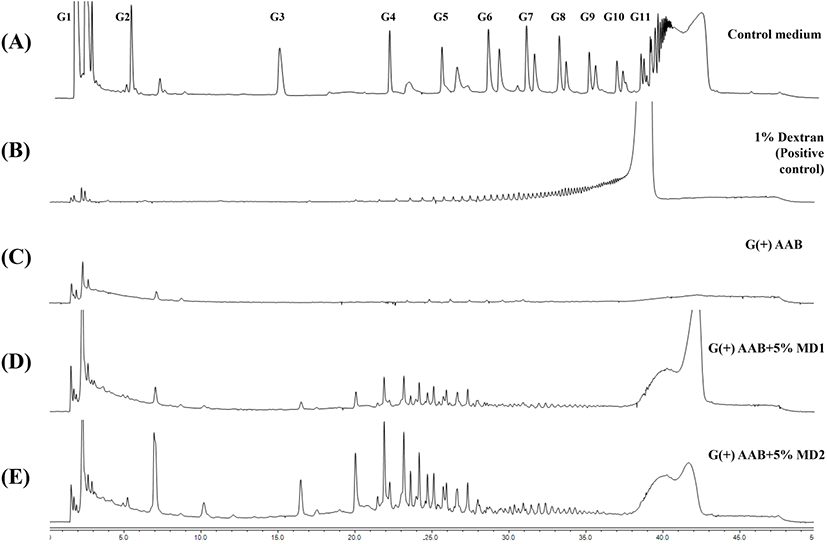
당전이 활성이 있는 초산균의 배양 조건에 따른 배지 내 구성당 변화 및 생성물의 구성당 패턴을 확인하기 위하여, 배양일별로 sampling하여 배양액 내 첨가한 기질의 감소 및 다당류 생성을 관찰하였다. dextrin 첨가 배지 내 구성은 포도당(G1), 말토오스(G2) 및 말토트리오스(G3) 등 말토올리고당류로 구성되어 중합도 11 이상의 당류를 포함하고(Fig. 6A), dextran 1% 수용액은 분석시간 20분 이후에 나타난 peak를 통해 고중합도의 다당류로 구성됨을 비교하였다(Fig. 6B). 배양회수액에서 dextrin 1% 첨가군(G(+)AAB+1%MD1, G(+)AAB+ 1%MD2)은 배양 1일차, 5% 첨가군(G(+)AAB+5%MD1, G(+)AAB+5%MD2)은 배양 2일차에 대부분의 dextrin peak 가 사라졌으며(data not shown), 이를 통해 G. oxydans 균주가 생육 및 dextran 생물전환을 위해 dextrin을 활발히 소비하는 것을 알 수 있었다. 7일간 G. oxydans ATCC 배양회수액 내 다당류 전환을 확인하기 위해 에탄올 침전 회수된 시료의 구성당 변화 결과, dextrin 무첨가 배지(G(+)AAB)와는 달리 5% dextrin 첨가 배지(G(+)AAB+5%MD1, G(+)AAB+5%MD2)에서 회수된 물질의 구성당 패턴은 20분 이후 dextran의 구성당 패턴과 유사한 것으로 나타났으며, 주로 20-30분 사이에 peak를 형성하는 pattern을 보였다. 또한 중합도가 높은 dextrin 배지, G(+)AAB+5%MD1 대비 중합도가 낮은 dextrin 배지(G(+)AAB+5%MD1)에서 peak를 나타내는 물질의 함량이 높게 나타났다(Fig. 6D, E). Yamamoto(1992)는 Acetobacter capsulatus ATCC11894 유래 DDase가 다양한 기질에 의한 dextran 형성능을 조사한 결과, Glucose G2를 제외한 모든 기질로부터 dextran을 합성할 수 있었고, 평균중합도(DP) 17.3에 해당하는 short chain amylose 이용 시 dextran 수율이 57.6%로 가장 높은 것으로 보고하였다. 반면 soluble starch는 21.4%로 보고되어 사전연구와 유사한 경향을 나타내었다. Nacssens와 Vandamme(2001)에 따르면, intracellular DDase는 maltose(G2)와 반응하여 폴리머의 형성 없이 glucose와 panose만 생성하였고, Sadahiro 등(2015)의 연구에서 또한, 기질로 첨가한 maltotetraose(G4)로부터 G3, G5 외에 panose가 분석된 것으로 보고하였는데, 본 연구의 배양상등액 회수물의 분석 결과 panose peak가 일부 관찰된 것과 일치하며(Fig. 6E), 이는 당전이 효소작용에 의해 α-1,6 glycosidic linkage를 포함한 물질의 형성을 의미한다. 추후 배양상등액에서 회수된 물질의 다당류 결합 패턴을 확인하기 위해 1H-NMR 분석을 실시하였다.
G. oxydans ATCC 19357에서 회수한 다당류의 구조 분석을 위하여 1H-NMR을 실시하였다. Dextran의 구조 분석은 여러 가지 방법으로 연구할 수 있으나, 그중 NMR spectroscopy는 1D 및 2D NMR spectra(TOCSY, NOESY, ROESY, HSQC 및 HMBC)의 적용을 통해 dextran의 자세한 구조정보를 얻기 위한 가장 중요한 기술이다(Purama 등, 2009; Wang 등, 2007). 앞서 HPAEC-PAD 분석을 통해 확인한 dextrin 첨가 7일 배양회수액에 함유된 다당류의 분자간 결합을 확인하기 위해 1H-NMR 분석결과를 나타내었다(Fig. 7). G. oxydans의 기질로 사용되는 dextrin의 분자 간 결합 분석 결과, chemical shift 값은 5.3 ppm peak를 보여 α-1,4 glycosidic linkage 물질이 가지는 특징을 확인하였고, positive control로 사용한 dextran에서 확인된 4.92 ppm의 anomeric proton signal은 전형적인 α-1,6 glycosidic linkage를 포함하는 물질임을 확인하였다(Tizzotti 등, 2011). G(+)AAB+ 5%MD2 배양 상등액에서 회수한 다당류의 chemical shift peak 형태는 4.92 ppm 위치에서 major peak, 5.3 ppm 위치에서 minor peak가 관찰되어, G. oxydans 유래 DDase의 당전이 반응을 통해 maltodextrin을 기질로 이용하여 α-1,6 glycosidic linkage 포함한 물질인 dextran으로 전환된 것으로 판단되었다(Fig. 7C).
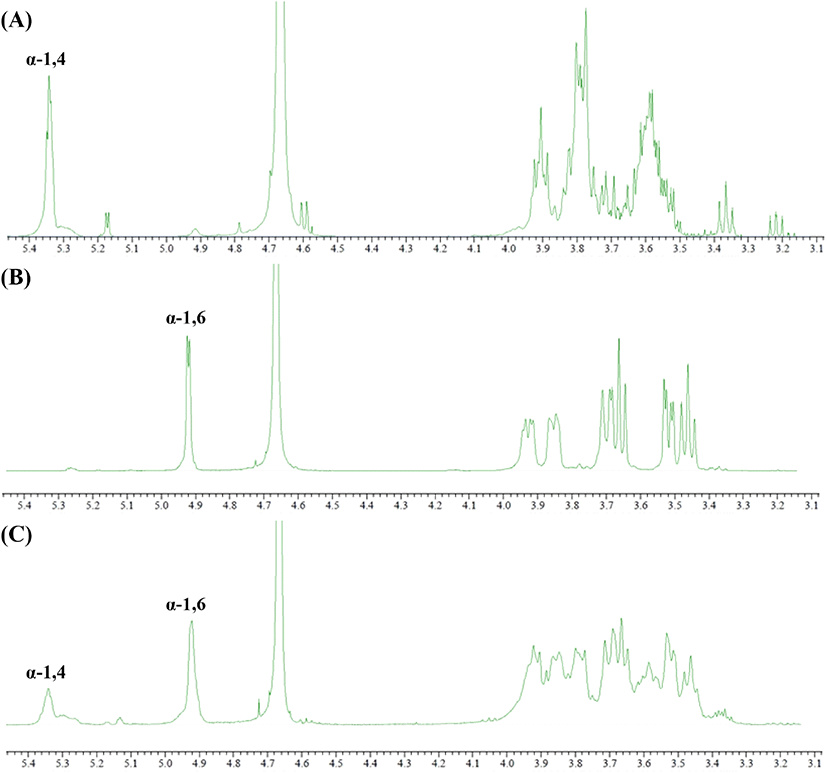
Hehre(1951)에 의하면 DDase는 dextrin의 비환원성 말단의 α-1,4 glucosyl 잔기 또한 dextran 전환하는 작용이 가능하다고 제안된 것과 같이, dextrin의 α-1,4 glucosyl 잔기로 인해 chemical shift 4.92 위치에 peak를 확인할 수 있었으며, 첨가된 maltodextrin이 전량 dextran으로 생물전환에 이용되지 못하고 남아 있는 잔여 기질에 의한 영향으로도 판단된다. 따라서 당전이 활성 초산균의 배양기간 연장 및 비연속식 기질 주입과 생성물의 분지결합도 측정 등 추가적 연구를 통해 배양액 내 dextran 생성 최적화 및 회수가 필요할 것으로 보인다.
