서 론
국내 고령화 현황은 2026년에 65세 이상의 노인 비율이 전체 인구의 약 20.8%로 초고령화 사회에 도달할 것으로 예측되고 있으며, 선진국 대비 2배 이상 빠르게 진행되고 있는 것으로 보고되고 있다(Koh, 2018). 고령화 사회의 도래에 따라 의료비 측면에서도 국민과 국가가 부담해야 하는 비용적 측면이 증가하게 되며, 특히 노화가 진행됨에 따라 인체를 구성하고 있는 조직 및 기관의 생리적 기능의 퇴화로 심장 및 동맥계 질환, 관절질환, 당뇨병과 같은 만성 퇴행성 질환의 위험성에 노출되고, 씹는 기능에 이상이 생기는 저작 장애, 음식을 삼키는 과정에 이상이 생기는 연하장애, 섭취한 음식에 대한 소화흡수율 저하 등의 문제가 발생하게 된다. 이는 섭취할 수 있는 음식에 제한이 생기고, 음식의 양과 질이 떨어지게 되어 심각한 상태의 질병을 초래할 수 있다(Lim 등, 2019).
발효유는 풍부한 영양 공급원으로 섭취 및 소화 용이성을 갖고 있어 장기 음용 시 인체 건강에 긍정적인 영향을 미치는 건강증진 식품으로 만성 퇴행성 질환의 예방에 효과가 있는 것으로 알려져 있다(Lee 등, 1999). 발효유는 유산균이나 효모를 이용하여 원유 또는 유가공품을 발효한 제품으로 기존에는 주로 칼슘 보충을 목적으로 섭취해 왔으나, 최근 프로바이오틱스의 효능과 기능성에 대한 관심이 증가함에 따라 기능성을 강조한 발효유 제품 시장이 확대되고 있다(Kim 등, 2019). 특히 발효유는 프로바이오틱스를 체내에 쉽게 매개할 수 있는 식품 급원으로 접근성이 우수하여 전 세계적으로 섭취율이 매년 지속 증가하고 있는 추세이며, 세계 인구의 30% 이상은 규칙적으로 섭취하고 있는 것으로 보고되고 있다(Kim과 Chung, 2017).
인체 장관은 장내 세균의 저장소로 장내 방어벽 기능, 항체 작용을 하는 면역글로불린의 분비, 대식세포계 등의 방어체계들을 포함하고 있어 외부물질을 차단, 통과 및 흡수하는 중요한 기능적 역할을 수행하고 있다(Han 등, 2008). 일반적으로 장점막 기능의 변화는 장내에 존재하는 유용균과 유해균에 의해 좌우되며, 이들의 분포는 개인별 유전적인 요인, 식습관 및 건강상태에 따라 다르며, 특히 질병 상태에 따라 장내 미생물 군집(microbiota)의 불균형(dysbiosis)이 발생하기도 한다. 불균형한 미생물 군집 구조는 프로바이오틱스 섭취 시 복원 및 안정화에 효과가 있는 것으로 밝혀지면서, 프로바이오틱스가 함유된 기능성 제품이 주는 유익한 효능에 대한 소비자의 관심이 높아지고 있다(Choi, 2019).
프로바이오틱스는 젖산을 생성하는 유산균(lactic acid bacteria, LAB)으로 장 건강에 좋은 영향을 주는 살아있는 미생물을 뜻한다. 프로바이오틱스를 충분히 섭취할 경우, 장내 유해균의 성장을 억제하여 원활한 배변 활동에 도움을 주며(Lim 등, 2015), 아토피 피부염과 같은 과민성 면역반응 개선 효과(Won 등, 2011), 항비만 효과(Cano 등, 2012), 식품 알러지에 대한 감수성 증진(Frossard 등, 2007), 유당불내증 경감(Yoon, 2009), 대장염 개선(Verma 등, 2018), 항암(Sivan 등, 2015) 등 신체 전반에 도움을 주는 다양한 기능성이 알려져 있다. 또한, 효과적인 프로바이오틱스로 사용하기 위한 유산균의 조건은 식품 유해 미생물에 대한 항균력과 산성 및 담즙산에 대한 내성이 있고, 위장관에 서식 가능해야 하며, 장 부착능과 내열성이 있어야 한다(Kim 등, 2009). 식품의약품안전처에 등록되어 있는 고시형 프로바이오틱스는 Lactobacillus, Lactococcus, Enterococcus, Streptococcus 및 Bifidobacterium 속 미생물로 이를 이용한 정장제, 건강기능식품, 인체 의약품, 동물 사료용, 화장품 원료 및 제과, 제빵류를 비롯한 아이스크림, 분유, 시유, 발효유 등 다양한 분야에 적용되어 사용되고 있다. 국내에서 사용되고 있는 발효 종균은 대부분은 미생물 개량 기술이 크게 앞서 있는 해외로부터 70% 이상 수입된 것으로, 한국인의 체질에 맞지 않아 효과가 미비하거나, 설사를 유발하는 등의 부작용이 발생할 수 있어 한국인에 적합한 프로바이오틱스 소재 개발이 무엇보다도 요구되는 실정이다(Ann, 2011).
따라서, 본 연구에서는 해외 수입 종균을 대체할 수 있는 국내 발효유 제조용 스타터 소재 개발을 목표로 전통발효 식품으로부터 발효유 제조에 활용 가능한 유산균을 분리 및 선발하고, 생리적 특성과 장 부착능 등 프로바이틱스 활성을 조사하여 프로바이오틱스 소재로서의 가능성을 검토하였다. 이뿐만 아니라, 최종적으로 선별한 유산균의 발효유 제조를 통해 발효유 제조 스타터로서의 활용 가능성을 조사하였다.
재료 및 방법
발효유 스타터로 활용하기 위한 유산균 후보 소재 확보를 위해 전라북도 순창군의 김치 및 젓갈을 수집하여 사용하였으며, 각각의 수집한 시료 1 g을 취하여 멸균된 0.85% NaCl 용액 9 mL에 단계 희석한 후 100 μL를 Lactobacilli MRS agar(Difco™, Miami, FL, USA) 배지에 도말하고, 37°C에서 24시간 배양하였다. 미생물의 형태학적 차이를 이용하여 1차 균주를 선발하였으며, 각각의 분리주는 12% skim milk에 접종하고, 40°C에서 24시간 동안 배양한 후 pH 4.5 이하 및 응고 현상 보인 균주를 2차로 선발하였다. 선발 균주는 다음 연구에 사용하기 위하여 −80°C에서 보관 후 사용하였다.
식품 유해 병원성 미생물에 대한 항균 활성은 Salmonella typhimurium UK1 KCTC1926, Escherichia coli ATCC10798, Bacillus cereus KCTC1661, Shigella sonnei KCTC2518, Staphylococcus aureus KCCM11593, Listeria ivannoill KCTC3444 등 총 6종의 균주를 배양한 후 배양액의 흡광도를 측정하여 일정한 농도(OD 660 nm, 0.4)로 0.8% soft agar plate를 제조하고, well diffusion 법(Lee 등, 2009)으로 측정하였다. 항균 활성 측정을 위한 분리주는 MRS(Difco™) 액체배지에 접종하여 37°C에서 24시간 동안 진탕 배양한 후 13,000 rpm으로 10분간 원심분리한 후 상등액을 취하여 0.45 μm membrane filter(Sartorius, Frankfurt, Germany)로 제균한 분리주의 배양 상등액 100 μL를 각각의 항균 활성 측정 배지에 분주한 뒤 30°C에서 24시간 동안 배양하여 형성된 억제환의 크기에 따라 항균 활성의 유무를 측정하였다.
최종 선발한 균주의 효소 활성을 조사하기 위해 API ZYM kit(bioMerieux Co., Marcy-I’Etoile, France)를 사용하여 alkalinephosphatase 외 18가지 효소에 대한 활성을 측정하였다. 최종 선발 균주를 MRS 고체 배지에서 배양하여 균체를 회수하고, 멸균수에 3회 세척한 후 멸균수에 현탁하여 시료를 준비하였다. 현탁액 500 μL를 5 mL suspension medium에 풀어준 후 5-6 Mcfarland(bioMerieux Co.)로 탁도를 조정하였다. 탁도를 조정한 현탁액을 ZYM kit의 각 큐플에 접종하고, 37°C에서 4시간 배양한 후 표현 활성 증가와 용해를 도와주는 ZYM A, B 시약을 각각의 큐플에 한 방울씩 떨어뜨려 5분간 반응 후 색깔의 변화를 관찰하여 효소 활성 정도를 조사하였다. 색의 변화 정도에 따라 0-5까지의 값으로 표시하였으며, 0은 음성반응, 5(≥40 nmoles)는 최대 강도의 반응이고, 4-1은 각각 30, 20, 10, 5 nmoles의 중간값을 나타내며, 3 이상일 경우 양성으로 판정하였다.
최종 선별 균주 JSRL18-60의 16S rRNA 염기서열 분석을 위하여 universal 프라이머인 27F(5'-AGAGTTTGATCCTG GCTCAG-3')와 1492R(5'-GGTTACCTTGTTACGACTT-3')을 사용하여 유전자를 증폭 후 증폭된 PCR 산물은 QIAquick PCR purification kit(QIAGEN, Valencia, CA, USA)를 사용하여 정제하고 ㈜마크로젠에 의뢰하여 염기서열을 해독하였다(De Lillo 등, 2006). 염기서열의 chromatogram을 이용하여 gap을 최소화한 뒤 National Center for Biotechnology Information(NCBI)에서 서열의 일치도가 높은 표준 균주의 16S rRNA 유전자 염기서열을 확보하고, 이를 이용한 계통도를 작성하였다. 작성된 계통도의 분석은 MEGA 7.0.26 program을 사용하여 분석하였으며, Tamura-Nei 모델에 기초한 Maximum Likelihood 방법(Tamura과 Nei, 1993)으로 분석을 실시하고, 산출한 각각의 계통수에서 각 분지에 대한 통계학적 신뢰도를 확보하기 위하여 bootstrap 분석을 1,000회 반복 실행하여 계통도의 견고성을 확인하였다.
선발 균주의 내담즙성은 Oxgall(Difco™) 0, 0.1, 0.3, 0.5, 1.0%(w/v)를 첨가하여 제조한 MRS 액체배지에 접종하고, 37°C에서 3시간 배양한 후 각각의 시료를 회수하여 생균수를 측정하였다. 생존율은 초기 균수에 비하여 내담즙성을 평가하였다. 내산성의 측정은 pH 2.0, 3.0, 4.0, 5.0(in 0.1N HCl(Sigma-Aldrich, St. Louis, MA, USA))로 조정한 MRS 액체배지에 접종하고, 37°C에서 3시간 배양한 후 내담즙성과 동일한 방법으로 균의 생존율을 조사하였고, 열에 대한 안정성은 MRS 액체배지에 접종한 후 30°C, 40°C, 50°C, 60°C, 80°C의 조건에서 10분간 처리한 이후에 생존한 미생물 수를 계수하여 측정하였다.
선별 균주의 장 상피세포 부착능은 한국세포주은행으로부터 Caco2 세포를 분양받아 Eom 등(2015)의 방법에 따라 측정하였다. Caco2 세포를 24-well tissue culture plate(SPL Life Sciences Co., Ltd., Pocheon, Korea)에 2×105 cell/well이 되도록 37°C 혐기 배양장치에서 24시간 배양하였다. 각각의 선별 균주를 multiplicity of infection(MOI) 10의 농도로 처리하여 45분간 감염시킨 후 PBS buffer(Sigma-Aldrich)로 3회 세척하였으며, 200 μL의 0.1% triton X-100(Sigma-Aldrich)를 처리하여 Caco2 세포에 부착된 균을 회수하고, MRS(Difco™) 고체 배지에 도말 후 생균수를 계수하고 아래 식에 대입하여 산출하였다.
배양 시간에 따른 유산균의 성장 정도를 조사하기 위해 MRS broth(Difco™)에 5% 균주를 접종하여 37°C shaking incubator(Vision Scientific Co., Ltd.)에서 60시간 동안 150 rpm으로 진탕 배양한 후 건조 균체량(DCW, dried cell weight) 및 흡광도(OD600)를 측정하였다. 3시간 간격으로 배양액을 회수하여 실험에 사용하였으며, 생균수 측정은 배양액 1 mL를 0.85% NaCl 용액 9 mL에 단계별로 희석한 후 희석액 100 μL를 MRS 고체 배지에 도말하여 측정하였고, 건조 균체량은 배양액 10 mL를 18,000 ×g에서 30분간 원심분리한 후 멸균 증류수로 3회 세척하여 80°C에서 항량에 달할 때까지 건조한 후 그 무게를 측정하였다. 흡광도는 회수한 배양액 1 mL를 18,000 ×g에서 30분간 원심분리한 후 멸균 증류수로 3회 세척하고, 1 mL에 재부유하여 UV/VIS spectrophotometer(SPECORD200, Analytik Jena, Jena, Germany)를 이용하여 600 nm에서 흡광도를 측정하였다.
선발된 균주는 MRS broth(Difco™)배지에 접종하여 37°C shaking incubator(Vision Scientific Co., Ltd.)에서 24시간 동안 150 rpm으로 진탕 배양한 후 18,000 ×g에서 30분간 원심분리하여 상층액 제거 후 멸균 증류수로 3회 세척하여 균체를 회수하였고, 멸균 증류수 1 mL에 재부유하여 12% 환원 탈지유(탈지분유, Seoul Dairy Co., Seoul, Korea)에 접종한 후 40°C에서 3시간 간격으로 60시간까지 배양하면서 pH, 산도, 생균수를 측정하였다. pH는 10 mL의 시료를 취하여 pH meter(S220-Bio, Mettler Toledo, Schwerzenbach, Switzerland)로, 적정산도는 동일량의 시료에 0.1 N NaOH(factor=1.001)를 pH가 8.3이 될 때까지 적정한 NaOH 용액의 소비량을 젖산으로 환산하였고, 3회 반복 측정하여 평균값으로 나타내었다. 생균수 측정은 발효 중 3시간 간격으로 각 시료 1 mL를 무균적으로 취한 후 멸균된 0.85% NaCl용액 9 mL에 단계 희석한 후 희석액 100 μL를 MRS agar(Difco™) 배지에 도말하고, 37°C에서 60시간 배양하여 형성된 colony를 계측하여 mL당 colony forming unit(CFU)로 나타내었다.
최종선별 균주를 이용하여 제조한 발효유의 특성 평가는 유리당, 유기산, 유리아미노산을 측정하여 분석하였다. 먼저 유리당 및 유기산 분석은 발효가 종료된 시료를 13,000 rpm에서 10분간 원심분리하고, 0.45 μm syringe filter(Sartorius)로 여과한 후 HPLC(Agilent 1200 series, Agilent Technologies, Santa Clara, CA, USA)를 이용하여 측정하였다. 분석을 위한 column은 Aminex HPX-87H(300×7.8 mm, Bio-RAD, Hercules, CA, USA)를 사용하여 측정하였으며, 이동상은 5 mM sulfuric acid(Sigma-Aldrich), 유속은 0.6 mL/min, 검출기는 DAD detector 210 nm(Agilent Technologies)와 RID detector(Agilent Technologies)를 이용하여 동시 분석하였다. 또한, 유리아미노산 분석은 아미노산 분석기(L-8900, Hitachi High-Technologies, Tokyo, Japan)를 이용하여 측정하였으며, 회수한 각 시료를 3,000 rpm에서 10분간 원심분리하고, 4°C에서 1시간 반응시킨 후 13,000 rpm에서 10분간 원심분리를 실시하였다. 상등액 500 μL에 500 μL의 0.02 N HCl(Sigma-Aldrich)을 첨가하고 0.45 μm syringe filter (Sartorius)로 여과한 후 분석에 사용하였으며, 기기 분석 조건은 Jeong 등(2014)의 방법에 따라 분석하였고, 대조구로는 환원 탈지유를 사용하여 측정하였으며, 최종 균주와 상업용 균주와의 비교를 위해 LGG를 비교 균주로 이용하였다.
요구르트 제조를 위해 선발 균주는 MRS broth(Difco™)배지에 접종하여 37°C shaking incubator(Vision Scientific Co., Ltd.)에서 30시간 동안 150 rpm으로 진탕 배양한 후 18,000 ×g에서 30분간 원심분리하여 상층액 제거 후 멸균 증류수로 3회 세척하여 균체를 회수하였고, 멸균 증류수 1 mL에 재부유하여 12% 멸균 환원 탈지유(Seoul Dairy Co.)에 접종하여 40°C에서 48시간 배양하여 요구르트를 제조하였다. 제조된 요구르트의 저장성을 확인하기 위해 4°C에 10일간 저장하면서 저장 기간의 pH, 산도, 생균수의 변화를 측정하였다.
결과 및 고찰
일반적으로 장내 유산균은 lactic acid나 acetic acid 등 유기산을 생성하여 산에 민감한 장내 병원성 세균인 Staphylococcus, Salmonella 등에 대한 오염 및 번식을 억제하여 설사와 같은 장 질환을 예방하며, 숙주의 면역 시스템을 자극하여 감염에 대한 저항성을 향상시킨다고 알려지고 있다(Herich와 Levkut, 2002). 따라서, 발효유 제조를 위한 유산균 분리를 위해 전라북도 순창군에서 김치 및 젓갈 32종을 수집하여 단계 희석한 후 유산균 선택배지에 배양하고 미생물의 형태적인 차이를 이용하여 1차로 88종의 균주를 분리하였다. 1차 분리주 중 커드 형성 능력 및 발효 후 pH 4.5 이하인 13종의 균주를 선별하였으며, 그람 양성균인 Bacillus cereus, Staphylococcus aureus, Listeria ivanovii 와 그람 음성균인 Salmonella typhimurium, Escherichia coli, Shigella sonnei 등 6종의 식품 유해 병원성 미생물에 대한 항균 활성을 측정하였다. 그 결과, JSRL17-4, 17-62, 18-7, 18-35, 18-60 등 5종의 분리주가 그람양성과 그람음성에 상관없이 식품 유해 병원성 미생물 6종에 대한 항균 활성을 모두 갖는 것으로 확인되었으며, 특히 JSRL18-60이 가장 우수한 항균력을 보유한 것을 확인하였다(Table 1). 유산균은 유기산, 과산화 물질, 박테리오신 등의 2차 대사산물을 생성하며 유해한 균 특히 병원성 유해 미생물을 저해한다고 보고하고 있으며(Kaur 등, 2002), 전통발효식품 유래 유산균에 의해 E. coli, Salmonella subsp.의 성장을 억제한다는 보고(Park 등, 2013)와도 유사한 결과를 나타냄을 확인하여, 향후 발효유 스타터 이외에도 생균제 또는 프로바이오틱스 소재 등 다양한 분야에 활용이 가능할 것으로 판단된다.
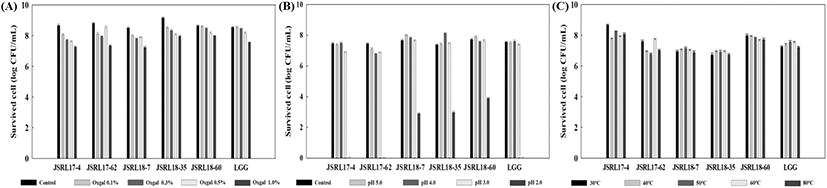
유산균이 프로바이오틱스 효과를 나타내기 위해서는 섭취 시 체내의 낮의 pH 조건인 위산과 고농도의 담즙이 존재하는 환경에도 생장할 수 있는 능력을 지녀야 한다. 따라서 담즙에 대한 저항성을 측정한 결과, 선별 균주 5종 모두 장내 담즙 농도(0.3%)보다 높은 0.5% 이상의 oxgall 조건에서도 약 80% 이상의 높은 생존율을 갖는 것을 확인하였다(Fig. 1A). 특히, 상업 균주 L. rhamnosus GG(LGG)와 비교하여도 선별 균주 5종 모두 큰 차이가 없이 유사한 결과값을 나타냄을 확인하였다(Fig. 1A). Lactobacillus를 포함한 많은 종의 유산균에서 담즙산염 가수분해효소를 생성하여 담즙산을 가수분해하고 억제작용을 감소시키며(Seo와 Lee, 2007), 특히 김치에서 분리한 Lactobacillus 속이 담즙산에 뛰어난 안전성을 갖고 있다는 결과(Choi 등, 2014)와도 일치함을 확인할 수 있었다. 산성 조건에 대한 생존력을 확인한 결과에서는 pH 3.0, 4.0, 5.0에서는 모든 균주가 대조구인 초기 투입 균수와 유사한 생존율로 존재하는 것을 확인하였으며, 특히 위산의 pH와 유사한 pH 2.0에서 LGG는 생존하지 못하는 결과를 보였으나, JSRL18-7은 37.84%, JSRL18-35는 40.42%, JSRL18-60은 50.43%로 산에 대한 저항성이 매우 우수함을 확인하였다(Fig. 1B). 일반적으로 유산균 자체의 내산성은 약하다고 알려져 있으나, L. paracasei 일부는 내산성을 지니고 있음이 보고되었으며(Shin 등, 2017), 선별균주 5종 모두 내산성과 내담즙성이 우수함을 확인하여 이는 내산성이 우수한 유산균의 경우에는 담즙에서도 우수한 활성을 지니고 있다는 보고와도 일치하는 결과를 확인하였다(Shin 등, 1999). 일반적으로 유산균의 경우 열에 대한 보존성 또한 매우 중요한 요소 중 하나로 제형화 및 제제화 공정에서 spray dring 또는 캡슐화 시 50-80°C의 고온 환경에 노출되면서 생균수가 급격히 감소하는 문제가 발생하게 된다. 따라서 선별 균주를 대상으로 열에 대한 안정성과 보존성을 측정하는 내열성 시험에서도 5종의 선별 균주 모두 80°C의 조건에서도 90% 이상의 높은 생존율로 LGG와 비교하여도 차이가 없음을 확인하였다(Fig. 1C). 이를 통해 김치나 젓갈 유래 유산균이 고염, 산성 등의 성장 조건하에서 생장하여 열악한 환경에서도 생존할 가능성이 높기 때문에 앞서 선별한 5종의 유산균 또한 내담, 내산, 내열성이 모두 우수한 것으로 사료된다.
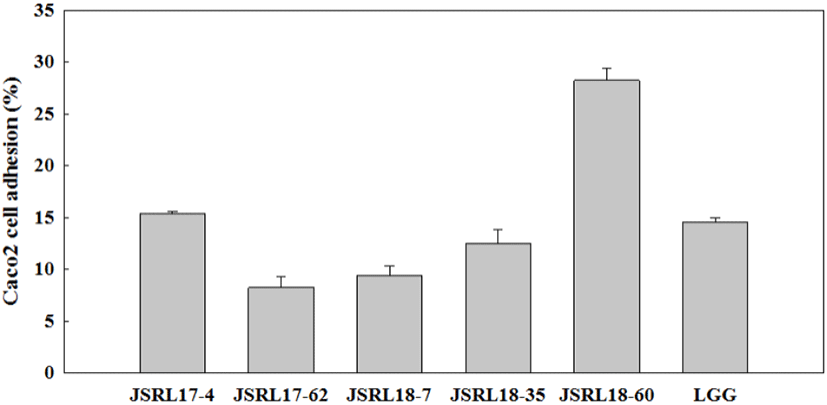
장내 세포 부착능은 위산과 담즙을 통과하여 최종 목적 부위인 장에 부착하여 효능을 발휘하기 위해 갖추어야 할 프로바이오틱스의 중요한 요소 중 하나이다. 따라서 선별 균주의 장내 세포 부착능을 분석하기 위하여 인체 소장 상피세포와 같은 형태로 증식되는 Caco2 세포를 사용하였고, 대조구는 일반적으로 상업 균주로 사용되는 LGG를 이용하였다. 초기 접종 균수 대비 5종의 선별 균주 중 JSRL17-4, JSRL18-7, JSRL18-60은 대조구인 LGG(15.3%)와 비교하여 유사하거나 높은 부착율을 나타내었으며, 특히 JSRL18-60은 29.7%로 가장 높은 장 상피세포에 대한 부착율을 나타내었다(Fig. 2). 상업 균주인 LGG의 Caco2 세포 부착능이 18.12%로 보고되고 있어(Kim 등, 2014) 해당 결과와 비교하여도 대조구인 LGG의 부착율과 유사한 결과임을 확인하였으며, L. curvatus ML17의 9.71%(Kim 등, 2014), L. sakei AJ29 22.5%, P. halophilus AJ22 18.6%, P. pentosaceus AJ35 15.1%(Choi 등, 2014)의 결과와 비교하여도 JSRL18-60이 더 우수한 세포 부착율을 갖고 있어 프로바이오틱스로서 섭취시 장내 환경 개선에 크게 도움을 줄 수 있을 것으로 사료된다. 따라서, 최종적으로 앞서 선별한 5종의 유산균 중 내담, 내산 및 내열성에 대한 안정성이 우수하고, Caco2 세포에 대한 부착능도 가장 우수하여 프로바이오틱스 소재로의 활용 범위가 넓은 JSRL18-60 균주를 발효유 제조에 활용할 수 있는 최종 균주로 선정하였다.
프로바이오틱스의 선발 주요 지표 중 효소 생산 여부는 매우 주요한 지표 중 하나이다. 따라서 본 실험에서 분리한 JSRL18-60이 어떠한 효소에 대한 활성을 갖는지를 확인하기 위해 API ZYM kit를 이용하여 측정하였다. 그 결과(Table 2) 지질에 대한 가수 분해 효소인 esterase 및 esterase lipase에 대한 활성을 갖고 있었으며, leucine arylamidase, valine arylamidase, α-glucosidase에 대해서도 높은 활성을 나타내었다. 특히 유당을 glucose와 galactose로 분해시키는 유당 분해효소인 β-galactosidase 활성이 확인됨에 따라 유제품의 낮은 소화율과 유당 불내증에 대한 단점도 보완할 수 있는 균주로 확인되었다. 또한, 인체 내 benzopyrene 같은 독성 물질의 유입 시 발암성 물질로 전환시키는 효소로 보고(Cole 등, 1989)된 β-glucuronidase에 대해서는 활성을 보이지 않아 유용 효소 생성과 유해물질 생성과 연관된 안전성 측면에서도 우수함을 확인하였다.
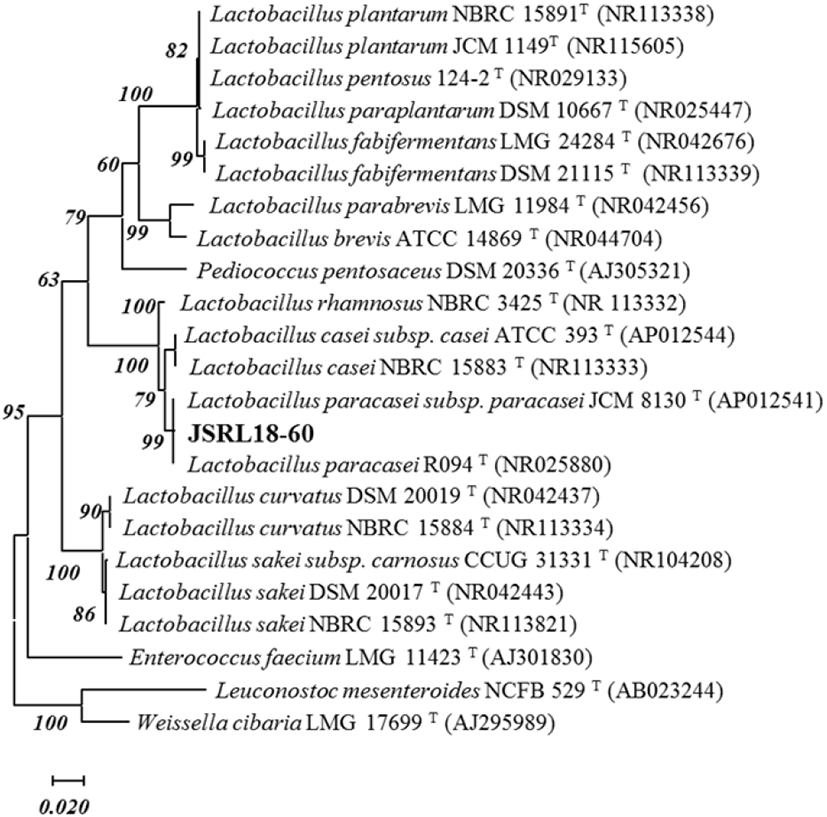
최종 선별한 JSRL18-60 균주의 16S rRNA 유전자 염기서열 분석 결과를 이용하여 NCBI nucleotide BLAST search를 수행하였으며, GenBank에 등록된 표준 균주와 염기서열의 상동성을 비교 분석하였다. 염기서열의 alignment 분석에 사용한 parameter 및 option의 값은 protein weight matrix로 Gonnet series를 사용하였으며, gap opening 15, gap extension 6.66, delay transition weight은 0.5로 설정하였고, gap penalty 5, K-tuple size 2, top diagonals 4, window size 4로 설정하여 진행하였다. 그 결과, 최종 선별한 JSRL18-60는 Lactobacillus parcasei JCM8130(AP012541), R094(NR025880)와 99.0%의 유사성을 나타내었다. 16S rRNA 유전자 염기서열을 토대로 Maximum Likelihood method를 사용하여 phylogenetic tree를 작성하였고(Fig. 3), 계통수의 신뢰도 확보를 위해 bootstrap 분석을 1,000회 실시하여 신뢰성을 향상시켰다. 최종적으로 프로바이오틱스 소재로의 활용 가능성이 우수한 JSRL18-60 균주는 Lactobacillus paracasei JSRL18-60로 명명하였고, 한국미생물보존센터(KCCM, Korean Cultrure Center of Microorganisms) Lactobacillus paracasei KCCM 12770P로 기탁하였다.
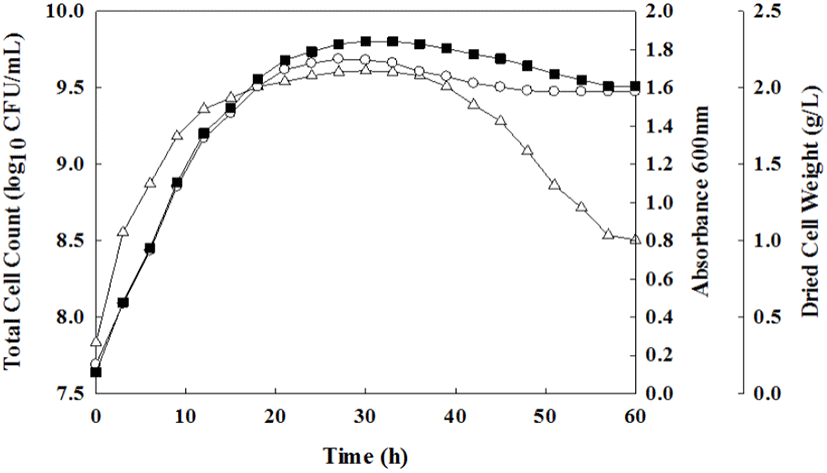
JSRL18-60 균주의 배양 시간에 따른 균체 성장을 조사하기 위해 액체배지에 접종하여 60시간 동안 배양하였으며, 3시간 간격으로 배양액을 회수하여 배양 시간에 따른 흡광도, 건조 균체량 및 생균수를 측정하여 균체 성장을 측정하였다. 배양 시간에 따른 흡광도, 건조 균체량 및 생균수를 비교 분석한 결과, 측정 요인에 따라 차이를 보이지 않고 유사한 세포 성장을 보였으며, 배양 9시간에서 30시간까지 균체가 급속도로 증식하는 대수기를 나타내었다. 배양 33시간 이후에는 균체 증식 속도가 점차 느려지기 시작하여 36시간 이후 정지기에 들어갔다(Fig. 4). JSRL18-60 균주는 배양 30시간에 생균수 9.61 log CFU/mL, 흡광도 1.74(OD 600 nm)와 건조 균체량 2.30 g/L로 가장 높은 세포 성장을 보여 JSRL18-60 균주의 균체 성장의 최적 배양 시간을 대수기에서 정지기로 들어가는 30시간으로 설정하였다. Park 등(2014)에 따르면 L. paracasei LS-2가 발효 후 24시간에 최대 균체 성장을 보인 결과와는 상이하나, 이는 초기 균주 접종량 및 배양 조건의 차이로 인한 것으로 판단되며, 아직까지 L. paracasei의 균체 성장과 관련된 연구가 부족한 실정으로, 향후 배지 성분 및 배양 조건 등에 대한 추가적 연구를 통해 최적 조건을 확립할 경우, 장내 면역조절 시스템을 조절하고, 설사를 감소시키는 효과가 있다고 알려진 L. paracasei 균주(Kalantzopulos, 1997)의 상업적 측면에서의 활용 가치를 더욱더 증가시키는 계기가 될 것으로 사료된다.
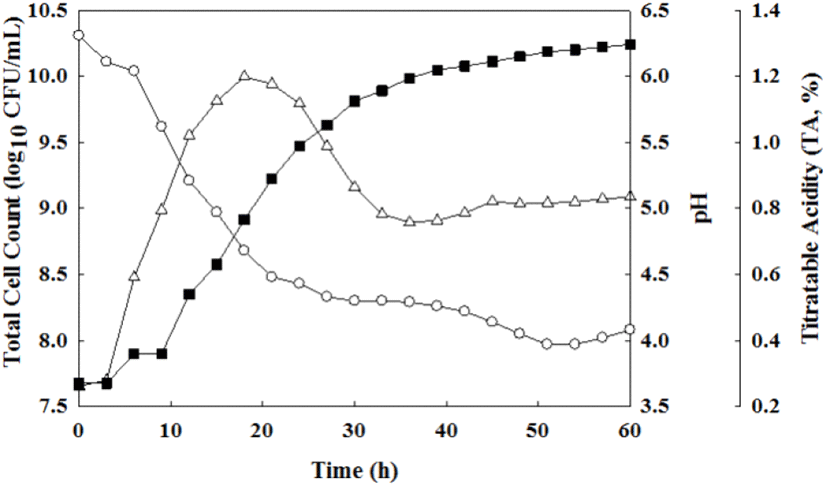
Kristo 등(2003)는 발효유의 발효 과정에서 유산균의 증식은 균의 접종량, 총 고형물의 양, 영양분 이용 정도에 따라 차이를 보이며, 생균수의 생존 및 증식은 산 생성량과 상관관계로 생균수가 많을수록 pH는 낮아지고 산도는 높아지는 경향을 갖는다고 보고하였다. 따라서, 최종선별 균주 JSRL18-60의 발효유 제조를 위한 스타터로서의 발효 적합성을 분석하기 위하여 균주 배양액을 12% 멸균 환원 탈지유에 접종한 후 40°C에서 3시간 간격으로 60시간까지 발효하면서 pH, 산도 및 생균수의 변화를 측정하였다(Fig. 5). pH 변화는 발효 초기 pH 6.3으로 시작하여 발효가 진행됨에 따라 pH가 급격히 낮아져 발효 종료 시점인 60시간에는 pH 4.08로 낮아졌으며, 적정 산도는 발효 초기 0.27%로 시작하여 발효 종료 시점인 60시간에는 1.30%로 약 21% 증가한 것을 확인하였다. 유산균의 생균수 변화는 발효 초기 7.65 log CFU/mL로 시작하여 발효 6시간에서 15시간 사이에 대수기를 보였고, 15시간 이후에는 완만한 증가세로 접어들어 발효 18시간째 9.99 log CFU/mL로 가장 높은 균체 성장을 확인하였다. 일반적으로 발효유 내 유산균 수는 107-108 CFU/mL 이상(KFIA, 2002), pH는 4.0-4.5(Min과 Chung, 2016), 적정 산도는 0.85-1.20% (Rasic와 Kurmann, 1978) 등의 결과와 비교하면 JSRL18-60으로 제조한 발효유는 발효 후 약 21시간에 9.94 log CFU/mL, pH 4.48, 적정 산도 0.89%로 해당 조건을 충족하는 것을 확인하여 최종 발효유를 제조 조건으로 확립하였다.
상업용 발효유 제조 시 사용되는 프로바이오틱스는 안전성과 기능성뿐만 아니라, 발효유에서의 균주 성장 이외에도 관능적 특성과 같은 기술적 특성이 고려되어야 하며, 발효유의 관능적 특성은 주로 발효 과정 중 유산균에 의해 생성되는 유기산, 아미노산 및 지방산 등에 의해 좌우된다(Beshkova 등, 1998). 따라서 최종 선발한 JSRL18-60을 이용하여 21시간 발효시킨 후 함유된 유기산 및 유리당 함량을 측정하였으며, 결과는 Table 3에 나타낸 바와 같다. Citric acid의 경우, 발효 전 환원 탈지유와 비교하여 감소하는 경향으로 LGG와 JSRL18-60으로 제조한 발효유 간 결과는 유사한 값을 나타내었다. Lactic acid 함량은 발효 전 0.79 mg/g에서 발효 후 11.44 mg/g으로 크게 증가하였으며, LGG의 2.66 mg/g과 비교하여도 약 4배 가량 증가한 것을 확인하였다. 이는 유산균에 의한 유당 대사과정 중 생성되는 glucose가 대사경로를 통해 pyruvate로 전환되고, 대부분의 homo 유산균이 함유하고 있는 lactate dehydrogenase에 의해 약 95%가 lactic acid로 전환되어 증가한 것으로 판단되며, 특히 lactic acid는 발효유 제품의 풍미, 조직 및 영양 면에서 중요한 역할을 담당하게 된다고 보고되고 있어(Ostilie 등, 2003), 향후 발효유 제조 시 JSRL18-60을 사용할 경우 긍정적 효과를 가져올 것으로 사료된다. 하지만 formic acid와 acetic acid의 경우 높은 수치상의 차이를 보이지는 않았으나 JSRL18-60으로 발효한 발효유에서 0.22 mg/g과 0.87 mg/g이 측정된 것에 비해 LGG는 0.74 mg/g과 1.58 mg/g으로 약 2-3배 높게 측정되었다. 특히 acetic acid의 경우 Ostilie 등(2003)은 lactic acid에 의해 배지의 pH가 저하되고, 유산균의 세포 내 pH도 감소하게 된다. 세포 내의 pH를 높게 유지하면서 유산균을 배양하면 lactate dehydrogenase의 활성이 낮아져 homo 유산균이라고 해도 다량의 acetic acid를 생성한다고 보고하고 있어 이는 LGG보다 더 높은 lactic acid를 생성함으로 인해 기인한 결과로 판단된다. 발효유 제조에 따른 lactose와 fructose의 함량을 측정하였으며, 그 결과 비교구로 사용한 LGG와 함량에서 일부 차이가 있음을 확인하였다(Table 3). Lactose의 경우 발효 전 대조구인 환원 탈지유와 비교하여 큰 차이는 없었으나, JSRL18-60으로 발효한 발효유에서 발효 전 52.04 mg/g 대비 47.71 mg/g으로 감소하였고, LGG는 변화가 없었다. Fructose는 발효 전(1.83 mg/g)에 비해 LGG와 JSRL18-60으로 제조한 발효유에서 모두 0.01 mg/g과 0.14 mg/g으로 크게 감소함을 확인하였다. 단순히 유산균을 이용하여 발효유 제조에 따른 유리당의 함량 변화를 보고한 선행 결과가 없어 직접적인 비교는 어려우나, 시판 막걸리로 제조한 전통발효유 타락의 발효 특성분석에서 젖산균이 단당류인 glucose와 fructose를 초기 발효원으로 사용 후 16시간 이후에는 검출되지 않았고, 타락의 주요 당인 lactose 또한 발효 20시간 이후에는 검출되지 않았다고 보고(Jung 등, 2015)하고 있어, 본 연구에서 JSRL18-60 단일 균주를 이용하여 발효함에 따라 종에 따른 차이와 혼합 발효에 의한 차이로 함량에는 차이가 있으나, 경향은 동일하게 감소함을 확인할 수 있었다. 또한, JSRL18-60을 이용하여 제조한 발효유의 유리아미노산을 측정하였으며, 결과는 Table 4에 나타낸 바와 같다. 먼저 aspartic acid, arginine, threonine, valine, phenylalanine, isoleucine 및 leucine 등이 함유된 펩타이드의 쓴맛 아미노산 구성비율이 발효유의 맛에 좋지 않은 영향을 준다고 보고(Fox, 1983)되었으나, 비교군인 LGG와 선별 균주인 JSRL18-60 및 발효 전 환원 탈지유의 각각 함량별 차이는 일부 있었으나 총량에서는 모두 큰 차이가 없음을 확인하였다. 발효유의 주요 풍미인 acetaldehyde의 형성에 관여하는 threonine과 methionine의 경우 methionine은 모든 시험구에서 검출되지 않았으나, threonine은 JSRL18-60으로 제조한 발효유에서 1.64 mg/g으로 LGG 0.29 mg/g 및 대조구 0.58 mg/g 대비 가장 높게 생성되었으며, 이외 유리아미노산의 경우에는 큰 함량의 차이를 나타내지는 않고 거의 유사한 수치를 나타내었다. Park 등(1986)은 서로 다른 유산균을 혼합 배양하였을 경우 균주들 간 아미노산 생성능이 다르기 때문에 서로 상호 보완작용을 하여 아미노산 이용성이 높아지게 되고, 이로 인해 산생성과 유산균 생육이 촉진된다고 보고하고 있어, 향후 발효유 제조시 다양한 유산균과의 혼합 배양을 통해 아미노산 생성 이외에도 유산균 생육이 더욱 증가할 수 있을 것으로 사료된다.
발효유의 맛과 품질은 저장온도 및 시간을 포함한 배양 조건과 발효 산물에 의한 길항 물질, 발효 및 저장기간 동안 생성되는 유기산의 함량에 의해 좌우된다고 보고되고 있다(Min과 Chung, 2016). 발효유의 저장 기간 중 유산균 수는 저장 초기 9.48 log CFU/mL에서 저장 10일째 9.36 log CFU/mL, pH와 적정 산도는 저장 초기 pH 4.48와 0.89%에서 저장 10일 후 pH 4.38와 0.98%를 나타내어 일반적인 기준 조건에서는 적정 범위 내에서 유지됨을 확인하였다(Table 5). 유산균을 이용하여 제조한 발효유의 저장기간 동안 일정한 균수를 유지하고, pH의 경우 서서히 감소, 적정 산도는 서서히 증가하지만 이는 미비한 수준으로 큰 변화 없이 유지한다는 보고(Kroger과 Weaver, 1973)와 동일한 결과를 확인하였다. 특히, 유산균 수의 경우 축산물 가공기준 및 성분 규격에 의한 108 CFU/mL 이상의 값에 충족하고, 국내 시판 발효유는 0.82-1.25%의 적정 산도를 유지한다는 보고(Lee 등, 1988)에도 일치하여 JSRL18-60 균주를 이용하여 제조한 발효유의 저장성 측면에서도 문제가 없을 것으로 사료된다. 이상의 결과로 미루어보아 전통 발효식품으로부터 분리한 L. paracasei 18-60은 프로바이오틱스 활성을 갖고 있어 내산성 및 내담즙성, 장내 상피세포 부착능이 우수하고, 이를 이용한 발효유 제조 시 발효 및 저장 중 품질 변화 없이 일정하게 유지되므로 스타터로서의 활용할 가치가 충분함을 확인하였다. 하지만 상업적으로 활용하기 위해서는 향후 대량생산을 위한 적정 발효조건 확립과 품질 개선 등 추가적인 연구가 선행되어야 할 것으로 판단된다.
| Storage period (days) | |||
|---|---|---|---|
| 0 | 5 | 10 | |
| L. paracasei JSRL18-60 (log CFU/mL) | 9.94±0.051)b2) | 9.32±0.75a | 9.36±0.01a |
| pH | 4.48±0.02c | 4.38±0.01a | 4.41±0.02b |
| Titratable acidity (%) | 0.89±0.02a | 1.01±0.02b | 0.98±0.01b |
