서 론
현대인들의 삶의 질이 향상되어가면서 식품의 역할이 생명유지의 기능 외에도 건강 증진 및 기호도가 중요시되고 있다. 최근 천연소재를 발효하여 개발된 발효식품은 세계적인 건강식품으로 인정받고 있다. 이러한 발효식품은 사용되는 미생물의 종류와 발효원료에 따라 매우 다양하며, 미생물의 작용 때문에 단백질 등의 원료 성분이 분해되기도 하고, 새로운 성분이 합성되기도 하여 영양성분과 기능성, 저장성 및 기호도가 향상된다.
옻은 옻나무과에 속하는 낙엽활엽교목으로 학명은 Rhus verniciflua Stokes 또는 Toxicodendron vernicifluum이며, 전 세계적으로도 약 600여 종이 존재하고 있는 것으로 알려져 있고, 우리나라에는 참 옻나무를 포함한 6종의 옻나무가 분포하고 있다(Kim 등, 2002; Lim 등, 2018).
옻나무는 항암, 항산화, 유전독성 및 세포 고사의 조절과정, 면역증강 등의 효과가 밝혀지면서 옻나무의 식품사용 및 재배면적이 증가하고 있으며, 다량의 항산화 물질이 함유되어 있다(Jin 등, 2017). 최근에는 이를 이용한 식품의 원료로 시판되고 있으며, 옻나무 추출물의 생리활성에 관한 연구도 활발히 진행되고 있다(Choi 등, 2010).
전통 발효 미생물 중 효모와 젖산균은 대표적인 발효 미생물이며, 발효에 이용되는 균주마다 발효물의 성분이나 기능성이 크게 달라지기 때문에 발효의 최적화를 위해서는 균주의 선택이 중요하다. 일반적인 발효의 경우 대부분 단일 균주를 이용하는 발효법을 이용하지만, 우리가 주로 먹는 김치, 청국장과 같은 발효식품에서 미생물을 분리해보면 다양한 종류의 미생물이 함께 발효에 관여한다.
Saccharomyces cerevisiae는 인체에 안전한 GRAS 균주로 핵산, 효소, 단백질, 지질, 미네랄 등의 원료로 사용되어 왔고(Lee 등, 2009), 다양한 생리 활성 물질 생산에 관한 연구를 통해 항치매 β-secretase 저해물질(Lee 등, 2007), 항고혈압성 안지오텐신 전환효소 저해물질(Kim 등, 2011), 항혈전 용해 활성물질(Jang 등, 2011) 등의 다양한 생리 기능성 물질을 생성하여 건강식품의 공급원으로 사용되고 있다(Jeong 등, 2019).
젖산균은 대표적인 probiotics로 당류를 발효하여 젖산을 생성하는 통성혐기성 세균으로서 전통적인 발효식품의 제조에 관여한다. 특히 젖산균에 의한 발효를 통한 단백질 및 대사산물 생산, 지방분해 작용으로 발효식품의 저장성과 기능성을 높이며, 식품의 풍미를 향상시킨다(Carr 등, 2002). 또한, 젖산균은 혈중 콜레스테롤과 혈압 수치를 낮추며, 체내 대사 활성에 긍정적인 영향을 주어 암 생성 억제, 위장염 억제 등과 같은 효과가 보고되었다(Kim 등, 2017). 특히 Lactobacillus brevis, Lactobacillus paracasei, Lactococcus lactis, Lactobacillus delbrueckii, Lactobacillus plantarum 등과 같은 젖산균은 전구물질 monosodium L-glutamate(MSG)로부터 기능성 물질인 GABA를 생합성하는 특징을 가지고 있다고 보고되었다(Kim, 2013; Lim, 2013; Park, 2019).
L-Glutamic acid는 중추신경계의 신경전달물질로 신경세포 활성을 유도하는 물질로 알려져 있고, glutamate decarboxylase(GAD, EC4.1.1.15)에 의해 γ-aminobutyric acid (GABA)로 전환된다(Park, 2001). GABA는 자연계에 널리 분포되어있고, 4개의 탄소로 구성되어있는 비단백성 아미노산이다. 이는 포유동물의 뇌나 척수에 존재하는 억제성 신경전달 물질이며, 전체 중주 신경 물질의 약 30%를 차지하고 있다(Oh, 2005). GABA는 혈류를 개선하며, 뇌의 산소공급을 증가시키며 뇌의 대사촉진 및 뇌 기억을 증진하는 뇌의 영양제로 알려져 있으며, 중풍, 치매 예방, 기억력 증진, 불면 등에 효과가 있다고 보고되었다(Park, 2001). 또한, 식욕과 포만감에 영향을 주어 체중을 감소시키는 효과가 있으며, 이 물질의 극심한 농도 감소는 발작, 경련을 유발하기도 한다고 보고되었다(Kim 등, 1999; Oh, 2005; Park, 2001). 미생물에 의한 GABA 합성은 기질인 glutamate로부터 GABA 합성 효소인 L-glutamic acid decarboxylase(GAD)와 보조인자인 pyridoxal-5-phosphate(PLP)에 의해 생합성되는 것으로 알려져 있다(Kim 등, 1999).
따라서 본 연구의 목적은 항산화성 및 다양한 기능성을 함유하는 것이 입증된 옻나무 추출물에 효모와 젖산균의 혼합발효를 최적화하여 고농도 GABA를 생산하는 것이며, 이를 통해 GABA, probiotics 등 생리활성물질이 강화된 옻 발효 식품소재 개발을 위한 기초 연구 자료를 제공하고자 한다.
재료 및 방법
본 실험에 사용한 옻나무 추출물(Toxicodendron vernicifluum extract, TVE)은 옻가네 식품(Chungchungbukdo, Korea)에서 생산된 원료를 제공받아 −18°C에서 냉동 보관하여 사용하였다. 탄소원으로 사용된 설탕(sucrose)과 lactose는 각각 대한제당(KS H-2003, Incheon, Korea)과 ㈜덕산약품공업(Ansan, Korea)으로부터 구입하였다. Yeast extract(YE)는 ㈜조홍(Ansan, Korea)으로부터 제품을 구입하여 사용하였다. 표준물질 GABA는 Sigma-Aldrich 사(St. Louis, MO, USA)에서 구입하였으며, glutamic acid는 Thermo scientific 사(Rockford, IL, USA) 제품을 구입하여 사용하였다.
Saccharomyces cerevisiae는 빵에서 분리된 효모로서 MRS agar plate에서 계대배양한 후, 멸균한 MRS broth에 순수 배양된 S. cerevisiae 한 백금이 접종한 뒤 항온배양기 30°C에서 24시간 동안 정치 배양하여 1차 효모발효 스타터로 사용하였다.
Lactobacillus plantarum EJ2014(KCCM 11545P)는 쌀겨(Uljin, Korea)에서 분리된 GABA 생성능이 우수한 균주로서, MRS agar plate에서 계대 배양한 후, 멸균한 MRS broth에 순수 배양된 L. plantarum 한 백금이 접종한 뒤 30°C 항온배양기에서 24시간 동안 정치 배양하여 2차 젖산균 발효 스타터로 사용하였다.
121°C에서 15분간 멸균된 옻나무 추출물 15 mL에 sucrose 5%(w/v)와 yeast extract 1%(w/v)를 250 mL baffle flask에 혼합한 뒤 최종 부피 100 mL가 되도록 멸균수를 첨가하였다. 그 다음 S. cerevisiae 스타터 1%(w/v)를 접종하여 항온배양기에서 30°C로 2일간 정치 배양한 후 발효물의 이화학적 분석을 하였다.
GABA 생산을 위한 2차 젖산균 발효는 1차 효모 발효물에 MSG 5%(w/v)와 lactose 2.5%(w/v)를 첨가한 후 부피를 200 mL가 되도록 멸균수를 첨가하였다. 그다음 L. plantarum 스타터 1%(w/v)를 추가적으로 접종하여 항온배양기에서 30°C로 7일간 정치 배양한 옻 발효물의 이화학적 분석을 하였다.
옻 발효물의 적정 산도는 시료 1 mL에 증류수 9 mL를 가하여 희석 후 pH 8.3에 도달할 때까지 0.1 N NaOH로 적정하여 사용된 소비량을 lactic acid 함량(%, w/v)으로 환산하여 측정하였으며, pH는 pH meter(SevenCompact™ pH/Ion S220, Mettler-Toledo AG, Schwerzenbach, Switzerland)를 이용하여 측정하였다.
생균 수는 발효물을 멸균 생리식염수로 106까지 단계별 희석한 것을 MRS agar 배지에 20 μL 도말한 후 배양한다. S. cerevisiae와 L. plantarum EJ2014는 MRS agar plate에서 30°C 항온배양기에서 각각 48시간 배양한 후 생균수를 log colony forming unit(CFU)/mL로 나타내었다.
환원당 함량은 dinitrosalicylic acid(DNS)법에 의해 측정하였다(Im 등, 2019). 옻 추출 혼합 발효물을 원심분리기(Eppendorf, Germany)를 이용하여 13,000 rpm, 15분 동안 원심분리를 하여 얻은 상등액을 희석한 시료 1 mL에 DNS 시약 3 mL를 가하고, 100°C에서 5분간 발색시킨다. 실온의 암소에서 40분간 냉각 후 550 nm에서 흡광도를 측정하였다.
옻나무 추출물의 무기질 분석은 식품공전(MFDS(2014) Ministry of Food and Drug Safety, Food Code Ⅱ, Cheongju, Korea, P)의 방법에 따라 수행하였으며, 무기질 중 Na, Ca, K, Mg, P, Fe, Mn 함량의 측정은 건식분해법에 따라 시험용액을 조제하고 ICP-OES로 정량하였다. 시료를 균질화하여 일정량(약 10 g)을 회화 용기에 취한 후 탄화시키고, 550-600°C의 온도에서 여러 시간 회백색이 될 때까지 회화하였다. 방냉 후 염산용액 10 mL를 가해 수욕상에서 완전 증발 건고시키고, 건고물에 염산용액 8-10 mL를 가하여 수분 가열한 다음 50 mL 정용플라스크에 여과하였다. 불용물은 여지와 같이 사용했던 회화 용기에 옮겨 건고한 후 다시 회화하였다. 이 회분을 증류수로 적셔 염산 용액 약 2 mL를 가해 증류수 약 5 mL로 희석한 후 수욕 상에서 가온하였다. 여과한 액을 앞의 100 mL 메스플라스크에 채워 증류수를 가하여 100 mL로 정용하고 시험용액으로 사용하였다. ICP-OES(Optima 7000DV, Perkin Elmer, Waltham, MA, USA)를 이용하여 무기질 함량을 측정하고, 이때 표준용액으로 얻은 각각의 검량선을 이용하여 정량하였다. ICP-OES를 이용한 기기분석 조건은 Table 1과 같다.
C: 흡광곡선에서 구한 결과값(mg/kg)
D: 시험용액의 희석배수
V: 시험용액의 전량(mL)
S: 검체의 채취량(g)
MSG 잔존량과 GABA 생성능 비교를 위한 thin-layer chromatography(TLC) 분석을 수행하였으며, 표준물질로 0.5% MSG와 0.5% GABA 용액을 사용하였다. 전개 용매는 n-butyl alcohol : acetic acid glacial : distilled water를 3 : 1 : 1(v/v)의 비율로 혼합하여 사각 chamber(30×25×10 cm)에 넣고 실온에서 4시간 이상 포화시켰다. 발효물은 증류수로 3-5배 희석한 후 각각 시료와 standard 용액을 silica gel TLC plate(10×20 cm)의 아래에서 15 mm 되는 위치에 2 μL를 점적 하였고, 간격은 10-20 mm를 유지하였다. 점적 후 TLC plate의 sample을 건조시킨 다음, 사각 chamber에서 전개한 후 TLC plate는 105°C 건조기에서 건조하였다. 건조한 TLC plate에 발색시약인 0.2% ninhydrin 용액을 뿌리고, 100°C 건조기에서 5-10분 동안 발색시킨 후 발효물의 MSG와 GABA spot을 확인하여 정성 분석하였다.
발효물의 유리아미노산 glutamic acid와 GABA 정량분석을 위해서 HPLC분석을 수행하였다. 발효물 1 g를 취하여 여과지로 여과한 후 유도체화를 위해 10 μL를 취하여 Borate Buffer 70 μL와 ACCQ-Fluor Reagent(Waters Co., Ltd., Milford, MA, USA) 20 μL를 넣어 10초간 잘 혼합한 후 1분 방치하고, 55°C oven에서 10분간 가열 후 방냉하여 분석하였다. 이때 HPLC(Waters 2475, Waters Co., Ltd.)를 사용하여 측정하였으며, ACCQ․Taq™(3.9×150 mm) column을 사용하였다. 또한. 검출기는 Fluorescence(excitation wavelength는 250 nm, emission wavelength는 395 nm)를 이용하고, mobile phase(A: waters AccQ Taq Eluent A, B: acetonitrile, C : tertiary distilled water)로 유속 1.0 mL/min의 속도로 흘려주었으며, 용매조건은 Table 2와 같다. 표준물질은 증류수에 녹여 각 단계별로 희석하여 작성한 표준 검량선을 이용하여 함량을 계산하였다.
| Time | A1) | B | C |
|---|---|---|---|
| 100 | 0 | 0 | |
| 0.5 | 99.5 | 0.5 | 0 |
| 10.0 | 96.5 | 3.5 | 0 |
| 15.0 | 96 | 4 | 0 |
| 18.0 | 96 | 4 | 0 |
| 19.0 | 91 | 9 | 0 |
| 29.5 | 83 | 17 | 0 |
| 40.0 | 0 | 50 | 50 |
| 450 | 100 | 0 | 0 |
| 55.0 | 100 | 0 | 0 |
이때 S는 시험용액의 농도(μg/mL), V는 시험용액의 양(mL), D는 희석배수, 그리고 W는 채취한 검체량(g)이다.
결과 및 고찰
냉동보관된 옻나무 추출물(T. vernicifluum extract, TVE)은 상온에서 해동시킨 후 사용하였으며, 발효 전 옻나무 추출물은 pH 5.58, 0.05% acidity를 나타내었으며, 고형분과 환원당 함량은 각각 0.99±0.01%, 0.55±0.01 mg/g을 함유하였다. 옻나무 추출액을 121°C에서 15분간 멸균하여 발효에 사용하였다.
무기질은 미생물 생육의 필수영양소로서 효소 활성에 조효소로 작용하면서 미생물의 생육에 요구되는 종류와 함량이 다르다(Landeweert 등, 2001). 옻나무 추출물의 무기질 함량을 측정한 결과, 각각 Na 2.84 mg/100 g, Ca 5.27 mg/100 g, K 17.78 mg/100 g, Fe 0.12 mg/100 g, P 3.19 mg/100 g, Mg 3.54 mg/100 g, Mn 0.04 mg/100 g이었으며, 이중 K의 경우 흔히 한약재로 사용되어지는 황칠나무 추출물의 K 2.38 mg/100 g에 비해 5배 가량 높은 함량을 나타내고 있다(Choi, 2016). 또한, 헛개나무 추출물의 무기질 함량 분석에서 K 8.98 mg/100 g, P 5.04 mg/100 g(Yoon과 Lee, 2019) 과 비교하여도 높은 함량을 나타내었다. 이는 옻나무 추출물이 발효 미생물의 생육을 위한 다양한 무기질을 함유하는 것으로 판단되었다.
1차 효모발효를 위해서 옻나무 추출물 15%에 5% sucrose, 1% yeast extract를 첨가한 후 30°C 배양기에서 2일간 1차 정치배양을 진행하였다. 1차 효모발효물의 이화학적 특성 및 생균수를 분석 한 결과는 Table 3에서 나타내었다. 2차 젖산균 발효시에 발효성 당의 농도를 최적화하기 위해서 유당의 첨가에 따른 혼합 발효물의 이화학적 특성 및 생균수를 분석한 결과는 Table 4에서 나타내었다.
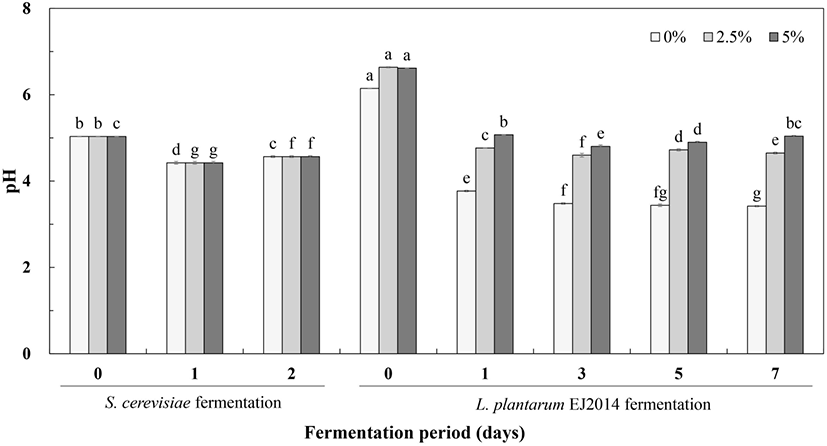
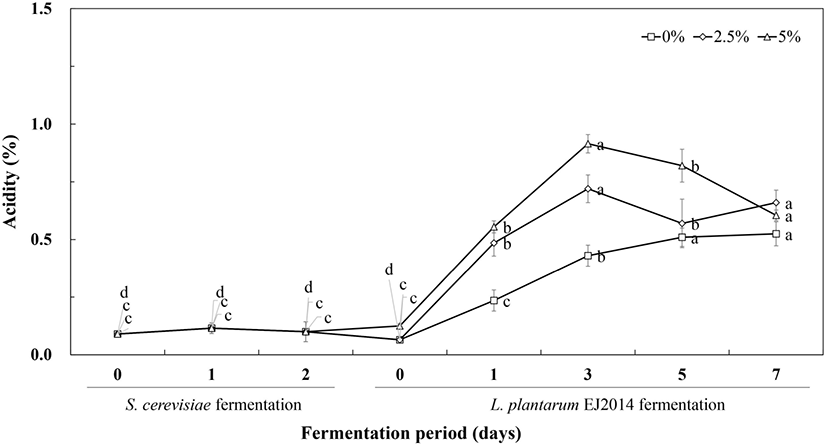
옻나무 추출물을 이용한 1차 효모발효는 sucrose, yeast extract 첨가조건에서 가스 생성을 보이면서 발효 0일에 pH 5.03에서 2일 차에 pH 4.57로 소폭 감소하는 경향을 보였다. 적정 산도는 효모발효 0일에 0.09%에서 발효 2일에 0.10%로 유사한 값을 나타내었다. 2차 젖산균 발효과정에서 유당 2.5%, 5.0%의 첨가군은 초기 pH 4.56에서 발효 7일에 각각 pH 5.12, pH 5.03의 낮은 값을 보였으며, 유당 무첨가 군은 pH 6.65로 증가하였다. 이때 유당이 첨가된 발효물의 pH는 발효 7일 동안 완만하게 증가하면서 산성 조건을 유지하였다.
2차 젖산발효에는 유당 첨가에 의해서 발효 3일까지 산도가 크게 증가하였으며, 발효 후반에는 약간 감소하는 경향을 보였다. 유당 2.5% 첨가시에 발효물의 초기 산도는 0.13%에서 발효 3일에 1.21%로 증가하여 가장 높은 산도값을 나타낸 후 발효 7일에는 0.66%로 크게 감소하였다. 또한, 유당 5.0% 첨가 경우에 발효 초기 0.13% 산도에서 발효 3일에 1.45%로 증가한 후 발효 7일에는 산도 0.85%로 감소하였다. 이는 젖산균 발효 7일 동안 발효물의 pH 증가와 함께 산도가 감소하는 경향을 보이면서 정상적인 젖산균 발효의 양상과는 차이가 있었다. 2차 젖산균 발효에서 첨가하는 전구물질인 MSG를 이용하여 기능성물질 GABA를 생산하는 과정에서 proton이 소비되면서 pH 증가와 산도 감소한다는 연구(Feehily and Karatzas, 2012)와 유사한 현상을 보였다.
1차 효모 발효에서 생균수는 5.95 log CFU/mL에서 7.63 log CFU/mL로 증가하였으며, 2차 젖산균 혼합 발효과정에서 유당을 첨가하지 않은 경우 발효 7일 차에 효모 생균수가 7.22 log CFU/mL로 비교적 높은 값을 보였다. 이때 2차 혼합발효시에 젖산균은 발효 0일 차에 7.44 log CFU/mL에서 발효 7일에 7.88 log CFU/mL로 소폭 증가하였다.
반면에 유당 2.5%, 5.0%를 첨가 경우 2차 젖산균 혼합 발효물에서 효모 생균수는 크게 감소하면서 각각 5.68 log CFU/mL, 5.40 log CFU/mL로 측정되었다. 유당 2.5%, 5% 첨가한 2차 젖산균 발효물은 발효 1일에 9.1 log CFU/mL 이상으로 크게 증가한 후 발효 7일에 소폭 감소하면서 9.0 log CFU/mL 정도로 나타났다. 이는 유당 첨가로 젖산균의 생육증가에 따른 젖산 생성으로 효모의 생육환경에 영향을 미친다는 것으로 판단되었다. 효모, 젖산균 혼합 발효시에 발효성당으로 유당을 첨가한 발효물에서 GABA 생성을 분석한 결과, 2.5% 유당을 첨가 경우에 발효 5일에 전구물질 MSG가 모두 소진되면서 GABA로 전환되었다(Fig. 1). 결론적으로 옻나무 추출물의 효모 젖산균 혼합 발효과정에서 발효성 당으로 유당 2.5%의 첨가는 2차 젖산균의 생육을 도와주면서 유기산 생성과 젖산균의 생균수를 증가시키며, 동시에 효과적으로 GABA를 생합성하는 것으로 나타나서 GABA 생성의 최적 조건으로 결정하였다.
옻나무 추출물의 효모와 젖산 혼합발효를 통한 GABA 생산 최적화하기 위해서 유당 2.5%를 첨가하여 MSG의 첨가 농도를 달리하여 pH와 적정 산도를 측정하였다.
1차 효모발효에서는 옻 발효물의 초기 pH 5.03에서 발효 2일 차 pH가 소폭 감소하면서 pH 4.57을 나타내었다. 2차 젖산 발효시에 MSG를 무첨가의 경우 발효물의 pH는 초기 6.15에서 발효가 진행되면서 지속적으로 감소하여 발효 7일에 pH 3.42를 나타내었다. 1차 효모 발효물에 MSG를 첨가하여 2차 젖산균 발효를 수행하는 경우에 pH는 일부 상승하는 경향을 보였다. MSG 2.5% 첨가한 2차 젖산 발효물의 초기 pH 6.64에서 발효 3일에 pH 4.6으로 감소한 후 발효 7일에 발효물의 pH는 소폭 상승하면서 pH 4.65를 나타내었다. MSG 농도를 5% 첨가한 2차 젖산균 발효물의 초기 pH 6.62에서 발효 3일에 pH 4.80으로 감소한 후 발효 7일에 약간 증가하면서 pH 5.04를 나타내었다. 이는 GABA생산의 전구물질로서 MSG를 최대 5% 수준으로 첨가할 때 젖산 발효 초반에 젖산 생성에 의해 발효물의 pH가 감소하지만, 발효가 진행되면서 발효물의 pH가 증가하는 경향을 보였다(Fig. 2).
적정 산도는 1차 효모발효 초기와 발효 2일에 각각 0.09%, 0.10%로 큰 변화는 없었다. MSG 무첨가 경우에 2차 젖산발효물의 산도는 초기 0.07%에서 발효 7일 동안에 완만하게 증가되면서 발효 7일에 산도 0.53%를 나타내었다. MSG 2.5%를 첨가한 2차 젖산발효물의 초기 산도는 0.06%에서 발효 3일에 0.72%로 가장 높은값을 보인 후에 발효 7일에 0.66%로 감소하였다. 또한, MSG 5%를 첨가한 2차 젖산발효물의 산도는 초기 0.13%에서 발효 3일에 0.92%로 가장 높은 값을 보인 후에 발효 7일에 산도 0.61%로 감소하였다(Fig. 3). 일반적인 젖산발효에 의한 발효물은 pH 감소와 산도의 증가를 보이는 결과와 다른 경향을 보인 것은 젖산균 발효과정에서 첨가되는 전구물질 MSG의 역할에 기인하는 것으로 판단되었다. 젖산균에 의한 GABA 생산에서 기질인 glutamic acid는 glutamate decarboxylase 효소에 의해서 탈탄산되어 GABA가 생성된다. 이때 효소에 의한 생물전환 과정에서 proton을 소진시키면서 발효물의 산도가 감소하는 것을 보고하였다(Cui 등, 2020; Feehily와 Karatzas, 2012).
옻나무 추출물의 효모와 젖산 혼합발효를 통한 GABA 생산 최적화하기 위해 MSG의 첨가 비율을 달리하여 진행한 발효물의 생균수를 측정한 결과를 Fig. 3에 나타내었다.
1차 효모발효에서는 발효 초기와 발효 2일에 생균수는 각각 5.95 log CFU/mL, 7.63 log CFU/mL로 측정되었다. 2차 젖산발효과정에서 전구물질로서 MSG의 첨가 비율에 따른 생균슈를 측정한 결과는 Fig. 3에 나타내었다. 2차 젖산발효가 진행된 1일 차에는 MSG를 0%, 2.5%, 5%로 첨가한 발효물의 효모 생육은 7.16 log CFU/mL, 6.84 log CFU/mL, 7.22 log CFU/mL로 비슷한 값을 보였다. 2차 젖산발효 3일 차의 효모 생육은 6.3 log CFU/mL, 6.7 log CFU/mL, 5.7 log CFU/mL로 효모의 생균수는 점차 감소하는 경향을 보였다. 발효 7일 차에 MSG 5% 첨가의 경우에 비교적 높은 생균수를 보이면서 MSG 0%, 2.5%, 5%는 각각 4.85 log CFU/mL, 4.85 log CFU/mL, 5.29 log CFU/mL의 효모 생균수를 나타내었다(Fig. 4).
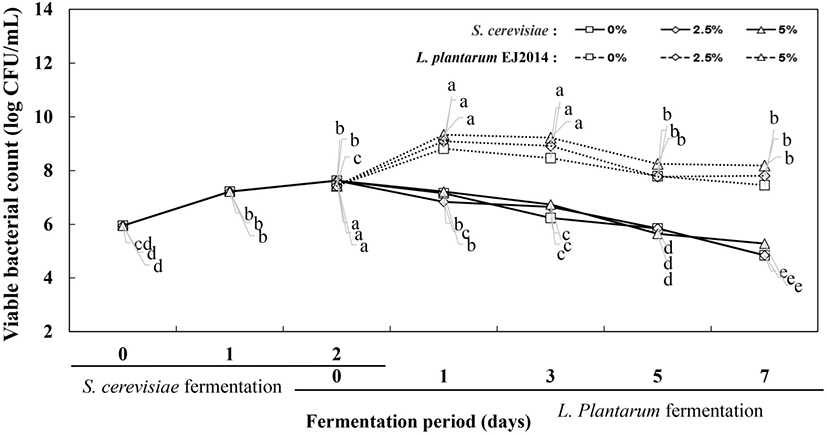
2차 젖산발효가 진행됨에 따라 발효 초기에 1차 효모 발효물에서 젖산균은 7.44 log CFU/mL로 생균수로 접종되었으며, 젖산 발효가 진행됨에 따라 젖산균의 생육에 차이를 보였다. 2차 젖산발효 1일 차에 MSG 0%, 2.5%, 5% 첨가한 발효물의 생균수는 각각 8.82 log CFU/mL, 9.09 log CFU/mL, 9.34 log CFU/mL로 MSG의 농도가 높을수록 젖산균의 생균수가 높은 것으로 나타났다. 발효 3일 이후에는 생균수가 감소하는 경향을 보였으며, 2차 젖산발효 7일에는 MSG 0%, 2.5%, 5% 첨가한 경우에 발효물의 젖산균 생균수는 각각 7.46 log CFU/mL, 7.81 log CFU/mL, 8.19 log CFU/mL로 나타났다. 결론적으로 2차 젖산균 발효시에 첨가되는 중성 아미노산인 MSG는 젖산균의 생육과 생존에 기여하는 것으로 판단되며, 5% MSG 첨가조건에서 가장 높은 생균수를 보였다(Fig. 4).
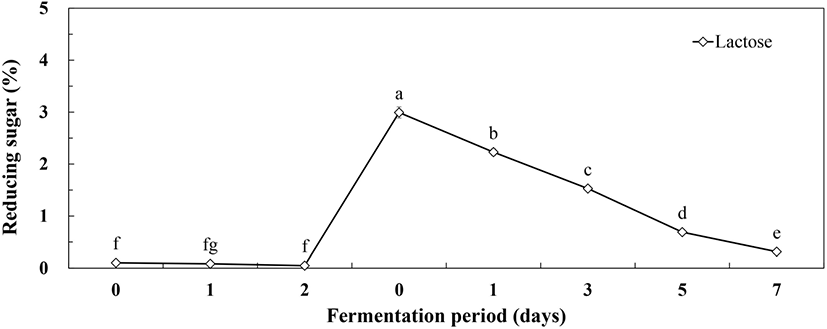
MSG 첨가농도 최적 조건에서 젖산발효에 따른 환원당 변화는 Fig. 5와 같다. 옻 추출액의 환원당은 0.45%에서 1차 효모발효 초기에 옻나무 추출물 혼합 배양액의 환원당은 0.1%에서 발효 2일에 0.05%로 소폭 감소하는 경향을 보였다. 2차 젖산발효과정에서 2.5% MSG와 2.5% lactose가 첨가되면서 2차 젖산 발효 초기에 2.99% 환원당에서 발효가 진행되면서 감소하여 발효 5일, 7일에 각각 환원당 1.0%, 0.31%를 나타내었다. 2차 젖산균에 의한 혼합발효가 진행될수록 유당이 급격하게 감소하여 환원당이 소진된 것을 확인할 수 있었다. 따라서 효모, 젖산균 혼합발효과정에서 유당 발효능이 결여된 효모보다는 젖산균의 유당 발효를 통해서 젖산 등의 대사산물 생산 및 전구물질인 MSG를 이용한 GABA 생산을 기대할 수 있었다. 사과즙을 이용한 젖산균에 의한 GABA 생산에서 발효배지의 발효성 당 함량이 높은 경우에 GABA 전환이 미비한 연구결과를 얻었으며, 이를 바탕으로 2차 젖산균 발효를 통한 GABA 생산에서 발효 5일 이후 발효성 당이 1.0% 정도를 유지하는 것이 바람직하다고 판단되었다(Lee 등, 2020).
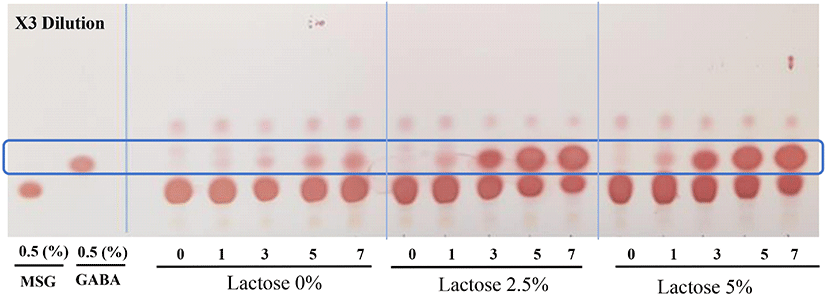
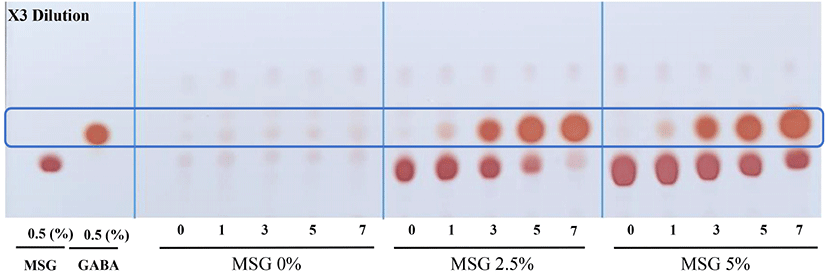
옻나무 추출물의 효모와 젖산 혼합발효를 통한 GABA 생성능을 확인하기 위해 TLC를 이용하여 정성분석을 진행하였다. 이는 선행연구에서 효모를 이용하여 1차 발효를 수행한 후 2차 젖산균 발효를 수행하는 것이 효과적으로 GABA 생산이 가능하였다. 또한 다른 연구(Kim, 2013; Masuda 등, 2008)에 따르면 TLC상 효모가 GABA 생산능력이 있는 것으로 나타났다. TLC 분석결과는 Fig. 6과 같다. MSG를 0% 첨가한 발효물은 GABA가 전혀 생성되지 않았으며 MSG 2.5% 첨가한 발효물의 발효 1일부터 GABA 전환이 시작되어 MSG 소진과 GABA 전환이 가장 빠른 것으로 나타났으며, 발효 7일에 전구물질 MSG가 모두 소진되고 GABA를 생성하였다. 또한, MSG 5% 첨가한 발효물의 경우 7일 차에는 MSG의 소진이 덜 되었지만 GABA 생성량이 더 높은 것으로 나타났다. 결론적으로 옻나무 추출물의 효모-젖산 혼합발효에서 2.5% MSG가 첨가된 조건이 GABA로의 전환능이 더욱 뛰어난 것으로 나타나서 최적조건으로 판단되었다. 본 연구에서는 2차 발효 3일차에 MSG의 GABA로의 전환이 시작되어 7일차에 전부 전환된 것을 확인할 수 있었다. 이는 유청을 이용한 혼합발효를 통한 GABA의 생산연구(Kim, 2019)와 늙은 호박의 혼합 발효를 통한 GABA 생산연구(Park, 2017)에서도 혼합발효 3일차부터 GABA가 생산되는 것과 유사한 결과를 보였다.
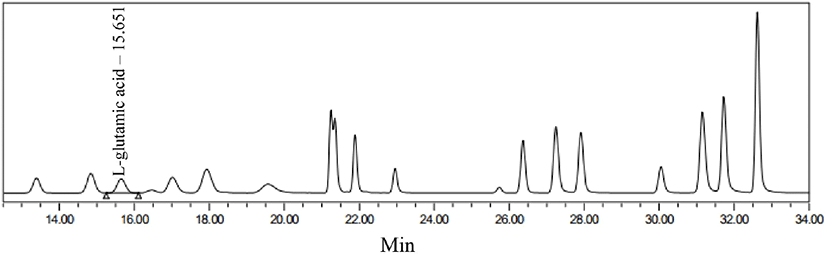
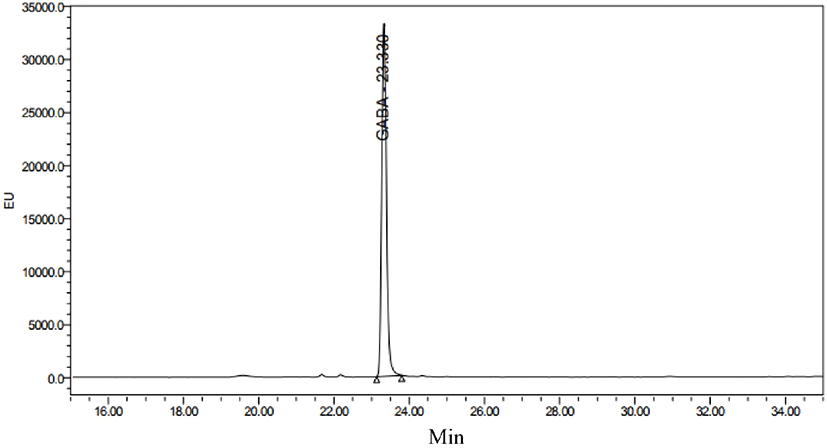
옻나무 추출물 발효물의 GABA 생성의 정량분석을 위해 HPLC로 분석을 진행하였다. Glutamic acid 표준용액은 15.7분에 peak를 나타냈으며, GABA는 23.3분에 peak를 나타내어 각각의 표준물질에 대한 retention time을 확인하였다(Fig. 7, Fig. 8). 옻나무 추출물의 최적 발효조건인 1차 효모발효 종료 후 lactose 2.5%와 MSG 2.5%를 추가 발효한 2차 젖산균 혼합발효물의 분석결과, 2차 젖산발효 초기에 2.49±0.08 g/100 g이었던 glutamic acid는 발효 7일 차에는 모두 소진되면서 존재하지 않았으며, GABA 함량은 2차 젖산발효 7일에 1.85±0.02 g/100 g으로 증가하는 것을 확인할 수 있었다(Table 5). 따라서 발효 결과 대부분의 glutamic acid가 GABA로 전환한 것을 확인할 수 있었으며, glutamic acid의 GABA로의 전환율은 74.3%로 나타났다.
| Free amino acid | Co-fermentation period (day) | |
|---|---|---|
| 0 | 7 | |
| Glutamic acid (g/100 g) | 2.49±0.081) | 0.00±0.02 |
| GABA (g/100 g) | 0.03±0.02 | 1.85±0.02 |
천연소재로 GABA는 현미 100 g 당 4-8 mg, 발아현미 10-100 mg으로 자연에서 얻을 수 있는 GABA는 제한적이며, 젖산균을 이용한 발효물에서 250 mg 이상의 GABA를 함유한다는 연구가 보고되었다(Hwang, 2011; Mody 등, 1994; Park, 2012). 울금을 이용한 B. subtilis HA와 L. plantarum K154의 혼합발효에서 1.78% GABA 생산이 보고 되었으며(Lim, 2014), 녹각 추출물을 이용한 L. plantarum EJ2014의 발효에서 1.4%, Leuconostoc mesenteroides SM와 Lactobacillus plantarum K154 균주의 혼합발효에서는 1.23%의 GABA가 생산되었다고 보고되었다(Kwon, 2016; Song, 2014). 옻나무 추출물의 효모, 젖산균 혼합발효를 통해서 1차 효모배양물에 첨가된 전구물질인 MSG가 효과적으로 생물전환되면서 고농도 GABA를 생산할 수 있었다.