서 론
아시아 국가 중 한국은 대두(Glycine max L.)의 주 원산지로 다른 국가에 비해 콩과 관련된 식품의 발전이 가장 많이이루어진 나라다(Jo 등, 2011). 이미 널리 알려진 대로 단백질의 대명사인 대두는 단백질과 불포화지방산 외에도 올리고당, 식이섬유, 사포닌, 이소플라본 등의 영양성분 및 기능성성분이 많이 함유되어 있어 아주 유용한 작물이라 할 수 있다(Lee 등, 2017). 대두를 사용한 식품의 분류는 일반적인 가공품(두부, 두유 등)과 미생물 발효가 접목된 된장, 간장, 청국장 등이 존재한다. 특히, 장류 식품의 가장 대표적인 효능과쓰임새로는 된장과 청국장의 경우, 항암과 혈전용해 등의 우수한 생리활성이 있음을 오래된 문헌(Kim, 1998; Kurechi 등, 1981; Lim 등, 1999)과 최근까지(Hwang 등, 2017a; Kim 등, 2014) 지속적으로 보고되고 있으며, 간장은 소금에 의한짠맛 외에도 아미노산에 의한 감칠맛, 유리당에 의한 단맛, 유기산에 의한 신맛으로 구성되어 오래전부터 민족의 지혜가담긴 대두 발효식품으로 가장 대표적인 한국 고유의 맛을 이루어 왔다(Jeon 등, 2002).
대두 발효식품(된장, 청국장, 간장, 두유 등)에는 공통적으로 여성 호르몬과 화학적 구조가 매우 유사한 물질인 식물성 에스트로겐(배당체 및 비배당체 이소플라본)이 다량 함유되어 있다. 배당체 이소플라본은 대두 그 자체에 daidzin, genistin, glycitin 형태와 malonyl기가 결합된 형태의 malonyl-daidzin-genistin-glycitin으로 대부분 분포하고 있지만 이를 발효시킨 형태의 대두 발효식품에서는 배당체 이소플라본 함량은 대부분 감소하고, 이에 상응하여 비배당체 형태의 daidzein, genistein, glycitein의 aglycones 형태로 다량 증가하는 것으로 보고되었다(Hwang 등, 2018d). 이렇듯 대두 이소플라본은 대부분 배당체 함량의 분포도가 높으나, 배당체로부터 비배당체로의 함량과 존재 변화의 가장 큰 요인으로는 미생물발효이며, 가공조건(가열 온도, 대두 발아율, 품종, 숙성, 효소 활성 등)에 따라서도 이소플라본의 변화는 이루어진다(Hwang 등, 2018d). 현재 국내 식품의약품안전처에는 대두이소플라본을 비배당체로서(25-27 mg/day) 뼈 건강에 도움을 줄 수 있는 생리활성 2등급 소재로 등재되어 있다(Hwang 등, 2018a).
또한, 콩은 단백질이 풍부하여 발효 시 수많은 아미노산으로 분해되며 특히, 감칠맛의 주성분인 glutamic acid는 glutamate decarboxylase(GAD, 글루탐산 탈탄산효소) 활성에 의해 γ-aminobutyric acid(GABA, C4H9NO2)로 생합성되고 succinic acid로 대사된다(Hwang 등, 2018b). 또한, succinic acid 대사경로가 차단될 때에는 GABA의 농도가 증가하는것으로 보고되었고(Pyo, 2008), 이때 외부의 물리적 처리조건(기계적 자극, 온도, 산소결핍, 수분, 스트레스 등)은 GAD 활성을 유도하는 것으로 연구결과가 보고되었다(Pyo, 2008). 이러한 물리적 처리는 GABA 농도를 증가시킬 수 있으나, 약리작용을 나타내기에는 그 함량이 미비하다는 일부 연구결과도 보고되어 있어(Hwang 등, 2018d) 최근에는 미생물 제제를 활용한 GABA 증가 연구가 여럿 보고되었다(Hwang 등, 2018a; Hwang 등, 2018c). 이러한 GABA는 현재 혈압저하효능이 알려져 있어 기능성 식품 소재로서의 관심도 꾸준히고조되고 있다(Pyo, 2008). 특히, 본 연구에서 사용한 품종인대원콩은 장류용콩으로 가공적성이 높은 신품종 육성을 목표로 1986년에 우량계통을 선발하여 육성한 품종으로 1997년도에 최종적으로 농작물종자협의회로부터 장려품종으로 결정되어 대원콩으로 명명된 품종이다. 현재까지 대원콩 품종은 국가가 보증하는 보급종으로써 전국 농가에 가장 많이 보급된 품종 중 하나이다.
한편, Bacillussubtilis 그룹은 오래 전부터 유산균과 같이안전성이 확보된 GRAS(Generally Recongnized As Safe) 미생물로 여러 식품 등 자연계에 다양하게 분포하고 있다(Hwang 등, 2018a). 국내의 장류 관련 연구에 따르면 메주와장류의 미생물 동정과 분리 및 균총 다양성에 관한 연구 결과가 보고되어 있으며(Kim 등, 2014; Shin 등, 2014), 특히 장류 발효와 숙성에 관여하는 미생물과 각종 기능성 물질 생성에 관여하는 주요 미생물로 Aspergillus oryzae, Bacillus subtilis 및 Bacillus licheniformis, Bacillus pumilus 등이 분리된 결과가 다수 존재한다(Cho 등, 2009; Cho 등, 2011).
따라서 본 연구에서는 시판 된장과 간장에서 Bacillus 그룹을 분리한 후 청국장 발효 특성을 평가하였다. 즉, 분리한 Bacillus 균주들은 16S rRNA 염기서열 분석으로 동정하고, 효소 활성을 확인한 후 분리 균주를 종균으로 사용하여 청국장 제조 후 기능성 물질(phytoestrogen과 GABA)과 라디칼 소거 활성을 측정하여 이들 균주들의 발효 특성을 분석하였다.
재료 및 방법
청국장 제조를 위한 장류콩은 경남 밀양시 소재 농촌진흥청기능성작물부로부터 대원콩을 공급받아 사용하였고, Bacillus 그룹 균주 분리를 위한 시료인 된장과 간장은 경남 창원시소재 몽고식품㈜로부터 공급받아 사용하였다. 6종의 이소플라본 표준품은 daidzin, genistin, glycitin, daidzein, glycitein 및 genistein은 Sigma-Aldrich Co.(St, Louis, MO, USA)에서구입하였다. Folin-Cialteu reagent, diethylene glycol 2,4,6-azino-bis(3-ethylbenzthiazoline-6-sulphnoic acid)(ABTS), 2,2-diphenyl-1-picrydrazyl(DPPH), thiobarbituric acid(TBA) 및 trichloroacetic acid(TCA) 역시 Sigma-Aldrich Co.에서 구입하여 사용하였다. 추출물 제조와 항산화 활성과 기기 분석 등에 사용한 유기용매(methanol, acetonitrile, water 및 acetic acid 등)는 J.T.Baker(Philpsbug, NJ, USA)에서 구입하여 사용하였고, 이 외 기타 시약은 필요에 따라서 분석용 특급또는 1급을 구입하여 사용하였다.
각 장류(된장과 간장) 10 g을 0.85% NaCl 용액으로 현탁하여 영양한천배지에 0.1 mL씩 도말하여 37°C에서 24시간배양하였다. 배양된 수많은 집락들 중 Bacillus sp.와 형태학적으로 일치하거나 유사한 집락들의 형태적 차이를 이용하여 1차 선별한 다음, 다시 순수 분리하여 Bacillus sp. 균주들을선별 및 확보하였다. 선별된 균주들의 배양은 tryptic soy broth/agar(TSB/TSA, Difico, Becton Dicknson Co., Sparks, MD, USA) 배지를 사용하여 상황에 따라 액체 혹은 고체 배양하였다.
분리된 Bacillus sp. 균주들은 최종적으로 된장으로부터 10종, 간장에서는 8종이 선별되었다. 이들 균주들의 정확한 동정을 위해 16s rRNA 염기서열 분석을 Hwang 등(2018d)의방법을 토대로 일련의 과정을 수행하여 염기서열을 분석하였으며, 16s rRNA 유사성 값은 DNAMAN analysis system (Lynnon Biosoft, Quebec, Canada)을 사용하여 alignments 및 evolutionary distance로부터 계산하였다.
분리 균주들의 세포외 효소활성 측정은 Baek 등(2010)과 Oh 등(2010)의 논문을 참고하여 amylase, cellulose, xylanase, mannase, protease 및 esterase 효소로 진행하였다. Amylase 활성은 0.5% soluble starch 함유 TSA 배지에 각 균주 배양액(108 수준)을 접종하여 37°C에서 48시간 배양하고, Gram’s iodine 용액(iodine crystal 0.1 g, potassium iodine 0.2 g, DW 30 mL)으로 염색하여 starch 분해활성을 clear zone으로관찰하였다. Cellulase 활성은 0.5% carboxy methyl cellulose (CMC) 함유 TSA 배지에 각 균주를 접종하고, 0.1% congo red로 염색 후 1 M NaCl로 세척한 다음 plate 상에서 clear zone을 관찰하였다. Xylanase(0.5% brichwood xylan), mannase(0.5% locust bean gum), protease(1.0% skim milk), esterase(1.0% tributrin) 활성 역시 각각 TSA 배지에 균 접종후 congo red(0.1%)로 염색 후 1 M NaCl로 세척한 다음 plate 상에서 생성된 clear zone의 지름을 측정하였으며, 지름의 길이는 mm로 나타내었다.
청국장은 물에 불린 대원콩 1 kg을 사각형의 스테인리스스틸 용기에 가지런히 담은 후 121°C에서 1시간 동안 증자와살균 처리를 동시에 진행하였다. 증자된 콩에 미리 액체 배양해 둔 각각의 균주 배양액 5.0%를 접종하고, 그 위에 한지를덮은 다음 37°C에서 48시간 동안 발효하여 청국장을 제조하였다. GABA, 암모니아 및 이소플라본 및 항산화 활성 분석을 위해 동결 건조시켜 분말 형태로 제조한 후 -70°C에서 보관하면서 사용하였다.
각 선발 균주 이용 청국장의 생균수는 각각의 청국장 10 g과 멸균증류수 90 mL를 혼합하여 102-1010 수준으로 단계별로 희석 후 그 희석액 0.1 mL를 미리 제조한 TSA 배지에도말하여 펼친 후 37°C에서 24시간 배양 후 생성된 집락수를측정하여 CFU/mL로 나타내었다.
Lee 등(2019)의 방법에 따라 각 청국장 추출물(250 μL)과 5 mM 4-nitrophenyl-β-D-glucopyranoside(p-NPG)가 함유된인산완충용액(pH 7.0) 250 μL를 첨가하여 37°C의 환경에서 30분간 효소 반응을 유도하였다. 30분간 효소 반응 후에는 0.2 M glycin-NaOH(pH 1.05)를효소 반응 중지 용액으로써 500 μL를 각각의 반응물에 분주하고, 효소 반응 중지 후 분광광도계(UV-1800 240V, Shimadzu Corp., Kyoto, Japan)를 사용하여 402 nm에서 측정하였으며, 음성 대조구로는 완충용액을 사용하였다.
청국장의 유리아미노산 분석은 동결건조 분말 1 g에 HPLC water 5 mL를 가한 후 60°C에서 1시간 가수분해를진행하였다. 이 가수분해물에 10% 5 sulfosalicylic acid를 2 mL 가하고 4°C에서 2시간 방치시켜 단백질을 침전시키며, 5,000 rpm의 속도로 3분간 원심분리하여 상등액을 60°C에서감압 농축시켜 0.2 N lithium citrate buffer(pH 2.2) 2 mL로용해하고, 0.45 μm membrane filter(pore size 0.45 μm, Advantec MFS, Japan)로 여과한 후 자동아미노산 분석기(L-8900, Hitachi High-Technologies Corp., Tokyo, Japan)로분석하고 mg/100 g으로 나타내었다(Hwang 등, 2018c). 식품의약품안전처 건강기능식품 고시형 기능성 원료인 GABA와청국장 품질 중 냄새 지표로 사용되는 암모니아 함량을 표시하였다(Foodsafetykorea.go.kr).
추출물 제조는 각각의 청국장 동결건조 분말 10 g에 50% 발효 주정 90 mL를 가하고 상온(25°C)에서 24시간 교반시키고 원심분리하여 상등액만을 0.45 μm membrane filter로 각각 여과하여 제조하였다. 제조된 이 추출물은 총 phenolics, 이소플라본 분석과 항산화 활성 평가에 사용하였다.
폴리페놀 함량은 각 추출물 500 μL를 시험관에 분주하고, 25% 탄산나트륨(Na2CO3) 용액 500 μL를 첨가하고 3분간 1차 반응시켰다. 1차 반응 후 2 N Folin-Ciocalteu phenol 시약을 250 μL 첨가하여 37°C에서 1시간 발색 반응을 진행하였다. 발색된 청색 반응물은 3분간 원심분리(13,500 rpm)하여상등액만을 회수하여 분광광도계(UV-1800 240V, Shimadzu Corp.)로 측정하였다. Total phenolic 함량 계산은 gallic acid를 이용하여 작성된 표준 검량곡선로부터 함량을 산출하였다(Hwang 등, 2018a).
이소플라본 분석은 Lee 등(2019)이 최근 보고한 연구방법에 준하여 high performance liquid chromatography(HPLC, Agilent 1200 system, Agilent Technologies Inc., Waldbronn, Germany)로 정량 분석하였다. 분석에 사용된 컬럼은 Lichrophore 100 RP C18(Merck KGaA, 125 mm×4 mm, 5 μm, Darmstadt, Germany)을 사용하였으며, diode array detector(DAD)로 254 nm에서 3회 반복하여 측정하였다. Gradient는 0.1% acetic acid를 함유한 HPLC water(A)와 0.1% acetic acid를 함유한 acetonitrile(B)을 0%(0분), 10% (15분), 20%(25분), 25%(35분), 35%(45-50분)로 설정하였다. 각 샘플의 주입량은 20 μL로 설정하였고, 이동상 속도는 30°C에서 분당 1 mL의 유속을 유지하여 254 nm에서 배당체(daidzin, genistin 및 glycitin)와 비배당체(daidzein, genistin 및 glycitein) 각각 6종류를 검출하였다.
DPPH 및 ABTS 라디칼 소거활성은 Hwang 등(2018b)의연구논문에 게재된 것을 바탕으로 실시하였다. DPPH 라디칼 소거활성은 각각의 추출물(10 mg/mL) 0.2 mL를 시험관에 취하고, DPPH(1.5×10−4 M) 용액 0.8 mL를 가하여 암실에서 15분간 반응시켜 527 nm에서 흡광도(UV-1800 240V, Shimadzu Corp.)를 측정하였다. ABTS 라디칼 소거능은 메탄올(50 mL)에 ABTS 용액(7.4 mM)과 2.6 mM의 potassium persulphate를 1:1로 혼합하여 12-16시간 암실에서 ABTS 양이온을 형성시켰다. 이후 732 nm에서 흡광도의 값이 0.8±0.02가 되도록 메탄올로 조정하고, 조정된 ABTS 용액 0.9 mL에 각각의 추출물 0.1 mL를 가하여 정확히 3분후에 732 nm(UV-1800 240V, Shimadzu Corp.)에서 측정하였다. 한편, 모든 항산화(DPPH 및 ABTS) 활성은 각 추출물 대신증류수를 사용하여 첨가구와 음성 대조구간의 흡광도 차이를아래의 식에 대입하여 백분율(%)로 나타내었다.
결과 및 고찰
본 연구에서는 콩 발효식품인 된장(pH 5.52, 총산 1.02%, 염도 13.6%)과 간장(pH 4.73, 총산 1.48%, 염도 17.9%)에서 Bacillus 그룹을 분리하고, 1차적으로 형태학적 특성이 같거나 유사한 균주들을 그룹화한 후 16S rRNA 염기서열 분석을통하여 최종 분리 Bacillus sp.를 확인하였다. 된장에서 10종과 간장에서 8종을 확인하여 최종 18종류의 Bacillus sp.를선발하였다(Table 1).
16S rRNA 유전자 염기서열 분석 결과, 된장에서 분리된균주 중 MGD01은 기존 data base에 등재되어 있던 Bacillus cytotoxicus NVH391-98 균주와 99%의 유사성을 보였다. MGD02 균주는 Bacillus amyloliquefaciens TUL308 균주와 상동이 100% 일치하였다(Table 1). 분리 균주 MGD03, MGD04와 MGD05 균주는 각각 Bacillus licheniformis N34, DSM13과 BPRIST039 균주와 99% 일치하였다. MGD06, MGD07 및 MGD10 분리 균주들은 Bacillus subtilis와 99-100% 일치하였으며, MGD08과 MGD09 두 균주는 Bacillus sp.로 확인되었다(Table 1). 간장에서 분리된 균주들 역시 모두 Bacillus sp. 균주들로 최종 확인되었다. MGK01 및 MGK06은 Bacillus sp. 분리 균주들과 99% 이상의 상동성을 나타내었으며, 분리균주 MGK02, MGK 04, MGK05 및 MGK07는 Bacillus subtilis와 일치하였다. MGK03 및 MGK08은 각각 Bacillus amyloliquefaciens 및 Bacillus safensis 균주와 99-100% 일치하였다.
Oh 등(2010)의 제주 전통된장으로부터 세포 외 효소 활성이 우수한 균주들의 16s rRNA 유전자를 분석한 결과, 대부분 Bacillus sp.에 속하는 종으로 나타남을 보고하였다. Baek 등(2010)의 장류로부터 세포 외 효소 활성이 우수한 미생물을 분리한 결과, B. subtilis, B. amyloliquefaciens 및 B. licheniformis로 동정이 되어 본 연구 결과와도 일치하였다. 한편, 이들 균주 외에도 Bacillus pumilus 종류도 관여한다는 결과도 보고되었다(Cho 등, 2009). 이렇듯 된장 및 간장과 같은 장류식품에는 대부분 Bacillus sp. 종들이 분포하는 것은 이미 오래전부터 보고된 연구결과이다(Hwang 등, 2017a; Jo 등, 2011; Kim 등, 2015; Shin 등, 2014).
선발 균주들의 amylase, celluase, xylanase, mannase, protease 및 esterase 효소 활성을 측정한 결과는 Table 2에나타내었다. 된장에서 분리한 균주 중 MGD01 균주는 protease 효소 활성만이 있었고, skim milk(1.0%) plate 상에서 clear zone의 지름은 14.8 mm로 나타났다. MGD02 균주는 amylase(7.9 mm), cellulose(11.0 mm), xylanase(10.5 mm) 및 protease(16.9 mm)를 생성하였으나, mannase와 esterase는생성하지 않았다. 된장에서 분리한 균주들은 대부분 유사한효소 활성을 나타내었으며 특히, MGD07 균주는 xylanase 생성력이 다른 균주들에 비해 가장 우수하였고, plate 상에서 생성된 clear zone의 크기는 18.7 mm였다. 간장에서 분리한 균주들은 된장에서 분리한 균주들보다 여러 효소 활성이 전반적으로 우수한 것으로 나타났다. MGK01 균주는 xylanase (22.3 mm), 생성력이 가장 우수하였고, MGK02 균주는 esterase(12.0 mm) 생성력이 우수한 것으로 나타났다. 한편, MGK08 균주는 amylase 생성력이 없었고, MGK03 균주는 mannase 생성력이 미약하였다. Xylanase 생성력은 MGK06, MGK07 및 MGK08 균주의 경우 없거나 미약하였고, mannase 생성력 역시 없는 것으로 나타났다(Table 2).
All values are presented as the mean±SD of triplicate determinations. Size of the halos formed around bacterial colonies on agar media (mm).
된장, 간장 및 청국장 등은 발효 과정에서 여러 미생물 또는 효모, 곰팡이에 의해 각종 분해효소(amylase, protease, cellulose, lipase 등)가 생성된다(Ra 등, 2004; Ryu 등, 2003). 이렇듯 생성되는 각종 분해효소들로 인해 콩에는 발효 과정 중에 다양한 성분 변화가 일어나며, 대표적인 영양성분 변화의 예로는 단백질 및 올리고다당류 분해에 따른 아미노산과 유리당 조성 증가 현상이 있다(Baek 등, 2010; Ra 등, 2004). 영양성분 외에도 기능성 물질 변화로는 배당체 이소플라본으로부터 비배당체 이소플라본으로 전환되어(Hwang 등, 2017a; Hwang 등, 2018a; Hwang 등, 2018b; Hwang 등, 2018d), 항산화 활성(Cho 등, 2009; Cho 등, 2011; Shin 등, 2014) 및 혈전 용해(Baek 등, 2010; Oh 등, 2010) 등의 기능을 나타내는 2차 대사산물이 생성된다. 특히, Oh 등(2010)의 세포 외 효소 활성 연구에서는 제주 전통 된장으로부터 분리한 균주들이 2% skim milk 함유 영양배지상에서 amylase, cellulose, lipase 및 protease 효소 생성력이 우수하다고 보고하였고, 이들 균주는 모두 Bacillus sp.로 최종적으로 동정되어 본 연구와도 매우 유사하였다. Baek 등(2010)의 연구에서도 마찬가지로 전통장류에서 분리한 Bacillus sp.에 속하는 B. subtilis와 B.amyloliquefaciens 균주들이 대부분 각각의 plate 상에서 clear zone의 지름이 크게 형성되어 각종 효소(amylase, cellulose, lipase 및 protease) 생성력이 우수하다고 보고하였고, 이 연구 역시 본 연구와도 유사한 결과로 판단된다. 한편, 미생물(세균) 및 진균류의 경우 cellulose 혹은 hemicellose 등을 분해하여 그들 자신의 생육에 필요한 인자로써 이용하게 된다(Baek 등, 2010; Oh 등, 2010).
선발 균주로 제조된 청국장의 생균수, β-glucosidase 활성및 암모니아 함량을 비교 분석한 결과는 Table 3에 나타낸바와 같다. 된장에서 분리한 Bacillus sp. 등의 청국장 내 생균수는 13.13 log CFU/mL로 B. amyloliquefaciens MGD02의 생균수가 가장 많이 존재하였고, 된장에서 분리된 균주들로 제조한 청국장의 생균수는 평균 11.27 log CFU/mL 수준이었다. 한편, 간장에서 분리한 균주들 역시 청국장 내 생균수는 평균 11.90 log CFU/mL 수준으로 분리원(된장 및 간장)과 Bacillus sp. 균주 종류에 따른 차이점은 나타나지 않고모두 유사한 생균수를 보였다(Table 3). 한편, 제조된 청국장의 경우 선발 접종한 Bacillus 균주 이외에 Bacillus cereus와 Escheria coli 등의 다른 미생물은 검출되지 않았다(data not shown).
β-Glucosidase 활성은 된장에서 분리한 그룹 중에서는 B. licheniformis MGD05 균주로 제조한 청국장 추출물에서 24.08 unit/g으로 가장 높은 활성도를 보였다. 간장에서 분리한그룹 중에서는 B. subtilis MGK04 균주에서 24.35 unit/g으로가장 활성도가 높았으며, β-glucosidase 활성은 18.24(unit/g)-23.84(unit/g)로 활성도를 나타내었다(Table 3).
암모니아 함량은 발효 균주에 따라 차이가 높았다. 특히, B. amyloliquefaciens MGD02(77.52 mg/g) 균주 이용 청국장에서 가장 낮은 함량을 나타내었고, B. subtilis MGK05 균주이용 청국장이 273.63 mg/g으로 암모니아 함량이 가장 많이검출되었다.
된장, 간장 및 청국장과 같은 장류 발효식품 제조의 주 원료인 콩은 미생물에서 유래되는 amylase와 protease와 같은효소들에 의해 당과 펩타이드 및 아미노산으로 분해된다(Lim과 Song, 2010). 이로 인해 된장, 간장 및 청국장은 숙성됨에 따라 유리아미노산 함량이 증가하여 결과적으로 구수한맛과 감칠맛이 형성되며, 이는 장류의 품질을 평가하는 지표로 사용된다(Lim과 Song, 2010; Hwang 등, 2017a; Hwang 등, 2017b).
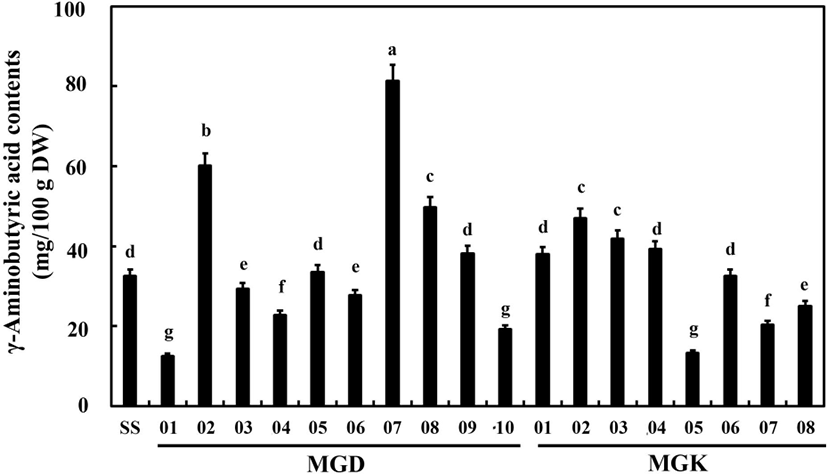
선발 균주로 제조된 청국장의 GABA 함량을 분석한 결과는 Fig. 1과 같았다. 발효를 시키지 않은 증자콩(SS, steamed soybean)에서는 GABA 함량이 32.50 mg/100 g이 검출되었다. MGD01 균주로 발효한 청국장 추출물에서는 GABA 함량이 12.56 mg/100 g으로 모든 청국장 추출물 중 가장 낮은함량이 검출되었다. 된장에서 분리한 균주 중 MGD07 균주는 81.33 mg/100 g으로 청국장 발효 시 가장 큰 폭으로 GABA 함량이 증가하였고, 뒤를 이어 MGD02(60.16 mg/100 g), MGD08(49.79 mg/100 g) 및 MGD09(38.22 mg/100 g) 균주이용 청국장에서 GABA 함량이 증자콩에 비해 높게 검출되었다. 간장에서 분리한 균주 중에서는 MGK02 균주로 발효한청국장이 47.04 mg/100 g으로 함량이 가장 많았고, MGK03 (41.85 mg/100 g), MGK04(39.24 mg/100 g), MGK01(37.95 mg/100 g), MGK06(32.57 mg/100 g), MGK08(25.03 mg/100 g), 및 MGK07(20.37 mg/100 g) 균주 순으로 GABA 함량이높았고, MGK05 균주는 13.29 mg/100 g으로 가장 낮은 함량이 검출되었다.
GABA 생합성 경로는 이미 오래 전 문헌에서 밝혀진 바와같이 미토콘드리아에서 aminotransferase 및 succinate semialdehyde dehydrogenase에 의해 succinic acid로 전환되며, 종래에는 TCA cycle에서 대사되고(Erlander와 Tobin, 1991; Shelp 등, 1999), glutamate decarboxylase(GAD) 작용을 받아 최종적으로 GABA가 생합성된다. 이때 GAD 효소작용을촉진시키는 주요 인자는 pH, Ca2+, calmodulin 등으로, 식물세포 내 칼슘과 수소이온 농도를 증가시켜 GABA 농도를 증가시키는 것으로 보고되어 있다(Hwang 등, 2018b; Hwang 등, 2018d). 특히, 식물 내에서의 여러 효소작용에 의한 GABA 생합성 과정 외에도 미생물에 의한 GABA 생합성 결과도 다수 보고된 바 있다. Hwnag 등(2018d)의 GABA 생성유산균 분리 연구에서 Lactobacillus brevis 균주들은 glutamic acid(GA) 또는 mono sodium glutamate(MSG) 존재하에서 GA→GABA로의 농도 증가가 일어남을 보고하였고, 이는 유산균들이 생성하는 GAD에 의한 것임을 보고하였다. 또, 다른연구 중에서는 본 연구의 청국장과 유사한 장류 식품은 여주첨가 간장(Hwang 등, 2017b) 및 된장(Hwang 등, 2017a) 연구 역시 발효(숙성) 전에 비해 발효 후 GABA 농도가 증가하였다. 이처럼 GABA의 농도 증가 현상은 각종 효소들이 관여하며, 크게 GA와 GABA와의 상관관계가 밀접한 것으로 사료된다. 이미 보고된 Hwang 등(2018d)의 GABA 생성 유산균 연구에서는 GA가 감소함에 따라 GABA가 증가하였고, Hwang 등(Hwang 등, 2017a; Hwang 등, 2017b)의 여주 간장과 된장에서는 각각 숙성 과정 중 GA와 GABA 모두 증가하는 결과를 나타내 유산균과 Bacillus 등의 발효균주 종류와 발효 기질 종류가 GABA 농도 증가에 가장 크게 작용하는것으로 판단된다. 그러므로 본 연구에서 된장과 간장에서 분리한 Bacillus로 제조한 청국장 추출물에서의 GABA 농도 증가 결과는 SS에 비해 GABA 함량이 낮았던 몇몇 균주들을제외하고는 대부분의 균주들은 GAD 효소활성이 있는 것으로 사료된다.
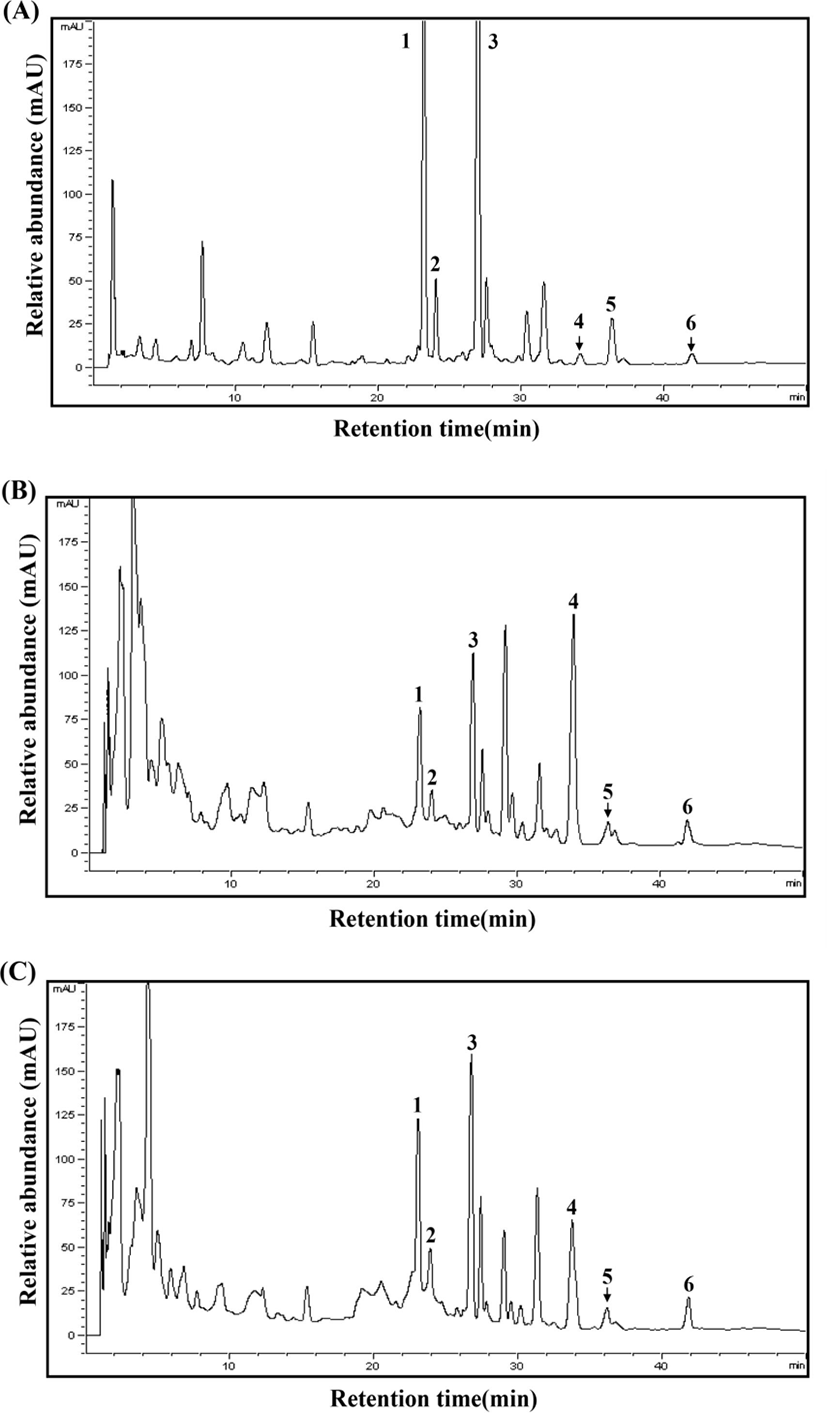
각 분리원(된장 및 간장)으로부터 분리 및 선발된 균주들로 제조한 청국장 추출물의 식물성 에스트로겐 분석결과는함량표와 HPLC 크로마토그램으로 각각 Fig. 2와 Table 4에나타내었다. 분석결과, 총 6종의 daidzin(peak 1), glycitin (peak 2), genistin(peak 3), daidzein(peak 4), glycitein(peak 6), genistein(peak 7) 화합물이 검출되었다(Fig. 2). SS에서는 daidzein(519.37 μg/g), glycitin(221.51 μg/g), genistin(527.85 μg/g)이 주요 화합물이었고, daidzein(12.55 μg/g), glycitein (30.41 μg/g), 및 genistein(8.64 μg/g) 화합물은 상대적으로낮은 함유량을 나타내었다(Fig. 2A 및 Table 4). 한편, SS를제외한 선발 균주 이용 모든 청국장 추출물의 경우 daidzin (peak 1)과 genistin(peak 3) 함량이 감소하였고, 이에 상응하여 daidzein(peak 4) 및 genistein(peak 6) 함량이 크게 증가하였고(Fig. 2B), glycitin(peak 2) 및 glyitein(peak 5) 함량은 큰변화가 없었다. MGD01 균주로 제조한 청국장의 daidzin, glycitin 및 genistin의 배당체 총 함량은 771.83 μg/g으로 이는 SS의 배당체 총 함량(1,268.73 μg/g)과 비교하였을 시 감소폭이 수치상 가장 낮은 것으로 나타났으나, MGD02(673.21 μg/g), MGD03(696.81 μg/g), MGD04(672.97 μg/g), MGD05 (633.41 μg/g), MGD06(686.04 μg/g), MGD07(693.29 μg/g), MGD08(721.98 μg/g), MGD09(705.15 μg/g), MGD10(761.38 μg/g) 균주 이용 청국장들 역시 감소된 배당체 총 함량은 유사하였다. 간장에서 분리한 균주들로 제조한 청국장 역시 배당체(peak 1, 2, 3) 총 함량은 SS에 비해 함량이 낮았으며, 629.64 μg/g(MGK02)-742.08 μg/g(MGK07) 수준이었고 평균 683.77 μg/g 수준으로 나타났다. 비배당체(peak 4, 5, 6) 형태인 daidzein, glycitein 및 genistein 함량은 배당체 함량변화와는 다르게 발효됨에 따라 크게 증가하는 것으로 나타났으며, 이들 화합물 중 daidzein이 가장 많이 증가하였다. SS에서는 daidzein(12.55 μg/g), glycitein(30.41 μg/g) 및 genistein(8.64 μg/g)의 총 함량은 51.60 μg/g으로 낮은 함량을 보였으나, 모든 청국장 추출물에서는 217.15 μg/g-312.62 μg/g으로 크게 증가하였다. 특히, 된장에서 분리하고 선발된균주 중 MGD05 균주 이용 청국장 추출물에서 daidzein (249.78 μg/g), glycitein(39.23 μg/g) 및 genistein(23.61 μg/g) 총 함량이 312.62 μg/g으로 가장 많았으며(Fig. 2B), 간장에서 분리한 균주 중에서는 MGK04(305.55 μg/g) 균주 이용 청국장 추출물에서 가장 많이 증가하였다(Fig. 2C).
된장과 청국장의 원료인 콩은 숙성이나 발효 과정 동안에이소플라본(식물성 에스트로겐) 및 폴리페놀 함량이 증가하고 단백질 감소에 따른 여러 아미노산 증가 등의 영양성분변화에 따라 항산화 활성이 증가한다(Park 등, 2005). 특히, 이소플라본 변화는 콩 연구에서는 가장 많이 보고된 결과로써, 원료콩에 대부분 함유되어 있는 포도당 결합(daidzim, genistin, glycitin) 및 말로닐 결합(malonyl-daidzin, -genistin, -glycitin) 형태는 콩의 숙성이나 발효 중에 포도당과 말로닐기가 해체된 아글리콘(daidzein, genistein, glycitein) 형태로변환된다(Hwang 등, 2017a; Hwang 등, 2018a; Hwang 등, 2018d). 이는 숙성 및 발효에 관여하는 미생물(Bacillus, 유산균 등)이 생성하는 β-glucosidase 활성 또는 산성물질에 의한것이다(Hwang 등, 2018c). Ku 등(2014)은 전통 된장 숙성기간에 따른 이소플라본 연구에서 숙성 1년 이상된 된장에서는배당체 형태의 이소플라본은 검출되지 않는 반면, 비배당체형태 이소플라본이 검출됨을 보고하였으며, 특히 비배당체중 가장 많이 검출된 이소플라본은 genistein이라 보고하였다. Ku 등(2014) 등의 연구결과에 따르면 genistein은 각 시료중에서 60% 이상의 점유율을 나타내었고, daidzein은 25% 이상을 차지하였으며, glycitein이 가장 낮음을 보고하였다. 한편, 본 연구에서는 모든 청국장 추출물에서 daidzein 함량이가장 높았고, 다음으로 genistein 함량이 높았음으로 Ku 등(2014)의 연구결과와는 약간 상이한 결과를 나타내었다. 그러나 발효 전 과정 중 glycitein 함량은 크게 변화가 없어 이결과는 Ku 등(2014)과도 유사한 것으로 사료된다. 된장과 청국장 외 이와 유사한 식품으로는 콩 우유 및 콩 요구르트 등의콩 발효물에 대한 연구결과도 다수 존재하며 특히, Hwang 등(2018d)의 유산균 이용 콩 분말 두유 발효 중에는 daidzein과 genistein 함량이 동시에 크게 증가하였고, glycitein 함량에는큰 변화가 없었고, 이와 유사한 연구 중 하나인 Hwang 등(2018c)의 콩 요구르트 연구 역시 glycitein은 발효 전 과정중 큰 변화가 없었으나, daidzein과 genistein은 동시에 크게증가하였다. Kim 등(2014)의 청국장 발효에서는 glycitein과 genistein보다 daidzein 함량이 가장 크게 증가하였고, Cho 등(2009)의 청국장 연구에서는 상기 보고된 결과와는 다르게 발효 중에 오직 daidzein 함량만 증가하였고, glycitein과 genistein은 원료콩에서부터 함유되어 있지 않거나 혹은 발효중에 모두 분해되어 검출되지 않는 결과를 보고하였다. 이렇듯 각기 다른 양상을 보이는 것은 연구에 사용된 콩의 종류나품종 차이일 것으로 사료되지만, Hwang 등(Hwang 등, 2018c; Hwang 등, 2018d)의 콩 발효에 사용된 미생물은 유산균이며, Kim 등(2014)과 Cho 등(2009)의 청국장 발효에 사용된 미생물은 각각 B. amyloliquefaciens 및 B. pumilus로 발효에 투입되는 미생물 종류와 이들이 생성하는 효소활성도에 따른 차이가 가장 큰 요인으로 작용하는 것이라 판단된다.
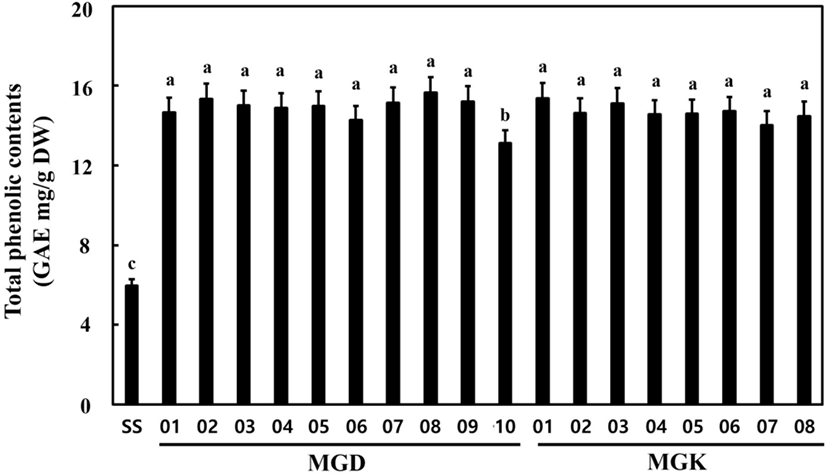
각 청국장 추출물의 폴리페놀 함량은 Fig. 3 및 항산화 활성(DPPH 및 ABTS)은 Fig. 4에 나타내었다. 폴리페놀 함량은 Fig. 3에 나타낸 바와 같이 SS(5.98 mg/g)보다 숙성·발효 시 모두 증가하는 것으로 나타났다. MGK10 균주 이용청국장 추출물에서의 폴리페놀 함량은 13.11 mg/g으로 가장낮은 함량을 나타내었고, MGK08 균주 이용 청국장 추출물에서는 15.65 mg/g으로 수치상 가장 많은 함량을 나타내었으나, 폴리페놀 함량은 모두 유사한 수치를 나타내었고, SS에비해 숙성과 발효 시 그 함량이 증가하는 공통적인 결과를얻을 수 있었다(Fig. 3).
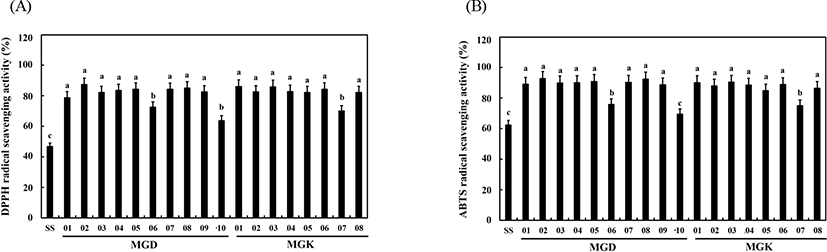
DPPH 라디칼 소거활성의 경우에도 마찬가지로 SS 추출물은 46.75%를 나타낸 반면, 이를 제외한 모든 청국장 추출물에서는 모두 항산화 활성이 증가하는 경향을 보였다. 가장낮은 활성을 보인 것은 된장 분리원 중에서는 MGD10 (63.74%)이었고, 간장 분리원 중에서는 MGK07(69.98%)이었다. 한편, DPPH 라디칼 소거활성은 72.47-87.34%의 범위로 나타나 대부분의 청국장 추출물은 우수한 라디칼 소거활성을 보였다(Fig. 4A). ABTS 라디칼 소거활성 역시 DPPH 라디칼 소거활성과 정확히 경향이 일치하였다. SS(62.41%)와 비교하였을 시 MGD10, MGK07 이용 청국장 추출물에서는 각각 69.55 및 74.97%로 라디칼 소거활성 증가폭은 크지않았다. 나머지 추출물에서는 SS에 비해 비교적 증가폭의 차이가 있었고, MGD06(75.77%) 청국장을 제외하고는 80-90%가 넘는 우수한 라디칼 소거활성을 나타내었다(Fig. 4B).
청국장과 같은 장류 식품은 지방의 산화과정, 당 분해 과정에 의해 콩에 함유된 비타민 E, 이소플라본 물질 등과 숙성및 발효과정 중 단백질 분해에 따라 아미노산, 펩타이드, 폴리페놀 성분들이 용출되어 항산화 활성에 기여하는 것으로보고되고 있다(Cho 등, 2009; Cho 등, 2011; Kim 등, 2014). 특히, 일반적으로 항산화 활성을 전자공여능 원리로만 설명할 순 없으나, 각 청국장 추출물에 함유된 수많은 항산화성물질들이 자동산화 과정 중에 생성되는 RO·, ROO· 등의라디칼에 전자를 제공하는 능력이 중요하다(Cho 등, 2019). 따라서 본 연구에서 DPPH와 ABTS 라디칼 소거활성이 큰차이를 보이지 않았고, 이는 항산화성 물질이 발효 균주에 기인한 것이 아닌 대두 즉, 청국장 자체에 함유된 성분들에 의해 항산화 활성이 유사하게 나타난 것으로 판단된다.
본 연구에서는 청국장 종균으로 사용할 수 있는 균주를 탐색하기 위해 된장과 간장으로부터 18종의 Bacillus sp.를 분리한 후 이들 분리균을 종균으로 청국장을 제조한 후 발효특성을 분석하였다. 그 결과, 암모니아 생성량 적고 GABA와 비배당체 이소플라본 생성이 우수한 B. amyloliquefaciens MGD02와 B. subtilis MGK02 두 균주는 향후 이취가 저감되고, 기능성 성분이 증진된 청국장 제조의 종균으로 사용 가능할 것으로 판단된다.
