서 론
발효 식품은 “특정 미생물의 성장과 효소의 작용을 통해 성분이 전환된 식품이나 음료”로 정의된다(Dimidi 등, 2019). 육류, 어류, 유제품, 채소류, 두류, 곡류 등 다양한 식재료가 발효 식품 제조에 이용되고 있고, 발효에 관여하는 미생물의 종류, 영양 성분, 환경 등의 조건에 따라 다양한 발효 식품이 제조된다(Dimidi 등, 2019). 인류의 역사상 오래 전부터 이용되어 온 발효 식품은 제조 과정 동안 유용 미생물에 의해 유기산, 알코올 및 박테리오신 등의 항균 물질이 생산되어 유해 미생물의 오염 위험과 증식이 억제됨으로써 저장성이 연장되고, 향미나 조직감과 같은 관능학적 특성과 기호도가 향상된다(Dimidi 등, 2019). 많은 유익균은 발효 과정 동안 식품 원료를 구성하는 화학 성분을 전환시켜 영양분의 생체이용률을 높이고, 생물학적 보존제로서 식품의 안전성을 강화시키며, 독성 물질 및 영양 저해 인자의 분해 및 생리활성 물질을 생산하는 것으로 보고되고 있다(Tamang 등, 2016). 게다가 발효 스타터 미생물의 대사 산물들은 심혈관 및 위장관 질환, 암, 알레르기, 골다공증, 유당불내증 및 당뇨 등 각종 질병 예방의 효과도 밝혀지고 있다(Tamang 등, 2016).
이에 반해 다양한 기능성과 유용성이 알려진 발효 식품일지라도 우리의 건강을 위협하는 독성 물질인 바이오제닉 아민(biogenic amines, BA)의 생성량이 상당히 높다는 점에 주목해야 한다. BA는 발효에 관여하는 미생물에 의해 전구체 아미노산의 탈탄산화 혹은 아미노산의 아미노기전이효소 활성으로 인한 알데히드와 케톤의 아미노기 전이반응에 따라 생성되는 저분자 유기화합물이다. BA는 호르몬, 알칼로이드, 핵산 및 단백질 합성을 위한 전구체인 질소원으로서 체온 조절, 영양분 흡수 및 혈압 강하 등의 생명 유지를 위해 필요하므로 소량의 BA 섭취는 건강에 유해하지 않다(Tamang 등, 2016). 하지만 유전적 결함, 위장 질환이나 모노아민 산화효소 억제제와 같은 약물 복용 등에 의하여 아민 산화효소의 활성이 낮으면 히스타민 과민증을 유발하게 된다(Tamang 등, 2016). 또한, 과도한 양의 BA 섭취 시 호흡곤란, 오심, 두통, 발진 및 혈압 상승 등의 세균성 식중독과 유사한 증상을 초래하게 된다(Ladero 등, 2010).
우리나라 대표적인 발효 식품의 하나인 김치는 다량의 비타민, 무기질 및 기타 기능성 성분을 생산하여 항암, 항산화, 항동맥경화, 항당뇨 및 항비만 등 건강에 이로운 여러 가지 활성을 발휘한다(Park 등, 2014). 김치 발효의 주체인 유산균은 프로바이오틱 활성으로 인하여 장 기능 개선, 항염증, 항균, 항콜레스테롤, 항노화 활성 및 면역 기능 강화 효과를 나타낸다(Zhao 등, 2019). 하지만 김치와 같은 발효 채소류에는 미생물의 증식과 탈탄산 효소의 활성에 따라 상당량의 BA가 검출되고 있다(Montet 등, 2014). Leuconostoc mesenteroides 등은 채소류의 유산 발효에 관여하는 대표적인 유산균으로 일부 아미노산을 탈탄산화 시켜 BA를 생성하는 것으로 확인된 바 있다(Garcia-Ruiz 등, 2011). Mah 등(2004)은 시판되는 8종의 김치로부터 푸트레신, 카다베린, 히스타민 및 티라민 등의 BA가 검출되었음을 확인하였고, 이는 부재료인 액젓이 유해 아민 생성에 중요한 역할을 한다고 설명하였다. 또한, 파김치와 갓김치로부터 분리된 Lactobacillus brevis가 티라민, 베타-페닐에틸아민, 푸트레신 및 카다베린 등을 생성하는 원인균인 것으로 확인된 바 있다(Lee 등, 2019). 반면 Lactobacillus plantarum CAU3823은 아민 산화효소를 생산함으로써 중국 쌀 와인의 발효 후기에 BA 함량을 약 40% 감소시켜 발효 식품의 독성 위험을 유의하게 낮춘 것으로 알려졌다(Niu 등, 2019). BA의 생성 및 분해능은 유산균뿐만 아니라, 효모에 의해서도 확인되었는데, 발효 유제품으로부터 분리된 Debaryomyces 속, Yarrowia 속, Candida 속, Kluyveromyces 속, Saccharomyces 속 등의 효모도 BA를 생성하는 것으로 알려진 바 있다(Benkerroum, 2016). 하지만 Baumlisberger 등(2015)은 Debaryomyces hansenii H525와 Yarrowia lipolytica 등의 일부 효모로부터 BA 분해능이 밝혀져 BA의 감소를 위한 스타터로서의 활용 가치가 높다고 보고하였다.
지금까지 유제품이나 두류 가공품 등 단백질 함량이 높거나 김치 등의 발효 채소류 내에 존재하는 유산균과 효모가 BA 함량에 미치는 영향을 조사한 연구 결과는 다수 보고되었다(Doeun 등, 2017; Spano 등, 2010). 일반적으로 발효 기간이 길어짐에 따라 BA 함량은 증가되는 것으로 알려져 있음에도 불구하고(Um 등, 2016), 오랜 기간 숙성시킨 묵은지 내 BA의 함량 및 분리된 유산균과 효모의 BA 생성 및 분해능에 관한 연구 결과는 부족하다. 따라서 본 연구에서는 김치 제조 시 첨가된 젓갈별 묵은지로부터 분리된 유산균과 효모의 BA 생성 및 분해능을 측정하고, 분해 활성을 나타내는 균주의 발효식품 스타터로서의 활용 가능성 평가를 위한 프로바이오틱 활성을 조사하였다.
재료 및 방법
전통 시장에서 구입한 배추는 반으로 자른 다음 배추 1 kg 당 10%(w/v) 천일염 용액에 담궈서 상온에 두고 약 15시간 침지시켰다. 흐르는 수돗물로 3회 깨끗하게 헹군 다음 3시간 가량 방치하여 물기를 제거하였다. 고춧가루(3.5%), 마늘(2.5%), 생강(0.5%), 양파(3.0%), 찹쌀풀(3.0%) 및 젓갈(2.5%)을 혼합하고, 분쇄기(SMKANB-4000, PN, Ansan, Korea)로 곱게 갈아서 만든 양념을 절임 배추(85%)에 골고루 묻혀 김치를 담궜다. 젓갈은 전통 시장에서 구입한 까나리와 멸치 액젓 및 새우젓갈을 각각 사용하였다. 담근 김치는 상온에서 하룻밤 정도 방치한 다음 2°C 냉장고에서 12개월간 보관하여 제조한 묵은지를 실험에 사용하였다.
시료 50 g에 인산완충용액(phosphate buffer saline, PBS, pH 7.0) 450 mL를 가한 다음 약 3분간 스토마커(3 M, Maplewood, MN, USA)로 균질화한 시료 용액을 1% (w/v) CaCO3가 첨가된 Lactobacilli MRS agar(BD Difco Co.) 평판배지에 도말 접종하고 37°C에서 48시간 배양하였다. 집락 주변에 투명한 환을 생성하는 균주를 선발하여 MRS agar(BD Difco Co., Sparks, MD, USA) 평판배지 상에서 순수 분리 배양하였다. 유산균은 Lim(2016)의 방법에 따라 DNA extraction kit(Qiagen, Hilden, Germany)로 균주의 DNA를 추출 정제한 후 27F(5’-AGAGTTTGATCCTGGCT CAG-3’)와 1492R(5’-GGTTACCTTGTTACGACTT-3’) 프라이머를 사용하여 중합효소연쇄반응(polymerase chain reaction, PCR, Bio-Rad Laboratories Inc., Foster City, California, USA)으로 초기 변성(94°C, 3분), 변성(94°C, 2분), 풀림(42°C, 1분), 신장(72°C, 2분), 연장(72°C, 7분) 순으로 36회 반복시켜 DNA를 증폭시켰다. PCR 산물은 purification kit(Qiagen)로 정제한 후 National Center for Biotechnology Information (NCBI)의 BLAST search(http://www.ncbi.nlm.nih.gov)를 통해 유전자 염기서열을 분석하고 상동성을 비교하여 동정하였다.
앞서 균질화한 시료 용액을 Yeast Glucose Chloramphenicaol(YGC) agar(BD Difco Co.) 평판배지에 도말 접종하고, 25°C에서 48시간 배양하여 생성된 집락을 YPD(yeast extract 1%, peptone 2%, dextrose 2%, agar 2%, w/v) 배지에서 순수 분리 배양한 효모는 Min 등(2012) 방법에 따라 동정하였다. 즉, YPD broth에 접종하여 30°C에서 24시간 동안 배양한 후 원심분리(7,000 ×g, 10분, 4°C)하였다. 세포를 TE buffer(10 mM Tris-HCl, pH 8.0; 1 mM EDTA)에 현탁시켜 genomic DNA purification kit(Promega, Madison, WI, USA)로 주형 DNA를 제조하였다. PCR에 사용될 26S rDNA의 D1/D2 도메인을 증폭시키기 위해 NL-1(5’-GCATATCAATAAGCGGA GGAAAAG-3’)과 NL-4(5’-G GTCCGTGTTTCAAGACGG-3’) 프라이머, ITS1/5.8S rDNA/ ITS2 도메인은 ITS-1(5’-TC CGTAGGTGAACCTGCG-3’)과 ITS-4(5’-TCCTCCGCTTA TTGATATGC-3’) 프라이머를 사용하였다. PCR Thermal cycler(Bio-Rad Laboratories Inc.)에서 초기 변성(94°C, 3분), 변성(94°C, 2분), 풀림(42°C, 1분), 신장(72°C, 2분), 연장(72°C, 7분) 순으로 36회 반복시켜 DNA를 증폭시켰다. PCR 산물은 purification kit(Qiagen)로 정제한 후 NCBI의 BLAST search를 통해 유전자 염기서열을 분석하고 상동성을 비교하여 동정하였다.
순수분리 및 동정된 유산균과 효모의 BA 생성능은 Eerola 등(1993)과 Mah 등(2003)의 방법에 따라 측정하였다. MRS broth에서 배양된 유산균 전 배양액(0.1 mL)은 BA 생성을 위한 합성배지(1 L당 meat extract 8 g, tryptone 5 g, yeast extract 4 g, glucose 1.5 g, fructose 1 g, Tween 80 0.5 g, MgSO4 0.2 g, FeSO4 0.04 g, MnSO4 0.05 g, CaCO3 0.1 g, tyrosine 2 g, histidine 2 g, ornithine 2 g, lysine 2 g, pyridoxal 5-phosphate 0.25 g, pH 5.5) 상에서 28°C, 5일간 배양하였다. 한편, 효모는 YPD broth에 접종한 후 배양시켜 얻은 전 배양액(0.1 mL)을 유산균과 동일한 BA 생성 합성배지 상에 접종한 다음, 28°C, 5일간 배양하였다. 유산균과 효모의 배양액은 원심분리(7,000 ×g, 10분)하여 상등액만 취해 여과 제균한 다음 Han 등(2007)의 방법을 일부 변형하여 BA 함량을 측정하였다. 즉, 시료(5 g)에 0.1 N HCl(20 mL)을 가하여 균질화 한 다음 원심분리(7,000 ×g, 20분)하여 상등액을 회수하였다. 침전물은 반복 조작을 통해 최종 50 mL에 맞춰 시료 용액으로 사용하였다. 여과 제균(0.45 μm membrane filter, Millipore Co., Bedford, MA, USA)한 시료 용액에 BA 혼합 표준 용액(cadaverine, histamine, putrescine, tyramine, 500 mg/L)과 0.4 M perchloric acid (Merck, Kenilworth, NJ, USA, 9 mL)를 첨가한 다음 진탕 혼합 후 원심분리(3,000 ×g, 10분)하였다. 상등액을 모아 여과(Whatman paper No.1, Piscataway, NJ, USA)하고, 그 여액(1 mL)에 2 N sodium hydroxide(200 μL)와 sodium bicarbonate 포화 용액(300 μL)을 가하고 아세톤에 용해시킨 dansyl chloride(Sigma-Aldrich, 10 mg/mL, 2 mL)를 첨가하여 40°C에서 약 45분간 반응시켰다. 25%(v/v) ammonium hydroxide(100 μL)를 가해 잔존하는 dansyl chloride를 제거하고, 상온에서 약 30분간 방치하였다. Acetonitrile을 가하여 최종 5 mL에 맞춘 다음 원심분리(2,500 ×g, 5분)하여 얻은 상등액은 0.22 μm membrane filter(Millipore)로 여과하여 dansyl 유도체화 시켰다. Nova-Pak C18 컬럼(150×3.9 mm, 4 μm, Waters, Milford, MA, USA)을 연결한 HPLC (Shimadzu, Kyoto, Japan)로 시료 내 BA 함량을 측정하였다. 이동상 A 용액으로는 0.1 M ammonium acetate와 B 용액으로는 acetonitrile을 사용하였고, 시료 10 μL를 주입하여 유속은 1 mL/min으로 조정하였으며, 컬럼 온도 40°C에서 분석하였다.
유산균과 효모의 BA 분해능은 Lee 등(2015)의 방법에 따라 측정하였다. 유산균은 MRS broth에서 37°C, 24시간, 효모는 YPD broth에서 30°C, 24시간 동안 각각 배양하여 원심분리(7,000 ×g, 10분)하여 모은 세포를 PBS(pH 7.0)에 현탁시켜 초기 균수를 1.0×106 CFU/mL로 조정하였다. 세포 현탁액(1 mL)에 BA(cadaverine dihydrochloride, histamine dihydrochloride, putrescine dihydrochloride, tyramine hydrochloride, 0.1%, w/v)을 첨가한 MRS broth와 YPD broth에 유산균과 효모를 각각 접종한 후 30°C에서 5일간 전 배양하였다. 유산균과 효모의 배양액(1 mL)을 BA(50 ppm)가 첨가된 MRS broth와 YPD broth에 각각 접종하고, 30°C에서 48시간 동안 본 배양하였다. 배양액(1 mL)에 BA 혼합 표준용액(500 mg/L) 및 0.4 M perchloric acid(9 mL)를 첨가하여 진탕 혼합한 다음 원심분리(3,000 ×g, 10분)하였다. 상등액을 여과(Whatman paper No. 1, Whatman, Maidstone, Kent, UK)해서 앞서 언급한 방법으로 유도체화 후 HPLC로 잔존하는 BA의 함량을 측정하였다. BA 분해능(%) 계산식[(초기 BA 함량 - 잔존 BA 함량) / 초기 BA 함량 × 100]에 대입하여 측정하였다.
Lim(2019)의 방법에 따라 BA 분해능을 나타낸 균주는 증균용 액체배지에서 37°C, 24시간 배양하였다. 배양액을 원심분리(7,000 ×g, 10분, 4°C)하여 세포를 회수하고 PBS(pH 7.0)를 가하여 2회 세척하였다. 세포수는 1.0×108 CFU/mL로 조정하여 인공 위액[NaCl 125 mL, KCl 7 mM, NaHCO3 45 mM, 펩신(Sigma-Aldrich) 1 mg/mL, pH 2.0]에 접종한 다음 37°C에서 2시간 배양하였다. 배양액 내 잔존하는 균수는 배양용 평판배지 상에서 표준한천평판배양법으로 측정하였다. 한편, 인공 위액 내에서 잔존하는 세포수로 조정한 현탁액을 1.0%(w/v) bile salts(Sigma-Aldrich) 용액에 접종하였다. 37°C에서 3시간 배양한 후 배양용 평판배지 상에서 표준한천평판배양법으로 균수를 측정하였고, 인공위액 및 담즙액에서의 생존율(%)로 나타내었다.
Lim(2019)의 방법에 따라 장내 상피세포에 대한 부착능 조사를 위해 Caco-2 cell(Korean Cell Line Bank)을 사용하였다. Dulbecco’s modified Eagle’s minimal essential medium (DMEM, Sigma-Aldrich) 배지에 10% (v/v) fetal bovine serum(Gibco, Rockvile, MD, USA), 2 mM L-glutamine, 1 mM sodium pyruvate, 100 U/mL penicillin, 0.1 mg/mL streptomycin을 첨가한 다음 Caco-2 cell을 접종하고, 5% CO2, 37°C에서 monolayer를 형성할 때까지 배양하였다. DMEM 배지를 분주한 6-well culture plate (Falcon, Beckton Dickinson, Sparks, MD, USA)에 PBS(pH 7.0)로 세척한 Caco-2 cell(1.0×105 cells/mL)을 접종한 다음 동일한 조건에서 2시간 배양하였다. 균 배양액을 원심분리(7,000 ×g, 10분, 4°C)하고 PBS(pH 7.0)로 세척한 세포를 DMEM에 현탁하여 균수를 1.0×108 CFU/mL로 조정하고, 각 well에 접종하여 37°C에서 2시간 동안 배양하였다. Caco-2 cell에 부착되지 않은 BA 분해균을 제거하고 난 후 trypsin-EDTA 용액으로 탈착시켜 PBS(pH 7.0)로 세척한 후 배양용 평판배지 상에서 표준한천평판배양법으로 BA 분해 균수를 측정하였다.
BA 분해능을 나타낸 균주의 항생제에 대한 감수성은 최소억제농도(minimum inhibitory concentration, MIC)법(Bauer 등, 1966)으로 측정하였다. 증균 배양액은 원심분리(7,000 ×g, 10분, 4°C)를 통해 세포를 모아 PBS(pH 7.0)로 세척 후 세포수는 1.0×106 CFU/mL로 조정하였다. 50°C 전후로 식힌 고체배지(agar 1.0%, w/v)에 세포 현탁액(1%, v/v)을 접종하고 혼합한 후 평판배지 위에 중층하여 응고시켰다. 암피실린, 에리스로마이신, 카나마이신, 페니실린, 스트렙토마이신, 테트라사이클린 및 반코마이신 등의 항생제(Sigma-Aldrich) stock으로부터 2진 희석법으로 농도를 맞춘 다음 paper disc(Φ 8 mm, Toyo Co., Japan)에 50 μL loading하고, 균이 접종된 평판배지에 올렸다. 37°C, 24시간 배양 후 disc 주위에 저해환을 생성하는 항생제의 최소 농도를 측정하였다.
BA 분해균은 37°C에서 24시간 배양하여 얻은 배양액을 원심분리(7,000 ×g, 10분, 4°C)하여 배양 상등액만을 모은 뒤 6N NaOH로 pH 6.5에 맞추고 카탈라아제(1 mg/mL, Sigma-Aldrich)를 처리하였다. 50%(w/v) 황산암모늄을 첨가하고 4°C에서 교반하면서 overnight 동안 단백질을 침전시킨 다음 원심분리(12,000 ×g, 30분, 4°C)하였다. 침전물을 모아 20 mM PBS(pH 6.5)에 현탁시키고, 투석막(molecular weight cut-off = 1,000 Da, Spectrum, Laguna Hils, CA, USA)으로 4°C에서 24시간 동안 투석하였다. 황산암모늄 침전법으로 농축한 시료를 carboxy-methyl sepharose CL-6B(CM-Sepharose CL-6B, Pharmacia Biotech., Uppsala, Sweden) 양이온 교환 수지를 이용하여 부분 정제하였다. 즉, 20 mM Na-phosphate buffer(pH 6.0)로 평형화시킨 다음 CM sepharose CL-6B column(1.6×23 cm)에 투석한 용액(4 mL)를 주입하고 1 M Na-phosphate buffer(pH 6.0)로 linear salt gradient 방법으로 수지에 단백질을 용출시켜 분획(4.5 mL)을 회수하여 항균 활성을 측정하였다(Lee 등, 2005). 항균력 측정을 위한 지시 균주는 본 연구에 사용된 김치 시료로부터 분리된 BA 생성 유산균과 효모를 사용하였다. 이들은 MRS broth(BD Difco Co.)와 YM broth(BD Difco Co.) 각각의 증균배지에서 배양한 배양액을 원심분리(7,000 ×g, 10분, 4°C)하여 모은 세포를 PBS(pH 7.0)로 2회 세척하고, 세포수를 1.0×105 CFU/mL로 조정하였다. 조 박테리오신 용액은 증균배지 상에서 이진 희석하여 microtiter plate(Falcon, Beckton Dickinson)에 분주한 다음 지시 균주의 세포 현탁액을 접종하여 37°C에서 24시간 배양하였다. 대조구는 조 박테리오신 용액 대신에 PBS(pH 7.0)를 첨가한 후 배양하였다. 배양 후 microplate reader (BioTek, Inc., Seoul, Korea)로 600 nm의 파장에서 측정된 대조구 흡광도의 50%에 이르는 조 박테리오신 용액의 최대 희석배수 역수를 박테리오신 활성(arbitray units, AU)으로 계산하였다.
BA 생성량에 대한 박테리오신 용액의 영향은 Shakila 등(1996)의 방법을 일부 변형하여 측정하였다. BA 생성균은 0.0005% pyridoxal-HCl(Sigma-Aldrich)과 0.5% L-histidine monohydrochloride monohydrate, L-lysine monohydrochloride, L-ornithine monohydrochloride 혹은 L-tyrosine hydrochloride (Sigma-Aldrich)를 첨가한 Trypticase Soy Broth(TSB, BD Difco Co.)에 접종한 다음 35°C에서 24시간 배양하였다. 배양액(1 mL)을 박테리오신 용액(100 AU/mL)과 아미노산(50 ppm)이 첨가된 TSB(5 mL)에 접종 후 35°C에서 24시간 배양하였다. 배양액을 원심분리(7,000 ×g, 10분, 4°C)한 다음 상등액은 0.22 μm membrane filter(Millipore로 여과한 후 앞서 언급한 방법에 따라 HPLC를 사용하여 BA 생성량의 저해율(%)을 측정하였다.
결과 및 고찰
천일염 및 3종의 액젓과 젓갈로 담근 김치를 12개월 동안 발효시킨 묵은지로부터 분리된 BA 생성능 혹은 분해능을 나타낸 유산균과 효모의 동정 결과는 Table 1 및 Table 2와 같다. 천일염으로 제조 후 발효시킨 묵은지로부터 분리된 유산균과 효모는 각각 L. mesenteroides subsp. mesenteroides CML01(98.6%), L. plantarum CML02(99.0%) 및 Saccharomyces cerevisiae CMY03(97.0%)으로 확인되었다. 까나리 액젓을 첨가하여 발효시킨 묵은지로부터는 L. brevis KML11 (98.2%), Enterococcus faecium KML12(100.0%), Weissella confuse KML13(99.9%), Pediococcus pentosaceus KML14 (99.0%), E. faecium KML15 (97.0%), Zygosaccharomyces mellis KMY16(99.0%), Pichia fermentans KMY17(96.8%)로 확인되었다. 멸치 액젓을 첨가하여 발효시킨 묵은지로부터는 Lactobacillus fermentum MML21(100.0%), L. mesenteroides MML22(99.9%), Lactobacillus sakei MML23(98.3%), L. brevis MML24(97.5%), L. plantarum MML25(100.0%), Enterococcus faecalis MML26(100.0%), S. cerevisiae MMY27(98.3%), Pichia membranefaeciens MMY28(99.2%), Candida versatilis MMY29(100.0%)로 확인되었다. 새우젓갈을 넣어 발효시킨 묵은지로부터는 L. mesenteroides SML31(99.0%), L. brevis SML32(98.9%), L. plantarum SML33(100.0%), P. pentosaceus SML34(99.3%), L. sakei SML35(99.5%), D. hansenii SMY36(98.0%), P. membranefaeciens SMY37(99.9%)로 확인되었다. 분리된 유산균과 효모의 종류는 묵은지 시료에 따라 유의한 차이가 있었는데, 이는 김치 주·부원료 및 제조와 발효 환경의 차이에 기인하는 것으로 판단된다.
Park 등(2010)은 4°C에서 발효시킨 김치의 초기 단계의 주요 유산균으로는 W. koreensis와 L. brevis가 우점종으로 하였고, 묵은지 시료로부터는 Leuconostoc gelidum과 L. sakei subsp. sakei가 주를 이룬다고 밝혔다. Lee와 Lee(2011)는 L. mesenteroides, L. plantarum 및 L. sakei는 묵은지로부터 분리되는 대표적인 균종이라고 보고하였고, Seo 등(2014)도 묵은지로부터 E. faecium SH01을 분리한 바 있는데, 이와 같이 이전의 연구에서 분리된 김치나 묵은지의 유산균들은 본 연구 결과에서도 일부 동일하였다. 숙성 전에는 L. mesenteroides가 우점종인 반면, 발효 후기에는 Lactobacillus 속이 주요 유산균으로 분리된다고(Rhee 등, 2011) 알려졌는데, 본 연구에서는 까나리 액젓을 첨가하여 발효시킨 묵은지를 제외한 시료에서 L. mesenteroides가 발효 초기에서부터 오랜 기간 동안 유지되었는데, 이는 저장 온도(2°C)가 낮았기 때문인 것으로 보여진다(data not shown). 따라서 김치 내 우점종 유산균의 종류는 김치의 원료와 제조 환경 및 발효 조건에 영향을 받는 것으로 추정된다.
유산균과 달리 효모는 김치 발효 후반에 나타나기 시작하며, 펙틴 분해 효소를 분비함으로써 김치의 조직감을 악화시키고 이취를 발생시키기 때문에 김치 발효에 유해한 미생물로 간주되고 있다(Lee 등, 2018). 김치 내 효모수는 발효 초기에서 중기까지는 원료로부터 유입되어 일정하게 유지되다가 중기 이후부터 유산균수가 감소되기 시작하면서 점진적으로 증가되어 김치 내에 알코올, 글리세롤, 비타민 및 방향성 물질을 생산함으로써 독특한 풍미를 제공할 뿐만 아니라, 발효 후기에는 주로 산막효모가 증식함으로써 김치의 조직을 무르게 하는 연부 현상을 유발한다(Kang 등, 2019). 본 연구의 시료로부터 분리된 유산균수도 담근 직후에는 6.9±3.1 ×105-7.0±1.1×106 CFU/g 정도에서 발효가 진행됨에 따라 서서히 증가하기 시작하여 최대 균수는 발효 3-6개월에 이르렀다가 그 이후에는 서서히 감소되어 9개월 발효시킨 묵은지에서는 8.8±1.9×106-6.2±0.2×107 CFU/g 수준이었다. 하지만 효모는 발효 3개월부터 검출되기 시작하였고, 9개월된 묵은지에선 6.0±3.2×103-1.3±0.3×105 CFU/g으로 검출되었으므로(Lim, 2020) 기존 연구와 비슷한 경향으로 나타났다. Kang 등(2019)은 배추김치로부터 Brettanomyces claussenii, Candida bogoriensis, Candida cacaoi, Candida guilliermondii, Citeromyces matritensis, Kluyveromyces vaeronae, P. membranefacience, Rhodotorula glutinis, Saccharomyces bayanus, S. cerevisiae, Saccharomyces pretoriensis, Saccharomyces italicus, Torulopsis salmanticensis 등이 분리되었고, Pichia kudriazevii, Pichia kluyveri, Kazachstania exigua, Kazachstania pseudohumilis, Kazachstania servazzii, Candida sake, Y. lipolytica 등 김치 표면에 피막을 형성하는 산막효모들이 발효 후기에 분리되었다고 보고하였다. 본 연구에서도 이들 결과에서 분리된 효모와 일부 균종이 일치하였으며, 발효 기간이 길어짐에 따라 묵은지의 조직감이 물러지고 이취가 발생되었다(data not shown).
묵은지로부터 분리된 미생물의 BA 생성능을 측정한 결과는 Table 3과 같다. L. mesenteroides subsp. mesenteroides CML01은 히스타민을 562.3±13.6 mg/L 생성하였고, L. plantarum CML02로부터 카다베린 생성능(103.6±1.2 mg/L)이 확인되었다. L. brevis KML11은 다량의 카다베린과 티라민을 생성하였고, W. confuse KML13과 P. pentosaceus KML14로부터는 히스타민 생성능이 확인되었으며, E. faecium KML15는 히스타민뿐만 아니라 티라민도 생성하였다. L. mesenteroides MML22와 L. brevis MML24는 히스타민과 푸트레신을 생성하였다. 게다가 L. plantarum MML25는 다량의 히스타민과 티라민, E. faecalis MML26에 의해선 카다베린과 푸트레신의 생성능이 확인되었다. L. mesenteroides SML31은 히스타민, L. brevis SML32와 L. plantarum SML33은 카다베린을 생성하였고, L. sakei SML35는 푸트레신과 티라민을 생성하였다.
한편, S. cerevisiae CMY03은 히스타민(107.2±16.8 mg/L)을 생성하였고 Z. mellis KMY16은 카다베린(80.7±2.7 mg/L), P. fermentans KMY17은 히스타민(147.6±5.4 mg/L)과 티라민(99.3±11.0 mg/L), S. cerevisiae MMY27은 푸트레신(164.2±21.1 mg/L)을 생성하였다. P. membranefaciens MMY28은 카다베린(209.7±11.4 mg/L), C. versatilis MMY29는 히스타민(56.9±2.9 mg/L)과 티라민(76.5±2.2 mg/L)을 생성하였다. D. hansenii SMY36은 카다베린(66.7±6.0 mg/L), P. membranefaciens SMY37은 티라민(47.1±3.4 mg/L)을 생성하였다.
이상의 결과에서 볼 때 젓갈 종류별 묵은지에서 분리된 유산균과 효모의 균주에 따라 생성되는 BA의 종류와 생성량에는 유의한 차이가 있음을 알 수 있었다.
천일염보다는 액젓이나 젓갈을 첨가한 묵은지로부터 다양한 종류의 BA 생성 유산균 및 효모가 분리되었는데, 이는 액젓이나 젓갈 자체에 함유된 BA 생성균에 의한 것으로 추정된다. 본 연구에서 사용된 까나리 액젓(푸트레신: 5.4±1.2 mg/kg, 카다베린: 192.4±10.1 mg/kg, 히스타민: 316.7±5.8 mg/kg, 티라민: 12.4±1.7 mg/kg), 멸치 액젓(푸트레신: 331.9± 20.4 mg/kg, 카다베린: 221.6±16.9 mg/kg, 히스타민: 201.3± 0.9 mg/kg, 티라민: 8.9±0.2 mg/kg) 및 새우젓갈(카다베린 및 히스타민: 불검출, 푸트레신: 152.3±13.7 mg/kg, 티라민: 342.1± 22.4 mg/kg)로부터 BA가 검출(data not shown)되었으므로 이들 수산 발효 식품 내에는 BA 생성능이 있는 미생물이 존재하였으며, 결국 김치와 묵은지의 BA 함량에도 영향을 미친 것으로 판단된다. 본 결과와 유사하게 파와 갓 김치로부터 검출된 BA는 액젓으로부터 유래되는 것으로 보고된 바 있고(Lee 등, 2019), Tsai 등(2005)도 배추김치로부터 검출된 과량의 히스타민은 액젓의 첨가에 따른 것이라고 밝혔다.
Jin 등(2019)은 깍두기와 총각김치로부터 분리된 티라민을 생성하는 일부 유산균 중 김치의 숙성이 진행되는 동안 티라민의 양을 증가시키는 균주는 L. brevis로 동정되었는데, 본 연구에서도 천일염을 제외한 액젓과 젓갈을 첨가하여 제조한 묵은지로부터 L. brevis KML11, MML24 및 SML32가 분리되었으며, 이들은 티라민을 비롯하여 카다베린, 히스타민 및 푸트레신을 생성하였다. 배추김치에서 분리된 L. mesenteroides는 티라민을 생성한 반면(Kim과 Kim, 2014) L. mesenteroides MML22는 히스타민과 푸트레신을, SML31은 히스타민을 생성하였다. 와인으로부터 분리된 L. plantarum은 티라민을 생성한 것으로 보고된 바 있는데(Arena 등, 2007), L. plantarum CML02와 SML33은 카다베린, MML25는 히스타민과 티라민을 생성하였다. 이와는 달리 깍두기와 총각김치로부터 분리된 L. mesenteroides, Lactobacillus pentosus 및 L. plantarum은 BA를 생성하지 않는 것으로 확인되었는데(Jin 등, 2019), 본 연구 결과에서는 이들과 동일한 균종들로부터 BA 생성능이 확인되어 상반되는 결과를 얻었다. 또한, 배추김치의 우점종 유산균인 L. brevis, L. plantarum, L. mesenteroides, P. pentosaceus도 BA를 생산하지 않는 것으로 보고된 바 있어, 유산균의 BA 생성능은 균종보다는 균주에 의존하는 것을 알 수 있었다(Mah 등, 2019).
Baumlisberger 등(2015)은 레드 와인으로부터 분리된 Dekkera bruxellensis는 다양한 종류의 BA를 생산하였고, 토양으로부터 분리된 D. hansenii H1/2-72는 푸트레신, 히스타민 및 티라민, H199는 히스타민과 티라민, H524와 H525는 BA를 생성하지 않는 것으로 확인되어 균주에 따라 생성하는 BA의 종류가 다르다고 밝혔다. 또한, 와인으로부터 분리된 P. membranefaciens H227은 티라민, Schizosaccharomyces pombe K81은 푸트레신, 티라민, 에틸아민, Zygosaccharomyces rouxii는 티라민과 에틸아민을 생성하는 것으로 확인되어 발효 식품 제조에 활용되는 효모에 의해서도 다양한 BA가 생성된다고 보고하였다. 본 연구에서의 P. membranefaciens MMY29는 히스타민과 티라민, SMY37은 티라민을 생산하여 Bäumlisberger 등(2015)의 결과와는 부분적으로 일치하였다. Caruso 등(2002)은 포도와 와인으로부터 분리된 Brettanomyces bruxellensis에 의해 총 BA 함량(15 mg/L)이 가장 높았고, 그 다음으로는 S. cerevisiae가 생산한 총 BA 함량(12.14 mg/L)이 가장 많은 것으로 나타났다. 특히 S. cerevisiae로 발효시킨 와인에는 에틸아민(2.3-16 mg/L), 아그마틴(3.1-7.5 mg/L)이 가장 높게 측정되었다고 하여 본 연구의 S. cerevisiae CMY03(히스타민) 및 MMY28(카다베린)과는 다른 종류의 BA를 생산하는 것으로 확인되었다. Qi 등(2014)은 히스타민, 티라민, 카다베린, 스페르미딘 등의 함량은 C. versatilis와 Z. rouxii 등의 효모에 의해 증가되었고, 간장 내에서 Z. rouxii는 121.71 mg/kg, C. versatilis는 69.96 mg/kg 생산하였으며, 효모의 아미노산 탈탄산 효소가 아미노산으로부터 BA를 생산하고 발효 기간이 길어질수록 BA량은 증가된다고 하였다
유산균은 영양분이 고갈된 상태에서도 에너지 획득 능력과 강한 생존력을 발휘하여 열악한 조건에서 상당 기간 견딜 수 있는 적응력을 가지고 있다(Barbieri 등, 2019). 특히 야생형 유산균은 낮은 pH에 대응할 수 있는 메커니즘을 활성화하여 산에 대한 스트레스에 저항할 수 있다. 스트레스에 노출된 유산균은 아미노산 탈탄산화 시스템의 발현과 활성화를 통해 에너지 고갈 상황에서도 적응력을 높이고, 이로 인하여 BA 생성이 가능해진다(Lucas 등, 2007). BA 생성과 관련된 탈탄산 효소 유전자의 존재는 균종보다는 균주에 의존하고, 열악한 조건 하에서의 생존과 적응을 위한 메커니즘의 일부분으로써 균주들 사이에 유전자 수평 전달도 가능하다(Barbieri 등, 2019). 이와 같은 유산균의 아미노산 탈탄산화 메커니즘으로 인해 김치의 발효가 진행됨에 따라 유산균이 생성한 유기산으로 pH가 낮아져도 BA 생성량은 유의하게 증가될 수 있을 것으로 판단된다.
묵은지로부터 분리된 미생물의 BA 분해능을 측정한 결과는 Table 4와 같다. L. mesenteroides subsp. mesenteroides CML01은 카다베린 분해능(6.5±0.9%)을 나타내었고, E. faecium KML12로부터는 히스타민(41.7±2.2%)과 티라민(25.3±0.4%)의 분해능이 확인되었다. L. fermentum MML21에 의해선 카다베린(24.2±0.9%), L. sakei MML23은 푸트레신(31.2±4.8%)과 티라민(19.7±4.1%), E. faecalis MML26에 의해선 히스타민(4.9±0.3%) 분해능이 나타났다. P. pentosaceus SML34는 푸트레신을 25.7±0.9% 분해시키는 것으로 확인되었다. 반면, 시료로부터 분리된 모든 효모에 의해서는 BA 분해능이 확인되지 않았다.
본 연구 결과에서 보듯이 균주에 따라 특정 BA을 생성한 반면, 또 다른 BA에 대해선 분해능을 나타내기도 하였다. Jin 등(2019)은 발효가 진행될수록 깍두기와 총각김치 내 티라민과 히스타민 함량이 서서히 감소되었는데 이는 BA 분해능이 있는 유산균에 의한 것이라고 추정하였다. Kim 등(2017)도 히스타민 분해능이 있는 L. sakei, L. plantarum, Leuconostoc carnosus 및 L. mesenteroides로 접종한 배추김치 내에 히스타민 함량은 대조구에 비해 유의하게 감소되었음을 보고하였다. Urs 등(2019)에 의해 L. plantarum은 히스타민(100%), 티라민(100%), 카다베린(28%) 및 푸트레신(67.8%)을 분해한 것으로 확인되었다. 이와 유사하게 본 연구의 결과에서도 L. mesenteroides subsp. mesenteroides CML01(카다베린), E. faecium KML12(히스타민, 티라민), L. fermentum MML21(카다베린), L. sakei MML23(푸트레신, 티라민), E. faecalis MML26(히스타민), P. pentosaceus SML34(푸트레신)로부터 BA 분해능이 확인되었는데, 세균의 BA 분해능은 아민 산화효소(amine oxidase)에 의해 산화적 탈아미노화 반응을 유도함으로써 나타난다고 알려져 있다(Tabanellin 등, 2014).
전보(Lim, 2020) 결과, 천일염으로 담근 김치에서부터 카다베린(0-105.16±5.07 mg/kg)과 히스타민(0-326.82±0.75 mg/kg)의 함량은 발효가 진행될수록 증가되었는데 L. mesenteroides subsp. mesenteroides CML01, L. plantarum CML02 및 S. cerevisiae CMY03의 영향인 것으로 추정된다. 한편, L. mesenteroides subsp. mesenteroides CML01은 카다베린 분해능이 확인되었으나, 활성이 낮아 묵은지 카다베린 함량을 유의하게 낮추지는 못한 것으로 판단된다.
까나리 액젓을 첨가하여 담근 김치 내 카다베린(4.55±0.9-440.96±2.97 mg/kg)의 함량은 발효가 진행될수록 점진적으로 증가되었는데, 이는 L. brevis KML11과 Z. mellis KMY16의 영향으로 추정된다. 히스타민(8.52±0.15-274.52±6.37 mg/kg)의 함량은 P. pentosaceus KML14, W. confusa KML13, E. faecium KML15 및 P. fermentans KMY17의 영향인 것으로 보여지며, 히스타민의 함량은 6개월 이후부터는 오히려 감소되었는데, 이는 E. faecium KML12의 분해능의 영향인 것으로 추정된다. 한편, 시료 내 티라민(0-368.05±0.99 mg/kg)은 L. brevis KML11과 E. faecium KML15 및 P. fermentans KMY17의 영향인 것으로 간주되며, 티라민의 함량은 9개월 이후부터 일정한 수준이 유지되었는데, 이는 E. faecium KML12의 분해능 및 생성균의 사멸에 의한 것으로 추정된다.
멸치 액젓으로 담궈 발효시킨 묵은지의 카다베린(6.69±0.64-185.72±1.66 mg/kg) 함량은 E. faecalis MML26, P. membranefaciens MMY28의 영향인 것으로 간주되며, 발효 후기로 갈수록 L. fermentum MML21의 분해능에 의해 카다베린의 함량은 크게 증가하지 않은 것으로 추정된다. 푸트레신(9.42±1.11-310.54±3.00 mg/kg)의 함량은 L. mesenteroides MML22, L. brevis MML24, E. faecalis MML26 및 S. cerevisiae MMY27의 영향인 것으로 보여지며, 발효 후기에 그 함량이 크게 증가되지 않았던 것은 L. sakei MML23의 분해능과 생성균의 사멸에 기인하는 것으로 간주된다. 티라민(0-93.89±2.26 mg/kg)의 함량은 L. plantarum MML25 및 C. versatilis MMY29에 기인하며, 9개월 이후에 일정한 수준으로 유지된 것은 L. sakei 23의 분해능 및 L. plantarum MML25의 사멸에 의한 것으로 보여진다. 반면, 히스타민(5.61±1.80-815.26±5.5 mg/kg)의 함량은 L. mesenteroides MML22, L. brevis MML24, L. plantarum MML25 및 C. versatilis MMY29에 의하며, E. faecalis MML26으로부터 분해능이 확인되었으나, 활성이 낮아 함량 감소에는 큰 영향을 미치지 않았던 것으로 판단된다.
새우젓갈을 넣어 발효시킨 묵은지의 카다베린(0-436.03± 8.4 mg/kg)은 L. brevis SML32와 L. plantarum SML33 및 D. hansenii SMY36에 기인하며, 히스타민(0-419.16±1.11 mg/kg)의 함량은 L. mesenteroides SML31의 영향이고, 푸트레신(4.87±0.37-180.21±7.67 mg/kg)과 티라민(10.52±0.32-390.36±0.51 mg/kg)은 모두 L. sakei SML35에 의한 것으로 발효 12개월까지 카다베린, 히스타민 및 티라민의 함량은 꾸준하게 증가되었다. 하지만 푸트레신의 함량은 P. pentosaceus SML34의 분해능에 의해 발효 후기로 갈수록 생성량이 크게 증가되지 않았던 것으로 추정된다.
이상의 결과, 발효 채소류의 우점종인 유산균과 효모의 균주에 따라 BA 생성량이 상이하다는 것을 알 수 있었으며, 일부의 발효 미생물에 의해선 BA 분해능이 확인되었으므로 발효 식품 제조에 이용하는 미생물의 BA 생성 여부 확인이 반드시 필요할 것으로 사료된다.
BA를 생성하지 않고 BA 분해능이 있는 E. faecium KML12, L. fermentum MML21, L. sakei MML23 및 P. pentosaceus SML34를 선발하여 프로바이오틱 균주의 가능성을 평가하기 위해 인공 소화액에 대한 저항성과 CaCo-2세포에 대한 부착능을 조사한 결과는 Fig. 1과 같다. E. faecium KML12는 pH 2.0의 인공 위액 하에서의 생존율 0.5±0.03%, 1% bile salts 하에서는 17.5±4.7% 생존하였고 상피세포에 대한 부착율은 4.7±1.1%이었다. L. fermentum MML21의 인공 위액과 담즙액 하에서의 생존율은 각각 0.06±0.01%와 32.4±2.9%이었으며, 상피세포에 대한 부착율은 27.2±3.9%로 나타났다. L. sakei MML23의 인공 위액과 담즙액 하에서의 생존율은 각각 23.9±3.4%와 52.8±3.1%이었고, 상피세포에 대한 부착율은 7.2±0.9%로 나타났다. P. pentosaceus SML34의 인공 위액과 담즙액에서의 생존율은 각각 1.9±0.3%와 25.8±5.0%로 나타났으며, 상피세포에 대한 부착율은 18.7±3.7%로 측정되었다. 이상의 결과, 인공 소화액에 대한 저항성과 상피세포에 대한 부착율은 균종에 따라 유의한 차이가 있었으며, 인공 위액과 담즙액에 대한 저항성은 L. sakei MML23이 가장 높았고, 상피세포에 대한 부착율은 L. fermentum MML21이 가장 높은 것으로 나타났다.
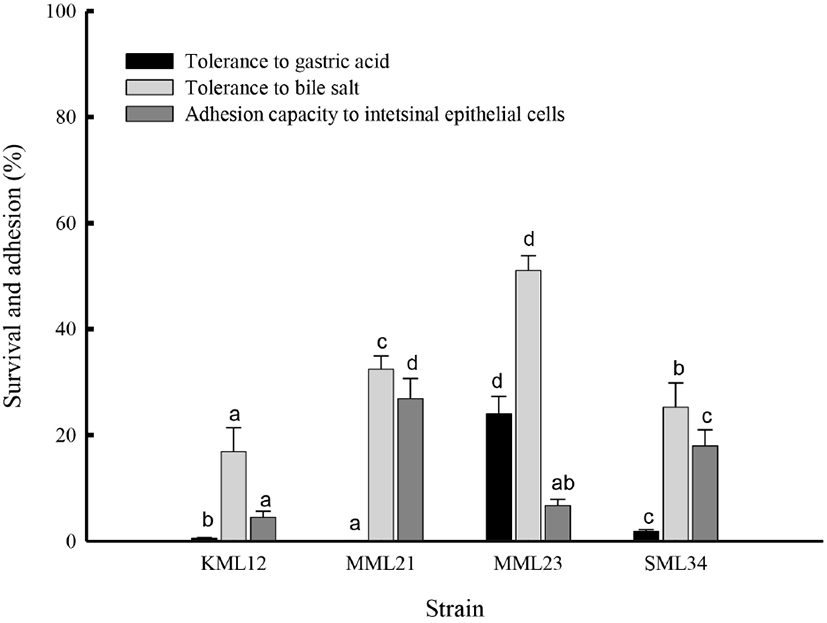
Lertworapreecha 등(2011)은 총 60균주의 E. faecium 중 15 균주는 산에 대한 저항성이 확인되었고, 그 중에서 EFMC21, EFMD30, EFMI47 및 EFMI49는 담즙에 노출되었을 때 생존율이 높았으며, 장관 점막에 대한 부착율도 높았다고 보고하였는데 E. faecium KML12는 산에 대한 저항성은 이들보다 다소 낮았다. Allameh 등(2013)에 의하면 L. fermentum-3은 pH 3-8 및 0.3% 담즙염 하에서 증식 가능하였고, 또한 L. fermentum BIF-19는 강한 세포 표면 소수성에 따라 Caco-2 세포에 양호한 부착력(8.78±0.36%)을 나타내었으며(Panicker 등, 2018), L. fermentum MML21도 담즙산에 대한 내성과 우수한 부착율을 나타내었다. L. sakei J4는 인공 위액에 대한 생존율은 24.3±3.0%, 담즙산에 대한 생존율은 25.8±0.4%로 다른 균주에 비해 상대적으로 높은 생존율을 나타내었고(Park 등, 2012), L. sakei CH8은 장관 상피 세포와 2시간 혼합 배양 후 높은 부착률을 보여주었다(Song 등, 2015). P. pentosaceus MZF16은 위액과 담즙염에 대한 스트레스에 높은 저항성을 나타내었고, 소수성 표면 특성을 나타내어 장관 Caco-2/TC7 세포에 대해 높은 부착력을 나타내었다고 하여(Zommiti 등, 2018) 본 연구 결과와는 다소 차이가 있었다.
E. faecium KML12, L. fermentum MML21, L. sakei MML23 및 P. pentosaceus SML34의 항생제에 대한 감수성을 측정한 결과는 Table 5와 같다. E. faecium KML12는 암피실린, 에리스로마이신 및 반코마이신에 대한 감수성이 높게 나타났으며, 카나마이신과 테트라사이클린에 대해 저항성이 큰 것으로 나타났다. L. fermentum MML21은 페니실린에 대한 감수성이 높았던 반면, 스트렙토마이신에 대한 저항성이 크게 나타났다. L. sakei MML23은 에리스로마이신과 테트라사이클린에 대한 감수성이 높았고, 암피실린과 페니실린에 대한 저항성이 큰 것으로 확인되었다. P. pentosaceus SML34는 암피실린과 카나마이신에 대한 감수성이 높았고, 페니실린에 대한 저항성이 크게 나타났다. E. faecium EFMC21, EFMD25, EFMI47 및 EFMI49는 박테리오신을 생산하였으며, 아목시실린/클라불란산, 시프로플록사신, 젠타마이신, 트리메소프림/설파메톡사졸, 반코마이신에 대해 감수성이 높았던 반면, 세포탁심, 에리스로마이신 및 테트라사이클린에 대해 저항성이 높았다고 하여(Lertworapreecha 등, 2011) E. faecium KML12와는 일부 항생제에 대해 비슷한 경향의 감수성을 나타내었다. L. fermentum-3은 스트렙토마이신, 젠타마이신 및 카나마이신에 대해 저항성이 강하였고, 테트라사이클린에 대해선 중간 정도의 수준이었으며, 클로람페니콜, 아목시실린, 암피실린에 대해서 감수성이 강한 것으로 나타나 프로바이오틱 균주로서 적합하다고 하였다(Allameh 등, 2013). L. sakei GMK01은 암피실린, 페니실린, 클록사실린, 클린다마이신, 클로람페니콜, 에리스로마이신, 젠타마이신, 카나마이신, 스트렙토마이신 등에 대해선 감수성이 높았던 반면, 옥사실린, 바시트라신, 반코마이신, 세픽심, 독시사이클린, 테트라사이클린 등에 대해 저항하였다(Khiralla, 2015). P. pentosaceus MZF16 균주는 젠타마이신, 클로람페니콜 및 반코마이신에 대해선 저항성이 높았으나, 오플로사신, 암피실린, 에리스로마이신, 스트렙토마이신 및 테트라사이클린에 대한 감수성이 높았다고 하였는데(Zommiti 등, 2018), 본 연구의 이들과 동일한 균종과 비교했을 때 균주에 따라 항생제의 감수성에 다소 차이가 있음을 알 수 있었다.
한편, 본 연구의 묵은지로부터 분리된 BA 생성 유산균과 효모에 대한 E. faecium KML12, L. fermentum MML21, L. sakei MML23 및 P. pentosaceus SML34가 생산한 박테리오신 용액의 항균 활성을 측정한 결과는 Table 5와 같다. E. faecium KML12와 L. fermentum MML21이 생산한 박테리오신 용액은 BA 생성균에 대해서 항균 활성을 나타내지 않았지만, L. sakei MML23의 박테리오신은 E. faecium KML15(2,560 AU/mL)와 S. cerevisiae MMY28(320 AU/mL)에 대해 항균 활성을 나타내었으며, P. pentosaceus SML34의 박테리오신도 L. brevis MML24(640 AU/mL)에 대해 항균 활성을 나타내었다. 게다가 L. sakei MML 23이 생산한 박테리오신 용액(100 AU/mL)을 처리한 경우 E. faecium KML15가 생산한 히스타민의 양을 44.7±4.8%와 S. cerevisiae MMY28이 생산한 카다베린을 6.9±1.2% 감소시켰다. 또한 P. pentosaceus SML34가 생산한 박테리오신 용액은 L. brevis MML24의 히스타민(8.1±0.5%)과 푸트레신(10.7±3.9%) 생성량을 감소시키는 효과를 나타내었다. 본 연구의 결과, 유산균의 균종에 따라 박테리오신의 항균 활성과 항균 스펙트럼에 상당한 차이가 있었으며, 항균 활성을 나타낸 박테리오신은 지시 균주의 증식 억제뿐만 아니라, 이들의 BA 생성량 감소에도 효과적이었음을 확인하였다. L. fermentum-3은 어류 병원균에 대한 강한 항균 활성을 나타내었으나(Allameh 등, 2013), L. fermentum BIF-19는 박테리오신을 생산하지 않은 것으로 나타났다(Panicker 등, 2018). L. sakei J4는 식중독균에 대한 높은 항균력을 나타내었고(Park 등, 2012), P. pentosaceus MZF16은 박테리오신을 생산하여 Listeria 속에 대한 항균 활성이 확인되었다고 하여(Zommiti 등, 2018) 균종에 따라 박테리오신 활성과 항균 스펙트럼은 상이하였다. 기존 연구 결과의 동일한 균종과는 프로바이오틱 활성에 다소 차이가 있었으나, L. sakei MML23 및 P. pentosaceus SML34는 위액에 대한 내성과 담즙산에 대한 높은 생존율 및 일부 항생제에 대한 감수성뿐만 아니라, BA 생성균에 대한 박테리오신 활성도 확인되었으므로 프로바이오틱 균주로서 적합하다고 판단된다. Nisin을 생산하는 Lactococcus lactis는 Streptococcus thermophilus와 E. faecalis의 BA 생산을 유의하게 억제하였으므로 박테리오신을 생산하는 유산균을 활용하는 방법이 BA 저감화에 효과적이라고 보고된 바 있다(Tabanelli 등, 2014). BA 분해능과 항균 물질 생산능이 있는 L. sakei MML23 및 P. pentosaceus SML34 등을 발효 식품 제조용 스타터로 이용한다면 발효 및 저장 과정 중 생성된 BA으로 인한 독성 위험을 낮출 수 있을 것으로 판단된다.
삶의 질이 향상됨에 따라 식품에 대한 소비자의 인식이 점차 변화되면서 화학적으로 합성된 식품첨가물에 대한 거부감이 강해지는 반면, 중독 위험이 없고 안전하면서 다양한 생리활성을 가진 천연물이나 생물학적 물질을 이용한 식품을 선호하고 있다. Generally recognized as safe(GRAS) 물질로서 무독성이 입증된 안전성과 건강에 유용한 생리활성뿐만 아니라, 항균 물질 생산에 따른 품질 향상 등의 기능을 발휘할 수 있는 프로바이오틱 균주의 활용 가치가 높이 평가되고 있다(Liu 등, 2017). BA 분해능이 있는 균주를 발효 스타터로 이용함으로써 독성 물질 축적을 억제시키고, 박테리오신, 세포 외 다당류, 비타민 및 공액 리놀레산 등의 유용한 성분 공급뿐만 아니라, 장 운동성과 흡착, 장내 세균총의 균형, 염증 감소 및 면역 시스템 조절 등의 건강 기능 향상에 도움을 주는 프로바이오틱 활성을 보유하고 있다면 숙주의 건강에도 도움을 줄 수 있는 기능성 식품 제조가 가능해질 것이다(Cousin 등, 2011; Li와 Cao, 2010). 하지만 인공 소화액에 대한 저항성, 상피세포에 대한 부착능 및 항균물질 생산능 등 프로바이오틱 균주로서 기본적인 조건을 갖추었다고 할지라도 BA와 같은 독성 물질을 생성하지 않아야만 안전하게 이용할 수 있으므로 발효 식품 제조에 이용하기 전에 아미노산 탈탄산 효소 생성능을 반드시 확인해야 할 것이다.
결론적으로 다양한 발효 식품을 안전하게 제조하기 위해선 BA 생성능이 없고 분해능이 있는 발효 스타터 이용과 식품의 제조 및 저장 과정 중에 BA의 생성 여부 확인을 위한 모니터링을 통해 철저히 관리되어야 한다. 또한, BA 생성균의 오염을 막을 수 있도록 최적의 제조 환경을 설정하고, 식품의 물성과 영양가에 악영향을 미치지 않는 제조 공정 기술을 적용하거나, 아민으로 전환되지 않는 새로운 원료를 개발하는 등 소비자가 안심하고 섭취할 수 있는 안전한 발효 식품 제조에 관한 연구는 앞으로도 계속 활발하게 이루어져야 할 것이다.
