서 론
한국에서 수산자원은 동물성 단백질 공급량의 39%를 점유하고 있는 중요 영양공급원 중 하나로, 우리나라는 반도의 지형적 특성에 따라 예로부터 다양한 수산물이 이용되고 있으며(Lee와 Kim, 2003), 한국인 1인당 수산물 섭취량은 58.4 kg/년으로 세계 1위를 차지하고 있는 것으로 보고되어 있다(Norway Seafood Commission, 2017). 국내에서는 국립수산과학원에서 주기적으로 표준수산물 성분표를 발간하여 수산물 및 수산식품에 대한 각종 영양성분을 제공하고 있으나, 지금까지 발간된 표준수산물성분표(2018)에서 수용성 비타민에 대한 데이터는 비타민 B1, B2, B3, C 성분만을 수록하고 있어 올바른 국민영양정책 수립을 위해서는 이 외의 수용성 비타민에 대한 데이터베이스 구축이 시급한 실정이다.
비타민(vitamin)은 미량필수영양소로 구분되고, 인체 내에서 신체 기능을 조절하는 효소 또는 조효소의 구성성분으로 탄수화물, 지방, 단백질, 무기질 대사에 관여하며, 결핍 시 체내 영양소 대사에 지장을 주게 된다. 비타민류는 인체 내에서 합성되지 않기 때문에 식품이나 보조제를 통해 필수적으로 섭취해야 하는 영양소로, 최근 건강기능식품에 대한 요구도가 높아지면서 미량영양소 섭취 수준에 관한 관심이 증가하고 있다(Kim 등, 2005). 특히, 비오틴(biotin, 비타민 B7)과 코발라민류(cobalamins, 비타민 B12)와 같이 식품 중 낮은 함량으로 존재하고 있는 미량비타민류는 분석 시 검출 및 정량이 어려운 분석적 한계, 국민영양정책 수립을 위한 미량성분에 대한 데이터베이스의 구축 필요성에 대한 인식 부족 등으로 인하여 그동안 국가영양성분 데이터베이스 구축 항목에서 누락되어 왔다. 최근, 올바른 국민영양보건정책 수립을 위해 이러한 미량비타민을 포함한 확대된 데이터베이스 구축의 필요성이 확산되면서 미량비타민의 분석법의 유효성 검증 및 이를 통한 다양한 자원들의 데이터베이스 구축이 시도되고 있다(Kwak 등, 2012; Mun 등, 2017; Shin 등, 2016). 식품 중 비오틴과 코발라민류의 분석은 함량이 검출하기 어려운 낮은 수준으로 존재하기 때문에 추출 후 검출 및 정량 한계 이상으로 농축이 필요한데, 이 과정에서 분석에 간섭을 일으키는 불순물도 함께 농축되는 것을 막기 위해 목적하는 분석 성분을 선택적으로 농축하는 과정이 필요하다. 최근 이용되고 있는 면역친화성컬럼(immunoaffinity column)은 비오틴과 시아노코발라민과 같은 미량 성분을 컬럼 내부의 면역친화성 겔과 특이적인 결합을 유도시키고, 기타 분석 간섭물질들을 효과적으로 제거함으로써 목적하는 성분을 농축 및 clean-up하는 방법에 적용할 수 있어 비오틴과 코발라민류와 같은 미량비타민 분석에 적용되고 있다(Cheon, 2019; Senyuva와 Gilbert, 2010).
비오틴은 비타민 B7 또는 비타민 H로 알려져 있는 수용성 비타민으로 d-biotin과 d-biocytin의 형태로 존재한다. 비오틴은 자연 상태에서 유리형과 결합형으로 나뉘며, 결합형은 식품에서는 단백질과 결합되어 있는 것으로 알려져 있다(Lahely 등, 1999). 비오틴은 체내에서 발생하는 정상적인 세포 기능 및 성장에 필수적인 영양소로 작용하며 주로 체내 장에서 흡수되어 이용된다(Said 등, 1990). 비오틴의 생체 주요 반응으로는 포도당 신생 합성, 지방산 합성, 아미노산 대사를 포함하는 여러 carboxylase의 조효소 역할을 하는데(Pacheco-Aluarez 등, 2002; Holler 등, 2006), 결핍 시 식욕부진, 우울증, 결막염, 탈모, 피부발진 등의 질병을 야기하지만, 비오틴 결핍에 대해서는 거의 보고된 바가 없으며, 과다복용에 대한 부작용도 현재까진 알려진 바가 없다(Bellows와 Moore, 2012; Zempleni와 Mock, 1998).
코발라민류는 cobalt corrinoid 중 비타민 B12 기능을 나타내는 코발라민류 화합물을 총칭하는데, 자연 식품에서는 다양한 형태로 존재하고 비타민 B12 강화식품의 경우 안정한 합성형 시아노코발라민으로 존재한다(Martens 등, 2002). 코발라민류는 식품 중 단백질과 결합되어 있어 섭취 시 위산과 펩신에 의해 단백질 복합체와 분리된 후 위벽에 존재하는 내인성 단백질과 결합되어 근위 회장에서 원위 회장으로 이동되고, 이후 transcobalamin Ⅱ에 결합되어 간과 골수로 수송된 후 라이소자임에 의해 분해된 후 체내에서 흡수된다(Petrus 등, 2009; Swain, 1995). 코발라민류는 주로 동물성 식품과 일부 해조류와 버섯류에만 존재하며, 식물성 식품에서는 발견되지 않기 때문에 채식주의자, 동물성 식품 섭취가 어려운 노인들, 위 절제 환자 및 흡수 장애가 있는 사람들에게 비타민 B12 결핍이 종종 발생하는 것으로 보고되어 있다(Andres 등, 2004; Carmel, 2000). 결핍 시 신경학적 증상(Healton 등, 1991), 거대적 혈모구 빈혈 등의 질병을 유발하며, 특히 빈혈은 비타민 B12 결핍의 가장 흔한 원인 중 하나로 분류되고 있다(Stabler, 2013).
본 연구에는 국내에서 이용되는 다양한 수산자원의 미량비타민 데이터베이스 확보를 위해 immunoaffinity-HPLC/PDA 분석법을 검증하고 총 7개 군으로부터 28종의 시료에 적용하여 수산자원별 비오틴과 코발라민류 데이터베이스 구축 및 데이터의 신뢰도를 확보하고자 하였다.
재료 및 방법
비오틴과 코발라민류 분석정량을 위한 biotin 및 cyanocobalamin 표준품과 추출용매 제조에 사용한 sodium phosphate monobasic, sodium phosphate dibasic hepta-hydrate, phosphate buffer saline은 Sigma-Aldrich사(St. Louis, MO, USA), sodium acetate trihydrate와 acetic acid는 Wako사(Osaka, Japan)에서 구입하여 사용하였다. 이외 기타 시약 및 용매는 특급 및 HPLC 급을 구입하여 사용하였다.
시료는 연근해, 내수면, 다소비 수산물 중 표준수산물성분표 2018 분류군에 따라 어류, 패류, 두족류, 갑각류, 해조류, 기타 수산물 및 수산가공품(건조품, 염장품)으로 분류한 뒤 수산물 분류군에 따른 대표 시료를 선정하였으며, 각 시료는 비가식부를 제거한 뒤 균질하여 −70°C에서 동결 보관하며 분석 시료로 사용하였다.
분석법 검증을 위한 표준참고물질 SRM 1549a(Whole milk powder), SRM 1849a(Infant/Adult Nutritional Formula), SRM 3290(Dry Cat Food)는 NIST사(Gaithersburg, MD, USA)에서, 분석품질관리 시료로 사용된 상업용 분유는 Namyang(imperial dream XO world class 3, Seoul, Korea)에서 구입하였다.
비오틴 추출 방법은 Joseph 등(2016)의 방법을 변형하여 사용하였다. 먼저, 삼각플라스크에 균질된 시료 5 g을 칭량한 뒤 0.15 M sodium phosphate buffer(pH 7) 50 mL를 넣고, 고압멸균기(autoclave ES-315, Tokyo, Japan)에서 121°C로 30분간 가열하여 추출하였다. 추출된 시료는 실온으로 냉각한 뒤 원심분리한 후 Whatman No.1(GE Healthcare, Amersham Place, UK)으로 여과하여 추출액으로 사용하였다. 코발라민류 추출은 뚜껑이 있는 100 mL 플라스크에 시료를 0.5~5.0 g을 칭량한 뒤 1% sodium cyanide 0.5 mL와 0.2M sodium acetate trihydrate buffer(pH 4.0) 49.5 mL를 가하여 10분간 초음파(8893-DHT, Cole-Parmer, Chicago, IL, USA) 처리 후 100°C 항온수조(WB-20M, Jeio Tech CO., Daejeon, Korea)에서 1시간 동안 추출하였다. 추출액은 냉각 후 buffer로 50 mL 정용한 뒤 Whatman No.1을 이용하여 여과하였다.
비오틴 분석을 위한 농축 및 정제는 immunoaffinity column(Easi-Extract Biotin, r-Biopharm, Glasgow, UK)을 사용하였다. 냉장 보관된 immunoaffinity column은 사용 전 실온 온도에 맞춘 뒤 컬럼 내부의 용액을 제거하였다. 용액 제거 후 phosphate buffer saline(PBS) 3 mL를 주입하여 conditioning 후 추출액 10 mL를 loading하여 비오틴 성분을 면역친화성 컬럼에 흡착시켰다. 잔여 불순물을 제거하기 위해 PBS buffer 3 mL와 초순수증류수(deionized distilled water, DDW) 6 mL를 주입하여 불순물을 제거한 뒤 실린지를 이용해 공기를 주입하여 남아있는 수분을 제거하였다. 이후 test tube에 고정시켜 methanol 4 mL를 주입하여 컬럼에 흡착되어 있는 비오틴 성분을 용출시킨 뒤 70°C에서 질소농축기(EYELAMG-2200, Tokyo Rikakikai Co., Tokyo, Japan)로 전량 휘발시켰다. 그 후 DDW 0.5 mL를 가하여 재용해시킨 뒤 0.45 μm membrane filter(cellulose acetate, Adventec, DISMIC-13CP, Osaka, Japan)로 여과한 후 vial에 옮겨 분석에 사용하였다.
식품 중 코발라민류는 추출 후 추출용액 중의 cyanide에 의해 시아노코발라민의 형태로 전환되게 된다. 전환된 시아노코발라민의 정제는 immunoaffinity column(Easi-Extract Vitamin B12, R-Biopharm Rhone Ltd., Glasgow, UK)을 사용하여 검출 및 정량 수준이 되도록 농축하였다. 먼저, 실온에서 안정화시킨 immunoaffinity column의 내부 용액을 제거하고, water 3 mL를 주입하여 conditioning하였다. 그 후 추출액 9 mL를 주입하여 시아노코발라민 성분을 흡착시킨 뒤 잔여 불순물 제거를 위해 water 9 mL를 주입하였다. 실린지를 이용하여 남아있는 수분을 제거한 후 test tube에 고정시켜 methanol 3 mL를 주입하여 시아노코발라민 성분을 용출시켰다. 그 후 70°C에서 질소농축기를 이용하여 전량 휘발한 후 water 0.5 mL를 가하여 재용해한 뒤 0.45 μm membrane filter로 여과하여 vial에 옮겨 분석에 사용하였다.
비오틴 및 시아노코발라민의 분리 및 정량 분석은 HPLC Agilent 1260 infinity(Agilent, Santa Clara, CA, USA) 시스템을 이용하였다. 비오틴 분석은 컬럼 Kinetex Phenyl-Hexyl (4.6 mm×150 mm, 2.6 μm, Phenomenex)을 사용하였으며, UV detector(PDA, G4212B, Agilent, Santa Clara, CA, USA)를 이용하여 파장 200 nm에서 검출하였다. 컬럼 온도는 25°C, 유속은 0.6 mL/min, 주입량은 100 μL 조건으로 분석하였다. HPLC 이동상은 (A)-0.1% phosphoric acid, (B)-100% acetonitrile, (C)-80% acetonitrile 용매 비율을 A:B:C= 90:10:0(v/v/v)으로 초기 18분 동안 유지한 다음 18.5분까지 C용매가 100%가 되도록 한 후 24분까지 유지하였으며 이후 24.5분에 A:B:C의 비율이 다시 90:10:0(v/v/v)이 되도록 하고 이를 27분까지 유지하는 조건으로 분석하였다. 시아노코발라민의 분석은 C18 ACE 3 AQ(3 mm×150 mm, ACE, Aberdeen, Scotland, UK) 컬럼을 사용하였으며, UV detector (PDA, G4212B, Agilent)를 사용하여 361 nm에서 검출하였다. 컬럼 온도는 35°C, 유속은 0.25 mL/min, 주입량은 100 μL이었다. 시아노코발라민의 분리를 위한 HPLC 이동상은 (A)-water와 (B)-acetonitrile을 사용하였으며, 0분에서 A 용매 100%로 시작하여 11분에서 A와 B가 각각 85%와 15%가 되도록 하고, 19분에 각각 75%와 25%, 20분에 각각 90%와 10%, 26분에 A용매가 100%가 되도록 한 다음 35분까지 계속 유지하는 조건으로 분석하였다.
분석법 검증은 국제적인 분석 검증 방법을 제시하고 있는 AOAC(2002)와 ICH(2005)의 검증 가이드라인에 따라 수행하였다. 각 성분의 특이성(specificity)은 표준용액과 꽃게, SRM 1849a를 PDA 검출기를 이용하여 200-600 nm에서 흡광도를 측정하여 표준용액과 시료에 대한 분석 성분의 PDA spectrum을 비교하였다. 비오틴과 시아노코발라민의 검출한계(limit of detection, LOD)와 정량한계(limit of quantification, LOQ)는 공시험(blank test) 시료를 분석한 후 S/N 평균값에 표준편차를 각각 3.3과 10으로 곱한 값을 더하여 산출하였다. 추출액 중의 분석 성분의 농도에 따른 분석법의 정량적 반응에 대한 직선성(linearity)은 각 표준용액을 농도별로 제조하여 HPLC 분석 크로마토그램에서의 해당하는 성분의 피크(peak)의 면적(area)을 y축, 추출액 중 분석성분의 농도(concentration)를 x축으로 검량선을 작성하였으며, 이들의 상관관계를 분석하여 분석법의 직선성을 평가하였다. 분석법의 정확성(accuracy)은 표준참고물질인 SRM 1549a, SRM 1849a, SRM 3290을 이용하여 비오틴과 코발라민류의 함량을 분석한 뒤 SRM을 제조한 NIST의 참고값(referencce value)과 분석법을 적용해서 얻은 실측값을 비교하여 회수율로 나타냈다. 정밀성(precision)은 상업용 분유를 품질관리시료로 사용하였으며, 하루 5반복 실험하여 repeatability(intra day, RSDr), 5일간 실험하여 reproducibility(inter day, RSDR)로 나타내었다.
분석품질관리는 AOAC(2002) 가이드라인에 따라 품질관리도표(quality control chart, QC chart)를 이용하여 관리하였다. 품질관리시료(상업용 분유)를 반복 분석한 뒤 표준편차가 5% 이내로 들어가는 값 10개를 선택하여 이들의 평균값을 QC chart의 기준값으로 설정하였다. 관리상한선 및 관리하한선(upper and lower control line, UCL and LCL)은 평균±(2×표준편차), 조치상한선 및 조치하한선(upper and lower action line, UAL and LAL)은 평균±(3×표준편차)로 설정하였다. 시료를 분석하는 전 기간 동안 시료 분석 시마다 QC 시료를 분석하고, 이를 QC chart에 기록하여 관리선 수준하에 분석이 진행되고 있는지 확인하였으며, 분석값이 관리 범위를 벗어나는 경우에 분석된 검체 분석값은 사용하지 않고 실험 환경 및 조건을 점검하여 분석이 관리 범위 내에 들어오는 것을 확인한 후 검체 분석을 진행하였다.
결과 및 고찰
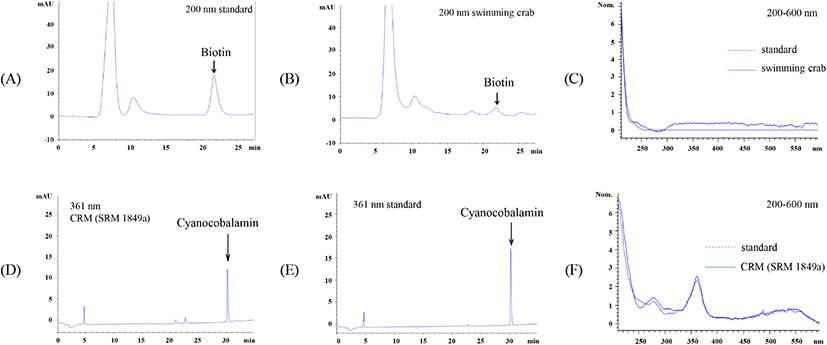
비오틴 및 코발라민류의 표준품(biotin, cyanocobalamin)과 시료(꽃게, SRM 1849a)를 HPLC-PDA로 분석한 크로마토그램은 Fig. 1과 같다. 표준용액과 꽃게의 HPLC 크로마토그램 비오틴 peak의 retention time은 21.5분으로 일치하였으며, PDA spectrum도 일치하는 것을 확인할 수 있었다. 또한, 코발라민류 표준용액(cyanocobalamin)과 SRM 1849a을 분석한 HPLC 크로마토그램(Fig. 1D, E)에서 시아노코발라민 peak는 모두 30.2분에서 검출되었고, 200-600 nm 범위에서 수집된 PDA spectrum 모두 일치하는 패턴을 보이는 것을 확인하였다.
비오틴 및 시아노코발라민의 LOD, LOQ 및 직선성 검증결과는 Table 1과 같다. 비오틴의 LOD와 LOQ는 각각 0.011 μg/100 g와 0.028 μg/100 g이었다. Shin 등(2016)의 LC-MS/MS 분석법에 의한 비오틴의 LOD 0.10 ng/mL와 LOQ 0.31 ng/mL, Huh 등(2011)의 HPLC-UV 분석법에 의한 비오틴 분석 LOD 22.5 ppm과 LOQ 68.3 ppm에 비하여 본 연구에서 적용한 immuoaffinity-HPLC/PDA 분석 LOD 및 LOQ가 보다 낮아 분석법의 민감도(sensitivity)가 높은 것으로 보여진다. 한편, 분석법의 직선성은 표준용액을 여러 수준의 농도로 제조하여 분석한 뒤 분석성분의 농도와 HPLC에서의 검출 반응 면적과의 관계를 분석한 결과, y=1,119.7x+0.6929의 관계식과 상관계수 R2=0.9998을 얻어 직선성이 높음을 확인하였다. 한편, 시아노코발라민의 LOD 및 LOQ는 각각 0.005 μg/100 g과 0.014 μg/100 g으로 나타났다(Table 1). Mun 등(2017)의 보고에서는 HPLC-DAD 분석법의 LOD 및 LOQ는 각각 0.01 μg/100 g과 0.03 μg/100 g이었으며, Jeong 등(2018)은 HPLC-PDA 분석법에 의한 LOD 및 LOQ는 각각 0.012 μg/100 g과 0.032 μg/100 g이었다고 보고하였다. 이에 비하여 본 연구의 시아노코발라민 LOD 및 LOQ 값이 낮아 분석법의 민감도가 높은 것으로 보여진다, 본 연구에서의 시아노코발라민 분석법은 성분의 농도 수준과 검량 반응도의 관계가 y=2,092.7x-10.461의 직선성을 보였으며 상관계수 R2=0.9996의 값을 나타내 높은 직선성을 나타냄을 확인할 수 있었다.
비오틴과 코발라민류 분석법의 정확성 검증을 위해 표준관리물질(SRM 1549a, SRM 1849a, SRM 3290)을 분석한 결과는 Table 2와 같다. 비오틴의 표준관리물질 분석 결과 15.226 μg/100 g(SRM 1549a), 140.605 μg/100 g(SRM 3290)의 값을 나타내었다. NIST에서 제시하는 인증값은 각각 15.200 μg/100 g(SRM 1549a), 142.00 μg/100 g(SRM 3290)으로 100.2%, 99.0%의 회수율을 나타내었다. 코발라민류의 표준관리물질 분석 결과 4.848 μg/100 g(SRM 1849a), 9.628 μg/100 g(SRM 3290)의 값을 나타내었으며 각각 100.6%, 101.3%의 회수율을 나타내었다. AOAC 가이드라인에서 제시하는 회수율 수용범위는 75-120%(1 μg/100 g 기준)를 나타내며, 두 성분 모두 범위에 충족하는 회수율을 보여 우수한 정확성을 확인하였다.
정밀성 평가는 반복성(repeatability)과 재현성(reproducibility) 두 가지로 수행하였다(Table 3). 비오틴 분석에 대한 반복성과 재현성은 각각 3.6%, 4.9%의 변동계수를 나타냈다. 코발라민류의 반복성은 5.73 μg/100 g, 재현성은 5.60 μg/100 g으로 각각의 변동계수는 3.8%, 6.1%를 나타냈다. AOAC 가이드라인에서 제시하는 정밀성 범위는 8%, 16% 이하를 제시하고 있으며(1 μg/100 g), 분석값 모두 수용범위 이하의 값을 나타내 우수한 정밀성을 확인하였다.
Repeatability refers to the results of independent 5 determination in triplicates obtained by analyzing a QC sample five times on the same day.
Reproducibility refers to the results of independent 5 determinations in triplicates obtained by analyzing a QC sample five times on different days (once a day).
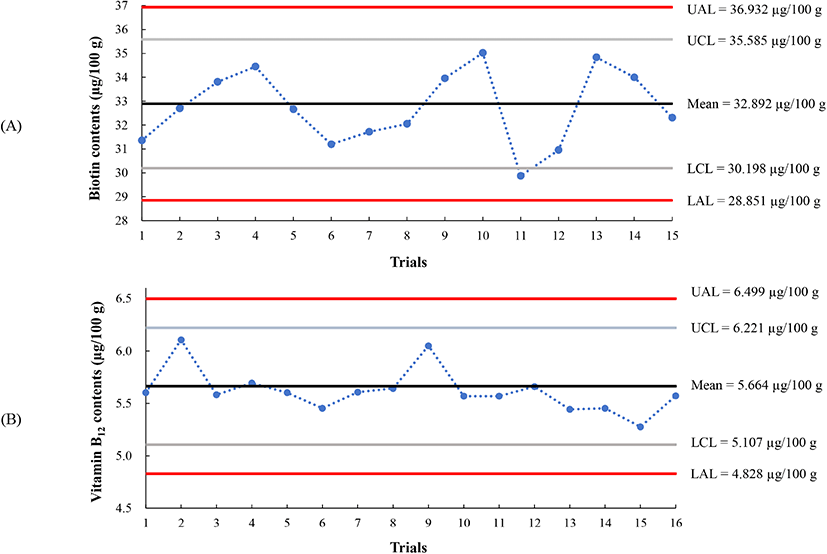
비오틴과 코발라민류의 분석품질관리는 QC chart를 이용하여 수행하였으며 그 결과는 Fig. 2와 같다. 비오틴 분석 QC chart의 초기 설정한 평균값은 32.89 μg/100 g이었으며, 관리 상·하한선은 각각 35.59 μg/100 g과 30.20 μg/100 g, 조치 상·하한선은 각각 36.93 μg/100 g과 28.85 μg/100 g이었다. 품질관리시료를 분석한 결과, 비오틴의 경우 1회를 제외한 모든 분석값이 관리한계선 범위 내에 들어감이 확인되었으며 관리한계선 범위 밖의 분석값을 얻은 경우 검체 분석을 중단하고, 분석 환경 및 조건을 검토한 이후 품질관리 시료의 재분석 값이 관리한계선 범위 안으로 들어가게 되면 검체 분석을 다시 진행하였으며, 이렇게 관리된 상태에서 분석된 시료 분석값만을 채택하여 결과로 사용하였다. 코발라민류 QC chart의 평균값은 5.664 μg/100 g을 나타냈으며, 관리 상·하한선은 6.221 μg/100 g, 5.107 μg/100 g으로, 조치 상·하한선 6.499 μg/100 g, 4.828 μg/100 g으로 나타났다. 코발라민류의 내부품질관리는 모든 분석 값이 관리 한계선 안에 들어가 분석이 수행되었음을 나타냈다.
수산자원 및 가공품의 비오틴 및 코발라민류 함량 분석 결과는 Table 4와 같다. 총 28종의 수산물 및 수산가공품의 비오틴과 코발라민류 함량범위는 각각 1.06-10.55 μg/100 g과 0.36-36.13 μg/100 g의 범위를 나타내어 코발라민류가 수산자원의 종류에 따라 보다 넓은 함량 분포를 나타내는 것을 확인할 수 있었다. 수산자원 및 가공품 모두에서 비오틴 함량이 검출되었으며, 이들의 함량을 비교해 보면 갑각류의 꽃게(Gazami crab)에서 10.55 μg/100 g으로 함량이 가장 높았으며 다음으로 갑각류의 갯가재(Japanese squillid mantis shrimp) 5.40 μg/100 g과 어류의 덕대(Korean pomfret) 5.07 μg/100를 제외하고는 모두 5 μg/100 g 이하의 함량 수준을 나타내었다. 인간은 체내에서 비오틴을 합성할 수 없기 때문에 식품과 보충제 등을 통해 섭취해야 하는데, 한국인의 비오틴 일일 권장섭취량 30 μg(MHW, KNS, 2015)은 다양한 자원으로 구성된 한국인의 일반적인 식단의 경우 비오틴 권장섭취량은 충분히 충족될 수 있는 것으로 알려져 있다. 수산자원은 대체로 비오틴 함량이 낮은 식품이지만 식단 속에서 섭취하게 되는 섭취량과 빈도수가 높아 비오틴 섭취량에 충분한 기여를 하는 것으로 알려져 있다(Ball, 2005). Kwon 등(2019)의 연구에 따르면 포도의 품종 및 재배지역에 따라 비오틴의 함량이 달라진다고 하였으며, Frigg(1984)는 동물성 자원의 경우 섭취시키는 사료의 비오틴 함량 및 섭취량에 따라 동물자원의 비오틴 함량이 달라지는 것으로 보인다고 보고하였다. 본 연구에서 분석한 수산물의 경우도 종에 의한 다른 분포도를 나타내었는데, 이러한 특성 외에도 생산지, 계절, 사료 등 다양한 생육 환경에 따라 비오틴 함량이 달라질 수 있을 것으로 사료된다.
한편, 수산자원 및 가공품의 코발라민류 함량의 분포는 어류 1.40-11.88 μg/100 g, 갑각류 1.30-13.29 μg/100 g, 해조류 0.36-1.07 μg/100 g, 두족류 1.13-4.14 μg/100 g, 패류 1.09-36.13 μg/100 g, 기타 1.82-4.15 μg/100 g, 가공품 0.61-25.83 μg/100 g으로 7개 군별로 다양한 범위를 나타냈다. 일반적으로 코발라민류는 식물성 식품에는 존재하지 않고 동물성 자원에 주로 분포하고 있는 것으로 알려져 있다(Kuhne 등, 1991). 하지만 식물성 식품 중 식용 해조류에서 코발라민류가 존재한다고 보고되어 있는데(Watanabe 등, 2002), 본 연구에서 한국 식단에서 이용되고 있는 해조류인 모자반(gulfweed), 톳(Hizikia fusiforme), 쇠미역(seersucker)을 분석한 결과, 동물성 수산자원에 비하여 상대적으로 낮으나 동물성 식품에만 존재하는 코발라민류를 함유하고 있는 것으로 나타났다. 이는 식용 해조류 자원이 채식주의자들에게는 식물성 식품에서 섭취할 수 없는 코발라민류를 보충할 수 있는 좋은 급원 식품이 될 수 있을 것으로 판단된다. 가장 높은 코발라민류 함량을 보인 시료는 피조개(ark shell)로 36.13 μg/100 g을 나타냈으며, 이 외에도 돌담치(mussel) 21.66 μg/100 g, 진주담치(blue mussel) 17.88 μg/100 g의 수준을 보여 전체적으로 패류에서 코발라민류 함량이 다른 군에 비하여 높은 것으로 보여진다. 하지만 패류 중 참소라(spiny top shell)의 경우는 코발라민류 함량이 1.09 μg/100 g 수준으로 해조류의 모자반과 유사한 수준의 함량을 나타났다. Petrus 등(2009)의 보고에 따르면 비타민 B12는 장내 미생물에 의해 합성되어 축적된다고 하였으며, 두족류의 경우 비가식 부위인 내장을 제거하여 섭취하지만 패류의 경우 내장을 같이 섭취하는 경우가 많아 가장 높은 시아노코발라민 함량을 나타낸 것으로 사료된다. Jeong 등(2019)의 보고에 따르면 수산물을 주 재료로 사용한 국 및 찌개류가 식물성 재료를 사용한 국 및 찌개류보다 높은 비타민 B12 함량을 나타내었다고 하였으며, 특히 패류를 사용한 국 및 찌개에서 가장 높은 비타민 B12 함량을 나타냈다. 이는 패류 섭취가 코발라민류 급원에 도움을 줄 수 있는 것으로 보이며, 평균 필요량인 2.0 μg/일을 충분히 섭취할 수 있을 것으로 사료된다. 한편, 어류에서 청어(pacific herring)는 11.88 μg/100 g, 갑각류에서는 꽃게(gazami crab) 13.29 μg/100 g, 가공품에서는 청어로 만든 과메기(half-dried herring) 25.83 μg/100 g이 높은 코발라민류 함량을 나타냈다.
지금까지 국내에서 발간된 표준수산물성분표(2018)에는 비오틴과 코발라민류 함량에 대한 정보가 수록되지 않았으나, 본 연구의 국내 수산물 및 수산가공품에 대한 비오틴 및 코발라민류 함량 분석법 검증 및 이를 적용한 분석 데이터는 표준수산물성분표의 데이터베이스 확대 구축에 활용될 수 있을 것으로 보여진다. 본 연구는 수산자원의 비오틴 및 코발라민류 최적 단일분석법을 적용한 연구로 향후 국내에서 이용되고 있는 수많은 수산자원에 대한 지속적인 데이터베이스 구축을 위해서는 시간과 비용을 절감할 수 있으면서도 수산자원의 복잡한 matrix에 적용하여 신뢰성 있는 결과를 얻을 수 있는 분석법 개발 및 검증 연구도 필요할 것으로 보인다.
