서 론
인체 내 세포의 정상적인 대사 과정에서 생성되는 활성산소종(reactive oxygen species, ROS)은 superoxide dismutase (SOD), glutathione peroxidase, catalase와 같은 체내 항산화 효소에 의해 적절하게 제거되어 세포 내 신호 전달과 생리적 기능이 원활하게 이루어지도록 하지만, 과도한 ROS의 생성은 산화적 스트레스를 유발하여 세포의 구성 성분인 지질, 단백질 및 DNA를 손상시키고, 노화, 암, 동맥경화, 퇴행성 신경질환 등 다양한 질환의 주요한 위험 요인으로 알려져 있다(Furukawa 등, 2004). Nitric oxide(NO), peroxynitrite(ONOO−), nitrogen dioxide(NO2) 등을 포함하는 활성질소종(reactive nitrogen species, RNS) 또한 생체 내 세포나 세포 소기관의 손상을 진행시키는 것으로 알려져 있으며, 특히 NO는 O2−와 쉽게 반응하여 반응성이 매우 높은 산화제인 ONOO−를 생성하여 생체 분자의 산화적 손상 및 세포 내 미토콘드리아 손상을 야기시킨다(Darley-Usmar 등, 1995; Patel 등, 1999). 최근에는 식품을 통해 섭취하는 비타민 C, 비타민 E, 폴리페놀 화합물 등이 체내에서 항산화제로 작용하여 산화에 대한 손상을 개선시킬 수 있다는 연구가 보고됨에 따라 독성 및 부작용에 대한 문제가 제기되고 있는 합성 항산화제보다 천연물 또는 식품 유래의 천연 항산화제에 대한 연구가 활발하게 이루어지고 있다(Byun 등, 2020; Choi 등, 2015).
식초는 가장 오래된 대표적인 발효 식품 중의 하나로, 음식을 조리할 때 특유의 향미를 부여하여 맛을 풍부하게 하고, 식욕을 증진시키는 조미료로 많이 이용되어왔다. 뿐만 아니라, 체내에서 쉽게 분해될 수 있고, 소화액의 분비를 촉진시켜 소화기관의 운동을 활발하게 한다고 알려져 있으며, 변비개선, 피로회복 등의 효과가 있는 건강식품이다(Lee 등, 1999a). 식초는 제조 방법에 따라 빙초산 또는 초산을 희석한 후 아미노산이나 당류 등의 각종 감미료를 첨가하여 만드는 합성식초와 곡류, 과일즙을 미생물로 발효시켜 제조하는 발효식초(양조식초)로 구분할 수 있다. 발효식초는 곡류나 과일을 원료로 하여 효모에 의해 당이 알코올로 발효되고 초산균에 의해 알코올이 초산으로 전환되는 발효 공정을 통해 제조되며, 발효 과정에서 생성되는 초산과 같은 유기산이 인체의 유해한 활성산소를 제거하는 역할을 한다고 알려져 있다(Budak 등, 2014; Turker 등, 2014). 과거에는 합성식초가 생산 기간이 짧고, 가격이 저렴하여 상업적으로 많이 이용되어 왔으나, 식초 고유의 풍미가 부족하고 빙초산의 합성 및 정제 시 첨가되는 유해물질의 문제점이 제기되어 최근에는 천연 소재를 활용한 발효식초에 대한 관심이 증가하고 있는 추세이다. 전통 발효식초는 원료에 따라 초산 이외에 다양한 유기산, 유리당, 아미노산 및 기능성 물질들이 포함되어 있다고 보고되고 있으며, 이에 따라 현미, 사과, 감, 배, 매실, 복분자 등 곡류와 과실을 이용한 식초를 개발하고자 하는 시도가 활발히 이루어지고 있는 추세이다(Park 등, 2016). 또한, 전통 발효식초는 노화 방지, 당뇨 및 동맥경화 예방뿐만 아니라, 피부 미용 개선, 체지방 감소 효과 등 다양한 생리활성이 보고되어 단순히 조미료가 아닌 건강식품으로서 소비자들의 관심이 꾸준히 증가하고 있다(Hwang 등, 2016; Jeong 등, 2016; Lee 등, 2012).
오디(mulberry)는 뽕나무과(Moraceae)에 속하는 뽕나무(Morus alba L.)의 열매로서 예로부터 ‘상심자’로 불리며, 당뇨, 피로회복, 빈혈, 고혈압, 관절 치료제로 널리 이용되어 왔다(Kim, 1991). 오디 추출물에 대한 생리활성 연구로는 항당뇨, 항염증, 항산화 등의 효과가 보고되어 있으며(Son과 Choi, 2013), 각종 유기산을 비롯하여 anthocyanin 색소를 다량 함유하고 있다고 알려져 있어 천연색소 자원으로 활용될 가능성이 높을 것으로 전망된다(Song 등, 2009). 그러나 오디는 크기가 작을 뿐만 아니라, 수분 함량이 높아 부패가 잘 일어나고 저장성이 떨어지기 때문에 그 이용률이 현저히 낮고, 현재 대부분은 오디를 착즙하여 오디잼, 오디즙, 오디시럽 등 일부의 형태로만 이용되고 있어 다양한 가공 식품 제조 및 특성에 관한 연구가 요구되고 있다(Kim과 Ryu, 2000). 지금까지 오디에 관한 연구로는 오디의 형태와 이화학적 특성(Kim 등, 1999), 오디 영양성분 및 색소(Kim 등, 2010), 오디가루를 첨가한 식빵과 절편의 품질 특성에 대한 연구가 주로 이루어져 있으나, 오디를 이용한 발효식초 제조 및 품질 특성 규명, 이를 이용한 생리 활성 연구 등은 미흡한 실정이다.
따라서 본 연구에는 오디를 이용하여 알코올 및 초산 발효를 통해 전통 발효식초를 제조한 뒤, 이화학적 성분 분석 및 대표적인 시판 과실 발효식초 중 하나인 사과 식초와 함께 라디칼 소거 활성을 비교 분석하여 항산화 효능을 가진 기능성 식품으로서의 이용 가능성에 대해 알아보고자 하였다.
재료 및 방법
본 연구에 사용된 오디는 2018년 6월에 경남 하동군에서 수확한 오디(과상 2호)였으며, 수확 후 −40°C 냉동고에서 냉동 보관하였고, 필요에 따라 상온에서 해동하여 사용하였다(Fig. 1). 항산화 활성을 비교하기 위한 사과 식초(Ottogi Co., Ltd., Seoul, Korea)는 마트에서 구입하여 사용하였다. 1,1-Diphenyl-2-picrylhydrazyl(DPPH)와 2-deoxyribose는 Sigma Chemical Co.(St. Louis, MO, USA)에서 구입하여 사용하였고, hydrogen peroxide(H2O2), sodium hydroxide(NaOH), acetic acid는 Junsei Chemical Co.(Tokyo, Japan)에서 구입하였다. Tiobarbituric acid(TBA)와 trichloroacetic acid(TCA)는 각각 Acros Organics(New Jersey, USA)와 Kanto Chemical Co., Inc.(Tokyo, Japan)에서 구입하여 사용하였다. FeSO4·7H2O는 Daejung Chemicals & Metals Co., Ltd.(Siheung, Korea)에서, phenezine methsulfate(PMS), NADH disodium salt, 그리고 nitrotetrazolium blue chloride(NBT)는 Bio Basic Inc.(Toronto, Canada)에서 구입하였다.
알코올 발효를 위한 효모 종균으로 Saccharomyces cerevisiae KCCM 11215 균주를 사용하였으며, 초산발효를 위한 초산균 종균은 본 실험실에서 분리하여 보관하고 있는 Acetobacter pasteurianus A8(Shin, 2013) 균주를 사용하였다. 효모와 초산균 보존용 배지는 YPDA(0.5% yeast extract, 0.5% peptone, 2% dextrose, 1.5% agar) 배지를 사용하였다. 효모 및 초산균 종균 배양은 엿기름배지(정수 1 L에 엿기름가루 200 g 가하고, 60°C에서 2시간 당화 후 여과하여 여액을 1 L로 조정한 후 121°C에서 15분 멸균)를 사용하였다. 효모 종균 배양을 위해 엿기름배지 100 mL가 들어 있는 250 mL Erlenmeyer flask에 YPDA배지에서 계대배양한 S. cerevisiae KCCM 11215균주를 1 백금이 접종하고 30°C 진탕 배양기(IS-971RF model, Jeiotech Co., Seoul, Korea)에서 160 rpm으로 2일간 진탕 배양하여 알코올 발효를 위한 주모로 사용하였다. 초산균 종초 배양을 위해 1%(v/v) 에탄올을 보충한 엿기름배지 100 mL가 들어 있는 250 mL Erlenmeyer flask에 YPDA에서 계대배양한 A. pasteurianus A8를 1 백금이 접종하고 30°C 진탕 배양기(IS-971RF model, Jeiotech Co., Seoul, Korea)에서 160 rpm으로 3일간 진탕 배양하여 초산발효를 위한 종초로 사용하였다.
실온에서 해동한 오디에 주스의 수득량을 높이기 위해 상업용 pectinase인 plantaseTM(Bision Co., Seoul, Korea)를 주스 양에 대하여 0.4%를 첨가하고, 45°C에서 2시간 처리한 후 천으로 걸러 오디주스를 제조하였다(Kim 등, 2017; Lee 등, 2018). 오디 주스에 설탕을 가하여 당 농도를 15 °Brix로 조정하였으며, 제조한 오디주스는 2 L 광구병(SCHOTT, Mainz, Germany)에 1L 분주하여 80°C에서 15분간 살균한 후 사용하였다. 살균 처리 후 상온으로 냉각한 오디 주스에 맥아 추출액 배지에서 종초 배양한 효모 주모를 5% 부피로 접종한 뒤 30°C에서 8일간 정치, 발효시켜 초산 발효를 위한 알코올 발효 기질을 제조하였다. 알코올 발효가 끝난 후 30°C에서 3일간 진탕 배양한 초산균 종초를 5% 부피비율로 접종하고, 30°C에서 20일간 정치하여 발효시켰다.
시료는 원심분리기(MF-550, Hanil Science Industrial Co., Kimpo, Korea)에서 3,000 rpm으로 15분간 원심 분리한 후 상등액을 취하여 pH meter(model 3510, Jenway, UK)를 사용하여 pH를 측정하였으며, 산도는 원심 분리한 시료 1 mL를 pH 8.2±0.1까지 중화시키는데 소요된 0.1 N NaOH의 소비 mL 수를 구하고, 아래 식에서와 같이 환산하였다.
유리당과 유기산은 HPLC(Agilent 1200 series, Agilent Co., Forest Hill, Vic, Australia)를 이용하여 분석하였다(Cho 등, 2008). 유리당을 분석하기 위해 시료 5 g에 물 25 mL를 가하여 녹인 후 acetonitrile로 50 mL까지 채웠다. 이 용액을 sep-pak NH2 column(Waters Co., Milford, MA, USA)과 0.45 μm membrane filter(Dismic-25CS, Toyoroshikaisha Ltd., Tokyo, Japan)로 여과한 뒤 시험용액으로 사용하였다. 당 분석 column(Polyamine II, 4.6×150 mm, 5 μm, YMC Co., Kyoto, Japan)에 시험용액 20 μL을 주입하고, 35°C에서 이동상 용매(acetonitrile:water = 70:30(v/v)를 1.0 mL/min 속도로 이동시키면서 refractive index(RI, Agilent 1200 series) 검출기 상에서 당을 검출하였다.
유기산 분석을 위해 시료를 원심분리기에서 3,000 rpm으로 15분간 원심분리한 후 상등액을 0.2 μm membrane filter(Dismic-25CS, Toyoroshikaisha Ltd.)로 여과하였다. 전 처리한 시료 20 μL를 TSK gel ODS-100V column(4.6×250 mm, 5 μm, Tosoh Corp., Tokyo, Japan)이 장착된 HPLC 시스템에 주입하고, 30°C에서 이동상 용매(0.1% phosphoric acid)를 1.0 mL/min 속도로 이동시키면서 UV 검출기(Agilent 1200 series, Agilent Co., CA, USA) 210 nm에서 유기산을 검출하였다. 유기산은 같은 조건으로 분석한 표준 유기산의 검량선과 비교하여 정량하였으며, 각 실험은 3회 반복 수행하여 평균 및 표준편차로 나타내었다.
유리아미노산은 시료 5 mL에 5% TCA를 5 mL 첨가하여 원심 분리(10,000 rpm, 10 min)한 다음 0.22 μm membrane filter로 여과하여 얻은 상층액을 아미노산 자동분석기(Model L-8900, Hitachi, Tokyo, Japan)를 이용하여 분석하였다(Choi 등, 2019). 각 실험은 3회 반복 수행하여 평균 및 표준편차로 나타내었다.
총폴리페놀 함량을 측정하기 위해 시료 100 μL와 10% Folin-Ciocalteu’s phenol reagent 200 μL를 혼합한 뒤 700 mM Na2CO3 700 μL를 잘 섞은 후 30분간 상온에 방치하였다. 반응이 끝난 후 650 nm에서 흡광도를 측정하였고, gallic acid를 이용한 검량선과 비교하여 μg gallic acid equivalents (GAE)/mL로 총페놀 함량을 나타내었다.
총플라보노이드 함량을 측정하기 위해 시료 150 μL와 5% NaNO2 75 μL를 섞은 후 6분간 실온에서 방치하였으며, 10% AlCl3 150 μL를 첨가하여 다시 5분간 방치하였다. 그 후 1 N NaOH 750 μL를 혼합하여 15분간 반응시킨 다음 492 nm에서 흡광도를 측정하였다. 총플라보노이드 함량은 quercetin을 이용한 검량선과 비교하여 μg quercetin equivalents(QE)/mL로 나타내었다.
DPPH 라디칼 소거능은 Hatano 등(1989)의 방법으로 측정하였다. Ethanol에 녹인 각 농도별 시료 100 μL와 60 μM DPPH 용액 100 μL를 96-well plate에 혼합하여 30분간 실온에 방치시킨 후, 540 nm에서 흡광도를 측정하였다. DPPH 라디칼 소거능은 다음 식에 따라 계산하였으며, 시료를 첨가하지 않은 대조군과 비교하여 라디칼 소거효과를 백분율과 IC50로 나타내었다.
As는 농도별 시료를 첨가한 실험군, Ab는 blank를 첨가한 대조군, Ac는 시료를 첨가하지 않은 대조군의 흡광도 값을 뜻한다.
OH 라디칼 소거능은 Chung 등(1997)의 방법으로 측정하였다. Fenton 반응에 따라 10 mM FeSO4·H2O-EDTA에 10 mM의 2-deoxyribose solution과 각 농도별 시료를 혼합한 다음, 10 mM의 H2O2를 첨가하여 37°C에서 4시간 배양하였다. 배양된 혼합액에 2.8% TCA와 1.0% TBA solution를 넣은 후 20분간 끓여 식힌 뒤, 490 nm에서 흡광도를 측정하였다. OH 라디칼 소거능은 다음 식에 따라 계산하였으며, 시료를 첨가하지 않은 대조군과 비교하여 라디칼 소거효과를 백분율과 IC50로 나타내었다.
As는 농도별 시료를 첨가한 실험군, Ab는 blank를 첨가한 대조군, Ac는 시료를 첨가하지 않은 대조군의 흡광도 값을 뜻한다.
NO 라디칼 소거능은 Marcocci 등(1994)의 방법으로 측정하였다. 5 mM SNP solution과 methanol에 녹인 각 농도별 시료를 혼합하여 실온에서 150분간 반응시켰고, 이 반응 혼합액을 Griess reagent와 동량으로 96-well plate에 주입하여 실온에서 30분간 배양한 뒤 540 nm에서 흡광도를 측정하였다. NO 라디칼 소거능은 다음 식에 따라 계산하였으며, 시료를 첨가하지 않은 대조군과 비교하여 라디칼 소거효과를 백분율과 IC50로 나타내었다.
As는 농도별 시료를 첨가한 실험군, Ab는 blank를 첨가한 대조군, Ac는 시료를 첨가하지 않은 대조군의 흡광도 값을 뜻한다.
O2− 라디칼 소거능은 Nishikimi 등(1972)의 방법에 따라 측정하였다. 각 농도별 시료에 0.1 M Tris-HCl, 0.1 mM PMS, 0.5 mM NBT, 그리고 0.5 mM NADH를 혼합하여 실온에서 10분간 반응시킨 후, 560 nm에서 흡광도를 측정하였다. O2− 라디칼 소거능은 다음 식에 따라 계산하였으며, 시료를 첨가하지 않은 대조군과 비교하여 라디칼 소거효과를 백분율과 IC50로 나타내었다.
As는 농도별 시료를 첨가한 실험군, Ab는 blank를 첨가한 대조군, Ac는 시료를 첨가하지 않은 대조군의 흡광도 값을 뜻한다.
본 실험에서 측정한 결과는 평균(mean)±표준편차(SD)로 나타내었으며, 통계프로그램인 Statistical Package for the Social Sciences(SPSS version 25, IBM Corporation, Almonk, NY, USA)를 이용하였다. 오디 주스와 오디 식초간의 이화학적 특성 및 성분 분석은 Student’s t-test를 통해 유의성을 검증하였으며, 라디칼 소거 활성은 분산분석(ANOVA, analysis of variance)을 구한 후 Duncan’s multiple range test를 사용하여 변인과의 차이를 분석하였다. 모든 통계적인 유의성은 p<0.05 수준에서 검증하였다.
결과 및 고찰
오디 식초 제조 과정에서 알코올 발효 과정 중 당도와 알코올 함량의 변화를 측정한 결과를 Fig. 2A에 나타내었다. 알코올 발효가 진행됨에 따라 당도가 초기(0일)에 14 °Brix에서 2일 째 6 °Brix로 급격하게 감소하였고, 그 후 완만하게 감소하여 말기(8일)에 5 °Brix로 나타났다. 알코올 함량은 발효가 진행됨에 따라 증가하였는데, 초기(0일)에 0%에서 2일째에 4.0%로 증가하였으며, 말기(8일)에는 5.8%로 나타났다. 따라서, 알코올 발효 과정을 통해 효모가 당을 발효 기질로 이용하여 알코올을 생성한 것으로 사료된다.
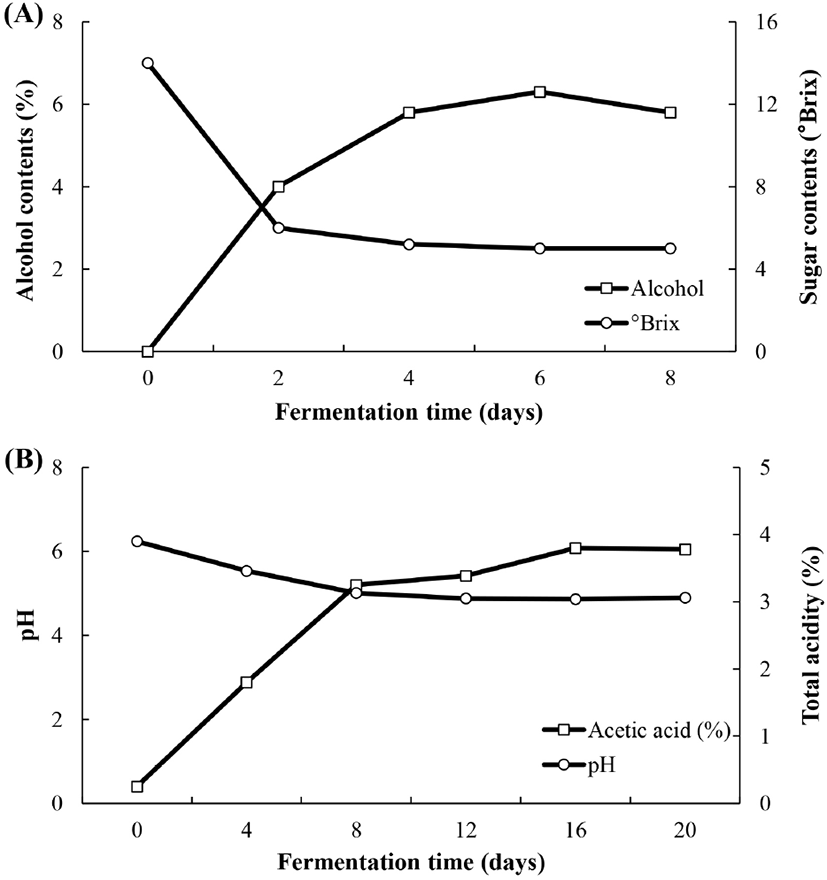
초산 발효과정 중 오디 식초의 pH 및 산도 측정 결과를 Fig. 2B에 나타내었다. 발효 전 오디 식초의 총 산도는 초기(0일)에 0.40%에서 4일과 8일째 각각 2.88%와 5.20%로 급격하게 증가하였으며, 말기(20일)에 6.05%를 나타내는 것을 확인하였다. 오디 식초의 pH는 초기(0일)에 3.90으로 나타났으며, 4일째와 8일째 각각 3.46, 3.13로 감소하였고, 발효 후 20일째 pH는 3.06으로 나타나 총 산도가 증가함에 따라 pH가 감소되는 것을 알 수 있었다. 일반적으로 초산 발효가 진행이 되면 초산균이 알코올을 에너지원으로 이용하거나, 발효기질로 사용하여 유기산 acetic acid를 생성하기 때문에 산도가 높아지고 pH가 낮아지는 현상이 발생한다. 본 연구에서도 발효가 진행됨에 따라 초산균에 의한 유기산의 생성으로 pH가 다소 낮아지는 경향을 나타낸 것으로 사료된다. 식품 공전에서는 식초에 대한 품질 규격으로 총산 함량을 4-20% 범위로 정해놓았으며(KFDA, 2020), 오디 식초의 산도는 이러한 기준에 적합한 것을 확인하였다.
오디 주스와 식초의 유리당 함량을 측정한 결과를 Table 1에 나타내었다. 오디 주스의 총 유리당 함량은 5,514.17 mg%로 주요 성분에는 fructose(2,870.83 mg%), glucose(2,643.34 mg%)가 확인되었으며, 오디 식초의 경우 총 유리당 함량이 1,644.50 mg%로 감소하였고, 주요 성분은 lactose(1,310.06 mg%), glucose(293.20 mg%), fructose(41.25 mg%)으로 나타났다. 이러한 결과는 이전 연구에서 섬애약쑥 추출물로 제조한 식초가 발효 기간 동안 glucose와 fructose의 함량이 감소하였다는 결과와 유사하였다(Shin 등, 2017). Hong 등(2012a)의 연구에 따르면, 유리당이 감소하는 것은 발효 과정 중 초산균의 대사 작용으로 인해 당이 대부분 산으로 전환되고, 일부는 에너지원으로 이용되기 때문이라고 보고하였으며, Sim 등(2016)의 연구에서는 식초 발효 시 초산균은 알코올을 이용하여 산을 생성하며 당이 감소하는 것은 1차 알코올 발효 후 남아있는 효모의 작용으로 인해 당이 분해되기 때문인 것으로 보고하였다. 반면, 오디 식초에서 lactose의 함량이 증가한 것을 확인할 수 있었는데, 영천지역의 오디를 이용하여 식초를 제조한 선행연구에서도 발효 후 lactose가 분석되어 본 실험 결과와 유사한 경향을 나타내었으나, 이에 대한 추가적인 연구가 필요하다고 생각된다(Chu 등, 2012).
일반적으로 식초의 유기산 성분은 식초의 품질과 산미에 중요한 영향을 미치는 것으로 알려져 있으며, TCA 회로 활성화를 통해 젖산 분해를 촉진시키는 기능이 있다고 보고된 바 있다(Nakanc, 1988). 발효 유무에 따른 유기산 함량을 살펴본 결과(Table 2), 발효 전 오디 주스의 주요 유기산은 citric acid로 616.74 mg%가 함유되어 있었으며, 그 다음으로 succinic acid가 153.34 mg%, acetic acid가 12.95 mg%, 그리고 oxalic acid가 1.99 mg%가 검출되었다. 오디 식초의 경우, acetic acid가 주요 유기산이었으며, 그 함량은 2,725.59 mg%로 나타났다. 이어서 오디 식초는 citric acid가 524.66 mg%, succinic acid가 480.63 mg% 순으로 높았으며, oxalic acid는 검출되지 않았다. 이전 연구에 따르면 복분자를 이용한 식초의 경우 acetic acid가 5,321.71 mg%로 가장 많았고(Hong 등, 2012b), malic acid가 348.26 mg%, succinic acid가 140.91 mg% 순으로 검출되었으며, 포도 과즙을 이용한 고산도 식초에서는 acetic acid가 10,085.6-10,351.4 mg%, malic acid가 305.2-317.4 mg%, citric acid가 279.9-311.7 mg% 순으로 높게 나타났다(Woo 등, 2015). 꾸지뽕 발효식초의 유기산 조성을 측정하였을 때도 acetic acid가 가장 많은 함량을 나타내어(Lee 등, 2019), 발효식초의 주요 유기산이 acetic acid으로 본 연구와 일치하는 경향을 확인할 수 있었으나, 유기산의 구성 성분과 함량에 차이가 있는 것은 발효 시 이용되는 과실의 종류, 초산균의 종류, 발효 온도 및 여과방식에 따라 다르게 나타나는 것으로 알려져 있다(Baek 등, 2016). 또한, 발효 후 식초에서 발효 전보다 citric acid와 succinic acid가 증가한 것을 볼 수가 있었는데, 이는 원료에 존재하는 성분이 식초로 이행되었거나, 발효 중 부산물이 생성되어 나타난 것으로 생각되며, 체내 TCA cycle에서 이용되는 주요 유기산으로 생리적 상태에 따라 필요한 물질로 쉽게 전환될 수 있어 생체 내 균형을 유지하는데 도움을 줄 수 있을 것으로 사료된다(Lee 등, 1999b).
식초에 함유되어 있는 아미노산은 원료에 따라 식초의 맛에 영향을 주며, 조성과 함량에 따라 식초의 품질에 영향을 미치는 것으로 알려져 있다. 오디 주스와 오디 식초의 유리아미노산 함량을 분석한 결과를 Table 3에 나타내었다. 오디 주스와 오디 식초의 아미노산은 각각 31종이 검출되었으며, 발효를 하기 전 오디 주스에서는 유리아미노산 함량이 172.95 mg%였으나, 오디 식초는 34.52 mg%로 감소된 것을 확인할 수 있었다. Jo 등(2014)의 연구에서도 배를 이용하여 식초를 제조할 때 초산 발효를 하는 과정에서 유리아미노산의 함량이 40% 이상 감소되었다고 보고하였다. 식초는 초산 발효 과정 중 원료의 아미노산이 자화되어 전체적으로 함량이 감소하며, 숙성기간 중에도 아미노산의 함량이 감소하는 것으로 보고되어 있다. 오디 식초의 주요 아미노산은 lysine (4.48 mg%), arginine(4.41 mg%), phenylalanine (2.99 mg%), tyrosine(2.36 mg%) 순으로 높은 함량을 나타냈으며, 곡류의 제한 아미노산이자 항산화 효과가 있다고 알려진 lysine (Al-Malki, 2015)과 면역 증강 및 비만 예방의 효과가 있다고 보고되어진 ornithine(Moinard 등, 2000; Moon 등, 2012)의 함량이 오디 주스에 비해 증가한 것을 알 수 있었다. 반면, 오디 식초는 주스에 비해 glutamic acid와 aspartic acid가 크게 감소하는 것으로 나타났는데, 이는 식초를 발효하였을 때 glutamic acid, aspartic acid와 proline의 감소 폭이 크다는 이전 보고와 유사한 경향을 나타내었다(Yulkimichi 등, 1987). Baek 등(2013)의 연구에 따르면 알코올 발효 종료 후 γ-amino-n-butyric acid의 함량이 발효 전보다 후에 감소되는 것으로 나타난 결과를 보았을 때, 오디 식초의 γ-amino-n-butyric acid 함량이 감소한 것 또한 여과 방식에 따라 차이를 보일 것으로 예상되며, 이에 따른 추가적인 연구가 필요할 것으로 생각된다.
폴리페놀 화합물은 천연물에 많이 함유되어 있는 성분으로 한 개 이상의 수산기(-OH)를 가지고 있으며, 수소 또는 전자를 제공함으로써 활성산소에 의해 손상되는 DNA나 세포막, 단백질 및 효소에 대해 항산화 작용에 중요한 역할을 하는 물질이라고 알려져 있다(Tsao, 2010). 플라보노이드는 anthocyanidins, tannins, cathechins 등 폴리페놀에 속하는 성분으로 C6-C3-C6을 기본 골격으로 하여 노란색 또는 담황색을 나타내며, 항산화능이 높은 물질이다(Heim 등, 2002). 본 연구에서 제조된 오디 식초의 총폴리페놀과 총플라보노이드 함량을 측정한 결과(Table 4), 각각 778.06 μg GAE/mL와 294.67 μg QE/mL로 발효 전 오디 주스에 비해 다소 감소하는 경향을 나타내었다. 이전 연구에 따르면 식초의 초산 발효 과정에서 강력한 페놀 분해 작용이 일어나 총페놀 함량이 감소한다고 보고되었고(Andlauer 등, 2000), 레빗아이 블루베리로 제조한 식초의 경우, 초산 발효 과정을 통해 anthocyanidins 함량, 총폴리페놀 함량 감소 및 그에 따른 항산화 효과가 감소하는 경향을 나타내었다(Su와 Chien, 2007).
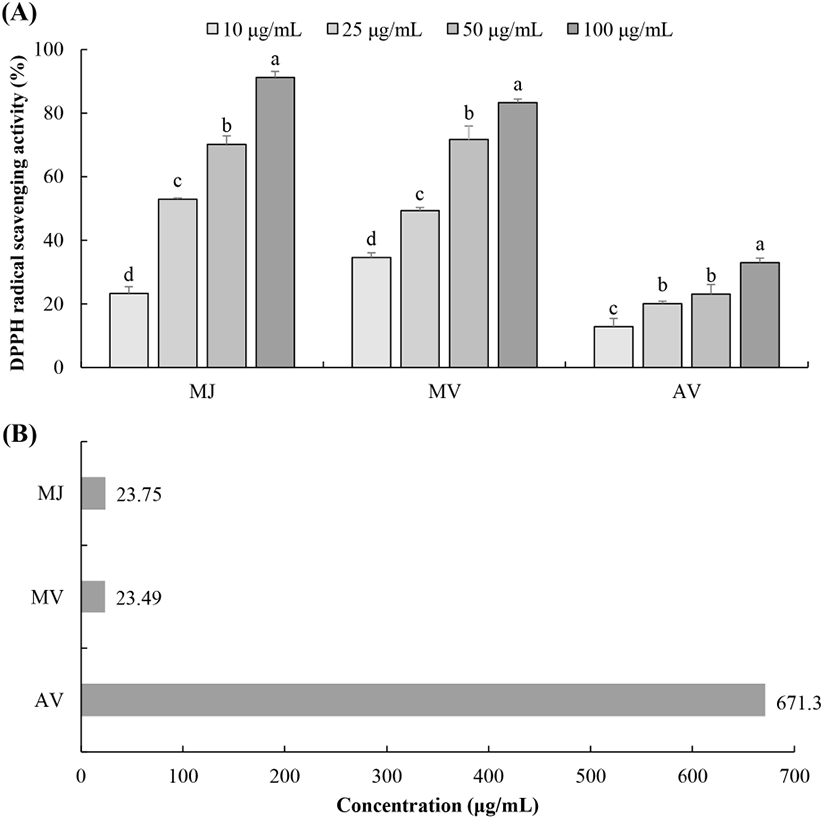
DPPH 라디칼 소거 활성법은 화학적으로 유도되는 안정한 라디칼로서 비교적 간단하면서도 대량으로 측정 가능하고, 재현성이 높아 다양한 천연소재의 항산화 능력을 알아보기 위해 가장 쉽고 널리 이용되는 방법 중의 하나이다. 분자 내 라디칼을 가지고 있는 보라색의 diphenylpicrylhydrazyl이 항산화제에 의해 전자나 수소를 받아 불가역적으로 안정한 분자인 diphenylpicrylhydrazine을 형성하여 환원됨에 따라 보라색에서 탈색되는 원리를 이용하여 라디칼 소거능을 측정한다(Wang 등, 2005). 오디 주스, 오디 식초와 시판 사과 식초의 DPPH 라디칼 소거효과를 살펴본 결과(Fig. 3), 모두 10-100 μg/mL 농도에서 농도 의존적으로 소거 활성이 증가하는 것을 확인할 수 있었다. 특히 시판 사과 식초의 IC50은 671.30 μg/mL였으나, 오디 주스와 오디 식초는 각각 23.75 μg/mL와 23.49 μg/mL로 낮은 값을 보여 효과적인 DPPH 라디칼 소거 활성을 확인할 수 있었으며, 발효에 따른 DPPH 라디칼 소거능의 큰 차이를 나타내지 않았다. 이전 연구에 따르면 오디 주스의 물 추출물과 메탄올 추출물을 처리하였을 때 DPPH, OH 및 O2− 라디칼 소거능이 농도 유의적으로 증가하였으며, 오디 ethyl acetate 분획물의 DPPH 소거능 EC50 값은 64.9 μg/mL로 양성대조군으로 사용된 합성 항산화제인 butylated hydroxytoluene의 EC50 값인 144.6 μg/mL보다 2.2배 낮은 값을 보여 강한 항산화 활성을 나타냈다고 보고한 바 있다(Jun 등, 2014; Kwon 등 2005). 오디 주스가 식초로 발효가 됨에 따라 총 페놀 함량과 플라보노이드 함량은 다소 감소하였으나 DPPH 라디칼 소거능이 유사하게 나타난 이유는 식초의 유기산이 carboxyl에 음전하(COO−)를 띄고 있어 전자를 공여할 수 있는 성질이 있으므로 이를 통해 항산화 활성에 기여했을 것으로 생각된다.
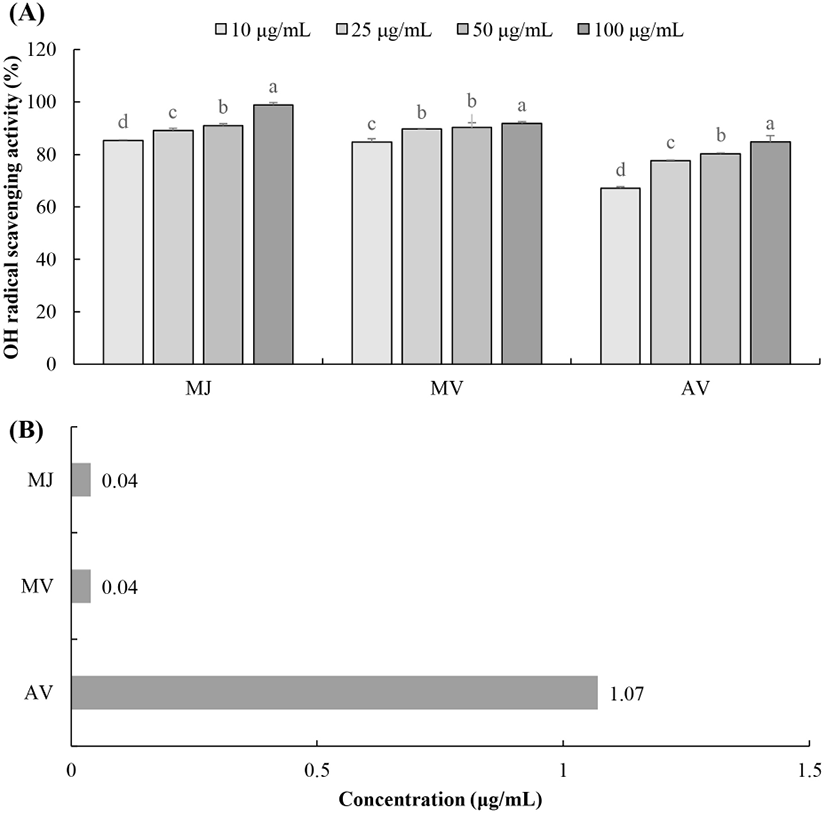
자유 라디칼은 세포가 호기성 환경에 노출되어있는 한 미토콘드리아 내 전자전달계에서 끊임없이 생산되는데, 그 중 OH 라디칼은 생체 내에서 발생하는 ROS 중에서 산화적 손상에 가장 독성이 강하고 반응성이 매우 커 인접한 생체 분자에 지질 산화, DNA 손상 및 돌연변이를 유발하여 다양한 질환의 발병에 관여한다(Althaus 등, 1994; Machlin 등, 1987). 정상적인 경우, OH 라디칼은 fenton 반응에 의해 O2−와 H2O2로부터 생성되며, 활성산소종인 ONOO−의 분해에 의해 생성되기도 한다(Freeman과 Carpo, 1982). 오디 주스, 오디 식초 및 시판 사과 식초의 OH 라디칼 소거능을 살펴본 결과(Fig. 4), 오디 주스와 오디 식초는 농도 유의적으로 소거 활성이 증가하였고, 시판 사과 식초보다 높은 OH 라디칼 소거 활성을 나타냈으며, 발효에 따른 라디칼 소거 효과에는 큰 차이를 나타내지 않았다. 특히 오디 주스와 오디 식초는 IC50값이 0.04 μg/mL를 나타내었고, 10 μg/mL의 낮은 농도에서도 80% 이상의 소거능을 나타내어 OH 라디칼에 대한 강력한 항산화 효과를 가지는 것을 확인하였다. 따라서 오디 식초의 이러한 라디칼 소거 효과는 체내에서 발생하는 산화적 스트레스를 줄여주는데 도움을 줄 것으로 생각된다.
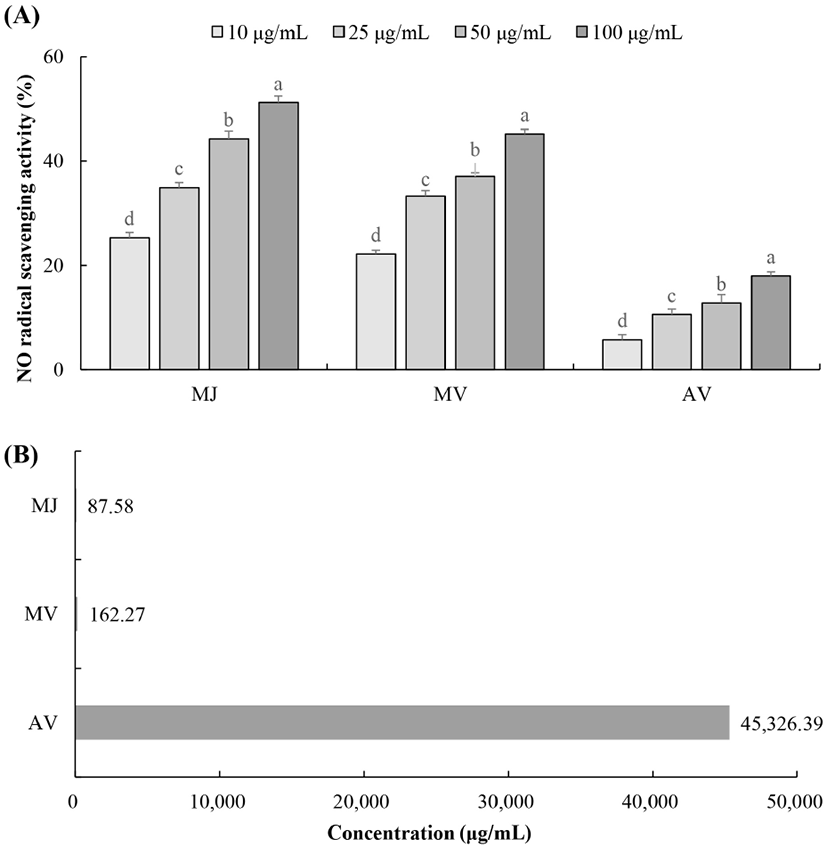
NO는 생체 내에서 항상 일정한 농도로 생성되어 혈액응고 및 혈압조절 기능 등 생리적 기능 유지 역할을 한다(Nakagawa와 Yokozawa, 2002). 또한, NO는 감염질환, 스트레스 및 종양형성 초기에 숙주방어를 위해 다양한 면역세포들이 활성화되면 과다하게 생성되어 감염을 일으키는 병원균을 공격하거나, 암 초기단계에 종양세포를 파괴하여 생체를 보호한다(Lipton, 1999). 그러나 과다하게 생성된 NO는 O2−와 결합하여 반응성이 크고 독성이 강한 산화제인 ONOO−를 생성하는데, 이는 단백질, DNA 등과 반응하여 세포 및 조직 손상을 야기하고, 알츠하이머병이나 파킨슨병과 같은 퇴행성 질환에도 중요한 요인으로 작용하는 것으로 알려져 있다(Althaus 등, 1994; Lee 등, 2009; Lee와 Kim, 2009). NO는 생리적 pH 상태(pH 7.4)의 SNP 용액에서 자연스럽게 생성되며, Griess reagent로 산소와 반응한 아질산염 생성량을 확인할 수 있다(Green 등, 1982). 본 실험에서 SNP를 이용하여 NO 소거 활성을 측정한 결과(Fig. 5), 오디 주스와 오디 식초 모두 농도 의존적으로 증가하는 경향을 보였으며, 모든 농도에서 시판 사과 식초보다 높은 NO 라디칼 소거 활성을 나타내었다. 특히 오디 주스와 오디 식초의 경우 100 μg/mL 농도에서 각각 51.25%와 45.24%의 가장 높은 NO 소거 효과를 나타냈으며, 오디 주스가 오디 식초에 비해 다소 낮은 IC50 값을 나타낸 것은 오디 주스의 총 페놀 및 플라보노이드 함량이 상대적으로 높기 때문인 것으로 사료된다(van Acker 등, 1995).
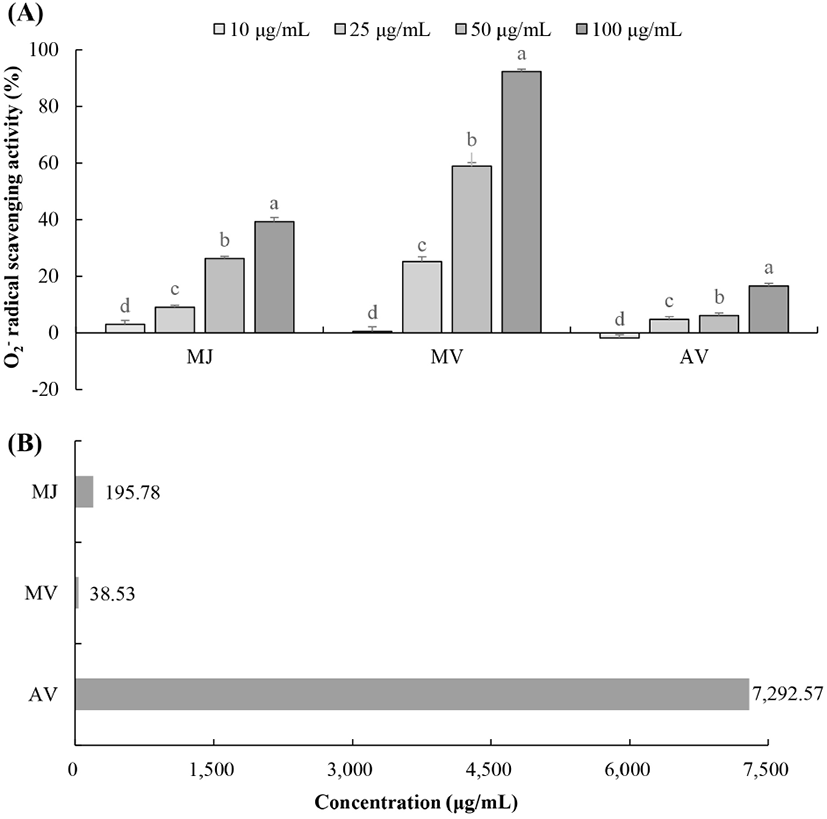
O2− 라디칼은 활성산소종 중에서 가장 먼저 생성되고 반응성이 약하지만, 일부 분자를 직접 공격할 수 있다. 예를 들어, glutathione peroxidase를 불활성화 시킬 수 있으며, DNA를 직접적으로 변형시키지는 못하지만 transition metals이 존재할 때 OH 라디칼 형성을 촉진한다(Kaur와 Kapoor, 2002). Fig. 6에서 보는 바와 같이 오디 주스와 오디 식초 모두 농도 의존적으로 O2− 라디칼을 소거하는 것으로 나타났으며, 시판 사과식초보다 더 높은 소거능을 나타내었다. 특히 오디 식초의 IC50은 38.53 μg/mL로 오디 주스(IC50, 195.78 μg/mL)보다 높은 O2− 라디칼 소거 효과를 나타내었다. 이전 연구에 따르면 발효 과정 중에 생긴 유기산 등 추가적인 유효성분이 라디칼 소거 활성을 향상시킨다고 보고된 바 있으며, 오디 주스에 비해 오디 식초에 많이 함유되어 있는 아미노산인 lysine이 항산화 효능이 있다고 알려져 있다(Al-Malki, 2015; Li 등, 2013). 그러나 lysine이 식초의 항산화 작용에 어떠한 기전을 통해 영향을 나타내었는지에 대한 추후 연구가 필요한 것으로 생각되며, 각 라디칼에 결합하는 유효 물질의 종류에 따라 라디칼 소거능이 다르게 나타났을 가능성이 있을 것으로 사료된다.