서 론
체내의 산소에는 약 95%의 좋은 산소와 약 5% 정도의 나쁜 산소가 있다. 좋은 산소가 어떠한 환경적 요인과 대사 현상으로 인해 전자를 받아 변화되어 생체에 유해한 나쁜 산소인 활성산소[oxygen radical, oxygen free radical, reactive oxygen species(ROS)]가 된다(Choi, 1998). 이 활성산소는 세포를 파괴하고 효소 활성을 저해하여 산화적 손상(oxidative damages)을 유발하여 다양한 질병을 일으키는 원인이며, 노화를 촉진시킨다. 생명체의 대사과정 중 필연적으로 생성되는 활성산소 종은 free radical로 인한 높은 반응성으로 염증 유발 및 세포 노화로 다양한 질병을 야기한다(Beckman 등, 1998; Haddad, 2002). 이러한 활성산소를 제거하는 주요 효능성분으로는 L-ascorbic acid (vitamin C), epigallocatechin gallate(EGCG), butylated hydroxy anisol(BHA) 등이 있으며, 이것들은 free radical을 제거하는 -OH group을 통해 활성산소를 소거하는 환원성을 가지며, 보통 동ㆍ식물성 유래 천연 항산화제로 알려져 있다(Ding 등, 2009). 그중에 EGCG는 비타민 E보다 25배, 비타민 C보다 100배 정도의 항산화 효과를 가지고 있다(Bagchi, 1999). 최근 현대 사회에 미세먼지가 큰 문제가 되고 있다. 공기 중 돌아다니는 미세먼지와 초미세먼지는 PM2.5로 입자가 매우 작으며 세계보건기구(WHO)에서 1급 발암물질로 인체에 매우 치명적이다(Kim 등, 2018). 경제가 발전하면서 발생하는 인위적인 발생원에 의해 배출되는 경우 직경이 대부분 작은데, 이 입자를 구성하는 화학물질로 중금속(Cd, Cr, As, Pb 등)이나 방향족 탄화수소(benzo pyrene 등) 같은 유해한 성분이 다량 포함되어있으며(Lee, 2003), 다른 환경오염 물질과 흡착해서 피부에 침투된다. 이로 인해 피부 장벽이 약해지고, 각질층이 제대로 역할을 못한다. 피부 속에 침투한 미세먼지는 미토콘드리아를 손상시켜 콜라겐 합성을 방해하고 분해를 증가시키며, 멜라닌 색소를 자극해 여러 가지 피부 질환을 일으킬 수 있다. 또한, 미세먼지에 포함된 중금속이 피부에 흡착되면 재생력이 떨어져 피부 결이 거칠어지고 탄력도 감소하게 되면서 피부 노화가 시작되어 주름이나 검버섯 등이 나타날 수 있다. 이는 가려움과 피부건조 등을 동반하며 만성적으로 재발하는 아토피는 정확한 원인이 규명되지 않았지만, 미세먼지의 중금속이나 공해물질이 알레르기 면역 반응을 유발해 증상이 악화될 수 있다(Seo 등, 2016). 이러한 이유로 소비자들은 미세먼지로 인해 발병하는 다양한 질병의 예방 및 치료에 관심이 높아지고 있으며, 이에 따라 피부로부터 미세먼지를 막아주거나 잘 씻겨나가게 해주는 화장품의 수요도 증가하고 있다.
님트리(Azadirachta indica)는 neem 또는, nim tree라고 불리며, 멀구슬나무과와 비슷한 종이다. 인도와 네팔, 파키스탄, 방글라데시, 스리랑카, 몰디브와 같은 열대 및 아열대 지역에서 서식하고 높이가 15–20 m로 급성장하는 특징을 가지고 있다. 인도 대륙에서 해충 방지제, 치과위생, 사막화방지 및 전통의학으로 사용되었으며, phytochemical을 함유하고 있어서 발열, 말라리아, 기생충 감염, 궤양 및 염증 및 피부와 같은 산화적 장애 관련 질병(Clayton 등, 1996), 류마티스성 관절염 질환 발열과 당뇨병 치료(Van der Nat 등, 1991)로 사용되고 있다. 하지만 님트리의 효능을 평가하기 위해 수행된 연구는 neem tree oil의 효능 정도뿐 거의 없는 실정이다.
본 연구에서는 님트리잎을 70% ethanol로 추출하여 생리활성 실험과 LPS로 유도된 대식세포를 이용하여 염증성 cytokine과 iNOS, COX-2 단백질의 발현 정도를 연구하고, 각질세포와 섬유아세포를 가지고 중금속 항공해(antipollution) 효과, 미세먼지로부터의 피부효과, 항균실험 등을 통해 효능 검증을 진행하고, anti-pollution 화장품 소재로서의 활용 여부를 알아보고자 하였다.
재료 및 방법
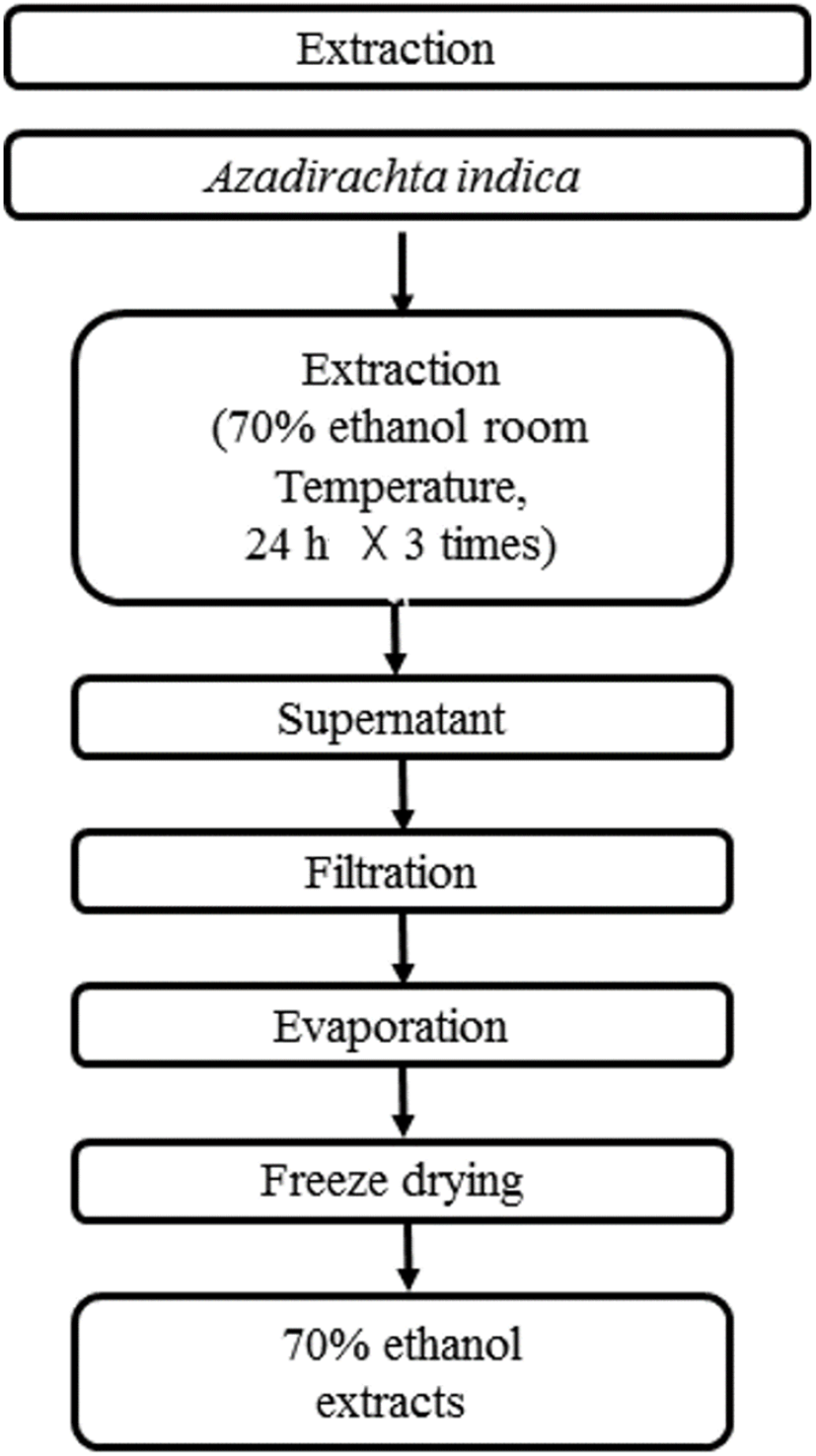
본 실험에 사용한 님트리(Azadirachta india)는 TNVHH SBJ Viet Nam Co.에서 구입하여 이용하였다. 70% ethanol 추출물은 님트리잎을 건조한 뒤 건조된 시료 중량의 10배의 용매로 상온에서 24시간 침지하여 추출하는 것을 3회 반복하여 추출액을 여과지(No.20 filter paper, Hyundai Micro Co., Ltd., Seoul, Korea)로 여과, 농축, 동결건조하여 분말화하였다. 수율은 29.32%였다. 추출물은 4°C 냉장실에 보관하고, 본 실험의 시료로 사용하였다(Fig. 1).
실험에 사용된 시약은 다음과 같다. 2,2-Disphenyl-1picrylhydrazyl, 2,2-azino-bis(3-ethylbenzo-thiazoline-6-sulphonic acid) diammonium salt, potassium peroxodisulfate, butylated hydroxy anisole, L-acorbic acid, tannic acid, xanthine, xanthine oxidase, nitro blue tetrazolium(NBT) 등은 Sigma-Aldrich Co., Ltd.(St. Louis, MO, USA)의 제품을 사용하였다. FolinCiocateu phenol reagent는 Junsei Chemical Co., Ltd.(Tokyo, Japan)의 제품을 사용하였다. potassium phosphate monobasic, potassium phosphate dibasic 등은 Duksan Pure Chemicals Co., Ltd.(Ansan, Korea)의 제품을 사용하였으며, 3,4-dihydroxy-L-phenylalanine, Tyrosinase from mushroom 등은 Sigma-Aldrich Co., Ltd.의 제품을 사용하였다. Sodium phosphate monobasic dihydrate, sodium phosphate dibasic anhydrous 등은 Duksan Pure Chemicals Co., Ltd.의 제품을 사용하였다. MITF, Tyrosinase, TRP-1, TRP-2. 2차 antibodies는 Biotech(Santa Cruz, CA, USA)에서 구입하였다. N-Succinyl-Ala-Ala-Ala-p-nitroanilide, Elastase from porcine pancreas 등은 Sigma-Aldrich Co., Ltd.의 제품을 사용하였다. MMP-1, Filaggrin 2차 antibodies는 Biotech에서 구입하였고, 균주로는 Escherichia coli KCTC 2441, Staphylococcus aureus KCTC 1916, Staphylococcus epidermidis KCTC 1917, Pseudomonas auruginosa KCTC 1750, Enterobacter cloace KCTC 2361, Propionibacterium acnes KCTC 3065, Candida albicans KCTC 7965 등이 사용되었다. 배지로는 Gifu anaerobic medum(GAM)는 Nissui Co.(Japan)에서 Nutrient agar(NA), Tryptic soy agar(TSA), Yeast Mold agar(YMA), Yeast Mold broth(YMB), Nutrient broth(NB)와 Tryptic soy broth(TSB)는 Difco Lab.(sparks, NV, USA)에서 구입하여 사용하였다. 세포주 Murine macrophage cell(RAW 264.7)은 ATCC(Manassas, VA, USA)에서 구하였으며, Keratinocyte cell(HaCaT)은 한약진흥재단(Gyungsan, Korea)에서 분양받아 사용하였다. 세포 배양을 위한 fetal bovine serum(FBS), dulbecco’s modified eagle medium(DMEM)은 GE HLS(Logan, UT, USA)에서 구입하여 사용했으며, trypan blue stain, trypsin-EDTA은 Gibco Co.(Grand Island, NY, USA)에서 구입하였고, MTT 시약은 Sigma-Aldrich Co., Ltd.에서 구입하여 사용하였다. Griess reagent, Lipopolysaccharide 등은 Sigma-Aldrich Co., Ltd.에서 구입하여 사용하였으며, Benzo[e]pyrene은 Sigma-Aldrich Co., Ltd.에서 구입하였다. 또한, Fine Dust(PM10-like)는 Sigma-Aldrich Co., Ltd.에서 구입하여 사용하였다.
본 실험에 사용된 기기는 ELISA reader(Spectra max 190, Moleculer devices, Sunnyvate, USA), freeze drier(Ilshin, Korea), autoclave(Hanbaek Scientiffic Co., Korea), Microscope (Olympus Co., Ltd,. Japan), Rotary vacuum evaporator (Rikakikai Co., Ltd., Japan), Digital reciprocating shaker (Daihan Scientific Co., Ltd., Korea), Western imaging system (CAS-400SM, Davinch-K Co., Ltd., Korea), TP rofessional basic thermocycler(Thistle Scientirfic Co., Ltd., UK), Step one real-time pcr system(Thermo Fisher Scientific Co., Ltd., USA), BOD incubator(Hanbaek Scientiffic Co., Korea), CO2 incubator(VS-9160GC, Hanbaek Scientiffic Co., Deajeon, korea)를 사용하였다.
ABTS+ cation decolorization assay 방법(Rice-Evans 등, 1974)에 따라 ABTS radical을 이용한 항산화력을 측정하였다. 7 mM 2,2-azino-bis와 2.4 mM potassium persulfate를 같은 비율로 섞고, 차광하여 12–24시간 동안 방치하여 반응을 시킨 후 실험을 진행하였다. 시료의 농도는 5, 10, 50, 100, 500, 1,000 μg/mL 농도로 희석하여 준비하였고, 양성 대조군으로는 epigallocatechin gallate(EGCG)를 사용하였다. 이후 96-well plate에 용액 100 μL와 각 추출물 100 μL를 가하여 25°C에서 7분간 반응시킨 뒤 파장 734 nm에서 흡광도를 측정하고 저해율(%)로 나타내었다.
DPPH radical 소거능의 효과 측정은 Blois(Blois, 1958)의 방법으로 측정하였다. 2,2-Diphenyl-1-picrylhydrazyl(DPPH)를 0.45 mM 농도가 되도록 99% ethanol로 녹여 준비하고, 시료의 농도는 5, 10, 50, 100, 500, 1,000 μg/mL 농도로 희석하여 준비하였다. 양성 대조군으로는 epigallocatechin gallate(EGCG)를 사용하였다. 이후 96-well plate에 각 추출물 120 μL와 DPPH 60 μL를 첨가하고, 실온에서 차광하여 15분 동안 반응시키며, 517 nm에서 ELISA reader를 사용하여 소거활성을 측정하였다.
총폴리페놀 화합물은 Folin-Denis 방법(Folin과 Denis, 1912)으로 측정하였다. 시료는 증류수에 5, 10, 50, 100, 500, 1,000 μg/mL 농도로 희석하여 준비한다. 0.2 mL Folin Ciocalteu reagent를 첨가하여 잘 혼합한 후 3분 동안 실온에 방치하였다. 3분 후 0.7 M Na2CO3 포화용액 0.5 mL를 가하여 섞은 후 각 추출물 0.5 mL씩 농도별로 넣은 후 1시간 반응시킨 뒤, 725 nm에서 흡광도를 측정하였다. Tannic acid를 사용한 표준곡선을 이용하여 양을 환산 후 총폴리페놀 함량을 표기하였다.
Marklund(Marklund와 Marklund, 1974)의 방법에 따라 superoxide dismutase(SOD) 유사활성을 측정하였다. 시료의 농도는 5, 10, 50, 100, 500, 1,000 μg/mL로 준비하였고, 양성 대조군으로는 L-ascorbic acid를 사용하였다. 96-Well plate에 시료용액 20 μL에 50 mM Tris-HCl buffer(pH 8.5) 130 μL, 증류수에 녹인 7.2 mM pyrogallol 20 μL를 넣고 20분 동안 실온에서 차광하여 반응시킨 후 420 nm에서 흡광도를 측정하여 pyrogallol의 양을 측정하였다.
Nitroblue tetrazolium(NBT) 환원방법(Fridovich, 1970)에 따라 superoxide anion radical 소거능을 측정하였다. 시료를 5, 10, 50, 100, 500, 1,000 μg/mL의 농도로 희석하여 각 시료 0.1 mL와 0.1 M potassium phosphate buffer(pH 7.5) 0.4 mL에 NBT(0.24 mM)와 xanthine(0.4 mM)을 녹인 substrate 2 mL를 첨가하고 xanthine oxidase(0.2 U/mL) 2 mL를 첨가하여 20분 동안 37°C에서 반응시킨 후 1 N HCl 1 mL를 첨가하여 흡광도 560 nm에서 측정하였다. 양성 대조군으로는 epigallocatechin gallate(EGCG)를 사용하였다.
항균력 측정 실험을 위해서 전처리 배양 및 본 실험의 배양을 위해 E. coli, S. epidermis, P. aeruginosa 및 E. cloacae의 액체배지로는 Nutrient broth(NB)를 S. aureus의 액체배지로 Tryptic soy broth(TSB)를 사용하였으며, P. acnes의 액체배지로 Gifu anaerobic medium(GAM)을 사용하였으며, C. albicans균의 액체배지로 yeast mold broth (YMB)를 사용하였다. 고체 배지는 nutrient agar(NA), Tryptic soy agar(TSA), Yeast Mold agar(YMA)와 Gifu anaerobic medium(GAM)을 사용하였으며, 실험에 있어서 본 배지에 agar powder를 첨가하여 실험에 사용하였다.
Paper disc(Conner과 Beuchat, 1984)를 이용하여 생육 저해력을 측정하였다. 즉, 액체 배지 15 mL에 평판 배지에서 배양된 각 균주를 1 백금이 취해서 18–24시간 배양하여 활성화시킨 뒤 다음 액체 배지 15 mL에 균액을 0.1 mL 접종하여 4–8시간 본 배양한 다음 평판배지 1개당 균수가 약 1×106 cells가 되게 접종하여 멸균된 명봉을 사용하여 균일하게 도말하였다. 멸균된 filter paper disc(8 mm, Tokyo, Japan)를 고체 평판배지에 올려놓고 시료를 농도별로 0.05 mL/disc가 되도록 흡수시켜 세균은 37°C 인큐베이터에, 진균은 25°C 인큐베이터에 12–48시간 배양하여 disc 주위의 Clear zone(mm)의 직경을 측정하여 저해활성을 확인하였다.
Tyrosinase 저해활성을 Yagi 등의 방법(1986)에 따라 측정하였다. 시료는 5, 10, 50, 100, 500, 1,000 μg/mL 농도로 희석하여 준비하였고, 양성 대조군으로 L-ascorbic acid를 사용하였다. 67 mM sodium phosphate buffer(pH 6.8) 80 μL에 10 mM L-DOPA를 녹인 substrate 40 μL와 시료 40 μL를 섞은 혼합액에 mushroom tyrosinase(125 unit/mL) 40 μL를 첨가하여 10분간 37°C에서 반응시킨 후 흡광도를 492 nm에서 측정하였다.
Elastase 저해활성은 Cannell 등(1988)의 방법을 참고하여 실험을 진행하였다. N-syccinyl-(L-Ala)-p-nitroanailide를 사용하여 36°C에서 25분간 기질로부터 생성되는 p-nitroanilide의 생성되는 양을 405 nm에서 ELISA로 측정하였다. 그 후, 시료는 1,000 μg/mL 농도로 희석하여 시료액을 40 μL로 취하고 50 mM 농도의 Tris-HCl buffer(pH 8.6)에 녹인 Porcine pancreas elastase (0.5 unit/mL) 용액 40 μL를 가한 후 기질로 50 mM 농도의 tris buffer(pH 8.6)에 녹인 N-succinyl-(L-Ala)3-p-nitroanailide을 첨가하여 20분 동안 반응시킨 후 결과를 측정하였다. 양성 대조군으로는 epigallocatechin gallate(EGCG)를 사용하였다.
본 실험에서 이용한 RAW 264.7 macrophage cell, CCD-986sk cell, HaCaT keratynocyte cell은 10% FBS와 1% penicillin/streptomycin(100 U/mL)을 첨가한 DMEM 배지를 사용하였으며, 37°C, 5% CO2 incubator에 적응시켜 계대 배양하였다. RAW 264.7은 cell scraper를 이용해서, HaCaT cell과 CCD-986sk cell의 경우 phosphate buffer saline(PBS)로 세척 후 trypsin-EDTA를 사용해서 세포를 수확한 후 계대 배양하였다.
세포 독성 측정은 Carmichael(Carmichael 등, 1987)의 방법에 따라 측정하였다. 96-well plate에 RAW 264.7, HaCaT cell은 5×103 cells/well이 되게 분주하고, CCD-986sk cell은 1×104 cells/well이 되게 분주한 뒤, RAW 264.7, HaCaT cell, CCD-986sk cell 모두 시료를 5, 10, 25, 50, 100, 250, 500 μg/mL 농도 별로 제조하여 0.02 mL 첨가 후 RAW 264.7 cell, HaCaT cell은 37°C, 5% CO2 incubator에서 24시간 배양하였고, CCD-986sk cell은 37°C, 5% CO2 incubator에서 48시간 배양하였다. 그 후 2.5 mg/mL 농도로 제조한 MTT 용액을 0.02 mL 첨가하여 4시간 동안 배양시켰다. 그 후 배양액을 최대한 제거하고 각 well 당 DMSO(dimethyl sulfoxide, DUSAN)를 0.1 mL를 가하여 실온에서 30분간 충분히 반응시켜 ELISA reader로 540 nm에서 흡광도를 측정하였다.
Nitric oxide(NO) 측정은 세포의 상등액의 NO의 양을 nitrite and nitrate로 측정하였다(Green 등, 1982). 96-well plate에 세포주 RAW 264.7을 1×104 cells/well이 되도록 분주하고, incubator에서 37°C, 5% CO2 조건으로 24시간 동안 배양시켰다. 그 뒤에 배양액을 혈청 무첨가 DMEM 배지로 교환하고, lipopolysaccharide(LPS)를 처치하여 염증 반응을 유도하였다. 따라서 LPS 1 ppm/well이 되도록 처리하고, 각각의 시료용액을 농도별로 처리한 후 incubator에서 37°C, 5% CO2 조건으로 24시간 동안 배양시켰다. 그 뒤에 새로운 96well plate에 세포 배양액을 100 μL 옮기고 Griess reagent를 100 μL 첨가하여 상온에서 5분 동안 반응시킨 뒤에 540 nm에서 흡광도를 측정하여 결과를 계산하였다.
iNOS, COX-2 그리고 MMP-1, Fillagrin, procollagen 단백질 발현량을 측정하기 위해 6-well plate에 세포주 RAW 264.7, HaCaT cell을 5×105 cells/well이 되도록 분주하고, 37°C, 5% CO2 incubator에서 24시간 동안 배양시켰다. 그 뒤에 배양액을 혈청 무첨가 DMEM 배지로 교환한 후 RAW 264.7은 lipopolysaccharide(LPS)로 처리하고, 각 시료용액을 농도별로 처리 후 37°C, 5% CO2 incubator에서 24시간 배양시켰다.
HaCaT cell에서 MMP-1, AHR, Filagrin, Procollagen 단백질 발현량 측정을 위해 HaCaT cell에 각 시료용액을 농도별로 처리 후 UV-B 또는 benzo[e]pyrene(BP)로 자극하여 37°C, 5% CO2 incubator에서 24시간 배양시켜 세포 보호 및 중금속 독성완화를 측정하였다.
그 뒤 배지를 제거하고 PBS로 1회 세척 후 모든 세포는 RIPA buffer로 처리하여 세포를 용해시키고 원심분리기를 이용하여 4°C, 16,000 ×g에서 15분 동안 원심분리 시킨 뒤 얻은 상등액을 새 튜브에 옮긴다. Membrane은 digital reciprocating shaker 기기를 이용하여 5% skim milk로 2시간 blocking한 다음 primary antibody로 3시간 반응시켜준 후 TBST solution으로 10분씩 3번 세척을 반복하였다. 그 다음에 특정 단백질에 primary antibody가 붙은 membrane을 각 항체의 숙주에 해당하는 Secondary antibody를 1시간 동안 반응시켰다. 그리고 TBST solution으로 10분씩 3번 세척을 반복한 뒤 Davinch Western imaging system을 이용하여 단백질 발현량을 측정하였다.
중금속 항공해 효과 측정을 확인하기 위해 96-well plate에 세포주 HaCaT cell을 5×103 cells/well이 되도록 분주하고, CCD-986sk cell은 1×104 cells/well 분주 후 incubator에서 37°C, 5% CO2 조건으로 24시간 동안 배양시켰다. 그 뒤에 배양액을 혈청 무첨가 DMEM 배지로 교환하고, benzo[e]-pyrene(BP)을 처리하여 자극하였다. 따라서 BP 150 ppm/well이 되도록 처리하고, 각각의 시료용액을 농도별로 처리한 후 HaCaT cell은 incubator에서 37°C, 5% CO2 조건으로 24시간 동안 배양시키고, CCD-986sk cell은 incubator에서 37°C, 5% CO2 조건으로 48시간 동안 배양시켰다. 그 뒤에 2.5 mg/mL 농도로 제조한 MTT 용액을 20 μL/well로 첨가하여 3–4시간 동안 배양한 후 배양액을 제거하고 dimethyl sulfoxide(DMSO)를 100 μL/well으로 첨가하여 실온에서 10분 동안 반응시킨 후 540 nm에서 흡광도를 통해 결과를 도출하였다.
미세먼지로부터의 피부세포 보호 효과를 확인하기 위해 96-well plate에 세포주 HaCaT cell을 5×103 cells/well이 되도록 분주하고, CCD-986sk cell은 1×104 cells/well 분주 후 incubator에서 37°C, 5% CO2 조건으로 24시간 동안 배양시켰다. 그 뒤에 배양액을 혈청 무첨가 DMEM 배지로 교환하고, Benzo[e]pyrene(BP)을 처리하여 자극한다. 따라서 BP 150 ppm/well이 되도록 처리하고, 각각의 시료용액을 농도별로 처리한 후 HaCaT cell은 incubator에서 37°C, 5% CO2 조건으로 24시간 동안 배양시키고, CCD-986sk cell은 incubator에서 37°C, 5% CO2 조건으로 48시간 동안 배양시켰다. 그 뒤에 2.5 mg/mL 농도로 제조한 MTT 용액을 20 μL/well로 첨가하여 3–4시간 동안 배양한 후 배양액을 제거하고, dimethyl sulfoxide(DMSO)를 100 μL/well으로 첨가하여 실온에서 10분간 반응시킨 후 540 nm에서 흡광도를 통해 결과를 도출하였다.
결과 및 고찰
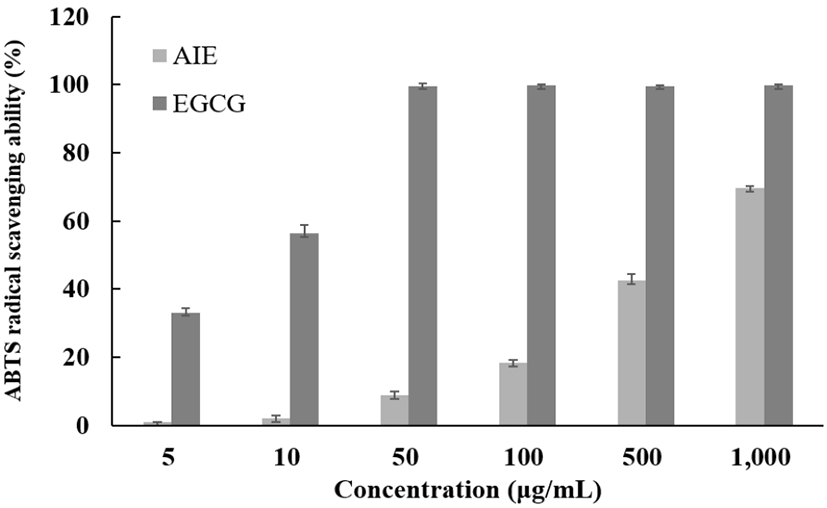
2,2’-Azino-bis(3-ethylbenzothiazoline-6-sulphonic acid(ABTS)가 potassium persulfate와 반응하여 ABTS+ radical이 생성되어 특유의 색인 청록색을 나타내는데, 시료를 첨가하게 되면 연한 녹색으로 변하며 hydrogen donating antioxidant와 chain breaking antioxidant 모두를 측정할 수 있는 특징을 갖는다. 항산화 물질과 반응함에 따라 흡광도의 변화가 생기므로 DPPH 소거능 실험법과 함께 많은 연구에서 이용되고 있다. 님트리잎 추출물의 항산화 능력을 알아보기 위해 대조군 epigallocatechin gallate(EGCG)를 사용하여 ABTS+ 라디칼 소거활성을 측정하였다. 최고 농도인 1,000 μg/mL에서 69.60%의 활성을 나타낸 것을 확인할 수 있었다. 대조군인 EGCG보다는 효과가 낮지만 항산화 기능성 소재로서 긍정적인 영향을 미칠 것으로 사료된다(Fig. 2).
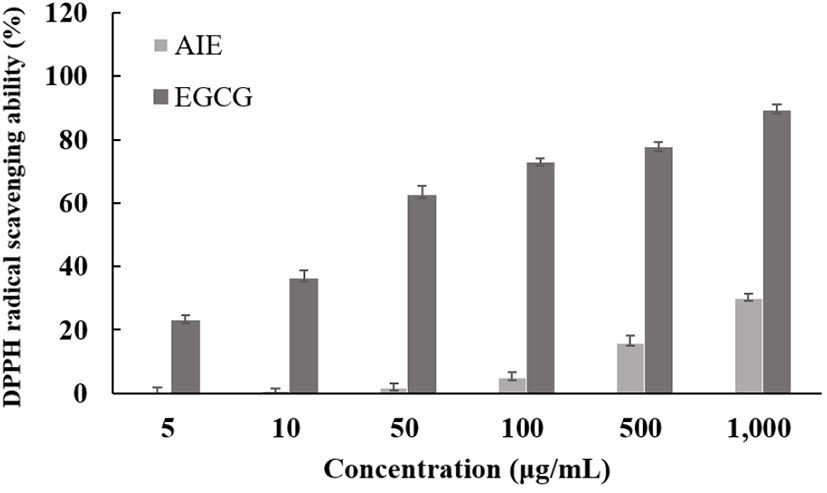
1,1-Diphenyl-2-picrylhydrazyl(DPPH)는 전자공여능 측정에 사용되며, 물질 스스로가 매우 안정한 free radical을 가지고 517 nm에서 다른 파장과 구별되는 광흡수를 나타내 보라색을 띄는 분획물이다. DPPH는 유기용매인 알코올 등에 안정하며, 항산화 활성을 눈으로 쉽게 파악할 수 있는 장점이 있다(Molyneux, 2004). 님트리잎 추출물의 항산화 능력을 알아보기 위해 대조군 epigallocatechin gallate (EGCG)를 사용하여 DPPH 라디칼 소거활성을 측정하였다. 님트리잎 추출물의 항산화 효능의 측정 결과, 농도 의존적인 항산화 효과가 나타났으며, 1,000 μg/mL의 농도에서 34.09%의 효과를 나타났다(Fig. 3).
페놀성 분획물은 천연물 속에 많이 함유되어 있으며, 자유 라디칼을 소거하는 것이 이들의 주요 역할이라는 연구가 많이 보고되어 있으며, 또한 이러한 플라보노이드나 페놀산 및 안토시아닌 등의 페놀성 분획물이 DPPH 라디칼 소거활성과 같은 항산화 활성에 매우 중요한 인자로 작용한다(Moon 등, 2004). 본 실험에서는 기본 물질로 tannic acid를 이용해 표준곡선을 사용하여 님트리 추출물의 폴리페놀 함량을 측정하고, 그 결과를 Table 1에 나타내었다. 그 결과, 51.37 mg/g의 함량을 가지고 있는 것을 확인할 수 있었다. 약용식물 추출물의 폴리페놀 함량 분석(38)에서 나온 갈화(6.46 mg/g), 갈근(5.50 mg/g) 및 감국(2.48 mg/g) 등과 비교했을 때 님트리잎 70% ethanol 추출물의 폴리페놀 함량이 높은 것을 확인하였다. 이렇게 다른 약용식물들보다 높은 폴리페놀 함량을 가지므로 항산화 기능성 소재 및 천연소재로서 활용이 가능할 것으로 사료된다(Table 1).
| Sample | Polyphenol contents (mg/g)1) |
|---|---|
| AIE2) | 51.37±0.603) |
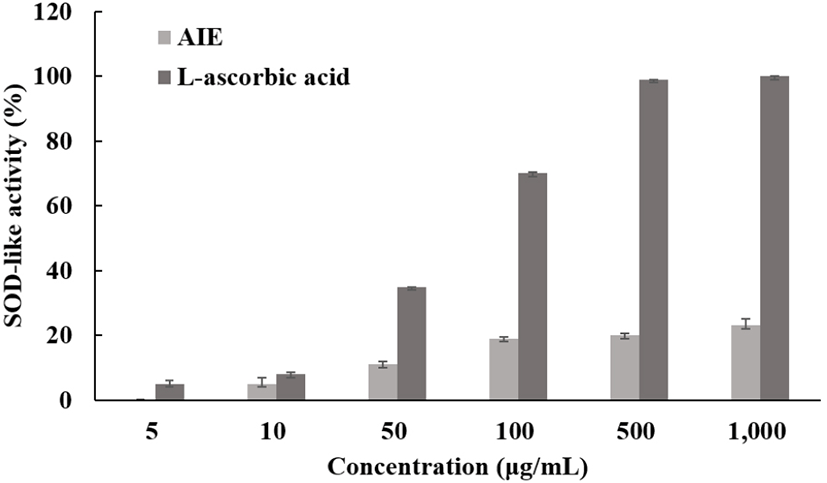
Superoxide dismutase(SOD)는 생체에서 유해한 superoxide anion radical(·O2−)과 반응하여 과산화수소(H2O2)를 생성하는 효소로, 산소를 사용하는 모든 생물에 존재하며 생체에서 활성산소에 대한 장애의 방어 작용을 하는 대표적인 활성산소 저해제이다(Jain, 2003; Choi, 1999). 또한, 산소분자가 환원되어 생기는 superoxide anion radical(·O2−2·O2 + 2e− → 2·O2−)을 제거하는 방어 메커니즘에 관여하는 효소(2O2−+ 2H+ → H2O2 + O2−)로, 독성이 매우 강한 hydroxy radical이 생성되는 것을 예방하는 작용을 하는 항염증 소재나 피부 노화방지를 위한 미용적인 소재로 화장품 등과 같은 첨가제로 사용이 되고 있다(Grasbon, 1999; Mckersie, 2000). SOD 유사활성 효과를 측정하여 님트리잎 추출물의 항산화 효과를 측정한 결과, 최고 농도인 1,000 μg/mL 농도에서 24.13%의 유사활성을 보였다(Fig. 4).
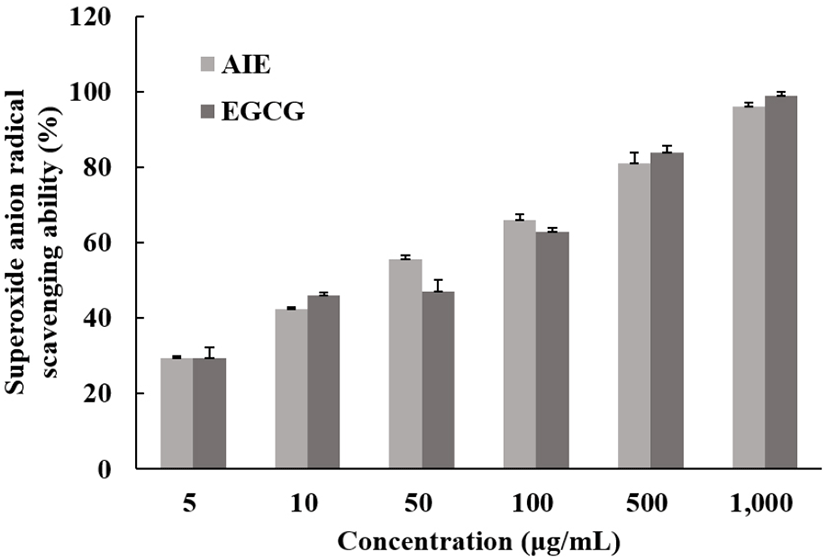
Superoxide anion radical(NBT)은 호기성 세포의 효소 또는 비효소적인 단계에서 매우 강한 독성이 생성되는 radical로서 노화와 관련하여 산화반응의 개시단계에 관여한다. 또한, 과산화수소, 하이드록시 라디칼, 일중항산소 등과 같은 활성산소종의 생성에 관여하여 지질, DNA, 단백질 등에 산화적 손상을 유도하는 것으로 알려져 있다(Ghosh, 1998; Feng, 1999). 이러한 과정중 항산화 물질이 superoxide anion radical과 반응하여 소거되면 보랏빛으로 발색되는 현상이 줄어들게 되고, 이 흡광도의 변화를 이용하여 항산화 효과를 측정하는 방법이다. Superoxide anion radical 소거능을 측정하여 님트리잎 추출물의 항산화 효과를 측정한 결과, 최고 농도인 1,000 μg/mL에서 96.04%로 나타났다. 대조군과 비슷한 활성을 갖는 것으로 보아 항산화 기능성 소재로 긍정적인 영향을 미칠 것으로 사료된다(Fig. 5).
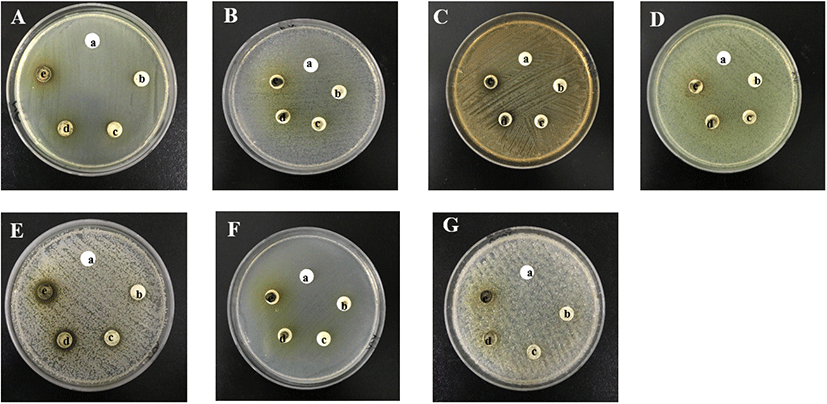
한천 내 확산법(paper disc agar diffusion assay)을 통한 님트리잎 추출물의 항균 효과를 알아보았으며, 그 결과를 생육 저해환(Clear zone)으로써 측정하여 Fig. 6과 Table 2에 나타내었다. 그 결과 님트리잎 추출물은 E. coli, S. epidermis, P. aeruginosa, E. cloacae, C. albicans균에 대하여 항균 효과를 가지지 못한 것으로 나타났으며, S. aureus균에서 2 mg/disc에서부터 1.0±0 cm 이상의 Clear zone이 나타났고, P. acnes균에 대해서는 5 mg/disc에서부터 1.1±0 cm 이상의 Clear zone이 나타난 것을 확인할 수 있었다. 이 결과, 여드름균인 P. acnes균에서 저해효과를 보이므로 여드름 기능성 소재로서의 활용이 가능할 것으로 사료된다.
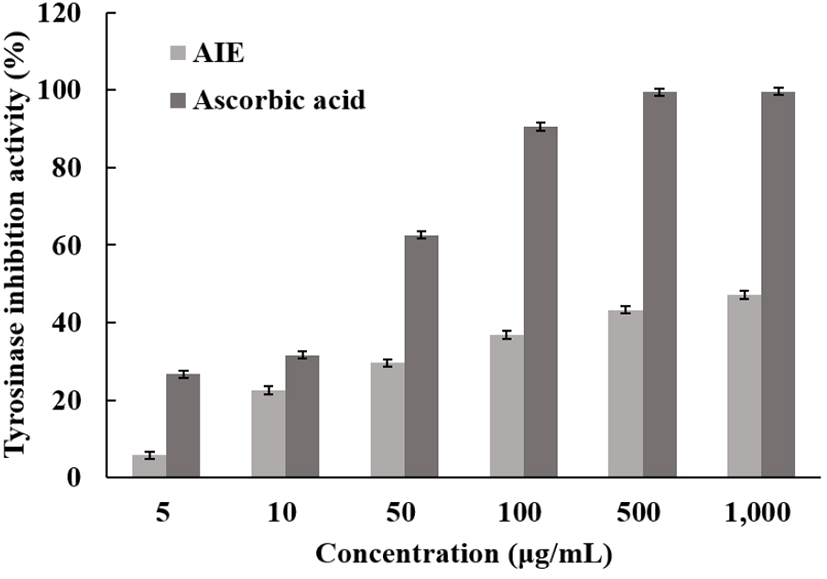
Melanocyte는 표피 기저층의 색소세포 내의 melanosome에서 생합성 되는데, 여기서 melanin은 피부의 색조를 결정하는 중요한 인자로 작용한다. 아미노산의 일종인 tyrosinase에 의해 L-3,4-dihudroxyl phenylslsnine(DOPA)과 DOPA qninone으로 산화된다. 그 후 다시 DOPA quinone이 5,6-dihydroxyindole, DOPA chrome, indole-5,6-quinone이 되고, indole-5,6-quinone 중합에 의해 melanin을 생성하는 것으로 알려져 있다(Lee 등, 2007). 이렇게 피부 속에서의 melanin의 중합체 생합성을 저해할 수 있는 tyrosinase의 저해활성을 측정하기 위해서 mushroom 유래의 tyrosinase 저해활성을 측정하였고, 그 결과 최고 농도인 1,000 μg/mL에서 47.21%의 저해율이 나타났으며, 양성 대조군으로 사용된 L-ascorbic acid보다는 낮은 효과가 나타났지만 님트리잎 추출물은 천연물로서 상당한 효과가 확인되어 미백 작용에 도움을 줄 수 있을 것으로 판단된다(Fig. 7).
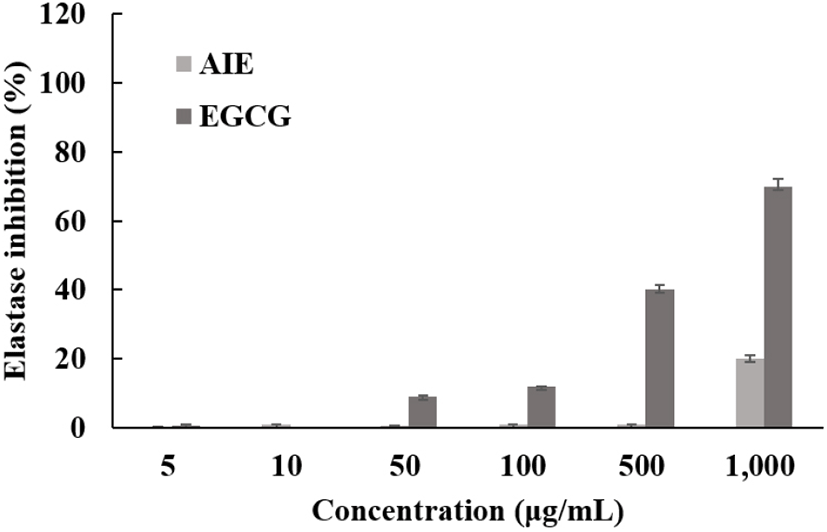
Elastin은 진피 내에서 피부 탄력을 유지하는데 매우 중요한 단백질이며, 피부의 결합조직에 존재하여 조직의 신축성과 유연성에 관여하고 있다. Elastase는 이러한 elastin을 분해하는 효소이며, 주름과 피부 처짐 등의 피부노화를 발생시키는 원인 중 하나이다(An 등, 2009). 따라서 elastase 저해제는 피부 주름개선을 통한 노화를 방지하는 작용을 하게 되는데, 님트리잎 추출물의 elastase 저해 활성 효과를 측정한 결과는 최고 농도인 1,000 μg/mL에서 저해활성이 24.24%로 나타났다(Fig. 8).
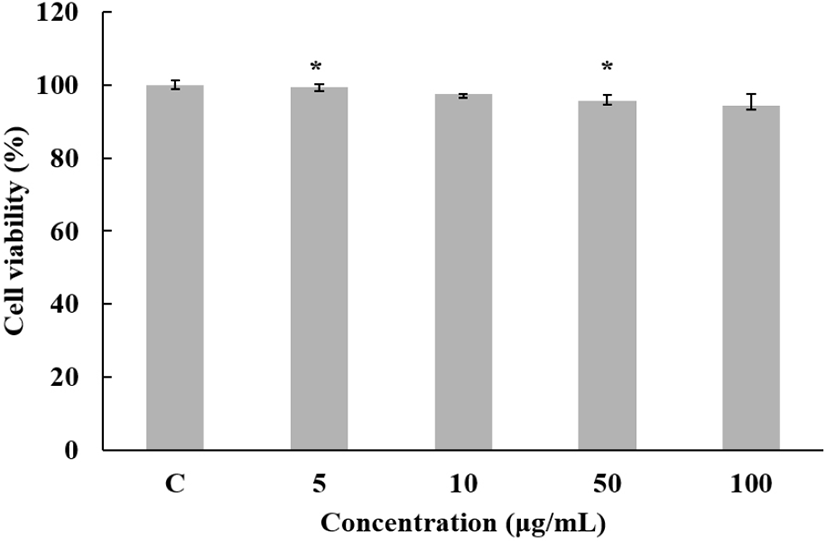
님트리에 의한 macrophage cell의 세포 생존율을 MTT assay를 통해 확인하였으며, 생존율이 80% 이상 나타내는 농도구간을 설정하여 100 ppm 이하로 실험을 진행하였다(Fig. 9).
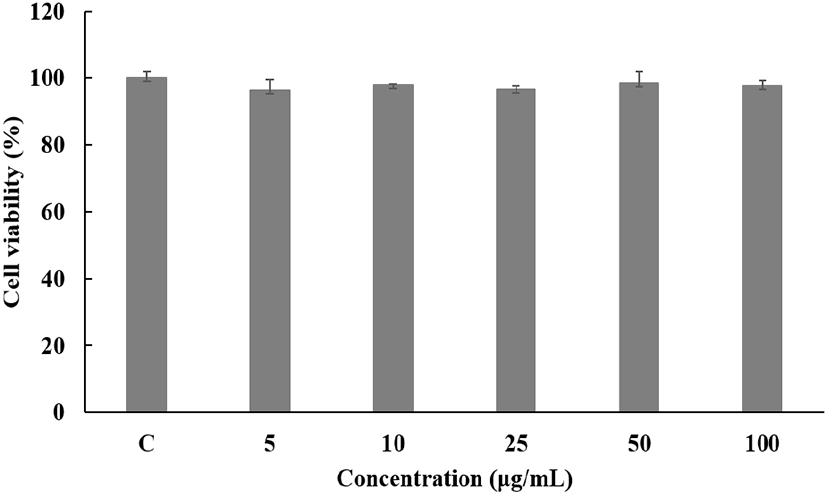
님트리에 의한 Human keratinocyte cell의 세포 생존율을 MTT assay를 통해 확인한 결과를 Fig. 10에 나타내었다. 측정한 결과, 농도 5, 10, 25, 50, 100 μg/mL에서 농도 10 μg/mL까지 80% 이상의 생존율을 보였고, western blot 실험을 진행하였다.
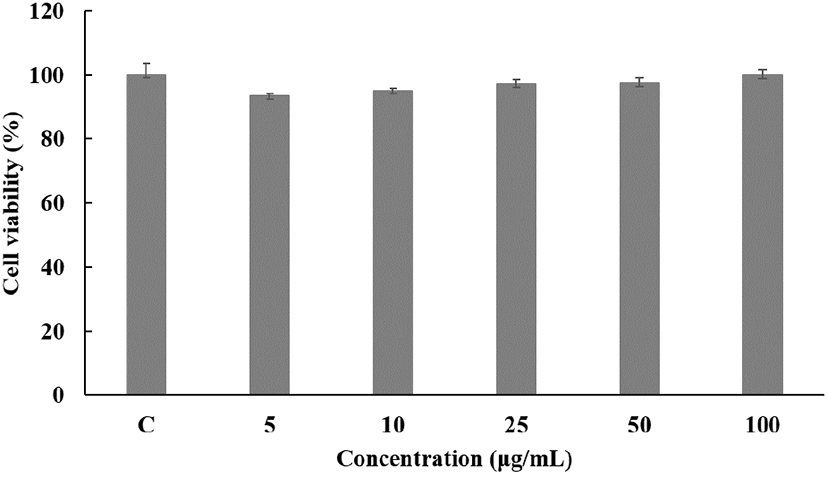
님트리에 의한 CCD-986sk fibroblast cell의 세포 생존율을 MTT assay를 통해 확인하였으며, 농도별로 측정한 결과, 농도 5, 10, 25, 50, 100 μg/mL에서 90% 이상의 생존율을 보였다(Fig. 11).
님트리의 macrophage cell인 Raw 264.7에서 chitosangluconate의 NO의 억제 정도를 측정하기 위해 농도별로 샘플을 처리하여 NO양을 측정한 결과를 Fig. 12와 같이 나타내었다. 최고농도인 100 μg/mL에서 68.86%의 저해효과를 보였다. 이 결과, 항염효과를 갖는 화장품 소재로 이용할 수 있을 것이라고 판단된다.
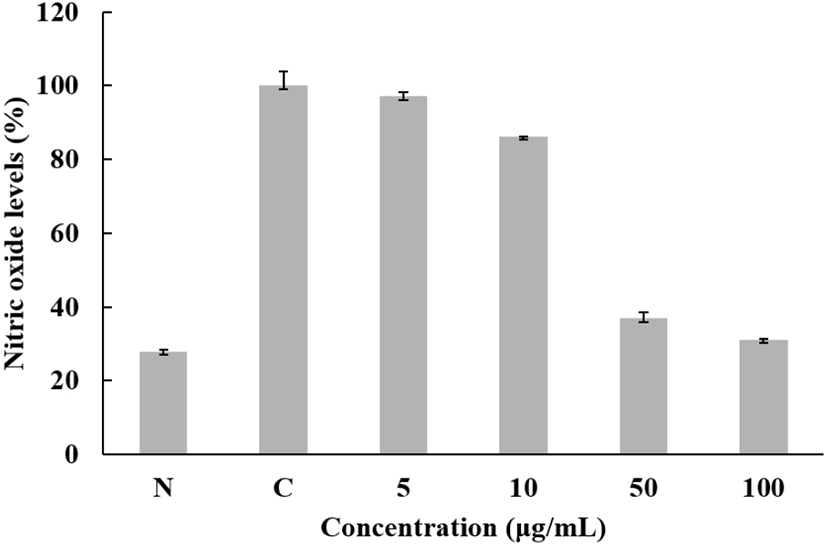
님트리가 iNOS, COX-2에 미치는 영향을 보기 위해 LPS로 유도된 mouse macrophages cell(RAW 264.7)에 70% Ethanol 추출물을 10, 50, 100 μg/mL의 농도로 처리한 후 24 h 뒤에 회수하여 western blot을 통해 발현을 확인하였다. 대조군으로는 ammonium pyrrolidinedithio-carbamate (PDTC)를 사용하였다. House keeping gene으로는 β-actin을 사용하였다. Fig. 13에 나타낸 결과, iNOS 단백질에서 최고농도 100 μg/mL에서 97.49%의 억제율이 나타난 것을 확인할 수 있었다. 이것으로 보아 iNOS 단백질에 의한 NO 생성을 억제하는 것으로 판단된다.
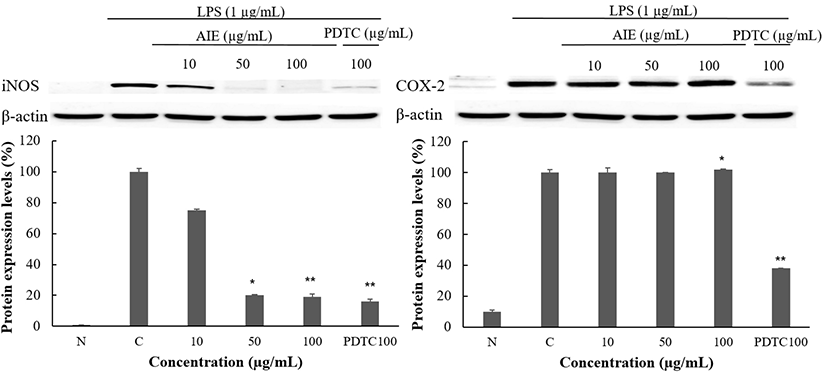
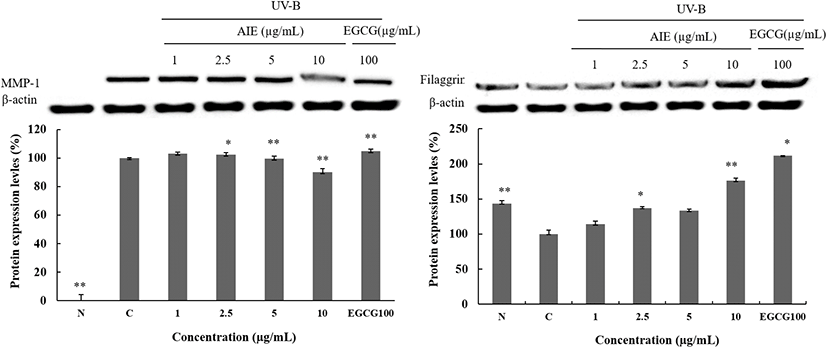
MMPs는 피부의 섬유아세포, 각질형성세포를 비롯하여 많은 세포들로부터 분비되며, 현재까지 약 20여 종의 종류가 있다고 알려져 있다. MMP-1은 Collagenase 1로 알려져 있으며, 콜라겐 type-Ⅰ과 Ⅲ을 기질로 한다(Wang 등, 1999). Profilaggrin이라고 불리는 전구체는 이물질 및 수분침투에 의한 방어막 역할을 하며 피부 내부로부터 수분 증발을 저지하여 케라토히알린과립(keratohyalin glanules)이 존재하는데 천연보습인자 생성에 관여하며 filaggrin 등의 단백질을 포함한다(Dale 등, 2001). 본 실험에서는 MMP-1과 filaggrin 단백질 발현 확인을 하여 결과를 Fig. 14에 나타내었다. 그래프에서 확인할 수 있듯이 최고농도인 10 μg/mL에서 MMP-1은 9.93%의 억제율을 보였으며, Filaggrin에서는 32.52%의 보습효과를 가진 것을 확인할 수 있었다.
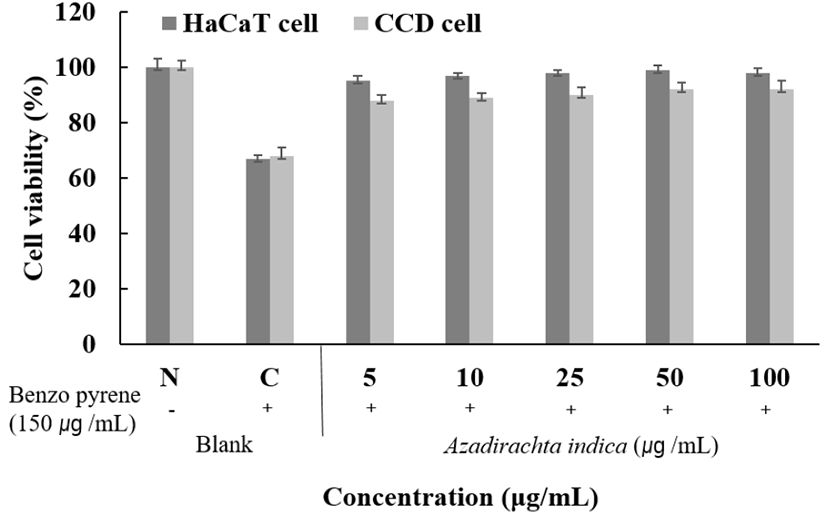
HaCaT 세포주에 benzo[e]pyrene만 처리했을 때 30% 정도의 사멸을 보였고, CCD 세포주는 benzo[e]pyrene만 처리했을 때 31% 정도의 사멸을 보였다. Benzo[e]pyrene을 처리한 세포에 님트리 70% ethanol 추출물을 5, 10, 25, 50, 100 μg/mL로 처치했을 때 HaCaT 세포주는 benzo[e]pyrene만 처리한 세포에 대비해 25 μg/mL에서 90% 이상의 개선효과를 보였으며, CCD 세포주는 benzo[e]pyrene만 처리한 세포에 대비해 25 μg/mL에서 80% 이상의 개선효과를 보였다. 이 결과, 중금속으로부터 피부보호 소재로서의 활용이 가능할 것으로 사료된다(Fig. 15).
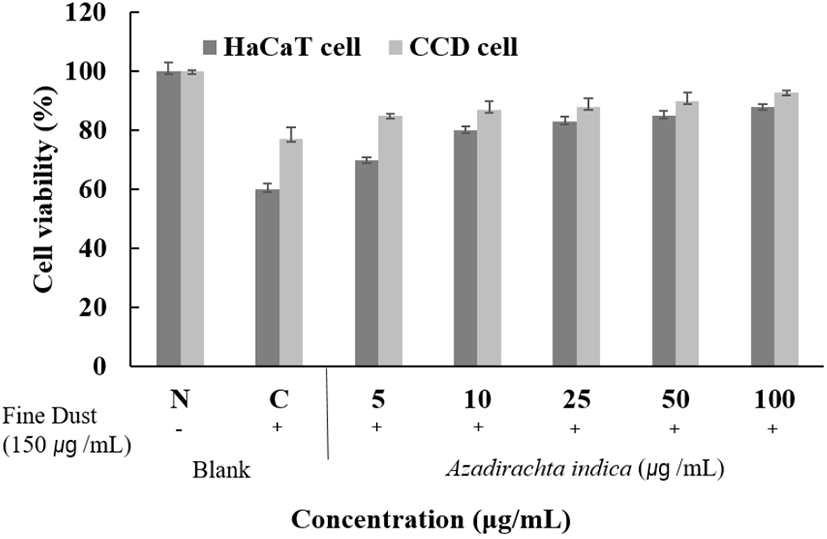
HaCaT 세포주에 미세먼지만 처리했을 때 23% 정도의 사멸을 보였고, CCD 세포주에 미세먼지만 처리했을 때 23% 정도의 사멸을 보였다. 미세먼지를 처리한 세포에 님트리잎 70% ethanol 추출물을 5, 10, 25, 50, 100 μg/mL로 처리했을 때 HaCaT 세포주는 미세먼지만 처리한 세포에 대비해 100 μg/mL에서 76% 이상의 개선효과를 보였으며, CCD 세포주는 미세먼지만 처리한 세포에 대비해 100 μg/mL에서 85% 이상의 개선효과를 보였다. 이것으로 보아 미세먼지로부터 피부보호 소재로 활용이 가능할 것으로 사료된다(Fig. 16).