서 론
현대인들은 스트레스, 식습관의 불균형, 생활환경 변화 등과 같은 요인에 의해 면역기능이 저하되어 최근 사회적 문제로 떠오른 미세먼지, 병원균 및 감염원 등을 이겨낼 수 있는 면역력 개선을 위한 식·의약품 소재에 관심이 높은 실정이다(Lee 등, 2018).
면역이란 인체에 특정 병원체 또는 내독소 물질이 침투하였을 때 이를 신속히 인지하고 제거하는 방어 체계를 뜻하는데, 저하된 면역력은 천식, 알레르기, 당뇨병, 아토피피부염 등과 같은 면역질환의 발병률을 높이게 된다(Kim, 2007).
이와 같은 면역은 크게 선천 면역과 적응면역으로 나뉠 수 있는데, 선천 면역은 침입한 병원체가 숙주의 양식인자분자나 TLR을 지닌 포식 세포에 의해 인지되어 염증 반응이 수 시간 내에 유발되어 특이적인 면역반응을 선행하는 결과를 나타나게 된다(Kwon 등, 2008; Choi 등, 2016). 반대로 적응면역은 다소 시간이 소요되지만, 선천 면역계의 방어 기전 이후 항원에 의한 기억(memory) 반응을 통해 동일한 병원체의 침투 시 신속하고 효과적으로 제거하는 역할을 한다(Kwon 등, 2008). 이는 선천 면역과 적응면역이 독립적이지 않고 사이토카인에 의해 조절되는 세포 내 반응전달 체계(Signaling)를 통해 유기적인 상호관계를 나타내고 있어 인체의 면역력 개선은 선천 면역력을 높이는 것이 최우선적인 목표라 할 수 있다.
본 연구에서 사용된 지골피(lycium root; Lycii radicis Cortex)는 구기자나무(Lycium chinense Miller)의 근피로, 근육과 뼈를 견고하게 하고 피를 맑게 하여 열을 내리며, 정기를 보한다는 효능이 한의서에 기재되어 있다(Koh와 Lee, 2007). 이 중 정기를 보하는 효능은 현대의학적 측면에서 면역 개선에 관한 내용이나 지골피를 활용한 연구는 우울증, 항당뇨, 항천식, 항염증 등만이 진행되었으나, 면역 개선과 관련된 연구는 진행된 바가 없다(Hong 등, 2002; Koh와 Lee, 2007; Han과 Park, 2013; Seo 등, 2013).
이에 본 저자는 지골피 추출물이 선천 면역 증진 효능을 확인하고자 마우스 대식세포 세포 생존율 및 자연살해(natural killer, NK) 세포 활성도 검사와 더불어 LPS로 염증을 유발한 동물을 활용하여 면역세포 수, 염증 사이토카인 생성량, 염증 반응 관련 매개체 등 혈액학적 분석을 진행하여 지골피가 면역력 개선을 위한 식·의약품 소재로서의 가능성을 과학적으로 확인하고자 하였다.
재료 및 방법
실험에 사용한 중국 영하에서 생산된 지골피는 ㈜옴니허브(Uiseong, Korea)에서 500 g 중량의 제품을 구매하여 사용하였다. 추출물의 제조는 지골피 50 g을 1 L 플라스크에 넣고, 10배 부피인 증류수를 첨가하여 3시간 동안 환류 추출기(EAMS 9504-03, Mtops, Seoul, Korea)에서 추출하고 정성 여과지(Whatman No.2)로 여과하였다. 여과 후 감압회전농축기(SB-1100, Tokyo Rikakikai, Tokyo, Japan)에서 농축하고, 동결건조기(FD8512, Ilsinbiobase, Dongducheon, Korea)로 72시간 동결 건조하여 획득한 분말 6.9 g(수율 13.8%)를 실험에 사용하였다.
실험에 사용된 동물인 수컷 5주령의 ICR 마우스는 ㈜샘타코코리아(Osan, Korea)에서 공급받아 Harlan 2018S Rodent diet(Harlan Laboratories, Indianapolis, IN, USA) 고형사료와 물을 충분히 공급하고, 온도 22±2°C, 습도 55±15%, 12시간–12시간(light-dark cycle)의 환경에서 2주간 적응시킨 후 실험에 사용하였다. 본 실험은 동물실험윤리위원회의 승인을 받아 동물 윤리준칙에 의거하여 실험하였다(DJUARB 2019-022).
시료의 세포독성을 확인하기 위해 사용된 마우스 대식 세포주인 RAW 264.7 세포는 10% fetal bovine serum(FBS, Hyclone, Logan, UT, USA), 1% penicillin-streptomycin (Hyclone, USA)이 첨가된 Dulbecco’s modified eagle’s medium (DMEM, Hyclone, USA) 배지를 사용하여 37°C, 5% CO2 incubator(MCO-18AUC, Sanyo electric, Osaka, Japan)에서 배양하였다. 96-well plate에 1.5×105 cells/mL로 100 μL씩 분주하고 24시간 동안 배양한 다음 지골피 추출물을 각각 1 μg/mL, 10 μg/mL, 100 μg/mL의 농도로 각 well에 처리하였다. 24시간 동안 배양 후 10 μL의 WST solution(Daeillab service, Guro, Korea)을 첨가하여 세포 배양기에서 30분간 반응시켰다. 반응 후 ELISA reader(Spectramax ABS, Molecular devices, San Jose, CA, USA)로 흡광도 450 nm에서 측정하였으며, 시료를 처리하지 않은 대조군에 대한 생존율을 백분율로 환산하였다.
시료의 면역세포 활성을 위해 사용된 자연살해 세포는 ICR 마우스에서 비장을 분리한 후 10% FBS(Hyclon, USA)와 2 mmol/L glutamine(Hyclone, USA)를 첨가한 RPMI 1640(Hyclone, USA)로 세척하고, 0.45 μm cell strainer를 사용하여 세포를 부유하였다. 이후 Red blood cell lysis buffer(Sigma-Aldrich Co., St. Louis, Mo, USA)로 적혈구를 용혈시켜 만든 비장 세포 부유액으로 mouse NK cell enrichment kit(StemCell Technologies Co., Vancouver, BC, CA)를 사용하여 분리하였다. 분리한 NK 세포는 RAW 264.7 세포의 생존율 검사와 동일한 방법으로 활성도를 평가하였다.
2주간의 안정기 후 7주령이 된 마우스를 그룹별로 6마리씩 배분하였으며, 실험 그룹은 실험기 동안 어떠한 처리도 하지 않고 자유 식이를 진행하는 정상군(이하, normal)과 2주간 증류수만을 경구 투여 후 LPS로 급성 염증을 유도하는 대조군(이하, control), 2주간 지골피 추출물을 각각 100 mg/kg/day 또는 300 mg/kg/day로 경구 투여 후 LPS로 급성 염증을 유도하는 실험군(이하, 100 또는 300) 등으로 나누었다. 증류수 및 지골피 추출물의 경구 투여는 매일 오전 10시에 진행하였으며, 지골피 추출물의 투여량은 60 kg의 성인이 하루에 100 mg 또는 300 mg을 섭취하는 용량을 기준으로 경구 투여 시작 전 7주령 마우스 평균 체중인 25 g으로 환산하여 산출하였다. 2주간의 시료 투여 후 급성 염증 유발은 정상군을 제외한 대조군과 실험군에 1 cc 주사기를 이용하여 1 mg/kg의 농도로 lipopolysaccharide (LPS, Sigma-Aldrich Co., St. Louis, Mo, USA)를 복강에 주사하였으며, 실험군 간에 급성 염증 반응 시간이 일치되도록 LPS 주입하는 편차는 마취와 채혈 시간을 고려한 30분 간격으로 진행하여 각 그룹은 복강 주사 후 90분째에 채혈을 진행하였다.
급성 염증 유도 후 마취된 상태의 마우스에서 심장 천자법을 통해 채혈하였으며, 채혈한 전혈은 면역세포 수 측정을 위한 분석 의뢰를 진행하였고, 의뢰용 전혈을 제외한 남은 혈액은 3,000 rpm에서 15분간 원심분리한 혈청을 통해 바이오마커 분석을 진행하였다.
Reactive oxygen species(ROS) 측정은 Mouse reactive oxygen species ELISA kit(Mybiosource, San Diego, CA, USA)을 사용하였다. 96-well plate에 standard와 혈청을 50 μL를 넣고 추가로 HRP-conjugate reagent 100 μL를 넣어 37°C에서 1시간 동안 반응시켰다. 이후, wash buffer를 이용하여 washing 작업을 실행한 후, chromogen solution A 용액 50 μL와 chromogen solution B 용액 50 μL를 순차적으로 넣고 37°C에서 30분 동안 반응시켰다. 마지막으로 stop solution 50 μL를 넣고 ELISA reader(Spectramax ABS, Molecular devices) 450 nm 파장에서 측정하였으며, standard curve를 기준으로 절대값으로 환산하였다.
Prostaglandin E2(PGE2) 측정은 prostaglandin E2 parameter assay kit(R&D system, Minneapolis, MN, USA)을 사용하였다. 96-well plate에 standard와 4배 희석한 혈청을 50 μL를 넣고 추가로 biotinylated detection antibody 50 μL를 넣어 37°C에서 45분 동안 반응시켰다. 이후, wash buffer를 이용하여 washing 작업을 실행한 후, HRP conjugate 100 μL를 넣고 37°C에서 30분 동안 반응시키고, 다시 washing 작업을 실행하고 substrate reagent를 90 μL를 넣어 37°C에서 15분 동안 반응시켰다. 마지막으로 stop solution 50 μL를 넣고 ELISA reader(Spectramax ABS, Molecular devices) 450 nm 파장에서 측정하였으며, standard curve를 기준으로 절대 값으로 환산하였다.
Leukotrien B4(LTB4) 측정은 Leukotrien B4 ELISA kit (R&D system, USA)을 사용하였다. 96-well plate에 3배 희석한 혈청 150 μL씩 분주하고, 50 μL의 primary antibody를 가하여 1시간 동안 500 rpm으로 plate shaker에서 반응시키고, 50 μL의 LTB4 conjugate를 추가하여 2시간 동안 상온에서 반응시켰다. 반응 후 washing 완충 용액을 이용하여 4회 세척하고, 200 μL의 substrate 용액을 가하여 30분 동안 빛을 차단한 채 반응시키고, 100 μL의 stop solution을 넣고 ELISA reader(Spectramax ABS, Molecular devices) 450 nm 파장에서 측정하였으며, standard curve를 기준으로 절대 값으로 환산하였다.
IL-1β, IL-6, IL-10, TNF-α 생성량은 The MILLIPLEX MAP Mouse Cytokine/Chemokine Magnetic Bead PanelImmunology Multiplex Assay kit(Merck Millipore, Billerica, MA, USA)을 이용하여 다음과 같이 측정하였다. 96-well plate에 10배 희석한 혈청 25 μL씩 분주하고, assay buffer 및 matrix buffer, antibody-immobilized beads를 각각 25 μL씩 가하여 혼합한 후 2시간 동안 실온에서 반응시키고, washing 완충 용액을 이용하여 2회 세척하였다. 이를 다시 25 μL의 detection antibody을 가하여 1시간 동안 실온에서 빛을 차단한 채 반응시키고, 추가로 25 μL의 streptavidin-phycoerythrin을 가하여 30분 동안 실온에서 반응시킨 후 washing 완충 용액을 이용하여 2회 세척하였다. 세척 후 PBS를 150 μL 넣고 5분간 shaking한 후 Luminex(Luminex SD, Merck Millipore, Billerica, MA, USA)를 이용하여 측정하였으며, standard curve를 기준으로 절대값으로 환산하였다.
결과 및 고찰
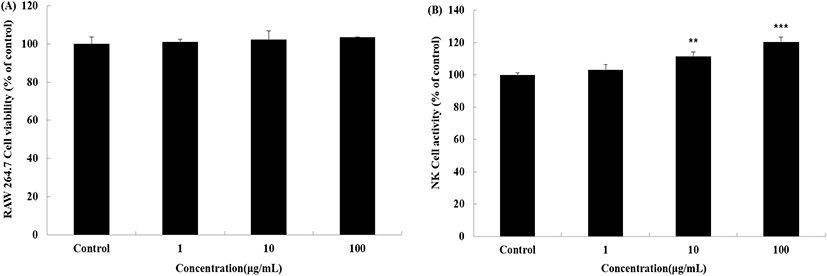
대식세포(macrophage)는 인체 내 간, 폐, 뇌, 뼈 등에 다양한 형태로 존재하며, 염증 발생 시 포식작용을 통해 감염원으로부터 인체를 보호하는 백혈구 세포이며, 자연살해세포(natural killer cell, NK cell)은 체내에 종양세포와 일부 바이러스에 감염된 세포가 발생한 경우 스스로 인지하여 세포를 살해하는 선천 면역계의 대표적 세포로 대식세포와 자연살해세포는 시료에 대한 안전성과 면역평가를 진행할 경우 주로 활용된다(Lee 등, 2008; Lee 등, 2016).
본 연구에서 지골피 추출물의 독성 및 면역 활성도를 확인하기 위해 RAW 264.7 및 NK 세포에 1 μg/mL, 10 μg/mL, 100 μg/mL 농도로 처리한 결과, 대조군 대비 RAW 264.7 세포에서는 모든 농도에서 100% 이상의 생존율을 보여 독성이 관찰되지 않았으며, NK 세포에서는 10 μg/mL 농도 이상에서 10% 이상의 활성도를 나타내었다(Fig. 1). 이와 같은 결과는 지골피 추출물의 안전성과 면역증진에 대한 가능성이 확인되었으며, 이전 연구를 통해 밝혀진 지골피 추출물의 항염증 효능을 근거로 면역 개선에 대한 효능을 검토하고자 동물실험을 진행하였다.
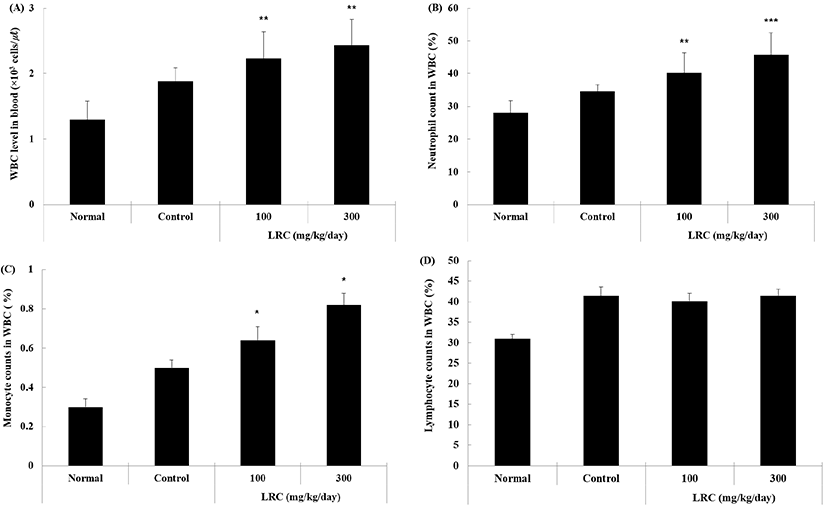
백혈구(white blood cell, WBC)는 체내에 세균에 의해 발생하는 내독소인 LPS와 같은 물질이 침투하게 되면, 림프구(lymphocyte), 과립구(granulocyte), 단핵구(monocyte, 대식세포) 등은 항체, 보체, 사이토카인 등과 같은 물질을 통해 탐식, 이상세포 살해, 항원 제시와 같은 기능을 수행하게 된다(Kurosawa와 Kato, 2008). 이를 구체화하면, 인체 내 염증 발생 시 항체가 항원에 결합함으로써 보체를 활성화하여 화학주성작용(chemotaxis)을 통해 과립구 중 하나인 호중구가 혈관 내벽 통과를 통해 가장 먼저 염증 부위에 결합하여 조직으로 빠져나오게 된다(Lee와 Im, 2000). 또한, 보체의 옵소닌작용(opsonization)은 대식세포의 탐식 기능을 용이하게 만들어 사이토카인을 통해 호중구가 처리하지 못한 부분에 대해 방어작용을 하고, 이러한 과정이 종료되면 림프구의 획득면역을 바탕으로 추후 동일 물질의 침투 시 신속한 면역반응을 일으키게 된다(Kim 등, 2016).
본 연구에서 혈액 내 면역세포 수를 확인한 결과, 대조군 대비 지골피 추출물을 경구 투여한 실험군은 백혈구 수와 백혈구 내 호중구 및 대식세포 수가 유의성 있게(p<0.05, p<0.01, p<0.001) 증가된 반면, 백혈구 내 림프구 수는 큰 차이를 보이지 않았다(Fig. 2). 이와 같은 결과는 지골피 추출물의 섭취가 선천 면역력을 강화하여 LPS가 체내에 주입되었을 때 증류수만을 섭취한 대조군보다 이물질의 인지 후 탐식 기능이 신속히 진행되는 것을 보여주고 있다. 다만, 실험군 간에 큰 차이를 보이지 않은 림프구 수는 본 연구에서 진행한 선천 면역 관련 매개체는 대부분 급성 염증 반응 단계에서 진행되어 실험 여건상 LPS 주입 후 단시간 내에 실험을 종료할 수밖에 없었다. 이로 인해 획득면역계 기능이 활성화되기 이전에 실험이 종료되어 변화를 관찰하지 못한 부분은 추후 연구를 통해 림프구 변화에 대한 재실험을 통해 연구 결과를 보완할 부분으로 남아있으나, 림프구를 제외한 백혈구, 과립구, 단핵구의 활성화 측면에서는 지골피 추출물이 면역 증강에 대해 긍정적인 결과가 도출된 것으로 판단된다.
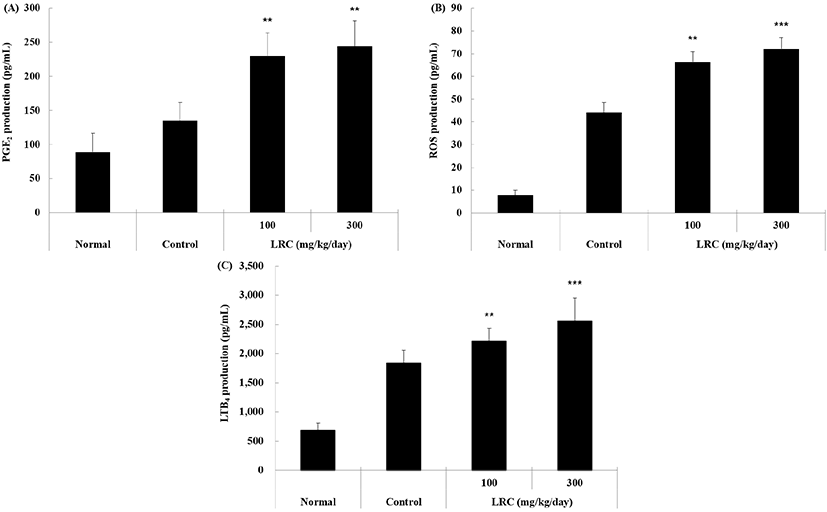
호중구와 대식세포가 가지고 있는 공통적인 항바이러스 기전은 산화적 방법으로, 활성산소종(ROS)을 이용하는 방어법이다(Kim 등, 2009). ROS는 NADPH 포식소체 산화효소(NADPH phagosome oxidase) 복합체에 의해 생성되며, 포식된 미생물은 포식소체(phagosome)로 이입되는 과정에서 ROS가 살미생물제(microbicide)로 사용된다(Lam 등, 2010). 이때, 화학주성인자(chemoattractant)의 역할을 하는 LTB4는 ROS를 형성하고 호중구의 부착과 활성을 중재한다(Crooks와 Stockley, 1998). 또한, 염증 매개물질인 PGE2는 급성 염증 반응을 제거하는 과정에서 발생하는 발열, 혈관 확장 등을 통해 물질을 제거하고 동시에 만성 염증 단계로 넘어가는 매개체로써 선천 면역에 중요한 역할을 담당하게 된다(Chandrasoma 등, 1995).
본 연구에서 혈청 내 바이오마커 생성량을 확인한 결과, 대조군 대비 지골피 추출물을 경구 투여한 실험군은 ROS 및 LTB4, PGE2 생성량이 유의성 있게(p<0.01, p<0.001) 증가하였다(Fig. 3). 이와 같은 결과는 지골피 추출물이 체내에 침투한 이물질 방어 시 발생하는 염증 반응 과정에서 항염증 작용 및 면역세포 활성 등에 대해 유기적인 역할이 수행되고 있으며, 이를 통해 만성 염증으로 야기되는 것을 방지하는 기전이 혈액 바이오마커 결과로 확인되고 있다.
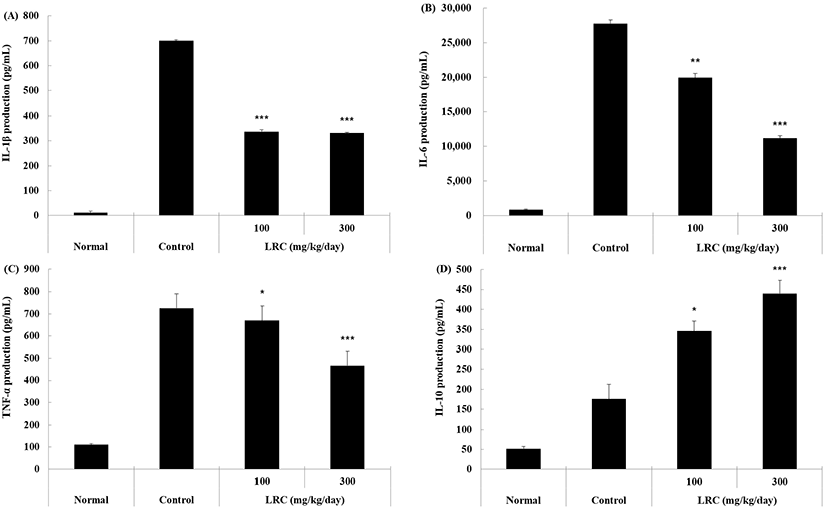
사이토카인은 백혈구 중 대식세포에서 분비되는 단백활성 물질로 세포 사이에 정보전달에 관여하는 단백질을 통해 염증 단계를 종료시킨다(Girodet 등, 2016). 염증 과정에 관련된 사이토카인은 크게 염증성 또는 항염증으로 나뉘어 각각의 역할에 맞는 사이토카인 명령을 통해 세포는 실행하게 된다. 대표적으로 알려진 염증성 사이토카인은 IL-1β, IL-6, TNF-α 등은 염증 반응이 야기되어 신속히 소거되지 않으면 전신반응으로 나타나, 류마티스관절염, 아토피피부염, 천식 등과 같은 면역질환을 일으키게 되므로 항염증성 사이토카인인 IL-10, TGF-β 등이 B세포의 증식 유도와 조직 회복과 같은 기능을 통해 이를 방어하는 역할이 수행된다(Sato 등, 1999; Park과 Park, 2009; Girodet 등, 2016).
본 연구에서 혈청 내 사이토카인 생성량을 확인한 결과, 대조군 대비 지골피 추출물을 경구 투여한 실험군은 염증성 사이토카인의 감소와 항염증성 사이토카인의 증가가 유의성 있게(p<0.05, p<0.01, p<0.001) 나타났다(Fig. 4). 이와 같은 결과는 지골피 추출물의 투여가 사이토카인 조절에 따른 항염증 반응에 대한 효능을 보여주고 있으며, 면역세포 수 변화와 혈액 바이오마커 생성량 결과 등에 부합되는 기전이 나타나, 선천 면역 강화로 인해 만성 염증으로의 전환을 억제하고 있음을 시사하고 있다.