서 론
오가피과에 속하는 다년생 식물인 인삼(Panax ginseng C. A. Meyer)은 우리나라를 비롯한 아시아 지역에 예로부터 전해져 내려온 약용 식물로 항산화, 항당뇨, 항암 등의 다양한 효능이 알려져 있고 널리 이용되어져 왔다(1-6). 이러한 인삼의 생리활성의 주요 약리 성분은 triterpenoid계의 dammarane계 사포닌으로 현재 30여종 이상이 보고되고 있지만 이중 ginsenoside Rb1, Rb2, Rc, Re, Rg1 등이 주로 존재하고 이들을 major ginsenoside라 부르고 있다. 인삼은 가공 방법에 따라 백삼, 홍삼 등으로 분류 되고 특히 인삼을 증삼하여 건조시킨 홍삼이 수삼에 비해 효능이 좋다고 알려져 있다. 이러한 홍삼의 가공 방법을 거치는 동안 열에 의한 ginsneoside 당 부분의 가수분해가 일어나고 major ginsenoside로부터 분자량이 줄어든 ginsenoside Rd, Rg3, Compound K 등의 minor ginsenoside가 생성 된다(7-11). Minor ginsenoside는 major ginsenoside에 비해 작은 분자량으로 체내 흡수율이 높고 효능이 뛰어나다고 알려져 있다(12,13). 특히 major ginsenoside의 대사산물인 Compound K는 체내 흡수율이 높고 항염, 독성물질에 대한 간장보호, 피부보호, 알츠하이머 예방, 항암, 항알러지 작용이 있다고 알려져 있지만 인삼 뿐 아니라 홍삼에서도 그 함량이 적어 산업적 이용에 어려움이 있다(4,14). 현재 Compound K는 효소를 이용한 생물전환 방법에 의한 생산이 연구되어지고 있지만 이를 통한 대량 생산 연구에 대한 결과는 미비한 실정이다(11,15-19).
인삼은 주로 뿌리를 사용하기 때문에 인삼 재배에 따른 인삼잎, 줄기, 열매 등의 1차 부산물이 다량 발생하고 이러한 인삼 부산물인 잎, 열매 등에도 다량의 ginsenoside가 존재하고 있어 인삼잎, 열매 등을 활용 하려는 연구가 일부 이루어지고 있지만 아직 까지는 미비한 실정이다(20-23). 이러한 인삼 부산물 내에 존재하는 ginsenoside의 활용 연구는 인삼 부산물을 이용한 산업화 소재 개발 및 산업적 이용 확대에도 기여 할 수 있으며, 결과적으로 인삼 부산물로부터 높은 경제적 부가가치를 창출하여 인삼 재배 농가의 소득 창출에도 기여 할 수 있는 높은 활용가치를 내포하고 있는 연구라고 할 수 있을 것이다.
일반적으로 인삼은 찌고 말리는 가공공정을 통하여 인삼이 내포하고 있는 약용 성분인 ginsenoside의 변화를 유도하여 홍삼, 백삼의 형태로 가공이 진행되고 있지만, 최근에는 미생물 및 효소를 이용하여 인삼 유래 major ginsenoside로부터 minor ginsenoside 생산을 위한 생물전환 연구가 높은 관심 속에서 진행되고 있다. 특히, 효소를 이용한 인삼 유래 ginsenoside의 생물전환 기술은 효소가 가지고 있는 기질특이성을 활용하여 특정 ginsenoside를 생산 할 수 있는 선택성이 높은 생물전환 기술로서 많은 주목을 받고 있다. 하지만, ginsenoside 생물전환에 적용 할 수 있는 효소자원 발굴은 지속적으로 이루어지고 있지만 아직까지 많이 미비한 실정이며 이러한 이유로 인하여 ginsenoside 생물전환에 적용할 수 있는 효소자원의 지속적 발굴 및 생물전환 효소 특성 규명은 ginsenoside 생물전환 생산 연구에 있어서 그 요구성이 매우 높다고 할 수 있다.
본 연구에서는 인삼 재배 시 발생하는 1차 부산물인 인삼잎을 소재로 활용하여 인삼잎 유래 기능성 물질인 major ginsenoside를 추출하여 함량을 분석하고, 안전성이 확보되어 식품첨가소재로서 활용 할 수 있는 상업용 효소인 Aspergillus oryzae 유래의 pectinase인 Cytolase PCL5을 이용하여 인삼잎 유래 major ginsenoside로부터 고부가가치 기능성 minor ginsenoside Compound K를 생산하는 연구기술을 확립하고자 하였다.
재료 및 방법
본 연구에 사용된 인삼잎 등은 충남 금산군 인삼 재배 농가로부터 시료를 직접 채취하여 세척·건조 하여 사용하였다. 실험에 사용한 상업용 효소 pectinase(Ulatazyme AFP, Sumyzyme AC, Cytolase PCL5), amylase(BAN 480L, Shearzyme, Fungamyl), cellulase(ViscozymeⓇL, Ultraflo, Celluclast) beta-glucosidases는 모두 Novozyme Nordisk(Bagsvaerd, Denmark)에서 구입하여 실험을 진행 하였고 ginsenoside 표준품(Rb1, Rb2, Rc, Rd, Compound K)은 Ambo Institute(Daejeon, Korea)에서 구입하여 사용하였다. 기타 실험에 사용한 시약들은 ㈜덕산약품공업(Ansan, Korea), Sigma-Aldrich Co.(St. Louis, Mo, USA)에서 구매하여 사용하였다.
실험에 사용한 인삼잎은 물 세척 및 건조 과정을 거친 인삼잎 100 g을 70% 주정 1 L를 이용하여 80℃에서 12시간 동안 추출한 후 filter paper(Whatman No.2)를 이용하여 여과 후 rotary evaporator(Eyela, tokyo, Japan)을 이용하여 감압 농축하였다. 농축된 침전물에 증류수를 이용하여 용해 후 인삼잎 추출물로 사용하여 효소반응에 이용하였고, 추출물 함유 major ginsenoside는 High Performance Liquid Chromatography(HPLC)(Agelent 1260 series, Agilent Technologies Int., Santa Clara, CA, USA)를 이용하여 분석하였다.
Particle size가 50 μm인 ODS-A resin (YMC Co., Ltd., Kyoto, Japan) 100 mL을 충진한 column을 이용하여 제조된 인삼잎 추출물로부터 Compound K 생산하는 효소반응 기질로 사용 가능한 PPD-type의 ginsenoside를 분리정제하였다. ODS-A resin이 충진된 column을 30% acetonitrile(ACN)을 이용하여 column equilibrium을 진행하였고, 인삼잎 유래 추출물 30 mL를 column에 loading 한 후 30, 60% 의 ACN을 1 mL/min의 유속으로 각각 200 mL씩 흘려주며 fraction으로 분리하였다. 분리한 각 fraction을 HPLC 시스템으로 분석한 후 ginsenoside를 함유하고 있는 fraction은 rotary evaporator를 이용하여 감압 농축하여 기질로 사용하였다.
상업용 효소를 이용한 인삼잎 유래 major ginsenoside로부터 Compound K 생물전환 생산실험을 위해 amylase, cellulase, β-glucosidase, pectinase(50 U/ml) 와 인삼잎 추출물 0.5 mg/mL를 각각 혼합하여 50 mM citrate-phosphate buffer(pH 6.0), 40℃에서 12시간 반응 후 Compound K 생산 유무를 검토하였다.
Compound K 생물전환 생산을 위한 Aspergillus oryzae 유래 pectinase인 Cytolase PCL 5의 효소반응 최적 pH, 온도, 온도 안정성 실험을 위해 인삼잎 추출물 0.6 mg/mL과 50 U/mL의 효소를 사용하여 실험을 진행하였다. 50 mM citrate-phosphate(pH 3.0-6.0)을 사용하여 50℃에서 12시간 반응하여 Compound K 생산에 있어 pH의 영향을 살펴보았다. Compound K 생산에 있어서 최적 반응 온도를 검토하기 위하여 50-75℃ 각각의 온도에서 50 mM citrate-phosphate(pH 4.5)를 사용하여 12시간 반응 후 생산된 Compound K를 HPLC 시스템을 이용하여 검토하였다. 본 효소의 안정성에 온도가 미치는 영향을 검토하기 위하여 50-75℃ 각각의 온도에서 효소를 열처리하여 특정 시간별로 효소를 sampling 한 후, Compound K 생산에 대한 효소활성의 half-life를 검토함으로써 Compound K 생산에 있어서 온도에 대한 효소안정성을 규명하였다.
Compound K 생산을 위한 최적 기질농도 규명을 위하여 50 mM citrate-phosphate buffer(pH 4.5)이용하여 기질농도를 1-25 mg/mL 범위로 제조하였으며, 각각의 기질농도에 효소 100 U/mL를 첨가하여 65℃에서 12시간 반응 후 생산된 Compound K를 HPLC 분석 시스템을 이용하여 분석하였다. 그리고, Compound K 생산을 위한 최적의 효소활성 검토를 위하여 효소농도는 10-250 U/mL로 제조한 후 20 mg/mL 기질(50 mM citrate-phosphate buffer, pH 4.5)을 첨가하여 65℃에서 12시간 반응 후 생산된 Compound K를 HPLC 분석 시스템을 이용하여 분석하였다.
결과 및 고찰
세척, 건조 된 인삼잎 100 g을 70% 주정 1 L를 이용하여 80℃에서 12시간 동안 추출하여 추출물을 제조 하였고 추출물 내의 ginsenoside 함량을 HPLC를 이용하여 정량분석 하였다(Table 1). 그 결과 인삼잎 1 g당 ginsenoside는 146.9 mg으로 정량 되었다. 이중 Compound K 생물전환에 기질로 사용 될 수 있는 PPD-type ginsenoside(ginsenoside Rb1, Rb2, Rc, Rd, F2)는 63.2 mg/g으로 약 43% 임을 확인 하였다. 기존 연구에 따르면 인삼잎 추출물의 ginsenoside중 PPD-type의 ginsenoside가 약 31-42% 라고 보고 되어져 있어(22,24) 본 연구에서 추출한 인삼잎 유래 추출물도 PPD-type의 ginsenoside를 기존에 보고되어진 함량과 유사하게 보유하고 있음을 확인하였다. 그리고, 인삼잎 유래 ginsenoside 종류에 대한 연구 보고에 있어서 Rh1, Rg1, Rg2, Rg3, Re, Rd, Rc, Rb1, Rb2, Rb3이 추출되는 것으로 보고되어 있는데, 본 연구에서 인삼잎으로부터 추출된 ginsenoside는 Table 1에 제시한 것과 같이 기존 연구보고와 80% 이상 일치하는 ginsenoside 성분이 추출되었으므로, 추출과정에서 ginsenoside 종류의 추출이 잘 이루어졌다는 것을 확인 할 수 있었다. 하지만, 기존 연구에서는 인삼잎 유래 ginsenoside로서 추출되지 않은 F2, Rf ginsenoside가 본 연구에 의해 추출되었으며, 기존 연구에서 인삼잎으로부터 추출된 Rg1, Rg3는 본 연구에서 추출이 되지 않은 것으로부터 인삼잎의 종류에 따라서 추출 ginsenoside 종류의 차이가 조금은 존재하는 것으로 확인되었다(22).
제조된 인삼잎 추출물중 Compound K 생물전환 기질로 사용 할 수 있는 PPD-type의 ginsenoside를 분리하기 위해 ODS-A column을 인삼잎 추출물을 loading하고 30%, 60%의 ACN을 이용하여 각각 용출 하였다. 30% ACN을 이용하여 용출한 분획에서는 ginsenoside Re, Rg1 등 PPT-type의 ginsenoside가 검출 되었고 이후 60% ACN을 이용하여 용출한 분획에서 ginsenoside Rb1, Rb2, Rc, Rd, F2 등 PPD-type의 ginsenoside가 검출되었다(Table 2). 분획한 PPD type의 ginsenoside를 감압농축하고 동결건조 후 HPLC를 통해 정량 분석한 결과 분획물 중 ginsenoside Rd, Rc, Rb2, Rb1, F2가 각각 18.2, 21.4, 12.7, 7.5, 5.3%로 확인 되었다.
| Ginsenosides | Rd | Rc | Rb2 | Rb1 | F2 | Total |
|---|---|---|---|---|---|---|
| Concentration (%) | 18.19±0.111) | 21.42±0.21 | 12.68±0.24 | 7.52±0.10 | 5.34±0.31 | 65.15±0.18 |
상업용 효소를 이용하여 Compound K 전환 효소를 찾기 위해 인삼잎 추출물을 부분정제한 분획물 0.6 mg/mL을 이용하여 상업용 효소 100 U/mL의 농도로 40℃에서 12시간 반응 후 HPLC 시스템을 이용하여 Compound K 전환 여부를 확인 하였다. 이때 사용된 상업용 효소는 amylase 3종, cellulase 3종, β-glucosidase 2종, pectinase 3종을 사용하여 시험을 진행하였다. 그 결과 사용된 상업용 효소 중 5% 이상 Compound K를 생산하는 효소는 Ulatazyme AFP, Sumyzyme AC, Cytolase PCL5 3가지 효소가 Compound K를 생산 할 수 있는 것으로 확인 되었고 이중 Cytolase PCL5가 약 40% 이상의 전환율을 나타내어 Cytolase PCL5를 이용하여 Compound K 전환 실험을 진행 하였다(Table 3).
| Enzymes | Contents of compound K (%) |
|---|---|
| Ulatazyme AFP | 8.4±0.091) |
| Sumyzyme AC | 9.1±0.11 |
| Cytolase PCL5 | 47.6±0.31 |
상업용 효소를 이용한 ginsenoside 생물전환 관련 기존 연구를 살펴보면 Choi 등(25)의 연구에서는 Cytolase PCL5 등 5가지 상업용 효소를 이용하여 홍삼 추출물을 반응 하였을 때 Compound K가 생산 되지 않는다고 보고 하였고, Lee 등(24)의 연구에서는 인삼잎 추출물을 이용하여 Cytolase PCL5 등 8가지 상업용 효소를 이용하여 반응 한 결과 대조군에 비해 Compound K 함량이 증가된 효소는 Cytolase PCL5와 Ultraflo L 2가지 상업용 효소에서 Compound K 함량이 각각 1.37, 1.49배 증가 한 것으로 보고되어져 있다(26). 하지만, 기존의 연구 보고에서는 Compound K 생산을 위해 효소반응 조건을 확립한 연구가 아니며, 효소반응을 통해 생산되는 다양한 minor ginsenoside 중 한 종류로서 Compound K의 생산을 보고하고 있다. 따라서, Compound K의 전환율과 생산량은 매우 낮은 결과가 보고되어져 있었다. 따라서, 본 연구에서는 생리활성의 기능이 높은 기능성 ginsenoside인 Compound K 생산을 목표로 효소반응을 통한 생물전환 생산 기술의 확립을 목표로 하였다.
Cytolase PCL5 효소반응 pH와 온도 조건을 살펴본 결과 Compound K 생산에 있어 pH는 4.5, 온도는 65℃에서 최고의 Compound K 전환율을 나타 내었다(Fig. 1). pH 3.0과 pH 6.0에서도 최대 효소활성의 약 80%의 활성을 보이고 있어 pH 조건에서는 대체로 안정적인 것을 확인 할 수 있었다. 그리고, 온도의 영향에 있어서, 본 효소는 65℃가 최적 온도이며, 50℃와 75℃에서 최대 효소 활성의 약 70% 이상의 활성을 유지하고 있어서 50℃ 이상의 고온에서 안정적인 효소 활성을 보이는 것을 확인할 수 있었다.
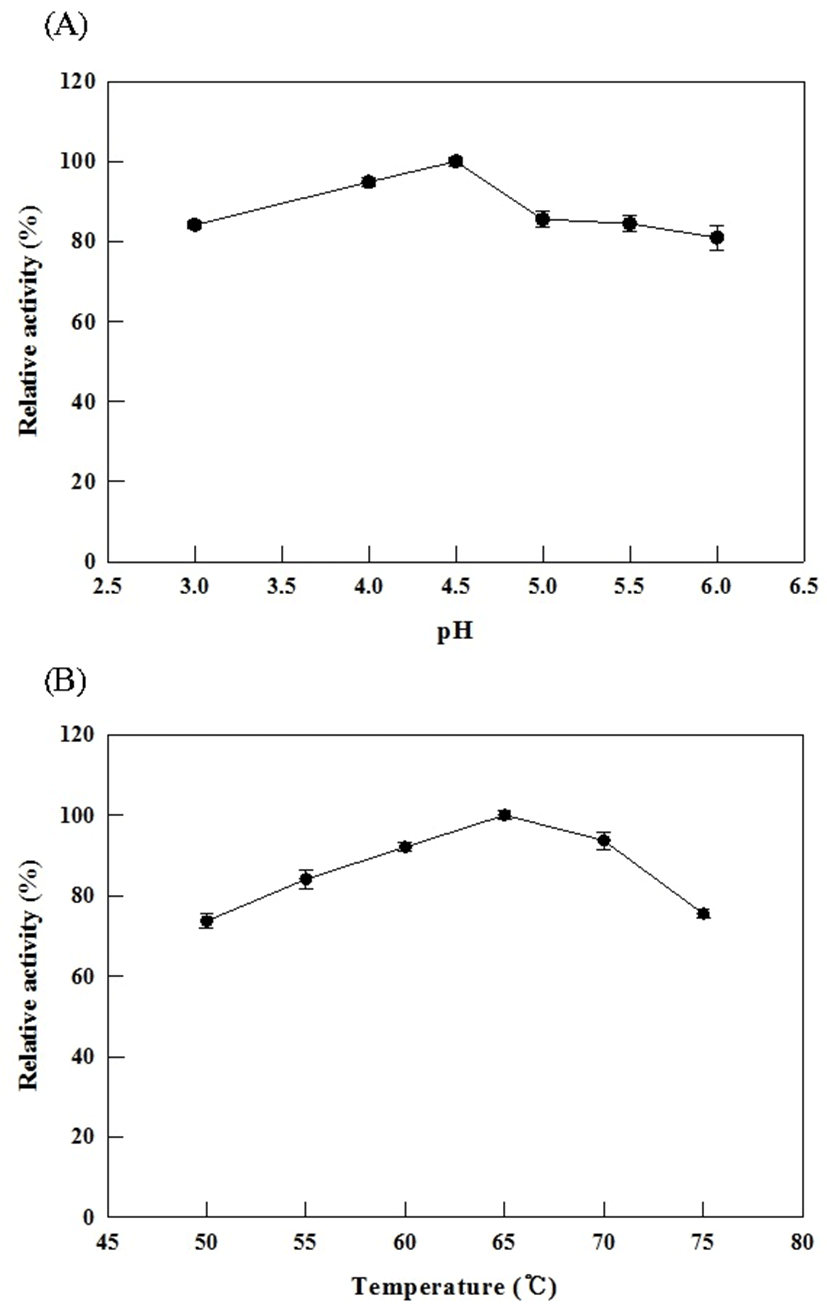
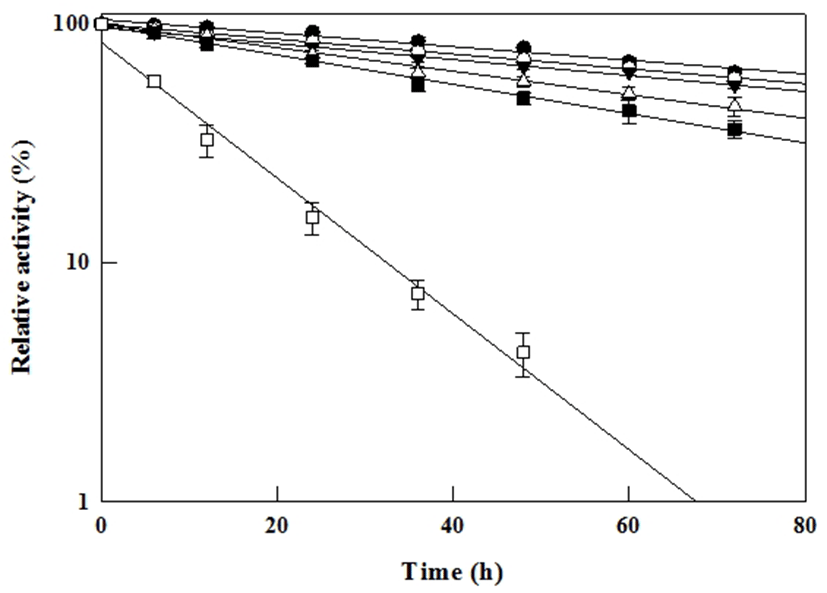
본 연구에서의 효소반응은 12시간이라는 긴 시간의 효소반응이기에 효소반응 중에 온도에 의한 활성 저하를 검토하기 위하여 효소의 열안정성에 대하여 확인하였다. 효소를 50-75℃ 조건 하에서 열처리하여 일정시간 간격으로 채취한 효소를 반응에 이용한 결과, 효소 활성은 1차 kinetics를 따랐고 이에 따른 반감기(t1/2)는 50, 55, 60, 65, 70, 75℃에서 각각 118, 94, 87, 60, 47, 8시간임을 알 수 있었다(Fig. 2). 효소 활성 온도 및 효소의 열안정성 결과로부터 본 연구에서 효소반응을 위해 설정한 65℃, 12시간 반응 조건은 효소 활성의 감소 없이 효소 활성이 잘 유지되고 있는 것으로 확인되었다. Choi 등(25)의 Cytolase PCL5를 이용한 ginsenoside 생산 연구는 Compound K 생산을 위한 효소특성 규명 연구가 아니었기에, 효소반응 조건으로서 10-55℃, 최적 pH는 2.5-5.0의 범위에서 연구가 진행되었으며, Compound K 생산을 위한 Cytolase PCL5의 최적 반응조건이 확립되지는 않았었다. 하지만, 본 연구에서는 Compound K 생산에 대한 Cytolase PCL5의 최적의 반응조건 확립을 통하여 효소 반응조건에 따라서 gisenoside 생산성에 차이를 확인함으로써, 이러한 결과로부터 향 후 효소를 적용하여 특정 ginsenoside 생산을 진행 할 경우에는 해당 효소가 특정 gisenoside 생산에 요구하는 최적 조건의 확립을 통하여 목표 gisenoside 생산성 향상에 기여 할 수 있다는 것을 시사하였다.
Cytolase PCL5를 이용한 Compound K 생산 최적 효소반응의 최적 기질농도는 인삼잎 추출물을 부분정제한 분획물 중 ginsenoside 함량을 기준으로 설정 하였다. 인삼잎 추출물 부분정제한 기질 중 ginsenoside 함량을 3-25 mg/mL의 농도에서 100 U/mL의 Cytolase PCL5 효소를 사용하여 최적 기질농도를 조사 하였다. 그 결과 기질농도 20 mg/mL 까지 Compound K 생산량이 꾸준히 증가 하는 것을 확인 할 수 있었지만 전환율에 있어 10 mg/mL 기질농도 까지는 약 100%에 가까운 전환율(mole/mole)을 나타내는 반면 그 이상 기질농도에서는 전환율이 급격히 감소하는 것을 확인 할 수 있었다. 이러한 결과를 바탕으로 Compound K 생산을 위한 최적 기질농도는 ginsenoside 기준 10 mg/mL로 확인되었다(Fig. 3(A)).
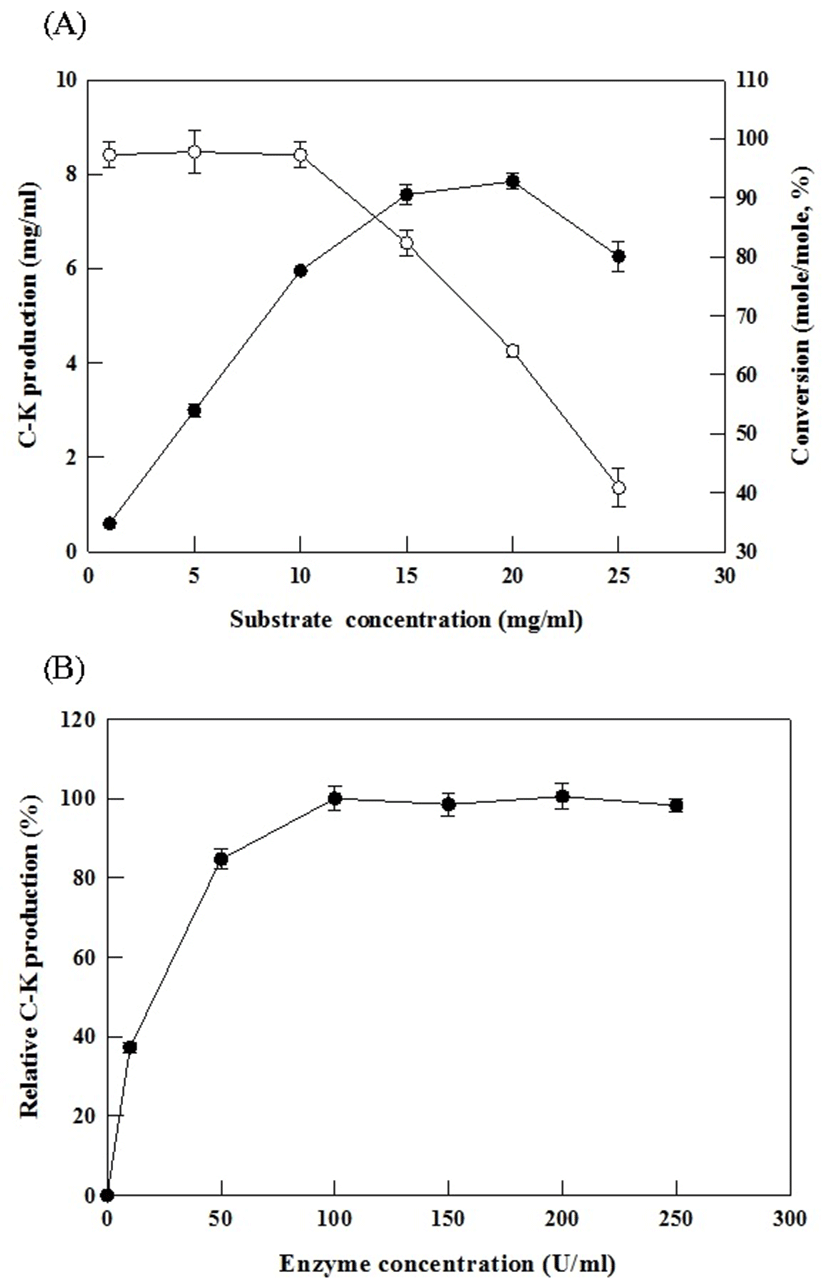
Compound K 생산에 있어 최적 Cytolase PCL5 효소량을 알아보기 위해 1-200 U/mL의 Cytolase PCL5을 사용하여 기질농도 10 mg/mL의 Compound K 생산에 미치는 효소량을 조사 하였다(Fig. 3(B)). 그 결과 100 U/mL까지 Compound K 생산량이 증가하고 그 이상 농도에서는 평형화 되는 것을 확인하여 최적 효소 농도는 100 U/mL인 것으로 확인되었다.
Bae 등(15)이 Bifidobacterium sp.을 이용하여 Rb1, Rb2, Rc로부터 Compound K를 생산한 연구와, Ko 등(17)이 다양한 glycoside hydrolase를 이용하여 사포닌 혼합물로부터 Compound K를 생산한 연구에서는 Compound 생산을 위하여 기질로 이용되는 gisenoside의 최적 농도 및 생물자원(효소 및 미생물)의 최적 농도 규명에 대한 연구는 진행되지 않았었다. 본 연구를 통하여 Cytolase PCL5를 이용한 인삼잎 유래 ginsenoside로부터 Compound K 생산을 위한 최적 기질 및 효소농도를 규명함으로써 기질 및 효소 사용량의 손실을 최소화 할 수 있는 효율적이며 경제적인 Compound K 생물전환 생산방법이 확립되었다고 할 수 있겠다.
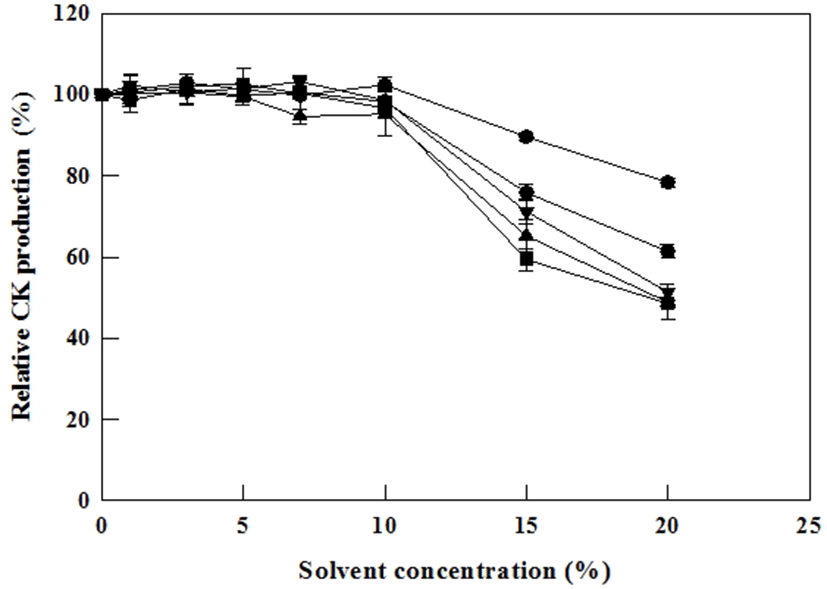
Cytolase PCL5의 유기용매 첨가에 따른 Compound K 생산에 미치는 영향을 알아보기 위해 0-20% 농도의 유기용매(Ethanol, Methanol, Dimethyl sulfoxide, Chloroform, Toluene)조건 하에서 기질농도 10 mg/mL, Cytolase PCL5 효소 농도 100 U/mL, pH 4.5, 65℃에서 12시간 반응 후 Compound K 생산을 확인해 보았다. 그 결과 10% 유기용매 농도 까지는 Compound K 생산량에 특이적인 변화는 없는 것으로 확인 되었고 10% 농도 이상에서는 Compound K 생산량이 급격히 줄어드는 것을 확인 할 수 있었다(Fig. 4). 10% 농도 이상의 유기용매는 Cytolase PCL5 효소 활성에 영향을 미치는 것으로 나타났으며, 그 이하 농도에서는 효소 활성 및 Compound K 생산량에 큰 영향을 미치지 않는 것으로 확인되었다.
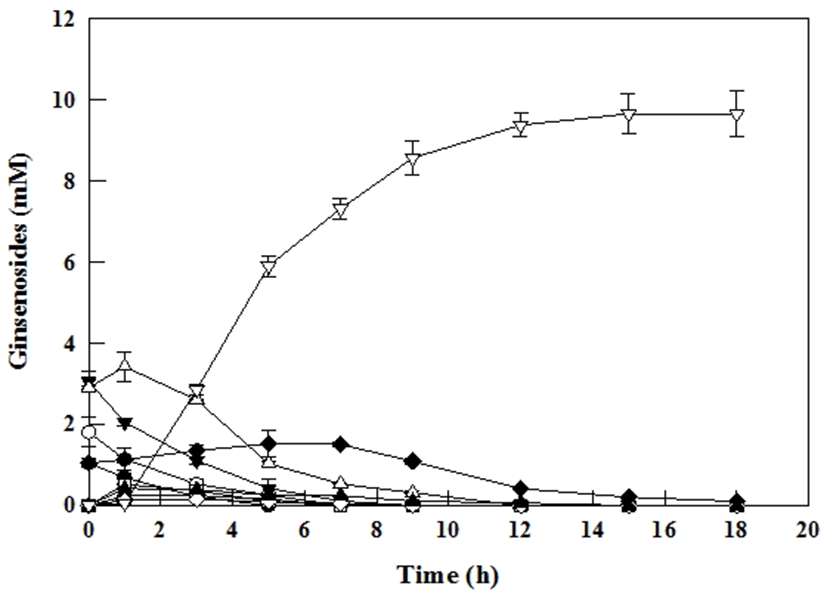
인삼잎 추출물을 ODS-A column을 이용하여 PPD type ginsenoside만 부분 정제한 분획물과 100 U/ml의 효소를 pH 4.5, 65℃에서 15시간 반응하여 Compound K 생산을 확인 하였다. Compound K 생산 시 기질로 사용되는 Rb1, Rb2, Rc, Rd, F2 등은 ginsenoside 기본 골격구조에 glucose, arabinose 등 당 분자 2-4개가 결합된 구조이고 Compound K는 glucose 1분자가 결합된 구조로서 기질 ginsenoside로부터 Compound K가 생산되면 분자량의 차이에 의해 Compound K의 질량은 기질 ginsenoside의 분자량보다 감소하게 된다. 따라서 정확한 Compound K의 전환율을 확인하기 위하여 기질 ginsenoside 및 생산물 Compound K는 질량단위인 mole 단위로 비교 검토되었다. 그 결과 Fig. 5와 같이 10시간 만에 약 9.8 mM의 Compound K를 생산하여 약 1 mmol/L/h의 생산성을 보이는 것으로 확인 되었다. 사용된 기질 중 ginsenoside Rb1, Rb2, Rc, Rd, F2의 mole 농도는 각각 1.0, 1.8, 3.1, 2.9, 1.0 mM로 전체 9.9 mM을 사용 하였고 최종 반응 후 Compound K의 mole 농도는 9.65 mM로 mole 비율에 따른 전환율은 약 97%임을 확인 할 수 있었다. 이와 같은 높은 전환율을 보이는 것은 Cytolase PCL5 효소반응 시 inhibitor로 작용할 수 있는 탄수화물 등이 ODS-A column을 이용하여 PPD-type ginsenoside를 부분정제하는 공정에서 일부 제거되어 고순도의 기질을 사용한 결과로 사료 된다.
초고온균인 Sulfolobus solfataricus 유래의 재조합 β-Glycosidase와 인삼 추출물을 이용한 Compound K 전환 연구에서는 3.57 mg/mL의 기질(ginsenoside Rb1, Rb2, Rc, Rd)을 이용하여 12시간동안 1.63 mg/mL의 Compound K를 생산 하였고 이때 mole 농도의 전환율은 약 79%, 생산성은 0.22 mmol/L/h 라고 보고 되어져 있고(19) Sulfolobus solfataricus 유래의 재조합 β-Glycosidase와 Caldicellulosiruptor saccharolyticus 유래의 재조합 α-L-arabinofuranosidase 2가지 효소를 동시에 사용한 연구에서는 12시간동안 100%의 mole 전환율을 보이고 생산성은 0.05 mmol/L/h로 보고되어져 있다(27). 또한 Paecilomyces bainier sp. 229균주를 이용한 발효 연구에서는 배양조건 최적화 등을 통해 mole 전환율을 72.7%의 Compound K 생산 연구를 수행 하였다(28).
본 연구의 결과와 선행 연구들을 살펴본 결과 상업용 효소인 Cytolase PCL5를 사용하여 major ginsenoside로부터 Compound K의 높은 전환율을 확인하였고 생산성은 초고온균인 S. solfataricus 유래의 재조합 β-Glycosidase의 Compound K의 약 4.5 배 향상 그리고, S. solfataricus 유래의 재조합 β-Glycosidase와 C. saccharolyticus 유래의 재조합 α-L-arabinofuranosidase 2가지 효소를 동시에 사용한 연구와 비교하여 20 배의 높은 생산성을 확인하였다. 또한 본 연구에서는 식품 제조 공정에 바로 사용 가능한 상업용 효소, Cytolase PCL5를 사용을 통하여 Compound K 생물전환 생산 방법을 확립하였기에 이러한 결과는 상업용 효소의 활용성 증가의 기여뿐만 아니라 인삼 부산물(인삼잎)을 이용한 고부가가치 소재인 ginsenoside Compound K의 산업적 생산과 함께 농산 폐기물로부터 부가가치 창출을 위한 생물전환 기술의 확대 적용에도 기여 할 수 있을 것으로 기대되어진다.
요 약
본 연구에서는 상업용 효소를 이용하여 인삼잎 유래 ginsenoside로부터 Compound K를 생산하는 연구를 수행하였다. 인삼잎 추출물에 함유되어 있는 총 ginsenoside는 146.9 mg/g 이었으며 PPD-type ginsenoside인 Rb1, Rb2, Rc, Rd, 그리고, F2의 함양은 각각 5.7, 11.58, 19.8, 16.4, 그리고 9.8 mg/g 이었다. 상업용 효소인 Aspergillus niger 유래 pectinase, Cytolase PCL5는 인삼잎 추출물 유래 PPD-type ginsenoside로부터 Compound K 생산에 있어서 가장 높은 효소 활성을 보였다. 본 효소는 pH 4.5와 65℃ 조건에서 가장 높은 효소 활성을 나타내었으며, 50, 55, 60, 65, 70, 그리고 75℃ 에서 half-life는 각각 118, 94, 87, 60, 47, 그리고 8시간을 나타내는 온도안정성을 보였다. Compound K 생산에 있어서 PPD-type ginsenoside와 효소의 최적 농도는 각각 10 mg/g 과 100 U/mL를 나타내었다. 본 연구에서 확립된 최적조건에서 Cytolase PCL5는 PPD type ginsenoside로부터 Compound K를 몰농도 97% 전환하였으며, 10시간 동안 1 mole/L/h의 생산성으로 Compound K를 생산하였다. 이러한 결과는 인삼잎은 Compound K를 생산하는데 효율적으로 활용 될 수 있는 소재이며, 상업용 효소 Cytolase PCL5는 Compound K 생산에 있어서 유용한 효소라는 것을 시사하였다.
