서 론
젖산균은 우유 및 채소류의 발효에 관여하여 발효식품의 저장성과 풍미를 부여한다. 메치니코프에 의해 발효유의 젖산균들이 정장작용을 한다는 것과 불가리아 농민들의 장수비결이 발효유라는 것이 소개된 이후로 젖산균과 관련된 건강을 위한 많은 연구들이 보고되고 있다(1,2). 그 중에서도 Lactobacillus spp.는 대표적인 probiotic으로서 정장작용, 면역증진 등의 효능이외에 최근 뇌건강과 관련된 효능이 보고되었다(3).
Lacotobacillus spp. 중에서도 Lactobacillus plantarum 균주가 생성하는 γ-aminobutyric acid(GABA)는 산에 대한 내성기작의 일환으로 생성되며 전구물질인 glutamate가 GAD(glutamate decarboxylase)에 의해 탈탄산화 되어 생성된다. GABA는 자연계에 존재하는 비단백질 아미노산으로 포유류의 중추신경계에서 흥분 억제성 신경전달물질로서 작용하며, 항 정신불안증, 항 경련 효과가 있다(4,5). 또한 뇌세포 대사기능을 촉진시키며, 혈압강하 효과, 기억력 증진 효과, 수면유도 효과가 있다고 보고되었다(6,7). 반면, GABA가 부족할 경우 경련, 간질 등을 유발시키기도 하는 것으로 알려져있다(5).
섭취를 통해 GABA의 생리 활성 효과를 기대하기 위해서는 하루 50-200 mg을 섭취해야 한다(8). 그러나 천연물에 존재하는 GABA의 함량은 몹시 미미하기 때문에 고농도의 GABA를 생산하기 위한 연구가 활발히 진행되고 있다(9). 특히 유산균 발효를 통해 GABA의 함량을 크게 증가시킨 연구들이 보고되어 있다. 이와 관련된 연구로는 김치유래 젖산균 Lacotobacillus sp.에 의한 GABA 생산(10), 카카오 추출물의 젖산균 발효를 통한 GABA 생산(11), 양송이 유래 젖산균에 의한 GABA 생산(12) 등이 있다.
한편, 돌배나무류(Pyrus spp.)는 장미과에 속하는 낙엽교목으로, 그 열매는 식용뿐만 아니라 민간약으로 널리 사용되어왔다. 돌배나무류는 돌배나무(P. pyrifolia (Burm. fil.) Nakai), 산돌배나무(P. ussuriensis Maximowicz), 백운배나무(P. ussuriensis Maximowicz var. hakunensis), 남해배나무(P. ussuriensis Maximowicz var. nankaiensis (Nakai) T. Lee), 청실배나무(P. ussuriensis Maximowicz var. ovoidea Rehder), 털산돌배나무(P. ussuriensis Maximowicz var. pubescens Nakaie) 등 종류가 다양하다(13).
그 중에서도 산돌배나무는 돌배나무와 함께 우리나라에 널리 분포하는 야생 배나무류 중 하나로(14), 산돌배 열매는 민간에서 한의학적으로 토사(吐瀉), 개선(疥癬), 해열(解熱) 등의 약재로 쓰여 왔으며(15), 예로부터 조상들이 즐겨먹는 과일의 한 종류로서 잘 알려져 왔다.
돌배나무류는 돌배나무 잎 추출물의 자외선 B에 의해 손상된 피부세포에 대한 보호효과(16), 산돌배나무 잎 분획물의 항암 및 항균활성(17), DPPH free radical 소거법을 이용한 산돌배 나무의 항산화 활성 화합물 분리(18)에 관한 연구 등이 보고되어 있으나 산돌배나무의 과실을 이용하여 식품 소재로서 활용하고자 하는 연구는 미미한 실정이다.
따라서 본 연구에서는 산돌배 과실을 고부가 가치 식품 소재로 개발하고자 두 가지 젖산 균주를 이용한 혼합발효를 통해 probiotic과 기능성 물질 GABA가 강화된 기능성 산돌배 과실 발효물을 생산하고자 하였다.
재료 및 방법
본 연구에 원료로 사용된 건조 산돌배는 서현생약영농조합(Chungnam, Korea)에서 구매하였다. 젖산 발효 시 탄소원으로 사용된 설탕과 GABA 생성을 위한 전구물질로 사용된 MSG는 CJ 제일제당㈜(Incheon, Korea)에서 구입하였고, MRS broth는 DifcoTM Lactobacilli MRS(Becton Dicknson and Company, Sparks, MD, USA) 제품을 사용하였다.
Lactobacillus plantarum EJ2014(L. plantarum EJ2014)는 미강(Rice mill, Uljin, Korea)으로부터 분리한 균주를 한국미생물보존센터에 기탁한 후 분양받아 사용하였다(KCCM 11545P). 이 균주를 MRS agar plate에 30℃, 24시간 배양한 다음 멸균한 MRS broth 액체배지에 순수 배양된 L. plantarum EJ2014를 한 백금이 접종하여 30℃에서 24시간 동안 정치 배양하여 스타터로 사용하였다.
Leuconostoc citreum S5(Lc. citreum S5)는 김치로부터 분리한 균주를 한국미생물보존센터에 기탁한 후 분양받아 사용하였다(KCCM 10778P). 이 균주를 sucrose를 포함함 agar plate(sucrose 2%, yeast extract 0.5%, tryptone 0.25%, K2HPO4 0.25%)에 25℃, 24시간 배양한 다음 멸균한 MRS broth 액체배지에 순수 배양된 Lc. citreum S5를 한 백금이 접종하여 30℃에서 24시간 동안 정치 배양하여 스타터로 사용하였다.
건조 산돌배 과실의 9배에 해당하는 양의 증류수를 첨가한 후 건조 산돌배를 넣어 100℃에서 30분간 용출시켰다. 침지시킨 건조 산돌배를 hand blender(HR 1673, Koninklijke Philips N.V. Co., Ltd., Amsterdam, Nederland)를 이용하여 분쇄한 후 거름망(80목)을 이용하여 씨와 껍질 등의 불용성 물질들을 제거하여 사용하였다.
건조 산돌배 과실 추출물(P. ussuriensis Maximowicz fruit extract, PFE)의 고형분 함량은 상압 가열 건조법(19)을 이용하여 수분 함량을 5회 반복 측정한 후 그 평균값을 100에서 제외한 값으로 산출하였다. 수분 함량은 시료 3 mL를 항량된 칭량 접시에 담은 후 105℃ 건조기(HB-502n, Hanbaek scientific Co., Bucheon, Korea)에서 건조하여 항량된 무게를 측정하였다.
영양성분으로 yeast extract 1%(v/v), potassium phosphate 0.5%(v/v)를 동일하게 첨가였으며, sucrose를 0, 5%(v/v)로 달리하였다. Lc. citreum S5스타터를 1%(v/v) 접종하여 25℃에서 2일간 정치배양 하였다. 2일간의 발효 후 L. plantarum EJ2014 발효가 진행되는 동안 GABA를 생성하기 위해 MSG 3%(v/v)를 추가하였다.
PFE 젖산균 혼합 발효물의 pH는 시료 1 mL에 증류수 9 mL를 첨가하여 희석한 후 pH meter(SevenEasy, Mettler-Toledo AG, Schwerzenbach, Switzerland)를 이용하여 측정하였다. 적정 산도는 pH 8.3에 도달할 때까지 0.1 N NaOH로 적정하여 그 소비량을 lactic acid 함량(%, v/v)으로 환산하여 산출하였다(20).
생균수는 10배 희석법을 이용하여 PFE 혼합 발효물 100 μL에 멸균 증류수 900 μL 첨가하여 104, 105, 106배로 희석한 것을 MRS agar plate에 20 μL 도말하였다. 그 후 30℃ 항온배양기(HB-201MS-4, Hanbaek scientific Co., Bucheon, Korea)에서 24시간 배양한 다음 측정하여 colony forming unit(CFU)/mL로 나타내었다.
PFE 혼합 발효물의 환원당 함량은 dinitrosalicylic acid(DNS)법(21)에 따라 측정하였으며, D-glucose(Sigma Aldrich, St. Louis, MO, USA)를 표준물질로 사용하였다. 일정한 농도로 희석한 시료를 15,000 rpm에서 20분 원심분리(Centrifuge 5415R, Eppendorf, Hamburg, Germany)하여 분리한 상등액 1 mL에 DNS 시약 3 mL를 첨가하였다. 그 후 5분간 100℃ 물에서 발색시키고 40분간 암소에서 실온으로 냉각한 후 550 nm에서 UV spectrophotometer(UltrospecⓇ2100 pro, Amersham Biosciences, Waltham, MA, USA)를 이용하여 흡광도를 측정하였다.
총 폴리페놀 함량은 AOAC법(22)에 의하여 측정하였으며, gallic acid (Sigma Aldrich, St. Louis, MO, USA)를 표준물질로 사용하였다. 추출물을 농도별로 희석한 용액 60 μL에 2배 희석 folin시약 60 μL를 첨가하여 3분간 방치한 후, 10% Na2CO3 용액 60 μL를 첨가하여 반응시킨 용액의 흡광도를 microplate spectrophotometer(Epoch, Biotek Instruments, Winooski, VT, USA)로 700 nm에서 측정하였다.
총 플라보노이드는 Nieva Moreno 등의 방법(23)을 이용하여 측정하였으며, quercetin(Sigma-Aldrich, St. Louis, MO, USA)를 표준물질로 사용하였다. 각 시료 추출물 0.1 mL와 80% ethanol 0.9 mL를 혼합한 혼합물 0.5 mL에 10% aluminium nitrate 0.1 mL, 1 M potassium acetate 0.1 mL 그리고 80% ethanol 4.3 mL를 가하여 실온에 40분 방치한 뒤 microplate spectrophotometer(Epoch, Biotek Instruments, Winooski, VT, USA)로 415 nm에서 흡광도를 측정하였다.
무기질 분석은 식품공전(24)에 따라 수행하였으며, 습식분해법에 따라 시험용액을 조제하였다. 시료를 회화하고 염산과 증류수를 넣고 용해한 뒤 100 mL 메스플라스크에 여과하여 정용하였다. 정용한 용액을 inductively coupled plasma atomic emission spectrometer(ICP-MS, ELAN 9000, Perkin Elmer Inc., CA, USA)로 무기질 표준품(AccuStandard, New haven, CT, USA)을 이용하여 정성 원소를 정성·정량하였다. ICP-MS 분석 조건으로 plasma power는 1.3 kw, nebulizer gas flow는 0.8 L/min, plasma gas flow 15 L/min, auxiliary gas flow 0.2 L/min로 하였다.
Silica gel thin layer chromatography(TLC) plate는 10×20 cm2로 잘라서 MSG와 GABA를 측정하였다. 발효물은 증류수로 2배 희석한 후 원심분리한 상등액을 sample로 사용하였다. TLC plate의 아래에서 15 mm 높이에 10 mm의 간격을 유지하며 점적한 후 건조하고 전개하였다. 전개는 n-butyl alcohol:acetic acid glacial:distilled water를 3:1:1(v/v)의 비율로 혼합하여 4시간 포화시킨 전개용매를 이용하여 chamber(30×25×10 cm3)에서 TLC plate의 상단이 10-15 mm 남을 때까지 진행하였다. 전개가 끝난 TLC plate는 건조한 후 발색하였으며, 0.2% ninhydrin 용액을 발색시약으로 사용하였다. 90℃ 건조기(HB-502n, Hanbaek Scientific Co., Bucheon, Korea)에서 5-10분 동안 발색시킨 후 발효물의 MSG와 GABA spot을 확인하였다. MSG의 표준물질로 사용된 glutamate와 GABA의 표준물질은 Sigma-Aldrich(St. Louis, MO, USA)에서 구입하였으며, 0.5%로 사용하였다.
GABA 전환율을 확인하기 위한 유리 아미노산 함량 측정은 건조시킨 시료를 phenylisothiocyanate(PITC)용액 20 μL(MeOH : H2O : TEA : PITC=7:1:1:1)에 유도체화 시킨 뒤 상온에서 30분간 반응 시켰다. 시료를 완전히 건조시킨 후 200 μL의 A solvent로 녹이고 원심분리한 후 상등액을 0.45 μm syringe filter로 여과하고 C19 컬럼(Nova-Pak, 4 um, 3.9×300 mm)이 장착된 HPLC(Agilent 1260, CA, USA)로 분석하였다. Column 온도는 46℃를 유지하였으며, 분석 용매 A(140 mM NaHAc, 0.15% TEA, 0.03% EDTA, 6% CH3CN), 용매 B(60% CH3CN, 0.015% EDTA)를 농도구배(A 100%, A 0%, 23 min) 조건에서 1.0 mL/min 속도로 흘리면서 245 nm에서 detector(HP 1100 series)로 측정하였다. 표준물질로 사용한 glutamate와 GABA는 TLC 정성 분석에서 사용한 것과 같다.
결과 및 고찰
PFE의 분석 결과는 Table 1, 2와 같다. Shin 등(25)은 추출 조건을 각각 water, 50% EtOH, 100% EtOH로 달리하여 약용식물을 추출한 결과 폴리페놀은 100% EtOH에서, 플라보노이드는 50% EtOH에서 가장 높게 측정되었다고 보고하였다. 이를 건조 산돌배 과실 열수 추출물을 분석한 본 결과와 비교했을 때, 산돌배의 폴리페놀 함량과 플라보노이드 함량은 측정된 결과보다 더 높은 것으로 나타났다.
| Items | Value |
|---|---|
| pH | 4.50 |
| Acidity (%) | 0.28 |
| Reducing sugar (%) | 1.43 |
| Soluble content (oBrix) | 5.25 |
| Polyphenol (µg/mL) | 400.41 |
| Flavonoid (µg/mL) | 29.50 |
| Items | Content (mg/100 g) |
|---|---|
| Potassium | 127.62 |
| Phosphorus | 8.52 |
| Sodium | 5.11 |
| Magnesium | 4.78 |
| Calcium | 3.51 |
| Ferrum | 0.23 |
| Manganese | 0.05 |
무기질 7종의 분석 결과, 칼륨이 127.6 mg/100 g으로 가장 높은 함량을 나타내었으며, Lim 등(26)은 칼륨의 섭취가 나트륨 흡수 저해의 효과가 있다고 보고한 바 있다. 다음으로 인 8.52 mg/100 g, 소듐 5.11 mg/100 g, 마그네슘 4.78 mg/100 g, 칼슘 3.51 mg/100 g, 철 0.23 mg/100 g, 망간 0.05 mg/100 g 순으로 함유하고 있는 것을 확인하였다.
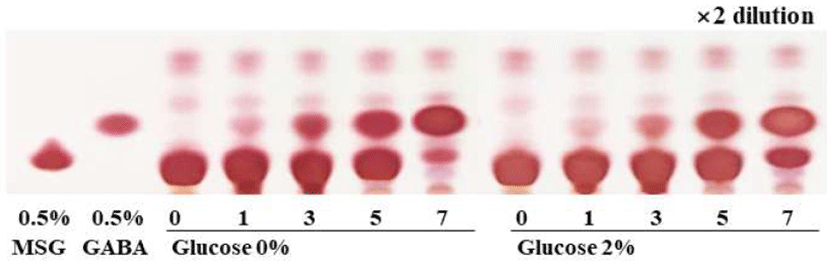
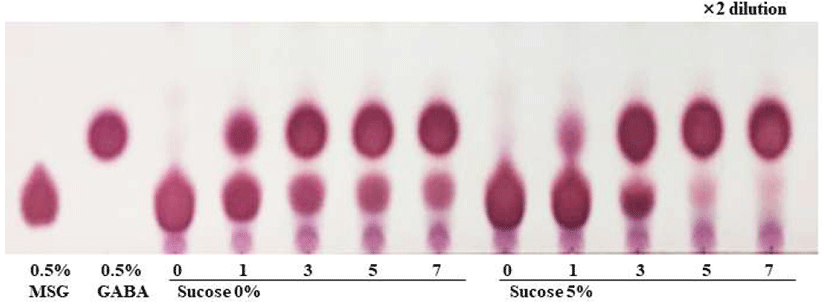
Starter를 접종하기 전 희석하지 않은 PFE의 생균수를 확인한 결과 0.0 log CFU/mL로 나타났다. 따라서 PFE가 살균된 상태라고 판단하고 실험을 진행하였다. 추출 PFE의 L. plantarum EJ2014 단일 젖산 발효에서 영양성분으로 glucose 0-2%, yeast extract 1%, GABA의 전구물질 MSG 3%를 공급한 후 7일간 발효를 진행하였을 때 TLC를 통해 MSG가 여전히 잔존하는 것을 확인하였다(Fig. 1). 따라서 Kwon 등(27)의 연구에서 Leuconostoc sp.균주가 생성하는 고분자 점성 물질인 dextran이 혐기적인 조건을 만듦에 따라 Lactobacillus sp.의 발효를 원활히 한다는 결과를 바탕으로 1차 Lc. citreum S5발효를 2일간 진행하였다. 이후 MSG 3%를 첨가하여 2차 L. plantarum EJ2014 발효를 7일간 진행하였다. 1차 발효 시 dextran의 전구물질인 sucrose를 각각 0, 5%로 달리 첨가하였으며, 그 외의 영양 성분인 yeast extract와 potassium phosphate는 각각 1%, 0.5%로 동일하게 첨가하였다.
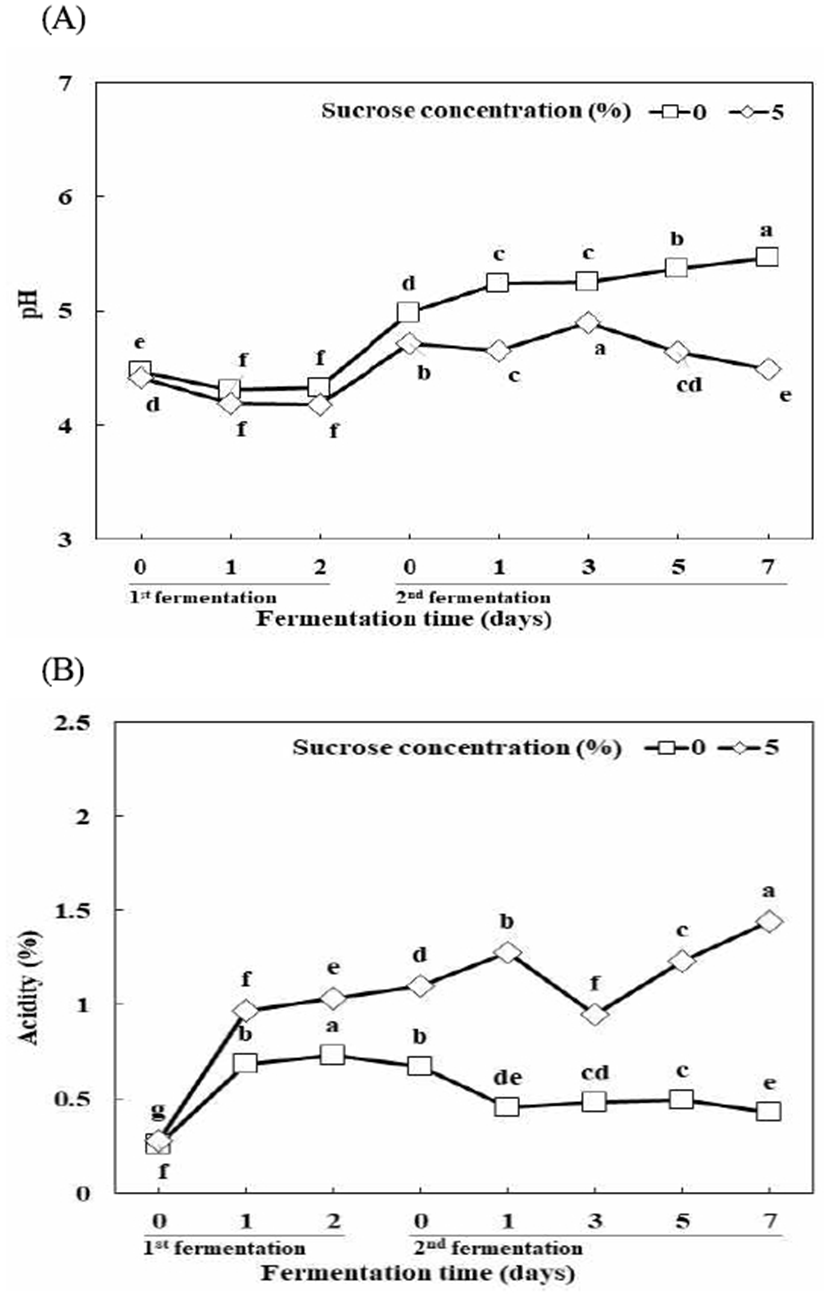
PFE의 초기 pH는 각각 pH 4.47, pH 4.42로 나타났으며 1차 발효가 진행됨에 따라 pH가 감소하여 발효 2일 차에 각각 pH 4.33, pH 4.19로 나타났다. 그 후 2차 발효 시 첨가한 중성 물질인 MSG로 인해 pH가 소폭 증가하여 각각 pH 4.99, pH 4.71로 나타났다. Sucrose 0% 조건의 경우 2차 발효가 진행되는 동안 pH가 유의적으로 증가하여 2차 발효 7일 차에 pH 5.46을 나타내었으며, sucrose 5% 조건의 경우 2차 발효 3일 차까지 pH 4.90으로 증가한 후 감소하여 2차 발효 7일 차에 pH 4.50을 나타내었다. Lim과 Lee(28)는 미생물에 의해 GABA가 생성될 때 GAD 효소에 의해 glutamate가 decarboxylation되는 동시에 proton이 소비됨으로써 GABA의 생성과 더불어 pH를 높이는 것으로 보고하였다. 따라서 2차 젖산균 발효가 진행되면서 pH가 증가하는 현상은 L. plantarum에 의해 기질인 MSG가 GABA로 전환되었기 때문인 것으로 사료되었다.
PFE의 초기 산도는 각각 0.26, 0.28%로 나타났으며, 1차 발효가 진행됨에 따라 산이 생성되어 각각 0.73, 1.03%를 나타내었다. 그 후 2차 발효 1일 차에 sucrose 0% 조건의 경우 유의적인 감소 후 큰 변화를 나타내지 않았으며 2차 발효 7일 차에 0.43%를 나타내었다. 반면에 sucrose 5% 조건의 경우 2차 발효 1일 차에 1.28%로 소폭 증가한 후 2차 발효 3일 차에 유의적으로 감소한 후 증가하여 2차 발효 7일 차에 1.44%로 나타났다(Fig. 2). 산도가 증가한 후 다시 감소한 것은 pH의 변화와 마찬가지로 젖산균 발효가 원활히 진행됨에 따라 유기산이 생성된 이후 전구물질인 glutamate가 GABA로 전환되는 과정에서 proton이 소비되어 나타나는 현상이라고 판단하였다.
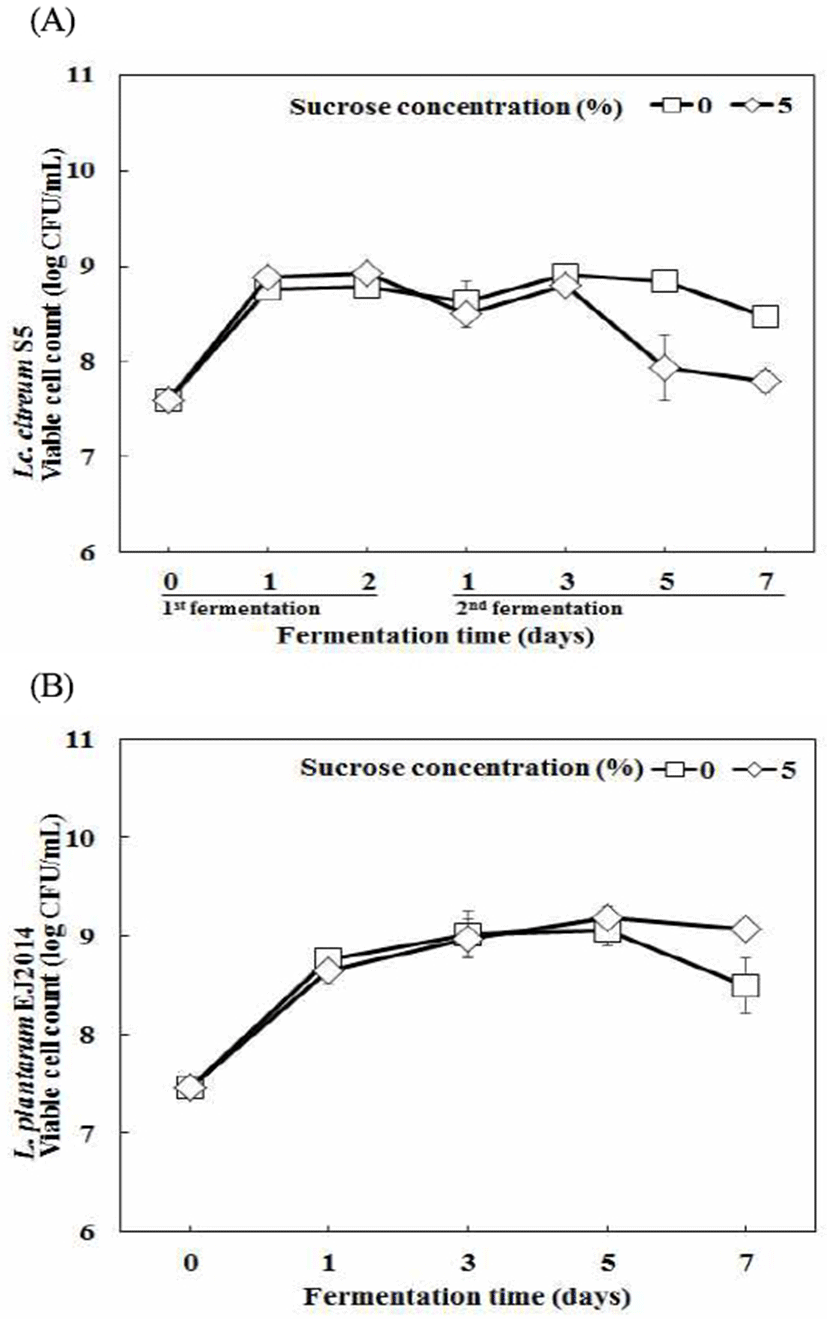
1차 젖산 발효에 이용한 Lc. citreum S5의 생균수는 7.59 log CFU/mL에서 1차 발효 2일 차에 각각 8.75, 8.87 log CFU/mL로 증가하였다. 이후 2차 발효가 진행되면서 균수가 전반적으로 감소하여, 2차 발효 7일 차에 8.48, 7.79 log CFU/mL로 나타났다. 2차 발효 시 L. plantarum EJ2014 발효를 위해 7.46 log CFU/mL를 접종하였으며, sucrose 0, 5% 두 조건 모두 2차 발효 5일 차에 9.07, 9.18 log CFU/mL로 증가한 후 2차 발효 7일 차에 미미하게 감소하였다(Fig. 3). 두 균주는 각 콜로니의 크기와 색깔을 비교하여 확인하였다(Fig. 4).
발효 초기 sucrose 0, 5% 두 조건의 환원당은 1.31, 1.47%로 나타났다. Sucrose 0% 조건의 경우 1차 발효 1일 차에 0.11%로 거의 모든 환원당을 소진하였다. Sucrose 5% 조건의 경우 발효 1일 차에 1.71%로 증가하였는데, 이는 Lee와 Park(29)의 연구결과에서 Leuconostoc sp.에 의해 sucrose가 glucose와 fructose로 분해된 것과 같이 비환원성 당인 sucrose가 분해되면서 환원성당인 glucose와 fructose로 전환되었기 때문인 것으로 판단하였다. 1차 발효 2일 차에 1.40%로 감소하였으며 2차 발효 3일 차까지 0.29%로 유의적으로 감소하였다(Fig. 5). 1차 발효가 진행되는 동안 환원당이 감소하는 것은 생성된 glucose와 fructose가 각각 dextran, mannitol로 합성, 전환(30) 되었기 때문인 것으로 판단하였다. 또한 2차 발효가 진행되는 동안 환원당이 감소하는 것은 L. plantarum EJ2014에 의해 환원당이 소진되었기 때문인 것으로 판단하였으며, 이는 Song과 Park(31)의 연구결과와 일치하였다.
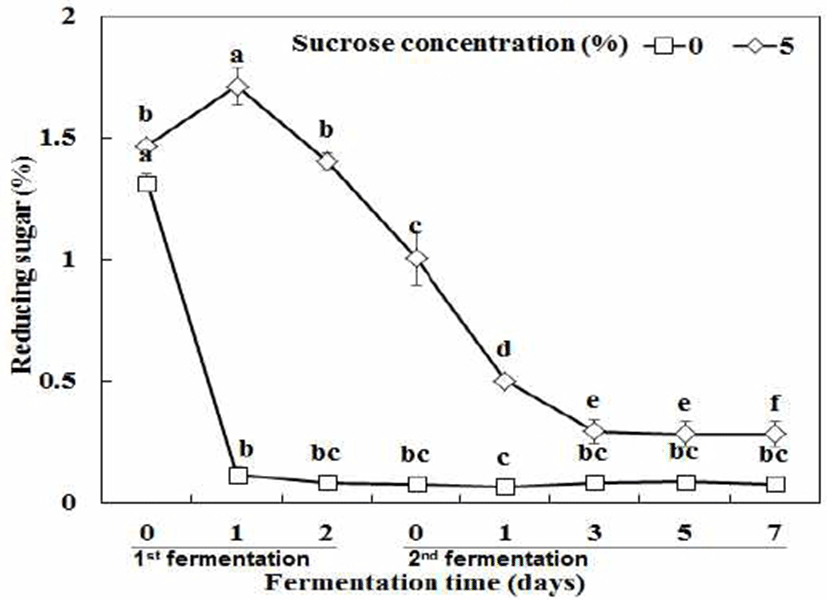
초기 sucrose 농도에 따른 젖산균 혼합 발효물의 MSG 소진과 GABA 생성을 비교하기 위해서 TLC plate를 이용하여 확인한 결과 sucrose 0% 조건에서 2차 발효 7일 차에 MSG가 잔존하는 것을 확인하였다. 반면 sucrose 5% 조건의 경우 2차 발효 5일 차에 거의 모든 MSG가 소진되는 것을 확인하였다(Fig. 6). 따라서 sucrose 5%를 첨가하여 2차 발효를 5일간 진행하는 것이 GABA 생산에 있어서 최적조건이라고 판단하였다. 이를 발효기간에 따른 환원당 함량변화 결과와 비교했을 때, sucrose 0% 조건에서 sucrose 5% 조건과 달리 2차 발효 초기에 거의 존재하지 않았던 환원당 함량이 MSG 소진과 GABA 생성에 영향을 끼쳤기 때문인 것으로 판단되었다. 따라서 초기 환원당의 농도는 MSG로부터 GABA를 생성할 때 매우 중요한 변수로 작용되는 것으로 판단되며, 이는 발효성 당이 부족할 경우 산 생성이 활발하지 않아 GAD효소 활성이 떨어짐으로 인해 GABA 생산에 영향을 끼쳤다는 연구보고(32)와 유사한 경향을 나타내었다.
최적조건으로 판단된 sucrose 5% 조건의 2차 발효 5일 차 sample의 glutamate와 GABA 함량을 HPLC를 이용하여 분석한 결과 75.01 mg/100 g의 glutamate가 잔존하고, 1780.77 mg/100 g의 GABA가 생성된 것을 확인하였다(Table 3).
| Content (mg/100 g) | |
|---|---|
| Glutamate | 75.01 |
| GABA | 1780.77 |
결론적으로 PFE를 두 가지 젖산균으로 혼합발효하여 고농도의 GABA를 생산할 수 있었으며, 이는 식용으로 잘 활용되지 않는 산돌배 과실을 이용할 방법이 될 수 있다고 사료된다. 또한 이 혼합발효물은 GABA, probotic 등이 함유되어 기능성 식품 소재로의 이용 가능성이 높을 것으로 기대된다.
요 약
산돌배 추출액을 이용하여 젖산균 혼합발효를 통한 고농도 GABA생산을 수행하였다. 산돌배 추출액은 수용성 고형분함량 5.25 oBrix, 다양한 무기질을 포함하여 높은 농도의 칼륨을 함유하였다. 1차 젖산균 발효는 Leuc. citreum S5를 접종한 후 25℃에서 2일 동안 정치 배양하였으며, 2차 젖산균 발효는 추가적으로 3% MSG를 첨가하여 30℃에서 5일동안 정치 배양하였다. 1차 젖산균 발효물은 pH 4.19, 1.03% 산도를 보였으며, 2차 L. plantarum 젖산균에 의한 혼합 발효물은 pH 4.50, 1.44% 산도와 9.07 logCFU/ml 생균수를 나타내었다. 최종 산돌배 혼합 발효물은 환원당과 MSG가 모두 소진되면서 1.78% GABA를 포함하였다.