Article
특이 콩 품종의 1차 대사체와 2차 대사체 조성 및 항산화 활성 비교
황정은1
,2, 김수철1, 이진환3, 이동희4, 조계만1
,5
,*

Comparison of primary and secondary metabolite compositions and antioxidant effects of specific soybean cultivars
Chung Eun Hwang1
,2, Su Cheul Kim1, Jin Hwan Lee3, Dong-Hee Lee4, Kye Man Cho1
,5
,*

1Department of Food Science, Gyeongnam National University of Science and Technology, Jinju 52725Korea
2Department of Research & Development, Jinju Bioindustry Foundation, Jinju 52839Korea
3Department of Life Resources Industry, Dong-A University, Busan 49315Korea
4Industry Academy Cooperation Foundation, Andong National University, Andong 36729Korea
5Herbal Medicine Resources Research, Korea Institute of Oriental Medicine, Naju 58245Korea
Copyright ⓒ The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Apr 26, 2019; Revised: Jul 17, 2019; Accepted: Jul 25, 2019
Abstract
The metabolite composition and antioxidant activity of the Saedanbaek, Jinyang, and Wooram soybean cultivars were evaluated. The moisture, crude ash, protein, fat, and carbohydrate contents in these soybean cultivars varied in the range 7.9-9.8 mg/g, 4.8-4.9 mg/g, 35.9-47.5 mg/g, 14.2-16.5 mg/g, and 21.4-35.0 mg/g, respectively. The crude protein content was found to be the highest 47.5 mg/g in the Saedanbaek soybean. The contents of saturated fatty acids such as palmitic acid, arachidic acid, behenic acid, and lignoceric acid were 1391.1, 490.8, 37.5, 44.9, and 16.6 mg/100 g, respectively, and were the highest in the Jinyang soybean. The unsaturated fatty acids (linoleic acid, oleic acid, and α-linolenic acid) were estimated to be 8258.0, 2896.8, and 906.5 mg/100 g, respectively, in the Saedanbaek, Jinyang, and Wooram soybeans. The highest total amino acid content (44598.54 mg/100 g) was found in the Saedanbaek soybean, and this was almost 2 and 1.6 folds higher than those in the Jinyang (21,525.93 mg/100 g) and Wooram (26,250.63 mg/100 g) soybeans. The highest glycosides, malonylglycosides, and aglycone contents (836.46 μg/g, 2,975.86 μg/g, and 231.60 μg/g, respectively) were found in the Wooram soybean.
Keywords: soybean cultivar; fatty acid, amino acid; isoflavone; antioxidant activity
서 론
두과작물인 대두는 오래전부터 동아시아에서 주요 식량자원으로 이용되어 왔고 현재에는 전 세계인의 건강기능 식품 원재료로 각광받고 있는 작물 중 하나이다(1). 한국에서는 오곡에 포함되며 쌀, 기장, 보리, 조 등과 함께 재배되고 있으며 특히 식물성 단백질 함량과 지방의 주요 공급원으로 사용되고 있다(1). 대두는 양질의 단백질과 불포화 지방산 외 oligosaccharide, phytosterol, phytic acid, dietary fiber, saponin, trypsin inhibitor, isoflavone 등의 화합물들을 함유하고 있다(2). 좀 더 상세하게는 대두 단백질과 같은 1차 대사체는 혈중 콜레스테롤 농도 감소와 심혈관계 질환인 죽상동맥경화증 예방에 효과가 탁월하며 2차 대사체인 phytochemical(saponin 및 isoflavone) 화합물들은 항산화, 항암, 항염증에 우수한 것으로 보고되어 있다(3).
대두에 천연적으로 함유되어 있는 여러 생리활성 물질 중 이소플라본은 antiestrogen 효과가 있어 식물성 estrogen으로 불리며 건강을 중요시하는 현대인들의 식생활 개선에 아주 중요한 역할을 하고 있다(4). 대두에 함유된 이소플라본 유도체들은 aglycones(daidzein, genistein, glycitein)와 같은 비배당체와 포도당 결합 형태인 glucosides(daidzin, genistin, glycitin), acetyl-glucosides(daidzin, genistin, glycitin), 및 malonyl-glucosides(daidzin, genistin, glycitin)와 같은 배당체 형태로 존재한다(5). 또한 이소플라본은 대두 품종에 따라 조금씩 차이는 있으나 보통 대두의 경우 malonyl glucosides 형태가 약 80%로 상당량을 차지하고 있으며 glucosides 형태가 25% 정도 분포되어 있고 acetyl glucosides 형태는 극미량 함유되어 있으며 aglycones 형태는 약 2% 정도 함유되어 있는 것으로 보고되었다(6). 현재 이소플라본은 콩에서 12 종류가 발견되었고 이들 유도체 모두 생리활성을 나타내지만 특히 비배당체 이소플라본이 우수한 활성을 나타내는 연구가 보고되었다(7).
한편, 대두는 콩 품종에 따라 각각 다른 종류의 식품제조에 사용되어 왔으며 대표적으로 장류(된장 및 고추장), 식용유, 두부, 유부 또는 두유 등의 가공에는 노란콩인 백태가 주로 사용되며 검정콩의 서리태 등은 조림 등에 이용되어 왔다. 또한 백태는 중립 또는 대립으로 백립중당 20-25 g 정도로 분류되며 검정콩은 28-29 g으로 극대립, 콩나물 콩은 소립(8-12 g)으로 분류되어 있다(6). 이러한 콩은 품종과 색 차이에 따라 수용성 페놀릭스, 플라보노이드 또는 이소플라본 함량과 항산화 활성의 차이가 있는 것으로 Cho 등(8)은 보고하였다. 이렇듯 콩 품종과 관련된 연구 결과로는 최근 Kim 등(9)이 발표한 품종별 발아콩의 이소플라본 함량 비교와 Lee 등(1)의 장류 및 두부용(대원, 신팔달 2호, 진품 2호, 태광), 콩나물용(소명, 푸른)과 밥밑용(검정 2호, 선흑) 콩의 일반성분과 기능성 성분분석 결과가 존재한다. 이외에도 국내에서 유통되는 노란콩과 검정콩의 지방함량(10)과 콩 종류에 따른 아미노산 함량(11) 연구 등 유사 연구는 국내에서 여럿 보고되었다.
한편, 본 연구에서 사용한 새단백 콩은 기존의 단백콩보다 단백질 함량(48% 이상)을 증대시킨 품종으로 국내 특이 품종 중 하나이다(12). 이 외 진양콩은 콩 특유의 비린내가 결여된 품종이며(13) 우람콩은 기계 수확 적응성이 우수하여 장류 또는 두부 가공 적성이 뛰어난 신품종이다(14). 현재 국산콩에 관한 연구는 많이 보고되었으나 특이 품종간의 성분 비교 분석 연구는 미흡한 것으로 조사되었다.
그러므로 본 연구에서는 각각의 특징이 있는 국내 특이 콩 품종간 1차 대사체 함량과 이들 추출물에 따른 2차 대사체 함량 및 생리활성을 비교 분석함으로써 향후 두부 또는 장류 등의 콩 가공공정에 적합한 품종을 활용하기 위한 목적으로 본 연구를 수행하였다.
재료 및 방법
실험재료 및 시약
본 연구에서 사용한 콩(Glycine max Merr) 중 새단백, 진양 및 우람 품종은 2015년도에 농촌진흥청에서 재배 및 수확된 것을 제공받아 사용하였다. 각각의 콩 품종에 함유되어 있는 이소플라본 배당체 중 glycitin, genistin, daidzin 표준품은 Indofine(Hillsborough, NJ, USA)에서 구입하였고 또 다른 배당체 형태의 malonyl glycitin, malonyl genistin, malonyl daidzin 표준품은 LC Laboratories(Woburn, MA, USA)에서 구입하였고 비배당체(daidzein, genistein, glycitein) 표준품은 Sigma-Aldrich(St, Louis, MO, USA)에서 구입하였다. 2,4,6-azino-bis(3-ethylbenzthiazoline-6-sulphnoic acid)(ABTS), 2,2-diphenyl-1-picrydrazyl(DPPH), trifluoroacetic acid(TCA), thiobarbituric acid (TBA), p-nitrophenyl-α-D-glucopyranoside(p-NPG), p-nitrophenyl-butyrate(p-NPB), α-glucosidase, 및 pancreatic lipase 역시 Sigma-Aldrich에서 구입하여 사용하였다. 각각의 콩 품종별 추출물 제조와 항산화 활성과 기기분석 등에 사용한 유기용매(methanol, acetonitrile, water 및 acetic acid 등)는 J.T.Baker(Philipsbug, NJ, USA)에서 구입하여 사용하였고 이 외 기타시약은 필요에 따라서 분석용 1급 또는 특급시약을 구입하여 사용하였다.
분석기기
지방산 분석은 gas chromatography(GC, Agilent 7890A, Boeblingen, Germany)를 사용하였고 아미노산 분석은 자동아미노산 분석기(Hitachi, L-8900, Tokyo, Japan)를 사용하여 분석하였으며 이소플라본 분석은 high performance liquid chromatography(HPLC, Agilent 1,200 system)를 사용하여 분석하였다. 이 외 라디칼 소거활성 및 소화효소 저해활성 측정은 분광광도계(UV-1800 240V, shimadzu, Kyoto, Japan)를 사용하여 측정하였다.
영양성분 분석
새단백, 진양, 및 우람콩 품종의 영양성분은 수분, 회분, 조단백, 조지방, 탄수화물로 구성하여 식품 및 식품첨가물공전(15)에 따라 분석하였다. 즉, 수분과 회분 함량은 각각 상압가열건조법과 건열회화법으로 측정하였고 조지방과 조단백 함량은 각각 Soxhelt과 Micro-Kjeldahl법을 적용하여 수행하였다. 탄수화물 함량은 상기 각 성분의 합을 100에서 뺀 값을 적용하였으며 mg/g으로 표시하여 나타내었다.
지방산 및 아미노산 분석
새단백, 진양, 및 우람콩 품종의 지방산 함량은 Lee 등(3)의 논문에 준하여 정량분석을 하였다. 각각의 원료콩 분말 1 g에 메탄올성 0.5 N 수산화나트륨 용액 3 mL를 가하여 100℃에서 10분간 가열하여 지방산과 글리세롤을 가수분해 하였다. 가수분해에 이어 삼불화붕소(BF3) 2 mL를 첨가하여 30분간 다시 가열하여 지방산 메틸에스테르화를 진행하였다. 반응 종료 후에는 이소옥탄 1 mL를 첨가하고 격렬히 흔든 후 방치시켜 이소옥탄 층에 녹아든 유지층만을 회수하여 무수아황산나트륨과 함께 탈수한 뒤 0.45 μm-membrane filter(Dismic-25CS, Toyoroshikaisha, Ltd., Tokyo, Japan)로 여과하여 분석시료를 제조하였다. GC는 질소 및 수소가스와 SP-2560 모세관 컬럼(100 m×0.25 mm, 0.25 μm) 및 형광검출기가 장착된 것을 사용하였다. 상세 분석조건으로는 oven의 초기온도는 180℃로 설정하여 분당 4℃ 조건으로 점차 승온시켜 최종 230℃로 상승시켰으며 각각의 시료량은 10 μL를 주입하여 35분간 형광검출기상에서 지방산 함량을 검출하였다.
아미노산 분석은 Hwang 등(12)의 방법을 약간 변형하여 실시하였다. 시료 100 mg을 시험관에 정확히 칭량하고 여기에 6 N HCl을 3 mL 가하여 110℃에서 24시간 동안 가수분해를 실시하였다. 가수분해 액은 glass filter로 여과하고 얻은 여액을 60℃에서 감압 농축하여 HCl과 물을 완전 건조하였다. 건조된 시료는 soduim citrate buffer(pH 2.2) 2 mL를 첨가하여 용해 후 0.45 μm membrane filter(Dismic-25CS, Toyoroshikaisha Ltd, Tokyo, Japan)로 여과한 여액을 아미노산 자동분석기(Hitachi L-8900, Tokyo, Japan)를 사용하여 분석하였으며 mg/100 g으로 나타내었다.
추출물 제조
각각의 품종별 콩 분말 10 g에 HPLC 등급의 메탄올 100 mL를 가하고 25℃ 환경에서 12-16시간 정도 교반시키고 원심분리 하여 상층만을 회수하고 이를 0.45 μm membrane filter로 여과하여 추출물을 제조하였다. 이 추출물은 이소플라본 분석과 항산화 활성 및 소화효소 저해활성 측정 시료로 사용하였다.
이소플라본 분석
이소플라본 분석은 Lee 등(16)이 최근 보고한 연구방법에 준하여 HPLC로 분석하였다. 분석에 사용된 컬럼은 Lichrophore 100 RP C18이며 이동상 용매는 0.2% 초산 함유 HPLC 등급의 water와 0.2% 초산 함유 HPLC 등급의 아세토나이트릴을 각각 A와 B 용매로 설정하여 분석하였다. 각 이동상 용매의 농도구배조건은 A 용매 기준으로 100%(0분), 90%(15분), 80%(25분), 75%(35분), 65%(45분) 및 65%(50분)로 설정하였다. 시료 주입량은 20 μL로 설정하였고 이동상 속도는 30℃에서 분당 1 mL의 유속으로 diode array detector(DAD)를 통과하여 254 nm에서 검출되도록 설정하였다.
항산화능 측정
DPPH 라디칼 소거활성은 Hwang 등(17)의 결과를 바탕으로 상기 기술된바와 같이 제조된 각각의 추출물(0.1 mg/mL) 0.2 mL를 시험관에 취하고 메탄올에 녹인 DPPH 용액(0.4 mM)을 가하여 암실에서 30분간 반응시켜 525 nm에서 흡광도를 측정하였다.
ABTS 라디칼 소거활성은 측정 전날 ABTS 용액(7.4 mM)과 2.6 mM의 potassium persulphate를 1:1로 혼합하여 암실에서 방치하여 ABTS 양이온을 형성시켰다. 양이온이 형성된 ABTS 용액과 HPLC 등급의 메탄올을 희석시켜 732 nm에서 흡광도 값이 0.7±0.1로 조제된 ABTS 용액 0.9 mL에 각각의 추출물 0.1 mL를 가하고 정확히 3분후에 732 nm에서 흡광도 값을 측정하였다(18).
Hydroxyl 라디칼 소거활성은 시험관에 FeSO4-EDTA 용액(10 mM) 0.2 mL, 2-deoxylribose(10 mM) 0.2 mL, 각각의 추출물 1.2 mL와 H2O2(10 mM) 0.4 mL를 순차적으로 첨가하고 37℃에서 4시간 반응시켰다. 반응 후 여기에 HPLC water에 용해된 TBA(1%)와 TCA(2.8%)를 1 mL씩 가한 후 100℃에서 20분간 발색시키고 냉각 후 525 nm에서 흡광도 변화를 측정하였다(19). 모든 항산화 활성은 시료 첨가구와 무첨가구 사이의 흡광도 차이를 %로 나타내었으며 아래와 같은 식에 의해 산출하였다.
효소 저해능 측정
α-Glucosidase 저해활성은 200 mM sodium phosphate buffer(pH 7.0)를 제조하고 여기에 p-NPG를 5 mM 농도로 녹인 후 각 시료 추출물과 기질용액을 1.0 mL씩 첨가하여 수욕조(37℃)에서 15분 예비반응을 시켰다. 이 반응물에 효소용액(30 U/mL)을 1.0 mL 추가하고 다시 37℃에서 15분간 본 반응을 진행하였다. 반응 후에는 Na2CO3(100 mM) 용액을 0.75 mL만큼 첨가하여 반응을 종료 시킨 것을 일정량 채취하여 420 nm에서 흡광도 값을 측정하였다(20).
Pancreatic lipase 저해활성 역시 α-glucosidase 저해활성과 유사한 방법으로 측정하였다. 각 추출물과 lipase 효소용액(30 U/mL)을 eppendorf tube에 50 uL씩 첨가하고 여기에 sodium phosphate buffer(200 mM, pH 7.0) 50 uL를 추가하여 수욕상에서 예비반응을 10분간 진행하였다. 예비반응 후 sodium phosphate buffer에 용해된 p-NPB(5 mM)를 100 uL 첨가 후 동일하게 37℃에서 10분간 본 반응시키고 반응 종료를 위해 Na2CO3(100 mM) 0.75 mL를 첨가하고 420 nm에서 흡광도를 측정하였다. 이때 모든 효소 저해활성 역시 시료 첨가구와 무첨가구 사이의 흡광도 차이를 %로 나타내었으며 아래와 같은 식에 의해 산출하였다(20).
통계처리
각 실험은 3회 반복 수행하였고 본 결과는 SPSS 12.0 package 시스템으로 분산 분석을 실시하였으며 평균±표준편차로 나타내었다. 각각의 분석 결과에 대한 유의성 검정은 분산 분석 후 p<0.05 수준에서 Duncant’s multiple range test를 실시하였다.
결과 및 고찰
특이 콩 품종별 영양성분 비교
새단백, 진양, 및 우람콩 품종의 영양성분을 분석한 결과는 Table 1과 같았다. 수분 함량은 우람콩이 12.7 g/100 g으로 가장 많았고 새단백콩은 9.8 g/100 g, 진양콩은 7.9 g/100 g을 나타내었다. 조회분은 4.8-4.9 g/100 g으로 유사하였고 조단백질 함량은 새단백콩이 47.5 g/100 g으로 가장 많았으며 진양콩(38.1 g/100 g)과 우람콩(35.9 g/100 g)의 조단백질 함량은 유사하였다. 조지방 함량은 새단백(16.5 g/100 g), 진양(14.2 g/100 g), 및 우람콩(12.0 g/100 g) 순으로 많았으며 탄수화물은 진양콩이 35.0 g/100 g으로 가장 많았고 새단백콩이 21.4 g/100 g으로 가장 낮았다.
Table 1.
Proximate analysis of variations soybean cultivars
|
Contents (g/100 g) |
Soybean cultivars |
|
Saedanbaek |
Jinyang |
Wooram |
|
Moisture |
9.8±0.49d1)
|
7.9±0.40d
|
8.7±0.44c
|
|
Crude ash |
4.9±0.25e
|
4.8±0.24e
|
4.8±0.24d
|
|
Crude protein |
47.5±2.38a
|
38.1±1.91a
|
35.9±1.80a
|
|
Crude fat |
16.5±0.83c
|
14.2±0.71c
|
16.0±0.80b
|
|
Carbohydrate |
21.4±1.07b
|
35.0±1.75b
|
34.6±1.73a
|
Download Excel Table
Kang(21)의 연구에서는 대원콩의 조단백질 함량은 39.37%로 보고하였고 이는 본 연구에서 사용한 진양콩(38.1%)과 우람콩(35.9%)의 조단백질 함량과 유사하였다. 또한 Lee 등(1)은 장류콩 중 대원콩, 신팔달 2호콩, 진품 2호콩, 태왕콩의 회분 함량은 각각 5.29, 5.41, 5.45, 및 4.89%로 보고하였고 이들 중 태왕콩의 회분 함량은 본 연구에서 사용된 3종류의 콩과 유사한 함량을 나타내었다. 그러나 조지방과 탄수화물의 함량은 본 연구와 큰 차이를 나타내었으며 이러한 결과는 품종에 따른 차이가 가장 클 것으로 판단되었다. Jung 등(22)의 중북부지역에서 재배한 콩나물 콩의 일반성분 분석 결과에서는 수분 함량은 5.45-6.49% 수준으로 본 연구에서 사용한 장류콩에 비해 수분 함량은 약간 낮은 경향을 나타내었다. 그러나 조회분과 조지방 함량은 각각 5.19-6.24% 및 15.62-19.06%로 새단백, 진양, 그리고 우람콩과 유사한 함량을 보였고 조단백질 함량 역시 33.32-40.53%로 나타나 본 연구에서 사용한 세 품종의 콩과 유사한 수치를 나타내었다. 한편 Lee 등(23)은 본 연구에서 사용된 품종과 동일한 새단백콩 품종의 영양성분 분석 결과, 수분, 조회분, 조지방, 조단백, 및 탄수화물 함량이 각각 6.93, 6.07, 14.19, 40.97, 및 31.81%로 보고하였고 조지방 및 조단백 함량은 본 연구와도 유사하였으나 수분, 조회분, 탄수화물 함량은 본 연구 결과와는 조금 차이가 있는 것으로 나타났다. 결과적으로 같은 품종일지라도 각 성분들의 함량은 차이가 있는 것으로 나타났고 이는 품종, 생산년도, 재배시기 및 환경 등에 의한 차이일 것이며 특히 Lee 등(23)의 연구에서 사용된 새단백콩 품종은 생산시기가 2017년도이고 본 연구에서 사용된 새단백콩 품종은 2015년이므로 생산과 시험포장 년도에 따른 차이가 가장 큰 요인인 것으로 생각된다.
특이 콩 품종별 지방산 비교
콩 품종에 따른 지방산을 분석한 결과는 Table 2와 같았다. 포화 지방산 중 palmitic acid는 진양콩이 1,392.1 mg/100 g으로 가장 많았으며 우람콩은 1,147.9 mg/100 g으로 두 번째로 많았으며 새단백콩은 890.9 mg/100 g으로 가장 낮은 함량을 나타내었다. Stearic acid 역시 진양콩이 490.8 mg/100 g으로 가장 많았고 포화 지방산 총 함량도 1,981.9 mg/g으로 진양콩이 가장 많이 함유하고 있었다. 한편 새단백콩은 포화지방산(arachidic acid 및 lignoceric acid)과 불포화지방산(palmitoleic acid, γ-linoleic acid, eicosenic acid, eicosadienoic acid, arachidonic acid, erucic acid 및 nervonic acid)이 진양콩과 우람콩에 비해 대부분 검출되지 않았으나 linoleic acid 함량은 8,258.0 mg/100 g으로 월등히 높은 것으로 나타났다. 진양콩의 linoleic acid 함량은 4,722.5 mg/100 g 이었고 우람콩은 6,665.5 mg/100 g을 함유하고 있었다. 새단백콩의 linoleic acid 함량은 진양콩에 비해서 1.75배나 높았고 우람콩에 비해서는 1.24배 높은 함량을 나타내었다. 지방산 총 함량은 우람콩이 11,978.0 mg/100 g으로 가장 많았고 이어서 새단백콩이 11,658.0 mg/100 g, 진양콩이 10,202.0 mg/100 g을 나타내었다.
Table 2.
Comparison of fatty acid contents in specific soybean cultivar
|
Contents (mg/100 g) |
Soybean cultivars |
|
Saedanbaek
|
Jinyang
|
Wooram |
|
Saturated fatty acids |
|
Palmitic acid (C16:0) |
890.9±44.55e1)
|
1,392.1±69.61f
|
1,147.9±57.40e
|
|
Stearic acid (C18:0) |
290.4±14.52f
|
490.8±24.54h
|
424.2±21.21f
|
|
Arachidic acid (C20:0) |
ND2)
|
37.5±1.88i
|
28.2±1.41g
|
|
Behenic aicd (C22:0) |
4.7±0.24h
|
44.9±2.25i
|
37.3±1.87g
|
|
Lignoceric acid (C24:0) |
ND |
16.6±0.83j
|
12.3±0.62h
|
|
Total |
1,186±59.30d
|
1,981.9±99.10e
|
1,649.9±82.50d
|
|
Unsaturated fatty acids |
|
Palmitoleic acid (C16:1) |
ND |
8.3±0.42k
|
6.6±0.33i
|
|
Oleic acid (C18:1n9c) |
2,175.8±108.79c
|
2,896.8±144.84d
|
2,717.0±135.85c
|
|
Linoleic acid (C18:2n6c) |
8,258.0±412.90b
|
4,722.5±236.13c
|
6,665.5±333.28b
|
|
γ-Linolenic acid (C18:3n6) |
ND |
ND |
1.8±0.09i
|
|
α-Linolenic acid (C18:3n3) |
38.3±1.92g |
537.9±26.90g
|
906.5±45.33e
|
|
Eicosenic acid (C20:1) |
ND |
16.5±0.83j
|
14.2±0.71h
|
|
Eicosadienoic acid (C20:2) |
ND |
18.8±0.94j
|
4.8±0.24i
|
|
Arachidonic acid (C20:4n6) |
ND |
5.6±0.28k
|
3.4±0.17i
|
|
Erucic acid (C22:1n9) |
ND |
9.2±0.46k
|
5.1±0.26i
|
|
Nervonic acid (C24:1) |
ND |
4.8±0.24k
|
2.7±0.14i
|
|
Total |
10,472.1±523.61a
|
8,220.4±411.02b
|
10,327.6±516.38a
|
|
Total fatty acids |
11,658.0±582.90a
|
10,202.0±510.10a
|
11,978.0±598.90a
|
Download Excel Table
콩에 함유된 지방산은 유전과 토양, 재배온도 및 환경 등에 영향을 받는 것으로 보고되었다(24). 특히 재배환경은 여러 콩 품종의 유전자 발현에 지대한 영향을 미칠 뿐만 아니라 지방 합성경로에 따라 지방산과 영양성분 조성에 큰 차이가 있는 것으로 보고되었다(24). Kim 등(10)은 117종의 황색콩과 검정콩의 지방산 함량 조사 결과 황색콩의 경우 주요 지방산은 linoleic acid(C18:2) 〉oleic acid(C18:1) 〉 palmitic acid(C16:0) 〉 linoenic acid(C18:3) 〉 stearic acid(C18:0) 순으로 보고하였고 이는 본 연구 결과와 일치하였다. 또한 Kim 등(10)은 불포화 지방산 중 linoleic acid(C18:2) 및 oleic acid(C18:1)가 각각 53.75 및 22.08%를 차지함을 보고하였고 이 역시 본 연구 결과와 정확히 일치하였다.
특이 콩 품종별 아미노산 비교
특이 콩 품종에 따른 아미노산 함량을 분석한 결과는 Table 3에 나타낸 바와 같다. 조단백질 함량이 가장 많았던 새단백콩은 아미노산 함량 역시 가장 많은 것으로 나타났다. 새단백콩의 주요 아미노산은 감칠맛의 주성분인 glutamic acid로 11,331.62 mg/100 g이 검출되었고 진양콩은 5,713.54 mg/100 g, 우람콩은 5,533.13 mg/100 g이 검출되었다. Aspartic acid 역시 비교적 많은 양이 확인되었고 각각 7,013.14 mg/100 g(새단백콩), 3,149.74 mg/100 g(진양콩), 및 3144.31 mg/100 g(우람콩)이 검출되었다. Aspartic acid 다음으로는 arginine 함량이 많았으며 새단백콩이 5492.28 mg/100 g으로 가장 많은 양을 함유하고 있었고 진양콩에서는 2,196.52 mg/100 g, 우람콩에서는 2,099.06 mg/100 g이 검출됨에 따라 단백질 함량에 비례적인 결과를 보였다. 이에 따라 비필수 아미노산 총 합은 새단백콩이 23,482.36 mg/100 g으로 가장 많았다. 필수 아미노산 중에서는 leucine이 가장 많은 양이 검출되었으며 새단백콩에서는 4,610.58 mg/100 g, 진양콩에서는 2,234.48 mg/100 g, 우람콩에서는 2,278.03 mg/100 g이 검출되었다. Leucine 다음으로는 lysine 함량이 많은 것으로 확인되었으며 세 품종간 가장 낮은 함량을 보인 아미노산은 methionine으로 확인되었다. 한편 아미노산 총 함량 역시 새단백콩이 44,598.54 mg으로 가장 많은 양이 검출되었고 우람콩은 26,250.63 mg, 진양콩은 21,525.93 mg이었다(Table 3).
Table 3.
Comparison of amino acid contents in specific soybean cultivar
|
Contents (mg/100 g) |
Soybean cultivars |
|
Saedanbaek
|
Jinyang
|
Wooram
|
|
Non-essential amino acids |
|
Aspartic acid |
7,013.14±350.66e1)
|
3,149.74±157.49d
|
3,144.31±157.22e
|
|
Serine |
2,970.50±148.53j
|
1,394.62±69.73g
|
1,406.94±70.35h
|
|
Glutamic acid |
11,331.62±566.58d
|
5,713.54±285.68c
|
5,533.13±276.66d
|
|
Glycine |
2,493.42±124.67j
|
1,202.80±60.14h
|
1,196.06±59.80j
|
|
Alanine |
2,540.08±127.00j
|
1,209.82±60.49h
|
1,219.13±60.96i
|
|
Cystine |
747.42±37.37m
|
358.34±17.92k
|
413.04±20.65i
|
|
Tyrosine |
1,850.10±92.51k
|
843.94±42.20i
|
902.68±45.13k
|
|
Arginine |
5,492.28±274.61f
|
2,196.52±109.83e
|
2,099.06±104.95f
|
|
Totals |
23,482.36±1,174.12b
|
11,275.38±563.77b
|
15,914.34±795.72b
|
|
Essential amino acids |
|
Threonine |
2,230.44±111.52j
|
1,112.31±55.62h
|
1,129.39±56.47j
|
|
Valine |
2,586.54±129.33j
|
1,260.67±63.03h
|
1,235.79±61.79i
|
|
Methionine |
550.34±27.52n
|
314.26±15.71k
|
292.26±14.61m
|
|
Isoleucine |
2,669.84±133.49j
|
1,281.89±64.09h
|
1,297.00±64.85i
|
|
Leucine |
4,610.58±230.53g
|
2,234.48±111.72e
|
2,278.03±113.90f
|
|
Phenylalanine |
3,138.04±156.90i
|
1,491.66±74.58g
|
1,492.42±74.62h
|
|
Lysine |
3,665.78±183.29h
|
1,754.27±87.71f
|
1,798.65±89.93g
|
|
Histidine |
1,664.62±83.23k
|
801.02±40.05j
|
812.75±40.64k
|
|
Total |
21,116.18±1,055.81c
|
10,250.55±512.53b
|
10,336.29±516.81c
|
|
Total amino acids |
44,598.54±2,229.93a
|
21,525.93±1,076.30a
|
26,250.63±1,312.53a
|
|
Ammonia |
930.30±46.52l |
403.71±20.19k
|
383.68±19.18l |
Download Excel Table
식품에서 사용되는 아미노산은 보통 20가지 내외이며 그 중 체내에서 합성되지 않거나 필요량을 충족시킬 수 있을 정도의 양이 합성되지 않기에 필수 아미노산은 반드시 식품을 통해 섭취해야한다고 권장되고 있다(11). Im 등(11)의 콩 종류와 조리방법에 따른 아미노산 함량 변화 연구 결과에서는 백태의 아미노산 성분으로는 isoleucine, leucine, phenylalanine과 같은 필수아미노산 9종류와 aspartic acid, cystine, tyrosin과 같은 비필수 아미노산 9종류로 보고하였고 이 결과는 본 연구 결과와도 유사한 경향을 나타내었다. Kim과 Kim(25), Kim 등(26)은 청태, 서리태, 수박태, 흑태, 서목태에 함유된 아미노산은 17종류로 보고하였고 이 결과 역시 본 연구 결과와도 유사한 경향을 나타내었다. 특히 Im 등(11)은 생콩에 함유된 아미노산 중 주요 성분은 glutamic acid(67.3-73.4 mg/g)로 보고하였고 그 다음으로 aspartic acid, arginine, leucine 순으로 높은 함량을 나타내었고 이는 본 연구 결과와 정확히 일치하였다. 이는 콩 품종에 따라 조금씩의 차이는 있을 수 있으나 일반적인 콩 단백질의 아미노산은 glutamic acid 및 aspartic acid와 같은 산성 아미노산의 함량이 가장 높으며 methionine 및 cysteine과 같은 함황 아미노산의 함량이 낮은 것이 특징이라고 보고한 Kim과 Kim(25), Kim 등(26)의 결과와 정확히 일치하였다.
특이 콩 품종별 이소플라본 유도체 비교
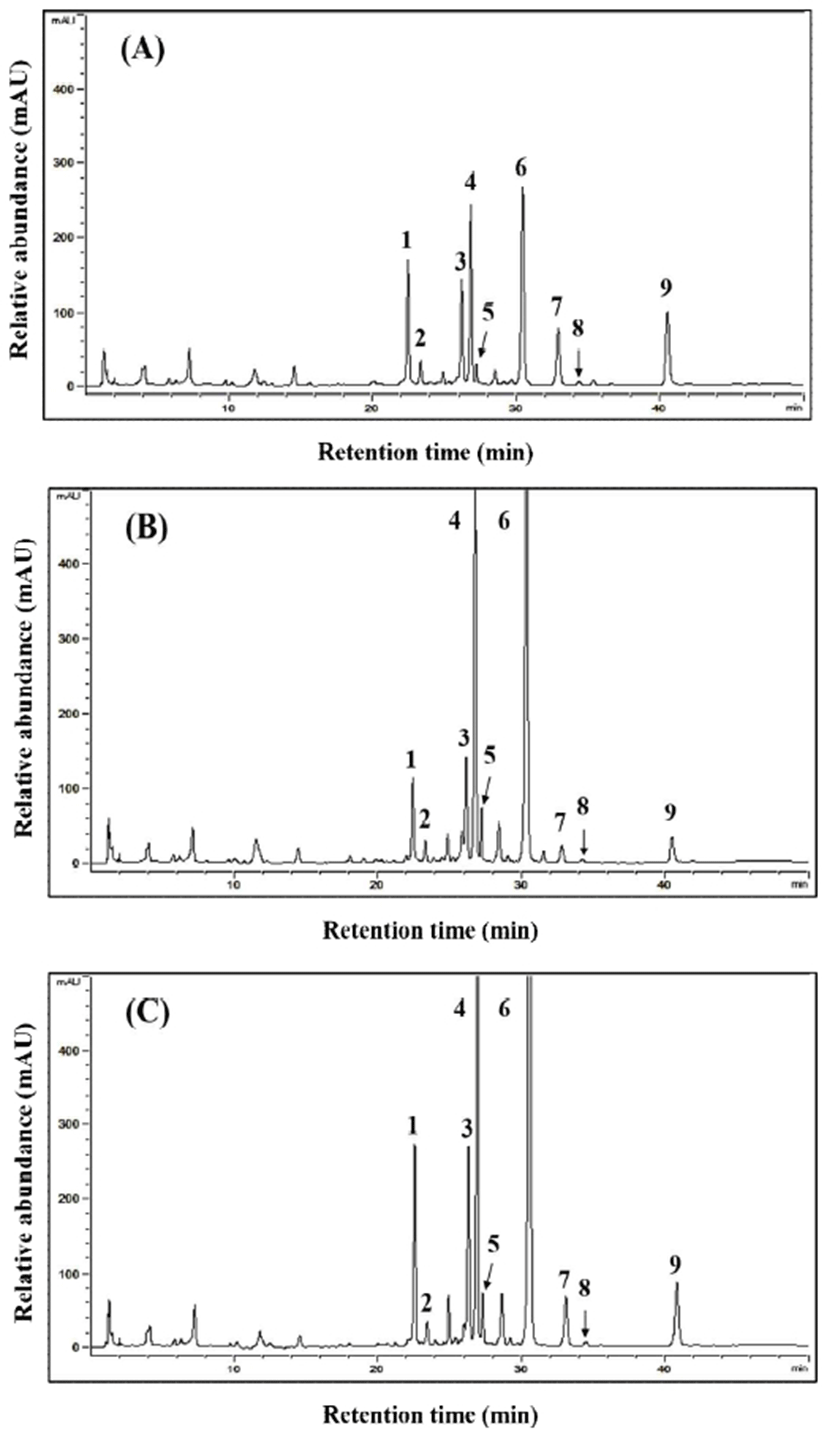
9종류의 이소플라본 유도체 함량 변화에 대한 결과는 Fig. 1과 Table 4에 나타내었다. Fig. 1에 나타낸 바와 같이 배당체(peak 1; daidzin, peak 2; glycitin, peak 3; genistin, peak 4; malonyl daidzin, peak 5; malonyl glycitin, peak 6; malonyl genistin)와 비배당체(peak 7; daidzein, peak 8; glycitein, peak 9; genistein) 유도체 9종류가 검출되었다. 새단백콩의 daidzin, glycitin, genistin 함량은 각각 248.72, 141.76, 및 163.75 μg/g이었으며 glycosides 총 함량은 554.23 μg/g이었다. 진양콩과 우람콩의 glycosides 총 함량은 각각 442.67 및 836.46 μg/g으로 우람콩에서 가장 많은 양이 검출되었다. Malonyl glycosides 총 함량 역시 새단백(874.26 μg/g) 및 진양콩(1,979.95 μg/g) 보다 우람콩(2,975.86 μg/g)에서 가장 많은 함량이 검출되었다. 비배당체 형태의 daidzein, glycitein, 및 genistein 함량은 새단백콩에서는 각각 115.60, 18.95, 및 110.59 μg/g이었고 진양콩에서는 37.78, 21.21. 및 42.48 μg/g이었고 우람콩에서는 104.69, 28.60, 및 98.31 μg/g이 검출되었다. 이에 따라 비배당체 이소플라본 총 함량은 진양콩(101.47 μg/g)이 가장 낮았고 새단백(245.14 μg/g)과 우람콩(231.60 μg/g)은 유사한 함량을 나타내었다. 한편 이소플라본 총 함량은 우람콩이 4,043.92 μg/g으로 가장 많은 것으로 나타났다(Table 4).
Fig. 1.
Comparison of HPLC chromatogram of 9 isoflavones in specific soybean cultivars.
A, Saedanbaek soybean cultivar; B, Jinyang soybean cultivar; C, Wooram soybean cultivar.
1, daidzin; 2, glycitin; 3, genistin; 4, malonyl daidzin; 5, malonyl glycitin; 6, malonyl genistin; 7, daidzein; 8, glycitein; 9, genistein.
Download Original Figure
Table 4.
Comparison of isoflavone contents in specific soybean cultivar
Contents
(μg/g) |
Soybean cultivars |
|
Saedanbaek
|
Jinyang
|
Wooram
|
|
Glycosides |
|
Daidzin |
248.72±12.44f1)
|
167.62±8.38f
|
373.58±18.68e
|
|
Glycitin |
141.76±7.09g
|
115.74±5.79f
|
154.65±7.73f
|
|
Genistin |
163.75±8.19g
|
159.30±7.97f
|
308.24±15.41e
|
|
Total |
554.23±27.71c
|
442.67±22.13e
|
836.46±41.82d
|
|
Malonyl glycosides |
|
Daidzin |
349.72±17.49f
|
752.08±37.60d
|
1,341.24±67.06c
|
|
Glycitin |
57.79±2.89h
|
119.78±5.99f
|
115.96±5.80f
|
|
Genistin |
466.76±23.34d
|
1,108.09±55.40c
|
1,518.67±75.93c
|
|
Total |
874.26±43.71b
|
1,979.95±99.00b
|
2,975.86±148.79b
|
|
Aglyones |
|
Daidzein |
115.60±5.78g
|
37.78±1.89g
|
104.69±5.23f
|
|
Glycitein |
18.95±0.95h
|
21.21±1.06g
|
28.60±1.43g
|
|
Genistein |
110.59±5.53g
|
42.48±2.12g
|
98.31±4.92g
|
|
Total |
245.14±12.26e
|
101.47±5.07f
|
231.60±11.58e
|
|
Total isoflavones |
1,673.63±83.68a
|
2,524.09±126.20a
|
4,043.92±202.20a
|
Download Excel Table
일반적으로 이소플라본 각각의 유도체 함량과 조성은 1차적으로 콩 품종에 의해 결정되고 2차적으로는 콩의 발아나 발효와 같은 가공 기술에 의해 결정된다(6). 본 연구 결과에서는 새단백콩과 우람콩의 daidzein, genistein, 및 glycitein 함량은 서로 유사하였으나 진양콩의 경우 이 두 품종과 비교하였을 시 극히 낮은 함량을 보였고 이는 같은 품종이라도 재배지역에 따라 함량 차이를 보인다는 Eldrige와 Kwolek(27)의 연구 결과와 유사한 것으로 추정된다. 또한 이소플라본 중 glycitein의 경우 배축에 많은 양이 존재하고(27) daidzein과 genistein은 자엽에 많은 양이 존재한다고 보고되었다(28). 본 연구 결과에서도 마찬가지로 세 품종간 glycitein 함량은 이 외 이소플라본 유도체에 비해 적은 양이 검출되어 Kim 등(28)의 연구 결과와 유사한 것으로 사료되며 daidzein 및 genistein 함량 역시 glycosides 및 malonyl glycosides 함량에 비해 비교적 적은 양이 검출되었으므로 Akagi 등(29)의 연구 결과와 유사한 것으로 판단된다.
특이 콩 품종별 항산화 및 효소 저해 활성 비교
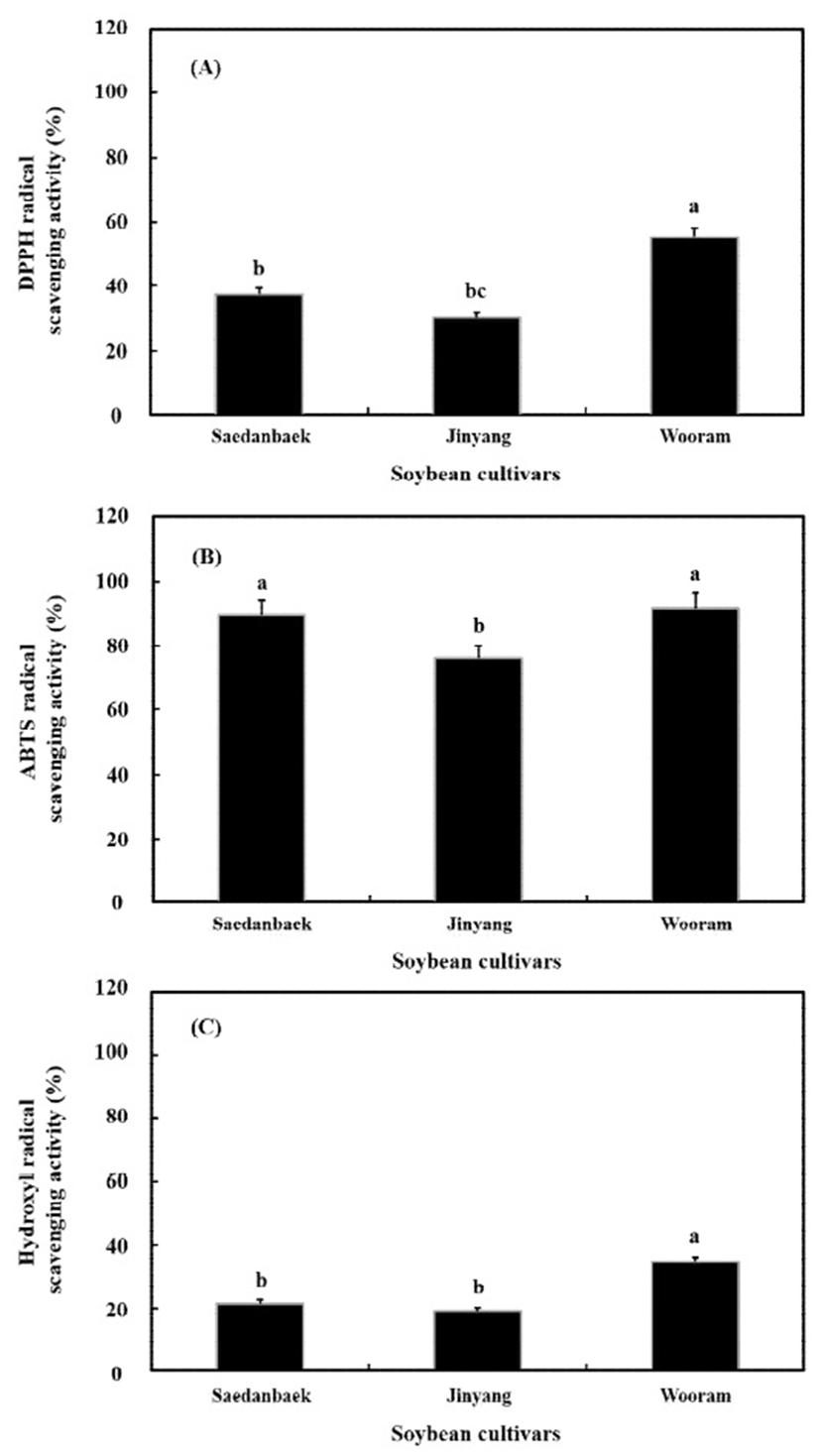
품종별 원료콩의 항산화 활성과 소화효소 저해 활성 측정 결과는 Fig. 2와 Fig. 3에 나타낸 바와 같다. DPPH는 54.99%로 우람콩이 새단백(37.30%) 및 진양콩(29.92%)보다 라디칼 소거능이 좀 더 높게 측정되었다(Fig. 2A). ABTS는 DPPH 라디칼 소거능에 비해 전체적으로 약 2배 가량 증가하는 현상을 보였다. 새단백콩의 ABTS 소거활성은 89.78%로 나타났으며 이는 DPPH와 비교하였을 시 2.4배 증가하였고 진양콩은 76.23%로 2.5배 상승한 것으로 나타났다. 우람콩은 91.84%로 이들 중 가장 높은 ABTS 라디칼 소거활성을 나타내었고 DPPH에 비해 약 1.6배 상승하였다(Fig. 2B). Hydroxyl은 새단백콩이 21.45%로 측정되어졌고 우람콩은 34.61%로 가장 우수하였고 진양콩은 19.10%로 가장 낮은 소거활성을 보였으며 DPPH에 비해 약 1.5배 가량 감소한 것으로 나타났다(Fig. 2C).
Fig. 2.
Comparison of antioxidant activity in specific soybean cultivars.
(A); DPPH, (B); ABTS, and (C); hydroxyl radical scavenging activities.
Means with different lowercase letters (a-c) indicate significant (p<0.05) differences of samples by Duncan’s multiple range test.
Download Original Figure
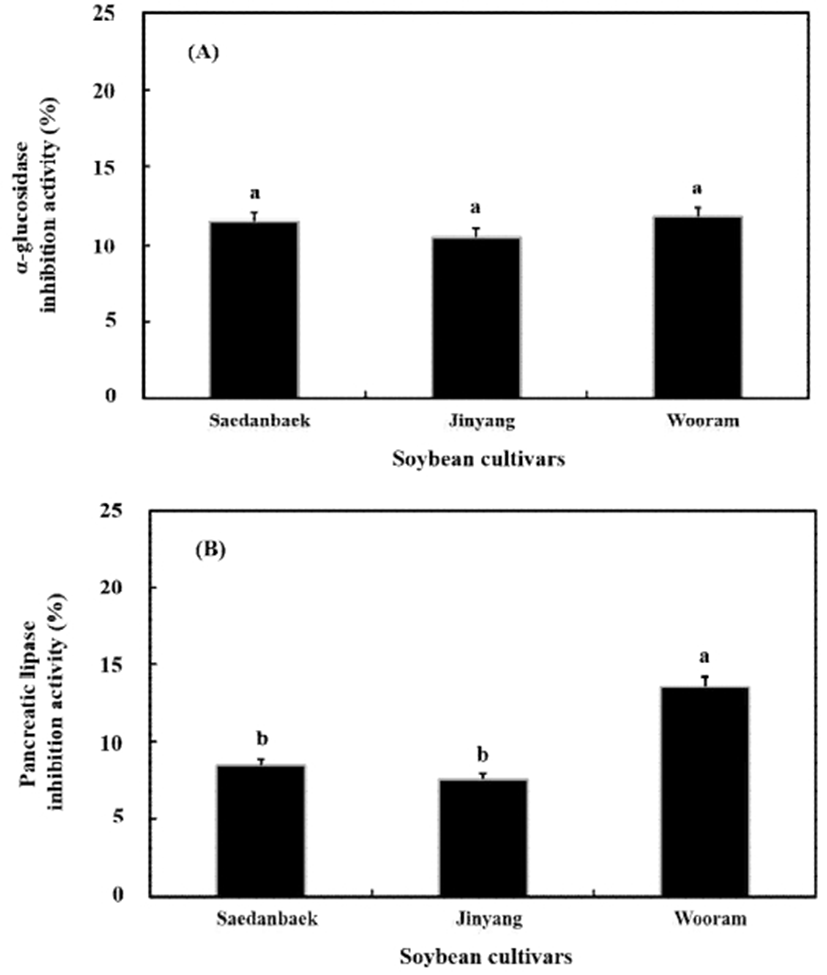
Fig. 3.
Comparison of enzyme inhibition activity in specific soybean cultivars.
(A); α-glucosidase and (B); pancreatic lipase inhibition activities.
Means with different lowercase letters (a-b) indicate significant (p<0.05) differences of samples by Duncan’s multiple range test.
Download Original Figure
한편 α-glucosidase 저해활성 결과, 새단백콩은 11.47%를 나타내었고 진양콩은 10.54%, 우람콩은 11.78%로 비교적 낮은 탄수화물 분해효소 저해를 나타내었다(Fig. 3A). Pancreatic lipase 저해활성 역시 α-glucosidase 경향과 일치하였으며 우람콩이 13.56%로 가장 높았고 새단백콩은 8.45%, 진양콩은 7.56%를 나타내었다(Fig. 3B).
ABTS 라디칼 소거능이 DPPH 및 hydroxyl보다 더 높게 측정되어지는 것은 보통 라디칼의 종류에 따른 차이가 있으나 특히 수용성과 지용성 생리활성 물질 모두 측정되는 특성에 따른 차이가 가장 큰 것으로 사료된다(30). 한편 이러한 항산화 활성은 페놀릭스와 이소플라본과 같은 플라보노이드 함량과 관계가 있다고 Kim 등(31)은 보고하여 항산화 활성은 이소플라본과 정의 상관관계가 있을 것으로 사료된다. 또한, α-glucosidase 활성을 저지할 경우 탄수화물의 분해를 지연시키거나 일부는 분해되지 않아 결과적으로 당류 흡수율이 떨어지게 되므로 식후 혈당 감소 효과가 있다(32). 이러한 저해활성 향상에 도움을 주는 물질은 플라보노이드의 하나인 quercetin 성분으로 특히 α-glucosidase를 비가역적으로 느리게 결합하여 비경쟁적 저해를 일으키므로 당뇨 치료제로 잠재적 가치가 있을 것으로 Cho 등(33)은 보고하였다. 보통 폴리페놀과 플라보노이드를 함유하고 있는 콩은 그 자체보다는 발효됨에 따라 항산화 활성과 효소 저해 활성이 우수한 것으로 보고되었다(34). 또한, 본 연구에서 측정한 pancreatic lipase는 효소의 작용이 지속적으로 작용 시 중성지방이 분해되어 흡수되므로 결과적으로는 체중 증가와 함께 만성 성인병에 노출되기가 쉽다(32). 그러므로 지방의 분해가 이루어지지 않도록 효소의 작용을 억제시켜 인체에 흡수되지 않고 배설된다면 성인병에 대한 위험도가 크게 감소될 것으로 사료된다. Lipase를 억제하는데 관여하는 것은 보통 항산화 효과를 증대시키는 물질로 보고되어 있으며 콩에 함유된 이소플라본이 가장 대표적이다(34). 특히, 이들 이소플라본들은 daidzin → daidzein, genistin → genistein, glycitin → glycitein으로 발효 시 화합물의 변화가 일어남과 동시에 효소 저해 활성이 증가하는 것으로 보고되어있다(6). 그러나 본 연구에서는 세 품종 모두 다소 낮은 활성을 보였고 이러한 결과는 콩의 발효 전(원료)과 발효 후(가공)의 차이가 가장 큰 요인일 것으로 판단된다.
따라서 지금까지의 연구결과로 볼 때 단백질, 지방산 및 아미노산 함량이 가장 많은 새단백 품종은 이미 알려진 대로 두부 가공적성에 탁월한 것으로 판단되며 진양 품종은 항산화 활성이 다소 낮게 측정되었으나 비린내가 결여된 품종이므로 콩국수 제조에 적합할 것으로 생각된다. 한편, 우람 품종은 이소플라본 함량이 가장 많고 이에 상응하여 항산화 활성이 가장 우수하므로 기능성 두유, 간장, 된장 등과 같은 콩 가공 및 발효 공정에 최적 품종이 될 것으로 기대된다.
요 약
본 연구에서는 특이 품종인 새단백, 진양, 및 우람콩으로부터 1차 대사체와 2차 대사체 조성 및 항산화 활성을 비교 분석하였다. 세 품종간 영양성분 분석 결과, 수분(7.9-9.8 mg/g), 회분(4.8-4.9 mg/g), 조지방(14.2-16.5 mg/g), 및 탄수화물(21.4-35.0 mg/g)을 함유하고 있었고 특히 새단백콩은 조단백 함량(47.5 mg/g)이 가장 많았다. 지방산 분석 결과로는 진양콩에서 포화 지방산인 palmitic acid, arachidic acid, behenic acid, lignoceric acid 함량이 각각 1,392.1, 490.8, 37.5, 44.9, 16.6 mg/100 g으로 가장 많았다. 불포화 지방산 중에서는 linoleic acid(새단백), oleic acid(진양), α-linolenic acid(우람)가 각각 8,258.0, 2,896.8, 906.5 mg/100 g으로 높게 검출되었다. 아미노산 총 함량은 새단백콩에서 44,598.54 mg/100 g으로 가장 높았으며 진양(21,525.93 mg/100 g)과 우람콩(26,250.63 mg/100 g)과 비교하였을 시 2배 또는 1.6배 높았다. 부가적으로, glycosides, malonyl glycosides, aglycones 함량은 각각 836.46, 2,975.86, 및 231.60 μg/g으로 우람콩에서 가장 많은 것으로 나타났다.
Acknowledgements
이 논문은 2018년도 경남과학기술대학교 박사 후 연수과정 지원사업의 지원을 받아 연구되었습니다.
References
LeeS, LeeYB, KimHS. 2013; Analysis of the general and functional components of various soybeans. J Korean Soc Food Nutr. 42:1255-1262


CowardL, BarnesNC, SetchellKDR, BarnessB. 1993; Genistein, daidzein, and their β-glucoside conjugates: antitumor isoflavones in soybean foods from american and asin diets. J Agric Food Chem. 41:1961-1967.

LeeJH, HwangCE, SonKS, ChoKM. 2019; Comparison of nutritional constituents in soybeans during solid state fermentation times and screening for their glucosidase enzymes and antioxidant properties. Food Chem. 272:362-371


LeeES, YiYS, YoonST, LeeHG. 2009; Variation in antioxidant components of black soybean as affected by variety and cultivation region. Korean J Crop Sci. 54:80-87.

Kudou S, Fleury Y, Welt D, Magnolato D, Uchida T, Kitamura K, Okubo K (1991) Malonyl isoflavones glycosides in soybean seeds (Glycine max Merrill). Agric Biol Chem, 55, 2227-2233
KudouS, FleuryY, WeltD, MagnolatoD, UchidaT, KitamuraK, OkuboK. 1991; Malonyl isoflavones glycosides in soybean seeds (
Glycine max Merrill). Agric Biol Chem. 55:2227-2233


HwangCE, ChoKM, KimSC, JooOS. 2018; Change in physicochemical properties, phytoestrogen content, and antioxidant activity during lactic acid fermentation of soy powder milk obtained from colored small soybean. Korean J Food Preserv. 25:696-705


Yang M, Kwak JS, Jang SR, Jia YN, Park IS (2013) Antioxidant activity of soybean yogurt added to tomato extract by Bacillus subtilis and Lactobacillus plantarum. Korean J Food Nutr, 26, 280-286
YangM, KwakJS, JangSR, JiaYN, ParkIS. 2013; Antioxidant activity of soybean yogurt added to tomato extract by
Bacillus subtilis and
Lactobacillus plantarum. Korean J Food Nutr. 26:280-286.

Cho KM, Ha TJ, Lee YB, Seo WD, Kim JY, Ryu HW, Jeong SH, Kang YM, Lee JH (2013) Soluble phenolics antioxidant properties of soybean (Glycine max L.) cultivars with varying seed coat colours. J Funct Foods, 5, 1065-1076
ChoKM, HaTJ, LeeYB, SeoWD, KimJY, RyuHW, JeongSH, KangYM, LeeJH. 2013; Soluble phenolics antioxidant properties of soybean (
Glycine max L.) cultivars with varying seed coat colours. J Funct Foods. 5:1065-1076.

Kim MY, Jang GY, Ji YM, Kim KM, Kim HS, Lee JS, Jeong HS (2016) Isoflavone composition and estrogenic activity of germinated soybeans (Glycine max) according to variety. J Korean Soc Food Sci Nutr, 45, 1430-1437
KimMY, JangGY, JiYM, KimKM, KimHS, LeeJS, JeongHS. 2016; Isoflavone composition and estrogenic activity of germinated soybeans (
Glycine max) according to variety. J Korean Soc Food Sci Nutr. 45:1430-1437


KimSL, LeeYH, ChiHY, LeeSJ, KimSJ. 2007; Diversity in lipid contents and fatty aid composition of soybean seeds cultivated in korea. Korean J Crop Sci. 52:348-357.

Im JY, Kim SC, Kim SN, Choi YM, Yang MR, Cho IH, Kim HR (2016) Protein and amino-acid contents in backtae, seoritae, huktae, and seomoktae soybean with different cooking methods. Korean J Food Cook Sci, 32, 567-574
ImJY, KimSC, KimSN, ChoiYM, YangMR, ChoIH, KimHR. 2016; Protein and amino-acid contents in
backtae, seoritae,
huktae, and
seomoktae soybean with different cooking methods. Korean J Food Cook Sci. 32:567-574


Hwang CE, Haque MA, Lee JH, Song YH, Lee HY, Kim SC, Cho KM (2018) Bioconversion of γ-aminobutyric acid and isoflavone contents during the fermentation of high-protein soy powder yogurt Lactobacillus brevis. Appl Biol Chem, 61, 409-421
HwangCE, HaqueMA, LeeJH, SongYH, LeeHY, KimSC, ChoKM. 2018; Bioconversion of γ-aminobutyric acid and isoflavone contents during the fermentation of high-protein soy powder yogurt
Lactobacillus brevis. Appl Biol Chem. 61:409-421.

KimIS, LeeSJ, LeeHJ, OhSJ, ChungJI, SungNJ. 2014; Quality characteristics and antioxidant activity of tofu made from lipoxygenase-free genotypes. Korean J Food Preserv. 21:215-223


KoJM, HanWY, KimHT, LeeYH, ChoiMS, LeeBW, ShinSU, SeoJH, OhKW, YunHT, JeonMG, ChoiKH, ShinJH, LeeEJ, YangS, OhIS. 2016; Soybean cultivar for soy-paste, ‘Uram’with mechanization harvesting, large seed, disease resistance and high yield. Korean J Breed Sci. 48:301-306


Lee JH, Hwang CE, Cho EJ, Song YH, Kim SC, Cho KM (2018) Improvement of nutritional components and in vitro antioxidative properties of soy-powder yogurts using Lactobacillus plantarum. J Food Drug Analy, 26, 1054-1065
LeeJH, HwangCE, ChoEJ, SongYH, KimSC, ChoKM. 2018; Improvement of nutritional components and in vitro antioxidative properties of soy-powder yogurts using
Lactobacillus plantarum. J Food Drug Analy. 26:1054-1065


Hwang JH, Oh YS, Lim JH, Park JE, Kim MB, Yoon HS, Lim SB (2009) Physiological properties of Jeju traditional Doenjang. J Korean Soc Food Sci Nutr, 38, 1656-1663
HwangJH, OhYS, LimJH, ParkJE, KimMB, YoonHS, LimSB. 2009; Physiological properties of Jeju traditional
Doenjang. J Korean Soc Food Sci Nutr. 38:1656-1663


Joo OS, Hwang CE, Hong SY, Sin EC, Nam SH, Cho KM (2018) Antioxidative and digestion enzyme inhibitory activity of Ganoderma lucidum depends on the extraction solvent. Korean J Food Preserv, 25, 124-135
JooOS, HwangCE, HongSY, SinEC, NamSH, ChoKM. 2018; Antioxidative and digestion enzyme inhibitory activity of
Ganoderma lucidum depends on the extraction solvent. Korean J Food Preserv. 25:124-135.

LeeJH, HwangCE, SonKS, ChoKM. 2019; Comparison of nutritional constituents in soybeans during solid state fermentation times and screening for their glucosidase enzymes and antioxidant properties. Food Chem. 272:362-371


Cho KM, Hwang CE, Joo OS (2017) Change of physicochemical properties, phytochemical contents and biological activities during the vinegar fermentation of Elaeagnus multiflora fruit. J Food Preserv, 24, 125-133
ChoKM, HwangCE, JooOS. 2017; Change of physicochemical properties, phytochemical contents and biological activities during the vinegar fermentation of
Elaeagnus multiflora fruit. J Food Preserv. 24:125-133


KangSH. 2012; Physicochemical and functional characteristics of traditional Meju and Doenjang with soybean in different seeding times. et al.Seoul National University. Seoul Korea: p. 12-371.

JungGH, KimSK, LeeJE, WooKS. 2018; Physicochemical characteristics of sorghum according to variety and seeding period. J Korean Soc Food Sci Nutr. 47:422-428


LeeJH, KimHJ, LeeBW, LeeYY, JeonYH, LeeBK, WooKS. 2018; Quality and physicochemical characteristics of soybean with variety and different seeding periods. J Korean Soc Food Sci Nutr. 47:804-812


OhtakeN, KawachiT, SatoA, OkuyamaI, FujikakeH, SueyoshK, SueyoshiT. 2001; Temporary application of nitrate to nitrogen-deficient soybean plants at the mid to late-stages of seed development increased the accumulation of the β-subunit of β-conglycinin, a major seed storage protein. Soil Sci Plant Nutr. 47:195-203


KimMJ, KimKS. 2005; Functional and chemical composition of Hwanggumkong, Yakong and Huktae. Korean J Food Cook Sci. 21:844-849.

KimKS, KimMJ, LeeKA, KwonDY. 2003; Physico-chemical properties of Korean traditional soybeans. Korean J Food Sci Technol. 35:335-341.

KimYH. 2002; Current achivement and perspective of seed quality evaluation in soybean. Korean J Crop Sci. 47:95-106.

Eldridge AC Kwolek WF 1983; Soybean isoflavone: effect of environment and variety on composition. J Agric Food Chem. 31:394-396.

KimSR, HongHD, KimSS. 1999; Some properties and contents of isoflavone in soybean and soybean foods. Korea Soybean Digest. 16:35-46.

AkagiI, NishiharaM, UedaS, YokoyhamaA, AsanoY, SaekiY. 2007; Isoflavone content of soybean cultivars for warm districts grown in Miyazaki prefecture. Jpn J Crop Sci. 76:454-458.

Choi JS, Kim HY, Seo WT, Lee JH, Cho KM (2012) Roasting enhances antioxidant effect of bitter melon (Momordica charantia L.) increasing in flavan-3-ol and phenolic acid contents. Food Sci Biotechnol, 21, 19-26
ChoiJS, KimHY, SeoWT, LeeJH, ChoKM. 2012; Roasting enhances antioxidant effect of bitter melon (
Momordica charantia L.) increasing in flavan-3-ol and phenolic acid contents. Food Sci Biotechnol. 21:19-26


Kim JH, Hwang CE, Lee CK, Lee JH, Kim GM, Jeong SH, Shin JH, Kim JS, Cho KM (2014) Characteristics and antioxidant effect of garlic in the fermentation of Cheonggukjang by Bacillus amyloliquefaciens MJ1-4. J Microbiol Biotechnol, 24, 959-968
KimJH, HwangCE, LeeCK, LeeJH, KimGM, JeongSH, ShinJH, KimJS, ChoKM. 2014; Characteristics and antioxidant effect of garlic in the fermentation of
Cheonggukjang by
Bacillus amyloliquefaciens MJ1-4. J Microbiol Biotechnol. 24:959-968


Cho KM, Hwang CE, Joo OS (2017) Change of physicochemical properties, phytochemical contents and biological activities during the vinegar fermentation of Elaeagnus multiflora fruit. Korean J Food Preserv, 24, 125-133
ChoKM, HwangCE, JooOS. 2017; Change of physicochemical properties, phytochemical contents and biological activities during the vinegar fermentation of
Elaeagnus multiflora fruit. Korean J Food Preserv. 24:125-133


LeeDS, KimJG, et al.LeeSH. 2006; Inhibition of α-glucosidase activity by quercetin. Kor J Microbiol Biotechnol. 34:368-372.

HwangCE, LeeDH, JooOS, LeeHY, KimSC, ParkKS, UmBS, ChoKM. 2017; Comparison of physiochemical property, phytochemical contents, and biological activity of soy sauce added with bitter melon powder. Korean J Food Preserv. 24:1138-1148.