Article
L-arginine과 GABA 함량 증가를 위한 황칠나무 잎의 적정 효소가수분해 조건
이기훈, 김선오*

Optimal enzymatic hydrolysis conditions for increased production of L-arginine and GABA in Dendropanax morbifera Lev. leaves
Ki Hoon Lee, Sunoh Kim*

B&Tech Co., Ltd., R&D Center, Gwangju 61239Korea
Copyright ⓒ The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Mar 26, 2019; Revised: Apr 15, 2019; Accepted: Apr 15, 2019
Abstract
Dendropanax morbifera Lev. (DP) leaves have the potential for use as a functional food ingredient. In this study, D. morbifera Lev. leaves were subjected to enzymatic hydrolysis by proteinase, peptidase, trypsin, bromelain, and papain to increase L-arginine and γ-aminobutyric acid (GABA) levels. Hydrolysis time, temperature, pH, vacuum conditions, enzyme type, enzyme concentration, and the order of enzyme administration were optimized to increase L-arginine and GABA concentrations. L-arginine and GABA recoveries were higher when enzymatic treatment was performed prior to the extraction process. No significant changes in L-arginine and GABA production were observed with changes in pH, vacuum conditions, or enzyme concentration. The optimized procedure for obtaining the highest L-arginine and GABA concentrations was to inactivate the enzymes after 8 h of hydrolysis, extract the leaves, and to perform a second hydrolysis step at 16 h with proteinase, trypsin, bromelain, and papain. By increasing L-arginine and GABA levels simultaneously, high-quality hydrolyzed D. morbifera Lev. extract (Hy-DP) was produced efficiently in large quantities at a low cost. With this enzymatic treatment and extraction process, Hy-DP has the potential for use as a functional food ingredient. Further evaluation of Hy-DP as a functional food additive may allow it to be used in foods.
Keywords: Dendropanax morbifera Lev.; L-arginine; γ-aminobutyric acid (GABA); enzymatic hydrolysis; optimization
서 론
서구형 식생활 패턴으로의 변화와 과잉 영양 섭취, 환경오염, 운동부족 등의 원인으로 현대인들의 각종 성인병 발병 증가는 심각한 사회적 문제가 되고 있다. 따라서 다양한 천연유래 식품소재가 가지고 있는 생리활성물질을 이용하여 질병을 예방할 수 있는 건강기능식품을 개발하기 위한 연구가 활발히 진행되고 있다. 특히 식물 추출물을 이용하여 제조되는 건강기능식품들은 많은 생리활성물질들을 함유하고 있어 신진대사 기능을 촉진하고 다양한 질병에 대한 예방효과가 크므로 그 수요가 급증하는 추세이며 시장규모 또한 확대되고 있는 실정이다(1).
황칠나무(Dendropanax morbifera Lev.)는 두릅나무과에 속하는 상록 활엽수로 제주도, 완도, 강진, 보길도 등 서남해안 지역 및 일부 온대지역에서 자생하는 수종이다(2). 황칠나무는 약 15 m 정도 자라고 줄기는 흑갈색을 띄며 작은 가지는 녹색을 띈다. 황칠나무의 효능으로는 항염증, 항산화, 항암, 항혈전증 등이 보고되어 있으며(3), 황칠수액의 주요 성분은 정유 성분으로서 sesquiterpene인 β-selinene, β-cubebene, β-elemene, germacrene D, γ-cadinene 등(2,4,5)과 rutin, chlorogenic acid, (+)-catechin, ferulic acid, myricetin, quercetin, resveratrol 등의 페놀성 화합물(3)이 있다. 특히 우리의 선행연구를 통해 황칠나무의 부위별, 수확시기별, 추출용매별 quercetin의 함량 차이를 비교 분석하고 표준 분석법을 확립하였다(6). 그 외 황칠나무의 성분으로서 비타민, 유리당, 지방산, 아미노산 및 무기물 등의 성분 연구들이 진행되고 있으며 특히, 황칠나무 잎에는 유리 아미노산 중 L-arginine의 함량이 다른 아미노산에 비해 매우 높은 비율로 구성되어 있다고 보고되고 있다(7). 최근 황칠나무의 효능이 널리 알려지면서 황칠나무를 활용한 가공제품이 다양하게 개발되고 있으며 건강기능식품 소재로 활용하기 위한 연구도 많이 이루어지고 있다. 황칠나무를 식품으로 가공하는 대표적인 방법은 황칠나무의 유용한 성분들을 물로 추출하여 음료나 차로 마시는 것이 대부분이다. 그러나 자연 상태의 황칠나무 잎에 다량 존재하는 L-arginine을 포함한 기능성 아미노산을 최적 조건으로 추출하는 공정에 대한 연구는 전무하며 현재는 전통적인 열수추출법에 의존하고 있는 실정이다.
아미노산은 생물을 구성하는 중요한 단백질 구성 인자이며 원활한 신진대사를 위해 절대적으로 필요한 영양소이다. 아미노산의 다양한 기능성에 대한 활발한 연구와 함께 제약 산업뿐만 아니라 식품산업 분야에서도 소비자들의 관심이 증가되고 있으며 미국, 일본 등 여러 나라에서는 이미 기능성 식품소재로서 아미노산이 크게 성장하고 있는 실정이다(8). 아미노산은 필수 아미노산과 비 필수 아미노산으로 나눌 수 있으며 필수 아미노산은 체내에서 합성되지 않지만 중요한 생리적 기능을 갖기 때문에 반드시 음식으로 공급해야만 한다. L-arginine은 조건부 필수 아미노산으로서 혈관이완 물질인 산화질소(nitric oxide) 합성의 전구물질로 작용하여 혈관이완에 도움을 주며 고혈압 등 혈관질환의 예방 및 치료를 위한 주요 기능성 물질로 널리 사용되고 있다(9). 또한 골밀도 감소지연, 성기능 개선, 체지방 감소 등 다양한 생리활성이 보고되고 있다(10-12). γ-Aminobutyric Acid(GABA)는 비단백질 아미노산의 일종으로 중추신경계에서 억제성 신경전달물질로 작용한다(13). 이러한 GABA는 뇌의 골수에 대부분 존재하며 아세틸콜린이라 불리는 신경전달 물질을 증가시켜 뇌기능을 촉진하는 주요한 물질로서, 혈압강하, 불안, 불면, 우울증, 통증 완화 등과 같은 기능성(14-16)과 지방대사 및 간 기능을 부분적으로 개선시켰다는 연구가 보고되었다(17). 즉 L-arginine과 GABA의 공통된 기능성으로 혈관 이완을 통한 혈압 강하 효과 및 혈행개선에 도움을 주는 기능을 갖고 있다.
황칠나무 잎에 함유되어 있는 유리아미노산은 15종이 보고되었고 봄철에 채취한 황칠나무 잎에서 가장 많은 유리아미노산이 함유되어 있다(7). 또한 이 연구의 보고에 따르면 aspartic acid, glutamic acid 및 L-arginine의 함량이 상대적으로 많았으며 그 중 L-arginine이 가장 높은 함량을 보였고, 봄철에 채취한 황칠나무 잎에서 그 함량이 가장 높은 것으로 보고되었다. 그러나 연구에 사용된 황칠나무 시료의 계절별 차이만 연구하였고, 이를 추출하는 조건 및 최적 추출을 위한 조건 확립에 대한 연구는 진행되지 않았다.
최근 대두, 인삼 및 천마 등의 단백질이 풍부한 식품 소재를 활용하여 이용가치와 이용도를 증대시키기 위하여 물리적, 화학적 또는 효소적 처리에 의한 단백질의 구조적 변화를 일으키는 연구와 개발이 시도되고 있다(18,19). 그러나 단백질의 가수분해 방법으로 산 알칼리를 이용한 가수분해가 주로 사용되고 있지만, 반응 생성물의 이미 이취가 발생하고 함황아미노산의 손실 및 독성 물질의 형성 등을 초래하여 단백질의 이용이 제한되고 있다(18). 그에 반해 효소적 가수분해방법은 용해도를 증가시키고 이취 성분을 유리시키는 장점이 있으며, 영양성분의 손실을 방지할 수 있어 그 자체에 안전성이 부여되기 때문에 단백질 분해효소를 이용한 방법이 최근 많이 사용되고 있다(18).
따라서 본 연구에서는 황칠나무를 이용하여 기능성 식품소재로써의 활용가능성을 확인하기 위한 연구의 일환으로 가수분해효소를 이용한 최적가수분해 공정을 개발하고 황칠나무에 다량 함유되어 있는 유리아미노산 뿐만 아니라, 황칠나무의 단백질을 가수분해하여 다양한 기능성은 갖는 L-arginine과 GABA의 최적화 추출 조건을 탐색하자 하였다. 또한 두 가지 아미노산을 한 가지 공정을 통해 동시에 처리 할 수 있는 대량 생산 공정을 개발하고자 하였다.
재료 및 방법
재 료
본 실험에서 사용한 황칠나무는 전라남도 강진군 칠량면에서 2017년에 재배된 8년생 이상의 것으로 3월-4월에 채취한 잎을 사용하였다. 채취한 황칠나무 잎을 세척 후 1.5 cm 내외로 세절하였으며, 열풍건조기(CF-21WF, Jeiotech, Daejeon, Korea)에서 건조(45℃, 24시간)한 후 밀봉하여 보관하면서 연구에 사용하였다. 황칠나무 잎을 가수분해하기 위하여 사용한 단백질가수분해효소인 Bacillus subtillis유래 protease, trypsin, trypsin/chymotrypsin mixture, pepsin, ficin, bromelain 및 papain은 지니어텍 인터내셔날(Suwon, Korea)에서 구입하여 사용하였다. 분석 및 추출조건에서 사용된 시약은 Sigma-Aldrich Co.(St. Louis, MO, USA)의 특급 시약과 HPLC 등급을 구입하여 사용하였다.
선 추출 후 가수분해 처리
건조 세절한 황칠나무 잎 1 kg에 중량 대비 1:20(w/v)의 증류수를 첨가하고 100℃에서 4시간동안 초고속 진공저온농축추출기(Cosmos660, Kyungseo machine, Incheon, Korea)를 이용하여 열수 추출을 실시하였다. 이 추출물을 30 °Brix로 농축하고 동결건조 시킨 후 분말로 제조하고 밀봉하여 냉암소에 보관하면서 모든 실험의 대조군(CTL)으로 사용하였다. 추출 후 추출물의 온도가 40℃로 되었을 때 황칠나무 잎 1 kg 중량을 기준으로 Table 1과 같은 다양한 조건의 함량으로 protease, trypsin/chymotrypsin mixture 또는 pepsin을 첨가하고 교반기를 이용하여 40℃에서 4~8시간 동안 1차 가수분해를 실시하였다. 1차 가수분해 종료 후 황칠나무 잎 1 kg 중량을 기준으로 Table 1과 같은 다양한 조건의 함량으로 bromelain과 papain 또는 ficin을 첨가하고 50℃에서 12~16시간 2차 가수분해를 실시하였다. 총 6가지의 다른 조건으로 2차 가수분해 종료 후 100℃에서 30분간 효소 불활성화 과정을 거친 후 30 oBrix로 농축하고 동결건조 하여 분말화 하였다. 제조된 분말을 밀봉하여 냉암소에 보관하면서 실험에 사용하였다. 총 6가지 각 조건별(A-F) 효소 함량 및 가수분해 시간은 Table 1과 같다.
Table 1.
Pre-extraction and post-hydrolysis of Dendropanax morbifera Lev. leaf with different reaction time and enzyme contents
|
Condition |
1st. hydrolysis |
|
2nd. hydrolysis |
|
protease (g) |
mixture1) (g) |
pepsin (g) |
time (h) |
bromelain (g) |
papain (g) |
ficin (g) |
time (h) |
|
A |
1 |
1 |
- |
4 |
|
1 |
1 |
- |
16 |
|
B |
1 |
1 |
1 |
4 |
|
1 |
1 |
1 |
16 |
|
C |
1 |
1 |
1 |
6 |
|
1 |
1 |
1 |
14 |
|
D |
1 |
1 |
1 |
8 |
|
1 |
1 |
1 |
12 |
|
E |
2 |
1 |
1 |
4 |
|
1 |
1 |
1 |
16 |
|
F |
4 |
1 |
1 |
4 |
|
1 |
1 |
1 |
16 |
Download Excel Table
선 가수분해 처리 후 추출
건조 세절한 황칠나무 잎 1 kg에 중량 대비 1:8(w/v)의 증류수를 첨가하고 45℃에서 4시간 동안 초고속 진공저온농축추출기(Cosmos660, Kyungseo machine)를 이용하여 침지를 실시하였다. 침지 후 황칠나무 잎 1 kg에 중량 대비 1:1(w/v)의 증류수에 황칠나무 잎 1 kg 중량을 기준으로 protease 1 g, trypsin 1 g을 녹여 효소액을 제조하여 침지액에 첨가하고 45℃에서 4시간동안 1차 가수분해를 실시하였다. 1차 가수분해 종료 후 황칠나무 잎 1 kg에 중량 대비1:1(w/v)의 증류수에 황칠나무 잎 1 kg 중량을 기준으로 bromelain 1 g, papain 1g을 녹여 효소액을 제조하여 첨가하고 55℃에서 16시간동안 2차 가수분해를 실시하였다. 2차 가수분해물을 30 °Brix로 농축하고 동결건조 시킨 후 분말로 제조한 시표를 조건 G로 하였다. 2차 가수분해 종료 후 최종적으로 황칠나무 잎 1 kg에 중량 대비 1:10(w/v)의 증류수를 추가하여 100℃에서 4시간동안 추출하는 동시에 효소불활성화를 수행 후 30 °Brix로 농축하고 동결건조 시킨 후 분말로 제조한 시표를 조건 H로 하였다. 1차 가수분해 시 5 N NaOH 용액을 이용하여 pH 7.5로 조절하여 가수분해를 실시하고, 2차 가수분해 시 10%(w/v) citric acid 용액을 이용해 pH 5.5로 조절하여 가수분해를 실시하였다. 이러한 조건의 2차 가수분해물을 30 °Brix로 농축하고 동결건조 시킨 후 분말로 제조한 시표를 조건 I로하고, 조건 I의 2차 가수분해물을 조건 H와 동일한 방법으로 추출한 후 농축 및 동결건조를 수행한 시료를 조건 J로 하였다. 최적 조건 K의 제조는 Fig. 1과 같이 건조 세절한 황칠나무 잎 1 kg에 중량 대비 1:9(w/v)의 증류수에 황칠나무 잎 1 kg 중량 대비 1:0.002(w/w)의 효소 혼합물(protease 1 g, trypsin 1 g)을 첨가하고 45℃에서 8시간동안 침지 및 1차 가수분해를 동시에 실시하였다. 1차 가수분해 종료 후 2차 가수분해 및 추출과정은 조건 H와 동일하게 진행하였다. 조건 L의 제조는 조건 K와 동일하게 1차 및 2차 가수분해를 실시하였고, 2차 가수분해 시 혐기성 조건을 조성하기 위해 진공을 300 torr 조건으로 설정하여 2차 가수분해를 실시하였다. 2차 가수분해 종료 후 추출 및 농축단계는 조건 H와 동일하게 진행하였다. 총 6가지 각 조건별(G-L) 효소 함량 및 가수분해 시간은 Table 2와 같다.
Table 2.
Pre-hydrolysis and post-extraction of Dendropanax morbifera Lev. leaf with different reaction time and enzyme contents
|
Condition |
1st. hydrolysis |
|
2nd. hydrolysis |
|
extraction |
|
protease (g) |
trypsin (g) |
time (h) |
pH |
bromelain (g) |
papain (g) |
time (h) |
pH |
vacuum (torr) |
time (h) |
|
G |
1 |
1 |
4 |
- |
|
1 |
1 |
16 |
- |
- |
|
0 |
|
H |
1 |
1 |
4 |
- |
|
1 |
1 |
16 |
- |
- |
|
4 |
|
I |
1 |
1 |
4 |
7.5 |
|
1 |
1 |
16 |
5.5 |
- |
|
0 |
|
J |
1 |
1 |
4 |
7.5 |
|
1 |
1 |
16 |
5.5 |
- |
|
4 |
|
K |
1 |
1 |
8 |
- |
|
1 |
1 |
16 |
- |
- |
|
4 |
|
L |
1 |
1 |
8 |
- |
|
1 |
1 |
16 |
- |
300 |
|
4 |
Download Excel Table
최적조건을 이용한 Pilot 규모 추출
조건 K의 가수분해 및 추출조건을 2톤 규모의 추출기를 이용하여 pilot 규모에서의 시험생산을 다음과 같이 실시하였다. 건조 세절한 황칠나무 잎 80 kg에 중량 대비 1:9(w/v)의 증류수(720 L)에 황칠나무 잎 80 kg 중량 대비 1:0.002(w/w)의 효소 혼합물(protease 80 g, trypsin 80 g)을 투입하여 효소액을 만들었다. 효소액 투입 후 45℃에서 8시간동안 처리하여 침지 및 1차 가수분해를 동시에 실시하였다. 1차 가수분해 종료 후 황칠나무 잎 80 kg 중량 대비 1:0.002(w/w)의 효소 혼합물(bromelain 80 g, papain 80 g)을 별도의 증류수 100 L에 투입하여 효소액을 만들어 1차 가수분해물에 첨가하고 55℃에서 16시간동안 2차 가수분해를 실시하였다. 2차 가수분해 종료 후 최종적으로 증류수 800 L를 첨가하고 100℃에서 4시간 동안 추출 및 효소불활성화를 실시하였으며, 30 oBrix로 농축하고 동결건조 분말로 최종 시료화 하였다.
가수분해 추출물의 가용성 고형분 함량 측정
각 조건별 가수분해 추출물의 가용성 고형분 함량은 식품공전(20)에 준하여 실시하였다. 각 가수분해물을 동결건조한 후 중량법에 따라 그 무게를 3회 반복 측정하였으며, 가수분해 추출물의 조제에 사용된 황칠나무 건물 시료량에 대한 백분율로써 가용성 고형분 함량을 표시하였다.
단백질 함량 및 가수분해도 측정
선정된 최적조건 (조건 K)을 대상으로 효소가수분해 전과 효소가수분해 후의 가용성 단백질의 함량은 BSA(bovine serum albumin)를 표준물질로 하여 Bradford 방법으로 작성한 표준곡선에 따라 단백질 정량하였다. 가수분해도(degree of hydrolysis)는 Park과 Yoon(21)의 방법에 따라 제조한 가수분해물에 동량의 20% TCA (trichloroacetic acid) 용액을 넣어 10% TCA 가용성 단백질을 얻은 후 이를 1,600×g로 30분간 원심분리하고 상층액의 단백질 함량을 측정하여 다음과 같은 식에 의해 산출하였고, 황칠나무 잎을 첨가하지 않고 동일 조건으로 효소만 처리하여 제조한 효소가수분해물의 측정값을 기저치로 하여 기저치를 차감한 값을 사용하였다.
아미노산 함량 분석
L-Arginine과 GABA를 포함하여 유리 아미노산의 분석은 최종 동결건조한 분말을 이용하여 Kim과 Chung(7)의 방법을 활용하여 측정하였으며 분석조건은 Table 3과 같다. HPLC는 Waters 510 pump, Waters Gradient Controller, Waters 717 Automatic sampler 및 Waters 2487 UV detector(Waters HPLC system, Millford, MA, USA)를 사용하였고, 데이터 수집 및 처리를 위해 Empower2 software program(Waters Corporation, Milford, MA, USA)을 사용하였다. 분석용 컬럼은 Waters Pico-tag column(3.9 × 300 mm, 4 μm, Waters, Milford, MA, USA)을 사용하였으며, 이동상 용매 A는 6% acetonitrile이 함유된 140 mM sodium acetate를, 용매 B는 60% acetonitrile를 사용하여 1.0 mL/min의 유속으로 각각 분석하였다. UV는 254 nm 파장에서 측정하였고, 시료 주입량은 10 μL로 하였다.
Table 3.
Analytical condition of HPLC for analysis of L-arginine and GABA.
|
Parameters |
Condition |
|
Column |
Waters Pico-tag column (3.9 × 300 mm, 4 μm) |
|
Detector |
UV 254 nm |
|
Flow rate |
1.0 mL/min |
|
Column temperature |
40℃ |
|
Injection volume |
10 μL |
|
Mobile phase |
A: 140 mM sodium acetate in 6% acetonitrile
B: 60% acetonitrile |
|
Gradient |
Time (min) |
A (%) |
B (%) |
|
0 |
100 |
0 |
|
9.0 |
86 |
14 |
|
9.2 |
80 |
20 |
|
17.5 |
54 |
46 |
|
17.7 |
0 |
100 |
|
21.0 |
100 |
0 |
|
24.0 |
100 |
0 |
|
25.0 |
100 |
0 |
Download Excel Table
통계 분석
본 실험은 독립적으로 3회 이상 반복 실시하여 실험결과를 평균과 표준편차(mean±SD)로 나타내었고, 통계분석은 Statistical Analysis System (SAS) 통계 프로그램을 이용하여 각각 일원배치분산분석(One-way ANOVA Test)을 하고 Duncan’s multiple range test와 t-test로 유의성 검정을 실시하였다.
결과 및 고찰
황칠나무 잎 추출물의 유리아미노산 조성
황칠나무 잎으로부터 기능성 아미노산이 가장 많이 생성되는 가수분해물을 생산하기 위한 단백질 분해 효소와 처리조건을 확립하기 위해 먼저 일반적인 방법으로 추출한 황칠나무 잎 열수추출물의 유리아미노산 분포와 함량을 측정해 보았다(Table 4). 20종의 아미노산이 검출되었는데 그 중에서 alanine (33.680 mg/g), valine (17.229 mg/g), glutamic acid (15.655 mg/g), aspartic aicd (15.146 mg/g), GABA (13.340 mg/g), proline (8.925 mg/g) 및 asparagine (8.682 mg/g)순으로 함량이 검출되었다. Kim과 Chung(7)이 보고한 황칠나무 잎에 분포한 유리아미노산 분포량 보고와 비교하였을 때 aspartic aicd (17.2 mg%)와 glutamic acid (12.3 mg%)가 많이 검출된 부분에서는 유사하였으나 본 연구에서는 L-arginine의 함량이 2.903 mg/g이 검출되어 다른 아미노산에 비해 그 분포량이 높지 않았다. 그러나 함유량을 비교하였을 때에는 Kim과 Chung(7)이 보고한 L-arginine의 함량(37.2 mg%)에 비해 본 실험에서는 약 7배가 높게 L-arginine이 함유되었음을 알 수 있었다. 이는 기존의 연구에서 사용한 황칠나무의 수령이 명확하게 제시되어 있지 않았고, 채취한 지역이 상이하였으며 추출 및 농축 방법의 차이 등의 요인에 의한 차이로 사료된다. 또한 GABA는 본 연구에서 최초로 황칠나무 잎에서 검출되어 황칠나무 잎에 GABA가 상당히 높은 수준으로 함유되어 있음을 알 수 있었다. Jeoung 등(22)이 보고한 연구에 따르면 GABA함량이 높다고 알려진 녹차잎(738.9 mg%), 미강(252.6 mg%), 및 거대미강(809.2 mg%)과 비교하였을 때 본 연구에서 황칠나무 잎에 함유된 GABA는 최소 1.5배에서 최대 5.3배 이상 높게 함유되어 있음을 알 수 있었다. 이는 황칠나무 잎에 함유된 L-arginine과 GABA는 섭취 시 생리활성 효과를 나타낼 수 있는 충분한 양으로 사료되며 이러한 생리활성 기능을 확대시키기 위해 그 함량을 증가시키는 공정 개발은 황칠나무 잎을 이용한 건강기능식품 소재로 개발하는데 충분한 가치가 있을 것으로 사료된다.
Table 4.
The free amino acid contents of Dendropanax morbifera Lev. leaf extracts
|
Amino acid (mg/g) |
|
1 |
Alanine |
33.680 |
|
2 |
Arginine |
2.903 |
|
3 |
Aspartic acid |
15.146 |
|
4 |
GABA |
13.340 |
|
5 |
Glutamic acid |
15.655 |
|
6 |
Glycine |
1.223 |
|
7 |
Histidine |
1.940 |
|
8 |
Leucine |
5.159 |
|
9 |
Isoleucine |
6.558 |
|
10 |
Lysine |
2.258 |
|
11 |
Methionine |
2.820 |
|
12 |
Phenylalanine |
1.439 |
|
13 |
Proline |
8.925 |
|
14 |
Serine |
6.025 |
|
15 |
Threonine |
2.853 |
|
16 |
Tryptophan |
0.444 |
|
17 |
Tyrosine |
7.501 |
|
18 |
Valine |
17.229 |
|
19 |
Asparagine |
8.682 |
|
20 |
Cystein |
2.537 |
|
21 |
Glutamine |
N.D. |
|
|
Total |
156.317 |
Download Excel Table
황칠나무 잎 가수분해처리를 통한 추출수율
황칠나무 잎으로부터 최적 가수분해물을 생산하기 위한 단백질 분해 효소 종류와 효소처리조건을 확립하기 위해 총 12가지 조건을 이용하여 효소 반응과 추출을 진행 후 이들의 가용성 고형분 함량 측정을 통해 추출수율을 측정(Table 5)하였다. 단백질 분해 효소를 처리하지 않은 황칠나무 잎의 열수 추출물을 기준으로 효소 종류, 가수분해 시간, 효소 농도 및 효소처리방법 등의 조건을 Table 1과 Table 2에 나타내었다. 단백질 분해 효소 처리조건별 및 추출조건별 가용성 고형분 함량 변화는 일반 열수추출물과 비교하였을 때 특별히 증가되거나 감소되는 경향은 보이지 않았다. 또한 단백질 분해 효소를 전처리 조건과 후처리 조건과 비교하였을 때에도 특별히 추출효율이 증가되는 경향은 보이지 않았다. 반면 조건 G와 조건 I의 경우 단백질 분해 효소 처리 후 추출공정을 진행하지 않는 조건의 경우에만 추출 수율이 다소 낮아지는 것을 알 수 있었다. 이러한 결과로 본 연구에서 설정한 단백질 분해 효소 처리 및 추출공정에 포함된 20배수의 증류수로 100℃에서 4시간동안 추출하는 공정은 황칠나무에 존재하는 가용성 고형분 성분을 최대한 추출할 수 있는 추출공정임을 알 수 있으며, 가용성 고형분 추출수율의 효율증가 효과 보다는 단백질 분해 효소에 의한 기능성 성분의 전환에 따른 성분 함량 변화를 예측할 수 있을 것으로 사료된다.
Table 5.
Yield of extracts obtained by hydrolysis and extraction of Dendropanax morbifera Lev. with different reaction time and enzyme contents
|
Condition |
Soluble solids
Yield (%) |
|
CTL |
26.54 |
|
A |
30.73 |
|
B |
28.77 |
|
C |
24.50 |
|
D |
24.86 |
|
E |
24.38 |
|
F |
23.86 |
|
G |
19.35 |
|
H |
29.62 |
|
I |
20.04 |
|
J |
27.50 |
|
K |
28.75 |
|
L |
30.05 |
|
Pilot scale |
27.68 |
Download Excel Table
황칠나무 잎 최적 가수분해처리 방법
각 12가지 조건별 L-arginine과 GABA의 함량 변화율을 비교해본 결과는 Table 6에 나타내었다. 열수추출을 진행한 후 단백질 분해 효소를 처리한 공정들(조건 A-F)에서는 L-arginine의 함량이 모든 공정에서 다소 감소하는 결과를 보였다. 그러나 GABA의 경우는 모든 조건에서 함량이 증가되는 것을 확인할 수 있었으며 조건 F의 경우 최대 149.74%까지 GABA 함량이 증가되는 것을 확인 할 수 있었다. 그러나 단백질 분해 효소처리의 농도, 시간 및 종류에 비례하여 특별한 경향을 보이며 함량이 증가되는 현상은 관찰 할 수 없었다.
Table 6.
L-arginine and GABA contents in Dendropanax morbifera Lev. leaf extracts at different conditions of hydrolysis
|
Condition |
L-Arginine (mg/g) |
fold changes
from CTL1)
|
GABA
(mg/g) |
fold changes
from CTL1)
|
|
CTL |
2.903 |
0 |
13.340 |
0 |
|
A |
2.766 |
0.95 |
18.338 |
1.37 |
|
B |
2.544 |
0.88 |
18.310 |
1.37 |
|
C |
2.335 |
0.80 |
19.095 |
1.43 |
|
D |
2.361 |
0.81 |
19.401 |
1.45 |
|
E |
2.383 |
0.82 |
17.009 |
1.28 |
|
F |
2.321 |
0.80 |
19.975 |
1.50 |
|
G |
6.653 |
2.29 |
18.411 |
1.38 |
|
H |
7.685 |
2.65 |
18.017 |
1.35 |
|
I |
6.513 |
2.24 |
20.580 |
1.54 |
|
J |
7.507 |
2.59 |
25.176 |
1.89 |
|
K |
18.730 |
6.45 |
30.450 |
2.28 |
|
L |
15.097 |
5.20 |
17.717 |
1.33 |
|
Pilot scale |
9.434 |
3.25 |
20.056 |
1.50 |
Download Excel Table
다른 방법으로 1차 단백질 분해 효소를 처리 시 건조된 황칠나무 잎을 4시간 충분히 침지시킨 후 단백질 분해 효소를 처리하고 열수추출과정을 진행한 공정들(조건 G-J)에서는 L-arginine과 GABA의 함량 모두가 크게 증가되는 결과를 보였다. 따라서 L-arginine과 GABA의 함량을 증가시키는 가장 중요한 공정은 단백질 분해 효소를 먼저 처리 한 후 추출과 효소불활성화 공정을 진행하는 것이 가장 효율적인 공정임을 알 수 있었다. 이는 먼저 열수추출을 진행하였을 경우 고압과 고열에 의해 황칠나무 잎 단백질이 열변성에 의해 단백질 분해 효소의 기질로서 적절하게 작용하지 못한 것으로 사료된다. 세부적인 여러 처리 조건들을 달리하여 처리한 결과 단백질 분해 효소의 활성에 가장 적절하다고 알려진 pH조건을 조절한 공정에서도 L-arginine과 GABA의 함량이 큰 폭으로 증가되었으나, pH를 조절하지 않은 조건과 비교하였을 경우 큰 차이가 없음을 알 수 있었다. 1차 단백질 분해 효소를 처리 전 4시간동안 건조된 황칠나무 잎을 침지시킨 공정을 1차 단백질 분해 효소를 포함하여 8시간동안 침지 및 효소처리를 동시에 처리한 조건 K에서 L-arginine 함량 18.730 mg/g으로 645.19%로 가장 높게 증가되었으며, GABA의 경우에도 30.450 mg/g으로 228.26% 증가되었음을 알 수 있었다. 즉, 단백질 분해 효소 처리 과정을 거치지 않은 황칠나무 열수추출물이 조건 K의 단백질 분해 효소 처리과정을 통해 L-arginine의 함량이 약 6.5배 이상 증가하였고, GABA의 함량이 약 2.3배 이상 증가함을 확인 할 수 있었다. Sawai 등(23)은 차나무 줄기와 잎을 혐기처리한 후 아미노산의 함량 변화 결과 혐기처리에 의해 GABA의 함량이 증진되었다고 보고하였고, Pyo (24)는 홍국균을 이용한 콩의 발효가 GABA와 유리아미노산 함량을 각각 최대 2.5배와 5.6배 증가시킨다고 보고하였다. 또한 Jeon 등(25)의 연구에서 한약재 추출물을 발아수로 이용하고 열처리를 줌으로써 현미 발아 후 GABA 함량을 약 2.5배 증가시킨다고 보고하였다. 따라서 가장 L-arginine과 GABA의 함량이 증가된 조건과 동일한 조건에서 혐기성 환경에 의한 GABA의 함량의 영향을 알아보기 위해 진공처리 공정(조건 L)을 추가하였을 경우에는 GABA의 함량 변화는 크게 관찰되지 않았다. 결론적으로 L-arginine과 GABA를 동시에 증가 시킬 수 있는 조건으로는 pH, 혐기성 환경, 효소 첨가량, 종류 등에 대한 조건을 모두 단순화시키며 침지와 1차 단백질 분해 효소반응을 동시 진행 시킨 후 2차 단백질 분해 효소반응을 실시한 조건 K를 최적 추출 조건으로 확립하였으며, 최적 공정 flow chart를 Fig. 1에 나타내었다. 이렇게 확립된 조건 K의 방법으로 pilot 규모의 대형 추출기를 이용하여 단백질 분해 효소처리와 추출을 진행한 결과 L-arginine 함량은 9.434 mg/g으로 324.97%로 높게 증가되었으며, GABA의 경우에도 20.056 mg/g으로 150.34% 증가되었음을 알 수 있었다. 비록 소량 반응을 진행하였던 조건 K보다는 낮은 증가 효율을 보였지만 lab scale의 다른 조건들의 결과보다는 높은 수준의 증가 효율을 보였다. 이는 가온과 감온에 소요되는 기계적 특징 차이에 따른 시간 차이와 같은 다양한 변수가 작용한 것이라고 판단된다. 따라서 향후 반복적이며 다양한 시설에서의 pilot 규모 시험에 대한 연구를 통해 scale up 공정을 확립할 필요가 있을 것으로 사료된다.
가수분해율 측정
선정된 최적 가부분해 및 추출 조건을 이용하여 단백질 분해 효소 처리 전과 후의 단백질량과 가수분해율을 Table 7에 나타내었다. 가수분해 전의 단백질량은 평균 12.62±0.21 mg/g이었으며, 단백질 분해 효소 처리 후의 단백질량은 평균 2.04±0.25 mg/으로 약 83.87±2.15%의 단백질이 가수분해 되었음을 알 수 있었다. Park과 Yoon(21)의 연구에서는 들깨에서 단백질 가수분해물을 얻기 위해 flavourzyme을 이용하여 가수분해한 결과 가수분해율이 70.50%로 가장 높았으며 본 연구결과와 비슷한 경향을 보였다.
Table 7.
Degree of enzymatic hydrolysis of Dendropanax morbifera Lev. leaf extracts
|
Name of the extract |
Protein (mg/g) |
Degree of hydrolysis (%) |
|
Before enzyme hydrolysis |
After enzyme hydrolysis |
|
Condition K |
Sample 1 |
12.567 |
2.313 |
81.594 |
|
Sample 2 |
12.400 |
2.091 |
83.134 |
|
Sample 3 |
12.900 |
1.703 |
86.801 |
|
mean±SD |
12.622±0.208 |
2.036±0.252***
|
83.872±2.184 |
Download Excel Table
최적 가수분해물의 유리 아미노산 함량
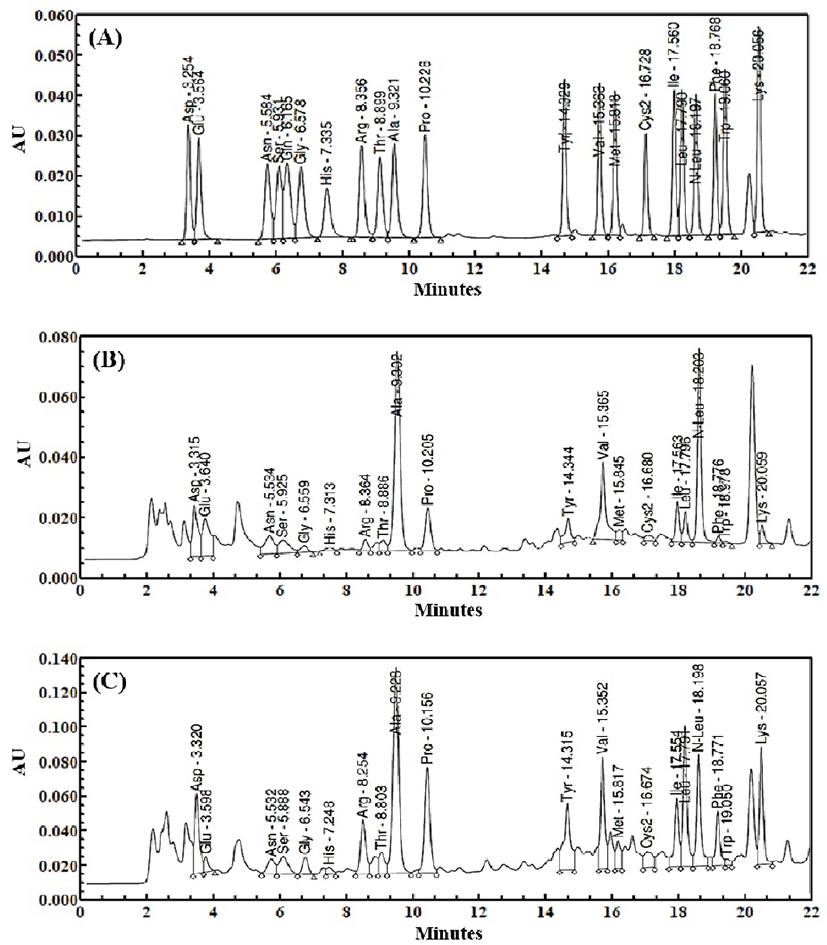
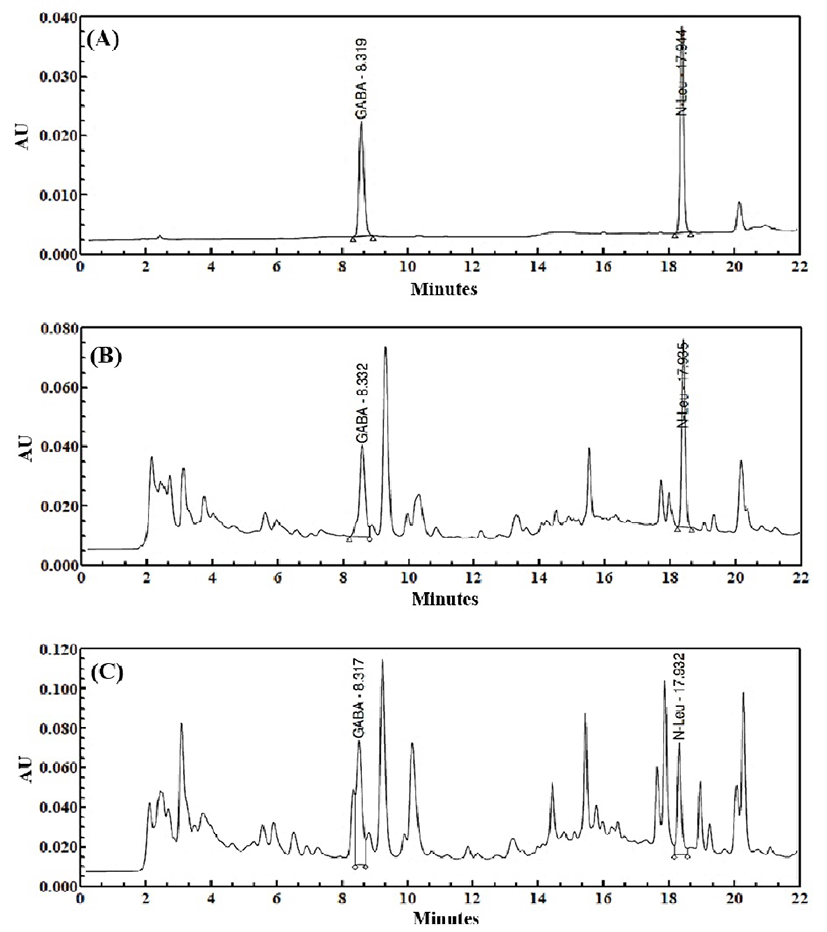
황칠나무 잎 추출물, 조건 K의 가수분해물 및 pilot 가수분해물의 유리아미노산과 GABA의 HPLC chromatogram은 Fig. 2와 3에 나타내었고 그 함량과 분포를 Table 8에 나타내었다. L-arginine은 일반 열수추출물(2.61±1.02 mg/g)에 비해 조건 K에서 유의적으로 증가(17.77±1.36 mg/g)되었으며 pilot 규모에서도 유의적으로 증가(8.74±0.96 mg/g)되었다. GABA또한 일반 열수추출물(15.53±3.10 mg/g)에 비해 조건 K에서 유의적으로 증가(27.81±3.73 mg/g)되었으며 pilot 규모에서도 유의적으로 증가(20.28±0.43 mg/g)되었다. GABA는 glutamic acid의 탈탄산화에 의해 생성되는 중요한 억제성 신경전달물질로서 흥분억제효과, 항경련작용, 정신집중력과 기억력 강화, 혈압강하 등의 체내 기능을 갖는다(25). 본 실험결과에 따르면 GABA의 함량이 증가될수록 glutamic acid의 함량이 감소된 것으로 보아 단백질 분해 효소에 의해 증가된 GABA는 황칠나무에 존재하는 glutamic acid의 탈탄산화 작용으로 증가된 것임을 알 수 있다. L-arginine과 GABA 이외에도 leucine, lysine 및 phenylalanine이 조건 K와 pilot 조건 모두에서 상대적으로 함량이 증가되었음을 알 수 있었으며, aspartic acid, isoleucine, methionine, proline 및 tyrosine도 조건 K에서 다소 함량이 증가되었음을 알 수 있어 전체적으로 유리아미노산의 함량이 증가되었음을 알 수 있었다.
Fig. 2.
Amino acids chromatogram profiles of (A) standards of amino acid, (B) water extract of Dendropanax morbifera Lev. leaf, and (C) condition K extract of Dendropanax morbifera Lev. leaf.
Download Original Figure
Fig. 3.
GABA chromatogram profiles of (A) standard of GABA, (B) water extract of Dendropanax morbifera Lev. leaf, and (C) condition K extract of Dendropanax morbifera Lev. leaf.
Download Original Figure
Table 8.
The free amino acid contents of Dendropanax morbifera Lev. leaf extracts
|
Amino acid (mg/g) |
CTL extracts1)
|
Optimal condition K extracts |
Pilot scale extracts |
|
1 |
Alanine |
33.61±0.11 |
40.41±7.31N.S2)
|
29.42±1.13N.S
|
|
2 |
Arginine |
2.61±1.02 |
17.77±1.36***
|
8.74±0.96***
|
|
3 |
Aspartic acid |
14.02±1.59 |
19.72±1.75*
|
14.23±2.79N.S
|
|
4 |
GABA |
15.53±3.10 |
27.81±3.73**
|
20.28±0.43*
|
|
5 |
Glutamic acid |
13.35±3.26 |
3.01±0.46***
|
6.74±1.45**
|
|
6 |
Glycine |
1.36±0.20 |
2.96±0.76N.S
|
2.16±0.06N.S
|
|
7 |
Histidine |
2.25±0.44 |
3.84±1.01N.S
|
0.76±0.14*
|
|
8 |
Leucine |
4.99±0.24 |
24.16±1.00***
|
10.73±0.10**
|
|
9 |
Isoleucine |
6.36±0.29 |
12.77±0.41**
|
6.11±0.26N.S
|
|
10 |
Lysine |
2.00±0.37 |
13.70±7.24***
|
9.64±0.71**
|
|
11 |
Methionine |
1.83±1.40 |
5.50±1.77**
|
2.66±1.43N.S
|
|
12 |
Phenylalanine |
1.46±0.03 |
12.41±0.12***
|
5.00±0.25**
|
|
13 |
Proline |
13.27±6.14 |
21.12±0.24*
|
15.72±2.67N.S
|
|
14 |
Serine |
6.18±0.22 |
7.90±1.91N.S
|
5.68±0.79N.S
|
|
15 |
Threonine |
3.34±0.69 |
4.70±1.04N.S
|
3.16±1.50N.S
|
|
16 |
Tryptophan |
0.50±0.08 |
0.87±1.24N.S
|
N.D. |
|
17 |
Tyrosine |
9.78±3.22 |
23.34±0.04*
|
15.82±0.34N.S
|
|
18 |
Valine |
13.50±5.27 |
18.04±1.71N.S
|
13.32±4.12N.S
|
|
19 |
Asparagine |
8.02±0.94 |
7.44±2.55N.S
|
6.44±0.55N.S
|
|
20 |
Cystein |
2.28±0.36 |
5.30±3.08N.S
|
0.50±0.12*
|
|
21 |
Glutamine |
N.D.2)
|
N.D. |
N.D. |
|
|
Total |
157.24 |
272.77 |
177.11 |
Download Excel Table
이상의 분석결과, 단백질 분해 효소인 protease와 trypsin을 처리한 후 침지와 1차 가수분해를 8시간 동시 진행하고, 이 후 bromelain과 papain을 추가하여 16시간 동안 2차 가수분해를 실시하여 추출한 조건이 황칠나무의 기능성 아미노산 중 하나인 L-arginine과 GABA를 동시 증가시킬 수 있는 최적 추출 공정으로 적용 가능함을 확인 할 수 있었다. 따라서 단백질 분해 효소를 이용한 가수분해 추출이 향후 황칠나무의 기능성식품소재로서의 개발 및 연구에 활용되어질 것으로 기대한다.
요 약
본 연구에서는 황칠나무로부터 다양한 약리작용 및 생리활성을 더욱 향상시킨 새로운 기능성식품소재로서의 개발과 동시에 황칠나무 잎 유래 L-arginine과 GABA의 증가 추출 조건을 최적화하였다. 선 추출 후 단백질 분해 효소 처리 조건과 선 단백질 분해 효소 처리 후 추출 조건으로 나누어 진행하였으며, 효소 종류, 가수분해 시간, 효소 농도 및 효소처리방법 등을 달리하였다. 각 조건별 L-arginine과 GABA의 함량을 비교 분석하여 최적 추출 조건을 최종 확인하였다. 물과 함께 원료 중량의 0.2% 함량의 protease, trypsin을 처리하고 45℃에서 8시간동안 침지 및 1차 가수분해를 동시에 실시한 후 동량의 bromelain, papain을 별도의 물과 함께 55℃에서 16시간동안 2차 가수분해를 실시하고 최종적으로 100℃에서 4시간동안 추출 및 효소불활성화를 수행하는 조건을 최적 추출 조건으로 확립하였다. 황칠나무 유래 L-arginine은 기존 2.61±1.02 mg/g에서 17.77±1.36 mg/g으로, GABA의 함량은 15.53±3.10 mg/g에서 27.81±3.73 mg/g으로 가장 효율적으로 증가하였으며 83.872%의 가수분해율을 얻을 수 있었다.
Acknowledgements
본 연구는 농림축산식품부의 재원으로 농림수산식품기술기획평가원의 고부가가치식품기술개발사업 (316065-3 및 116032-3)의 지원을 받아 수행된 연구 결과이며, 이에 감사드립니다.
References
SadakiO. 1996; The development of functional foods and material. Bioindustry. 13:44-50.

Jeong BS, Jo JS, Pyo BS, Hwang B (1995) Studies on the distribution of Dendropanax morbifera and component analysis of the golden lacquer. Korean J Biotechnol Bioeng, 10, 393-400
JeongBS, JoJS, PyoBS, HwangB. 1995; Studies on the distribution of
Dendropanax morbifera and component analysis of the golden lacquer. Korean J Biotechnol Bioeng. 10:393-400.

Hyun TK, Ko YJ, Kim EH, Chung IM, Kim JS (2015) Anti-inflammatory activity and phenolic composition of Dendropanax morbifera leaf extracts. Ind Crops Prod, 74, 263-270
HyunTK, KoYJ, KimEH, ChungIM, KimJS. 2015; Anti-inflammatory activity and phenolic composition of
Dendropanax morbifera leaf extracts. Ind Crops Prod. 74:263-270


Lim KP, Chung WY (1998) Studies on the development of traditional Korean Golden Vamish(Hwngchil)(Ⅱ) chemical composition and coating-oil characteristics of the exudates and bark-extractives of Hwangchil namu (Dendropanax morbifera Lev.). Mokchae Konghak, 26, 7-13
LimKP, ChungWY. 1998; Studies on the development of traditional Korean Golden Vamish(Hwngchil)(Ⅱ) chemical composition and coating-oil characteristics of the exudates and bark-extractives of Hwangchil namu (
Dendropanax morbifera Lev.). Mokchae Konghak. 26:7-13.

Ahn JC, Kim MY, Kim OT, Kim KS, Kim SH, Kim SH, Hwang B (2002) Selection of the high yield capacity of Hwangchil lacquer and identification of aromatic components in essential oil of Dendropanax morbifera Lev. Korean J Medicinal Crop Sci, 10, 126-131
AhnJC, KimMY, KimOT, KimKS, KimSH, KimSH, HwangB. 2002; Selection of the high yield capacity of Hwangchil lacquer and identification of aromatic components in essential oil of
Dendropanax morbifera Lev. Korean J Medicinal Crop Sci. 10:126-131.

Lee KH, Na HJ, Song CK, Kang SY, Kim S (2018) Quercetin quantification in a Jeju Dendropanax morbifera Lev. extract by varying different parts, harvest times, and extraction solvents. Korean J Food Preserv, 25, 344-350
LeeKH, NaHJ, SongCK, KangSY, KimS. 2018; Quercetin quantification in a Jeju
Dendropanax morbifera Lev. extract by varying different parts, harvest times, and extraction solvents. Korean J Food Preserv. 25:344-350


Kim HR, Chung HJ (2000) Chemical characteristics of the leaves and the seeds of korea Dendropanax (Dendropanax morbifera Lev.). J Korean Soc Appl Biol Chem, 43, 63-66
KimHR, ChungHJ. 2000; Chemical characteristics of the leaves and the seeds of korea Dendropanax (
Dendropanax morbifera Lev.). J Korean Soc Appl Biol Chem. 43:63-66.

KimHB, KimSL, KangSW. 2004; Varietal analysis and quantification of amino acid in mulberry fruits. Korea J Seric Sci. 46:47-53.

SiasosG, TousoulisD, VlachopoulosC, AntoniadesC, StefanadiE, IoakeimidisN, AndreouI, ZisimosK, PapavassiliouAG, StefanadisC. 2008; Short-term treatment with L-arginine prevents the smoking-induced impairment of endothelial function and vascular elastic properties in young individuals. Int J Cardiol. 126:394-399


ChoiMJ. 2009; Effects of arginine supplementation on bone mineral density and bone markers in OVX rats. Korean J Nutr. 42:309-317


ChenJ, WollmanY, ChernichovskyT, IainaA, SoferM, MatzkinH. 1999; Effect of oral administration of high-dose nitric oxide donor L-arginine in men with organic erectile dysfunction: results of a double-blind, randomized, placebo-controlled study. BJU Int. 83:269-273.

FuWJ, HaynesTE, KohliR, HuJ, ShiW, SpencerTE, CarrollRJ, MeiningerCJ, WuG. 2005; Dietary L-arginine supplementation reduces fat mass in Zucker diabetic fatty rats. J Nutr. 135:714-721


GuinTWC, BottiglieriT, CarterSO. 2003; GABA, γ-hydroxybutyric acid, and neurological disease. Ann Neurol. 54:3-12.

WangHF, TsaiYS, LinML, OuAS. 2006; Comparison of bioactive components in GABA tea and green tea produced in Taiwan. Food Chem. 96:648-653


Qingyun B, Meiqing C, Zhenxin G, Xiaohong C, Yan L, Kunlun L (2009) Effects of components in culuture medium on glutamate decarboxylase activity and γ-aminobutyric acid accumulation in foxtail millet (Setaria italic L.) during germination. Food Chem, 116, 152-157
QingyunB, MeiqingC, ZhenxinG, XiaohongC, YanL, KunlunL. 2009; Effects of components in culuture medium on glutamate decarboxylase activity and γ-aminobutyric acid accumulation in foxtail millet (
Setaria italic L.) during germination. Food Chem. 116:152-157.

BjorkJM, MoellerFG, KramerGL, KramM, SurisA, RushAJ, PettyF. 2001; Plasma GABA levels correlate with aggressiveness in relatives of patients with unipolar depressive disorder. Psychiatry Res. 101:131-136


HwangES, JangMR, KimGH. 2012; Effects of storage condition on the bioactive compound contents of Korean cabbage. Food Sci Biotechnol. 21:1655-1661


Lee MH, Gu YA, Choi MS, Kwon JH, Kim IS, Jeong YJ (2007) Characteristic changes in red ginseng fusion Cheonggukjang based on hydrolysis conditions. J Korean Soc Food Sci Nutr, 36, 1031-1037
LeeMH, GuYA, ChoiMS, KwonJH, KimIS, JeongYJ. 2007; Characteristic changes in red ginseng fusion
Cheonggukjang based on hydrolysis conditions. J Korean Soc Food Sci Nutr. 36:1031-1037


Kim HT, Park EJ (2014) Change of amino acids contents of Gastrodia elata Blume with harvest times and seed tuber. J Plant Biotechnol, 41, 229-235
KimHT, ParkEJ. 2014; Change of amino acids contents of
Gastrodia elata Blume with harvest times and seed tuber. J Plant Biotechnol. 41:229-235


Ministry of Food and Drug Safety 1997; Korea food code. Ministry of Health and Welfare. Osong, Korea: p. 507-510.

ParkBY, YoonKY. 2018; Conditions for hydrolysis of perilla seed meal protein for producing hydrolysates and ultrafiltered peptides and their antioxidant activity. Korean J Food Preserv. 25:605-612


Jeoung YK, Kim JH, Baek IS, Kang YJ, Chi JH (2017) Effect of schizandra berry dregs and rice bran treatment on γ-aminobutyric acid (GABA) content enhancement in Pleurotus ostreatus. J. Mushrooms, 15, 88-93
JeoungYK, KimJH, BaekIS, KangYJ, ChiJH. 2017; Effect of schizandra berry dregs and rice bran treatment on γ-aminobutyric acid (GABA) content enhancement in
Pleurotus ostreatus. J. Mushrooms. 15:88-93.

SawaiY, KonomiK, OdakaY, YoshitomiH, YamaguchiY, MiyamaD. 1999; Contents of γ-aminobutyric acid in stem of anaerobic incubated tea shoot. Nippon Shokuhin Kagaku Kogaku Kaishi. 46:274-277.

Pyo YH (2008) Effect of Monascus-fermentation on the content of GABA and free amino acids in soybean. J Korean Soc Food Sci Nutr, 37, 1208-1213
PyoYH. 2008; Effect of
Monascus-fermentation on the content of GABA and free amino acids in soybean. J Korean Soc Food Sci Nutr. 37:1208-1213


JeonG, LeeMY, YoonJ, JangS, JungM, JungHS, LeeJ. 2010; Effects of heat treatment and selected medicinal plant extracts on GABA content after germination. J Korean Soc Food Sci Nutr. 39:154-158