서 론
현대인들은 자외선, 흡연, 매연, 약물 및 방사선 등의 다양한 요인과 산화 촉진물질로 인하여 인체의 항산화 방어체계의 균형이 깨어진다. 이로 인해 생성된 superoxide(O2-), nitric oxide(NO), nitrogen dioxide(NO2), hydroxyl(OH), peroxynitrite(ONOO-) 등과 같은 활성 산소 종(reactive oxygen species, ROS)은 인체 내에서 산화를 유발하여 산화적 스트레스를 촉진한다(1,2). 인체의 과도한 산화적 스트레스는 세포의 구성성분인 지질, 단백질, 당 및 DNA 등의 비선택적, 비가역적 파괴를 촉진하여 노화 촉진 및 각종 질병을 유발하는데 특히 암, 뇌질환, 실혈관계질환 및 피부질환 등과 밀접한 관계가 있다(3-5). 체내의 ROS 또는 자유라디칼을 중화시켜 노화방지 및 성인병 예방 등의 기능을 하는 성분을 항산화 물질이라고 하며, 대표적인 항산화제로서 butylated hydroxy anisol(BHA), butylated hydroxy toluene(BHT) 등의 합성 항산화제가 사용되었으나(6,7) 암, 지질대사 불균형 등의 부작용이 발견되어 사용을 제한하고 있다(8). 따라서 보다 안전하고 부작용이 적은 천연물 유래의 천연 항산화제의 관심 증가와 개발이 지속적으로 이루어지고 있다(9).
최근 급격한 경제성장 및 생활수준의 향상으로 인해 서구화된 식습관으로의 변화가 가속화됨에 따라 만성 대사성 질환 중 하나인 당뇨병의 발병률이 증가하고 있다(10). 당뇨병은 제1 형 및 제 2형 당뇨병으로 구분되며, 제1형 당뇨병은 췌장 베타세포의 병변에 따른 인슐린 결핍으로 인한 인슐린 의존성이고, 제2형 당뇨병은 인슐린 저항성으로 인한 인슐린 비의존성 당뇨병으로 정의된다(11). 최근의 보고에 따르면 췌장 베타세포의 손상이 산화적 스트레스에 의해 발생되고 이것이 곧 인슐린 분비감소로 이어져 항산화 물질이 당뇨병 개선과 밀접한 연관성이 보고되어 져있다(12). 한편 α-glucosidase는 소장점막에 존재하는 당분해효소로서 이를 저해하면 탄수화물의 소화 및 흡수를 방해하여 식후 급격한 혈당상승을 억제하여 고혈당을 예방하는 작용을 한다(13). 대표적인 α-glucosidase 저해제로는 acarbose 및 voglibose가 알려져 있으나, 이들의 장기 복용 시 각종 부작용을 유발하는 것이 알려져있다(14). 따라서 천연물 유래의 보다 안전하고 우수한 효능을 가진 α-glucosidase 저해제의 탐색이 필요한 실정이다. 현재까지 천연물로부터 α-glucosidase 저해제의 분리 및 동정에 관한 다양한 연구가 보고되어져 있으며(15), 최근에는 α-glucosidase 저해활성이 우수한 신규의 prenylflavonoid, gallotannin, butyrolactone glucoside 및 chalcone 등의 화합물이 동정 되었다(16-20).
섬바디(Dystaenia takeshimana)는 산형과에 속하는 다년생 초본식물로 울릉도 전 지역에서 자생하며, 전통의학에서 과실 또는 뿌리를 약용으로 사용하였다(21). 최근 연구에서 섬바디의 뿌리 추출물로부터 coumarin, flavonoid 및 terpenoid류의 화합물이 동정 되었으며, 이들 화합물의 항염증 활성이 보고되어졌다(22), 또한 전북 고창 지역에서 재배된 섬바디 EtOH 추출물로부터 항균 활성이 우수한 polyacetylene류의 화합물의 존재가 보고되어졌다(23). 그러나 울릉도 자생 섬바디에 대한 생리활성 또는 성분에 대한 연구는 전무한 실정이다. 따라서 본 연구에서는 울릉도 자생 섬바디 전초 추출물 및 극성별 유기용매를 활용한 각 분획물에 대하여 항산화 활성과 관련된 DPPH 및 ABTS+ 라디칼 소거능, 항 당뇨 활성과 관련된 α-glucosidase 저해활성 평가에서 우수한 활성을 확인하였기에 그 결과를 보고하고자 한다.
재료 및 방법
본 실험에 시료는 경상북도 울릉군에서 2009년 5월에 채취한 건조된 섬바디(Dystaenia takeshimana) 전초를 사용하였다. 표본시료는 대구대학교의 식품공학과 천연물 화학실험실에 보관하고 있으며, 기능성 평가에 사용된 시약은 gallic acid, 1,1-diphenyl-2-picrylhydrazyl(DPPH), 2,2'-azinobis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS+), Saccharomyces cerevisiae 유래의 α-glucosidase, (+)-catechin 및 acarbose은 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입하여 사용하였고, 그 외에 사용된 용매 및 시약은 모두 일급 이상의 등급을 사용하였다.
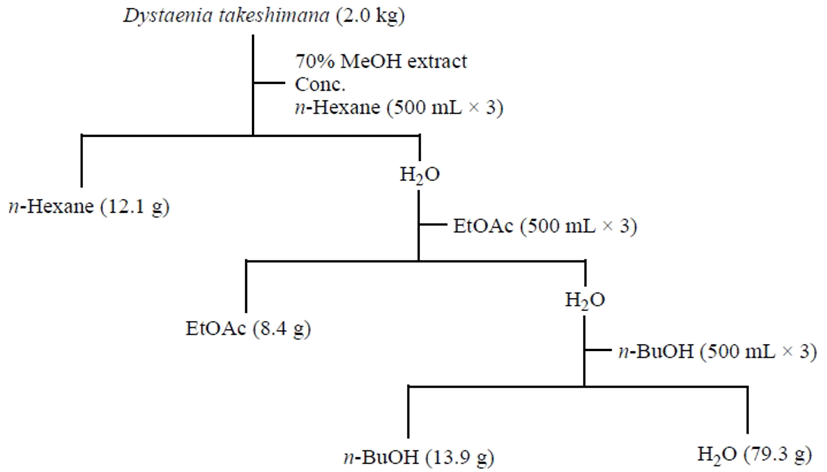
건조된 울릉 섬바디 전초 2.0 kg을 분쇄기로 잘게 마쇄한 후, 70% methyl alcohol(MeOH) 10.0 L로 상온에서 침지추출을 3일간 3회 반복하여 여과 한 후 농축하였다. 얻어진 울릉 섬바디 70% MeOH 추출물(120.4 g)을 물에 현탁하여 저극성 용매인 n-hexane으로 먼저 분획한 후 수층을 다시 ethyl acetate(EtOAc)와 n-butyl alcohol(n-BuOH)을 이용하여 각각 순차적으로 3회 분획하였다. 각 용매추출 분획을 저온 감압 농축한 뒤 건조하여 n-hexane 분획물(12.1 g), EtOAc 분획물(8.4 g), n-BuOH 분획물(13.9 g), H2O 분획물(79.3 g)을 각각 수득하였다(Fig. 1). 농축된 섬바디 70% MeOH 추출물과 유기용매를 이용한 각 분획물을 대상으로 총 페놀 함량 측정, DPPH 및 ABTS+ 라디칼 소거활성 및 α-glucosidase 저해활성 평가를 수행하였다.
울릉 섬바디 70% MeOH 추출물 및 유기용매 분획물의 총 페놀성 화합물의 함량은 Folin-Denis 방법(24)에 따라 측정하였으며, 추출물 혹은 분획물을 1.0 mg/mL 농도로 조제한 후, 시료 50 μL와 Folin-Denis 시액 50 μL, 0.7 M 탄산나트륨 포화용액 50 μL를 차례로 넣은 다음 이것을 잘 혼합하여 실온에서 60분 방치한 후 UV/VIS 분광광도계로 750 nm에서 흡광도를 측정하였으며, 표준물질은 gallic acid를 이용하여 표준곡선을 작성하여 양을 환산하였다.
울릉도에 자생하는 섬바디 70% MeOH 추출물 및 분획물의 전자공여능은 Blois 방법(25)에 따라 측정하였다. 각 시료용액 120 μL에 0.45 mM의 DPPH 용액 60 μL을 넣고 교반한 후 15분간 방치한 다음 517 nm에서 흡광도를 측정하였다. 이 때 양성 대조군은 천연 항산화제인 (+)-catechin을 사용하였다.
결과는 첨가군(Asample)과 무첨가군(Ablank)의 흡광도 감소율 차이를 백분율로 환산하여 나타내었다.
울릉 섬바디의 70% MeOH 추출물 및 분획물에 대하여 ABTS+ radical 소거능을 Re(26)의 방법을 변형하여 다음과 같이 측정하였다. 7 mM ABTS+ 와 2.4 mM K2O8S2동량을 혼합 후 실온, 암실에서 12시간 방치하여 라디칼의 생성을 유도한 후 ABTS+ 라디칼 용액을 희석하여 734 nm에서 흡광도 값이 0.7-0.8 정도가 되도록 희석한 후 사용하였다. 희석한 ABTS+ 라디칼 용액 100 μL와 섬바디 추출물 및 분획물 100 μL를 혼합하여 실온에서 7분간 반응시킨 후 734 nm에서 흡광도를 측정하였다. 이 때 양성대조군은 천연 항산화제인 (+)-catechin을 사용하였다.
결과는 첨가군(Asample)과 무첨가군(Ablank)의 흡광도 감소율 차이를 백분율로 환산하여 나타내었다.
α-Glucosidase 저해능은 Kim(27)이 행한 방법을 변형하여 효소-기질반응을 이용한 분광학적 방법으로 측정하였다. 즉, 1 U/mL α-glucosidase 90 μL에 시료 혹은 0.1M sodium phosphate buffer(pH 6.8) 10 μL를 첨가하여 혼합한 후 37℃에서 15분 동안 incubation 시켰다. 반응 후 기질인 1 mM p-NPG 100 μL를 첨가한 후 5분간 반응시키고 405 nm에서 ELISA reader를 이용하여 흡광도를 측정함으로써 기질로부터 유리되어 나오는 p-nitrophenol을 측정하였다. 양성대조군으로 대표적인 α-glucosidase 저해제로 잘 알려진 acarbose를 사용하였다.
α-Glucosidase 저해활성의 결과는 첨가군(Asample)과 무첨가군(Ablank)의 흡광도 감소율 차이를 백분율로 환산하여 나타내었다.
결과 및 고찰
울릉도 전역에 자생하는 섬바디 70% MeOH 추출물 및 각 유기용매 분획물에 함유하고 있는 총 페놀성 함량은 Table 1에 나타내었다. 그중 섬바디 70% MeOH 추출물은 1 g당 46.6±1.1 mg GAE/g을 함유하고 있었으며, EtOAc 분획물은 98.1±2.3 mg GAE/g으로 가장 많은 페놀성 화합물을 함유하고 있었다. 그 외 n-BuOH 및 H2O 분획물은 각 66.6±1.8, 39.4±0.9 mg GAE/g의 순으로 페놀성 화합물의 함량이 확인되었으며, n-hexane 분획물은 21.0±0.5 mg GAE/g으로 상대적으로 낮은 페놀성 화합물을 함유하고 있는 것으로 확인되었다.
| Samples | Total phenolics contents (mg GAE/g)1) |
|---|---|
| 70% MeOH ext. | 46.6±1.12)c3) |
| n-Hexane layer | 21.0±0.5e |
| EtOAc layer | 98.1±2.3a |
| n-BuOH layer | 66.6±1.8b |
| H2O layer | 39.4±0.9d |
보라색을 띄는 DPPH 라디칼은 517 nm 부근에서 최대 흡광도를 가지며, 항산화 활성이 우수한 물질과 반응하면 노란색으로 탈색되며 흡광도 값이 감소하게 되는 원리를 활용하여 천연소재의 항산화제 연구 개발에 많이 이용되고 있다(24). Table 2에 나타낸 것처럼 울릉 섬바디 70% MeOH 추출물 및 각 유기용매 분획물에 대해서 DPPH 라디칼 소거활성을 평가한 결과, 70% MeOH 추출물의 IC50 값이 213.9±3.4 μg/mL의 활성을 나타났다. H2O 및 n-hexane 분획물의 경우 각 492.2±4.6, >500 μg/mL으로 상대적으로 낮은 IC50 값을 나타냈으며, n-BuOH 분획물의 경우 IC50 값은 247.3±3.5 μg/mL로 우수한 DPPH 라디칼 소거활성을 나타내었다. 또한 EtOAc 분획물에 DPPH 라디칼 소거활성의 IC50 값이 127.3±2.1 μg/mL로 가장 우수한 활성을 나타냈으며, 이 결과는 페놀성 화합물의 함량과 DPPH 라디칼 소거활성 사이에 밀접한 상관 관계가 있다는 보고와도 일치하는 결과이다(28). 최근 연구에서 울릉도 약용식물인 섬기린초(Sedum takesimense)의 전초 추출물에서 우수한 DPPH 라디칼 소거활성이 보고 되었으며, 활성을 나타내는 새로운 페놀 화합물인 2,6-di-O-galloylarbutin 및 gossypetin-8-O-β-D-xyloside가 구조 동정되었다(29).
울릉 섬바디 70% MeOH 추출물 및 유기용매 분획물을 대상으로 ABTS+ 라디칼 소거활성 평가를 수행하였다. 그 결과(Table 3), 70% MeOH 추출물의 경우 IC50 값이 200.3±2.7 μg/mL로 우수한 ABTS+ 라디칼 소거활성이 나타났으며, n-BuOH 분획물 및 H2O 분획물에서 IC50 값이 165.2±2.5, 365.9±3.8 μg/mL로 준수한 라디칼 소거활성을 확인되었다. DPPH 라디칼 소거능에서 가장 우수한 활성을 나타낸 EtOAc 분획물에서 IC50 값이 72.7±1.2 μg/mL로 가장 우수한 ABTS+ 라디칼 소거 활성을 나타났으며, n-hexane 분획물의 경우 IC50 값이 >500 μg/mL 이상으로 상대적으로 낮은 소거활성이 확인되었다. Table 1 및 2에 나타낸 바와 같이 EtOAc 분획물에서 가장 우수한 DPPH 라디칼 소거활성을 확인되었으며, 총 페놀 함량이 상대적으로 많이 함유되어 있는 EtOAc 분획물에서 ABTS+ 라디칼을 효과적으로 소거하는 물질의 존재가 시사 되었으며, 이 활성은 추출물 상태의 활성으로 향후 각종 칼럼크로마토그래피 및 기기분석을 활용하여 EtOAc 분획물에 함유되어 있는 우수한 ABTS+ 라디칼 소거활성 물질의 동정이 필요하다고 사료된다.
울릉도 전 지역에 자생하는 섬바디의 70% MeOH 추출물 및 유기용매 분획물을 대상으로 항 당뇨 활성과 관련된 α-glucosidase 저해활성 평가를 수행한 결과(Table 3), 섬바디 70% MeOH 추출물의 IC50 값이 >500 μg/mL로 상대적으로 낮은 저해 활성을 나타냈다. 라디칼 소거활성 평가에서 상대적으로 우수한 소거활성을 나타낸 EtOAc 분획물의 경우 IC50 값이 229.3±2.3 μg/mL로 준수한 α-glucosidase 저해활성을 나타냈다. 저 극성 용매인 n-hexane 분획물의 IC50 값이 55.5±0.4 μg/mL로 가장 우수한 α-glucosidase 저해활성을 나타냈으며, 양성대조군인 acarbose(IC50=193.1±2.1 μg/mL)보다 3배 이상 우수한 활성 보임을 확인하였다. 이전 연구결과 섬바디 EtOH 추출물의 n-hexane 분획물에서 polyacetylene류 화합물인 falcarindiol이 구조 동정 되었으며(23), falcarindiol의 IC50 값이 67.7 μM로 매우 우수한 α-glucosidase 저해활성이 보고되었다(30). 본 연구 결과 역시 각종 유기용매 분획물 중에 n-hexane 분획물에서 상대적으로 가장 우수한 α-glucosidase 저해활성이 확인 되었으며, 섬바디 70% MeOH 추출물의 n-hexane 분획물에도 활성을 나타내는 저극성 화합물들이 많이 함유되어 있을 것이라고 추정 된다. 향후 활성을 나타낸 n-hexane 분획물을 각종 칼럼크로마토그래피 및 기기 분석을 활용하여 활성물질의 동정이 필요하며, 세포 및 동물실험 등의 추가적인 효능 검증을 실시하여 우수한 α-glucosidase 저해제로서 가능성을 검증할 필요가 있다고 생각된다.
요 약
울릉도에 자생하는 섬바디를 70% MeOH로 침지 추출하여 얻어진 추출물에 대해 각종 유기용매를 활용하여 순차 분획을 실시하였고, 얻어진 추출물 및 분획물을 대상으로 총 페놀 함량, DPPH, ABTS+ 라디칼 소거활성 및 α-glucosidase 저해활성 평가를 수행하였다. DPPH 라디칼 소거활성 평가에서 페놀성 화합물이 가장 많이 함유되어 있는 EtOAc 분획물의 IC50 값이 127.3±2.1 μg/mL을 나타냈으며, ABTS+ 라디칼 소거활성 평가 역시 EtOAc 분획물의 IC50 값이 72.7±1.2 μg/mL으로 가장 우수한 라디칼 소거활성을 나타내었다. 항 당뇨활성과 관련된 α-glucosidase 저해활성 평가에서는 n-hexane 분획물의 IC50 값이 55.5±0.4 μg/mL로 가장 우수한 저해활성을 나타내었으며, 이전 연구 결과와 비교해볼 때 n-hexane 분획물에 우수한 α-glucosidase 저해활성을 나타내는 polyacetylene과 같은 저해활성이 강한 화합물이 다량 함유되어 있을 것으로 추정한다. 다양한 화합물이 함유된 상태의 추출물 시료를 단일물질로 정제할 경우 더욱 우수한 활성의 화합물이 존재할 가능성을 확인하였으며, 향후 이들 추출물의 활성물질 동정을 통한 활성 기작에 대한 연구가 필요하며, 본 연구결과로 보다 우수한 라디칼 소거활성 및 α-glucosidase 저해활성을 가지는 새로운 천연 기능성 소재 발굴을 위한 기초자료로 활용 가능할 것으로 사료된다.
