서 론
최근 급격한 경제성장, 서구화된 식생활, 노령화, 환경오염 등으로 인한 영향으로 비만, 당뇨, 고지혈증, 동맥경화, 알츠하이머, 암 등과 같은 만성질환의 발병이 증가하는 추세이다. 또한 고령화 사회로 진입하면서 수명 연장 및 건강한 삶에 대한 욕구가 증가하고 이에 따라 복용하는 약물의 수도 점점 다양해지고 있다. Yoon(1)에 따르면 노인 1명당 평균 7.23개의 약물의 복용하고 있으며, 다양한 약물의 지속적인 복용이나 남용은 질병을 악화 시킬 뿐만 아니라 심각한 부작용을 유발하는 것으로 알려져 있다(2). 특히, 암 치료 시 일반적으로 이용되는 화학약물치료법은 체내 위장관계, 신경계 및 혈액학적 부작용을 유발하는 것으로 보고되어 있다(2,3). 전통적으로 여러 병리학적 상황에서 천연물은 질병 치료에 사용되어 왔고 경험에 의해 안전성을 신뢰할 수 있기 때문에 부작용에 대해 비교적 안전한 소재로 각광받고 있다(4). 다양한 생리활성 효과를 가지는 천연물 성분 인자로는 섬유질(5), 식물유래 polyphenol 화합물(6), 다불포화지방산(7) 및 식물성 단백질(8) 등이 보고되어 있다. 그 중 폴리페놀류는 식물체 스스로가 자외선에 의한 산화나 곰팡이, 병원균 및 천적으로부터 자신을 보호하기 위해 합성하는 2차 대사산물로 여러 연구들에 의해 만성질환의 예방 및 개선에 유의적인 효능을 나타낸다고 보고되었다(9).
예로부터 종자는 인간생활에 필수적인 천연자원으로 식품, 약재, 기호품, 향신료 등 다양한 용도로 이용되어 왔다. 최근 식용 및 약용 목적으로 종자 이용에 대한 관심이 증가하고 있으며 다양한 식물체 종자의 규명되지 않은 잠재적 생리활성 효능을 발견하고 그 용도를 확대하고자 하는 연구들이 진행되고 있다(10). 쇠별꽃(Stellaria aquatica)은 쌍자엽식물강(Dicotyledoneae), 중심자목(Centrospermales), 석죽과(Caryophyllaceae)에 속하는 2년 내지 다년초로 북반구의 온대와 아열대, 북아프리카에 널리 분포하며, 한국에서는 전국 각지의 습한 곳에 서식하는 것으로 알려져 있다. 쇠별꽃 종자에는 폴리페놀 및 지방유가 함유되어 있고, 줄기와 잎에는 무기염류가 함유되어 있다는 것 외에 어떤 성분이 들어있는지 알려진 바가 없으나, 예로부터 한방에서는 잎과 줄기 말린 것을 번루 또는 우번루라 피를 맑게 하거나 젖을 나오게 하며 폐렴, 고혈압, 이뇨 등의 치료에 사용되어 왔다(11).
이와 같이 쇠별꽃 종자에 대한 식품 및 약리학적 이용에 대한 연구가 거의 없음에 착안하여 본 연구에서는 쇠별꽃 종자의 추출물을 대상으로 항산화, 총 폴리페놀 및 플라보노이드 함량, 항암 및 대식세포 면역활성 효과에 대하여 알아보았다. 이를 통해 기능성 식품 제원의 체계적인 연구를 위한 기초자료를 제공하고 연구가 미흡한 식물 자원의 활용가능성을 증대시키고자 한다.
재료 및 방법
재료는 경기도 포천시 및 홍성군 지역에서 2002, 2005, 2006, 2007, 2013년도에 채취한 쇠별꽃 종자를 농촌진흥청 국립식량과학원에서 분양 받았으며 4℃ 냉장보관 후 쇠별꽃 종자를 혼합 마쇄하여 실험에 사용하였다. 실험에 사용한 쇠별꽃 종자 추출물은 증류수, 에탄올, 메탄올, 70% 에탄올을 이용해 추출 하였다. 마쇄한 종자 분말에 20배 용량(v/w)의 추출용매를 혼합하여 37℃ water bath에서 10시간씩 2회 추출하여 추출물을 얻었다. 제조한 추출물은 필터(JET BIOFIL, 25 mm, PTFE membrane, 0.45 μm, Sterile)로 여과한 후 감압농축기를 사용하여 농축 후 dimethyl sulfoxide(DMSO, Sigma Chemical Co., St Louis, MO, USA)를 이용하여 100 mg/mL의 농도로 녹여 4℃에 냉장보관 하여 실험에 사용하였다. 물, 에탄올, 메탄올 및 70% 에탄올 용매별 추추물의 건조수율은 각 6.3%, 8.5%, 11.9% 및 8.4%였다.
DPPH radical 소거활성은 Blois(12)의 방법을 변형하여 사용하였다. α,α'-Diphenyl-β-picrylhydrazine(DPPH)의 환원성을 이용한 것으로 250, 500 및 1,000 μg/mL로 희석시킨 쇠별꽃 종자 추출물 40 μL에 DPPH 200 μL을 처리하였으며, 양성 대조군(positive control)인 0.1% dibutylated hydroxytoluene (BHT)와 0.1% α-tocopherol 용액에도 추출물과 동일하게 DPPH를 처리한 후 30분간 암소에서 반응시켰다. 517 nm에 UV/Vis-spectrometer(Hitachi, Tokyo, Japan)로 측정하였다. 대조군은 추출물 대신 에탄올을 첨가하여 대조군에 대한 흡광도의 감소비율을 나타냈다.
ABTS・+ radical 소거능은 Biglari 등(13)의 방법을 변형하여 측정 하였다. 7.4 mM 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid)(ABTS)는 2.6 mM의 potassium peroxodisulfate와 혼합한 후 23℃의 암소에서 16시간 동안 반응시켰다. ABTS 용액의 농도는 732 nm에서 흡광도 측정값이 0.700±0.03 정도가 되도록 희석하였다. 250, 500 및 1,000 μg/mL로 희석시킨 쇠별꽃 종자 추출물 100 μL과 ABTS 용액 3,900 μL을 혼합한 후 23℃에서 6분간 암소에서 반응시키고 732 nm에서 UV/Vis-spectrometer(Hitachi)로 흡광도를 측정하였다. 양성 대조군은 0.1% BHT(Sigma Chemical Co.)와 0.1% α-tocopherol(Sigma Chemical Co.)을 사용하였다. ABTS radical 소거능은 다음의 식에 따라 계산하였다.
시료의 환원력은 Yildirim 등(14)의 방법을 변형하여 측정하였다. 250, 500 및 1,000 μg/mL로 희석시킨 쇠별꽃 종자 추출물 50 μL에 phosphate buffer(0.2 M, pH 6.6) 250 μL과 potassium ferricyanide(1%, w/v) 250 μL를 첨가하여 섞은 후, 5℃로 유지하면서 20분간 반응시켰다. 반응액에 250 μL의 trichloroacetic acid(10%, w/v)를 첨가한 후 10,000 rpm으로 10분간 원심분리 하였다. 상층액의 250 μL를 well plate에 담고 250 μL 증류수와 50 μL의 FeCl3(0.1%,w/v)을 첨가하여 700 nm에서 UV/Vis-spectrometer(Hitachi)로 흡광도를 측정하였다.
총 폴리페놀 함량은 Folin-Ciocalteu 방법을 변형하여 측정하였다(15). 증류수 45 μL에 1,000 μg/mL로 희석시킨 쇠별꽃 종자 추출물 5 μL을 넣고 2 N Folin-Ciocalteu 시약(Sigma Chemical Co.) 5 μL를 넣은 후 5분간 반응시키고 7% Na2CO3(Junsei Chemical Co., Ltd., Tokyo, Japan) 100 μL를 가하여 1시간 동안 암소에서 반응시켰다. 흡광도 측정은 760 nm에서 UV/Vis-spectrometer(Hitachi)를 사용하여 측정하였으며, gallic acid(Sigma Chemical Co.)를 희석하여 검량선을 만들어, 이를 바탕으로 추출물의 총 폴리페놀 함량을 정량하였다.
총 플라보노이드 함량은 Graham(16)의 방법을 변형하여 측정하였다. 1,000 μg/mL로 희석시킨 쇠별꽃 종자 추출물 20 μL에 10% diethylene glycol(Sigma Chemical Co.) 200 μL와 1 N NaOH(Daejung Chemical Co., Ltd., Siheung, Korea) 20 μL을 넣고 섞어준다. 그 후 37℃에서 1시간 반응을 시키고 흡광도 측정은 420 nm에서 UV/ Vis-spectrometer (Hitachi)를 사용하여 측정하였으며, quercetin(Sigma Chemical Co.)를 희석하여 검량선을 만들어, 이를 바탕으로 추출물의 총 플라보노이드 함량을 정량하였다.
본 실험에 사용한 세포는 한국 세포주은행(KCLB)에서 분양 받은 HepG2(human liver cancer cell)와 The Global Bioresource Center(ATCC)에서 분양 받은 A549(human lung cancer cell), MCF-7(human breast cancer cell), HT-29(human colon cancer cell), PC-3(human colorectal cancer cell), B16(mouse melanoma cell) 및 RAW 264.7(mouse macrophage)를 사용하였다. HepG2, HT-29, PC-3 및 B16 세포는 100 unit/mL의 antibiotic antimycotic(GIBCO®/InvitrogenTM, Gran Island, NY, USA)와 10% fetal bovine serum(FBS)가 첨가된 DMEM을 사용하여 37℃, 5% CO2incubator에서 계대 배양하여 실험에 사용하였으며, A549, MCF-7 및 RAW 264.7 세포는 100 unit/mL의 antibiotic antimycotic과 10% FBS가 첨가된 RPMI1640 (GIBCO®/InvitrogenTM)을 사용하여 위와 같은 조건에서 계대 배양하여 실험에 사용하였다.
암세포 증식 억제능은 HepG2, A549, MCF-7, HT-29, PC-3 및 B16 세포를 사용하였으며, sulforhodamine B(SRB, Sigma Chemical Co.)법을 이용하여 측정하였다. 생존 세포 내의 단백질 총량을 흡광도로 나타내어 세포 증식 억제능을 확인하는 방법으로 Trichloroacetic acid(TCA, Sigma Chemical Co.)에 의해 생존 세포만 well plate에 부착되며 이 세포의 단백질 내 염기성 아미노산 잔기가 SRB와 결합하여 마지막에 처리하는 Tris buffer(Sigma Chemical Co.)에 녹아 나와 흡광도를 나타낸다(17). 암세포 증식 억제능은 세포를 2×104 cells/mL가 되도록 희석하여 48-well plate에 분주한 다음 37℃, 5% CO2 incubator에서 24시간 배양한 후 250 및 500 μg/mL으로 희석시킨 쇠별꽃 종자 추출물을 첨가하고 24시간 동안 반응시켰다. 24시간 후 12% TCA를 넣어 4℃에서 1시간 동안 세포를 고정시키고 well을 증류수로 세척한 후 0.4% SRB 용액을 첨가하여 암소에서 1시간 동안 염색 하였다. 염색 종료 후 1% acetic acid(Kanto Chemical Co., Inc., Tokyo, Japan)로 세척하고 10 mM Tris buffer를 첨가 하여 SRB를 녹였다. Tris buffer에 세포가 잘 섞이도록 피펫팅을 한 후 상등액을 96-well plate에 옮겨 UV/Vis-spectrometer(Hitachi)를 사용하여 540 nm에서 흡광도를 측정하였다.
암세포를 1×105 cells/mL가 되도록 희석하여 6-well plate에 분주한 다음 37℃, 5% CO2 incubator에서 24시간 배양하여 쇠별꽃 추출물을 100 μg/mL으로 처리하고 24시간 동안 반응시켰다. 이후 세포의 형태학적 변화는 200배율의 광학현미경(Leica Micro systems, Wetzlar, Germany)으로 관찰하고 사진을 촬영하였다.
암 세포의 apoptotic 세포 사멸을 확인하기 위하여 Muse Annexin V and dead cell kit에 의해 염색된 세포를 Muse Cell Analyzer를 이용하여 flow cytometry 방법에 의해 측정하였다. 세포를 24-well plate에 1×105 cells/mL의 농도로 분주하고 37℃, 5% CO2 incubator에서 24시간 배양한 후 100 μg/mL으로 희석시킨 쇠별꽃 추출물을 첨가하여 24시간 동안 반응시켰다. 24시간이 경과한 후 trypsin-EDTA를 처리하여 세포를 수집하였으며 Annexin V 및 PI 염색 시약을 혼합한 용액을 100 μL씩 추가한 후 실온에서 20분 간 반응시켰다. Annexin V와 PI 시약에 의해 단독 및 교차 염색된 세포는 군 당 5,000개씩 분석하였으며 각각의 특성에 따라 live, early apoptotic, late apoptotic 및 apoptotic 세포로 분류하였다.
Nitric oxide(NO) 생성량 측정은 RAW 264.7를 2×104 cells/mL가 되도록 희석하여 96-well plate에 분주한 다음 37℃, 5% CO2 incubator에서 24시간 배양하고 2.5, 5 및 10 μg/mL로 희석한 쇠별꽃 종자 추출물을 12시간 동안 처리하였으며 양성대조군(positive control)으로 100 ng/mL의 LPS를 사용하였다. 이후 상등액 50 μL을 획득한 뒤 동량의 Griess(Sigma Chemical Co.) 시약을 첨가하고 암소에서 15분간 반응 시킨 후 UV/Vis-spectrometer(Hitachi)를 이용하여 540 nm에서 흡광도를 측정하였다. NO 농도는 sodium nitrite(NaNO2, Sigma Chemical Co.)를 사용하여 얻은 검량선을 기준으로 정량하였다.
결과 및 고찰
ABTS는 수용성의 peroxidase 기질로서 peroxidase 활성이 있는 시료와 반응하여 옅은 푸른색으로 변화하고 이를 통해 시료의 항산화 활성을 측정할 수 있다. 추출용매 별 쇠별꽃 종자 추출물의 ABTS radical 소거 활성을 나타낸 결과는 Fig. 1A와 같다. 합성 항산화제인 0.1% BHT 및 천연 항산화제인 0.1% α-tocopherol 군을 처리하였을 때 각각 72.48%, 60.12%의 ABTS 라디칼 소거활성을 나타내었으며, 쇠별꽃 종자 추출물들도 농도의존적 ABTS 라디칼 소거활성의 증가를 나타내었다. 특히, 1,000 μg/mL의 메탄올 및 70% 에탄올 추출물에서 각각 65.81% 및 70.01%의 ABTS 라디칼 소거활성을 나타내었으며 이는 물 및 에탄올 추출물과 비교하여 약 33.85-48.75% 높은 수치였다. 이를 통해 쇠별꽃 종자 70% 에탄올 추출물이 메탄올 추출물과 비교하여 유사한 ABTS 라디칼 소거능을 가지고, 물 및 에탄올 추출물보다는 그 효능이 우수한 것을 알 수 있다.
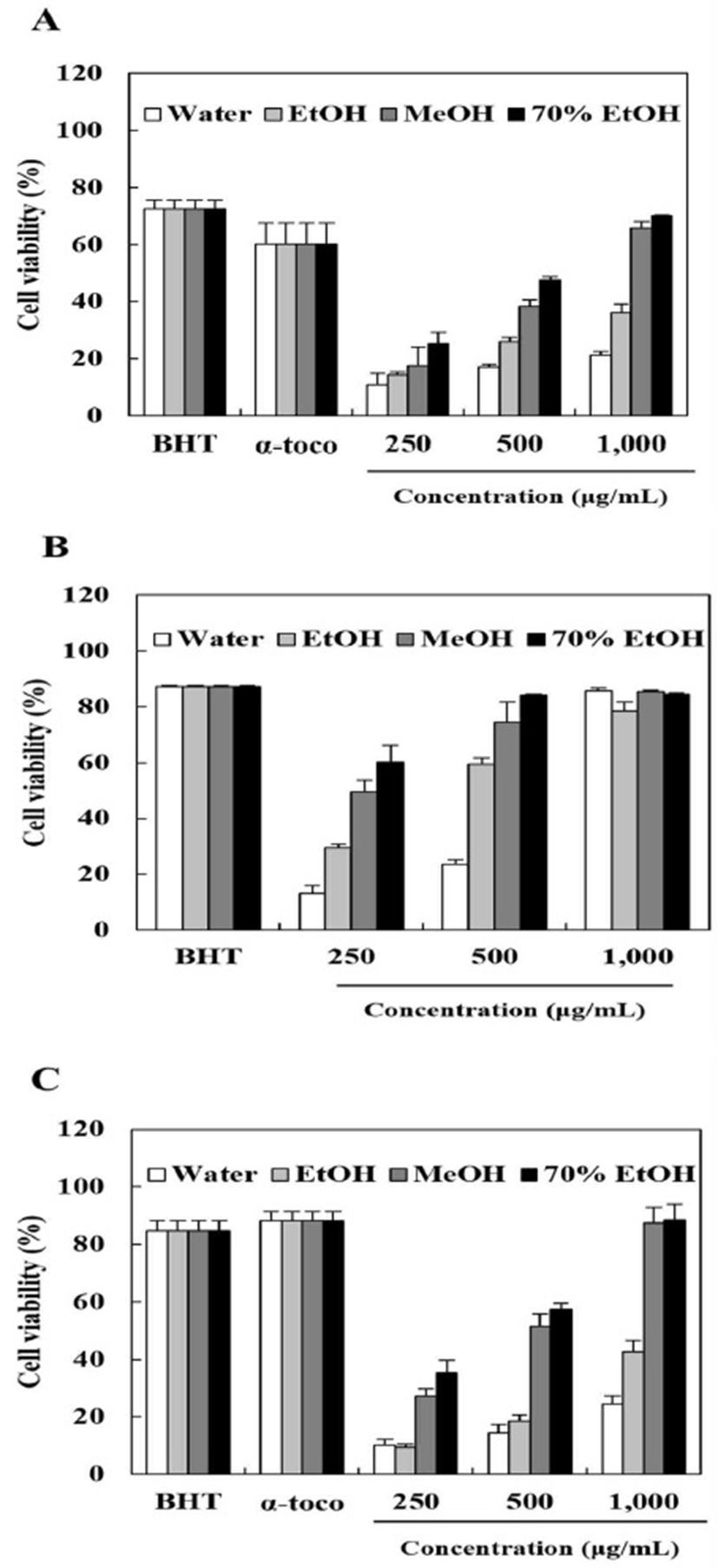
에탄올에 용해되는 DPPH 분자는 자주색을 띄는 질소 중심의 자유라디칼로서 517 nm에서 최대 흡광도를 나타내며 수소공여능이 우수한 시료와 결합 시 옅은 황색으로 변화되는 것으로 알려져 있다(18). 본 연구에서 추출용매 별 쇠별꽃 종자 추출물의 DPPH 라디칼 소거활성을 측정한 결과 500 μg/mL의 농도에서 70% 에탄올 추출물의 소거활성은 84.30%로 동일농도의 물(23.50%), 에탄올(59.43%) 및 메탄올 추출물(74.48%)과 비교하여 가장 우수한 DPPH 라디칼 소거능을 보였다(Fig. 1B). 이는 대조구인 0.1% BHT군(87.18%)과 비교하여 유사한 수치를 나타내었다. DPPH 라디칼 소거활성이 ABTS 라디칼 소거활성과 비교하여 비교적 낮은 수치를 나타내는 것은 라디칼의 종류, 소거기작의 차이점, 기질의 결합강도 등의 원인에 의한 것으로 판단된다(19).
산화된 형태인 금속이온인자(Fe3+등)의 킬레이트 활성을 통해 나타나는 환원력을 측정하였을 때 쇠별꽃 종자 70% 에탄올 및 메탄올 추출물은 1,000 μg/mL의 농도에서 각각 88.48% 및 87.46%의 환원력 활성을 나타내었으며 이는 물 및 에탄올 추출물과 비교하여 약 45.92-63.92% 높은 환원력 활성을 나타내었다(Fig. 1C). 또한 1,000 μg/mL의 70% 에탄올 추출물과 메탄올 추출물은 0.1% BHT 및 0.1% α-tocopherol과 비교하여 유사한 환원력 활성을 기록하였다.
식용으로 이용되는 종자와 새싹 채소 등은 항산화 효능 및 폴리페놀 함량이 뛰어난 것으로 알려져 있으며, 종자 추출물의 풍부한 항산화 활성은 다양한 질환의 예방 및 치료와 관련이 있을 것으로 보고되었다(20). Jo 등(21)은 DPPH 및 ABTS 라디칼 소거능을 가지는 아마란스 종자 추출물은 대식세포 산화질소의 감소 및 산화적 손상에 대한 세포보호 효과를 나타낸다고 보고하였고, Jang과 Park(22)은 미선나무 종자가 항산화 및 tyrosinase 억제활성을 통해 미백효능을 나타내는 것을 확인하였다. 따라서 쇠별꽃 종자 추출물의 우수한 항산화 활성은 다양한 생리활성 효능과 연관이 있을 것으로 판단되며 천연 항산화제 및 기능성 식품 등의 개발에 대해 높은 잠재력을 가질 것으로 기대된다.
자연계에 광범위하게 존재하는 폴리페놀 화합물은 식물체가 생산하는 2차 대사산물로 플라보노이드류, 페놀산류, 리그난류, 스틸벤류 등이 있으며 대부분 단백질, 효소 또는 기타 거대분자와 반응성이 큰 하이드록실기(hydroxyl group)를 하나 이상 포함한다(23). 식물체 내 폴리페놀 화합물에 대한 연구에서 암, 당뇨, 심혈관계 질환, 뇌졸중, 알츠하이머 등과 같은 만성질환의 예방과 관련이 있다고 보고되며 기능성 식품학 및 천연물 의약품으로 이용하기 위한 시도가 꾸준히 증가하고 있는 추세이다(24,25). 쇠별꽃 종자 추출물의 총 폴리페놀 및 총 플라보노이드 함량은 Table 1과 같다. 쇠별꽃 종자 물, 에탄올, 메탄올 및 70% 에탄올 추출물의 총 폴리페놀 함량은 각각 7.08, 10.48, 22.21 및 27.30 mg GAE/g이고 총 플라보노이드 함량은 3.77, 8.55, 16.94 및 23.22 mg QE/g으로 나타났다. 쇠별꽃 종자 메탄올 및 70% 에탄올 추출물의 총 폴리페놀 및 플라보노이드 함량은 물 및 에탄올 추출물과 비교하여 2.11-3.85배 더 높은 수치를 보였고 이는 쇠별꽃 종자 메탄올 및 70% 에탄올 추출물의 높은 항산화 활성과도 동일한 경향을 나타내었다. Jo 등(21)은 아마란스 종자 추출물의 총 폴리페놀 함량이 약 1.69-4.23 mg GAE/g인 것으로 보고하였고 Park 등(26)은 쪽 종자 메탄올 추출물의 총 폴리페놀 함량이 11.08 mg GAE/g인 것으로 확인하였다. 이들 종자 추출물과 비교하여 쇠별꽃 종자 추출물의 총 폴리페놀 함량은 상당히 높은 편인 것으로 판단된다. 또한, 현대인의 식생활에서 폴리페놀이 풍부한 천연물의 섭취가 항종양작용을 포함한 다양한 생리활성 작용에 도움을 줄 수 있으므로, 기능성 식품 및 천연물 의약품으로서 쇠별꽃 종자 추출물을 활용할 수 있을 것으로 기대된다.
|
Total polyphenol contents (mg GAE/g) |
Total flavonoid contents (mg QE/g) |
|
|---|---|---|
| Water | 7.08±1.011) | 3.77±0.87 |
| EtOH | 10.48±1.82 | 8.55±1.18 |
| MeOH | 22.21±2.11 | 16.94±3.03 |
| 70% EtOH | 27.30±2.79 | 23.22±2.31 |
전 세계적으로 암은 가장 높은 사망률을 나타내는 만성질환 중 하나로 활성산소, 자외선 및 독성물질 등과 같은 다양한 외부요인들의 자극에 의해 정상 조직 및 세포의 DNA 손상이 유발되어 발생한다(27,28). 최근 다양한 연구들에서 항산화 효능 및 폴리페놀 함량이 뛰어난 천연물이 암의 진행 및 발전을 억제할 수 있는 것으로 보고되었기에 쇠별꽃 종자 추출물이 다양한 암종의 성장을 억제시킬 수 있는지 알아본 결과는 Table 2와 같다. 쇠별꽃 종자 추출물을 다양한 암세포 종에 24시간 동안 처리하였을 때 74.43-914.55 μg/mL의 농도에서 세포 생존율이 50%가 되는 것으로 나타났다(Table 2). HepG2(인체 간암), A549(인체 폐암), MCF-7(인체 유방암) 및 B16(마우스 흑색종 피부암) 세포에서 쇠별꽃 종자 70% 에탄올 추출물의 IC50농도 값은 각각 75.82, 351.22, 74.43 및 77.41 μg/mL로 다른 추출물과 비교하여 높은 암세포 성장 억제 활성을 나타내었으며 다음으로 메탄올 및 에탄올 추출물이 높은 암세포 성장 억제효능을 보였다. 반면 HT-29 인체 대장암 세포 및 PC-3 인체 전립선암 세포는 쇠별꽃 종자 에탄올 추출물에서 154.23 및 621.56 μg/mL의 IC50 농도 값으로 우수한 암세포 성장 억제효능을 나타내었으며 나머지 추출물들의 IC50농도 값은 모두 543.26-1,000 μg/mL을 초과하는 것으로 확인되었다. 항산화 활성이 우수한 천연물은 다양한 암 종의 치료 및 예방에 적용할 수 있으나(29,30), 이는 암의 종류, 관련 세포사멸 기전, 독성에 대한 저항력 등에 대한 차이에 의해 활성이 달라질 수 있다(31). 본 연구에서 항산화 활성 및 폴리페놀 함량이 높았던 쇠별꽃 종자 메탄올 및 70% 에탄올 추출물이 다양한 암세포에서 대체로 우수한 항암 활성을 나타내었으나 대장암 및 전립선암 세포에서는 예외적으로 에탄올 추출물의 활성이 높았다. 또한, 쇠별꽃 70% 에탄올 추출물은 간암, 폐암 및 흑색종 피부암 세포와 같은 특정 암세포에서 75.82-77.41 μg/mL의 비교적 낮은 IC50 값을 나타내었다. 이는 인체 자궁암 세포에서 93.2 μg/mL의 IC50 값을 나타내었던 흑종초(Nigella sativa) 종자 추출물(32) 및 인체 편평세포암 세포에서 245.9 μg/mL의 IC50 농도를 가진다고 보고된 포도 종자 추출물(33)과 비교하여 낮은 수치를 보이는 것으로 확인되었다. Thomasset 등(34)은 천연물 내 폴리페놀 함량, 구성 및 섭취 농도에 따라 암세포 사멸 및 바이오마커 발현에 대한 민감성이 다르게 나타난다고 보고하였기에, 쇠별꽃 종자 추출물의 특정 암세포 증식억제효과는 폴리페놀 종류와 구성성분에 의해 차이가 있을 것으로 추측되며 이후 심도 있는 연구를 통해 암 억제 효능을 갖는 기능성 식품 및 천연물 의약품으로 이용될 수 있을 것으로 기대된다.
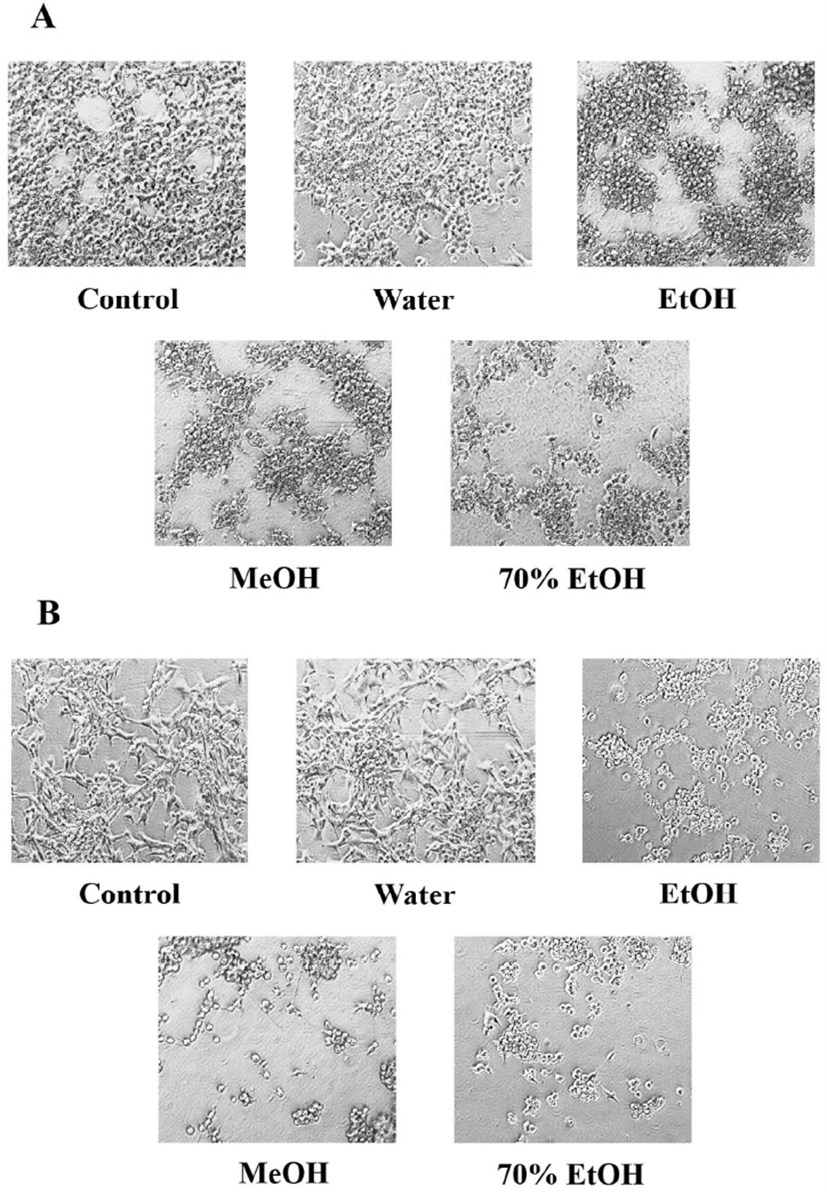
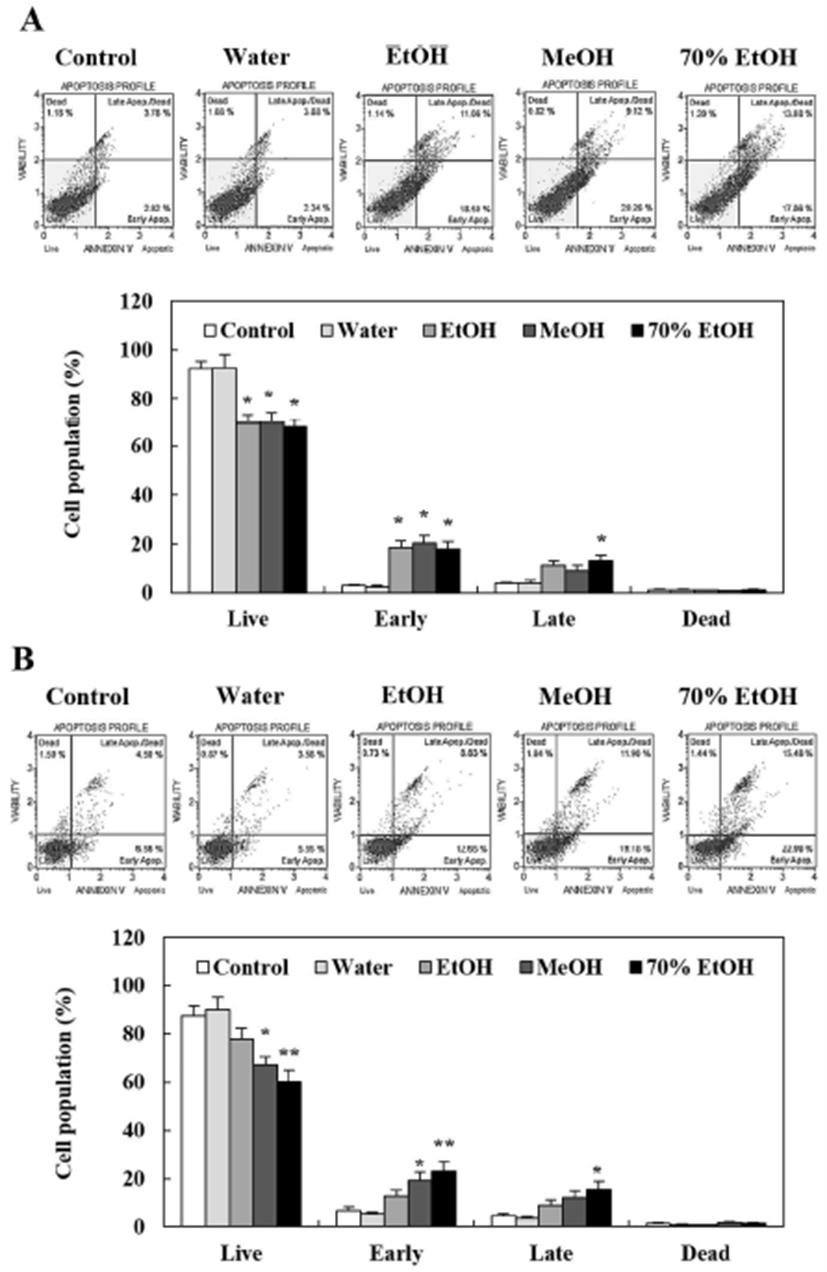
Apoptosis는 조직 내 세포 수를 일정하게 유지하기 위하여 항상성 기전 및 노화 등에 의해 자연적으로 발생하는 세포사멸 현상으로, 종종 외부자극이나 면역반응에 의해 손상된 세포들에서 활성화 되기도 한다(35). 특히, 암과 같은 병리학적 상황에서 방사선이나 암 억제 약물에 의해 암세포가 손상을 받으면 p53 단백질 및 하위 신호전달 경로의 활성을 통해 형태학적 변화, 세포 수축, DNA 손상 등이 유도되고 최종적으로 암세포가 사멸하는 것으로 보고되어 있다(36). 쇠별꽃 종자 추출물의 처리에 의해 뛰어난 암세포 증식 억제 효능을 보였던 HepG2 인체 간암 및 MCF-7 인체 유방암 세포가 apoptosis에 의해 사멸하는지 알아본 결과는 Fig. 2 및 3과 같다. HepG2 및 MCF-7 세포는 대조군에서 well plate에 안정적으로 부착되어 증식이 진행되었지만 50 μg/mL의 쇠별꽃 종자 추출물을 처리하였을 때 에탄올, 메탄올 및 70% 에탄올 추출물 군에서 세포의 수축, 증식억제 및 부유현상 등이 관찰되었다(Fig. 2). 하지만 쇠별꽃 종자 물 추출물을 처리한 군에서는 세포의 손상 없이 대조군과 유사한 세포증식 활성을 나타내었다(Fig. 2). 또한, Annexin V 및 PI 교차 염색을 통해 live, early apoptosis, late apoptosis 및 dead 세포의 분포를 알아본 결과, 쇠별꽃 종자 EtOH, MeOH, 70% EtOH 추출물을 50 μg/mL의 농도로 처리한 군에서 HepG2 및 MCF-7 세포 모두 live 세포의 함량이 감소하는 경향을 보였다(Fig. 3A,B). 특히, HepG2 및 MCF-7 세포에서 쇠별꽃 종자 70% EtOH 추출물을 처리하였을 때 live 세포는 유의적으로 감소하고 early 및 late apoptosis 세포는 유의적으로 증가하는 것으로 확인 되었다(Fig. 3A,B). 하지만 쇠별꽃 종자 물 추출물을 처리한 군에서는 대조군과 비교하여 HepG2 및 MCF-7 세포에서 유의적인 변화가 관찰되지 않았다(Fig. 3A,B). Broker 등(37)은 암세포의 사멸에는 세포주기 억제, apoptosis, necrosis 및 autophagy와 같은 다양한 신호전달 기전이 관여할 수 있다고 보고하였다. 본 연구에서 폴리페놀 함량이 가장 높았던 쇠별꽃 종자 70% 에탄올 추출물이 HepG2 및 MCF-7 세포의 사멸 및 apoptosis 유도 활성이 우수한 것으로 나타났다. 비록 쇠별꽃 종자 추출물의 apoptosis 유도 메커니즘에 대한 심도 있는 연구가 요구되지만 위의 결과를 통해 쇠별꽃 종자 70% 에탄올 추출물에 의한 암 세포 성장억제효과가 apoptosis의 유도를 통해 이루어진다는 것을 알 수 있었다.
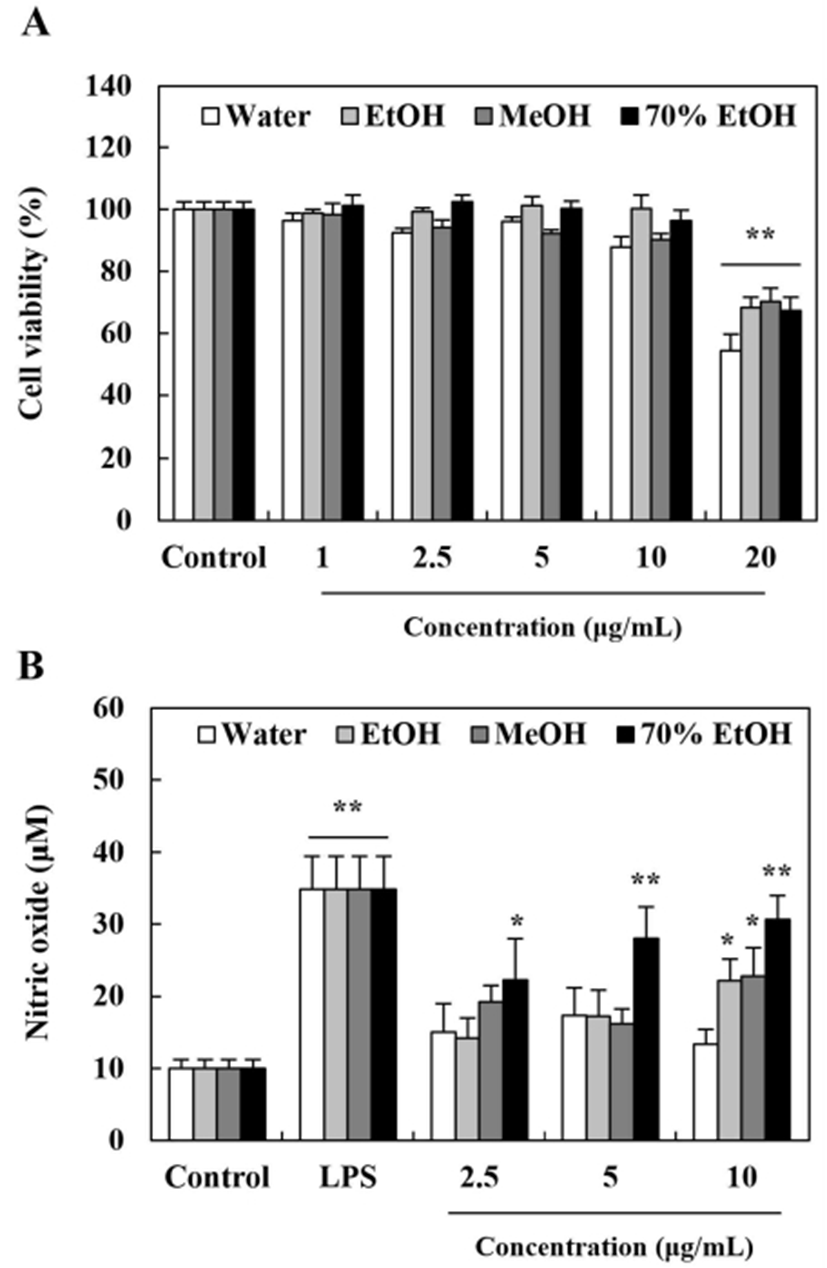
다양한 면역세포 중 선천면역계와 관련된 대식세포의 활성은 암과 같은 질병 상황에서 면역체계의 활성화를 통해 불필요한 세포 내 이물질, 노폐물 및 암세포 등을 제거한다(38). 이때 대식세포에서 생성되는 산화질소(nitric oxide, NO)는 다량일 경우 염증반응을 일으킬 수 있으나, 소량일 경우는 nuclear factor (NF)-κB경로의 활성화를 유도하여 면역작용을 촉진하는 역할을 하는 것으로 알려져 있다(39). 본 연구에서는 쇠별꽃 종자 추출물의 처리가 대식세포 내NO 생성량의 변화에 영향을 미치는지 알아보았으며 이를 통해 면역활성 효능에 대한 가능성을 평가하고자 하였다(Fig. 3). 쇠별꽃 종자 추출물을 1-20 μg/mL의 농도로 24 시간 동안 처리하였을 때 20 μg/mL에서부터 유의적인 세포증식 억제효과를 보였기에(Fig. 3A), 이를 바탕으로 유의적인 세포 성장 억제효능을 보이지 않았던 2.5-10 μg/mL의 쇠별꽃 종자 추출물을 12시간 처리한 후 NO 생성량의 변화를 관찰하였다. 대조군과 비교하여 LPS 처리군에서 유의적인 NO 생성량의 증가를 확인하였으며 쇠별꽃 종자 에탄올, 메탄올 및 70% 에탄올 추출물에서 유의적으로 NO가 증가하는 것으로 나타났다(Fig 3B). 특히 70% 에탄올 추출물을 10 μg/mL의 농도로 처리하였을 때 약 30.69 μM의 NO가 생성되었으며 이는 동일 농도의 다른 추출물과 비교하여 가장 높은 NO 활성을 유도하는 것으로 확인되었다. 하지만 물 추출물의 NO 생성량은 대조군과 유사한 수준으로 특이적인 영향이 없었다. 쇠별꽃 종자 추출물의 NO 생성능에 대한 결과는 폴리페놀 함량이 가장 우수한 70% 에탄올 추출물에서 효과가 높은 것으로 관찰되었으며 이는 항산화 및 암세포 증식억제 효능과 유사한 경향을 나타내었다. 최근 다양한 연구들은 천연물 유래 폴리페놀 성분들에 의해 대식세포의 면역활성이 증가될 수 있다고 보고하였으며 이는 암 억제효능 등과 연관이 있는 것으로 확인되었다(40-42). 따라서 쇠별꽃 종자 70% 에탄올 추출물의 뛰어난 대식세포 산화질소 활성 효과는 쇠별꽃 종자 내 풍부한 폴리페놀에 기인한 것으로 추측하며 이후 면역활성 효능에 대한 심도 있는 연구가 필요할 것으로 판단된다.
요 약
쇠별꽃은 석죽과(카네이션과)에 속하는 다년생 식물로 온대와 아열대 지방에 분포한다. 쇠별꽃 종자는 폴리페놀이 풍부한 천연물로 알려져 있으나 생리활성에 대한 연구는 거의 연구된 바가 없다. 본 연구에서는 쇠별꽃 종자 추출물을 기능성 식품 및 천연물 의약품으로서 이용하기 위해 항산화, 항암, 면역조절 효과 및 총 폴리페놀 함량을 조사하였다. 쇠별꽃 종자 추출물은 1,000 μg/mL의 농도에서 합성항산화제인 BHT 및 천연항산화제인 α-tocopherol과 유사한 라디칼 소거활성을 나타내었다. 쇠별꽃 종자 추출물 내 총 폴리페놀 및 플라보노이드 함량은 70% 에탄올 추출물에서 각각 27.30 mg GAE/g 및 23.22 mg QE/g으로 물, 에탄올 및 메탄올 추출물과 비교하여 높은 것으로 확인되었다. 쇠별꽃 종자 추출물의 암세포 증식 억제활성은 간암(HepG2), 폐암(A549), 유방암(MCF-7) 및 흑색종 피부암(B16)에서 70% 에탄올 추출물이 가장 낮은 IC50 값을 나타내었으나, 대장암(HT-29) 및 전립선암(PC-3)에서는 에탄올 추출물이 가장 낮은 IC50 값을 보였다. 암세포 중 증식억제효능이 가장 높았던 간암 및 유방암세포에 쇠별꽃 종자 에탄올, 메탄올 및 70% 에탄올 추출물을 50 μg/mL의 농도로 처리했을 때 형태학적 변화와 동시에 apoptosis에 의한 세포 사멸이 증가하는 것으로 확인되었다. 또한 RAW 264.7 마우스 대식세포에서 쇠별꽃 종자 10 μg/mL 농도의 70% 에탄올 추출물은 유의적인 세포독성 없이 일산화질소(nitric oxide, NO)의 생성을 증가시켜 산화질소 분비활성 효능이 있는 것으로 나타났다. 본 연구의 결과를 통해 풍부한 폴리페놀 함량을 가진 쇠별꽃 종자 70% 에탄올 추출물이 항산화, 항암 및 산화질소 분비활성 효과를 나타낸다는 것을 확인하였으며 이는 효과적인 건강기능식품 소재 및 천연물 의약품으로서 이용할 수 있을 것으로 기대한다.
